Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Transplantation intrapéritonéale pour générer une leucémie myéloïde aiguë chez la souris
Dans cet article
Résumé
Ici, l’injection intrapéritonéale de cellules leucémiques est utilisée pour établir et propager la leucémie myéloïde aiguë (LAM) chez la souris. Cette nouvelle méthode est efficace dans la transplantation en série de cellules AML et peut servir d’alternative pour ceux qui peuvent éprouver des difficultés et des incohérences avec l’injection intraveineuse chez la souris.
Résumé
Il existe un besoin non satisfait de nouvelles thérapies pour traiter la leucémie myéloïde aiguë (LAM) et la rechute associée qui implique des cellules souches leucémiques persistantes (LSC). Un modèle expérimental de rongeurs AML pour tester des thérapies basées sur la transplantation réussie de ces cellules par injections rétro-orbitales chez des souris receveuses est semé d’embûches. L’objectif de cette étude était de développer une méthode simple, fiable et cohérente pour générer un modèle murin robuste de LAM en utilisant une voie intrapéritonéale. Dans le protocole actuel, les cellules de la moelle osseuse ont été transduites avec un rétrovirus exprimant l’oncoprotéine de fusion MLL-AF9 humaine. L’efficacité des populations de lignées négatives (Lin-) et Lin-Sca-1+c-Kit+ (LSK) en tant que CLL donneurs dans le développement de la LAM primaire a été testée, et l’injection intrapéritonéale a été adoptée comme nouvelle méthode pour générer la LAM. La comparaison entre les injections intra-péritonéales et rétro-orbitales a été faite dans des transplantations en série pour comparer et contraster les deux méthodes. Les cellules Lin- et LSK transduites avec le virus MLL-AF9 humain bien greffé dans la moelle osseuse et la rate des receveurs, conduisant à une LAM à part entière. L’injection intrapéritonéale de cellules de donneur a établi la LAM chez les receveurs lors de la transplantation en série, et l’infiltration de cellules de LAM a été détectée dans le sang, la moelle osseuse, la rate et le foie des receveurs par cytométrie en flux, qPCR et analyses histologiques. Ainsi, l’injection intrapéritonéale est une méthode efficace d’induction de la LAM utilisant la transplantation en série de cellules leucémiques de donneur.
Introduction
La leucémie myéloïde aiguë (LAM) est un type d’hémopathie maligne d’étiologie diverse avec un mauvais pronostic1. La génération de modèles animaux de LAM jette les bases de la compréhension de ses variations complexes et de sa pathobiologie dans le but de découvrir de nouvelles thérapies2. La leucémogenèse chez la souris implique la transplantation de cellules de donneurs exprimant des oncoprotéines de fusion, y compris des fusions impliquant le gène de la leucémie de lignée mixte (MLL) pour induire puissamment la LAM, afin d’imiter la maladie chez l’homme3. Diverses origines cellulaires de cellules de donneurs ont été rapportées lors de la transplantation de LAM4 associée au gène LAM, et on sait très peu de choses sur les cellules responsables de l’origine de la maladie.
Plusieurs voies ont été développées pour la transplantation chez la souris; plutôt qu’une injection intra-fémorale, qui introduit directement des cellules donneuses mutantes dans la moelle osseuse5, une injection intraveineuse qui utilise le plexus du sinus veineux, la veine de la queue et la veine jugulaire a été largement utilisée pour générer des modèles murins de LAM 6,7,8,9. Dans le cas de l’injection rétro-orbitale (r.o.), divers inconvénients inhérents, tels que la limitation du volume, la forte demande technique, le peu de risques de tentatives répétées ou d’erreurs, et les lésions oculaires potentielles, ont été des pierres d’achoppement majeures avec peu ou pas d’alternatives viables7. L’injection de veines de queue peut avoir des problèmes similaires en plus des blessures locales; Pour faciliter la procédure, les souris ont souvent besoin d’être réchauffées pour dilater leurs veines de la queue10. Il est également difficile de localiser la veine de la queue sans source de lumière supplémentaire, en particulier chez la souche C57BL / 6 de souris. Pour l’injection de la veine jugulaire, le personnel de recherche a besoin d’une formation suffisante pour localiser la veine et limiter les complications possibles. De plus, les injections du sinus veineux et de la veine jugulaire doivent être effectuées sous anesthésie, ce qui ajoute un autre niveau de complexité. Ainsi, il est tentant d’explorer de nouvelles voies de transplantation pour faciliter l’établissement de modèles murins de LMA.
L’injection intrapéritonéale (i.p.) est couramment utilisée pour administrer des médicaments, des colorants et des anesthésiques 11,12,13,14,15; Il a également été utilisé pour introduire des cellules hématopoïétiques pour l’hématopoïèse ectopique16 et pour transplanter des cellules souches mésenchymateuses dérivées de la moelle osseuse dans divers modèles murins 17,18,19,20,21. Cependant, il a été rarement utilisé pour établir des tumeurs malignes hématopoïétiques chez la souris, en particulier pour étudier la progression de la LMA.
La présente étude décrit la faisabilité de l’injection intraveineuse dans la génération de modèles murins AML, en plus de comparer l’efficacité de transplantation des populations de lignées négatives (Lin-) et Lin-Sca-1+c-Kit+ (LSK) en tant que cellules donneuses. Ces résultats fournissent un moyen simple et efficace de générer des modèles expérimentaux de LAM et de leucémies myéloïdes connexes. Une telle méthode a le potentiel d’approfondir notre compréhension des mécanismes de la maladie et de fournir un modèle relativement facile pour tester des thérapies expérimentales.
Protocole
Toutes les expériences ont été préapprouvées par le Comité institutionnel de soin et d’utilisation des animaux de l’Université d’État de Pennsylvanie.
1. Préparation des tampons et des réactifs
- Préparer des plaques de gélose LB supplémentées en ampicilline (AP) (plaques stériles de 10 cm). Pour ce faire, dissoudre 10 g de bouillon LB avec de la gélose dans 400 mL d’eau distillée, remuer et porter le volume à 500 mL. Stériliser la solution par autoclavage, puis laisser refroidir la solution, ajouter 0,5 mL d’ampicilline (stock : 150 mg/mL) dans la solution et agiter pour mélanger. Ajouter immédiatement 18 mL de solution dans une plaque stérile de 10 cm près d’une lampe à alcool, laisser solidifier à température ambiante et conserver les plaques à l’envers à 4 °C jusqu’à nouvelle utilisation.
- Préparer le média LB en dissolvant 10 g de LB sans gélose dans 500 mL d’eau distillée. Stériliser la solution par autoclavage, laisser refroidir la solution, ajouter 0,5 mL d’ampicilline (stock : 150 mg/mL) dans la solution et agiter pour mélanger.
- Préparer un tampon d’écoulement en ajoutant 5 mL de pénicilline/streptomycine et 10 mL de sérum fœtal bovin inactivé par la chaleur (hiFBS) dans 485 mL de 1x solution saline tamponnée au phosphate de Dulbecco (DPBS).
REMARQUE: Pour désactiver FBS par chauffage, placez les bouteilles FBS décongelées dans un bain-marie à 56 ° C. Assurez-vous que les bouteilles ne se renversent pas ou ne sont pas immergées dans le bain-marie. La température est critique pour une dégradation complète; pour s’en assurer, attendez que la température se stabilise à 56 °C après avoir mis les bouteilles au bain-marie. Remuez doucement les bouteilles toutes les 10 minutes trois fois. Ne laissez pas le sérum incuber pendant plus de 30 minutes. - Préparer le milieu d’entretien en ajoutant 50 mL de hiFBS, 5 mL de L-glutamine et 5 mL de pénicilline/streptomycine dans 440 mL de milieu aigle modifié (DMEM) de Dulbecco. Préparer les milieux de transfection en ajoutant 50 mL de hiFBS et 5 mL de L-glutamine dans 445 mL de milieu DMEM.
- Préparer un tampon de lyse des globules rouges (GR) en ajoutant 4,145 g deNH4Cl, 0,504 g de NaHCO3 et 16,81 mg d’acide éthylènediaminetétraacétique (EDTA) dans 500 mL d’eau distillée. Préparer le milieu modifié de Dulbecco (IMDM) incomplet d’Iscove en ajoutant 75 mL de hiFBS, 5 g d’albumine sérique bovine (BSA), 0,5 mL d’insuline à 10 mg/mL, 2,5 mL d’holotransférrine à 4 mg/mL, 3,5 μL de β-mercaptoéthanol, 5 mL de L-glutamine et 0,5 mL de ciprofloxacine dans 416,5 mL de milieu IMDM.
- Préparer 10 mL de 2x milieux IMDM, dans lesquels la concentration de cytokines est deux fois supérieure à la quantité dans 1x milieu IMDM, en ajoutant 10 μL de 50 ng/μL de mr-SCF, 20 μL de 25 ng/μL mr-Flt3L, 20 μL de 10 ng/μL mr-IL-6, 20 μL de 10 ng/μL mr-IL-3, 10 μL de 10 mg/mL d’insuline, et 50 μL d’holotransférrine à 4 mg/mL dans 9,87 mL de milieu IMDM incomplet.
REMARQUE : Assurez-vous que le tampon d’écoulement, le tampon de lyse des globules rouges, les milieux d’entretien, les milieux de transfection et les milieux IMDM incomplets sont stérilisés par filtre avant utilisation.
2. Transformation plasmidique
- Décongeler 20 μL de cellules compétentes α-Select sur glace. Ajouter 1 μL (~2 ng) de plasmide22 MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 aux cellules compétentes décongelées et mélanger doucement en tapotant le tube. Incuber la réaction sur la glace pendant 30 min.
- Choc thermique du mélange par incubation pendant 40 s dans un bloc chauffant à 42 °C. Transférer immédiatement le tube sur de la glace pendant 2 min.
- Ajouter 1 mL de média LB (sans ampicilline) dans le tube et agiter à 37 °C et 200 rpm pendant 1 h.
- Centrifuger le tube à température ambiante à 500 x g pendant 4 min et jeter 0,9 mL de surnageant. Remettez le précipité en suspension dans les 0,1 mL restants de milieu LB.
- Étaler les cellules compétentes transformées sur des plaques de gélose AP LB préchauffées (37 °C). Incuber la plaque à l’envers à 37 °C pendant 12-16 h.
- Prélever une seule colonie et dépenser les cellules transformées dans 10 ml de milieu AP LB pendant une nuit à 37 °C et 200 tr/min.
- Ajouter 5 mL de cellules compétentes transformées épuisées à 500 mL de milieu AP LB dans une fiole et incuber la fiole pendant une nuit à 37 °C et 200 tr/min.
- Extraire le plasmide à l’aide d’une trousse d’extraction de plasmide conformément aux instructions du fabricant et remettre en suspension dans 0,5 mL d’eau ultrapure autoclavée. Quantifier le plasmide à l’aide d’un spectrophotomètre.
3. Transfection de cellules écotropes Phoenix (pECO)
- Culture de 2 x 106 pECO cellules/plaque dans un milieu d’entretien en plaques de 10 cm dans un incubateur humidifié à 5% de CO2 à 37 °C. S’assurer que les cellules pECO sont maintenues dans une phase de croissance exponentielle et se divisent activement avant le passage.
- Lorsque les cellules deviennent confluentes à 80 %, laver les plaques avec 5 mL de DPBS deux fois, ajouter 1 mL de trypsine dans la plaque et incuber dans un incubateur humidifié à 5 % de CO 2 à 37 °C pendant2 min. Récolter les cellules avec 5 mL de milieu d’entretien dans un tube stérile de 15 mL et centrifuger à 4 °C et 400 x g pendant 3 min. Remettez en suspension la pastille de cellule dans 5 mL de fluide d’entretien.
- Mélanger 10 μL de suspension cellulaire et 10 μL de bleu de trypan et charger 10 μL sur un hémocytomètre pour compter les cellules.
Nombre total de cellules/ml = (nombre total de cellules comptées x facteur de dilution x 104 cellules/ml)/ nombre de carrés comptés)
Ensemencer 2 x 10 6 cellules/plat dans des boîtes de6 cm en utilisant 5 mL de milieu d’entretien pour la transfection et cultiver les cellules dans un incubateur humidifié à 5 % de CO2 à 37 °C. - Remplacer le milieu d’entretien par 5 mL de milieu de transfection lorsque les cellules deviennent confluentes à 50 % à 60 % après 18 h de culture.
- Conserver le réactif de transfection à température ambiante pendant au moins 30 minutes avant la transfection.
- Ajouter 5,5 μg de plasmide MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC322 à 0,5 mL de milieu DMEM ordinaire dans un tube stérile de 1,5 mL. Mélangez-le doucement en tapotant le tube et laissez-le reposer pendant 10 min.
- Ajouter 14,6 μL (3x la quantité de plasmide; v/p) de réactif de transfection dans le tube et tapoter doucement le tube toutes les 10 minutes trois fois.
- Ajouter uniformément le mélange goutte à goutte à toutes les zones de la vaisselle avec les cellules pECO dans les milieux de transfection. Déplacez doucement les plats vers l’avant et vers l’arrière 10 fois et latéralement 10 fois. Incuber les plats dans un incubateur humidifié à 5% de CO2 à 37 °C pendant 48 h.
- Mesurer l’efficacité de la transfection par microscopie à florescence et cytométrie en flux pour la protéine fluorescente verte (GFP) comme décrit en22. Les cellules sont d’abord fermées sur FSC-A/FSC-H et FSC-A et SSC-A pour acquérir des singulettes. La population GFP+ est fermée sur le graphique FL1 en la comparant à des cellules non transfectées.
- Recueillir et filtrer les surnageants à travers un filtre à seringue de 0,45 μm dans un tube stérile de 50 mL. Utilisez immédiatement les surnageants pour la transduction ou congelez-les dans de l’azote liquide et conservez-les à -80 °C jusqu’à une nouvelle utilisation.
REMARQUE: les cellules pECO doivent être correctement mélangées et ensemencées uniformément dans des plats. Laissez les cellules se répandre en déplaçant les plats vers l’avant et vers l’arrière 10 fois et latéralement 10 fois pendant l’ensemencement. Le nombre de cellules à ensemencer peut varier en fonction des variations de comptage. Pour trouver le nombre optimal de cellules d’ensemencement qui peut atteindre une confluence de 50% à 60% après 18 h de culture, il est utile d’ensemencer des cellules avec des dilutions en série.
4. Transduction lentivirale
- Euthanasier des souris C57BL6/J femelles CD45.1 âgées de 8 à 10 semaines (deux à trois souris donneuses par souris receveuse) dans une chambre de CO2 .
- Stérilisez tout le corps des souris avec de l’éthanol à 70%. Placez les souris sur un tampon chirurgical stérile sur une planche en polystyrène et épinglez les jambes à travers les coussinets de la souris.
- Coupez la peau au-dessus de la cavité abdominale à la ligne médiane et élargissez l’espace sous-cutané vers les pattes postérieures avec des ciseaux stériles à extrémité pointue.
- Étendez l’incision de la ligne médiane abdominale jusqu’aux chevilles. Élargissez l’espace sous-cutané sous les pattes postérieures avec les lames de ciseaux stériles à extrémité tranchante.
- Couper le tendon d’Achille avec des ciseaux stériles à extrémité pointue. Tenez le tendon à l’aide d’une pince avec des dents et coupez l’autre extrémité attachée au fémur pour enlever le muscle gastrocnémien.
- Coupez le tendon du quadriceps attaché au genou avec des ciseaux stériles à extrémité tranchante. Tenez le tendon à l’aide d’une pince avec des dents et coupez les têtes musculaires attachées au fémur pour enlever le muscle gastrocnémien.
- Coupez les autres muscles entourant le fémur à l’extrémité attachée au tibia avec des ciseaux stériles à extrémité pointue.
- Coupez la cheville avec des ciseaux stériles à extrémité tranchante, en veillant à ce que le tibia reste intact. Tenez l’extrémité distale du fémur à l’aide d’une pince avec des dents et coupez l’articulation de la hanche avec des ciseaux stériles à extrémité pointue, en veillant à ce que la tête fémorale reste intacte.
- Transférer les tibias et les fémurs dans un tampon d’écoulement dans un tube stérile de 15 mL.
- Séparez le tibia et le fémur en brisant le genou à la main. Retirez la rotule, le cartilage et les condyles fémoraux pour exposer le plateau tibial et le fémur distal à la main. Retirez les muscles à l’aide d’une gaze stérile, puis faites tremper les os dans un tampon d’écoulement.
- Couper le col du fémur et rincer les cellules de la moelle osseuse avec un tampon d’écoulement des deux extrémités du fémur à l’aide d’une seringue de 10 ml avec une aiguille de 23 g.
- Couper la malléole tibiale et rincer les cellules de la moelle osseuse avec un tampon d’écoulement des deux extrémités du tibia à l’aide d’une seringue de 10 ml avec une aiguille de 23 g.
- Disperser les cellules en pipetant de haut en bas à l’aide d’une seringue de 10 ml avec une aiguille de 18 g. Centrifuger la suspension unicellulaire à 4 °C et 400 x g pendant 3 min.
- Jeter le surnageant et remettre les cellules en suspension dans 5 mL de tampon de lyse des globules rouges pour lyser les globules rouges pendant 3 min.
- Ajouter 5 mL de tampon d’écoulement pour arrêter la lyse et centrifuger la suspension cellulaire à 4 °C et 400 x g pendant 3 min.
- Placer une crépine cellulaire de 70 μm sur un tube stérile de 50 mL. Suspendre la pastille avec 5 ml de tampon d’écoulement, mélanger et passer à travers la crépine cellulaire pour recueillir les cellules.
- Ajuster la concentration de la cellule avec un tampon de débit à 1 x 108/mL dans des tubes en polypropylène à fond rond.
- Sélectionnez les cellules Lin- à l’aide d’un kit d’isolation de cellules hématopoïétiques de souris conformément aux instructions du fabricant.
- Gardez de côté trois tubes de 1 x 104 cellules dans 100 μL de tampon pour un témoin non coloré et deux témoins simples colorés par anticorps pour l’anti-souris conjugué APC CD117 (c-Kit) et l’anti-souris conjugué PE-Cy7 Ly-6A/E (Sca-1). Utiliser 1 μL d’anticorps (à partir de 0,2 mg/mL de stock) pour chacun des témoins colorés par des anticorps.
- Colorer le reste des cellules dans un tube avec les deux anticorps (4 μL de chacun à partir de 0,2 mg / mL de stock) dans 400 μL. Incuber les tubes sur de la glace dans l’obscurité pendant 0,5-1 h.
- Après coloration, laver les cellules en ajoutant 1 mL de tampon de débit et centrifuger à 4 °C et 400 x g pendant 3 min.
- Remettez en suspension les cellules pour le témoin non coloré et les témoins uniques colorés par anticorps dans 100 μL de tampon de débit. Resuspendre les cellules colorées par deux anticorps dans 1 mL de tampon de débit pour le tri.
- Trier les cellules souches hématopoïétiques (CSH) en tant que population LSK à l’aide d’un trieur de cellules tel que décrit dans23,24.
- Pendant la coloration, enduire une capsule stérile de 6 cm de rétronectine comme suit : Préparer 100 μg/mL de rétronectine dans du PBS et ajouter 0,9 mL de PBS et 0,1 mL de rétronectine dans une boîte de 6 cm. Enrober le plat d’une hotte stérile à température ambiante pendant 2 h. Ensuite, retirer la rétronectine et bloquer le plat avec 0,5 mL de BSA filtré à 2% (en PBS) pendant 30 min. Lavez le plat avec 5 ml de PBS deux fois et le plat est prêt pour la transduction.
- Centrifuger les CSH triées ou les cellules Lin- non triées à 4 °C et 400 x g pendant 3 min et les remettre en suspension dans 3 mL de 2x (de cytokines) de milieu IMDM et 3 mL de surnageant viral (généré à partir de l’étape 3.10) dans une boîte recouverte de rétronectine. Incuber la capsule dans un incubateur humidifié à 5% de CO2 à 37 °C pendant 6 ou 24 h.
NOTE: Dans la présente étude, les cellules Lin- ont été triées ou non triées selon le plan expérimental.
5. Transplantation en série (Figure 1)
REMARQUE : Les souris receveuses primaires étaient des souris C57BL6/J mâles âgées de 8 à 10 semaines (CD45.2). Ils ont reçu de l’eau ad libitum contenant des antibiotiques pour prévenir les infections digestives opportunistes, de 3 jours avant la transplantation à 7 jours après la transplantation. Les souris receveuses primaires ont été irradiées sublétalement (4,75 Gy) 3 heures avant la transplantation25. L’isoflurane n’a pas été appliqué aux souris par injection intrapéritonéale.
- Après transduction pendant 6 ou 24 h, récolter les cellules par centrifugation à température ambiante et 400 x g pendant 3 min. Utilisez la trypsine pour recueillir les cellules attachées au fond du plat si nécessaire. Jeter le surnageant et remettre les cellules en suspension dans du PBS préchauffé. Déterminer le volume de PBS en fonction du nombre de receveurs (c.-à-d. 0,1 mL/souris et 0,5 mL/souris pour les receveurs recevant des injections rétro-orbitales et intrapéritonéales, respectivement).
- Placer les souris réceptrices irradiées sous létale dans une chambre d’isoflurane (le débit d’oxygène est réglé à 1,0 L/min et le vaporisateur d’isoflurane à 5 %). Appliquez une pommade humide sur les yeux pour prévenir la sécheresse sous anesthésie. Les souris sont prêtes pour d’autres procédures lorsque le rythme cardiaque tombe à 60 battements par minute.
- Injecter des cellules dans des souris receveuses primaires rétro-orbitalement (0,1 mL/souris)7 ou intrapéritonéale (0,5 mL/souris)26 avec une aiguille 27 G1/2. Observez les souris en continu jusqu’à ce qu’elles acquièrent suffisamment de conscience pour maintenir la position couchée sternale. Surveillez quotidiennement le bien-être des souris après la transplantation.
- Après 1 mois, prélever du sang chaque semaine par saignement rétro-orbitaire pour surveiller la leucocytose en évaluant la numération globulaire complète (FSC) sur un hémadet comme décrit ci-dessous.
- Placez la souris latéralement après l’anesthésie avec de l’isoflurane (le débit d’oxygène est réglé sur 1,0 L/min et le vaporisateur d’isoflurance est réglé sur 5%). Les souris sont prêtes pour d’autres procédures lorsque le rythme cardiaque tombe à 60 battements par minute.
- Proptose l’œil avec le pouce et l’index. Pénétrer dans le plexus du sinus veineux avec un tube capillaire hémacrit astérile à travers le canthus interne.
- Prélevez 20 à 25 μL de sang dans un tube de prélèvement sanguin EDTA et fermez les paupières pour arrêter le saignement. Appliquez une goutte de solution ophtalmique de sulfate de gentamicine sur l’œil.
- Au point final, lorsque les globules blancs (GB) atteignent 4 x 10 4 cellules/μL, euthanasier la souris dans une chambre de CO2 et isoler les cellules de la moelle osseuse en rinçant les fémurs et les tibias avec un tampon d’écoulement, suivie d’une lyse des globules rouges comme mentionné à l’étape4.
- À la fin, récoltez les splénocytes comme mentionné ci-dessous.
- Euthanasier la souris dans une chambre CO2 . Placez les souris sur un tampon chirurgical stérile sur une planche en polystyrène et épinglez les jambes à travers les coussinets de la souris. Stérilisez tout le corps des souris avec de l’éthanol à 70%.
- Coupez la peau et les muscles à la ligne médiane pour exposer la cavité abdominale avec des ciseaux stériles à extrémité pointue. Isolez la rate avec des ciseaux stériles à extrémité tranchante et placez-la dans un tampon d’écoulement dans un tube stérile de 15 mL.
- Mailler la rate à travers une passoire stérile de 70 μm dans un plat de 6 cm avec 3 mL de tampon d’écoulement. Transférer les cellules de la capsule dans un tube stérile de 15 mL et centrifuger la suspension unicellulaire à 4 °C et 400 x g pendant 3 min.
- Jeter le surnageant et remettre les cellules en suspension dans 5 mL de tampon de lyse des globules rouges pour lyser les globules rouges pendant 3 min. Ajouter 5 mL de tampon d’écoulement pour arrêter la lyse et centrifuger la suspension cellulaire à 4 °C et 400 x g pendant 3 min.
- Placer une crépine cellulaire de 70 μm sur un tube stérile de 50 mL. Suspendre la pastille avec 5 mL de tampon d’écoulement, mélanger et passer à travers la crépine cellulaire pour recueillir les cellules.
- Identifier les cellules primaires (1°) de LAM en colorant les splénocytes et les cellules de la moelle osseuse avec un anticorps anti-souris CD45.1 conjugué FITC et en les détectant sur un cytomètre en flux. Les cellules sont d’abord fermées sur FSC-A/FSC-H et FSC-A et SSC-A pour acquérir des singulettes. La population de CD45,1+ est fermée sur la parcelle FL1 en la comparant à des cellules non colorées.
- Pour la transplantation secondaire (2°), remettre en suspension les cellules spléniques de LAM CD45.1 des receveurs 1° r.o. dans PBS (0,1 mL/souris) et les injecter rétro-orbitalement à des souris C57BL6/J mâles CD45.2. Parallèlement, remettre en suspension les cellules spléniques AML de receveurs 1° i.p. dans PBS (0,5 mL/souris) et les injecter intrapéritonéale à des souris mâles Ai14TdTomato 27 âgées de 8 à 12 semaines.
- Pour la transplantation tertiaire (3°), remettre en suspension des cellules de LAM isolées de la moelle osseuse ou de la cavité péritonéale de receveurs 2° i.p. et les injecter intrapéritonéale à des souris Ai14TdTomato (RFP+) ou CD45.2, respectivement. Resuspendre les cellules de LMA isolées de la cavité péritonéale des receveurs de 2° r.o. et les transplanter par injection r.o. chez des souris Ai14TdTomato (RFP+).
NOTE: Pour la transplantation 2°, nous avons identifié la progression de la maladie chez les receveurs 2° en surveillant le CBC dans le sang périphérique. Pour confirmer davantage l’établissement de la LMA, nous avons recueilli du sang périphérique entier par ponction cardiaque ainsi que de la moelle osseuse, de la rate et du foie. De plus, nous avons effectué un lavage i.p. pour collecter les cellules i.p. Des suspensions unicellulaires ont été acquises à partir de moelle osseuse, de rate et de lavage intraveineux comme décrit ci-dessus. Les cellules de ces sites ont été analysées sur un cytomètre en flux après la lyse des globules rouges. Les cellules de LAM ont été reconnues comme des cellules RFP négatives (RFP-). Pour la transplantation 3°, nous avons échantillonné des cellules de sang, de moelle osseuse, de rate, de foie et d’IP au point final ; Les cellules RFP ou CD45.1+ ont été identifiées comme des cellules AML et examinées par cytométrie en flux. Aucune irradiation ou eau antibiotique n’a été administrée aux souris réceptrices à 2° et 3°.
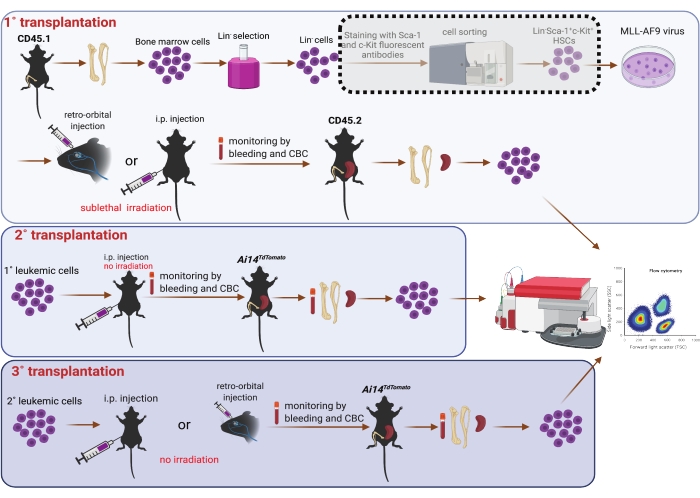
Figure 1 : Schéma de la transduction virale MLL-AF9 dans les CSH de la moelle osseuse et des transplantations en série (1°, 2° et 3°). Le tri des populations doublement positives Sca-1 et c-Kit à l’aide d’un trieur de cellules indiqué dans la zone d’ombrage en pointillés est considéré comme facultatif, si les ressources le permettent. La figurine a été créée à l’aide de BioRender (https://biorender.com/). Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Lavage intrapéritonéal
- Injecter 5 mL de milieu IMDM incomplet dans la cavité péritonéale deux fois pour recueillir les cellules dans un tube stérile de 15 mL. Centrifuger la suspension cellulaire à température ambiante et 400 x g pendant 3 min. Transplantation de cellules de LAM (4 x 105 cellules/souris) de la cavité péritonéale de receveurs à 2° par injection intraveineuse chez des souris receveuses de CD45,2 à 3° (n = 3).
7. Analyse histologique 28
- Isoler la rate, le foie et les fémurs des souris lors de l’euthanasie. Fixez-les dans 5 ml de formol tamponné à 10 % (v/v). Échantillonnez la rate et le foie de homologues sains pour des comparaisons.
- Intégrez les tissus fixes dans la paraffine et coupez-les en sections. Colorer les sections avec des colorants à l’hématoxyline et à l’éosine (H & E).
- Obtenez les images au microscope à un grossissement 20x installé avec un logiciel compatible pour l’analyse histologique.
8. Effectuer une PCR semi-quantitative (qPCR)
- Préparer les ARN dans le réactif à ARN conformément aux instructions du fabricant.
- Utilisez des ARN de 0,5 à 1,0 μg pour synthétiser l’ADNc à l’aide d’un kit de transcription inverse de l’ADNc conformément aux instructions du fabricant.
- Utilisez l’ADNc pour effectuer la qPCR à l’aide d’un kit qPCR et exécutez les échantillons dans un système qPCR. Utilisez les sondes TaqMan pré-validées suivantes : KMT2A (ML ; Ref Seq: ARN ribosomique NM_001197104(2), IDT)29 et 18S (Hs99999901_s1).
- Chargez les amplicons KMT2A et 18S sur un gel d’agarose à 2% pour visualiser l’expression. Acquérir des images dans un imageur installé avec le logiciel compatible.
9. Traitement des données
- Analysez les résultats à l’aide d’un logiciel d’analyse statistique et présentez les résultats sous forme de moyenne ± SEM. Générez des figures à l’aide d’un outil d’illustration commerciale.
Résultats
Comparaison de l’efficacité de transplantation de cellules de LAM murines par les voies de transplantation r.o. et i.p.
Auparavant, l’établissement de 1° AML a été rapporté chez des souris receveuses transplantées rétro-orbitalement avec des cellules LSK transduites MLL-AF9, et la transplantabilité de cellules AML 1° a été démontrée par transplantation en série30. La présente étude est la première à évaluer la possibilité d’utiliser des cellules Lin
Discussion
Ces études décrites ci-dessus fournissent des preuves à l’appui que la transplantation de cellules Lin- est comparable à celle de cellules LSK dans la génération de LAM murine de 1°. En outre, les données actuelles montrent également que l’injection intraveineuse est une méthode efficace et pratique pour établir la LAM murine par rapport à l’injection intraveineuse (ou r.o.).
En plus des cellules LSK, d’autres populations telles que le progéniteur granulocytaire...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs remercient le Flow Cytometry Core Facility du Huck Institute et l’Histopathology Core Facility du Animal Diagnostic Laboratory, Department of Veterinary and Biomedical Sciences, The Pennsylvania State University, pour leur soutien technique en temps opportun. Ce travail a été soutenu par des subventions de l’American Institute for Cancer Research (KSP), du Penn State College of Agricultural Sciences, du Penn State Cancer Institute, du projet USDA-NIFA 4771, numéro d’acquisition 00000005 à K.S.P. et R.F.P.
matériels
| Name | Company | Catalog Number | Comments |
| a-Select competent cells | Bioline | BIO-85027 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | Cat# A-9434 | |
| Ampicillin | Sigma Aldrich | Cat# A0797 | |
| Bovine Serum Albumin (BSA), Fraction V—Low-Endotoxin Grade | Gemini bio-products | Cat# 700-102P | |
| Ciprofloxacin HCl | GoldBio.com | Cat# C-861-100 | |
| DMEM, high glucose, no glutamine | Gibco | Cat# 11960-044 | |
| Dulbecco’s Phosphate-Buffered Saline (PBS) | Corning | Cat# 21-031-CV | |
| EDTA, Disodium Salt (EDTA-2Na), Dihydrate, Molecular Biology Grade | Calbiochem | Cat# 324503 | |
| Fetal Bovine Serum - Premium Select | Atlanta Biologicals | Cat# S11550 | |
| Holo-transferrin, bovine | Sigma Aldrich | Cat# T1283 | |
| Insulin solution human | Sigma | Cat# I-9278 | |
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | Cat# 12440-053 | |
| L-glutamine 200 mM (100×) solution | HyClone, Gelifesciences | Cat# SH30034.01 | |
| LB broth, Lennox | NEOGEN | Cat #: 7290A | |
| LB Broth with agar (Miller) | Sigma Aldrich | Cat# L-3147 | |
| Mouse anti-mouse CD45.1 (FITC) | Miltenyi Biotec | Cat# 130-124-211 | |
| Mouse Interleukin-3 (IL-3) | Gemini bio-products | Cat# 300-324P | |
| Mouse Interleukin-6 (IL-6) | Gemini bio-products | Cat# 300-327P | |
| Mouse Stem Cell Factor (SCF) | Gemini bio-products | Cat# 300-348P | |
| Penicillin-Streptomycin Solution, 100x | Corning | Cat# 30-002-CI | |
| Phenix-Eco (pECO) cells | ATCC | CRL-3214 | |
| Potassium Bicarbonate (KHCO3), Granular | JT. Baker | Cat# 2940-01 | |
| Rat anti-mouse CD117 (c-kit) (APC) | BioLegend | Cat # 105812 | |
| Rat anti-mouse Ly-6A/E (Sca-1) (PE-Cy7) | BD Pharmingen | Cat# 558162 | |
| Recombinant Murine Flt3-Ligand | Pepro Tech, INC. | Cat# 250-31L | |
| RetroNectin Recombinant Human Fibronectin Fragment | TaKaRa | Cat# T100A | |
| TransIT-293 Reagent | MirusBio | Cat# MIR 2705 | |
| TRI Reagent | Sigma Aldrich | Cat# T9424 | |
| Trypan Blue Solution, 0.4% | Gibco | Cat # 15250061 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | Cat# 25200-056 | |
| β-Mercaptoethanol (BME) | Sigma Aldrich | Cat# M3148 | |
| Commercial Assays | |||
| EasySep Mouse Hematopoietic Progenitor Cell Isolation Kit | StemCell technologies | Cat# 19856A | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher | Cat# 4368813 | |
| PerfeCTa qPCR SuperMix | Quanta Bio | Cat# 95051-500 | |
| Plasmid Maxi Kit (25) | Qiagen | Cat#:12163 | |
| Animals | |||
| Ai14TdTomato mice | Jackson Laboratory | Strain # 007914 | |
| CD45.1 C57BL6/J mice | Jackson Laboratory | Strain # 002014 | |
| CD45.2 C57BL6/J mice | Jackson Laboratory | Strain # 000664 | |
| Instruments and Softwares | |||
| Adobe illustrator | Version 25.2.3 | ||
| BD accuri C6 flow cytometer | BD Biosciences | ||
| FlowJo 10.8.0 | BD | ||
| GeneSys software program | Version 1.5.7.0 | ||
| GraphPad Prism version 6 | GraphPad | ||
| Hemavet 950FS | Drew Scientific | ||
| 7300 Real time PCR system | Applied Biosystems | ||
| Syngene G:BOX Chemi XR5 Chemiluminescence Fluorescence Imaging | G:Box Chemi |
Références
- Dohner, H., Weisdorf, D. J., Bloomfield, C. D. Acute myeloid leukemia. The New England Journal of Medicine. 373 (12), 1136-1152 (2015).
- Fortier, J. M., Graubert, T. A. Murine models of human acute myeloid leukemia. Cancer Treatment and Research. 145, 183-196 (2010).
- Ernst, P., et al. Definitive hematopoiesis requires the mixed-lineage leukemia gene. Developmental Cell. 6 (3), 437-443 (2004).
- Fisher, J. N., Kalleda, N., Stavropoulou, V., Schwaller, J. The Impact of the cellular origin in acute myeloid leukemia: learning from mouse models. Hemasphere. 3 (1), 152 (2019).
- Zhan, Y., Zhao, Y. Hematopoietic stem cell transplant in mice by intra-femoral injection. Methods in Molecular Biology. 430, 161-169 (2008).
- Price, J. E., Barth, R. F., Johnson, C. W., Staubus, A. E. Injection of cells and monoclonal antibodies into mice: comparison of tail vein and retroorbital routes. Proceedings of the Society for Experimental Biology. 177 (2), 347-353 (1984).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animal. 40 (5), 155-160 (2011).
- Suckow, M. A., Danneman, P., Brayton, C. . The Laboratory Mouse. , (2001).
- Barr, J. E., Holmes, D. B., Ryan, L. J., Sharpless, S. K. Techniques for the chronic cannulation of the jugular vein in mice. Pharmacology, Biochemistry, and Behavior. 11 (1), 115-118 (1979).
- Kang, Y. Analysis of cancer stem cell metastasis in xenograft animal models. Methods in Molecular Biology. 568, 7-19 (2009).
- Nungestee, W., Wolf, A., Jourdonais, L. Effect of gastric mucin on virulence of bacteria in intraperitoneal injections in the mouse. Proceedings of the Society for Experimental Biology and Medicine. 30 (2), 120-121 (1932).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and part I: anesthetic considerations in preclinical research. ILAR journal. 53 (1), 55-69 (2012).
- Leong, S. -. K., Ling, E. -. A. Labelling neurons with fluorescent dyes administered via intravenous, subcutaneous or intraperitoneal route. Journal of Neuroscience Methods. 32 (1), 15-23 (1990).
- Ma, P., et al. Intraperitoneal injection of magnetic Fe3O4-nanoparticle induces hepatic and renal tissue injury via oxidative stress in mice. International Journal of Nanomedicine. 7, 4809-4918 (2012).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Muench, M. O., Chen, J. C., Beyer, A. I., Fomin, M. E. Cellular therapies supplement: the peritoneum as an ectopic site of hematopoiesis following in utero transplantation. Transfusion. 51, 106-117 (2011).
- Zhao, W., et al. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World Journal of Gastroenterology. 18 (10), 1048 (2012).
- Yousefi, F., Ebtekar, M., Soleimani, M., Soudi, S., Hashemi, S. M. Comparison of in vivo immunomodulatory effects of intravenous and intraperitoneal administration of adipose-tissue mesenchymal stem cells in experimental autoimmune encephalomyelitis (EAE). International Immunopharmacol. 17 (3), 608-616 (2013).
- Cheng, K., et al. Transplantation of bone marrow-derived MSCs improves cisplatinum-induced renal injury through paracrine mechanisms. Experimental and Molecular Pathology. 94 (3), 466-473 (2013).
- Castelo-Branco, M., et al. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 7 (3), 33360 (2012).
- Bazhanov, N., et al. Intraperitoneally infused human mesenchymal stem cells form aggregates with mouse immune cells and attach to peritoneal organs. Stem Cell Research & Therapy. 7, 27 (2016).
- Liu, Q., Chen, L., Atkinson, J. M., Claxton, D. F., Wang, H. G. Atg5-dependent autophagy contributes to the development of acute myeloid leukemia in an MLL-AF9-driven mouse model. Cell Death & Disease. 7 (9), 2361 (2016).
- Wognum, A. W., Eaves, A. C., Thomas, T. E. Identification and isolation of hematopoietic stem cells. Archives of Medical Research. 34 (6), 461-475 (2003).
- Randall, T. D., Weissman, I. L. Characterization of a population of cells in the bone marrow that phenotypically mimics hematopoietic stem cells: resting stem cells or mystery population. Stem Cells. 16 (1), 38-48 (1998).
- Gott, K. M., et al. A comparison of Cs-137 gamma rays and 320-kV X-rays in a mouse bone marrow transplantation model. Dose Response. 18 (2), 1559325820916572 (2020).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Applied Microbiology. 17 (2), 250-251 (1969).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Ronan, J. L., Wu, W., Crabtree, G. R. From neural development to cognition: unexpected roles for chromatin. Nature Review Genetics. 14 (5), 347-359 (2013).
- Qian, F., et al. Interleukin-4 treatment reduces leukemia burden in acute myeloid leukemia. FASEB Journal. 36 (5), 22328 (2022).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 442 (7104), 818-822 (2006).
- Chen, W., et al. Malignant transformation initiated by Mll-AF9: gene dosage and critical target cells. Cancer Cell. 13 (5), 432-440 (2008).
- Somervaille, T. C. P., Cleary, M. L. Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell. 10 (4), 257-268 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon