Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Trasplante intraperitoneal para la generación de leucemia mieloide aguda en ratones
En este artículo
Resumen
Aquí, la inyección intraperitoneal de células leucémicas se utiliza para establecer y propagar la leucemia mieloide aguda (LMA) en ratones. Este nuevo método es eficaz en el trasplante seriado de células de LMA y puede servir como una alternativa para aquellos que pueden experimentar dificultades e inconsistencias con la inyección intravenosa en ratones.
Resumen
Existe una necesidad insatisfecha de nuevas terapias para tratar la leucemia mieloide aguda (LMA) y la recaída asociada que involucra células madre de leucemia persistente (LSC). Un modelo experimental de roedores AML para probar terapias basadas en el trasplante exitoso de estas células a través de inyecciones retroorbitarias en ratones receptores está lleno de desafíos. El objetivo de este estudio fue desarrollar un método fácil, confiable y consistente para generar un modelo murino robusto de LMA utilizando una ruta intraperitoneal. En el presente protocolo, las células de la médula ósea se transdujeron con un retrovirus que expresa la oncoproteína de fusión MLL-AF9 humana. Se probó la eficiencia de las poblaciones de linaje negativo (Lin-) y Lin-Sca-1+c-Kit+ (LSK) como LSC de donantes en el desarrollo de LMA primaria, y se adoptó la inyección intraperitoneal como un nuevo método para generar LMA. La comparación entre las inyecciones intraperitoneales y retroorbitarias se realizó en trasplantes seriados para comparar y contrastar los dos métodos. Tanto las células Lin como las LSK transducidas con el virus MLL-AF9 humano se injertaron bien en la médula ósea y el bazo de los receptores, lo que llevó a una LMA en toda regla. La inyección intraperitoneal de células del donante estableció la LMA en los receptores tras el trasplante seriado, y la infiltración de células de LMA se detectó en la sangre, la médula ósea, el bazo y el hígado de los receptores mediante citometría de flujo, qPCR y análisis histológicos. Por lo tanto, la inyección intraperitoneal es un método eficiente de inducción de LMA mediante el trasplante en serie de células leucémicas de donantes.
Introducción
La leucemia mieloide aguda (LMA) es un tipo de neoplasia maligna hematológica de etiología diversa con mal pronóstico1. La generación de modelos animales de LMA sienta las bases para la comprensión de sus complejas variaciones y patobiología en un esfuerzo por descubrir nuevas terapias2. La leucemogénesis en ratones implica el trasplante de células donantes que expresan oncoproteínas de fusión, incluidas las fusiones que involucran el gen de la leucemia de linaje mixto (MLL) para inducir potentemente la LMA, para imitar la enfermedad en humanos3. Se han reportado varios orígenes celulares de células de donantes en el trasplante de LMA4 asociada al gen MLL, y se sabe muy poco sobre las células responsables del origen de la enfermedad.
Se han desarrollado múltiples vías para el trasplante en ratones; en lugar de una inyección intrafemoral, que introduce directamente células mutantes del donante en la médula ósea5, una inyección intravenosa que utiliza el plexo sinusal venoso, la vena de la cola y la vena yugular se ha utilizado ampliamente para generar modelos murinos de LMA 6,7,8,9. En el caso de la inyección retroorbitaria (r.o.), varias desventajas inherentes, como la limitación de volumen, la alta demanda técnica, las pocas posibilidades de repetidos intentos o errores, y las posibles lesiones oculares, han sido grandes obstáculos con alternativas limitadas o inviables7. La inyección de venas de la cola puede tener problemas similares además de las lesiones locales; Para facilitar el procedimiento, los ratones a menudo necesitan ser calentados para dilatar sus venas de la cola10. También es difícil localizar la vena de la cola sin una fuente de luz adicional, particularmente en la cepa de ratones C57BL / 6. Para la inyección de vena yugular, el personal de investigación requiere suficiente capacitación para localizar la vena y limitar las posibles complicaciones. Además, tanto las inyecciones de seno venoso como las de venas yugulares deben realizarse bajo anestesia, lo que agrega otro nivel de complejidad. Por lo tanto, es tentador explorar nuevas rutas de trasplante para facilitar el establecimiento de modelos murinos de LMA.
La inyección intraperitoneal (i.p.) se usa comúnmente para administrar medicamentos, colorantes y anestésicos 11,12,13,14,15; También se ha utilizado para introducir células hematopoyéticas para la hematopoyesis ectópica16 y para trasplantar células madre mesenquimales derivadas de médula ósea en varios modelos de ratón17,18,19,20,21. Sin embargo, se ha utilizado con poca frecuencia para establecer neoplasias malignas hematopoyéticas en ratones, particularmente para estudiar la progresión de la enfermedad de LMA.
El presente estudio describe la viabilidad de la inyección i.p. en la generación de modelos de ratón LMA, además de comparar la eficiencia del trasplante de poblaciones de linaje negativo (Lin-) y Lin-Sca-1+c-Kit+ (LSK) como células donantes. Estos hallazgos proporcionan una manera simple y eficiente de generar modelos experimentales de AML y leucemias mieloides relacionadas. Tal método tiene el potencial de ampliar nuestra comprensión de los mecanismos de la enfermedad, así como proporcionar un modelo relativamente fácil para probar terapias experimentales.
Protocolo
Todos los experimentos fueron aprobados previamente por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Pensilvania.
1. Preparación de tampones y reactivos
- Preparar ampicilina suplementada (AP) con placas de agar LB (placas estériles de 10 cm). Para hacer esto, disuelva 10 g de caldo LB con agar en 400 ml de agua destilada, revuelva y lleve el volumen hasta 500 ml. Esterilice la solución en autoclave, luego deje que la solución se enfríe, agregue 0.5 ml de ampicilina (stock: 150 mg / ml) en la solución y agítela para mezclar. Añadir inmediatamente 18 ml de solución a una placa estéril de 10 cm cerca de una lámpara de alcohol, dejar solidificar a temperatura ambiente y almacenar las placas boca abajo a 4 °C hasta su uso posterior.
- Preparar los medios LB disolviendo 10 g de LB sin agar en 500 mL de agua destilada. Esterilice la solución en autoclave, deje que la solución se enfríe, agregue 0.5 ml de ampicilina (stock: 150 mg / ml) en la solución y agítela para mezclar.
- Prepare el tampón de flujo agregando 5 ml de penicilina/estreptomicina y 10 ml de suero bovino fetal inactivado por calor (hiFBS) en 485 ml de 1x solución salina tamponada con fosfato de Dulbecco (DPBS).
NOTA: Para desactivar FBS por calentamiento, coloque las botellas FBS descongeladas en un baño de agua a 56 °C. Asegúrese de que las botellas no se vuelquen ni se sumerjan en el baño de agua. La temperatura es crítica para la degradación completa; para garantizar esto, espere hasta que la temperatura se estabilice a 56 ° C después de poner las botellas al baño maría. Agite suavemente las botellas cada 10 minutos tres veces. No permita que el suero se incube durante más de 30 minutos. - Prepare los medios de mantenimiento agregando 50 ml de hiFBS, 5 ml de L-glutamina y 5 ml de penicilina/estreptomicina en 440 ml de medio de águila modificada (DMEM) de Dulbecco. Prepare los medios de transfección agregando 50 ml de hiFBS y 5 ml de L-glutamina en 445 ml de medios DMEM.
- Prepare el tampón de lisis de glóbulos rojos (RBC) agregando 4.145 g de NH4Cl, 0.504 g de NaHCO3 y 16.81 mg de ácido etilendiaminotetraacético (EDTA) en 500 ml de agua destilada. Prepare el medio de Dulbecco (IMDM) modificado de Iscove agregando 75 ml de hiFBS, 5 g de albúmina sérica bovina (BSA), 0.5 ml de insulina de 10 mg / ml, 2.5 ml de holotransferrina de 4 mg / ml, 3.5 μL de β-mercaptoetanol, 5 ml de L-glutamina y 0.5 ml de ciprofloxacino en 416.5 ml de medios IMDM.
- Preparar 10 ml de 2x medios IMDM, en los que la concentración de citocinas sea el doble de la cantidad en 1x medio IMDM, añadiendo 10 μL de 50 ng/μL mr-SCF, 20 μL de 25 ng/μL mr-Flt3L, 20 μL de 10 ng/μL mr-IL-6, 20 μL de 10 ng/μL mr-IL-3, 10 μL de 10 mg/ml de insulina, y 50 μL de holotransferrina de 4 mg/ml en 9,87 ml de medios IMDM incompletos.
NOTA: Asegúrese de que el búfer de flujo, el tampón de lisis RBC, los medios de mantenimiento, los medios de transfección y los medios IMDM incompletos estén esterilizados por filtro antes de su uso.
2. Transformación de plásmidos
- Descongele 20 μL de células competentes α-Select en hielo. Agregue 1 μL (~2 ng) de MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 plásmido22 a las células competentes descongeladas y mezcle suavemente golpeando el tubo. Incubar la reacción en hielo durante 30 min.
- Choque térmico de la mezcla por incubación durante 40 s en un bloque calefactor a 42 °C. Transfiera inmediatamente el tubo sobre hielo durante 2 minutos.
- Añadir 1 ml de medio LB (sin ampicilina) al tubo y agitar a 37 °C y 200 rpm durante 1 h.
- Centrifugar el tubo a temperatura ambiente a 500 x g durante 4 min y desechar 0,9 ml de sobrenadante. Resuspender el precipitado en los 0,1 ml restantes de medios LB.
- Extienda las células competentes transformadas en placas de agar AP LB precalentadas (37 °C). Incubar la placa boca abajo a 37 °C durante 12-16 h.
- Elija una sola colonia y gaste las células transformadas en 10 ml de medios AP LB durante la noche a 37 °C y 200 rpm.
- Añadir 5 ml de células competentes transformadas gastadas a 500 ml de medios AP LB en un matraz e incubar el matraz durante la noche a 37 °C y 200 rpm.
- Extraiga el plásmido utilizando un kit de extracción de plásmidos de acuerdo con las instrucciones del fabricante y vuelva a suspenderlo en 0,5 ml de agua ultrapura esterilizada en autoclave. Cuantificar el plásmido usando un espectrofotómetro.
3. Transfección de células Phoenix Ecotropic (pECO)
- Cultivo de 2 x 106 células/placa pECO en medios de mantenimiento en placas de 10 cm en una incubadora humidificada deCO2 al 5% a 37 °C. Asegúrese de que las células pECO se mantengan en fase de crecimiento exponencial y se dividan activamente antes del paso.
- Cuando las células se confluyan en un 80%, lavar las placas con 5 ml de DPBS dos veces, añadir 1 ml de tripsina a la placa e incubar en una incubadora humidificada deCO2 al 5% a 37 °C durante 2 min. Cosechar las células con 5 ml de medios de mantenimiento en un tubo estéril de 15 ml y centrifugar a 4 °C y 400 x g durante 3 min. Resuspender el pellet celular en 5 mL de medios de mantenimiento.
- Mezclar 10 μL de suspensión celular y 10 μL de azul de tripano y cargar 10 μL en un hemocitómetro para contar las células.
Total de células/ml = (Total de células contadas x factor de dilución x 104 células/ml)/ Número de cuadrados contados)
Sembrar 2 x 106 células/plato en platos de 6 cm utilizando 5 ml de medios de mantenimiento para la transfección y el cultivo de las células en una incubadora humidificada deCO2 al 5% a 37 °C. - Reemplace los medios de mantenimiento con 5 ml de medios de transfección cuando las células se conviertan en 50% -60% confluentes después de 18 h de cultivo.
- Mantenga el reactivo de transfección a temperatura ambiente durante al menos 30 minutos antes de la transfección.
- Añadir 5,5 μg de MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 plásmido22 a 0,5 ml de medios DMEM simples en un tubo estéril de 1,5 ml. Mezcle suavemente golpeando el tubo y déjelo reposar durante 10 minutos.
- Agregue 14.6 μL (3 veces la cantidad de plásmido; v/p) de reactivo de transfección al tubo y golpee suavemente el tubo cada 10 minutos tres veces.
- Agregue uniformemente la mezcla gota a gota a todas las áreas de los platos con las células pECO en medios de transfección. Mueva suavemente los platos hacia adelante y hacia atrás 10 veces y hacia los lados 10 veces. Incubar los platos en una incubadora humidificada deCO2 al 5% a 37 °C durante 48 h.
- Medir la eficiencia de la transfección mediante microscopía de florescencia y citometría de flujo para la proteína fluorescente verde (GFP) como se describe en22. Las células se bloquean primero en FSC-A / FSC-H y FSC-A y SSC-A para adquirir singletes. La población GFP+ se cierra en la gráfica FL1 comparándola con células no transfectadas.
- Recoja y filtre los sobrenadantes a través de un filtro de jeringa de 0,45 μm en un tubo estéril de 50 ml. Use los sobrenadantes inmediatamente para la transducción o congélelos en nitrógeno líquido y guárdelos a -80 °C hasta que se vuelvan a usar.
NOTA: las células pECO deben mezclarse adecuadamente y sembrarse en platos de manera uniforme. Permita que las células se propaguen moviendo los platos hacia adelante y hacia atrás 10 veces y hacia los lados 10 veces mientras siembran. El número de celdas a sembrar puede variar dependiendo de las variaciones en el conteo. Para encontrar el número óptimo de células de siembra que pueda lograr una confluencia del 50% -60% después de 18 h de cultivo, es útil sembrar células con diluciones en serie.
4. Transducción lentiviral
- Eutanasia ratones hembra CD45.1 C57BL6/J de 8-10 semanas de edad (dos a tres ratones donantes por ratón receptor) en una cámara deCO2 .
- Esterilizar todo el cuerpo de los ratones con etanol al 70%. Coloque los ratones en una almohadilla quirúrgica estéril en una tabla de espuma de poliestireno y fije las patas a través de las almohadillas de las patas del ratón.
- Corte la piel por encima de la cavidad abdominal en la línea media y amplíe el espacio subcutáneo hacia las patas traseras con tijeras estériles afiladas.
- Extienda la incisión desde la línea media abdominal hasta los tobillos. Amplíe el espacio subcutáneo debajo de las patas traseras con las cuchillas de tijeras estériles de punta afilada.
- Cortar el tendón de Aquiles con tijeras estériles de extremo afilado. Sostenga el tendón con fórceps con dientes y corte el otro extremo unido al fémur para extraer el músculo gastrocnemio.
- Corte el tendón del cuádriceps unido a la rodilla con tijeras estériles de punta afilada. Sostenga el tendón con fórceps con dientes y corte las cabezas musculares unidas al fémur para extraer el músculo gastrocnemio.
- Corte los otros músculos que rodean el fémur en el extremo unido a la tibia con tijeras estériles de extremo afilado.
- Corte el tobillo con tijeras estériles de punta afilada, asegurándose de que la tibia permanezca intacta. Sostenga el extremo distal del fémur con fórceps con dientes y corte la articulación de la cadera con tijeras estériles de extremo afilado, asegurando que la cabeza femoral permanezca intacta.
- Transfiera las tibias y los fémures al tampón de flujo en un tubo estéril de 15 ml.
- Separe la tibia y el fémur rompiendo la rodilla con la mano. Retire la rótula, el cartílago y los cóndilos femorales para exponer la meseta tibial y el fémur distal con la mano. Retire los músculos con una gasa estéril y luego remoje los huesos en tampón de flujo.
- Corte el cuello femoral y enjuague las células de la médula ósea con tampón de flujo desde ambos extremos del fémur con una jeringa de 10 ml con una aguja de 23 G.
- Corte el maléolo tibial y enjuague las células de la médula ósea con tampón de flujo desde ambos extremos de la tibia con una jeringa de 10 ml con una aguja de 23 G.
- Dispersar las células pipeteando hacia arriba y hacia abajo usando una jeringa de 10 ml con una aguja de 18 G. Centrifugar la suspensión unicelular a 4 °C y 400 x g durante 3 min.
- Deseche el sobrenadante y resuspenda las células en 5 ml de tampón de lisis de glóbulos rojos para lisar los glóbulos rojos durante 3 min.
- Añadir 5 ml de tampón de flujo para detener la lisis y centrifugar la suspensión celular a 4 °C y 400 x g durante 3 min.
- Coloque un filtro de células de 70 μm en un tubo estéril de 50 ml. Suspenda el pellet con 5 ml de tampón de flujo, mezcle y pase a través del filtro celular para recoger las células.
- Ajuste la concentración de la celda con tampón de flujo a 1 x 108/ml en tubos de polipropileno de fondo redondo.
- Seleccione Lin- cells usando un kit de aislamiento de células hematopoyéticas de ratón de acuerdo con las instrucciones del fabricante.
- Mantener a un lado tres tubos de 1 x 104 células en 100 μL de tampón para un control no teñido y dos controles únicos teñidos con anticuerpos para CD117 (c-Kit) anti-ratón conjugado con APC y anti-ratón conjugado con PE-Cy7 Ly-6A/E (Sca-1). Use 1 μL de anticuerpo (de 0,2 mg/ml) para cada uno de los controles únicos teñidos con anticuerpos.
- Teñir el resto de las células en un tubo con ambos anticuerpos (4 μL de cada uno de 0,2 mg/ml de existencias) en 400 μL. Incubar los tubos en hielo en la oscuridad durante 0,5-1 h.
- Después de la tinción, lavar las células añadiendo 1 ml de tampón de flujo y centrifugar a 4 °C y 400 x g durante 3 min.
- Resuspender las células para el control no teñido y los controles únicos teñidos con anticuerpos en 100 μL de tampón de flujo. Resuspender las células teñidas con anticuerpos dobles en 1 ml de tampón de flujo para la clasificación.
- Clasificar las células madre hematopoyéticas (HSC) como una población de LSK utilizando un clasificador de células como se describe en23,24.
- Durante la tinción, cubra un plato estéril de 6 cm con retronectina de la siguiente manera: Prepare 100 μg/ml de retronectina en PBS y agregue 0,9 ml de PBS y 0,1 ml de retronectina a una placa de 6 cm. Cubra el plato en una campana estéril a temperatura ambiente durante 2 h. Luego, retire la retronectina y bloquee el plato con 0.5 ml de BSA filtrada al 2% (en PBS) durante 30 min. Lave el plato con 5 ml de PBS dos veces y el plato estará listo para la transducción.
- Centrifugar las HSC clasificadas o las células Lin no clasificadas a 4 °C y 400 x g durante 3 min y resuspender en 3 ml de 2x (de citoquinas) medios IMDM y 3 ml de sobrenadante viral (generado a partir del paso 3.10) en una placa recubierta de retronectina. Incubar el plato en una incubadora humidificada deCO2 al 5% a 37 °C durante 6 o 24 h.
NOTA: En el presente estudio, las células Lin se clasificaron o no según el diseño experimental.
5. Trasplante seriado (Figura 1)
NOTA: Los ratones receptores primarios fueron ratones machos C57BL6/J de 8-10 semanas de edad (CD45.2). Se les proporcionó agua ad libitum que contenía antibióticos para prevenir infecciones digestivas oportunistas, desde 3 días antes del trasplante hasta 7 días después del trasplante. Los ratones receptores primarios fueron irradiados subletalmente (4,75 Gy) 3 h antes del trasplante25. El isoflurano no se aplicó a ratones con inyección intraperitoneal.
- Después de la transducción durante 6 o 24 h, cosechar las células por centrifugación a temperatura ambiente y 400 x g durante 3 min. Use tripsina para recolectar las células adheridas al fondo del plato si es necesario. Deseche el sobrenadante y resuspenda las células en PBS precalentado. Determinar el volumen de PBS en función del número de receptores (es decir, 0,1 ml/ratón y 0,5 ml/ratón para los receptores con inyecciones retroorbitarias e intraperitoneales, respectivamente).
- Coloque los ratones receptores irradiados subletalmente en una cámara de isoflurano (el caudal de oxígeno se establece en 1.0 L / min y el vaporizador de isoflurano se establece en 5%). Aplique ungüento húmedo en los ojos para evitar la sequedad mientras está bajo anestesia. Los ratones están listos para procedimientos adicionales cuando los latidos del corazón caen a 60 latidos por minuto.
- Inyectar células en ratones receptores primarios retroorbitalmente (0,1 mL/ratón)7 o intraperitonealmente (0,5 mL/ratón)26 con una aguja 27 G1/2. Observe a los ratones continuamente hasta que adquieran suficiente conciencia para mantener la decúbito esternal. Controle a los ratones diariamente para su bienestar después del trasplante.
- Después de 1 mes, recolecte sangre semanalmente por sangrado retroorbitario para controlar la leucocitosis mediante la evaluación del conteo sanguíneo completo (CSC) en una hematona como se describe a continuación.
- Coloque el ratón lateralmente después de la anestesia con isoflurano (el caudal de oxígeno se establece en 1.0 L / min y el vaporizador de isoflurancia se establece en 5%). Los ratones están listos para procedimientos adicionales cuando los latidos del corazón caen a 60 latidos por minuto.
- Propósate el ojo con el pulgar y el índice. Penetrar el plexo sinusal venoso con tubo capilar hemacrit asteril a través del canto interno.
- Recoja 20-25 μL de sangre en un tubo de recolección de sangre EDTA y cierre los párpados para detener el sangrado. Aplique una gota de solución oftálmica de sulfato de gentamicina en el ojo.
- En el punto final, cuando los glóbulos blancos (WBC) alcancen 4 x 104 células / μL, eutanasia al ratón en una cámara de CO2 y aísle las células de la médula ósea enjuagando los fémures y las tibias con tampón de flujo, seguido de lisis de glóbulos rojos como se mencionó en el paso 4.
- En el punto final, cosecha los esplenocitos como se menciona a continuación.
- Eutanasia del ratón en una cámara deCO2 . Coloque los ratones en una almohadilla quirúrgica estéril en una tabla de espuma de poliestireno y fije las patas a través de las almohadillas de las patas del ratón. Esterilizar todo el cuerpo de los ratones con etanol al 70%.
- Corte la piel y el músculo en la línea media para exponer la cavidad abdominal con tijeras estériles de punta afilada. Aísle el bazo con tijeras estériles de punta afilada y colóquelo en un tampón de flujo en un tubo estéril de 15 ml.
- Engranar el bazo a través de un colador estéril de 70 μm en una placa de 6 cm con 3 ml de tampón de flujo. Transfiera las células del plato a un tubo estéril de 15 ml y centrifugar la suspensión unicelular a 4 °C y 400 x g durante 3 min.
- Deseche el sobrenadante y resuspenda las células en 5 ml de tampón de lisis de glóbulos rojos para lisar los glóbulos rojos durante 3 min. Añadir 5 ml de tampón de flujo para detener la lisis y centrifugar la suspensión celular a 4 °C y 400 x g durante 3 min.
- Coloque un filtro de células de 70 μm en un tubo estéril de 50 ml. Suspenda el pellet con 5 ml de tampón de flujo, mezcle y pase a través del filtro celular para recolectar células.
- Identificar células primarias (1°) de LMA tiñendo los esplenocitos y las células de la médula ósea con el anticuerpo CD45.1 anti-ratón conjugado con FITC y detectando en un citómetro de flujo. Las células se bloquean primero en FSC-A / FSC-H y FSC-A y SSC-A para adquirir singletes. La población CD45.1+ está cerrada en la gráfica FL1 comparándola con células no teñidas.
- Para el trasplante secundario (2°), resuspender las células esplénicas de LMA CD45.1 de receptores de 1° r.o. en PBS (0,1 ml/ratón) e inyectarlas retroorbitalmente en ratones machos CD45.2 C57BL6/J. Paralelamente, resuspender células esplénicas de LMA de receptores de 1° i.p. en PBS (0,5 mL/ratón) e inyectarlas intraperitonealmente en ratones machos Ai14TdTomato que expresan proteína de fluorescencia roja (RFP) de 8-12 semanas de edad27.
- Para el trasplante terciario (3°), resuspender las células de LMA aisladas de la médula ósea o la cavidad peritoneal de los receptores de 2° i.p. e inyectarlas intraperitonealmente en ratones Ai14TdTomato (RFP+) o CD45.2, respectivamente. Resuspender células de LMA aisladas de la cavidad peritoneal de receptores de 2° r.o. y trasplantarlas mediante inyección de r.o. en ratones Ai14TdTomato (RFP+).
NOTA: Para el trasplante de 2°, identificamos la progresión de la enfermedad en receptores de 2° mediante la monitorización del CBC en sangre periférica. Para confirmar aún más el establecimiento de AML, recolectamos sangre periférica completa por punción cardíaca, así como médula ósea, bazo e hígado. Además, realizamos un lavado i.p. para recolectar células i.p. Las suspensiones unicelulares se adquirieron de la médula ósea, el bazo y el lavado i.p. como se describió anteriormente. Las células de estos sitios se analizaron en un citómetro de flujo después de la lisis de glóbulos rojos. Las células de AML se reconocieron como células RFP negativas (RFP-). Para el trasplante de 3°, tomamos muestras de sangre, médula ósea, bazo, hígado y células i.p. en el punto final; Las células RFP o CD45.1+ se identificaron como células de LMA y se examinaron mediante citometría de flujo. No se administró irradiación ni agua antibiótica a ratones receptores de 2° y 3°.
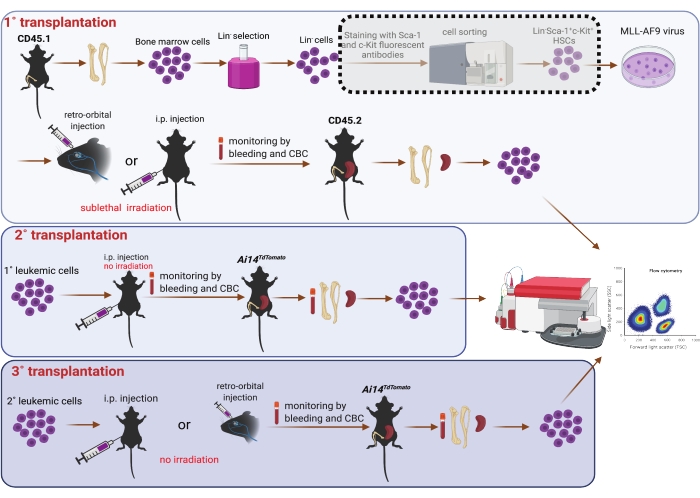
Figura 1: Esquema de transducción viral MLL-AF9 en HSC de médula ósea y trasplante seriado (1°, 2° y 3°). La clasificación de la población doble positiva de Sca-1 y c-Kit mediante el uso de un clasificador de celdas que se muestra en el cuadro de sombra punteado se considera opcional, si los recursos lo permiten. La figura fue creada usando BioRender (https://biorender.com/). Haga clic aquí para ver una versión más grande de esta figura.
6. Lavado intraperitoneal
- Inyecte 5 ml de medios IMDM incompletos en la cavidad peritoneal dos veces para recoger las células en un tubo estéril de 15 ml. Centrifugar la suspensión celular a temperatura ambiente y 400 x g durante 3 min. Trasplante de células de LMA (4 x 105 células /ratón) de la cavidad peritoneal de 2° receptores mediante inyección i.p. en ratones receptores de CD45,2 a 3° (n = 3).
7. Análisis histológico 28
- Aísle los bazos, hígados y fémures de ratones tras la eutanasia. Fíjelos en 5 ml de formalina tamponada al 10% (v / v). Muestree los bazos y los hígados de contrapartes sanas para comparaciones.
- Incrustar tejidos fijos en parafina y cortarlos en secciones. Manche las secciones con colorantes de hematoxilina y eosina (H&E).
- Obtenga las imágenes bajo un microscopio a un aumento de 20x instalado con un software compatible para análisis histológicos.
8. Realización de PCR semicuantitativa (qPCR)
- Prepare los ARN en el reactivo de ARN de acuerdo con las instrucciones del fabricante.
- Utilice ARN de 0,5 a 1,0 μg para sintetizar ADNc utilizando un kit de transcripción inversa de ADNc de acuerdo con las instrucciones del fabricante.
- Utilice ADNc para realizar qPCR utilizando un kit de qPCR y ejecute las muestras en un sistema de qPCR. Utilice las siguientes sondas TaqMan validadas previamente: KMT2A (MLL; Ref Seq: ARN ribosómico NM_001197104(2), IDT)29 y 18S (Hs99999901_s1).
- Cargue los amplicones KMT2A y 18S en un gel de agarosa al 2% para visualizar la expresión. Adquiera imágenes en un generador de imágenes instalado con el programa de software compatible.
9. Tratamiento de datos
- Analice los resultados utilizando un software de análisis estadístico y presente los resultados como la media ± SEM. Genere figuras utilizando una herramienta de ilustrador comercial.
Resultados
Comparación de la eficiencia del trasplante de células murinas de LMA mediante las vías de trasplante r.o. e i.p.
Anteriormente, se informó el establecimiento de 1° LMA en ratones receptores trasplantados retroorbitalmente con células LSK transducidas por MLL-AF9, y la capacidad de trasplante de células de LMA de 1° se demostró mediante trasplante seriado30. El presente estudio es el primero en evaluar la posibilidad de utilizar células Lin- de médula óse...
Discusión
Estos estudios descritos anteriormente proporcionan evidencia de apoyo de que el trasplante de células Lin es comparable a las células LSK en la generación de LMA murina de 1°. Además, los datos actuales también muestran que la inyección i.p. es un método eficiente y conveniente para establecer la LMA murina en comparación con la inyección intravenosa (o r.o.).
Además de las células LSK, se ha informado que otras poblaciones como el progenitor granulocítico-monocitos (G...
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores agradecen a la Instalación Central de Citometría de Flujo del Instituto Huck y a la Instalación Central de Histopatología del Laboratorio de Diagnóstico Animal, Departamento de Ciencias Veterinarias y Biomédicas, Universidad Estatal de Pensilvania, por brindar apoyo técnico oportuno. Este trabajo fue apoyado por subvenciones del Instituto Americano para la Investigación del Cáncer (KSP), Penn State College of Agricultural Sciences, Penn State Cancer Institute, USDA-NIFA project 4771, Número de Acceso 00000005 a K.S.P. y R.F.P.
Materiales
| Name | Company | Catalog Number | Comments |
| a-Select competent cells | Bioline | BIO-85027 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | Cat# A-9434 | |
| Ampicillin | Sigma Aldrich | Cat# A0797 | |
| Bovine Serum Albumin (BSA), Fraction V—Low-Endotoxin Grade | Gemini bio-products | Cat# 700-102P | |
| Ciprofloxacin HCl | GoldBio.com | Cat# C-861-100 | |
| DMEM, high glucose, no glutamine | Gibco | Cat# 11960-044 | |
| Dulbecco’s Phosphate-Buffered Saline (PBS) | Corning | Cat# 21-031-CV | |
| EDTA, Disodium Salt (EDTA-2Na), Dihydrate, Molecular Biology Grade | Calbiochem | Cat# 324503 | |
| Fetal Bovine Serum - Premium Select | Atlanta Biologicals | Cat# S11550 | |
| Holo-transferrin, bovine | Sigma Aldrich | Cat# T1283 | |
| Insulin solution human | Sigma | Cat# I-9278 | |
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | Cat# 12440-053 | |
| L-glutamine 200 mM (100×) solution | HyClone, Gelifesciences | Cat# SH30034.01 | |
| LB broth, Lennox | NEOGEN | Cat #: 7290A | |
| LB Broth with agar (Miller) | Sigma Aldrich | Cat# L-3147 | |
| Mouse anti-mouse CD45.1 (FITC) | Miltenyi Biotec | Cat# 130-124-211 | |
| Mouse Interleukin-3 (IL-3) | Gemini bio-products | Cat# 300-324P | |
| Mouse Interleukin-6 (IL-6) | Gemini bio-products | Cat# 300-327P | |
| Mouse Stem Cell Factor (SCF) | Gemini bio-products | Cat# 300-348P | |
| Penicillin-Streptomycin Solution, 100x | Corning | Cat# 30-002-CI | |
| Phenix-Eco (pECO) cells | ATCC | CRL-3214 | |
| Potassium Bicarbonate (KHCO3), Granular | JT. Baker | Cat# 2940-01 | |
| Rat anti-mouse CD117 (c-kit) (APC) | BioLegend | Cat # 105812 | |
| Rat anti-mouse Ly-6A/E (Sca-1) (PE-Cy7) | BD Pharmingen | Cat# 558162 | |
| Recombinant Murine Flt3-Ligand | Pepro Tech, INC. | Cat# 250-31L | |
| RetroNectin Recombinant Human Fibronectin Fragment | TaKaRa | Cat# T100A | |
| TransIT-293 Reagent | MirusBio | Cat# MIR 2705 | |
| TRI Reagent | Sigma Aldrich | Cat# T9424 | |
| Trypan Blue Solution, 0.4% | Gibco | Cat # 15250061 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | Cat# 25200-056 | |
| β-Mercaptoethanol (BME) | Sigma Aldrich | Cat# M3148 | |
| Commercial Assays | |||
| EasySep Mouse Hematopoietic Progenitor Cell Isolation Kit | StemCell technologies | Cat# 19856A | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher | Cat# 4368813 | |
| PerfeCTa qPCR SuperMix | Quanta Bio | Cat# 95051-500 | |
| Plasmid Maxi Kit (25) | Qiagen | Cat#:12163 | |
| Animals | |||
| Ai14TdTomato mice | Jackson Laboratory | Strain # 007914 | |
| CD45.1 C57BL6/J mice | Jackson Laboratory | Strain # 002014 | |
| CD45.2 C57BL6/J mice | Jackson Laboratory | Strain # 000664 | |
| Instruments and Softwares | |||
| Adobe illustrator | Version 25.2.3 | ||
| BD accuri C6 flow cytometer | BD Biosciences | ||
| FlowJo 10.8.0 | BD | ||
| GeneSys software program | Version 1.5.7.0 | ||
| GraphPad Prism version 6 | GraphPad | ||
| Hemavet 950FS | Drew Scientific | ||
| 7300 Real time PCR system | Applied Biosystems | ||
| Syngene G:BOX Chemi XR5 Chemiluminescence Fluorescence Imaging | G:Box Chemi |
Referencias
- Dohner, H., Weisdorf, D. J., Bloomfield, C. D. Acute myeloid leukemia. The New England Journal of Medicine. 373 (12), 1136-1152 (2015).
- Fortier, J. M., Graubert, T. A. Murine models of human acute myeloid leukemia. Cancer Treatment and Research. 145, 183-196 (2010).
- Ernst, P., et al. Definitive hematopoiesis requires the mixed-lineage leukemia gene. Developmental Cell. 6 (3), 437-443 (2004).
- Fisher, J. N., Kalleda, N., Stavropoulou, V., Schwaller, J. The Impact of the cellular origin in acute myeloid leukemia: learning from mouse models. Hemasphere. 3 (1), 152 (2019).
- Zhan, Y., Zhao, Y. Hematopoietic stem cell transplant in mice by intra-femoral injection. Methods in Molecular Biology. 430, 161-169 (2008).
- Price, J. E., Barth, R. F., Johnson, C. W., Staubus, A. E. Injection of cells and monoclonal antibodies into mice: comparison of tail vein and retroorbital routes. Proceedings of the Society for Experimental Biology. 177 (2), 347-353 (1984).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animal. 40 (5), 155-160 (2011).
- Suckow, M. A., Danneman, P., Brayton, C. . The Laboratory Mouse. , (2001).
- Barr, J. E., Holmes, D. B., Ryan, L. J., Sharpless, S. K. Techniques for the chronic cannulation of the jugular vein in mice. Pharmacology, Biochemistry, and Behavior. 11 (1), 115-118 (1979).
- Kang, Y. Analysis of cancer stem cell metastasis in xenograft animal models. Methods in Molecular Biology. 568, 7-19 (2009).
- Nungestee, W., Wolf, A., Jourdonais, L. Effect of gastric mucin on virulence of bacteria in intraperitoneal injections in the mouse. Proceedings of the Society for Experimental Biology and Medicine. 30 (2), 120-121 (1932).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and part I: anesthetic considerations in preclinical research. ILAR journal. 53 (1), 55-69 (2012).
- Leong, S. -. K., Ling, E. -. A. Labelling neurons with fluorescent dyes administered via intravenous, subcutaneous or intraperitoneal route. Journal of Neuroscience Methods. 32 (1), 15-23 (1990).
- Ma, P., et al. Intraperitoneal injection of magnetic Fe3O4-nanoparticle induces hepatic and renal tissue injury via oxidative stress in mice. International Journal of Nanomedicine. 7, 4809-4918 (2012).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Muench, M. O., Chen, J. C., Beyer, A. I., Fomin, M. E. Cellular therapies supplement: the peritoneum as an ectopic site of hematopoiesis following in utero transplantation. Transfusion. 51, 106-117 (2011).
- Zhao, W., et al. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World Journal of Gastroenterology. 18 (10), 1048 (2012).
- Yousefi, F., Ebtekar, M., Soleimani, M., Soudi, S., Hashemi, S. M. Comparison of in vivo immunomodulatory effects of intravenous and intraperitoneal administration of adipose-tissue mesenchymal stem cells in experimental autoimmune encephalomyelitis (EAE). International Immunopharmacol. 17 (3), 608-616 (2013).
- Cheng, K., et al. Transplantation of bone marrow-derived MSCs improves cisplatinum-induced renal injury through paracrine mechanisms. Experimental and Molecular Pathology. 94 (3), 466-473 (2013).
- Castelo-Branco, M., et al. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 7 (3), 33360 (2012).
- Bazhanov, N., et al. Intraperitoneally infused human mesenchymal stem cells form aggregates with mouse immune cells and attach to peritoneal organs. Stem Cell Research & Therapy. 7, 27 (2016).
- Liu, Q., Chen, L., Atkinson, J. M., Claxton, D. F., Wang, H. G. Atg5-dependent autophagy contributes to the development of acute myeloid leukemia in an MLL-AF9-driven mouse model. Cell Death & Disease. 7 (9), 2361 (2016).
- Wognum, A. W., Eaves, A. C., Thomas, T. E. Identification and isolation of hematopoietic stem cells. Archives of Medical Research. 34 (6), 461-475 (2003).
- Randall, T. D., Weissman, I. L. Characterization of a population of cells in the bone marrow that phenotypically mimics hematopoietic stem cells: resting stem cells or mystery population. Stem Cells. 16 (1), 38-48 (1998).
- Gott, K. M., et al. A comparison of Cs-137 gamma rays and 320-kV X-rays in a mouse bone marrow transplantation model. Dose Response. 18 (2), 1559325820916572 (2020).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Applied Microbiology. 17 (2), 250-251 (1969).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Ronan, J. L., Wu, W., Crabtree, G. R. From neural development to cognition: unexpected roles for chromatin. Nature Review Genetics. 14 (5), 347-359 (2013).
- Qian, F., et al. Interleukin-4 treatment reduces leukemia burden in acute myeloid leukemia. FASEB Journal. 36 (5), 22328 (2022).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 442 (7104), 818-822 (2006).
- Chen, W., et al. Malignant transformation initiated by Mll-AF9: gene dosage and critical target cells. Cancer Cell. 13 (5), 432-440 (2008).
- Somervaille, T. C. P., Cleary, M. L. Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell. 10 (4), 257-268 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados