Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Intraperitoneale Transplantation zur Erzeugung akuter myeloischer Leukämie bei Mäusen
In diesem Artikel
Zusammenfassung
Dabei wird die intraperitoneale Injektion von Leukämiezellen genutzt, um eine akute myeloische Leukämie (AML) bei Mäusen zu etablieren und zu propagieren. Diese neue Methode ist bei der seriellen Transplantation von AML-Zellen wirksam und kann als Alternative für diejenigen dienen, bei denen Schwierigkeiten und Inkonsistenzen bei der intravenösen Injektion bei Mäusen auftreten können.
Zusammenfassung
Es besteht ein ungedeckter Bedarf an neuartigen Therapien zur Behandlung der akuten myeloischen Leukämie (AML) und des damit verbundenen Rezidivs, an dem persistierende Leukämiestammzellen (LSCs) beteiligt sind. Ein experimentelles AML-Nagetiermodell zur Erprobung von Therapien, die auf der erfolgreichen Transplantation dieser Zellen durch retroorbitale Injektionen in Empfängermäusen basieren, ist mit Herausforderungen verbunden. Das Ziel dieser Studie war es, eine einfache, zuverlässige und konsistente Methode zu entwickeln, um ein robustes murines AML-Modell auf intraperitonealer Route zu generieren. Im vorliegenden Protokoll wurden Knochenmarkszellen mit einem Retrovirus transduziert, das humanes MLL-AF9-Fusions-Onkoprotein exprimiert. Die Effizienz von liniennegativen (Lin-) und Lin-Sca-1+c-Kit+ (LSK) Populationen als Spender-LSCs bei der Entwicklung der primären AML wurde getestet und die intraperitoneale Injektion als neue Methode zur Erzeugung von AML eingeführt. Der Vergleich zwischen intraperitonealen und retroorbitalen Injektionen wurde bei seriellen Transplantationen durchgeführt, um die beiden Methoden zu vergleichen und gegenüberzustellen. Sowohl Lin- als auch LSK-Zellen, die mit dem humanen MLL-AF9-Virus transduzierten, transplantierten gut in das Knochenmark und die Milz der Empfänger, was zu einer ausgewachsenen AML führte. Die intraperitoneale Injektion von Spenderzellen etablierte AML bei Empfängern nach serieller Transplantation, und die Infiltration von AML-Zellen wurde im Blut, Knochenmark, Milz und Leber der Empfänger durch Durchflusszytometrie, qPCR und histologische Analysen nachgewiesen. Daher ist die intraperitoneale Injektion eine effiziente Methode der AML-Induktion durch serielle Transplantation von Spenderleukämiezellen.
Einleitung
Die akute myeloische Leukämie (AML) ist eine Form der hämatologischen Malignität unterschiedlicher Ätiologie mit schlechter Prognose1. Die Generierung von AML-Tiermodellen legt den Grundstein für das Verständnis ihrer komplexen Variationen und Pathobiologie, um neue Therapien zu entdecken2. Die Leukämiegenese bei Mäusen umfasst die Transplantation von Spenderzellen, die Fusions-Onkoproteine exprimieren, einschließlich Fusionen, an denen das MLL-Gen (Mixed Lineage Leukemia) beteiligt ist, um AML stark zu induzieren und die Krankheit beim Menschen nachzuahmen3. Bei der Transplantation von MLL-Gen-assoziierter AML4 wurden verschiedene zelluläre Ursprünge von Spenderzellen beschrieben, wobei nur sehr wenig über die Zellen bekannt ist, die für die Entstehung der Krankheit verantwortlich sind.
Es wurden mehrere Wege für die Transplantation in Mäuse entwickelt. Anstelle einer intrafemoralen Injektion, bei der mutierte Spenderzellen direkt in das Knochenmark eingeführt werden5, wurde eine intravenöse Injektion, bei der der venöse Sinusplexus, die Schwanzvene und die Halsvene verwendet werden, häufig verwendet, um murine AML-Modelle zu erzeugen 6,7,8,9. Im Falle der retroorbitalen Injektion waren verschiedene inhärente Nachteile, wie z. B. Volumenbegrenzung, hohe technische Anforderungen, geringe Wahrscheinlichkeit von Wiederholungsversuchen oder Fehlern und mögliche Augenverletzungen, große Stolpersteine mit begrenzten oder gar keinen praktikablen Alternativen7. Die Injektion einer Schwanzvene kann neben lokalen Verletzungen ähnliche Probleme haben. Um den Eingriff zu erleichtern, müssen Mäuse oft aufgewärmt werden, um ihre Schwanzvenen zu erweitern10. Es ist auch schwierig, die Schwanzvene ohne eine zusätzliche Lichtquelle zu lokalisieren, insbesondere beim Mäusestamm C57BL/6. Für die Injektion einer Halsvene benötigt das Forschungspersonal eine ausreichende Ausbildung, um die Vene zu lokalisieren und mögliche Komplikationen zu begrenzen. Darüber hinaus müssen sowohl Venenhöhlen- als auch Jugularveneninjektionen unter Narkose durchgeführt werden, was die Komplexität noch erhöht. Daher ist es verlockend, neue Wege für die Transplantation zu erkunden, um die Etablierung von AML-Mausmodellen zu erleichtern.
Die intraperitoneale (i.p.) Injektion wird häufig zur Verabreichung von Medikamenten, Farbstoffen und Anästhetika verwendet 11,12,13,14,15; Es wurde auch verwendet, um hämatopoetische Zellen für die ektopische Hämatopoeseeinzuführen 16 und aus dem Knochenmark stammende mesenchymale Stammzellen in verschiedene Mausmodelle zu transplantieren 17,18,19,20,21. Es wurde jedoch nur selten zur Feststellung hämatopoetischer Malignome bei Mäusen eingesetzt, insbesondere zur Untersuchung des Fortschreitens der AML-Erkrankung.
Die vorliegende Arbeit beschreibt die Machbarkeit der i.p. Injektion bei der Generierung von AML-Mausmodellen und vergleicht die Transplantationseffizienz von liniennegativen (Lin-) und Lin-Sca-1+c-Kit+ (LSK) Populationen als Spenderzellen. Diese Ergebnisse bieten eine einfache und effiziente Möglichkeit, experimentelle Modelle für AML und verwandte myeloische Leukämien zu erstellen. Eine solche Methode hat das Potenzial, unser Verständnis der Krankheitsmechanismen zu verbessern und ein relativ einfaches Modell für die Erprobung experimenteller Therapien zu liefern.
Protokoll
Alle Experimente wurden vom Institutional Animal Care and Use Committee der Pennsylvania State University vorab genehmigt.
1. Herstellung von Puffern und Reagenzien
- Bereiten Sie Ampicillin-supplementierte (AP) LB-Agarplatten (sterile 10-cm-Platten) vor. Lösen Sie dazu 10 g LB-Brühe mit Agar in 400 ml destilliertem Wasser auf, rühren Sie um und bringen Sie das Volumen auf 500 ml. Sterilisieren Sie die Lösung durch Autoklavieren, lassen Sie die Lösung abkühlen, geben Sie 0,5 ml Ampicillin (Vorrat: 150 mg/ml) in die Lösung und schütteln Sie sie, um sie zu mischen. Geben Sie sofort 18 ml der Lösung auf eine sterile 10-cm-Platte in der Nähe einer Alkohollampe, lassen Sie sie bei Raumtemperatur erstarren und lagern Sie die Platten bis zur weiteren Verwendung kopfüber bei 4 °C.
- Bereiten Sie LB-Medien vor, indem Sie 10 g LB ohne Agar in 500 ml destilliertem Wasser auflösen. Sterilisieren Sie die Lösung durch Autoklavieren, lassen Sie die Lösung abkühlen, geben Sie 0,5 ml Ampicillin (Vorrat: 150 mg/ml) in die Lösung und schütteln Sie sie, um sie zu mischen.
- Bereiten Sie den Flusspuffer vor, indem Sie 5 ml Penicillin/Streptomycin und 10 ml hitzeinaktiviertes fötales Kälberserum (hiFBS) in 485 ml 1x Dulbeccos phosphatgepufferte Kochsalzlösung (DPBS) geben.
Anmerkungen: Um FBS durch Erhitzen zu inaktivieren, legen Sie aufgetaute FBS-Flaschen in ein 56 °C warmes Wasserbad. Achten Sie darauf, dass die Flaschen nicht umkippen oder anderweitig in das Wasserbad getaucht werden. Die Temperatur ist entscheidend für den vollständigen Abbau; Um dies zu gewährleisten, warten Sie, bis sich die Temperatur bei 56 °C stabilisiert hat, nachdem Sie die Flaschen ins Wasserbad gestellt haben. Schwenken Sie die Flaschen alle 10 Minuten dreimal vorsichtig. Lassen Sie das Serum nicht länger als 30 Minuten inkubieren. - Bereiten Sie Erhaltungsmedien vor, indem Sie 50 ml hiFBS, 5 ml L-Glutamin und 5 ml Penicillin/Streptomycin in 440 ml Dulbeccos modifiziertes Adlermedium (DMEM) geben. Bereiten Sie Transfektionsmedien vor, indem Sie 50 ml hiFBS und 5 ml L-Glutamin in 445 ml DMEM-Medien geben.
- Bereiten Sie Lysepuffer für rote Blutkörperchen (RBC) vor, indem Sie 4,145 g NH4Cl, 0,504 g NaHCO3 und 16,81 mg Ethylendiamintetraessigsäure (EDTA) in 500 ml destilliertes Wasser geben. Bereiten Sie unvollständiges modifiziertes Dulbecco-Medium (IMDM) von Iscove vor, indem Sie 75 ml hiFBS, 5 g Rinderserumalbumin (BSA), 0,5 ml 10 mg/ml Insulin, 2,5 ml 4 mg/ml Holotransferrin, 3,5 μl β-Mercaptoethanol, 5 ml L-Glutamin und 0,5 ml Ciprofloxacin zu 416,5 ml IMDM-Medium hinzufügen.
- Bereiten Sie 10 ml 2x IMDM-Medien vor, in denen die Konzentration der Zytokine doppelt so hoch ist wie in 1x IMDM-Medien, indem Sie 10 μl 50 ng/μl mr-SCF, 20 μl 25 ng/μl mr-Flt3L, 20 μl 10 ng/μl mr-IL-6, 20 μl 10 ng/μl mr-IL-3, 10 μl 10 mg/ml Insulin hinzufügen. und 50 μl 4 mg/ml Holotransferrin in 9,87 ml unvollständiges IMDM-Medium.
Anmerkungen: Stellen Sie sicher, dass Durchflusspuffer, Erythrozyten-Lysepuffer, Wartungsmedien, Transfektionsmedien und unvollständige IMDM-Medien vor der Verwendung filtersterilisiert werden.
2. Plasmid-Transformation
- Tauen Sie 20 μl α-Select-kompetente Zellen auf Eis auf. Geben Sie 1 μL (~2 ng) MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 Plasmid22 zu den aufgetauten kompetenten Zellen und mischen Sie sie vorsichtig durch Klopfen auf das Röhrchen. Inkubieren Sie die Reaktion 30 Minuten lang auf Eis.
- Hitzeschock der Mischung durch Inkubation für 40 s in einem 42 °C heißen Heizblock. Legen Sie den Schlauch sofort 2 Minuten lang auf Eis.
- 1 ml LB-Medium (ohne Ampicillin) in das Röhrchen geben und bei 37 °C und 200 U/min 1 h schütteln.
- Zentrifugieren Sie das Röhrchen bei Raumtemperatur bei 500 x g für 4 min und verwerfen Sie 0,9 ml Überstand. Resuspendieren Sie den Niederschlag in den verbleibenden 0,1 ml LB-Medien.
- Verteilen Sie die transformierten kompetenten Zellen auf vorgewärmten (37 °C) AP LB-Agarplatten. Die Platte kopfüber bei 37 °C für 12-16 h inkubieren.
- Wählen Sie eine einzelne Kolonie aus und geben Sie die transformierten Zellen über Nacht bei 37 °C und 200 U/min in 10 ml AP LB-Medium ein.
- Geben Sie 5 ml verbrauchte transformierte kompetente Zellen zu 500 ml AP LB-Medien in einen Kolben und inkubieren Sie den Kolben über Nacht bei 37 °C und 200 U/min.
- Extrahieren Sie das Plasmid mit einem Plasmid-Extraktionskit gemäß den Anweisungen des Herstellers und resuspendieren Sie es in 0,5 ml autoklaviertem Reinstwasser. Quantifizieren Sie das Plasmid mit einem Spektralphotometer.
3. Transfektion von Phoenix Ecotropic (pECO) Zellen
- Kultivieren Sie 2 x 106 pECO-Zellen/Platte in Erhaltungsmedien in 10-cm-Platten in einem befeuchteten 5% CO2 -Inkubator bei 37 °C. Stellen Sie sicher, dass die pECO-Zellen in der exponentiellen Wachstumsphase gehalten werden und sich vor der Passage aktiv teilen.
- Wenn die Zellen zu 80 % konfluieren, waschen Sie die Platten zweimal mit 5 ml DPBS, geben Sie 1 ml Trypsin auf die Platte und inkubieren Sie sie 2 Minuten lang in einem befeuchteten 5 % CO2 -Inkubator bei 37 °C. Die Zellen werden mit 5 ml Pflegemedium in einem sterilen 15-ml-Röhrchen entnommen und 3 Minuten lang bei 4 °C und 400 x g zentrifugiert. Resuspendieren Sie das Zellpellet in 5 ml Erhaltungsmedium.
- Mischen Sie 10 μl Zellsuspension und 10 μl Trypanblau und laden Sie 10 μl auf ein Hämozytometer, um die Zellen zu zählen.
Gesamtzahl der Zellen/ml = (Gesamtzahl der gezählten Zellen x Verdünnungsfaktor x 104 Zellen/ml)/ Anzahl der gezählten Quadrate)
2 x 10 6 Zellen/Schale mit 5 ml Erhaltungsmedium für die Transfektion in 6-cm-Schalen aussäen unddie Zellen in einem befeuchteten 5%igen CO2 -Inkubator bei 37 °C kultivieren. - Ersetzen Sie die Erhaltungsmedien durch 5 ml Transfektionsmedien, wenn die Zellen nach 18 Stunden Kultur zu 50 % bis 60 % konfluent sind.
- Bewahren Sie das Transfektionsreagenz vor der Transfektion mindestens 30 Minuten bei Raumtemperatur auf.
- 5,5 μg MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 Plasmid22 auf 0,5 ml DMEM-Medium in ein steriles 1,5-ml-Röhrchen geben. Mischen Sie es vorsichtig, indem Sie auf das Röhrchen klopfen, und lassen Sie es 10 Minuten ruhen.
- Geben Sie 14,6 μl (3x die Plasmidmenge; v/w) Transfektionsreagenz in das Röhrchen und klopfen Sie dreimal alle 10 Minuten vorsichtig auf das Röhrchen.
- Geben Sie die Mischung gleichmäßig tropfenweise auf alle Bereiche der Schalen mit den pECO-Zellen in Transfektionsmedien. Bewegen Sie das Geschirr 10 Mal vorsichtig vorwärts und rückwärts und 10 Mal seitwärts. Die Schalen werden in einem befeuchteten 5%igen CO2 -Inkubator bei 37 °C für 48 h inkubiert.
- Messung der Transfektionseffizienz mittels Fluoreszenzmikroskopie und Durchflusszytometrie für grün fluoreszierendes Protein (GFP) wie in22 beschrieben. Die Zellen werden zunächst auf FSC-A/FSC-H und FSC-A und SSC-A angesteuert, um Singuletts zu erhalten. Die GFP+ -Population wird im FL1-Diagramm durch Vergleich mit nicht-transfizierten Zellen kontrolliert.
- Sammeln und filtrieren Sie die Überstände durch einen 0,45-μm-Spritzenvorsatzfilter in ein steriles 50-ml-Röhrchen. Verwenden Sie die Überstände sofort zur Transduktion oder gefrieren Sie sie in flüssigem Stickstoff und lagern Sie sie bis zur weiteren Verwendung bei -80 °C.
HINWEIS: pECO-Zellen müssen richtig gemischt und gleichmäßig in Schalen ausgesät werden. Lassen Sie die Zellen sich ausbreiten, indem Sie die Schalen während der Aussaat 10 Mal vorwärts und rückwärts und 10 Mal seitwärts bewegen. Die Anzahl der zu säenden Zellen kann je nach Zählabweichungen variieren. Um die optimale Samenzellzahl zu finden, die nach 18 Stunden Kultur eine Konfluenz von 50%-60% erreichen kann, ist die Aussaat von Zellen mit seriellen Verdünnungen hilfreich.
4. Lentivirale Transduktion
- 8-10 Wochen alte CD45.1 weibliche C57BL6/J-Mäuse (zwei bis drei Spendermäuse pro Empfängermaus) in einer CO2 -Kammer einschläfern.
- Sterilisieren Sie den ganzen Körper der Mäuse mit 70% Ethanol. Legen Sie die Mäuse auf ein steriles OP-Pad auf einer Styroporplatte und stecken Sie die Beine durch die Mauspfotenballen.
- Schneiden Sie die Haut oberhalb der Bauchhöhle an der Mittellinie auf und erweitern Sie den Unterhautraum in Richtung der Hinterbeine mit einer sterilen Schere mit scharfem Ende.
- Verlängern Sie den Schnitt von der Bauchmittellinie bis zu den Knöcheln. Erweitern Sie den Unterhautraum unter den Hinterbeinen mit den Klingen einer sterilen Schere mit scharfem Ende.
- Durchtrennen Sie die Achillessehne mit einer sterilen Schere mit scharfem Ende. Halten Sie die Sehne mit einer Pinzette mit Zähnen fest und schneiden Sie das andere Ende, das am Oberschenkelknochen befestigt ist, ab, um den Gastrocnemius-Muskel zu entfernen.
- Durchtrennen Sie die am Knie befestigte Quadrizepssehne mit einer sterilen Schere mit scharfem Ende. Halten Sie die Sehne mit einer Pinzette mit Zähnen fest und schneiden Sie die Muskelköpfe durch, die am Oberschenkelknochen befestigt sind, um den Gastrocnemius-Muskel zu entfernen.
- Schneiden Sie die anderen Muskeln, die den Oberschenkelknochen umgeben, am Ende, das am Schienbein befestigt ist, mit einer sterilen Schere mit scharfem Ende durch.
- Schneiden Sie den Knöchel mit einer sterilen Schere mit scharfem Ende ab und achten Sie darauf, dass das Schienbein intakt bleibt. Halten Sie das distale Ende des Oberschenkelknochens mit einer Pinzette mit Zähnen fest und schneiden Sie das Hüftgelenk mit einer sterilen Schere durch, wobei Sie darauf achten müssen, dass der Hüftkopf intakt bleibt.
- Übertragen Sie die Tibias und Femurs in einen Durchflusspuffer in einem sterilen 15-ml-Röhrchen.
- Trenne das Schien- und Oberschenkelsystem, indem du das Knie von Hand brichst. Entfernen Sie die Patella, den Knorpel und die Femurkondylen, um das Tibiaplateau und den distalen Femur von Hand freizulegen. Entfernen Sie die Muskeln mit einer sterilen Gaze und tränken Sie die Knochen dann in Flusspuffer.
- Durchtrennen Sie den Oberschenkelhals und spülen Sie die Knochenmarkzellen mit Flusspuffer von beiden Enden des Oberschenkelknochens mit einer 10-ml-Spritze mit einer 23-G-Nadel.
- Schneiden Sie den Knöchel der Tibia und spülen Sie die Knochenmarkzellen mit Flusspuffer von beiden Enden der Tibia mit einer 10-ml-Spritze mit einer 23-G-Nadel.
- Dispergieren Sie die Zellen, indem Sie mit einer 10-ml-Spritze mit einer 18-g-Nadel auf und ab pipettieren. Die Einzelzellsuspension wird bei 4 °C und 400 x g für 3 min zentrifugiert.
- Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 5 ml Erythrozyten-Lysepuffer, um die Erythrozyten 3 Minuten lang zu lysieren.
- Fügen Sie 5 ml Flusspuffer hinzu, um die Lyse zu stoppen, und zentrifugieren Sie die Zellsuspension bei 4 °C und 400 x g für 3 Minuten.
- Setzen Sie ein 70-μm-Zellsieb auf ein steriles 50-ml-Röhrchen. Suspendieren Sie das Pellet mit 5 ml Durchflusspuffer, mischen Sie es und passieren Sie es durch das Zellsieb, um die Zellen zu sammeln.
- Stellen Sie die Zellkonzentration mit Durchflusspuffer auf 1 x 108/ml in Polypropylenröhrchen mit rundem Boden ein.
- Wählen Sie Lin-Zellen mit einem hämatopoetischen Mauszell-Isolationskit gemäß den Anweisungen des Herstellers aus.
- Lassen Sie drei Röhrchen mit 1 x 104 Zellen in 100 μl Puffer für eine ungefärbte Kontrolle und zwei einzelne Antikörper-gefärbte Kontrollen für APC-konjugiertes Anti-Maus-CD117 (c-Kit) und PE-Cy7-konjugiertes Anti-Maus-Ly-6A/E (Sca-1) beiseite. Verwenden Sie 1 μl Antikörper (ab 0,2 mg/ml Vorrat) für jede der mit Einzelantikörpern gefärbten Kontrollen.
- Die restlichen Zellen werden in einem Röhrchen mit beiden Antikörpern (je 4 μl aus 0,2 mg/ml-Beständen) in 400 μl gefärbt. Inkubieren Sie die Röhrchen auf Eis im Dunkeln für 0,5-1 h.
- Nach dem Färben waschen Sie die Zellen durch Zugabe von 1 ml Durchflusspuffer und zentrifugieren Sie sie 3 Minuten lang bei 4 °C und 400 x g .
- Resuspendieren Sie die Zellen für die ungefärbte Kontrolle und die einzelnen Antikörper-gefärbten Kontrollen in 100 μl Flusspuffer. Resuspendieren Sie die mit doppelten Antikörpern gefärbten Zellen in 1 ml Flusspuffer zur Sortierung.
- Sortierung hämatopoetischer Stammzellen (HSZ) als LSK-Population unter Verwendung eines Zellsortierers wie in23,24 beschrieben.
- Während des Färbens eine sterile 6-cm-Schale wie folgt mit Retronektin bestreichen: Bereiten Sie 100 μg/ml Retronektin in PBS vor und geben Sie 0,9 ml PBS und 0,1 ml Retronektin in eine 6-cm-Schale. Die Schüssel 2 Stunden lang mit einer sterilen Haube bei Raumtemperatur bestreichen. Entfernen Sie dann das Retronektin und verschließen Sie die Schale 30 Minuten lang mit 0,5 ml filtriertem 2%igem BSA (in PBS). Waschen Sie die Schale zweimal mit 5 ml PBS und die Schale ist bereit für die Transduktion.
- Die sortierten HSZ oder unsortierten Lin-Zellen werden bei 4 °C und 400 x g für 3 min zentrifugiert und in 3 mL 2x (Zytokinen) IMDM-Medien und 3 mL viralem Überstand (erzeugt aus Schritt 3.10) in einer mit Retronektin beschichteten Schale resuspendiert. Inkubieren Sie die Schale in einem befeuchteten 5% CO2 -Inkubator bei 37 °C für 6 oder 24 h.
ANMERKUNG: In der vorliegenden Studie wurden die Lin-Zellen je nach Versuchsaufbau entweder sortiert oder unsortiert.
5. Serielle Transplantation (Abbildung 1)
HINWEIS: Die primären Empfängermäuse waren 8-10 Wochen alte männliche C57BL6/J-Mäuse (CD45.2). Sie erhielten Wasser ad libitum , das Antibiotika enthielt, um opportunistische Verdauungsinfektionen zu verhindern, und zwar von 3 Tagen vor der Transplantation bis 7 Tage nach der Transplantation. Primäre Empfängermäuse wurden 3 h vor der Transplantation subletal bestrahlt (4,75 Gy)25. Isofluran wurde bei Mäusen mit intraperitonealer Injektion nicht angewendet.
- Nach einer Transduktion von 6 oder 24 h werden die Zellen durch Zentrifugation bei Raumtemperatur und 400 x g für 3 min geerntet. Verwenden Sie Trypsin, um bei Bedarf die Zellen zu sammeln, die am Boden der Schale befestigt sind. Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in vorgewärmtem PBS. Bestimmen Sie das PBS-Volumen in Abhängigkeit von der Anzahl der Empfänger (d. h. 0,1 ml/Maus bzw. 0,5 ml/Maus für Empfänger mit retroorbitalen bzw. intraperitonealen Injektionen).
- Platzieren Sie die subletal bestrahlten Empfängermäuse in einer Isoflurankammer (die Durchflussrate des Sauerstoffs wird auf 1,0 l/min und der Verdampfer von Isofluran auf 5 % eingestellt). Tragen Sie feuchte Salbe auf die Augen auf, um Trockenheit unter Narkose zu vermeiden. Die Mäuse sind bereit für weitere Eingriffe, wenn der Herzschlag auf 60 Schläge pro Minute sinkt.
- Injektion von Zellen in primäre Empfängermäuse retroorbital (0,1 ml/Maus)7 oder intraperitoneal (0,5 ml/Maus)26 mit einer 27 G1/2-Nadel. Beobachte die Mäuse kontinuierlich, bis sie ein ausreichendes Bewusstsein erlangt haben, um das Brustbein zu halten. Überwachen Sie die Mäuse täglich, um ihr Wohlbefinden nach der Transplantation zu gewährleisten.
- Nach 1 Monat wird wöchentlich Blut durch retroorbitale Blutung entnommen, um die Leukozytose zu überwachen, indem das vollständige Blutbild (CBC) auf einem Hemavet wie unten beschrieben ausgewertet wird.
- Platzieren Sie die Maus nach der Anästhesie mit Isofluran seitlich (die Durchflussrate des Sauerstoffs wird auf 1,0 l/min und der Verdampfer der Isofluranz auf 5% eingestellt). Die Mäuse sind bereit für weitere Eingriffe, wenn der Herzschlag auf 60 Schläge pro Minute sinkt.
- Stützen Sie das Auge mit Daumen und Zeigefinger ab. Penetrieren Sie den venösen Sinusplexus mit einem asterilen Hämacrit-Kapillarrohr durch den inneren Canthus.
- Sammeln Sie 20-25 μl Blut in einem EDTA-Blutentnahmeröhrchen und schließen Sie die Augenlider, um die Blutung zu stoppen. Tragen Sie einen Tropfen Gentamicinsulfat-Augenlösung auf das Auge auf.
- Am Endpunkt, wenn die weißen Blutkörperchen (WBCs) 4 x 10 4 Zellen/μl erreichen, wird die Maus in einer CO2 -Kammer eingeschläfert und die Knochenmarkzellen isoliert, indem die Oberschenkelknochen und Tibien mit Flusspuffer gespült werden, gefolgt von einer Erythrozytenlyse, wie in Schritt4 erwähnt.
- Am Endpunkt werden die Splenozyten wie unten erwähnt entnommen.
- Euthanasieren Sie die Maus in einer CO2 - Kammer. Legen Sie die Mäuse auf ein steriles OP-Pad auf einer Styroporplatte und stecken Sie die Beine durch die Mauspfotenballen. Sterilisieren Sie den ganzen Körper der Mäuse mit 70% Ethanol.
- Schneiden Sie die Haut und den Muskel an der Mittellinie auf, um die Bauchhöhle mit einer sterilen Schere freizulegen. Isolieren Sie die Milz mit einer sterilen Schere und legen Sie sie in einen Durchflusspuffer in ein steriles 15-ml-Röhrchen.
- Die Milz wird durch ein steriles 70-μm-Sieb in einer 6-cm-Schale mit 3 ml Durchflusspuffer gesiebt. Übertragen Sie die Zellen aus der Schale in ein steriles 15-ml-Röhrchen und zentrifugieren Sie die Einzelzellsuspension bei 4 °C und 400 x g für 3 Minuten.
- Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in 5 ml Erythrozyten-Lysepuffer, um die Erythrozyten 3 Minuten lang zu lysieren. Fügen Sie 5 ml Flusspuffer hinzu, um die Lyse zu stoppen, und zentrifugieren Sie die Zellsuspension bei 4 °C und 400 x g für 3 Minuten.
- Setzen Sie ein 70-μm-Zellsieb auf ein steriles 50-ml-Röhrchen. Suspendieren Sie das Pellet mit 5 ml Durchflusspuffer, mischen Sie es und passieren Sie es durch das Zellsieb, um Zellen zu sammeln.
- Identifizierung primärer (1°) AML-Zellen durch Färbung der Splenozyten und Knochenmarkszellen mit FITC-konjugiertem Anti-Maus-CD45.1-Antikörper und Nachweis auf einem Durchflusszytometer. Die Zellen werden zunächst auf FSC-A/FSC-H und FSC-A und SSC-A angesteuert, um Singuletts zu erhalten. Die CD45.1+-Population wird auf dem FL1-Plot durch Vergleich mit ungefärbten Zellen fixiert.
- Für die sekundäre (2°) Transplantation werden CD45.1 AML-Milzzellen von 1°-r.o.-Empfängern in PBS (0,1 ml/Maus) resuspendiert und retroorbital in männliche CD45.2-C57BL6/J-Mäuse injiziert. Parallel dazu werden AML-Milzzellen von 1°-i.p.-Empfängern in PBS (0,5 ml/Maus) resuspendiert und intraperitoneal in 8-12 Wochen alte männliche Mäuse mit rotem Fluoreszenzprotein (RFP) injiziert, die Ai14TdTomato exprimieren27.
- Für die tertiäre (3°) Transplantation werden AML-Zellen, die aus dem Knochenmark oder der Peritonealhöhle von 2°-i.p.-Empfängern isoliert wurden, resuspendiert und intraperitoneal in Ai14TdTomato (RFP+) bzw. CD45.2-Mäuse injiziert. Resuspendieren Sie AML-Zellen, die aus der Peritonealhöhle von 2°-r.o.-Empfängern isoliert wurden, und transplantieren Sie sie durch r.o.-Injektion in Ai14TdTomato (RFP+)-Mäuse.
HINWEIS: Bei der 2°-Transplantation haben wir das Fortschreiten der Erkrankung bei 2°-Empfängern identifiziert, indem wir das Blutbild im peripheren Blut überwacht haben. Um die Etablierung der AML weiter zu bestätigen, entnahmen wir peripheres Vollblut durch Herzpunktion sowie Knochenmark, Milz und Leber. Des Weiteren führten wir eine i.p. Lavage durch, um i.p. Zellen zu gewinnen. Einzelzellige Suspensionen wurden wie oben beschrieben aus Knochenmark, Milz und i.p. Lavage gewonnen. Zellen von diesen Stellen wurden nach der Erythrozytenlyse auf einem Durchflusszytometer analysiert. AML-Zellen wurden als RFP-negative (RFP-) Zellen erkannt. Für die 3°-Transplantation wurden Blut-, Knochenmark-, Milz-, Leber- und IP-Zellen am Endpunkt entnommen. RFP- oder CD45.1+-Zellen wurden als AML-Zellen identifiziert und durchflusszytometrisch untersucht. Es wurde kein Bestrahlungs- oder antibiotisches Wasser an 2°- und 3°-Empfängermäuse verabreicht.
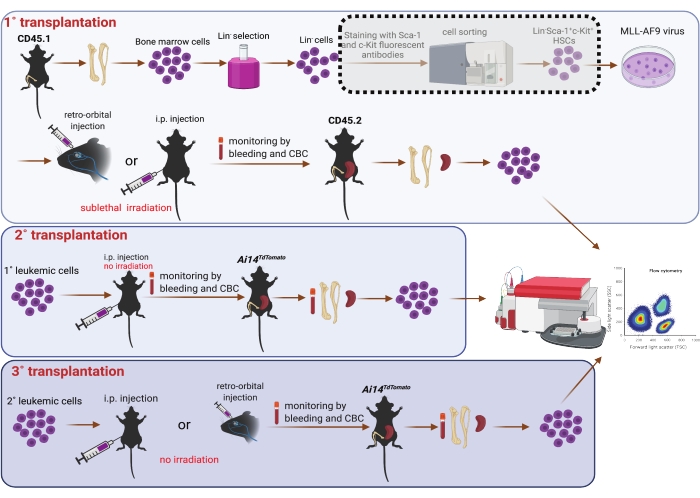
Abbildung 1: Schematische Darstellung der viralen MLL-AF9-Transduktion in Knochenmark-HSZ und serieller Transplantation (1°, 2° und 3°). Die Sortierung der doppelt positiven Population von Sca-1 und c-Kit mit Hilfe eines Zellsortierers, der in der gepunkteten Schattenbox angezeigt wird, wird als optional betrachtet, sofern die Ressourcen dies zulassen. Die Figur wurde mit BioRender (https://biorender.com/) erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Intraperitoneale Lavage
- Injizieren Sie zweimal 5 ml unvollständiges IMDM-Medium in die Peritonealhöhle, um die Zellen in einem sterilen 15-ml-Röhrchen zu sammeln. Zentrifugieren Sie die Zellsuspension bei Raumtemperatur und 400 x g für 3 min. Transplantation von AML-Zellen (4 x 10,5 Zellen/Maus) aus der Peritonealhöhle von 2°-Empfängern mittels i.p. Injektion in 3°-CD45.2-Empfängermäuse (n = 3).
7. Histologische Analyse 28
- Isolieren Sie Milz, Leber und Oberschenkelknochen von Mäusen bei der Euthanasie. Fixieren Sie sie in 5 ml 10%igem (v/v) gepuffertem Formalin. Proben von Milz und Leber von gesunden Gegenstücken zum Vergleich.
- Betten Sie fixierte Gewebe in Paraffin ein und schneiden Sie sie in Abschnitte. Färben Sie die Schnitte mit Hämatoxylin- und Eosinfarbstoffen (H&E).
- Nehmen Sie die Bilder unter einem Mikroskop mit 20-facher Vergrößerung auf, das mit einer kompatiblen Software für die histologische Analyse installiert ist.
8. Durchführung einer semiquantitativen PCR (qPCR)
- Bereiten Sie RNAs im RNA-Reagenz gemäß den Anweisungen des Herstellers vor.
- Verwenden Sie 0,5-1,0 μg RNAs, um cDNA mit einem cDNA-Reverse-Transkriptionskit gemäß den Anweisungen des Herstellers zu synthetisieren.
- Verwenden Sie cDNA, um eine qPCR mit einem qPCR-Kit durchzuführen, und führen Sie die Proben in einem qPCR-System durch. Verwenden Sie die folgenden vorvalidierten TaqMan-Sonden: KMT2A (MLL; Ref Seq: NM_001197104(2), IDT)29 und 18S ribosomale RNA (Hs99999901_s1).
- Laden Sie die KMT2A - und 18S-Amplikons auf ein 2%iges Agarosegel, um die Expression zu visualisieren. Erfassen Sie Bilder in einem Imager, der mit dem kompatiblen Softwareprogramm installiert ist.
9. Datenverarbeitung
- Analysieren Sie die Ergebnisse mit einer statistischen Analysesoftware und präsentieren Sie die Ergebnisse als Mittelwert ± SEM. Generieren Sie Zahlen mit einem kommerziellen Illustrator-Tool.
Ergebnisse
Vergleich der Transplantationseffizienz von murinen AML-Zellen unter Verwendung von r.o. und i.p. Transplantationswegen
Zuvor wurde die Etablierung von 1° AML in Empfängermäusen berichtet, die retroorbital mit MLL-AF9-transduzierten LSK-Zellen transplantiert wurden, und die Transplantationsfähigkeit von 1° AML-Zellen wurde durch serielle Transplantation nachgewiesen30. Die vorliegende Studie ist die erste, die die Möglichkeit der Verwendung von Knochenmark-Linz...
Diskussion
Diese oben beschriebenen Studien liefern unterstützende Hinweise darauf, dass die Transplantation von Lin- Zellen bei der Erzeugung von 1° muriner AML mit LSK-Zellen vergleichbar ist. Darüber hinaus zeigen die aktuellen Daten auch, dass die i.p. Injektion im Vergleich zur intravenösen (oder r.o.) Injektion eine effiziente und bequeme Methode zur Etablierung einer murinen AML ist.
Zusätzlich zu LSK-Zellen wurde berichtet, dass andere Populationen wie der Granulozyten-Monozyten-V...
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Die Autoren danken der Core Facility für Durchflusszytometrie des Huck-Instituts und der Core Facility für Histopathologie des Animal Diagnostic Laboratory, Department of Veterinary and Biomedical Sciences, The Pennsylvania State University, für die rechtzeitige technische Unterstützung. Diese Arbeit wurde durch Zuschüsse des American Institute for Cancer Research (KSP), des Penn State College of Agricultural Sciences, des Penn State Cancer Institute, des USDA-NIFA-Projekts 4771, der Beitrittsnummer 00000005 zu K.S.P. und R.F.P. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| a-Select competent cells | Bioline | BIO-85027 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | Cat# A-9434 | |
| Ampicillin | Sigma Aldrich | Cat# A0797 | |
| Bovine Serum Albumin (BSA), Fraction V—Low-Endotoxin Grade | Gemini bio-products | Cat# 700-102P | |
| Ciprofloxacin HCl | GoldBio.com | Cat# C-861-100 | |
| DMEM, high glucose, no glutamine | Gibco | Cat# 11960-044 | |
| Dulbecco’s Phosphate-Buffered Saline (PBS) | Corning | Cat# 21-031-CV | |
| EDTA, Disodium Salt (EDTA-2Na), Dihydrate, Molecular Biology Grade | Calbiochem | Cat# 324503 | |
| Fetal Bovine Serum - Premium Select | Atlanta Biologicals | Cat# S11550 | |
| Holo-transferrin, bovine | Sigma Aldrich | Cat# T1283 | |
| Insulin solution human | Sigma | Cat# I-9278 | |
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | Cat# 12440-053 | |
| L-glutamine 200 mM (100×) solution | HyClone, Gelifesciences | Cat# SH30034.01 | |
| LB broth, Lennox | NEOGEN | Cat #: 7290A | |
| LB Broth with agar (Miller) | Sigma Aldrich | Cat# L-3147 | |
| Mouse anti-mouse CD45.1 (FITC) | Miltenyi Biotec | Cat# 130-124-211 | |
| Mouse Interleukin-3 (IL-3) | Gemini bio-products | Cat# 300-324P | |
| Mouse Interleukin-6 (IL-6) | Gemini bio-products | Cat# 300-327P | |
| Mouse Stem Cell Factor (SCF) | Gemini bio-products | Cat# 300-348P | |
| Penicillin-Streptomycin Solution, 100x | Corning | Cat# 30-002-CI | |
| Phenix-Eco (pECO) cells | ATCC | CRL-3214 | |
| Potassium Bicarbonate (KHCO3), Granular | JT. Baker | Cat# 2940-01 | |
| Rat anti-mouse CD117 (c-kit) (APC) | BioLegend | Cat # 105812 | |
| Rat anti-mouse Ly-6A/E (Sca-1) (PE-Cy7) | BD Pharmingen | Cat# 558162 | |
| Recombinant Murine Flt3-Ligand | Pepro Tech, INC. | Cat# 250-31L | |
| RetroNectin Recombinant Human Fibronectin Fragment | TaKaRa | Cat# T100A | |
| TransIT-293 Reagent | MirusBio | Cat# MIR 2705 | |
| TRI Reagent | Sigma Aldrich | Cat# T9424 | |
| Trypan Blue Solution, 0.4% | Gibco | Cat # 15250061 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | Cat# 25200-056 | |
| β-Mercaptoethanol (BME) | Sigma Aldrich | Cat# M3148 | |
| Commercial Assays | |||
| EasySep Mouse Hematopoietic Progenitor Cell Isolation Kit | StemCell technologies | Cat# 19856A | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher | Cat# 4368813 | |
| PerfeCTa qPCR SuperMix | Quanta Bio | Cat# 95051-500 | |
| Plasmid Maxi Kit (25) | Qiagen | Cat#:12163 | |
| Animals | |||
| Ai14TdTomato mice | Jackson Laboratory | Strain # 007914 | |
| CD45.1 C57BL6/J mice | Jackson Laboratory | Strain # 002014 | |
| CD45.2 C57BL6/J mice | Jackson Laboratory | Strain # 000664 | |
| Instruments and Softwares | |||
| Adobe illustrator | Version 25.2.3 | ||
| BD accuri C6 flow cytometer | BD Biosciences | ||
| FlowJo 10.8.0 | BD | ||
| GeneSys software program | Version 1.5.7.0 | ||
| GraphPad Prism version 6 | GraphPad | ||
| Hemavet 950FS | Drew Scientific | ||
| 7300 Real time PCR system | Applied Biosystems | ||
| Syngene G:BOX Chemi XR5 Chemiluminescence Fluorescence Imaging | G:Box Chemi |
Referenzen
- Dohner, H., Weisdorf, D. J., Bloomfield, C. D. Acute myeloid leukemia. The New England Journal of Medicine. 373 (12), 1136-1152 (2015).
- Fortier, J. M., Graubert, T. A. Murine models of human acute myeloid leukemia. Cancer Treatment and Research. 145, 183-196 (2010).
- Ernst, P., et al. Definitive hematopoiesis requires the mixed-lineage leukemia gene. Developmental Cell. 6 (3), 437-443 (2004).
- Fisher, J. N., Kalleda, N., Stavropoulou, V., Schwaller, J. The Impact of the cellular origin in acute myeloid leukemia: learning from mouse models. Hemasphere. 3 (1), 152 (2019).
- Zhan, Y., Zhao, Y. Hematopoietic stem cell transplant in mice by intra-femoral injection. Methods in Molecular Biology. 430, 161-169 (2008).
- Price, J. E., Barth, R. F., Johnson, C. W., Staubus, A. E. Injection of cells and monoclonal antibodies into mice: comparison of tail vein and retroorbital routes. Proceedings of the Society for Experimental Biology. 177 (2), 347-353 (1984).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animal. 40 (5), 155-160 (2011).
- Suckow, M. A., Danneman, P., Brayton, C. . The Laboratory Mouse. , (2001).
- Barr, J. E., Holmes, D. B., Ryan, L. J., Sharpless, S. K. Techniques for the chronic cannulation of the jugular vein in mice. Pharmacology, Biochemistry, and Behavior. 11 (1), 115-118 (1979).
- Kang, Y. Analysis of cancer stem cell metastasis in xenograft animal models. Methods in Molecular Biology. 568, 7-19 (2009).
- Nungestee, W., Wolf, A., Jourdonais, L. Effect of gastric mucin on virulence of bacteria in intraperitoneal injections in the mouse. Proceedings of the Society for Experimental Biology and Medicine. 30 (2), 120-121 (1932).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and part I: anesthetic considerations in preclinical research. ILAR journal. 53 (1), 55-69 (2012).
- Leong, S. -. K., Ling, E. -. A. Labelling neurons with fluorescent dyes administered via intravenous, subcutaneous or intraperitoneal route. Journal of Neuroscience Methods. 32 (1), 15-23 (1990).
- Ma, P., et al. Intraperitoneal injection of magnetic Fe3O4-nanoparticle induces hepatic and renal tissue injury via oxidative stress in mice. International Journal of Nanomedicine. 7, 4809-4918 (2012).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Muench, M. O., Chen, J. C., Beyer, A. I., Fomin, M. E. Cellular therapies supplement: the peritoneum as an ectopic site of hematopoiesis following in utero transplantation. Transfusion. 51, 106-117 (2011).
- Zhao, W., et al. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World Journal of Gastroenterology. 18 (10), 1048 (2012).
- Yousefi, F., Ebtekar, M., Soleimani, M., Soudi, S., Hashemi, S. M. Comparison of in vivo immunomodulatory effects of intravenous and intraperitoneal administration of adipose-tissue mesenchymal stem cells in experimental autoimmune encephalomyelitis (EAE). International Immunopharmacol. 17 (3), 608-616 (2013).
- Cheng, K., et al. Transplantation of bone marrow-derived MSCs improves cisplatinum-induced renal injury through paracrine mechanisms. Experimental and Molecular Pathology. 94 (3), 466-473 (2013).
- Castelo-Branco, M., et al. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 7 (3), 33360 (2012).
- Bazhanov, N., et al. Intraperitoneally infused human mesenchymal stem cells form aggregates with mouse immune cells and attach to peritoneal organs. Stem Cell Research & Therapy. 7, 27 (2016).
- Liu, Q., Chen, L., Atkinson, J. M., Claxton, D. F., Wang, H. G. Atg5-dependent autophagy contributes to the development of acute myeloid leukemia in an MLL-AF9-driven mouse model. Cell Death & Disease. 7 (9), 2361 (2016).
- Wognum, A. W., Eaves, A. C., Thomas, T. E. Identification and isolation of hematopoietic stem cells. Archives of Medical Research. 34 (6), 461-475 (2003).
- Randall, T. D., Weissman, I. L. Characterization of a population of cells in the bone marrow that phenotypically mimics hematopoietic stem cells: resting stem cells or mystery population. Stem Cells. 16 (1), 38-48 (1998).
- Gott, K. M., et al. A comparison of Cs-137 gamma rays and 320-kV X-rays in a mouse bone marrow transplantation model. Dose Response. 18 (2), 1559325820916572 (2020).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Applied Microbiology. 17 (2), 250-251 (1969).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Ronan, J. L., Wu, W., Crabtree, G. R. From neural development to cognition: unexpected roles for chromatin. Nature Review Genetics. 14 (5), 347-359 (2013).
- Qian, F., et al. Interleukin-4 treatment reduces leukemia burden in acute myeloid leukemia. FASEB Journal. 36 (5), 22328 (2022).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 442 (7104), 818-822 (2006).
- Chen, W., et al. Malignant transformation initiated by Mll-AF9: gene dosage and critical target cells. Cancer Cell. 13 (5), 432-440 (2008).
- Somervaille, T. C. P., Cleary, M. L. Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell. 10 (4), 257-268 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten