Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Внутрибрюшинная трансплантация при возникновении острого миелоидного лейкоза у мышей
В этой статье
Резюме
Здесь внутрибрюшинная инъекция лейкозных клеток используется для установления и распространения острого миелоидного лейкоза (ОМЛ) у мышей. Этот новый метод эффективен при серийной трансплантации клеток ОМЛ и может служить альтернативой для тех, кто может испытывать трудности и несоответствия при внутривенном введении мышам.
Аннотация
Существует неудовлетворенная потребность в новых методах лечения острого миелоидного лейкоза (ОМЛ) и связанного с ним рецидива, связанного с персистирующими лейкозными стволовыми клетками (LSC). Экспериментальная модель грызунов AML для тестирования терапии, основанной на успешной трансплантации этих клеток с помощью ретроорбитальных инъекций мышам-реципиентам, сопряжена с проблемами. Цель этого исследования состояла в том, чтобы разработать простой, надежный и последовательный метод создания надежной мышиной модели ОМЛ с использованием внутрибрюшинного пути. В настоящем протоколе клетки костного мозга трансдуцировали ретровирусом, экспрессирующим слитый онкопротеин MLL-AF9 человека. Была проверена эффективность отрицательных (Lin-) и Lin-Sca-1+c-Kit+ (LSK) популяций в качестве донорских LSC в развитии первичного ОМЛ, и внутрибрюшинная инъекция была принята в качестве нового метода генерации ОМЛ. Сравнение между внутрибрюшинными и ретроорбитальными инъекциями проводилось при серийных трансплантациях, чтобы сравнить и сопоставить эти два метода. Клетки Lin- и LSK, трансдуцированные вирусом MLL-AF9 человека, хорошо приживались в костном мозге и селезенке реципиентов, что приводило к полномасштабному ОМЛ. Внутрибрюшинная инъекция донорских клеток установила ОМЛ у реципиентов при серийной трансплантации, а инфильтрация клеток ОМЛ была обнаружена в крови, костном мозге, селезенке и печени реципиентов с помощью проточной цитометрии, кПЦР и гистологических анализов. Таким образом, внутрибрюшинная инъекция является эффективным методом индукции ОМЛ с использованием серийной трансплантации донорских лейкозных клеток.
Введение
Острый миелоидный лейкоз (ОМЛ) – это разновидность гематологических злокачественных новообразований различной этиологии с неблагоприятнымпрогнозом1. Генерация моделей животных ОМЛ закладывает основу для понимания его сложных вариаций и патобиологии в попытке открыть новые методы лечения2. Лейкемогенез у мышей включает трансплантацию донорских клеток, экспрессирующих слитые онкопротеины, включая слияния с участием гена лейкемии смешанной линии (MLL) для мощной индукции ОМЛ, чтобы имитировать заболевание у людей3. Сообщалось о различном клеточном происхождении донорских клеток при трансплантации AML4, связанного с геном MLL, при этом очень мало известно о клетках, ответственных за происхождение заболевания.
Было разработано несколько путей трансплантации мышам; вместо внутрибедренной инъекции, которая непосредственно вводит мутантные донорские клетки в костный мозг5, внутривенная инъекция, которая использует венозное синусовое сплетение, хвостовую вену и яремную вену, широко использовалась для создания мышиных моделей AML 6,7,8,9. В случае ретроорбитальной (р.о.) инъекции различные присущие ей недостатки, такие как ограничение объема, высокая техническая требовательность, малая вероятность повторных попыток или ошибок, а также потенциальные повреждения глаз, были основными камнями преткновения при ограниченных или отсутствующих жизнеспособных альтернативах7. Инъекция в хвостовую вену может иметь аналогичные проблемы, помимо местных травм; Чтобы облегчить процедуру, мышей часто нужно разогревать, чтобы расширить их хвостовые вены10. Также трудно определить местонахождение хвостовой вены без дополнительного источника света, особенно у штамма мышей C57BL/6. Для инъекции в яремную вену исследовательский персонал должен пройти достаточную подготовку, чтобы найти вену и ограничить возможные осложнения. Кроме того, инъекции в венозный синус и яремную вену необходимо проводить под наркозом, что добавляет еще один уровень сложности. Таким образом, заманчиво изучить новые пути трансплантации, чтобы облегчить создание мышиных моделей AML.
Внутрибрюшинная (внутривенная) инъекция обычно используется для введения лекарств, красителей и анестетиков 11,12,13,14,15; Он также использовался для введения гемопоэтических клеток для эктопического кроветворения16 и для трансплантации мезенхимальных стволовых клеток, полученных из костного мозга, на различных моделяхмышей 17,18,19,20,21. Тем не менее, он нечасто использовался для установления злокачественных новообразований кроветворения у мышей, особенно для изучения прогрессирования заболевания ОМЛ.
В настоящем исследовании описывается целесообразность внутривенной инъекции в поколении мышиных моделей AML, а также сравнивается эффективность трансплантации отрицательных (Lin-) и Lin-Sca-1+c-Kit+ (LSK) популяций в качестве донорских клеток. Эти результаты обеспечивают простой и эффективный способ создания экспериментальных моделей ОМЛ и связанных с ним миелоидных лейкозов. Такой метод может способствовать дальнейшему пониманию механизмов заболевания, а также обеспечить относительно простую модель для тестирования экспериментальных методов лечения.
протокол
Все эксперименты были предварительно одобрены Институциональным комитетом по уходу за животными и их использованию в Университете штата Пенсильвания.
1. Приготовление буферов и реагентов
- Приготовьте ампициллин с добавлением (AP) LB агаровые пластины (стерильные 10-сантиметровые пластины). Для этого 10 г отвара ЛБ с агаром растворяют в 400 мл дистиллированной воды, перемешивают, доводят объем до 500 мл. Стерилизуйте раствор автоклавированием, затем дайте раствору остыть, добавьте 0,5 мл ампициллина (запас: 150 мг / мл) в раствор и встряхните его, чтобы перемешать. Немедленно добавьте 18 мл раствора в стерильную 10-сантиметровую тарелку рядом со спиртовой лампой, дайте застыть при комнатной температуре и храните пластины вверх дном при температуре 4 °C до дальнейшего использования.
- Приготовьте среду LB, растворив 10 г LB без агара в 500 мл дистиллированной воды. Стерилизуйте раствор автоклавированием, дайте раствору остыть, добавьте 0,5 мл ампициллина (запас: 150 мг / мл) в раствор и встряхните его, чтобы перемешать.
- Подготовьте буфер потока, добавив 5 мл пенициллина/стрептомицина и 10 мл инактивированной теплом эмбриональной бычьей сыворотки (hiFBS) в 485 мл 1x фосфатного буферного физиологического раствора Дульбекко (DPBS).
ПРИМЕЧАНИЕ: Чтобы инактивировать FBS путем нагревания, поместите размороженные бутылки FBS в водяную баню с температурой 56 ° C. Следите за тем, чтобы бутылки не опрокинулись и не погрузились в водяную баню. Температура имеет решающее значение для полной деградации; чтобы убедиться в этом, подождите, пока температура стабилизируется на уровне 56 ° C после постановки бутылок на водяную баню. Аккуратно взбалтывайте бутылки каждые 10 минут три раза. Не допускайте инкубации сыворотки более 30 минут. - Подготовьте поддерживающую среду, добавив 50 мл hiFBS, 5 мл L-глутамина и 5 мл пенициллина/стрептомицина в 440 мл модифицированной орлиной среды Дульбекко (DMEM). Подготовьте среду для трансфекции, добавив 50 мл hiFBS и 5 мл L-глютамина в 445 мл среды DMEM.
- Приготовьте буфер для лизиса эритроцитов (эритроцитов), добавив 4,145 г NH4Cl, 0,504 г NaHCO3 и 16,81 мг этилендиаминтетрауксусной кислоты (ЭДТА) в 500 мл дистиллированной воды. Приготовьте неполную модифицированную среду Дульбекко (IMDM) Iscove, добавив 75 мл hiFBS, 5 г бычьего сывороточного альбумина (BSA), 0,5 мл 10 мг / мл инсулина, 2,5 мл 4 мг / мл голотрансферрина, 3,5 мкл β-меркаптоэтанола, 5 мл L-глутамина и 0,5 мл ципрофлоксацина в 416,5 мл среды IMDM.
- Приготовьте 10 мл 2х сред IMDM, в которых концентрация цитокинов в два раза превышает количество в 1x среде IMDM, добавив 10 мкл 50 нг/мкл mr-SCF, 20 мкл 25 нг/мкл mr-Flt3L, 20 мкл 10 нг/мкл mr-IL-6, 20 мкл 10 нг/мкл mr-IL-3, 10 мкл инсулина 10 мг/мл, и 50 мкл 4 мг/мл голотрансферрина в 9,87 мл неполной среды IMDM.
ПРИМЕЧАНИЕ: Перед использованием убедитесь, что буфер потока, буфер лизиса эритроцитов, поддерживающая среда, трансфекционная среда и неполная среда IMDM стерилизованы фильтром.
2. Плазмидная трансформация
- Разморозьте 20 мкл компетентных клеток α-Select на льду. Добавьте 1 мкл (~ 2 нг) плазмиды MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC322 к размороженным компетентным клеткам и аккуратно перемешайте, постукивая по пробирке. Инкубируйте реакцию на льду в течение 30 мин.
- Тепловой шок смеси путем инкубации в течение 40 с в нагревательном блоке с температурой 42 °C. Сразу же переложите тюбик на лед на 2 мин.
- Добавьте 1 мл среды LB (без ампициллина) в пробирку и встряхните при 37 ° C и 200 об/мин в течение 1 ч.
- Центрифугируйте пробирку при комнатной температуре при 500 x g в течение 4 мин и выбросьте 0,9 мл надосадочной жидкости. Ресуспендируют осадок в оставшихся 0,1 мл среды LB.
- Разложите преобразованные компетентные клетки на предварительно разогретых (37 ° C) агаровых пластинах AP LB. Инкубируйте тарелку вверх дном при температуре 37 °C в течение 12-16 часов.
- Выберите одну колонию и израсходуйте трансформированные клетки в 10 мл среды AP LB в течение ночи при 37 ° C и 200 об/мин.
- Добавьте 5 мл израсходованных трансформированных компетентных клеток к 500 мл среды AP LB в колбе и инкубируйте колбу в течение ночи при 37 ° C и 200 об/мин.
- Извлеките плазмиду с помощью набора для экстракции плазмиды в соответствии с инструкциями производителя и ресуспендируйте в 0,5 мл автоклавной сверхчистой воды. Количественно определите плазмиду с помощью спектрофотометра.
3. Трансфекция клеток Phoenix Ecotropic (pECO)
- Культивируйте 2 x 106 клеток pECO на поддерживающей среде в 10-сантиметровых планшетах в увлажненном инкубаторе 5% CO2 при 37 °C. Убедитесь, что клетки pECO поддерживаются в фазе экспоненциального роста и активно делятся перед прохождением.
- Когда клетки станут сливающимися на 80%, дважды промойте пластины 5 мл DPBS, добавьте в пластину 1 мл трипсина и инкубируйте в увлажненном инкубаторе 5% CO 2 при 37 ° C в течение2 минут. Соберите клетки с 5 мл поддерживающих сред в стерильную пробирку объемом 15 мл и центрифугу при 4 ° C и 400 x g в течение 3 мин. Ресуспендируйте клеточную гранулу в 5 мл поддерживающей среды.
- Смешайте 10 мкл клеточной суспензии и 10 мкл трипанового синего и загрузите 10 мкл на гемоцитометр для подсчета клеток.
Общее количество клеток/мл = (общее количество подсчитанных клеток x коэффициент разбавления x 104 клеток/мл) / количество подсчитанных квадратов)
Высевают 2 x 106 клеток/чашку в 6-сантиметровую посуду, используя 5 мл поддерживающей среды для трансфекции, и культивируют клетки в увлажненном инкубаторе 5% CO2 при 37 ° C. - Замените поддерживающую среду 5 мл трансфекционной среды, когда клетки станут сливаться на 50-60% после 18 часов культивирования.
- Перед трансфекцией реагент для трансфекции выдерживают при комнатной температуре не менее 30 минут.
- Добавьте 5,5 мкг плазмиды MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC322 к 0,5 мл простой среды DMEM в стерильной пробирке объемом 1,5 мл. Аккуратно перемешайте, постукивая по трубке, и оставьте на 10 минут.
- Добавьте 14,6 мкл (в 3 раза больше количества плазмиды; v/w) трансфекционного реагента в пробирку и осторожно постукивайте по пробирке каждые 10 минут три раза.
- Равномерно добавьте смесь по каплям во все области посуды с ячейками pECO в трансфекционных средах. Аккуратно перемещайте посуду вперед и назад 10 раз и вбок 10 раз. Инкубируйте посуду в увлажненном инкубаторе 5% CO2 при 37 ° C в течение 48 часов.
- Измерьте эффективность трансфекции с помощью флуоресцентной микроскопии и проточной цитометрии для зеленого флуоресцентного белка (GFP), как описано в22. Клетки сначала закрываются на FSC-A / FSC-H и FSC-A и SSC-A для получения синглетов. Популяция GFP+ закрыта на графике FL1 путем сравнения его с нетрансфицированными клетками.
- Соберите и отфильтруйте надосадочные жидкости через шприцевой фильтр 0,45 мкм в стерильную пробирку объемом 50 мл. Немедленно используйте надосадочные жидкости для трансдукции или заморозьте их в жидком азоте и храните при температуре -80 °C до дальнейшего использования.
ПРИМЕЧАНИЕ: клетки pECO должны быть правильно перемешаны и равномерно посеяны в посуду. Дайте клеткам распространиться, перемещая посуду вперед и назад 10 раз и вбок 10 раз во время посева. Количество ячеек, подлежащих посеву, может варьироваться в зависимости от различий в подсчете. Чтобы найти оптимальное количество посевных ячеек, которое может достичь слияния 50-60% после 18 часов культивирования, полезно засевывать клетки последовательными разведениями.
4. Лентивирусная трансдукция
- Усыпить 8-10-недельных самок мышей C57BL6 / J CD45.1 (две-три мыши-донора на мышь-реципиента) в камере CO2 .
- Стерилизуйте все тело мышей 70% этанолом. Поместите мышей на стерильную хирургическую подушечку на доске из пенополистирола и закрепите ноги через подушечки лап мыши.
- Разрежьте кожу над брюшной полостью по средней линии и расширьте подкожное пространство к задним лапам стерильными ножницами с острым концом.
- Расширьте разрез от средней линии живота до лодыжек. Расширьте подкожное пространство ниже задних лап лезвиями стерильных ножниц с острым концом.
- Разрежьте ахиллово сухожилие стерильными ножницами с острым концом. Возьмитесь за сухожилие с помощью щипцов с зубами и отрежьте другой конец, прикрепленный к бедренной кости, чтобы удалить икроножную мышцу.
- Разрежьте сухожилие четырехглавой мышцы, прикрепленное к колену, стерильными ножницами с острым концом. Удерживайте сухожилие с помощью щипцов с зубами и разрежьте головки мышц, прикрепленных к бедренной кости, чтобы удалить икроножную мышцу.
- Разрежьте другие мышцы, окружающие бедренную кость на конце, прикрепленные к большеберцовой кости, стерильными ножницами с острым концом.
- Разрежьте лодыжку стерильными ножницами с острым концом, следя за тем, чтобы большеберцовая кость оставалась неповрежденной. Удерживайте дистальный конец бедренной кости с помощью щипцов с зубцами и разрежьте тазобедренный сустав стерильными ножницами с острым концом, следя за тем, чтобы головка бедренной кости оставалась неповрежденной.
- Перенесите большеберцовую кость и бедренную кость в буфер потока в стерильной пробирке объемом 15 мл.
- Разделите большеберцовую и бедренную кости, сломав колено рукой. Удалите надколенник, хрящи и мыщелки бедренной кости, чтобы обнажить плато большеберцовой кости и дистальный отдел бедренной кости рукой. Удалите мышцы с помощью стерильной марли, а затем замочите кости в буфере потока.
- Разрежьте шейку бедренной кости и промойте клетки костного мозга буфером потока с обоих концов бедренной кости с помощью шприца объемом 10 мл с иглой 23 G.
- Разрежьте лодыжку большеберцовой кости и промойте клетки костного мозга буфером потока с обоих концов большеберцовой кости с помощью шприца объемом 10 мл с иглой 23 G.
- Диспергируйте клетки, пипеткой вверх и вниз с помощью шприца объемом 10 мл с иглой 18 г. Центрифугируйте одноэлементную суспензию при 4 °C и 400 x g в течение 3 мин.
- Выбросьте надосадочную жидкость и ресуспендируйте клетки в 5 мл буфера для лизиса эритроцитов для лизиса эритроцитов в течение 3 мин.
- Добавьте 5 мл проточного буфера, чтобы остановить лизис, и центрифугируйте клеточную суспензию при 4 ° C и 400 x g в течение 3 мин.
- Поместите клеточный фильтр размером 70 мкм на стерильную пробирку объемом 50 мл. Суспендируйте гранулу с 5 мл буфера потока, перемешайте и пропустите через клеточный фильтр для сбора клеток.
- Отрегулируйте концентрацию клеток с проточным буфером до 1 x 108/мл в полипропиленовых пробирках с круглым дном.
- Выберите Lin-клетки с помощью набора для выделения гемопоэтических клеток мыши в соответствии с инструкциями производителя.
- Отложите в сторону три пробирки по 1 x 104 клеток в 100 мкл буфера для одного неокрашенного контроля и двух одиночных контрольных групп, окрашенных антителами, для APC-конъюгированного антимышиного CD117 (c-Kit) и PE-Cy7-конъюгированного антимышиного Ly-6A / E (Sca-1). Используйте 1 мкл антитела (из 0,2 мг / мл) для каждого из контрольных групп, окрашенных антителами.
- Остальные клетки окрашивают в пробирку обоими антителами (по 4 мкл каждого из запасов 0,2 мг/мл) в 400 мкл. Инкубируют пробирки на льду в темноте в течение 0,5-1 ч.
- После окрашивания вымойте клетки, добавив 1 мл буфера потока и центрифугу при 4 ° C и 400 x g в течение 3 мин.
- Ресуспендируют клетки для неокрашенного контроля и контроля, окрашенного одним антителом, в 100 мкл буфера потока. Ресуспендируют клетки, окрашенные двойными антителами, в 1 мл проточного буфера для сортировки.
- Сортируйте гемопоэтические стволовые клетки (ГСК) как популяцию LSK с помощью сортировщика клеток, как описано в23,24.
- Во время окрашивания покройте стерильную 6-сантиметровую посуду ретронектином следующим образом: приготовьте 100 мкг/мл ретронектина в PBS и добавьте 0,9 мл PBS и 0,1 мл ретронектина в 6-сантиметровую чашку. Смажьте блюдо стерильным капюшоном комнатной температуры на 2 часа. Затем удалите ретронектин и заблокируйте блюдо 0,5 мл отфильтрованного 2% BSA (в PBS) на 30 минут. Дважды вымойте посуду 5 мл PBS, и блюдо готово к выдавливанию.
- Центрифугируют отсортированные ГСК или несортированные лин-клетки при 4 °C и 400 x g в течение 3 мин и ресуспендируют в 3 мл 2x (цитокинов) сред IMDM и 3 мл вирусной надосадочной жидкости (полученной на этапе 3.10) в чашке, покрытой ретронектином. Инкубируйте чашку в увлажненном инкубаторе 5% CO2 при 37 ° C в течение 6 или 24 часов.
ПРИМЕЧАНИЕ: В настоящем исследовании лин-клетки были либо отсортированы, либо несортированы в зависимости от экспериментального дизайна.
5. Серийная трансплантация (рис. 1)
ПРИМЕЧАНИЕ: Первичными мышами-реципиентами были 8-10-недельные самцы мышей C57BL6/J (CD45.2). Им давали воду ad libitum , содержащую антибиотики, для предотвращения оппортунистических инфекций пищеварения, от 3 дней до трансплантации до 7 дней после трансплантации. Мышей-реципиентов первичного облучения (4,75 Гр) проводили сублетальное облучение (4,75 Гр) за 3 ч до трансплантации25. Изофлуран не применяли мышам с внутрибрюшинной инъекцией.
- После трансдукции в течение 6 или 24 ч собирают клетки центрифугированием при комнатной температуре и 400 x g в течение 3 мин. При необходимости используйте трипсин для сбора клеток, прикрепленных к дну чашки. Выбросьте надосадочную жидкость и ресуспендируйте клетки в предварительно подогретом PBS. Определите объем PBS в зависимости от количества реципиентов (т.е. 0,1 мл/мышь и 0,5 мл/мышь для реципиентов с реципиентами с ретроорбитальными и внутрибрюшинными инъекциями соответственно).
- Поместите мышей-реципиентов с сублетальным облучением в изофлурановую камеру (расход кислорода установлен равным 1,0 л / мин, а испаритель изофлурана установлен равным 5%). Нанесите влажную мазь на глаза, чтобы предотвратить сухость под наркозом. Мыши готовы к дальнейшим процедурам, когда сердцебиение упадет до 60 ударов в минуту.
- Вводите клетки мышам-первичным реципиентам ретроорбитально (0,1 мл / мышь)7 или внутрибрюшинно (0,5 мл / мышь)26 с помощью иглы 27 G1/2. Наблюдайте за мышами непрерывно, пока они не приобретут достаточное сознание, чтобы поддерживать лежачее положение грудины. Ежедневно следите за состоянием мышей после трансплантации.
- Через 1 месяц еженедельно собирайте кровь с помощью ретроорбитального кровотечения для мониторинга лейкоцитоза путем оценки общего анализа крови (ОАК) на гемавете, как описано ниже.
- Поместите мышь сбоку после анестезии изофлураном (расход кислорода установлен как 1,0 л / мин, а испаритель изофлюранта установлен как 5%). Мыши готовы к дальнейшим процедурам, когда сердцебиение упадет до 60 ударов в минуту.
- Протоптизируйте глаз большим и указательным пальцами. Проникают в венозное синусовое сплетение с помощью капиллярной трубки астерильного гемакрита через внутренний кантус.
- Соберите 20-25 мкл крови в пробирку для сбора крови ЭДТА и закройте веки, чтобы остановить кровотечение. Нанесите одну каплю офтальмологического раствора гентамицина сульфата на глаз.
- В конечной точке, когда лейкоциты (лейкоциты) достигают 4 x 10 4 клеток/мкл, усыпляют мышь в камере CO2 и изолируют клетки костного мозга путем промывания бедренных костей и большеберцовой кости буфером потока с последующим лизисом эритроцитов, как указано на шаге4.
- В конечной точке соберите спленоциты, как указано ниже.
- Усыпьте мышь в камере CO2 . Поместите мышей на стерильную хирургическую подушечку на доске из пенополистирола и закрепите ноги через подушечки лап мыши. Стерилизуйте все тело мышей 70% этанолом.
- Разрежьте кожу и мышцы по средней линии, чтобы обнажить брюшную полость стерильными ножницами с острым концом. Изолируйте селезенку стерильными ножницами с острым концом и поместите ее в буфер потока в стерильной пробирке объемом 15 мл.
- Пропустите селезенку через стерильное ситечко размером 70 мкм в 6-сантиметровой чашке с 3 мл буфера потока. Перенесите клетки из чашки в стерильную пробирку объемом 15 мл и центрифугируйте одноклеточную суспензию при 4 ° C и 400 x g в течение 3 мин.
- Выбросьте надосадочную жидкость и ресуспендируйте клетки в 5 мл буфера для лизиса эритроцитов для лизиса эритроцитов в течение 3 мин. Добавьте 5 мл проточного буфера, чтобы остановить лизис, и центрифугируйте клеточную суспензию при 4 ° C и 400 x g в течение 3 мин.
- Поместите клеточный фильтр размером 70 мкм на стерильную пробирку объемом 50 мл. Суспендируйте гранулу с 5 мл буфера потока, перемешайте и пропустите через клеточный фильтр для сбора клеток.
- Идентификация первичных (1°) клеток ОМЛ путем окрашивания спленоцитов и клеток костного мозга антителом CD45.1, конъюгированного с FITC, и обнаружения на проточном цитометре. Клетки сначала закрываются на FSC-A / FSC-H и FSC-A и SSC-A для получения синглетов. Популяция CD45.1+ закрыта на графике FL1 путем сравнения его с неокрашенными клетками.
- Для вторичной (2°) трансплантации ресуспендируют клетки селезенки CD45.1 AML от реципиентов 1° r.o. в PBS (0,1 мл / мышь) и вводят их ретроорбитально мышам CD45.2 самцов C57BL6 / J. Параллельно ресуспендируют клетки селезенки AML от реципиентов с 1° внутривенным введением в PBS (0,5 мл / мышь) и вводят их внутрибрюшинно 8-12-недельному красному флуоресцентному белку (RFP), экспрессирующему Ai14TdTomato самцам мышей 27.
- Для третичной (3°) трансплантации ресуспендируют клетки ОМЛ, выделенные из костного мозга или брюшной полости реципиентов 2° внутривенно, и вводят их внутрибрюшинно мышам Ai14TdTomato (RFP+) или CD45.2 соответственно. Ресуспендируют клетки AML, выделенные из брюшной полости реципиентов 2° r.o., и пересаживают их путем инъекции r.o. мышам Ai14TdTomato (RFP+).
ПРИМЕЧАНИЕ: Для трансплантации 2° мы определили прогрессирование заболевания у реципиентов 2° путем мониторинга общего анализа крови в периферической крови. Чтобы дополнительно подтвердить установление ОМЛ, мы собрали цельную периферическую кровь с помощью пункции сердца, а также костный мозг, селезенку и печень. Кроме того, мы провели внутримышечное промывание для сбора внутримышечного промывания. Одноклеточные суспензии были получены из костного мозга, селезенки и внутривенного лаважа, как описано выше. Клетки из этих участков были проанализированы на проточном цитометре после лизиса эритроцитов. Клетки AML были признаны RFP-отрицательными (RFP-) клетками. Для трансплантации 3° мы взяли образцы крови, костного мозга, селезенки, печени и внутримышечного введения клеток в конечной точке; Клетки RFP или CD45.1+ были идентифицированы как клетки AML и исследованы с помощью проточной цитометрии. Мышам-реципиентам 2° и 3° не давали облучения или воды с антибиотиками.
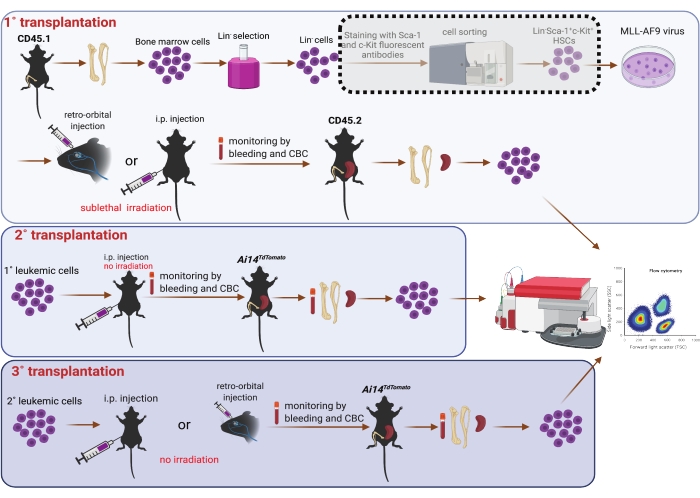
Рисунок 1: Схема трансдукции вируса MLL-AF9 в ГСК костного мозга и серийной трансплантации (1°, 2° и 3°). Сортировка двойной положительной популяции Sca-1 и c-Kit с помощью сортировщика ячеек, показанного в пунктирной тени, считается необязательной, если позволяют ресурсы. Рисунок был создан с помощью BioRender (https://biorender.com/). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Внутрибрюшинный лаваж
- Дважды введите 5 мл неполной среды IMDM в брюшную полость, чтобы собрать клетки в стерильную пробирку объемом 15 мл. Центрифугируют ячейку суспензии при комнатной температуре и 400 х г в течение 3 мин. Пересадка клеток ОМЛ (4 x 105 клеток на мышь) из брюшной полости реципиентов 2° путем внутримышечного введения мышам-реципиентам 3° CD45.2 (n = 3).
7. Гистологический анализ 28
- Изолируйте селезенку, печень и бедренные кости у мышей после эвтаназии. Зафиксируйте их в 5 мл 10% (об. / об.) буферного формалина. Возьмите образцы селезенки и печени у здоровых аналогов для сравнения.
- Всадите закрепленные ткани в парафин и разрежьте их на участки. Окрашивайте срезы гематоксилином и эозином (H&E) красителями.
- Получение изображений под микроскопом с 20-кратным увеличением, установленным с совместимым программным обеспечением для гистологического анализа.
8. Проведение полуколичественной ПЦР (кПЦР)
- Подготовьте РНК в РНК-реагенте в соответствии с инструкциями производителя.
- Используйте 0,5-1,0 мкг РНК для синтеза кДНК с использованием набора обратной транскрипции кДНК в соответствии с инструкциями производителя.
- Используйте кДНК для выполнения кПЦР с помощью набора для кПЦР и запускайте образцы в системе кПЦР. Используйте следующие предварительно проверенные зонды TaqMan: KMT2A (MLL; Ссылка Seq: NM_001197104(2), IDT)29 и 18S рибосомная РНК (Hs99999901_s1).
- Загрузите ампликоны KMT2A и 18S на 2% агарозный гель, чтобы визуализировать экспрессию. Получение изображений в тепловизоре, установленном с совместимой программой.
9. Обработка данных
- Проанализируйте результаты с помощью программного обеспечения для статистического анализа и представьте результаты в виде среднего значения ± SEM. Создавайте рисунки с помощью коммерческого инструмента иллюстратора.
Результаты
Сравнение эффективности трансплантации мышиных ОМЛ-клеток с использованием р.о. и в/путей трансплантации
Ранее сообщалось об установлении 1° AML у мышей-реципиентов, которым ретроорбитально трансплантировали клетки LSK, трансдуцированные MLL-AF9, а трансплантируемость клеток 1° A...
Обсуждение
Эти вышеописанные исследования предоставляют подтверждающие доказательства того, что трансплантация Lin-клеток сопоставима с клетками LSK при генерации 1° мышиного ОМЛ. Кроме того, текущие данные также показывают, что внутривенная инъекция является эффективным и удобным методом у...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы благодарят Центр проточной цитометрии Института Гека и Центр гистопатологии Лаборатории диагностики животных Департамента ветеринарных и биомедицинских наук Университета штата Пенсильвания за своевременную техническую поддержку. Эта работа была поддержана грантами Американского института исследований рака (KSP), Колледжа сельскохозяйственных наук штата Пенсильвания, Института рака штата Пенсильвания, проекта USDA-NIFA 4771, номер присоединения 00000005 к K.S.P. и R.F.P.
Материалы
| Name | Company | Catalog Number | Comments |
| a-Select competent cells | Bioline | BIO-85027 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | Cat# A-9434 | |
| Ampicillin | Sigma Aldrich | Cat# A0797 | |
| Bovine Serum Albumin (BSA), Fraction V—Low-Endotoxin Grade | Gemini bio-products | Cat# 700-102P | |
| Ciprofloxacin HCl | GoldBio.com | Cat# C-861-100 | |
| DMEM, high glucose, no glutamine | Gibco | Cat# 11960-044 | |
| Dulbecco’s Phosphate-Buffered Saline (PBS) | Corning | Cat# 21-031-CV | |
| EDTA, Disodium Salt (EDTA-2Na), Dihydrate, Molecular Biology Grade | Calbiochem | Cat# 324503 | |
| Fetal Bovine Serum - Premium Select | Atlanta Biologicals | Cat# S11550 | |
| Holo-transferrin, bovine | Sigma Aldrich | Cat# T1283 | |
| Insulin solution human | Sigma | Cat# I-9278 | |
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | Cat# 12440-053 | |
| L-glutamine 200 mM (100×) solution | HyClone, Gelifesciences | Cat# SH30034.01 | |
| LB broth, Lennox | NEOGEN | Cat #: 7290A | |
| LB Broth with agar (Miller) | Sigma Aldrich | Cat# L-3147 | |
| Mouse anti-mouse CD45.1 (FITC) | Miltenyi Biotec | Cat# 130-124-211 | |
| Mouse Interleukin-3 (IL-3) | Gemini bio-products | Cat# 300-324P | |
| Mouse Interleukin-6 (IL-6) | Gemini bio-products | Cat# 300-327P | |
| Mouse Stem Cell Factor (SCF) | Gemini bio-products | Cat# 300-348P | |
| Penicillin-Streptomycin Solution, 100x | Corning | Cat# 30-002-CI | |
| Phenix-Eco (pECO) cells | ATCC | CRL-3214 | |
| Potassium Bicarbonate (KHCO3), Granular | JT. Baker | Cat# 2940-01 | |
| Rat anti-mouse CD117 (c-kit) (APC) | BioLegend | Cat # 105812 | |
| Rat anti-mouse Ly-6A/E (Sca-1) (PE-Cy7) | BD Pharmingen | Cat# 558162 | |
| Recombinant Murine Flt3-Ligand | Pepro Tech, INC. | Cat# 250-31L | |
| RetroNectin Recombinant Human Fibronectin Fragment | TaKaRa | Cat# T100A | |
| TransIT-293 Reagent | MirusBio | Cat# MIR 2705 | |
| TRI Reagent | Sigma Aldrich | Cat# T9424 | |
| Trypan Blue Solution, 0.4% | Gibco | Cat # 15250061 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | Cat# 25200-056 | |
| β-Mercaptoethanol (BME) | Sigma Aldrich | Cat# M3148 | |
| Commercial Assays | |||
| EasySep Mouse Hematopoietic Progenitor Cell Isolation Kit | StemCell technologies | Cat# 19856A | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher | Cat# 4368813 | |
| PerfeCTa qPCR SuperMix | Quanta Bio | Cat# 95051-500 | |
| Plasmid Maxi Kit (25) | Qiagen | Cat#:12163 | |
| Animals | |||
| Ai14TdTomato mice | Jackson Laboratory | Strain # 007914 | |
| CD45.1 C57BL6/J mice | Jackson Laboratory | Strain # 002014 | |
| CD45.2 C57BL6/J mice | Jackson Laboratory | Strain # 000664 | |
| Instruments and Softwares | |||
| Adobe illustrator | Version 25.2.3 | ||
| BD accuri C6 flow cytometer | BD Biosciences | ||
| FlowJo 10.8.0 | BD | ||
| GeneSys software program | Version 1.5.7.0 | ||
| GraphPad Prism version 6 | GraphPad | ||
| Hemavet 950FS | Drew Scientific | ||
| 7300 Real time PCR system | Applied Biosystems | ||
| Syngene G:BOX Chemi XR5 Chemiluminescence Fluorescence Imaging | G:Box Chemi |
Ссылки
- Dohner, H., Weisdorf, D. J., Bloomfield, C. D. Acute myeloid leukemia. The New England Journal of Medicine. 373 (12), 1136-1152 (2015).
- Fortier, J. M., Graubert, T. A. Murine models of human acute myeloid leukemia. Cancer Treatment and Research. 145, 183-196 (2010).
- Ernst, P., et al. Definitive hematopoiesis requires the mixed-lineage leukemia gene. Developmental Cell. 6 (3), 437-443 (2004).
- Fisher, J. N., Kalleda, N., Stavropoulou, V., Schwaller, J. The Impact of the cellular origin in acute myeloid leukemia: learning from mouse models. Hemasphere. 3 (1), 152 (2019).
- Zhan, Y., Zhao, Y. Hematopoietic stem cell transplant in mice by intra-femoral injection. Methods in Molecular Biology. 430, 161-169 (2008).
- Price, J. E., Barth, R. F., Johnson, C. W., Staubus, A. E. Injection of cells and monoclonal antibodies into mice: comparison of tail vein and retroorbital routes. Proceedings of the Society for Experimental Biology. 177 (2), 347-353 (1984).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animal. 40 (5), 155-160 (2011).
- Suckow, M. A., Danneman, P., Brayton, C. . The Laboratory Mouse. , (2001).
- Barr, J. E., Holmes, D. B., Ryan, L. J., Sharpless, S. K. Techniques for the chronic cannulation of the jugular vein in mice. Pharmacology, Biochemistry, and Behavior. 11 (1), 115-118 (1979).
- Kang, Y. Analysis of cancer stem cell metastasis in xenograft animal models. Methods in Molecular Biology. 568, 7-19 (2009).
- Nungestee, W., Wolf, A., Jourdonais, L. Effect of gastric mucin on virulence of bacteria in intraperitoneal injections in the mouse. Proceedings of the Society for Experimental Biology and Medicine. 30 (2), 120-121 (1932).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and part I: anesthetic considerations in preclinical research. ILAR journal. 53 (1), 55-69 (2012).
- Leong, S. -. K., Ling, E. -. A. Labelling neurons with fluorescent dyes administered via intravenous, subcutaneous or intraperitoneal route. Journal of Neuroscience Methods. 32 (1), 15-23 (1990).
- Ma, P., et al. Intraperitoneal injection of magnetic Fe3O4-nanoparticle induces hepatic and renal tissue injury via oxidative stress in mice. International Journal of Nanomedicine. 7, 4809-4918 (2012).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Muench, M. O., Chen, J. C., Beyer, A. I., Fomin, M. E. Cellular therapies supplement: the peritoneum as an ectopic site of hematopoiesis following in utero transplantation. Transfusion. 51, 106-117 (2011).
- Zhao, W., et al. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World Journal of Gastroenterology. 18 (10), 1048 (2012).
- Yousefi, F., Ebtekar, M., Soleimani, M., Soudi, S., Hashemi, S. M. Comparison of in vivo immunomodulatory effects of intravenous and intraperitoneal administration of adipose-tissue mesenchymal stem cells in experimental autoimmune encephalomyelitis (EAE). International Immunopharmacol. 17 (3), 608-616 (2013).
- Cheng, K., et al. Transplantation of bone marrow-derived MSCs improves cisplatinum-induced renal injury through paracrine mechanisms. Experimental and Molecular Pathology. 94 (3), 466-473 (2013).
- Castelo-Branco, M., et al. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 7 (3), 33360 (2012).
- Bazhanov, N., et al. Intraperitoneally infused human mesenchymal stem cells form aggregates with mouse immune cells and attach to peritoneal organs. Stem Cell Research & Therapy. 7, 27 (2016).
- Liu, Q., Chen, L., Atkinson, J. M., Claxton, D. F., Wang, H. G. Atg5-dependent autophagy contributes to the development of acute myeloid leukemia in an MLL-AF9-driven mouse model. Cell Death & Disease. 7 (9), 2361 (2016).
- Wognum, A. W., Eaves, A. C., Thomas, T. E. Identification and isolation of hematopoietic stem cells. Archives of Medical Research. 34 (6), 461-475 (2003).
- Randall, T. D., Weissman, I. L. Characterization of a population of cells in the bone marrow that phenotypically mimics hematopoietic stem cells: resting stem cells or mystery population. Stem Cells. 16 (1), 38-48 (1998).
- Gott, K. M., et al. A comparison of Cs-137 gamma rays and 320-kV X-rays in a mouse bone marrow transplantation model. Dose Response. 18 (2), 1559325820916572 (2020).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Applied Microbiology. 17 (2), 250-251 (1969).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Ronan, J. L., Wu, W., Crabtree, G. R. From neural development to cognition: unexpected roles for chromatin. Nature Review Genetics. 14 (5), 347-359 (2013).
- Qian, F., et al. Interleukin-4 treatment reduces leukemia burden in acute myeloid leukemia. FASEB Journal. 36 (5), 22328 (2022).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 442 (7104), 818-822 (2006).
- Chen, W., et al. Malignant transformation initiated by Mll-AF9: gene dosage and critical target cells. Cancer Cell. 13 (5), 432-440 (2008).
- Somervaille, T. C. P., Cleary, M. L. Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell. 10 (4), 257-268 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены