A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השתלה תוך צפקית ליצירת לוקמיה מיאלואידית חריפה בעכברים
In This Article
Summary
כאן, הזרקה תוך פריטוניאלית של תאי לוקמיה מנוצלת כדי לבסס ולהפיץ לוקמיה מיאלואידית חריפה (AML) בעכברים. שיטה חדשה זו יעילה בהשתלה סדרתית של תאי AML ויכולה לשמש חלופה למי שעלול לחוות קשיים וחוסר עקביות עם הזרקה תוך ורידית בעכברים.
Abstract
קיים צורך בלתי מסופק בטיפולים חדשניים לטיפול בלוקמיה מיאלואידית חריפה (AML) והישנות הנלווית הכוללת תאי גזע לוקמיה מתמשכת (LSCs). מודל ניסיוני של מכרסמים AML לבדיקת טיפולים המבוססים על השתלה מוצלחת של תאים אלה באמצעות זריקות רטרו-מסלוליות בעכברים מושתלים טומן בחובו אתגרים. מטרת מחקר זה הייתה לפתח שיטה קלה, אמינה ועקבית ליצירת מודל מורין חזק של AML באמצעות מסלול תוך פריטוניאלי. בפרוטוקול הנוכחי, תאי מח עצם הומרו עם רטרו-וירוס המבטא אונקופרוטאין היתוך MLL-AF9 אנושי. נבדקה יעילותן של אוכלוסיות שליליות בשושלת (Lin-) ו- Lin-Sca-1+c-Kit+ (LSK) כ- LSCs תורמים בפיתוח AML ראשוני, והזרקה תוך צפקית אומצה כשיטה חדשה ליצירת AML. השוואה בין זריקות תוך פריטוניאליות ורטרו-אורביטליות נעשתה בהשתלות סדרתיות כדי להשוות ולהשוות בין שתי השיטות. תאי לין ו-LSK שהותמרו עם נגיף MLL-AF9 אנושי הושתלו היטב במח העצם ובטחול של המושתלים, מה שהוביל ל-AML במלוא מובן המילה. הזרקה תוך-צפקית של תאי תורם ביססה AML במושתלים לאחר השתלה סדרתית, וחדירת תאי AML זוהתה בדם, במח העצם, בטחול ובכבד של המושתלים על ידי ציטומטריית זרימה, qPCR וניתוחים היסטולוגיים. לפיכך, הזרקה תוך צפקית היא שיטה יעילה להשראת AML באמצעות השתלה סדרתית של תאים לוקמיים מתורם.
Introduction
לוקמיה מיאלואידית חריפה (AML) היא סוג של ממאירות המטולוגית של אטיולוגיה מגוונת עם פרוגנוזה גרועה1. דור המודלים של AML בבעלי חיים מניח את היסודות להבנת הווריאציות המורכבות והפתולוגיה שלו במאמץ לגלות טיפולים חדשניים2. לוקמוגנזה בעכברים כוללת השתלה של תאי תורם המבטאים אונקופרוטאינים היתוך, כולל איחוי המערב את הגן לוקמיה שושלת מעורבת (MLL) כדי לגרום ל- AML בעוצמה, כדי לחקות את המחלה בבני אדם3. מקורות תאיים שונים של תאי תורם דווחו בהשתלת AML4 הקשור לגן MLL, כאשר מעט מאוד ידוע על התאים האחראים למקור המחלה.
פותחו מסלולים רבים להשתלה בעכברים; במקום זריקה תוך-פמורלית, המחדירה ישירות תאי תורם מוטנטיים למח עצם5, נעשה שימוש נרחב בזריקה תוך-ורידית המשתמשת במקלעת הסינוסים הוורידית, וריד הזנב ווריד הצוואר ליצירת מודלים 6,7,8,9 של AML. במקרה של הזרקת רטרו-אורביטל (r.o.), חסרונות מובנים שונים, כגון הגבלת נפח, ביקוש טכני גבוה, סיכויים מעטים לניסיונות חוזרים או טעויות, ופגיעות עיניים פוטנציאליות, היו אבני נגף עיקריות עם חלופות מוגבלות או ללא קיימות7. הזרקת ורידים זנב יכולה להיות בעיות דומות מלבד פציעות מקומיות; כדי להקל על ההליך, עכברים לעתים קרובות צריך להיות מחומם כדי להרחיב את ורידי הזנב שלהם10. כמו כן, קשה לאתר את וריד הזנב ללא מקור אור נוסף, במיוחד בזן C57BL/6 של עכברים. עבור הזרקת ורידים Jugular, אנשי המחקר דורשים הכשרה מספקת כדי לאתר את הווריד ולהגביל סיבוכים אפשריים. בנוסף, הן סינוס ורידי זריקות ורידים jugular צריך להתבצע תחת הרדמה, אשר מוסיף רמה נוספת של מורכבות. לכן, מפתה לחקור מסלולים חדשים להשתלה כדי להקל על הקמת מודלים של AML murine.
הזרקה תוך צפקית (i.p.) משמשת בדרך כלל למתן תרופות, צבעים והרדמה 11,12,13,14,15; הוא שימש גם להחדרת תאים המטופויטיים להמטופויזיס חוץ רחמי16 ולהשתלת תאי גזע מזנכימליים שמקורם במח עצם במודלים שונים של עכברים 17,18,19,20,21. עם זאת, הוא שימש לעתים רחוקות כדי לבסס ממאירויות hematopoietic בעכברים, במיוחד כדי לחקור את התקדמות מחלת AML.
המחקר הנוכחי מתאר את ההיתכנות של הזרקת i.p. בדור של מודלים של עכברי AML, בנוסף להשוואת יעילות ההשתלה של אוכלוסיות שליליות בשושלת (Lin-) ו- Lin-Sca-1+c-Kit+ (LSK) כתאי תורם. ממצאים אלה מספקים דרך פשוטה ויעילה ליצור מודלים ניסיוניים של AML ולוקמיה מיאלואידית קשורה. לשיטה כזו יש פוטנציאל לקדם את הבנתנו את מנגנוני המחלה, כמו גם לספק מודל קל יחסית לבדיקת טיפולים ניסיוניים.
Protocol
כל הניסויים אושרו מראש על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת פנסילבניה.
1. הכנת מאגרים וריאגנטים
- הכינו צלחות אגר LB בתוספת אמפיצילין (AP) (צלחות סטריליות בקוטר 10 ס"מ). כדי לעשות זאת, להמיס 10 גרם של מרק LB עם אגר ב 400 מ"ל של מים מזוקקים, לערבב, ולהביא את נפח עד 500 מ"ל. לעקר את התמיסה על ידי autoclaving, ולאחר מכן לאפשר את התמיסה להתקרר, להוסיף 0.5 מ"ל של ampicillin (מלאי: 150 מ"ג / מ"ל) לתמיסה, ולנער אותו כדי לערבב. הוסיפו מיד 18 מ"ל תמיסה לצלחת סטרילית בקוטר 10 ס"מ ליד מנורת אלכוהול, הניחו להתמצק בטמפרטורת החדר, ואחסנו את הצלחות הפוכות בטמפרטורה של 4°C עד לשימוש נוסף.
- הכן מדיה LB על ידי המסת 10 גרם של LB ללא אגר ב 500 מ"ל של מים מזוקקים. לעקר את הפתרון על ידי autoclaving, לאפשר את הפתרון להתקרר, להוסיף 0.5 מ"ל של ampicillin (מלאי: 150 מ"ג / מ"ל) לתמיסה, ולנער אותו כדי לערבב.
- הכן את חיץ הזרימה על ידי הוספת 5 מ"ל פניצילין/סטרפטומיצין ו-10 מ"ל של סרום בקר עוברי מומת בחום (hiFBS) ל-485 מ"ל של מלח חוצץ פוספט (DPBS) של 1x Dulbecco.
הערה: כדי להשבית את FBS על ידי חימום, יש להניח בקבוקי FBS מופשרים באמבט מים בטמפרטורה של 56°C. ודאו שהבקבוקים אינם מתהפכים או שוקעים בדרך אחרת באמבט המים. הטמפרטורה קריטית להתכלות מוחלטת; כדי להבטיח זאת, המתן עד שהטמפרטורה תתייצב על 56 מעלות צלזיוס לאחר הכנסת הבקבוקים לאמבט המים. מערבלים בעדינות את הבקבוקים כל 10 דקות שלוש פעמים. אין לאפשר לסרום לדגור במשך יותר מ-30 דקות. - הכינו אמצעי תחזוקה על ידי הוספת 50 מ"ל של hiFBS, 5 מ"ל של L-גלוטמין ו-5 מ"ל של פניצילין/סטרפטומיצין ל-440 מ"ל של מדיום הנשר המעובד של דולבקו (DMEM). הכן מדיה transfection על ידי הוספת 50 מ"ל של hiFBS ו 5 מ"ל של L-גלוטמין לתוך 445 מ"ל של מדיה DMEM.
- הכינו חיץ ליזה של תאי דם אדומים (RBC) על ידי הוספת 4.145 גרם של NH4Cl, 0.504 גרם של NaHCO3 ו-16.81 מ"ג של חומצה אתילאנדיאמיןטטראצטית (EDTA) ל-500 מ"ל מים מזוקקים. הכן מדיה בינונית (IMDM) של Dulbecco של Iscove על ידי הוספת 75 מ"ל של hiFBS, 5 גרם אלבומין בסרום בקר (BSA), 0.5 מ"ל של 10 מ"ג / מ"ל אינסולין, 2.5 מ"ל של 4 מ"ג / מ"ל הולו-טרנספרין, 3.5 מיקרוליטר של β-מרקפטואתנול, 5 מ"ל של L-גלוטמין, ו 0.5 מ"ל של ciprofloxacin לתוך 416.5 מ"ל של מדיה IMDM.
- הכן 10 מ"ל של 2x מדיה IMDM, שבה ריכוז הציטוקינים כפול מהכמות במדיית IMDM 1x, על ידי הוספת 10 μL של 50 ng/μL mr-SCF, 20 μL של 25 ng/μL mr-Flt3L, 20 μL של 10 ng/μL mr-IL-6, 20 μL של 10 ng/μL mr-IL-3, 10 μL של 10 מ"ג/מ"ל אינסולין, ו-50 מיקרוליטר של הולו-טרנספרין במינון 4 מ"ג/מ"ל ל-9.87 מ"ל של מדיית IMDM חלקית.
הערה: ודא שמאגר זרימה, מאגר ליזה RBC, מדיית תחזוקה, מדיית טרנספקציה ומדיית IMDM חלקית עוברים עיקור לפני השימוש.
2. טרנספורמציה פלסמידית
- הפשירו 20 μL של תאים מוסמכים α-Select על קרח. הוסף 1 μL (~ 2 ng) של MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC3 plasmid22 לתאים מתאימים מופשרים וערבב בעדינות על ידי הקשה על הצינור. לדגור את התגובה על קרח במשך 30 דקות.
- מחממים את התערובת על ידי דגירה במשך 40 שניות בגוש חימום של 42 מעלות צלזיוס. מעבירים מיד את הצינור על קרח למשך 2 דקות.
- הוסף 1 מ"ל של חומר LB (ללא אמפיצילין) לצינור ונער ב-37°C וב-200 סל"ד למשך שעה אחת.
- צנטריפוגה את הצינור בטמפרטורת החדר ב 500 x גרם במשך 4 דקות ולהשליך 0.9 מ"ל של supernatant. להשעות מחדש את המשקע ב 0.1 מ"ל הנותרים של מדיה LB.
- פזרו את התאים המוכשרים שעברו טרנספורמציה על לוחות אגר AP LB שחוממו מראש (37°C). לדגור את הצלחת הפוך ב 37 ° C במשך 12-16 שעות.
- בחר מושבה אחת והשקיע את התאים שעברו טרנספורמציה ב- 10 מ"ל של מדיה AP LB למשך הלילה ב- 37 ° C ו- 200 סל"ד.
- הוסף 5 מ"ל של תאים מוכשרים שעברו טרנספורמציה מושקעת ל- 500 מ"ל של מדיה AP LB בבקבוק ודגור על הבקבוק למשך הלילה ב- 37 ° C ו- 200 סל"ד.
- חלץ את הפלסמיד באמצעות ערכת מיצוי פלסמיד בהתאם להוראות היצרן והשהה מחדש ב 0.5 מ"ל של מים אולטרה טהורים autoclaved. כמת את הפלסמיד באמצעות ספקטרופוטומטר.
3. טרנספקציה של תאים אקוטרופיים פיניקס (pECO)
- תרבית 2 x 106 תאי pECO / צלחת באמצעי תחזוקה בלוחות 10 ס"מ באינקובטור 5% CO2 לח ב 37 ° C. ודא שתאי ה- pECO נשמרים בשלב הצמיחה המעריכית ומתחלקים באופן פעיל לפני המעבר.
- כאשר התאים הופכים 80% confluent, לשטוף את הצלחות עם 5 מ"ל של DPBS פעמיים, להוסיף 1 מ"ל של טריפסין לצלחת, לדגור אינקובטור לח 5% CO 2 ב 37 ° C במשך2 דקות. קצרו את התאים עם 5 מ"ל של אמצעי תחזוקה בצינור סטרילי של 15 מ"ל וצנטריפוגה ב 4 ° C ו 400 x גרם במשך 3 דקות. להשעות מחדש את גלולת התא ב 5 מ"ל של מדיה תחזוקה.
- ערבבו 10 μL של תרחיף תאים ו-10 μL של טריפאן כחול והעמיסו 10 μL על המוציטומטר כדי לספור את התאים.
סה"כ תאים/מ"ל = (סה"כ התאים שנספרו x מקדם דילול x 10,4 תאים/מ"ל)/ מספר הריבועים שנספרו)
זרעו 2 x 10 6 תאים / צלחת לתוך צלחות6 ס"מ באמצעות 5 מ"ל של אמצעי תחזוקה עבור transfection ותרבית התאים באינקובטור לח 5% CO2 ב 37 ° C. - החלף את אמצעי התחזוקה ב -5 מ"ל של מדיה טרנספקציה כאשר התאים הופכים למפגש של 50%-60% לאחר 18 שעות של תרבית.
- שמור את מגיב transfection בטמפרטורת החדר לפחות 30 דקות לפני transfection.
- הוסף 5.5 מיקרוגרם של פלסמיד MSCV-MLL-AF9-EF1α-luc2-P2A-EGFP-LC322 עד 0.5 מ"ל של מדיה DMEM רגילה בצינור סטרילי של 1.5 מ"ל. מערבבים אותו בעדינות על ידי הקשה על הצינור ומניחים לו לשבת במשך 10 דקות.
- הוסף 14.6 μL (פי 3 מכמות הפלסמיד; v/w) של מגיב טרנספקציה לצינור והקש בעדינות על הצינור כל 10 דקות שלוש פעמים.
- מוסיפים את התערובת באופן אחיד לכל אזורי הכלים עם תאי ה-pECO באמצעי טרנספקציה. הזיזו בעדינות את הכלים קדימה ואחורה 10 פעמים ולצדדים 10 פעמים. לדגור את הכלים בחממה לח 5% CO2 ב 37 ° C במשך 48 שעות.
- למדוד את יעילות הטרנספקציה על ידי מיקרוסקופ פלורסנציה וציטומטריית זרימה עבור חלבון פלואורסצנטי ירוק (GFP) כמתואר ב22. התאים מגודרים תחילה על FSC-A/FSC-H ו-FSC-A ו-SSC-A כדי לרכוש סינגלטים. אוכלוסיית GFP+ מגודרת על חלקת FL1 על ידי השוואתה לתאים שאינם נגועים.
- אספו וסננו את הסופרנאטנטים דרך מסנן מזרקים של 0.45 מיקרומטר לתוך צינור סטרילי של 50 מ"ל. השתמשו בסופרנאטנטים מיד לצורך התמרה או הצמדה, הקפיאו אותם בחנקן נוזלי ואחסנו אותם בטמפרטורה של -80°C עד לשימוש נוסף.
הערה: תאי pECO צריכים להיות מעורבבים כראוי ונזרעים בכלים באופן אחיד. אפשרו לתאים להתפשט על ידי הזזת הכלים קדימה ואחורה 10 פעמים ולצדדים 10 פעמים בזמן הזריעה. מספר התא שיש לזרוע עשוי להשתנות בהתאם לשינויים בספירה. כדי למצוא את מספר תאי הזריעה האופטימלי שיכול להשיג מפגש של 50%-60% לאחר 18 שעות של תרבית, זריעת תאים עם דילול סדרתי מועילה.
4. התמרה לנטיויראלית
- הרדימו עכברי CD45.1 נקבות CD45.1 בנות 8-10 שבועות (שניים עד שלושה עכברים תורמים לכל עכבר מקבל) בתא CO2 .
- לעקר את כל הגוף של העכברים עם 70% אתנול. הניחו את העכברים על כרית כירורגית סטרילית על לוח קלקר ונעצו את הרגליים דרך כריות כפות העכבר.
- חותכים את העור מעל חלל הבטן בקו האמצע ומרחיבים את החלל התת עורי לכיוון הרגליים האחוריות בעזרת מספריים סטריליים חדים.
- האריכו את החתך מקו האמצע של הבטן עד לקרסוליים. להרחיב את החלל התת עורי מתחת לרגליים האחוריות עם להבים של מספריים סטריליים חדים.
- חותכים את גיד אכילס במספריים סטריליים חדים. החזיקו את הגיד באמצעות מלקחיים עם שיניים וחתכו את הקצה השני המחובר לעצם הירך כדי להסיר את שריר הגסטרוקנמיוס.
- חותכים את גיד הארבע ראשי המחובר לברך בעזרת מספריים סטריליים חדים. החזיקו את הגיד באמצעות מלקחיים עם שיניים וחתכו את ראשי השרירים המחוברים לעצם הירך כדי להסיר את שריר הגסטרוקנמיוס.
- חותכים את השרירים האחרים המקיפים את עצם הירך בקצה המחוברים לשוקה, בעזרת מספריים סטריליים חדים.
- חותכים את הקרסול עם מספריים סטריליים חדים, להבטיח כי השוקה נשארת שלמה. החזיקו את הקצה הדיסטלי של עצם הירך באמצעות מלקחיים עם שיניים וחתכו את מפרק הירך עם מספריים סטריליים בעלי קצה חד, כדי להבטיח שראש עצם הירך יישאר שלם.
- מעבירים את הטיביאס ועצם הירך לחיץ זרימה בצינור סטרילי של 15 מ"ל.
- להפריד את השוקה ואת עצם הירך על ידי שבירת הברך ביד. הסר את הפטלה, הסחוס וקונדיל הירך כדי לחשוף את הרמה הטיביאלית ואת עצם הירך הדיסטלית ביד. הסר את השרירים באמצעות גזה סטרילית ולאחר מכן להשרות את העצמות בחיץ זרימה.
- חותכים את צוואר הירך ושוטפים את תאי מח העצם עם חיץ זרימה משני קצוות עצם הירך באמצעות מזרק 10 מ"ל עם מחט 23 גרם.
- חותכים את malleolus tibial ולשטוף את תאי מח העצם עם חיץ זרימה משני הקצוות של השוקה באמצעות מזרק 10 מ"ל עם מחט 23 גרם.
- לפזר את התאים על ידי pipeting למעלה ולמטה באמצעות מזרק 10 מ"ל עם מחט 18 גרם. צנטריפוגה את המתלה החד-תאי בטמפרטורה של 4°C ו-400 x g למשך 3 דקות.
- השליכו את הסופרנאטנט והשהו מחדש את התאים ב-5 מ"ל של חיץ ליזה RBC כדי לשקוע ב-RBCs למשך 3 דקות.
- הוסף 5 מ"ל של חיץ זרימה כדי לעצור את הליזיס וצנטריפוגה את תרחיף התא ב 4 ° C ו 400 x גרם למשך 3 דקות.
- הניחו מסננת תאים של 70 מיקרומטר על צינור סטרילי של 50 מ"ל. להשהות את הגלולה עם 5 מ"ל של חיץ זרימה, לערבב, ולעבור דרך מסננת התא כדי לאסוף את התאים.
- התאם את ריכוז התא עם חיץ זרימה ל- 1 x 108/mL בצינורות פוליפרופילן תחתונים עגולים.
- בחר תאי Lin- באמצעות ערכת בידוד תאים hematopoietic עכבר בהתאם להוראות היצרן.
- שמור בצד שלושה צינורות של 1 x 104 תאים ב 100 μL של חיץ עבור בקרה אחת לא מוכתמת ושני פקדים מוכתמים נוגדנים בודדים עבור APC מצומד נגד עכבר CD117 (c-Kit) ו PE-Cy7-מצומד נגד עכבר Ly-6A/E (Sca-1). יש להשתמש ב-1 מיקרוליטר נוגדנים (ממלאי של 0.2 מ"ג/מ"ל) עבור כל אחת מקבוצת הביקורת המוכתמת בנוגדן יחיד.
- מכתימים את שאר התאים בצינור עם שני הנוגדנים (4 μL מכל אחד ממלאי של 0.2 מ"ג/מ"ל) ב-400 μL. דוגרים על הצינורות על קרח בחושך למשך 0.5-1 שעות.
- לאחר הצביעה, יש לשטוף את התאים על ידי הוספת 1 מ"ל של חיץ זרימה וצנטריפוגה בטמפרטורה של 4°C ו-400 x g למשך 3 דקות.
- השהה מחדש את התאים עבור הבקרה הלא מוכתמת ואת הפקדים המוכתמים בנוגדן יחיד ב -100 μL של מאגר זרימה. השהה מחדש תאים מוכתמים בנוגדנים כפולים ב 1 מ"ל של חיץ זרימה למיון.
- מיין תאי גזע המטופויטיים (HSCs) כאוכלוסיית LSK באמצעות ממיין תאים כמתואר ב23,24.
- בזמן הצביעה, מצפים צלחת סטרילית בקוטר 6 ס"מ ברטרונקטין באופן הבא: מכינים מלאי של 100 מיקרוגרם/מ"ל של רטרונקטין ב-PBS ומוסיפים 0.9 מ"ל PBS ו-0.1 מ"ל רטרונקטין לצלחת של 6 ס"מ. מצפים את המנה במכסה מנוע סטרילי בטמפרטורת החדר למשך שעתיים. לאחר מכן, להסיר את retronectin ולחסום את המנה עם 0.5 מ"ל של מסונן 2% BSA (ב PBS) במשך 30 דקות. לשטוף את המנה עם 5 מ"ל של PBS פעמיים ואת המנה מוכנה transduction.
- צנטריפוגו את תאי HSC ממוינים או תאי לין לא ממוינים בטמפרטורה של 4°C ו-400 x g למשך 3 דקות והשהו מחדש ב-3 מ"ל של 2x (של ציטוקינים) מדיה IMDM ו-3 מ"ל של סופרנאטנט נגיפי (שנוצר משלב 3.10) בצלחת מצופה רטרונקטין. לדגור את המנה באינקובטור לח 5% CO2 ב 37 ° C במשך 6 או 24 שעות.
הערה: במחקר הנוכחי, תאי לין מוינו או לא מוינו בהתאם לתכנון הניסוי.
5. השתלה סדרתית (איור 1)
הערה: העכברים המושתלים העיקריים היו עכברי C57BL6/J זכרים בני 8-10 שבועות (CD45.2). הם קיבלו מים המכילים אנטיביוטיקה למניעת זיהומי עיכול אופורטוניסטיים, החל מ-3 ימים לפני ההשתלה ועד 7 ימים לאחר ההשתלה . עכברים מושתלים ראשוניים הוקרנו באופן תת-קטלני (4.75 Gy) 3 שעות לפני ההשתלה25. Isoflurane לא הוחל על עכברים עם הזרקה intra-peritoneal.
- לאחר התמרה במשך 6 או 24 שעות, לקצור את התאים על ידי צנטריפוגה בטמפרטורת החדר 400 x גרם במשך 3 דקות. השתמשו בטריפסין כדי לאסוף את התאים המחוברים לתחתית הצלחת במידת הצורך. השליכו את הסופרנאטנט והשהו מחדש את התאים ב-PBS שחומם מראש. קבע את עוצמת הקול של PBS בהתאם למספר המושתלים (כלומר, 0.1 מ"ל/עכבר ו-0.5 מ"ל/עכבר עבור מושתלים עם זריקות רטרו-אורביטליות ותוך-פריטוניאליות, בהתאמה).
- הניחו את העכברים המקבלים המוקרנים באופן תת-קטלני בתא איזופלורן (קצב זרימת החמצן נקבע כ-1.0 ליטר/דקה והוופורייזר של איזופלורן נקבע כ-5%). יש למרוח משחה רטובה על העיניים כדי למנוע יובש בזמן הרדמה. העכברים מוכנים להליכים נוספים כאשר פעימות הלב יורדות ל -60 פעימות לדקה.
- הזריקו תאים לעכברים מושתלים ראשוניים באופן רטרו-אורביטלי (0.1 מ"ל/עכבר)7 או תוך צפקי (0.5 מ"ל/עכבר)26 באמצעות מחט 27 G1/2. התבוננו בעכברים ברציפות עד שהם מקבלים הכרה מספקת כדי לשמור על עצם החזה. עקוב אחר העכברים מדי יום לרווחתם לאחר ההשתלה.
- לאחר חודש אחד, לאסוף דם מדי שבוע על ידי דימום רטרו-אורביטלי כדי לפקח על לויקוציטוזה על ידי הערכת ספירת דם מלאה (CBC) על hemavet כמתואר להלן.
- הניחו את העכבר לרוחב לאחר הרדמה עם איזופלורן (קצב זרימת החמצן נקבע כ-1.0 ליטר/דקה והוופורייזר של איזופלורנס נקבע כ-5%). העכברים מוכנים להליכים נוספים כאשר פעימות הלב יורדות ל -60 פעימות לדקה.
- העמידו את העין בעזרת האגודל והאצבע המורה. חודרים למקלעת הסינוס הוורידי עם צינור נימי המקריט סטרילי דרך הקנתוס הפנימי.
- לאסוף 20-25 μL של דם לתוך צינור איסוף דם EDTA ולסגור את העפעפיים כדי לעצור את הדימום. החל טיפה אחת של תמיסה אופתלמית גנטמיצין סולפט על העין.
- בנקודת הקצה, כאשר תאי הדם הלבנים (WBCs) מגיעים ל 4 x 104 תאים / μL, הרדימו את העכבר בתא CO2 ובודדו את תאי מח העצם על ידי שטיפת עצם הירך והטיביאס עם חיץ זרימה, ואחריו ליזה RBC כפי שהוזכר בשלב 4.
- בנקודת הקצה, לקצור את הטחול כפי שהוזכר להלן.
- הרדימו את העכבר בתא CO2 . הניחו את העכברים על כרית כירורגית סטרילית על לוח קלקר ונעצו את הרגליים דרך כריות כפות העכבר. לעקר את כל הגוף של העכברים עם 70% אתנול.
- חותכים את העור והשריר בקו האמצע כדי לחשוף את חלל הבטן עם מספריים סטריליים חדים. בודדו את הטחול בעזרת מספריים סטריליים חדים והכניסו אותו למאגר זרימה בצינור סטרילי של 15 מ"ל.
- יש לערבב את הטחול דרך מסננת סטרילית בגודל 70 מיקרומטר בכלי בקוטר 6 ס"מ עם 3 מ"ל של חיץ זרימה. מעבירים את התאים מהצלחת לצינור סטרילי של 15 מ"ל וצנטריפוגה את תרחיף התא הבודד ב 4 ° C ו 400 x גרם למשך 3 דקות.
- השליכו את הסופרנאטנט והשהו מחדש את התאים ב-5 מ"ל של חיץ ליזה RBC כדי לשקוע ב-RBCs למשך 3 דקות. הוסף 5 מ"ל של חיץ זרימה כדי לעצור את הליזיס וצנטריפוגה את תרחיף התא ב 4 ° C ו 400 x גרם למשך 3 דקות.
- הניחו מסננת תאים של 70 מיקרומטר על צינור סטרילי של 50 מ"ל. להשהות את הגלולה עם 5 מ"ל של חיץ זרימה, לערבב, ולעבור דרך מסננת התא כדי לאסוף תאים.
- זהה תאי AML ראשוניים (1°) על ידי צביעת הטחול ותאי מח העצם בנוגדן CD45.1 נגד עכבר מצומד FITC וזיהוי על ציטומטר זרימה. התאים מגודרים תחילה על FSC-A/FSC-H ו-FSC-A ו-SSC-A כדי לרכוש סינגלטים. אוכלוסיית CD45.1+ מגודרת על חלקת FL1 על ידי השוואתה לתאים לא מוכתמים.
- להשתלה שניונית (2°), יש להשעות מחדש תאי ספלני CD45.1 AML ממושתלי 1° r.o ב-PBS (0.1 מ"ל/עכבר) ולהזריק אותם רטרו-מסלולית לעכברי CD45.2 זכרים C57BL6/J. במקביל, יש להשעות מחדש תאים ספלניים AML ממושתלי i.p. 1° ב-PBS (0.5 מ"ל/עכבר) ולהזריק אותם תוך צפקית לעכברים זכרים בני 8-12 שבועות המבטאים חלבון פלואורסצנטי אדום (RFP) המבטא Ai14TdTomato 27.
- להשתלה שלישוני (3°), יש להשהות מחדש תאי AML שבודדו ממח העצם או מחלל הצפק של מקבלי 2° i.p. ולהזריק אותם תוך צפקית לעכברי Ai14TdTomato (RFP+) או CD45.2, בהתאמה. להשהות מחדש תאי AML שבודדו מחלל הצפק של מקבלי 2° r.o. ולהשתיל אותם על ידי הזרקת r.o. לעכברי Ai14TdTomato (RFP+).
הערה: עבור השתלת 2°, זיהינו את התקדמות המחלה אצל מושתלים 2° על ידי ניטור CBC בדם היקפי. כדי לאשר עוד יותר את הקמתה של AML, אספנו דם היקפי שלם על ידי ניקוב לב, כמו גם מח עצם, טחול וכבד. יתר על כן, ביצענו שטיפת i.p. כדי לאסוף תאי i.p. מתלים של תאים בודדים נרכשו ממח עצם, טחול ושטיפת I.P. כמתואר לעיל. תאים מאתרים אלה נותחו על ציטומטר זרימה בעקבות ליזה RBC. תאי AML זוהו כתאי RFP שליליים (RFP-). עבור השתלת 3°, דגמנו דם, מח עצם, טחול, כבד ותאי I.P בנקודת הקצה; תאי RFP או CD45.1+ זוהו כתאי AML ונבדקו על ידי ציטומטריית זרימה. לא ניתנו קרינה או מים אנטיביוטיים לעכברים שקיבלו 2° ו-3°.
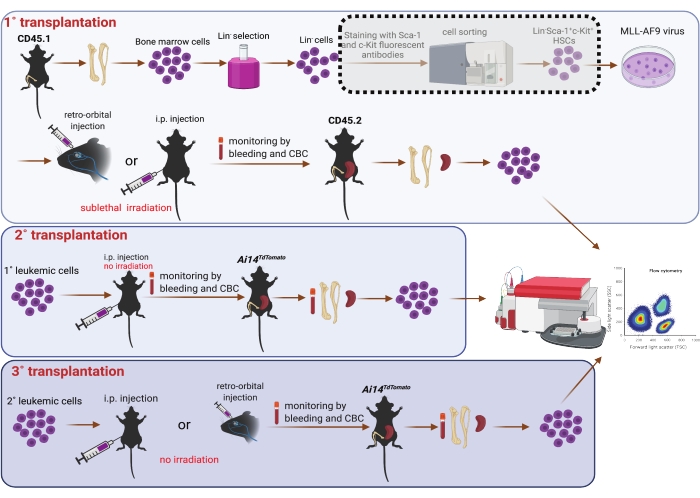
איור 1: סכמה של התמרה נגיפית MLL-AF9 במח עצם HSCs והשתלה סדרתית (1°, 2° ו-3°). מיון אוכלוסיית Sca-1 ו- c-Kit חיובית כפולה באמצעות ממיין תאים המוצג בתיבת ההצללה המנוקדת נחשב אופציונלי, אם המשאבים מאפשרים זאת. הדמות נוצרה באמצעות BioRender (https://biorender.com/). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. שטיפה תוך פריטוניאלית
- הזריקו 5 מ"ל של מדיה IMDM לא שלמה לחלל הצפק פעמיים כדי לאסוף את התאים בצינור סטרילי של 15 מ"ל. צנטריפוגה את מתלה התא בטמפרטורת החדר ו 400 x גרם במשך 3 דקות. השתלת תאי AML (4 x 105 תאים / עכבר) מחלל הצפק של 2° מושתלים באמצעות הזרקת i.p. לעכברים מושתלי CD45.2 3° (n = 3).
7. ניתוח היסטולוגי 28
- בודדו את הטחול, הכבד ועצם הירך מעכברים לאחר המתת חסד. תקן אותם ב 5 מ"ל של 10% (v/v) פורמלין חוצץ. דגמו את הטחול והכבד מעמיתים בריאים להשוואות.
- להטביע רקמות קבועות בפרפין לחתוך אותם לחלקים. צבעו את החלקים בצבעי המטוקסילין ואוזין (H&E).
- קבל את התמונות תחת מיקרוסקופ בהגדלה של פי 20 המותקן עם תוכנה תואמת לניתוח היסטולוגי.
8. ביצוע PCR כמותי למחצה (qPCR)
- הכינו RNA בריאגנט RNA בהתאם להוראות היצרן.
- השתמש ב- RNA של 0.5-1.0 מיקרוגרם כדי לסנתז cDNA באמצעות ערכת שעתוק לאחור cDNA בהתאם להוראות היצרן.
- השתמש ב- cDNA כדי לבצע qPCR באמצעות ערכת qPCR והפעל את הדגימות במערכת qPCR. השתמש בבדיקות TaqMan המאומתות מראש הבאות: KMT2A (MLL; Ref Seq: NM_001197104(2), IDT)29 ו-18S RNA ריבוזומלי (Hs99999901_s1).
- טען את האמפליקונים KMT2A ו- 18S על ג'ל אגרוז 2% כדי להמחיש את הביטוי. קבל תמונות במכונת הדמיה המותקנת עם התוכנה התואמת.
9. עיבוד נתונים
- נתח את התוצאות באמצעות תוכנת ניתוח סטטיסטי והצג את התוצאות כממוצע ± SEM. צור איורים באמצעות כלי אילוסטרייטור מסחרי.
תוצאות
השוואה של יעילות ההשתלה של תאי AML מורין באמצעות r.o. ו- I.P. נתיבי השתלה
בעבר, דווח על הקמת AML של 1° בעכברים מושתלים שהושתלו רטרו עם תאי LSK מומרים MLL-AF9, ויכולת ההשתלה של תאי AML 1° הודגמה על ידי השתלה סדרתית30. המחקר הנוכחי הוא הראשון להעריך את האפשרות להשתמש בתאי מח עצם ל...
Discussion
מחקרים אלה המתוארים לעיל מספקים ראיות תומכות לכך שהשתלת תאי לין דומה לתאי LSK בדור של AML מורין 1°. בנוסף, הנתונים הנוכחיים מראים גם כי הזרקת I.P. היא שיטה יעילה ונוחה לביסוס AML מורין בהשוואה להזרקה תוך ורידית (או r.o.).
בנוסף לתאי LSK, אוכלוסיות אחרות כגון אב גרנולוציטים-מונוציט...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
המחברים מודים למתקן הליבה של ציטומטריית זרימה של מכון האק ולמתקן הליבה להיסטופתולוגיה של המעבדה לאבחון בעלי חיים, המחלקה למדעי הווטרינריה והביו-רפואה, אוניברסיטת פנסילבניה, על מתן תמיכה טכנית בזמן. עבודה זו נתמכה על ידי מענקים מהמכון האמריקאי לחקר הסרטן (KSP), מכללת פן סטייט למדעי החקלאות, מכון הסרטן פן סטייט, פרויקט USDA-NIFA 4771, הצטרפות מספר 00000005 ל- K.S.P. ו- R.F.P.
Materials
| Name | Company | Catalog Number | Comments |
| a-Select competent cells | Bioline | BIO-85027 | |
| Ammonium chloride (NH4Cl) | Sigma Aldrich | Cat# A-9434 | |
| Ampicillin | Sigma Aldrich | Cat# A0797 | |
| Bovine Serum Albumin (BSA), Fraction V—Low-Endotoxin Grade | Gemini bio-products | Cat# 700-102P | |
| Ciprofloxacin HCl | GoldBio.com | Cat# C-861-100 | |
| DMEM, high glucose, no glutamine | Gibco | Cat# 11960-044 | |
| Dulbecco’s Phosphate-Buffered Saline (PBS) | Corning | Cat# 21-031-CV | |
| EDTA, Disodium Salt (EDTA-2Na), Dihydrate, Molecular Biology Grade | Calbiochem | Cat# 324503 | |
| Fetal Bovine Serum - Premium Select | Atlanta Biologicals | Cat# S11550 | |
| Holo-transferrin, bovine | Sigma Aldrich | Cat# T1283 | |
| Insulin solution human | Sigma | Cat# I-9278 | |
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | Cat# 12440-053 | |
| L-glutamine 200 mM (100×) solution | HyClone, Gelifesciences | Cat# SH30034.01 | |
| LB broth, Lennox | NEOGEN | Cat #: 7290A | |
| LB Broth with agar (Miller) | Sigma Aldrich | Cat# L-3147 | |
| Mouse anti-mouse CD45.1 (FITC) | Miltenyi Biotec | Cat# 130-124-211 | |
| Mouse Interleukin-3 (IL-3) | Gemini bio-products | Cat# 300-324P | |
| Mouse Interleukin-6 (IL-6) | Gemini bio-products | Cat# 300-327P | |
| Mouse Stem Cell Factor (SCF) | Gemini bio-products | Cat# 300-348P | |
| Penicillin-Streptomycin Solution, 100x | Corning | Cat# 30-002-CI | |
| Phenix-Eco (pECO) cells | ATCC | CRL-3214 | |
| Potassium Bicarbonate (KHCO3), Granular | JT. Baker | Cat# 2940-01 | |
| Rat anti-mouse CD117 (c-kit) (APC) | BioLegend | Cat # 105812 | |
| Rat anti-mouse Ly-6A/E (Sca-1) (PE-Cy7) | BD Pharmingen | Cat# 558162 | |
| Recombinant Murine Flt3-Ligand | Pepro Tech, INC. | Cat# 250-31L | |
| RetroNectin Recombinant Human Fibronectin Fragment | TaKaRa | Cat# T100A | |
| TransIT-293 Reagent | MirusBio | Cat# MIR 2705 | |
| TRI Reagent | Sigma Aldrich | Cat# T9424 | |
| Trypan Blue Solution, 0.4% | Gibco | Cat # 15250061 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | Cat# 25200-056 | |
| β-Mercaptoethanol (BME) | Sigma Aldrich | Cat# M3148 | |
| Commercial Assays | |||
| EasySep Mouse Hematopoietic Progenitor Cell Isolation Kit | StemCell technologies | Cat# 19856A | |
| High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher | Cat# 4368813 | |
| PerfeCTa qPCR SuperMix | Quanta Bio | Cat# 95051-500 | |
| Plasmid Maxi Kit (25) | Qiagen | Cat#:12163 | |
| Animals | |||
| Ai14TdTomato mice | Jackson Laboratory | Strain # 007914 | |
| CD45.1 C57BL6/J mice | Jackson Laboratory | Strain # 002014 | |
| CD45.2 C57BL6/J mice | Jackson Laboratory | Strain # 000664 | |
| Instruments and Softwares | |||
| Adobe illustrator | Version 25.2.3 | ||
| BD accuri C6 flow cytometer | BD Biosciences | ||
| FlowJo 10.8.0 | BD | ||
| GeneSys software program | Version 1.5.7.0 | ||
| GraphPad Prism version 6 | GraphPad | ||
| Hemavet 950FS | Drew Scientific | ||
| 7300 Real time PCR system | Applied Biosystems | ||
| Syngene G:BOX Chemi XR5 Chemiluminescence Fluorescence Imaging | G:Box Chemi |
References
- Dohner, H., Weisdorf, D. J., Bloomfield, C. D. Acute myeloid leukemia. The New England Journal of Medicine. 373 (12), 1136-1152 (2015).
- Fortier, J. M., Graubert, T. A. Murine models of human acute myeloid leukemia. Cancer Treatment and Research. 145, 183-196 (2010).
- Ernst, P., et al. Definitive hematopoiesis requires the mixed-lineage leukemia gene. Developmental Cell. 6 (3), 437-443 (2004).
- Fisher, J. N., Kalleda, N., Stavropoulou, V., Schwaller, J. The Impact of the cellular origin in acute myeloid leukemia: learning from mouse models. Hemasphere. 3 (1), 152 (2019).
- Zhan, Y., Zhao, Y. Hematopoietic stem cell transplant in mice by intra-femoral injection. Methods in Molecular Biology. 430, 161-169 (2008).
- Price, J. E., Barth, R. F., Johnson, C. W., Staubus, A. E. Injection of cells and monoclonal antibodies into mice: comparison of tail vein and retroorbital routes. Proceedings of the Society for Experimental Biology. 177 (2), 347-353 (1984).
- Yardeni, T., Eckhaus, M., Morris, H. D., Huizing, M., Hoogstraten-Miller, S. Retro-orbital injections in mice. Lab Animal. 40 (5), 155-160 (2011).
- Suckow, M. A., Danneman, P., Brayton, C. . The Laboratory Mouse. , (2001).
- Barr, J. E., Holmes, D. B., Ryan, L. J., Sharpless, S. K. Techniques for the chronic cannulation of the jugular vein in mice. Pharmacology, Biochemistry, and Behavior. 11 (1), 115-118 (1979).
- Kang, Y. Analysis of cancer stem cell metastasis in xenograft animal models. Methods in Molecular Biology. 568, 7-19 (2009).
- Nungestee, W., Wolf, A., Jourdonais, L. Effect of gastric mucin on virulence of bacteria in intraperitoneal injections in the mouse. Proceedings of the Society for Experimental Biology and Medicine. 30 (2), 120-121 (1932).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and part I: anesthetic considerations in preclinical research. ILAR journal. 53 (1), 55-69 (2012).
- Leong, S. -. K., Ling, E. -. A. Labelling neurons with fluorescent dyes administered via intravenous, subcutaneous or intraperitoneal route. Journal of Neuroscience Methods. 32 (1), 15-23 (1990).
- Ma, P., et al. Intraperitoneal injection of magnetic Fe3O4-nanoparticle induces hepatic and renal tissue injury via oxidative stress in mice. International Journal of Nanomedicine. 7, 4809-4918 (2012).
- Schwarze, S. R., Ho, A., Vocero-Akbani, A., Dowdy, S. F. In vivo protein transduction: delivery of a biologically active protein into the mouse. Science. 285 (5433), 1569-1572 (1999).
- Muench, M. O., Chen, J. C., Beyer, A. I., Fomin, M. E. Cellular therapies supplement: the peritoneum as an ectopic site of hematopoiesis following in utero transplantation. Transfusion. 51, 106-117 (2011).
- Zhao, W., et al. Intravenous injection of mesenchymal stem cells is effective in treating liver fibrosis. World Journal of Gastroenterology. 18 (10), 1048 (2012).
- Yousefi, F., Ebtekar, M., Soleimani, M., Soudi, S., Hashemi, S. M. Comparison of in vivo immunomodulatory effects of intravenous and intraperitoneal administration of adipose-tissue mesenchymal stem cells in experimental autoimmune encephalomyelitis (EAE). International Immunopharmacol. 17 (3), 608-616 (2013).
- Cheng, K., et al. Transplantation of bone marrow-derived MSCs improves cisplatinum-induced renal injury through paracrine mechanisms. Experimental and Molecular Pathology. 94 (3), 466-473 (2013).
- Castelo-Branco, M., et al. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 7 (3), 33360 (2012).
- Bazhanov, N., et al. Intraperitoneally infused human mesenchymal stem cells form aggregates with mouse immune cells and attach to peritoneal organs. Stem Cell Research & Therapy. 7, 27 (2016).
- Liu, Q., Chen, L., Atkinson, J. M., Claxton, D. F., Wang, H. G. Atg5-dependent autophagy contributes to the development of acute myeloid leukemia in an MLL-AF9-driven mouse model. Cell Death & Disease. 7 (9), 2361 (2016).
- Wognum, A. W., Eaves, A. C., Thomas, T. E. Identification and isolation of hematopoietic stem cells. Archives of Medical Research. 34 (6), 461-475 (2003).
- Randall, T. D., Weissman, I. L. Characterization of a population of cells in the bone marrow that phenotypically mimics hematopoietic stem cells: resting stem cells or mystery population. Stem Cells. 16 (1), 38-48 (1998).
- Gott, K. M., et al. A comparison of Cs-137 gamma rays and 320-kV X-rays in a mouse bone marrow transplantation model. Dose Response. 18 (2), 1559325820916572 (2020).
- Miner, N. A., Koehler, J., Greenaway, L. Intraperitoneal injection of mice. Applied Microbiology. 17 (2), 250-251 (1969).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Cardiff, R. D., Miller, C. H., Munn, R. J. Manual hematoxylin and eosin staining of mouse tissue sections. Cold Spring Harbor Protocols. 2014 (6), 655-658 (2014).
- Ronan, J. L., Wu, W., Crabtree, G. R. From neural development to cognition: unexpected roles for chromatin. Nature Review Genetics. 14 (5), 347-359 (2013).
- Qian, F., et al. Interleukin-4 treatment reduces leukemia burden in acute myeloid leukemia. FASEB Journal. 36 (5), 22328 (2022).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 442 (7104), 818-822 (2006).
- Chen, W., et al. Malignant transformation initiated by Mll-AF9: gene dosage and critical target cells. Cancer Cell. 13 (5), 432-440 (2008).
- Somervaille, T. C. P., Cleary, M. L. Identification and characterization of leukemia stem cells in murine MLL-AF9 acute myeloid leukemia. Cancer Cell. 10 (4), 257-268 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved