需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于蛋黄抗体的细胞术微球测定的标准化
摘要
该协议描述了一种使用IgY抗体进行抗原检测的乳胶珠制备乳胶珠的方法。
摘要
免疫测定是检测多种分子靶标的重要测试。在目前可用的方法中,细胞仪微球测定在近几十年来越来越突出。设备读取的每个微球代表被测分子之间相互作用能力的分析事件。在一次检测中读取数千个此类事件,从而确保高检测准确性和重现性。该方法还可用于验证用于诊断疾病的新输入,例如IgY抗体。这些抗体是通过用目标抗原对鸡进行免疫,然后从动物鸡蛋的蛋黄中提取免疫球蛋白而获得的;因此,这是一种获得抗体的无痛且高效的方法。除了高精度验证该测定的抗体识别能力的方法外,本文还提出了一种提取这些抗体的方法,确定抗体和乳胶珠的最佳偶联条件,并确定测试的灵敏度。
引言
在旨在诊断疾病的免疫测定技术中,细胞术微球测定已成为一种高度灵敏和可靠的方法,因为它允许在一次测定中分析数千个颗粒1。该技术除了具有高生产率并允许使用较小体积的样品外,还具有极大的灵活性,因为它允许检测多种分子,例如细胞因子,粘附分子,抗体同种型和蛋白质2,3。
不同的颗粒用于开发这些测定,其中包括乳胶珠,这是一种有效且低成本的输入。这些可以在其表面呈现修饰,例如存在允许某些分子共价或非共价偶联的官能团或蛋白质3,4,5。
这些免疫测定使用抗原和抗体等成分来检测疾病标志物,通常需要来自哺乳动物(如小鼠、兔子和山羊)的抗体。这会产生与伦理问题相关的问题,因为哺乳动物的免疫通常需要许多动物才能获得良好的产量,以及导致动物痛苦的程序的频繁执行6,7。另一种方法是使用从免疫鸡的蛋黄中分离的 IgY 抗体,因为在蛋黄中可以找到高浓度的针对接种抗原的特异性抗体;一只鸡的产量相当于在一年内生产 4.3 只兔子 6,7。
因此,该协议的目的是提供一种使用乳胶珠流式细胞术评估从鸡蛋黄中获得的IgY抗体的方法。为此,我们提出了一种使用乳胶珠进行三明治形式的细胞术微球免疫测定的标准化方法。作为模型,我们使用针对恶性疟原虫富含组氨酸的蛋白II抗原(IgY-Pf HRP2)的IgY抗体。我们描述了一种提取抗体的方法,讨论了确定这些抗体与乳胶珠偶联浓度的关键步骤,并评估了抗原的检测限。流式细胞术的高精度,加上乳胶珠的低成本,使该技术适用于免疫测定工具的分析,例如抗体和抗原。该方法可用于检测各种目标。
研究方案
注意:有关本协议中使用的所有材料、试剂和仪器的详细信息,请参阅 材料表 。
1. 从蛋黄中提取IgY。
- 鸡蛋的卫生化
- 将鸡蛋(新鲜产下或产卵后 4 天,来自 Gallus gallus Dekalb White 谱系)浸入 0.2% 稀释的次氯酸钠溶液中,在流水下快速冲洗,然后轻轻擦拭以备后用或立即使用。
注意:如果不立即使用,请在4°C下保持长达15天。
- 将鸡蛋(新鲜产下或产卵后 4 天,来自 Gallus gallus Dekalb White 谱系)浸入 0.2% 稀释的次氯酸钠溶液中,在流水下快速冲洗,然后轻轻擦拭以备后用或立即使用。
- 蛋黄的分离
- 小心地打碎鸡蛋,并在蛋黄分离器的帮助下将蛋黄与蛋白分开。
- 在滤纸的帮助下去除多余的白色。刺穿蛋黄,并将其内部收集到 50 mL 锥形管中。使用前将蛋黄在-20°C下储存至少24小时。
注意:在这些实验中(数据未显示),观察到使用以前未冷冻的蛋黄阻碍了从蛋黄的脂质部分分离免疫球蛋白。
- 蛋黄酸化
- 解冻储存的蛋黄,并在 1 mM PBS 中以 1:10 的比例稀释。用1N HCl将溶液的pH调节至5,并将溶液在4°C孵育6-24小时。
- 将溶液以3,000× g 离心40分钟,回收上清液,并使用0.7mm纤维素过滤器过滤。
- 用辛酸沉淀脂质
- 将上清液的pH值重新调节至5,并在4°C下不断搅拌30分钟,加入辛酸(≥98%初始浓度)至终浓度为8.7%。
注意:上清液的体积可以根据步骤1.3.2中沉淀的脂质质量而变化。因此,例如,应将3.107mL辛酸加入到过滤后获得的35mL上清液中。 - 将样品以18,600× g离心15分钟,并将上清液与沉淀材料分离。
- 使用1M NaOH将溶液的pH值重新调节至7.4,使用Bradford测定8定量抗体,并将抗体储存在-20°C直至使用时间。
注意:抗体的浓度为1μg/μL,通过12%SDS-PAGE凝胶进行验证。
- 将上清液的pH值重新调节至5,并在4°C下不断搅拌30分钟,加入辛酸(≥98%初始浓度)至终浓度为8.7%。
2. IgY抗体对乳胶珠的饱和度曲线
- 磁珠与 IgY 抗体的偶联
- 将 21 μL 1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDC,初始浓度为 367 mM)和 21 μL N-羟基琥珀酰亚胺(NHS,初始浓度为 50 mM)加入 21 μL 乳胶珠 (4% w/v),并用过滤的 10 mM PBS 调节至 2.1 mL 的最终体积。
注意:PBS溶液的pH范围应在7.2和7.4之间,因为在本工作中,当使用超出此范围的溶液时,观察到偶联和其他步骤的负变化。 - 在22°C下快速振荡孵育3小时。
- 将4μg,2μg,1μg,0.5μg,0.25μg,0.125μg和0μg先前提取的捕获抗体IgY-PfHRP2(参见步骤1.4.3)添加到含有步骤2.1.1中所述的100μL溶液(0.04%最终磁珠浓度)的不同微管中,并在与步骤2.1.2中所述的相同条件下孵育16小时。
- 将样品在 15 °C 下以 857 × g 离心 5 分钟,弃去上清液,并使用离心和重悬循环用 500 μL 过滤的 10 mM PBS(0.008% 最终珠浓度)洗涤乳胶珠两次。
注意:不要超过 857 × g,因为在这项工作中,观察到超过此速度的珠子会发生变形,从而对测试结果产生负面影响。
- 将 21 μL 1-乙基-3-(3-二甲氨基丙基)碳二亚胺(EDC,初始浓度为 367 mM)和 21 μL N-羟基琥珀酰亚胺(NHS,初始浓度为 50 mM)加入 21 μL 乳胶珠 (4% w/v),并用过滤的 10 mM PBS 调节至 2.1 mL 的最终体积。
- 阻挡珠子
- 将样品重悬于1mL封闭缓冲液(0.004%最终珠浓度)(过滤10mM PBS +牛血清白蛋白,BSA,5%)中,并在与步骤2.1.2中所述的相同条件下孵育2小时。
- 封闭后,按照步骤2.1.4中的说明洗涤,并重悬于10mM PBS缓冲液中。
- 与标记有Alexa Fluor 488的抗鸡二抗一起孵育
- 如步骤 2.1.3 所述,在 10 mM PBS + 0.5% BSA 中加入 100 μL 稀释至 1:2,000 的荧光抗鸡抗体 (2 mg/mL)。
- 按照步骤2.1.2中所述孵育样品,这次在黑暗中孵育30分钟。
- 按照步骤2.1.4洗涤珠子,并用250μL(0.016%最终珠浓度)过滤的10mM PBS重悬。按照第 5 节所述执行流式细胞仪读数。
注意:从获得的荧光百分比数据中,观察平台形成的初始点(1μg,如本研究中观察到的)。我们建议使用平台的第二个点(2 μg,如此处观察到)进行后续步骤(图1)。
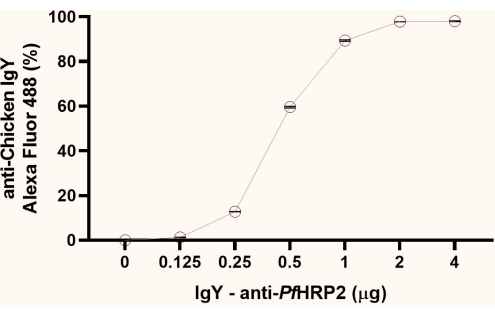
图 1:流式细胞术分析图,用于确定 IgY-Pf HRP2 抗体与乳胶珠偶联的饱和点。x轴表示抗体浓度,Y轴表示获得的荧光百分比。克鲁斯卡尔-瓦利斯检验,p < 0.0033。请点击此处查看此图的大图。
3. 基于乳胶珠的流式细胞术测定抗原检测
- 在确定IgY抗体对乳胶珠的饱和点后,按照步骤2.1.1再次进行磁珠活化过程。
- 将磁珠偶联到观察到的饱和浓度(如步骤2.1.3中所述),并根据步骤2.1.2孵育。
注意:在使用 IgY-PfHRP2 抗体进行的测定中,每 1 μL 乳胶珠的饱和度条件为 2 μg。
- 将磁珠偶联到观察到的饱和浓度(如步骤2.1.3中所述),并根据步骤2.1.2孵育。
- 按照步骤2.2封闭并洗涤珠子。
- 与抗原一起孵育
- 为了确定检测限,将相当于 100 μL 封闭的磁珠制剂分配到含有不同量重组蛋白 PfHRP2 (1 μg/mL)(rPfHRP2、10 μg、1 μg、0.1 μg、0.01 μg、0.001 μg 和 0 μg)的管中,在 10 mM PBS + 0.5% BSA 中稀释,一式三份。
注意:这种重组蛋白是在Sousa等人的工作中开发的9。 - 如步骤2.1.2中所述,将珠溶液与rPfHRP2蛋白孵育1小时。
- 按照步骤2.1.4进行洗涤,离心后弃去上清液。
- 为了确定检测限,将相当于 100 μL 封闭的磁珠制剂分配到含有不同量重组蛋白 PfHRP2 (1 μg/mL)(rPfHRP2、10 μg、1 μg、0.1 μg、0.01 μg、0.001 μg 和 0 μg)的管中,在 10 mM PBS + 0.5% BSA 中稀释,一式三份。
- 与一抗一起孵育
- 在每份样品中加入 2 μg 针对在 10 mM PBS + 0.5% BSA 中稀释的 rPfHRP2 蛋白的小鼠 IgG 抗体至最终体积为 100 μL。按照步骤2.1.2所述孵育样品,并在最后一次离心后弃去上清液。
注意:该抗体是在Sousa等人的工作中开发的9。
- 在每份样品中加入 2 μg 针对在 10 mM PBS + 0.5% BSA 中稀释的 rPfHRP2 蛋白的小鼠 IgG 抗体至最终体积为 100 μL。按照步骤2.1.2所述孵育样品,并在最后一次离心后弃去上清液。
- 与二抗一起孵育
- 向每个样品中加入 100 μL 荧光抗小鼠抗体 (2 mg/mL),在 10 mM PBS + 0.5% BSA 中稀释至 1:2,000。如步骤2.1.2中所述孵育,并重悬于250μL(0.016%最终珠浓度)的过滤10mM PBS中。根据第 5 节进行读取。
4. 流式细胞仪读取样品
- 细胞术设置:将细胞仪的光学参数与计算机耦合对齐
- 打开计算机和流式细胞仪,等待几分钟,让设备连接到计算机。
- 单击计算机上安装的细胞术软件并登录。从软件工作区中,选择 细胞仪 |启动 |清洁模式 |静坐液。
注意:在样品采集前,应在细胞仪启动过程中清除气泡和障碍物。
- 质量管理
- 使用质量控制试剂检查光电倍增管的电压并评估细胞仪的灵敏度。
- 将细胞仪设置试剂和示踪微球放入 12 mm x 75 mm 封盖聚苯乙烯管中。
- 通过涡旋轻轻混合管子。
- 悬浮珠的制备
- 为了确定基线,将 0.5 mL 稀释剂(10 mM 过滤 PBS,pH 7)和三滴珠子添加到 12 mm x 75 mm 封盖聚苯乙烯管中。使用前轻轻涡旋试管。
- 在细胞仪软件工作区中,选择 "细胞仪 |CST,并等待细胞仪与细胞仪软件接口断开连接并连接到CS&T接口。在屏幕底部的细胞仪软件 状态栏 上观察以下消息: 已断开连接的细胞仪。
- 使用装有质量控制试剂的 12 mm x 75 mm 封盖聚苯乙烯管,并将其连接到流式细胞仪探头上。
- 细胞仪配置验证
- 在 "系统摘要 "窗口中,验证细胞仪配置是否适合实验。
- 性能检查的设置
- 选择与CS&T研究珠批次相对应的设置磁珠ID。
- 性能检查
- 将试管连接到流式细胞仪探头,然后单击 设置控制 窗口。选择 检查性能,然后单击 运行。
- 性能检查完成后,等待对话框打开。执行下列操作之一:
- 要查看 细胞仪性能 报告,请单击 查看报告。
- 若要完成性能检查并返回到工作区的设置视图,请单击 "完成"。
- 观察形态学和荧光灵敏度分析的最终结果,如 系统摘要 |状态 为 "通过"的细胞仪性能结果。
- 从细胞仪上取下试管。检查 "系统摘要 "窗口中显示的细胞仪性能结果。
5. 使用流式细胞术进行样品分析
- 登录细胞仪软件。
- 从细胞仪软件工作区中,选择 细胞仪 |清洁模式 |静坐液。
- 调整到软件工作区。
- 根据阴性对照颗粒的形态和荧光特性(无荧光珠)定义设门策略。
- 要确定细胞形态测量,请选择点图图形以使用 SSC-A 分析 FSC-A 参数(补充图 1A)。
- 使用点图通过SSC确定单个细胞,以分析y轴上的SSC-H和x轴的SSC-W(补充图1B),并使用点图通过FSC确定单个细胞,用于分析y轴中的FSC-H和x轴的FSC-W(补充图1C)。
- 对于荧光分析,选择使用FCS-A的FL1点阵图。使用12 mm x 75 mm带塞的聚苯乙烯管,其中包含未标记的样品和先前用单色Alexa Fluor 488标记的样品(补充图1D,E)。
- 在流式细胞术中获取样品。
- 使用含有先前标记样品的 12 mm x 75 mm 带塞聚苯乙烯管。小心混合试管内容物,将试管连接到流式细胞仪探头上,然后左键单击获取。
- 要设置激光器的功率,请单击参数,然后在下面的选项中,将FSC的电压调整为182 V,将SSC的电压调整为236 V。 要设置阈值,请单击细胞仪 |阈值,然后在下面的选项中,将FSC调整为500 V。
- 设置分析门以按大小和复杂性表征颗粒,以及执行单细胞分析。
- 要消除自发荧光,请分析仅含有乳胶珠的无染料样品,并调整检测器的电压:在以下选项中,将FL1(FITC)的电压调整为332 V。
- 从点图中显示的负点以四边形格式设置荧光分析门。
- 调整形态学和荧光分析后,为设备配置 50,000 个事件:在 采集下,单击 记录。
结果
图2提供了 通过酸化 提取IgY抗体的过程,然后使用辛酸进行分离的图形表示(图2)。
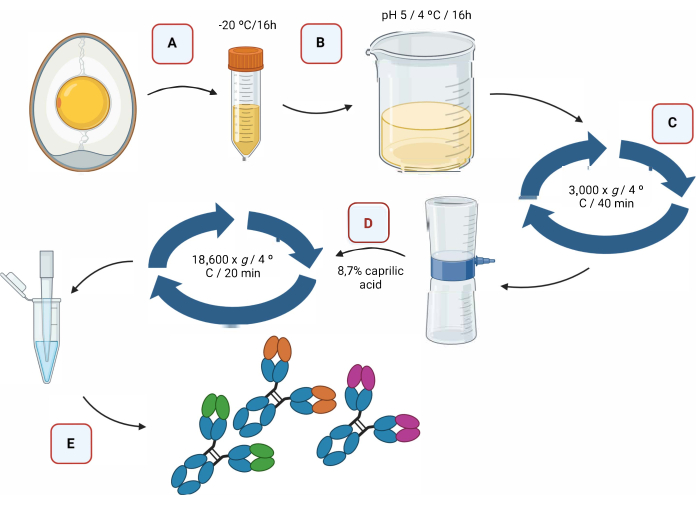
图 2:IgY 抗体的提取步骤和使用辛酸分离的示意图 。 (A)分离蛋黄,在锥形管中回收,冷冻。...
讨论
通过降低pH值然后使用辛酸进行脂质分离来沉淀IgY抗体的方法可有效地分离总抗体而不会损失任何功能。这里提出的方法比Redwan等人报告的方法更简单,更便宜11,后者也使用酸化和辛酸沉淀,但方案更复杂和费力。与常用的从蛋黄中分离IgY的方法相比,该方法也具有优势,例如使用PEG沉淀12,13,硫酸钠14,15和氯仿
披露声明
作者声明与本文的研究、作者身份和出版没有潜在的利益冲突。
致谢
我们要感谢FIOCRUZ("Leônidas e Maria Deane - ILMD/Fiocruz Amazônia-PROEP-LABS/ILMD FIOCRUZ AMAZÔNIA")、生物技术研究生课程(亚马逊联邦大学的PPGBIOTEC - UFAM)、尼加拉瓜佩索阿尔协会(CAPES)和亚马逊国家宪法权利保护基金会(FAPEAM)提供奖学金。图 2 和 图 4 是使用 biorender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| Anti-Chicken IgY (H+L), highly cross-adsorbed, CF 488A antibody produced in donkey | Sigma-Aldrich | SAB4600031 | |
| Anti-mouse IgG (H+L), F(ab′)2 | Sigma-Aldrich | SAB4600388 | |
| BD FACSCanto II | BD Biosciences | BF-FACSC2 | |
| BD FACSDiva CS&T research beads (CS&T research beads) | BD Biosciences | 655050 | |
| BD FACSDiva software 7.0 | BD Biosciences | 655677 | |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Caprilic acid | Sigma-Aldrich | O3907 | |
| Centrifuge 5702 R | Eppendorf | Z606936 | |
| Chloride 37% acid molecular grade | NEON | 02618 NEON | |
| CML latex, 4% w/v | Invitrogen | C37253 | |
| Megafuge 8R | Thermo Scientific | TS-HM8R | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide Hydrochloride Powder (EDC) | Sigma-Aldrich | E7750-1G | |
| N-Hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672-25G | |
| Phosphate buffered saline | Sigma-Aldrich | 1003335620 | |
| Sodium hydroxide | Acs Cientifica | P.10.0594.024.00.27 | |
| Sodium hypochlorite | Acs Cientifica | R09211000 | |
| Thermo Mixer Heat/Cool | KASVI | K80-120R |
参考文献
- Salzer, U., Sack, U., Fuchs, I. Flow cytometry in the diagnosis and follow up of human primary immunodeficiencies. Electronic Journal of the International Federation of Clinical Chemistry and Laboratory. 30 (4), 407 (2019).
- de Figueiredo, A. M., Glória, J. C., Chaves, Y. O., Neves, W. L. L., Mariúba, L. A. M. Diagnostic applications of microsphere-based flow cytometry: A review. Experimental Biology and Medicine. 247 (20), 1852-1861 (2022).
- Morgan, E., et al. Cytometric bead array: A multiplexed assay platform with applications in various areas of biology. Clinical Immunology. 110 (3), 252-266 (2004).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Kellar, K. Multiplexed microsphere-based flow cytometric assays. Experimental Hematology. 30 (11), 1227-1237 (2002).
- Schade, R., et al. Chicken egg yolk antibodies (IgY-technology): A review of progress in production and use in research and human and veterinary medicine. ATLA Alternatives to Laboratory Animals. 33 (2), 129-154 (2005).
- Xu, Y., et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: A review. Biotechnology Advances. 29 (6), 860-868 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Sousa, L. P., et al. A novel polyclonal antibody-based sandwich ELISA for detection of Plasmodium vivax developed from two lactate dehydrogenase protein segments. BMC Infectious Diseases. 14 (1), 49 (2014).
- Klimentzou, P., et al. Development and immunochemical evaluation of antibodies Y for the poorly immunogenic polypeptide prothymosin alpha. Peptides. 27 (1), 183-193 (2006).
- Redwan, E. M., Aljadawi, A. A., Uversky, V. N. Simple and efficient protocol for immunoglobulin Y purification from chicken egg yolk. Poultry Science. 100 (3), 100956 (2021).
- Lee, H. Y., Abeyrathne, E. D. N. S., Choi, I., Suh, J. W., Ahn, D. U. K. Sequential separation of immunoglobulin Y and phosvitin from chicken egg yolk without using organic solvents. Poultry Science. 93 (10), 2668-2677 (2014).
- Pauly, D., Chacana, P., Calzado, E., Brembs, B., Schade, R. IgY Technology: Extraction of chicken antibodies from egg yolk by polyethylene glycol (PEG) precipitation. Journal of Visualized Experiments. (51), e3084 (2011).
- Chang, H. M., Lu, T. C., Chen, C. C., Tu, Y. Y., Hwang, J. Y. Isolation of immunoglobulin from egg yolk by anionic polysaccharides. Journal of Agricultural and Food Chemistry. 48 (4), 995-999 (2000).
- Ko, K. Y., Ahn, D. U. Preparation of immunoglobulin Y from egg yolk using ammonium sulfate precipitation and ion exchange chromatography. Poultry Science. 86 (2), 400-407 (2007).
- Polson, A. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure. Immunological Communications. 19 (3), 253-258 (1990).
- Simonova, M. A., et al. xMAP-based analysis of three most prevalent staphylococcal toxins in Staphylococcus aureus cultures. Analytical and Bioanalytical Chemistry. 406 (25), 6447-6452 (2014).
- Sharma, P., et al. A multiplex assay for detection of staphylococcal and streptococcal exotoxins. PLoS One. 10 (8), e0135986 (2015).
- Merbah, M., et al. Standardization of a cytometric p24-capture bead-assay for the detection of main HIV-subtypes. Journal of Virological Methods. 230, 45-52 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。