このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
卵黄抗体に基づくサイトメトリービーズアッセイの標準化
要約
このプロトコルは、抗原検出にIgY抗体を使用するアッセイ用のラテックスビーズを調製するための方法論を記載しています。
要約
イムノアッセイは、多数の分子標的を検出するための重要な検査です。現在利用可能な方法の中で、サイトメトリービーズアッセイはここ数十年で注目を集めています。装置によって読み取られる各マイクロスフェアは、試験対象の分子間の相互作用能力の分析イベントを表します。これらの数千のイベントが1回のアッセイで読み取られるため、高いアッセイ精度と再現性が保証されます。この方法論は、疾患の診断のためのIgY抗体などの新しいインプットの検証にも使用できます。これらの抗体は、目的の抗原でニワトリを免疫し、動物の卵の卵黄から免疫グロブリンを抽出することによって得られます。したがって、これは抗体を得るための痛みがなく生産性の高い方法です。この論文では、このアッセイの抗体認識能力を高精度に検証するための方法論に加えて、これらの抗体を抽出し、抗体とラテックスビーズの最適なカップリング条件を決定し、テストの感度を決定する方法も提示します。
概要
疾患の診断を目的としたイムノアッセイ技術の中で、サイトメトリービーズアッセイは、1回のアッセイで数千の粒子の分析を可能にするため、高感度で信頼性の高いアプローチとして浮上しています1。この手法は、生産性が高く、少量のサンプルを使用できることに加えて、サイトカイン、接着分子、抗体アイソタイプ、タンパク質などの複数の分子の検出を可能にするため、優れた柔軟性も備えています2,3。
これらのアッセイの開発には、効果的で低コストのインプットであるラテックスビーズなど、さまざまな粒子が使用されます。これらは、特定の分子の共有結合または非共有結合を可能にする官能基またはタンパク質の存在など、それらの表面に修飾を提示することができる3、4、5。
これらのイムノアッセイは、抗原や抗体などの成分を使用して疾患マーカーの検出を行い、一般的にマウス、ウサギ、ヤギなどの哺乳類由来の抗体を必要とします。哺乳類の予防接種は一般に多くの動物が良好な収量を得る必要があり、動物の苦しみにつながる手順を頻繁に実行する必要があるため、これは倫理的問題に関連する問題を引き起こします6,7。これに代わるものは、接種された抗原に対する高濃度の特異的抗体が卵黄中に見出され得るので、免疫されたニワトリの卵黄から単離されたIgY抗体の使用である。鶏肉の生産は、年間4.3匹のウサギの生産に相当します6,7。
したがって、このプロトコルの目的は、ラテックスビーズを用いたフローサイトメトリーを用いて鶏卵黄から得られたIgY抗体を評価する方法を提供することである。そこで我々は,ラテックスビーズを用いたサンドイッチ形式のサイトメトリービーズイムノアッセイの標準化法を提案する.モデルとして、熱帯熱マラリア原虫ヒスチジンリッチプロテインII抗原(IgY-Pf HRP2)を対象としたIgY抗体を使用しました。抗体を抽出する方法について説明し、ラテックスビーズへのこれらの結合濃度を定義するための重要なステップについて説明し、抗原の検出限界の評価を提示します。フローサイトメトリーの精度が高く、ラテックスビーズが低コストであるため、この手法は抗体や抗原などのイムノアッセイツールの分析に適用できます。この方法は、多様なターゲットの検出に使用できます。
プロトコル
注意: このプロトコルで使用されるすべての材料、試薬、および機器に関連する詳細については、 材料表 を参照してください。
1. 卵黄からのIgYの抽出
- 卵の衛生化
- 次亜塩素酸ナトリウムの0.2%希釈溶液に卵(産卵したてまたは産卵後4日まで)を0.2%希釈した次亜塩素酸ナトリウムに浸し、流水ですばやくすすぎ、後でまたはすぐに使用できるように軽く拭きます。
注意: すぐに使用しない場合は、4°Cで最大15日間保管してください。
- 次亜塩素酸ナトリウムの0.2%希釈溶液に卵(産卵したてまたは産卵後4日まで)を0.2%希釈した次亜塩素酸ナトリウムに浸し、流水ですばやくすすぎ、後でまたはすぐに使用できるように軽く拭きます。
- 卵黄の分離
- 卵を慎重に割って、卵黄分離器の助けを借りて卵黄を白から分離します。
- ろ紙の助けを借りて余分な白を取り除きます。卵黄に穴を開け、その内部を50mLの円錐形のチューブに集めます。使用前に卵黄を-20°Cで少なくとも24時間保管してください。
注:これらの実験(データは示されていません)の間、以前に凍結されていなかった卵黄の使用は、卵黄の脂質部分からの免疫グロブリンの単離を妨げることが観察されました。
- 卵黄の酸性化
- 保存した卵黄を解凍し、1 mM PBSで1:10の比率で希釈します。溶液のpHを1 N HClで5に調整し、溶液を4°Cで6〜24時間インキュベートします。
- 溶液を3,000 × g で40分間遠心分離し、上清を回収し、0.7 mmセルロースフィルターを使用してろ過します。
- カプリル酸による脂質の沈殿
- 上清のpHを5に再調整し、カプリル酸(初期濃度≥98%)を4°Cで30分間攪拌しながら終濃度8.7%になるように添加した。
注:上清の量は、ステップ1.3.2で沈殿した脂質量によって異なる場合があります。したがって、例えば、3.107mLのカプリル酸を濾過後に得られた35mLの上清に添加すべきである。 - サンプルを18,600 × gで15分間遠心分離し、沈殿した材料から上清を分離します。
- 1 M NaOHを使用して溶液のpHを7.4に再調整し、ブラッドフォードアッセイ8を使用して抗体を定量し、使用時まで抗体を-20°Cで保存します。
注:抗体は1 μg/μLの濃度で得られ、12%SDS-PAGEゲルによって検証されました。
- 上清のpHを5に再調整し、カプリル酸(初期濃度≥98%)を4°Cで30分間攪拌しながら終濃度8.7%になるように添加した。
2. ラテックスビーズに対するIgY抗体の飽和曲線
- ビーズとIgY抗体のカップリング
- 21 μLの1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC、初期濃度367 mM)と21 μLの N-ヒドロキシスクシンイミド(NHS、初期濃度50 mM)を21 μLのラテックスビーズ(4%w/v)に加え、ろ過した10 mM PBSで最終容量2.1 mLに調整します。
注:この研究では、この範囲外の溶液を使用するとカップリングやその他のステップに負の変化が観察されたため、PBS溶液のpH範囲は7.2〜7.4である必要があります。 - 22°Cで3時間急速に振とうしながらインキュベートします。
- ステップ2.1.1で説明した溶液100 μL(最終ビーズ濃度0.04%)を含む別のマイクロチューブに、4 μg、2 μg、1 μg、0.5 μg、0.25 μg、0.125 μg、0.125 μg、および0 μg(ステップ1.4.3を参照)を追加し、ステップ2.1.2で説明した溶液100 μL(最終ビーズ濃度0.04%)を含む別のマイクロチューブにインキュベートします。
- サンプルを857 × g 、15°Cで5分間遠心分離し、上清を廃棄し、遠心分離および再懸濁サイクルを使用して、500 μLのろ過された10 mM PBS(最終ビーズ濃度0.008%)でラテックスビーズを2回洗浄します。
注:この作業のように、857 × gを超えないようにしてください、この速度を超えると、ビードが変形してテスト結果に悪影響を与えることが観察されました。
- 21 μLの1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC、初期濃度367 mM)と21 μLの N-ヒドロキシスクシンイミド(NHS、初期濃度50 mM)を21 μLのラテックスビーズ(4%w/v)に加え、ろ過した10 mM PBSで最終容量2.1 mLに調整します。
- ビーズをブロックする
- サンプルを1 mLのブロッキングバッファー(最終ビーズ濃度0.004%)(ろ過した10 mM PBS +ウシ血清アルブミン、BSA、5%)に再懸濁し、ステップ2.1.2に記載ののと同じ条件で2時間インキュベートします。
- ブロッキング後、ステップ2.1.4に記載のように洗浄し、10 mM PBSバッファーに再懸濁します。
- Alexa Fluor 488で標識した抗ニワトリ二次抗体とのインキュベーション
- ステップ2.1.3で説明したように、10 mM PBS + 0.5% BSAで1:2,000に希釈した100 μLの蛍光抗ニワトリ抗体(2 mg/mL)を各マイクロチューブに追加します。
- ステップ2.1.2で説明したように、今度は暗闇の中で30分間サンプルをインキュベートします。
- ステップ2.1.4と同様にビーズを洗浄し、250 μL(最終ビーズ濃度0.016%)でろ過した10 mM PBSで再懸濁します。セクション5の説明に従ってフローサイトメーターの読み取りを実行します。
注:得られた蛍光パーセンテージデータから、プラトー形成の初点(この研究で観察された1μg)を観察します。次のステップでは、プラトーの2番目のポイント(ここで観察された2 μg)を使用することをお勧めします(図1)。
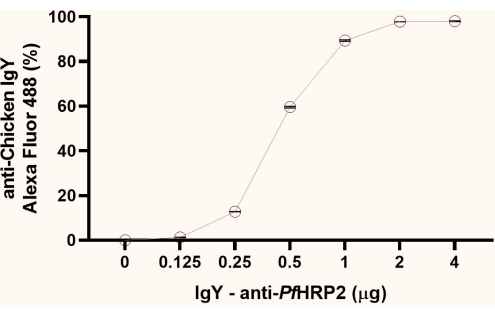
図1:ラテックスビーズに結合するIgY-Pf HRP2抗体の飽和点を決定するためのフローサイトメトリー分析のグラフ。X軸は抗体濃度を表し、Y軸は得られた蛍光の割合を表す。クラスカル・ウォリス検定、p<0.0033。この図の拡大版を表示するには、ここをクリックしてください。
3. 抗原検出のためのラテックスビーズを用いたフローサイトメトリーアッセイ
- ラテックスビーズに対するIgY抗体の飽和点を決定した後、ステップ2.1.1に従ってビーズ活性化プロセスを再度実行します。
- 観察された飽和濃度でビーズを結合し(ステップ2.1.3で説明)、ステップ2.1.2に従ってインキュベートします。
注:IgY-PfHRP2抗体を用いて実施したアッセイでは、飽和条件はラテックスビーズ1 μLごとに2 μgでした。
- 観察された飽和濃度でビーズを結合し(ステップ2.1.3で説明)、ステップ2.1.2に従ってインキュベートします。
- ステップ2.2に従ってビーズをブロックして洗浄します。
- 抗原とのインキュベーション
- 検出限界を決定するには、100 μL相当のブロックビーズ調製物を、10 mM PBS + 0.5% BSAで三重に希釈した異なる量の組換えタンパク質 Pf HRP2 (1 μg/mL) (r PfHRP2、10 μg、1 μg、0.1 μg、0.01 μg、0.001 μg、0.0001 μg、および 0 μg) を含むチューブに分配します。
注:この組換えタンパク質は、Sousaらの研究で開発されました9。 - ステップ2.1.2で説明したように、ビーズ溶液をrPfHRP2タンパク質とともに1時間インキュベートします。
- ステップ2.1.4で説明したように洗浄を行い、遠心分離後に上清を廃棄します。
- 検出限界を決定するには、100 μL相当のブロックビーズ調製物を、10 mM PBS + 0.5% BSAで三重に希釈した異なる量の組換えタンパク質 Pf HRP2 (1 μg/mL) (r PfHRP2、10 μg、1 μg、0.1 μg、0.01 μg、0.001 μg、0.0001 μg、および 0 μg) を含むチューブに分配します。
- 一次抗体とのインキュベーション
- 10 mM PBS + 0.5% BSAで希釈したrPfHRP2タンパク質に対するマウスIgG抗体2 μgを、各サンプルの最終容量100 μLまで加えます。ステップ2.1.2の説明に従ってサンプルをインキュベートし、最後の遠心分離後に上清を廃棄します。
注:この抗体は、Sousaらの研究で開発されました9。
- 10 mM PBS + 0.5% BSAで希釈したrPfHRP2タンパク質に対するマウスIgG抗体2 μgを、各サンプルの最終容量100 μLまで加えます。ステップ2.1.2の説明に従ってサンプルをインキュベートし、最後の遠心分離後に上清を廃棄します。
- 二次抗体とのインキュベーション
- 10 mM PBS + 0.5% BSAで1:2,000に希釈した蛍光抗マウス抗体(2 mg/mL)100 μLを各サンプルに加えます。ステップ2.1.2で説明したようにインキュベートし、ろ過した10 mM PBSの250 μL(最終ビーズ濃度0.016%)に再懸濁します。セクション5に従って読み取りを実行します。
4. サンプルのフローサイトメーターの読み取り
- サイトメトリー設定:コンピュータに結合されたサイトメーターの光学パラメータの調整
- コンピューターとフローサイトメーターの電源を入れ、機器がコンピューターに接続するまで数分待ちます。
- コンピューターにインストールされているサイトメトリーソフトウェアをクリックしてログインします。ソフトウェアワークスペースから、 サイトメーター |スタートアップ |クリーンモード |SIT流体。
注:気泡や障害物は、サンプル取得前のサイトメーター開始プロセス中に除去する必要があります。
- 品質管理
- 品質管理試薬を使用して、光電子増倍管の電圧をチェックし、サイトメーターの感度を評価します。
- サイトメーターのセットアップ試薬とトラッキングビーズを、キャップ付き 12 mm x 75 mm のポリスチレンチューブに入れます。
- ボルテックスでチューブを静かに混ぜます。
- 懸濁ビーズの調製
- ベースラインを定義するには、0.5 mLの希釈液(10 mMろ過PBS、pH 7)と3滴のビーズを12 mm x 75 mmのキャップ付きポリスチレンチューブに加えます。使用前にチューブを静かにボルテックスしてください。
- サイトメーターソフトウェアのワークスペースで、 サイトメーター |CSTを実行し、サイトメーターがサイトメーターソフトウェアインターフェースから切断され、CS&Tインターフェースに接続するのを待ちます。画面下部のサイトメーター ソフトウェア のステータス バー に「 サイトメーターが切断されました」というメッセージが表示されます。
- 品質管理試薬を含むキャップ付き12 mm x 75 mmのポリスチレンチューブを使用し、フローサイトメータープローブに取り付けます。
- サイトメーター構成の検証
- [ システムの概要 ] ウィンドウで、サイトメーターの構成が実験に適していることを確認します。
- パフォーマンスチェックのセットアップ
- CS&T研究用ビーズのロットに対応するセットアップビーズのIDを選択します。
- 性能確認
- チューブをフローサイトメータープローブに取り付け、 セットアップコントロール ウィンドウをクリックします。[ パフォーマンスの確認] を選択し、[ 実行] をクリックします。
- パフォーマンス チェックが完了したら、ダイアログ ボックスが開くまで待ちます。次のいずれかの操作を行います。
- サイトメーターのパフォーマンスレポートを表示するには、[レポートの表示]をクリックします。
- パフォーマンスチェックを完了してワークスペースのセットアップビューに戻るには、[ 完了]をクリックします。
- システムサマリーに表示される形態測定および蛍光感度分析の最終結果を観察する |ステータスが PASSED のサイトメーターパフォーマンス結果。
- サイトメーターからチューブを取り外します。 [システムの概要 ] ウィンドウに表示されるサイトメーターのパフォーマンス結果を確認します。
5. フローサイトメトリーを用いたサンプル解析
- サイトメーターソフトウェアにログインします。
- サイトメーターソフトウェアのワークスペースから、 サイトメーター |クリーンモード |SIT流体。
- ソフトウェアワークスペースに合わせて調整します。
- ネガティブコントロール粒子の形態測定および蛍光特性(蛍光のないビーズ)に基づいてゲーティング戦略を定義します。
- 細胞形態測定を決定するには、SSC-Aを使用してFSC-Aパラメータを分析するためにドットプロットプロットグラフィックを選択します(補足図1A)。
- y軸のSSC-Hとx軸のSSC-Wの分析にはドットプロットプロットグラフィックを使用してSSCで単一セルを決定し(補足図1B)、y軸のFSC-Hとx軸のFSC-Wの分析にはドットプロットプロットグラフィックを使用してFSCで単一セルを決定します(補足図1C)。
- 蛍光分析には、FCS-Aを使用したFL1ドットプロットプロットを選択します。ラベルのないサンプルと、単色のAlexa Fluor 488でラベル付けされたサンプルを含む12 mm x 75 mmのストッパー付きポリスチレンチューブを使用します(補足図1D、E)。
- フローサイトメトリーでサンプルを取得します。
- 以前にラベル付けされたサンプルを含む12 mm x 75 mmのストッパー付きポリスチレンチューブを使用します。チューブの内容物を注意深く混合し、チューブをフローサイトメータープローブに取り付けて、Acquireを左クリックします。
- レーザーの出力を設定するには、[パラメータ]をクリックし、以下のオプションで、FSCの電圧を182 Vに、SSCの電圧を236 Vに調整します。 しきい値を設定するには、サイトメーター|しきい値、および以下のオプションで、FSCを500 Vに調整します。
- 解析ゲートを設定して、サイズと複雑さによって粒子を特徴付け、単一セル解析を実行します。
- 自家蛍光を除去するには、ラテックスビーズのみを含む色素フリーサンプルを分析し、検出器の電圧を調整します:以下のオプションで、FL1(FITC)の電圧を332Vに調整します。
- 蛍光解析ゲートをドットプロットグラフに示す負の点から四角形に設定する。
- 形態測定および蛍光分析を調整したら、50,000イベント用にデバイスを構成します: [取得]で、[ 記録]をクリックします。
結果
図2は、酸性化 による IgY抗体の抽出プロセスと、それに続くカプリル酸を使用した分離のグラフ表示です(図2)。
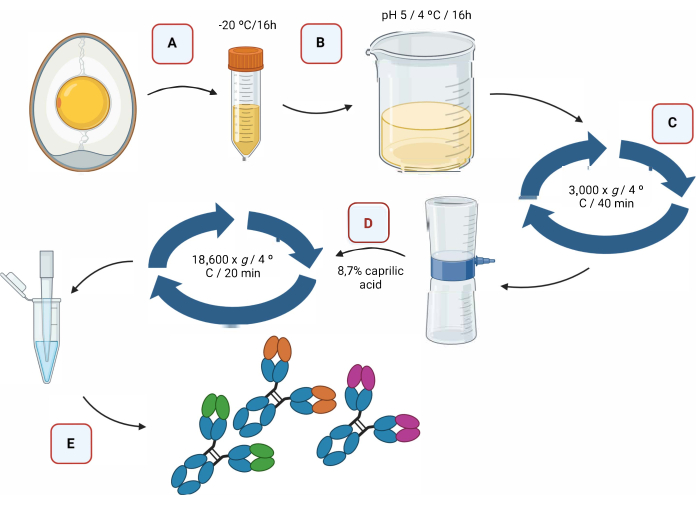
図2:カプリル酸を用いたIgY抗体の抽出工程および分離の概略図 。 (a
ディスカッション
pH低下によるIgY抗体の沈殿法とそれに続くカプリル酸を用いた脂質分離法は、機能を損なうことなく全抗体を単離するのに効率的である。ここで提案された方法は、酸性化とカプリル酸による沈殿を使用したRedwanら11によって報告されたものよりも単純で安価ですが、より複雑で面倒なプロトコルを使用しています。この方法はまた、PEG沈殿12,13、硫酸ナトリウム
開示事項
著者は、この記事の研究、著者、および公開に関して潜在的な利益相反を宣言しません。
謝辞
FIOCRUZ (「プログラム・デ・エクセレンシア・エム・ペスキサ・バシカ・エ・アプリカダ・エ・アプリカダ・エム・サウデ・ドス・ラボラトリオス・ド・インスティトゥート・レオニダス・エ・マリア・ディーン-ILMD/フィオクルス・アマゾニア-ILMD/FIOCRUZ AMAZÔNIA」)、バイオテクノロジー大学院プログラム(アマゾナス連邦大学-UFAM)、ペソアル・デ・ニベル研究所(CAPES)、および奨学金を提供してくれたアンパロ・ア・ペスキサ・ド・エスタード・ド・アマゾナス財団(FAPEAM)に感謝します。図 2 と 図 4 は biorender.com で作成したものです。
資料
| Name | Company | Catalog Number | Comments |
| Anti-Chicken IgY (H+L), highly cross-adsorbed, CF 488A antibody produced in donkey | Sigma-Aldrich | SAB4600031 | |
| Anti-mouse IgG (H+L), F(ab′)2 | Sigma-Aldrich | SAB4600388 | |
| BD FACSCanto II | BD Biosciences | BF-FACSC2 | |
| BD FACSDiva CS&T research beads (CS&T research beads) | BD Biosciences | 655050 | |
| BD FACSDiva software 7.0 | BD Biosciences | 655677 | |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Caprilic acid | Sigma-Aldrich | O3907 | |
| Centrifuge 5702 R | Eppendorf | Z606936 | |
| Chloride 37% acid molecular grade | NEON | 02618 NEON | |
| CML latex, 4% w/v | Invitrogen | C37253 | |
| Megafuge 8R | Thermo Scientific | TS-HM8R | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide Hydrochloride Powder (EDC) | Sigma-Aldrich | E7750-1G | |
| N-Hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672-25G | |
| Phosphate buffered saline | Sigma-Aldrich | 1003335620 | |
| Sodium hydroxide | Acs Cientifica | P.10.0594.024.00.27 | |
| Sodium hypochlorite | Acs Cientifica | R09211000 | |
| Thermo Mixer Heat/Cool | KASVI | K80-120R |
参考文献
- Salzer, U., Sack, U., Fuchs, I. Flow cytometry in the diagnosis and follow up of human primary immunodeficiencies. Electronic Journal of the International Federation of Clinical Chemistry and Laboratory. 30 (4), 407 (2019).
- de Figueiredo, A. M., Glória, J. C., Chaves, Y. O., Neves, W. L. L., Mariúba, L. A. M. Diagnostic applications of microsphere-based flow cytometry: A review. Experimental Biology and Medicine. 247 (20), 1852-1861 (2022).
- Morgan, E., et al. Cytometric bead array: A multiplexed assay platform with applications in various areas of biology. Clinical Immunology. 110 (3), 252-266 (2004).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Kellar, K. Multiplexed microsphere-based flow cytometric assays. Experimental Hematology. 30 (11), 1227-1237 (2002).
- Schade, R., et al. Chicken egg yolk antibodies (IgY-technology): A review of progress in production and use in research and human and veterinary medicine. ATLA Alternatives to Laboratory Animals. 33 (2), 129-154 (2005).
- Xu, Y., et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: A review. Biotechnology Advances. 29 (6), 860-868 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Sousa, L. P., et al. A novel polyclonal antibody-based sandwich ELISA for detection of Plasmodium vivax developed from two lactate dehydrogenase protein segments. BMC Infectious Diseases. 14 (1), 49 (2014).
- Klimentzou, P., et al. Development and immunochemical evaluation of antibodies Y for the poorly immunogenic polypeptide prothymosin alpha. Peptides. 27 (1), 183-193 (2006).
- Redwan, E. M., Aljadawi, A. A., Uversky, V. N. Simple and efficient protocol for immunoglobulin Y purification from chicken egg yolk. Poultry Science. 100 (3), 100956 (2021).
- Lee, H. Y., Abeyrathne, E. D. N. S., Choi, I., Suh, J. W., Ahn, D. U. K. Sequential separation of immunoglobulin Y and phosvitin from chicken egg yolk without using organic solvents. Poultry Science. 93 (10), 2668-2677 (2014).
- Pauly, D., Chacana, P., Calzado, E., Brembs, B., Schade, R. IgY Technology: Extraction of chicken antibodies from egg yolk by polyethylene glycol (PEG) precipitation. Journal of Visualized Experiments. (51), e3084 (2011).
- Chang, H. M., Lu, T. C., Chen, C. C., Tu, Y. Y., Hwang, J. Y. Isolation of immunoglobulin from egg yolk by anionic polysaccharides. Journal of Agricultural and Food Chemistry. 48 (4), 995-999 (2000).
- Ko, K. Y., Ahn, D. U. Preparation of immunoglobulin Y from egg yolk using ammonium sulfate precipitation and ion exchange chromatography. Poultry Science. 86 (2), 400-407 (2007).
- Polson, A. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure. Immunological Communications. 19 (3), 253-258 (1990).
- Simonova, M. A., et al. xMAP-based analysis of three most prevalent staphylococcal toxins in Staphylococcus aureus cultures. Analytical and Bioanalytical Chemistry. 406 (25), 6447-6452 (2014).
- Sharma, P., et al. A multiplex assay for detection of staphylococcal and streptococcal exotoxins. PLoS One. 10 (8), e0135986 (2015).
- Merbah, M., et al. Standardization of a cytometric p24-capture bead-assay for the detection of main HIV-subtypes. Journal of Virological Methods. 230, 45-52 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved