JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
달걀 노른자 항체를 기반으로 한 세포 측정 비드 분석의 표준화
요약
이 프로토콜은 항원 검출을 위해 IgY 항체를 사용하여 분석용 라텍스 비드를 제조하는 방법론을 설명합니다.
초록
면역 측정법은 수많은 분자 표적의 검출을위한 중요한 검사입니다. 현재 사용 가능한 방법 중에서 세포 측정 비드 분석은 최근 수십 년 동안 두각을 나타내고 있습니다. 장비에서 판독하는 각 마이크로스피어는 테스트 중인 분자 간의 상호 작용 용량에 대한 분석 이벤트를 나타냅니다. 이러한 수천 개의 이벤트가 단일 분석에서 판독되므로 높은 분석 정확도와 재현성이 보장됩니다. 이 방법론은 질병 진단을 위한 IgY 항체와 같은 새로운 투입물의 검증에도 사용할 수 있습니다. 이 항체는 관심 항원으로 닭을 면역시킨 다음 동물 알의 노른자에서 면역 글로불린을 추출하여 얻습니다. 따라서 이것은 항체를 얻기위한 고통이없고 매우 생산적인 방법입니다. 이 분석법의 항체 인식 능력에 대한 고정밀 검증을 위한 방법론 외에도 이 논문은 이러한 항체를 추출하고, 항체와 라텍스 비드에 대한 최상의 결합 조건을 결정하고, 검사의 민감도를 결정하는 방법을 제시합니다.
서문
질병 진단을 목표로 하는 면역분석 기법 중에서, 세포측정 비드 분석법은 단일 분석법으로 수천 개의 입자를 분석할 수 있기 때문에 매우 민감하고 신뢰할 수 있는 접근법으로 부상하고 있다1. 이 기술은 생산성이 높고 소량의 샘플을 사용할 수있을뿐만 아니라 사이토 카인, 접착 분자, 항체 이소 타입 및 단백질 2,3과 같은 여러 분자를 검출 할 수 있기 때문에 유연성이 뛰어납니다.
이러한 분석법의 개발에는 다양한 입자가 사용되며, 그 중 라텍스 비드는 효과적이고 저렴한 투입물입니다. 이들은 특정 분자의 공유 또는 비공유 결합을 허용하는 작용기 또는 단백질의 존재와 같은 표면에 변형을 나타낼 수 있습니다 3,4,5.
이러한 면역검정은 항원 및 항체와 같은 성분을 사용하여 질병 마커의 검출을 수행하며 일반적으로 생쥐, 토끼 및 염소와 같은 포유류의 항체를 필요로 합니다. 이것은 포유류의 예방 접종이 일반적으로 많은 동물들이 좋은 수확량을 얻을뿐만 아니라 동물의 고통을 초래하는 절차의 빈번한 수행을 요구하기 때문에 윤리적 문제와 관련된 문제를 야기한다 6,7. 이에 대한 대안은 접종 된 항원에 대한 고농도의 특정 항체가 노른자에서 발견 될 수 있기 때문에 면역 화 된 닭의 난황에서 분리 된 IgY 항체를 사용하는 것입니다. 닭의 생산은 6,7 년 동안 4.3 마리의 토끼를 생산하는 것과 같습니다.
따라서, 이 프로토콜의 목적은 라텍스 비드를 이용한 유세포 분석을 사용하여 닭고기 달걀 노른자로부터 수득된 IgY 항체를 평가하는 방법을 제공하는 것이다. 이를 위해 라텍스 비드를 이용한 샌드위치 형태의 세포측정 비드 면역분석법의 표준화 방법을 제안한다. 모델로서 우리는 Plasmodium falciparum 히스티딘이 풍부한 단백질 II 항원(IgY-Pf HRP2)에 대한 IgY 항체를 사용했습니다. 우리는 항체를 추출하는 방법을 설명하고, 라텍스 비드에 대한 이들의 결합 농도를 정의하기 위한 중요한 단계를 논의하고, 항원 검출 한계에 대한 평가를 제시합니다. 유세포 분석의 높은 정확도와 저렴한 라텍스 비드 비용으로 인해 이 기술은 항체 및 항원과 같은 면역분석 도구의 분석에 적용할 수 있습니다. 이 방법은 다양한 표적을 탐지하는 데 사용할 수 있습니다.
프로토콜
알림: 이 프로토콜에 사용된 모든 재료, 시약 및 기기와 관련된 자세한 내용은 재료 표를 참조하십시오.
1. 달걀 노른자에서 IgY 추출
- 계란의 위생
- 달걀(갓 낳은 것 또는 낳은 후 4일까지, 갈루스 갈루스 데칼브 화이트 혈통에서)을 0.2% 희석된 차아염소산나트륨 용액에 담그고 흐르는 물에 빠르게 헹구고 나중에 또는 즉시 사용할 수 있도록 부드럽게 닦습니다.
알림: 즉시 사용하지 않을 경우 최대 15일 동안 4°C에서 보관하십시오.
- 달걀(갓 낳은 것 또는 낳은 후 4일까지, 갈루스 갈루스 데칼브 화이트 혈통에서)을 0.2% 희석된 차아염소산나트륨 용액에 담그고 흐르는 물에 빠르게 헹구고 나중에 또는 즉시 사용할 수 있도록 부드럽게 닦습니다.
- 노른자의 분리
- 계란을 조심스럽게 깨고 노른자 분리기를 사용하여 노른자를 흰색에서 분리하십시오.
- 여과지를 사용하여 여분의 흰색을 제거하십시오. 노른자를 뚫고 내부를 50mL 원뿔형 튜브에 모은다. 사용하기 전에 노른자를 -20 °C에서 최소 24시간 동안 보관하십시오.
참고: 이러한 실험(데이터는 표시되지 않음) 동안 이전에 냉동되지 않은 노른자를 사용하면 노른자의 지질 부분에서 면역글로불린이 분리되는 것을 방해하는 것으로 관찰되었습니다.
- 노른자의 산성화
- 저장된 노른자를 해동하고 1mM PBS에 1:10 비율로 희석합니다. 용액의 pH를 1 N HCl로 5로 조정하고, 용액을 4°C에서 6-24시간 동안 인큐베이션한다.
- 용액을 3,000 × g 에서 40 분 동안 원심 분리하고, 상청액을 회수하고, 0.7 mm 셀룰로오스 필터를 사용하여 여과한다.
- 카프릴산을 이용한 지질의 침전
- 상층액의 pH를 5로 재조정하고, 4°C에서 30분 동안 일정한 교반 하에 카프릴산(≥98% 초기 농도)을 최종 농도 8.7%로 첨가한다.
참고: 상청액의 부피는 1.3.2단계에서 침전된 지질 질량에 따라 달라질 수 있습니다. 따라서, 예를 들어, 3.107 mL의 카 프릴 산을 여과 후 얻은 상청액 35 mL에 첨가해야한다. - 샘플을 18,600 × g에서 15 분 동안 원심 분리하고, 침전 된 물질로부터 상청액을 분리한다.
- 1 M NaOH를 사용하여 용액의 pH를 7.4로 재조정하고, 브래드포드 분석(8)을 사용하여 항체를 정량하고, 사용 시점까지 항체를 -20°C에서 보관한다.
참고: 항체는 1μg/μL의 농도로 얻었으며 12% SDS-PAGE 젤을 사용하여 확인했습니다.
- 상층액의 pH를 5로 재조정하고, 4°C에서 30분 동안 일정한 교반 하에 카프릴산(≥98% 초기 농도)을 최종 농도 8.7%로 첨가한다.
2. 라텍스 비드에 대한 IgY 항체의 포화 곡선
- IgY 항체에 대한 비드의 커플링
- 21μL의 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드(EDC, 초기 농도 367mM)와 21μL의 N-하이드록시숙신이미드(NHS, 초기 농도 50mM)를 21μL의 라텍스 비드(4% w/v)에 추가하고 여과된 10mM PBS로 최종 부피 2.1mL로 조정합니다.
참고: PBS 용액의 pH 범위는 7.2에서 7.4 사이여야 하는데, 이 작업에서 이 범위를 벗어난 용액을 사용할 때 커플링 및 기타 단계의 음의 변화가 관찰되었기 때문입니다. - 22°C에서 3시간 동안 빠르게 진탕하여 배양합니다.
- 4 μg, 2 μg, 1 μg, 0.5 μg, 0.25 μg, 0.125 μg 및 0 μg의 이전에 추출된 포획 항체 IgY-PfHRP2 (단계 1.4.3 참조)를 2.1.1 단계 (0.04% 최종 비드 농도)에 기재된 용액 100 μL를 함유하는 상이한 마이크로튜브에 첨가하고, 단계 2.1.2에 기재된 것과 동일한 조건 하에서 16시간 동안 인큐베이션한다.
- 샘플을 15°C에서 857× g 에서 5분 동안 원심분리하고, 상층액을 버리고, 원심분리 및 재현탁 사이클을 사용하여 여과된 10mM PBS(0.008% 최종 비드 농도)의 500μL로 라텍스 비드를 2회 세척합니다.
참고: 이 작업에서와 같이 857× g을 초과하지 마십시오.이 속도를 초과하면 비드가 변형되어 테스트 결과가 부정적으로 변경되는 것으로 관찰되었습니다.
- 21μL의 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드(EDC, 초기 농도 367mM)와 21μL의 N-하이드록시숙신이미드(NHS, 초기 농도 50mM)를 21μL의 라텍스 비드(4% w/v)에 추가하고 여과된 10mM PBS로 최종 부피 2.1mL로 조정합니다.
- 비드 차단
- 1mL의 블로킹 완충액(0.004% 최종 비드 농도)(여과된 10mM PBS + 소 혈청 알부민, BSA, 5%)에 샘플을 재현탁하고 2.1.2 단계에 설명된 것과 동일한 조건에서 2시간 동안 배양합니다.
- 블로킹 후, 단계 2.1.4에 기재된 바와 같이 세척하고, 10 mM PBS 완충액에 재현탁시킨다.
- Alexa Fluor 488로 표지된 항닭 2차 항체를 사용한 배양
- 2.1.3단계에 설명된 대로 100mM PBS + 0.5% BSA에서 1:2,000으로 희석된 100μL의 형광 항닭 항체(mg/mL)를 각 마이크로튜브에 추가합니다.
- 2.1.2 단계에 설명된 대로 샘플을 이번에는 어둠 속에서 30분 동안 배양합니다.
- 단계 2.1.4에서와 같이 비드를 세척하고, 여과된 10 mM PBS (0.016% 최종 비드 농도)의 250 μL로 재현탁시켰다. 섹션 5에 설명된 대로 유세포 분석기 판독을 수행합니다.
참고: 형광 백분율에서tage 얻은 데이터에서 고원 형성의 초기 지점(이 연구에서 관찰된 1μg)을 관찰합니다. 다음 단계를 위해 고원의 두 번째 지점(여기에서 관찰된 대로 2μg)을 사용하는 것이 좋습니다(그림 1).
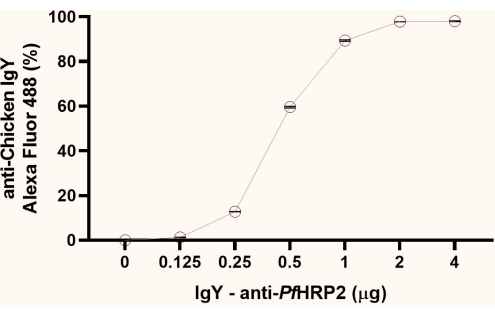
도 1: 라텍스 비드에 커플링된 IgY-Pf HRP2 항체의 포화점을 결정하기 위한 유세포 분석 그래프. x축은 항체 농도를 나타내고 Y축은 얻은 형광 백분율을 나타냅니다. Kruskal-Wallis 검정, p < 0.0033. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 항원 검출을 위한 라텍스 비드 기반 유세포 분석
- 라텍스 비드에 대한 IgY 항체의 포화점을 결정한 후, 단계 2.1.1에 따라 비드 활성화 과정을 다시 수행한다.
- 관찰된 포화 농도에서 비드를 커플링하고(단계 2.1.3에 설명된 대로), 단계 2.1.2에 따라 배양합니다.
참고: IgY-PfHRP2 항체를 사용하여 수행된 분석에서 포화 조건은 라텍스 비드 1μL당 2μg이었습니다.
- 관찰된 포화 농도에서 비드를 커플링하고(단계 2.1.3에 설명된 대로), 단계 2.1.2에 따라 배양합니다.
- 단계 2.2에 따라 비드를 차단하고 세척합니다.
- 항원과의 배양
- 검출 한계를 결정하기 위해, 10 mM PBS + 0.5% BSA에 3 회 희석한 재조합 단백질 Pf HRP2 (1 μg/mL) (r PfHRP2, 10 μg, 1 μg, 0.1 μg, 0.01 μg, 0.001 μg, 0.0001 μg 및 0 μg)를 포함하는 튜브에 100 μL의 차단된 비드 제제를 분배한다.
참고: 이 재조합 단백질은 Sousa et al.9의 연구에서 개발되었습니다. - 비드 용액을 단계 2.1.2에 기재된 바와 같이 r, Pf,HRP2 단백질과 함께 1시간 동안 인큐베이션한다.
- 단계 2.1.4에 설명된 대로 세척을 수행하고 원심분리 후 상청액을 버립니다.
- 검출 한계를 결정하기 위해, 10 mM PBS + 0.5% BSA에 3 회 희석한 재조합 단백질 Pf HRP2 (1 μg/mL) (r PfHRP2, 10 μg, 1 μg, 0.1 μg, 0.01 μg, 0.001 μg, 0.0001 μg 및 0 μg)를 포함하는 튜브에 100 μL의 차단된 비드 제제를 분배한다.
- 1차 항체를 사용한 인큐베이션
- 10 mM PBS + 0.5 % BSA로 희석 된 rPfHRP2 단백질에 대해 2 μg의 마우스 IgG 항체를 각 샘플의 100 μL의 최종 부피에 첨가하십시오. 단계 2.1.2에 기술된 바와 같이 샘플을 인큐베이션하고, 마지막 원심분리 후에 상청액을 버린다.
참고: 이 항체는 Sousa et al.9의 연구에서 개발되었습니다.
- 10 mM PBS + 0.5 % BSA로 희석 된 rPfHRP2 단백질에 대해 2 μg의 마우스 IgG 항체를 각 샘플의 100 μL의 최종 부피에 첨가하십시오. 단계 2.1.2에 기술된 바와 같이 샘플을 인큐베이션하고, 마지막 원심분리 후에 상청액을 버린다.
- 2차 항체를 사용한 인큐베이션
- 10mM PBS + 0.5% BSA에서 1:2,000으로 희석된 형광 항마우스 항체(2mg/mL) 100μL를 각 샘플에 추가합니다. 단계 2.1.2에 기재된 바와 같이 인큐베이션하고, 여과된 10 mM PBS의 250 μL (0.016% 최종 비드 농도)에 재현탁시킨다. 섹션 5에 따라 읽기를 수행하십시오.
4. 샘플의 유세포 분석기 판독
- 세포분석 설정: 컴퓨터에 연결된 세포분석기의 광학 파라미터 정렬
- 컴퓨터와 유세포 분석기를 켜고 장비가 컴퓨터에 연결될 때까지 몇 분 정도 기다립니다.
- 컴퓨터에 설치된 세포 분석 소프트웨어를 클릭하고 로그인하십시오. 소프트웨어 작업 공간에서 Cytometer | 스타트업 | 클린 모드 | SIT 유체.
참고: 기포와 장애물은 샘플 획득 전에 세포분석기 개시 과정에서 제거해야 합니다.
- 품질 관리
- 품질 관리 시약을 사용하여 광전자 증배관의 전압을 확인하고 세포분석기의 감도를 평가합니다.
- 세포분석기 설정 시약과 추적 비드를 12mm x 75mm 캡이 있는 폴리스티렌 튜브에 넣습니다.
- 소용돌이치면서 튜브를 부드럽게 혼합하십시오.
- 현탁액 비드의 제조
- 기준선을 정의하기 위해 0.5mL의 희석제(10mM 여과된 PBS, pH 7)와 비드 3방울을 12mm x 75mm 캡이 있는 폴리스티렌 튜브에 추가합니다. 사용하기 전에 튜브를 부드럽게 소용돌이치십시오.
- Cytometer 소프트웨어 작업 공간에서 Cytometer | CST를 실행하고 세포분석기가 세포분석기 소프트웨어 인터페이스에서 연결을 끊고 CS&T 인터페이스에 연결될 때까지 기다립니다. 화면 하단의 유세포분석기 소프트웨어 상태 표시줄 에 Disconnected Cytometer(연결이 끊긴 유세포분석기) 메시지가 표시됩니다.
- 품질 관리 시약이 들어 있는 12mm x 75mm 캡이 있는 폴리스티렌 튜브를 사용하여 유세포 분석기 프로브에 부착합니다.
- 세포분석기 구성 확인
- System Summary(시스템 요약) 창에서 Cytometer(세포분석기) 구성이 실험에 적합한지 확인합니다.
- 성능 검사 설정
- CS&T 연구용 비드의 로트에 해당하는 셋업 비드의 ID를 선택합니다.
- 성능 검사
- 튜브를 유세포 분석기 프로브에 부착하고 설정 제어 창을 클릭합니다. Check Performance(성능 확인)를 선택하고 Run(실행)을 클릭합니다.
- 성능 검사가 완료되면 대화 상자가 열릴 때까지 기다립니다. 다음 중 하나를 수행합니다.
- Cytometer Performance 보고서를 보려면 View Report(보고서 보기)를 클릭합니다.
- 성능 검사를 완료하고 작업 공간의 설정 보기로 돌아가려면 마침을 클릭합니다.
- 형태 측정 및 형광 민감도 분석의 최종 결과를 관찰합니다. PASSED 상태의 Cytometer Performance Result(세포분석기 성능 결과)입니다.
- 세포분석기에서 튜브를 제거합니다. System Summary(시스템 요약 ) 창에 표시된 Cytometer 성능 결과를 확인합니다.
5. 유세포 분석을 이용한 시료 분석
- 세포분석기 소프트웨어에 로그인합니다.
- Cytometer 소프트웨어 작업 공간에서 Cytometer | 클린 모드 | SIT 유체.
- 소프트웨어 작업 공간에 맞게 조정합니다.
- 음성 대조군 입자의 형태 측정 및 형광 특성(형광이 없는 비드)을 기반으로 게이팅 전략을 정의합니다.
- 세포 형태 측정을 결정하려면 SSC-A를 사용하여 FSC-A 파라미터를 분석하기 위해 Dot Plot Plot Graphic을 선택합니다(보충 그림 1A).
- y축의 SSC-H 및 x축의 SSC-W를 분석하기 위한 Dot Plot Plot Graphic을 이용하여 SSC로 단세포를 결정하고(보충도 1B), y축의 FSC-H 및 x축의 FSC-W의 분석을 위한 Dot Plot Plot Graphic을 이용하여 FSC로 단세포를 결정한다 (보충도 1C).
- 형광 분석의 경우 FCS-A를 사용한 FL1 도트 플롯 플롯을 선택합니다. 라벨이 없는 샘플과 이전에 단색 Alexa Fluor 488로 라벨링된 샘플이 들어 있는 12mm x 75mm 스토퍼 폴리스티렌 튜브를 사용하십시오(보충 그림 1D, E).
- 유세포 분석에서 샘플을 획득합니다.
- 이전에 라벨이 부착된 샘플이 들어 있는 12mm x 75mm 마개 폴리스티렌 튜브를 사용합니다. 튜브 내용물을 조심스럽게 혼합하고 튜브를 유세포 분석기 프로브에 부착한 다음 Acquire를 마우스 왼쪽 버튼으로 클릭합니다.
- 레이저의 출력을 설정하려면 매개 변수를 클릭하고 아래 옵션에서 FSC의 전압을 182V로, SSC의 전압을 236V로 조정하십시오. 임계값을 설정하려면 Cytometer | 임계값을 설정하고 아래 옵션에서 FSC를 500V로 조정합니다.
- 분석 게이트를 설정하여 크기 및 복잡성에 따라 입자를 특성화하고 단일 세포 분석을 수행합니다.
- 자가형광을 제거하려면 라텍스 비드만 포함된 무염료 시료를 분석하고 검출기의 전압을 조정합니다: 아래 옵션에서 FL1(FITC)의 전압을 332V로 조정합니다.
- 형광 분석 게이트를 도트 플롯 그래프에 표시된 음의 점에서 사각형 형식으로 설정합니다.
- 형태 측정 및 형광 분석이 조정된 후 50,000개의 이벤트에 대해 장치를 구성합니다. 획득에서 기록을 클릭합니다.
결과
그림 2는 산성화를 통한 IgY 항체의 추출 과정과 카프릴산을 사용한 분리를 그래픽으로 보여줍니다(그림 2).
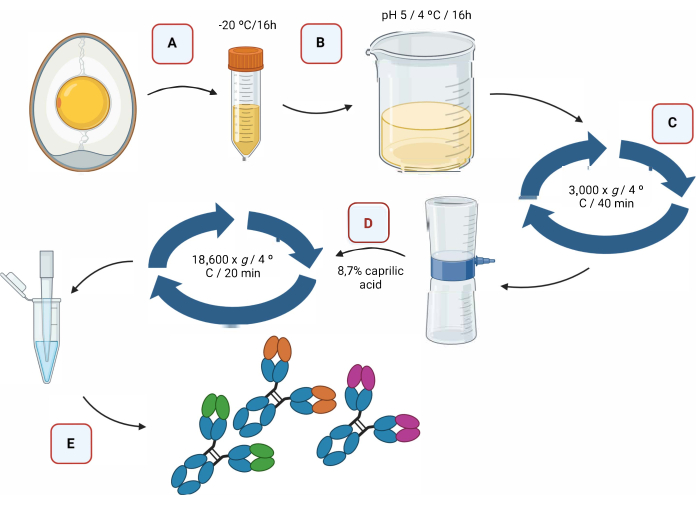
그림 2: IgY 항체의 추출 단계 및 카프릴산을 사용한 분리의 개략도 . (A) ?...
토론
pH 감소에 의한 IgY 항체의 침전 후 카프릴산을 이용한 지질 분리의 방법은 기능성 손실 없이 전체 항체를 분리하는데 효율적이다. 여기에서 제안된 방법은 Redwan et al.11에 의해 보고된 방법보다 간단하고 저렴하며, 산성화 및 카프릴산에 의한 침전도 사용했지만 더 복잡하고 힘든 프로토콜을 사용했습니다. 이 방법은 또한 PEG 침전 12,13, 황산나트륨 14,15 ?...
공개
저자는 이 기사의 연구, 저자 및 출판과 관련하여 잠재적인 이해 상충을 선언하지 않습니다.
감사의 말
장학금을 제공해주신 FIOCRUZ ("Programa de excelência em pesquisa básica e aplicada em saúde dos laboratórios do Instituto Leônidas e Maria Deane - ILMD/Fiocruz Amazônia-PROEP-LABS/ILMD FIOCRUZ AMAZÔNIA"), 생명공학 대학원 프로그램(PPGBIOTEC at the Universidade Federal do Amazonas - UFAM), Coordenação de Aperfeiçoamento de Pessoal de Nível (CAPES) 및 Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM)에 장학금을 제공해주신 데 대해 감사드립니다. 그림 2와 그림 4는 biorender.com 로 만들어졌습니다.
자료
| Name | Company | Catalog Number | Comments |
| Anti-Chicken IgY (H+L), highly cross-adsorbed, CF 488A antibody produced in donkey | Sigma-Aldrich | SAB4600031 | |
| Anti-mouse IgG (H+L), F(ab′)2 | Sigma-Aldrich | SAB4600388 | |
| BD FACSCanto II | BD Biosciences | BF-FACSC2 | |
| BD FACSDiva CS&T research beads (CS&T research beads) | BD Biosciences | 655050 | |
| BD FACSDiva software 7.0 | BD Biosciences | 655677 | |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Caprilic acid | Sigma-Aldrich | O3907 | |
| Centrifuge 5702 R | Eppendorf | Z606936 | |
| Chloride 37% acid molecular grade | NEON | 02618 NEON | |
| CML latex, 4% w/v | Invitrogen | C37253 | |
| Megafuge 8R | Thermo Scientific | TS-HM8R | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide Hydrochloride Powder (EDC) | Sigma-Aldrich | E7750-1G | |
| N-Hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672-25G | |
| Phosphate buffered saline | Sigma-Aldrich | 1003335620 | |
| Sodium hydroxide | Acs Cientifica | P.10.0594.024.00.27 | |
| Sodium hypochlorite | Acs Cientifica | R09211000 | |
| Thermo Mixer Heat/Cool | KASVI | K80-120R |
참고문헌
- Salzer, U., Sack, U., Fuchs, I. Flow cytometry in the diagnosis and follow up of human primary immunodeficiencies. Electronic Journal of the International Federation of Clinical Chemistry and Laboratory. 30 (4), 407 (2019).
- de Figueiredo, A. M., Glória, J. C., Chaves, Y. O., Neves, W. L. L., Mariúba, L. A. M. Diagnostic applications of microsphere-based flow cytometry: A review. Experimental Biology and Medicine. 247 (20), 1852-1861 (2022).
- Morgan, E., et al. Cytometric bead array: A multiplexed assay platform with applications in various areas of biology. Clinical Immunology. 110 (3), 252-266 (2004).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Kellar, K. Multiplexed microsphere-based flow cytometric assays. Experimental Hematology. 30 (11), 1227-1237 (2002).
- Schade, R., et al. Chicken egg yolk antibodies (IgY-technology): A review of progress in production and use in research and human and veterinary medicine. ATLA Alternatives to Laboratory Animals. 33 (2), 129-154 (2005).
- Xu, Y., et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: A review. Biotechnology Advances. 29 (6), 860-868 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Sousa, L. P., et al. A novel polyclonal antibody-based sandwich ELISA for detection of Plasmodium vivax developed from two lactate dehydrogenase protein segments. BMC Infectious Diseases. 14 (1), 49 (2014).
- Klimentzou, P., et al. Development and immunochemical evaluation of antibodies Y for the poorly immunogenic polypeptide prothymosin alpha. Peptides. 27 (1), 183-193 (2006).
- Redwan, E. M., Aljadawi, A. A., Uversky, V. N. Simple and efficient protocol for immunoglobulin Y purification from chicken egg yolk. Poultry Science. 100 (3), 100956 (2021).
- Lee, H. Y., Abeyrathne, E. D. N. S., Choi, I., Suh, J. W., Ahn, D. U. K. Sequential separation of immunoglobulin Y and phosvitin from chicken egg yolk without using organic solvents. Poultry Science. 93 (10), 2668-2677 (2014).
- Pauly, D., Chacana, P., Calzado, E., Brembs, B., Schade, R. IgY Technology: Extraction of chicken antibodies from egg yolk by polyethylene glycol (PEG) precipitation. Journal of Visualized Experiments. (51), e3084 (2011).
- Chang, H. M., Lu, T. C., Chen, C. C., Tu, Y. Y., Hwang, J. Y. Isolation of immunoglobulin from egg yolk by anionic polysaccharides. Journal of Agricultural and Food Chemistry. 48 (4), 995-999 (2000).
- Ko, K. Y., Ahn, D. U. Preparation of immunoglobulin Y from egg yolk using ammonium sulfate precipitation and ion exchange chromatography. Poultry Science. 86 (2), 400-407 (2007).
- Polson, A. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure. Immunological Communications. 19 (3), 253-258 (1990).
- Simonova, M. A., et al. xMAP-based analysis of three most prevalent staphylococcal toxins in Staphylococcus aureus cultures. Analytical and Bioanalytical Chemistry. 406 (25), 6447-6452 (2014).
- Sharma, P., et al. A multiplex assay for detection of staphylococcal and streptococcal exotoxins. PLoS One. 10 (8), e0135986 (2015).
- Merbah, M., et al. Standardization of a cytometric p24-capture bead-assay for the detection of main HIV-subtypes. Journal of Virological Methods. 230, 45-52 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유