Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estandarización de un ensayo citométrico de perlas basado en anticuerpos de yema de huevo
En este artículo
Resumen
Este protocolo describe una metodología para la preparación de perlas de látex para ensayos con anticuerpos IgY para la detección de antígenos.
Resumen
Los inmunoensayos son pruebas importantes para la detección de numerosas dianas moleculares. Entre los métodos disponibles en la actualidad, el ensayo citométrico de perlas ha ganado protagonismo en las últimas décadas. Cada microesfera que es leída por el equipo representa un evento de análisis de la capacidad de interacción entre las moléculas bajo prueba. Miles de estos eventos se leen en un solo ensayo, lo que garantiza una alta precisión y reproducibilidad del ensayo. Esta metodología también se puede utilizar en la validación de nuevos insumos, como los anticuerpos IgY, para el diagnóstico de enfermedades. Estos anticuerpos se obtienen a través de la inmunización de pollos con el antígeno de interés y luego la extracción de la inmunoglobulina de la yema de los huevos de los animales; Por lo tanto, este es un método indoloro y altamente productivo para obtener los anticuerpos. Además de una metodología para la validación de alta precisión de la capacidad de reconocimiento de anticuerpos de este ensayo, este artículo también presenta un método para extraer estos anticuerpos, determinar las mejores condiciones de acoplamiento para los anticuerpos y las perlas de látex, y determinar la sensibilidad de la prueba.
Introducción
Entre las técnicas de inmunoensayo destinadas al diagnóstico de enfermedades, el ensayo de perlas citométricas se ha convertido en un enfoque altamente sensible y fiable, ya que permite el análisis de miles de partículas en un solo ensayo1. Esta técnica, además de tener una alta productividad y permitir el uso de volúmenes más pequeños de muestras, también presenta una gran flexibilidad, ya que permite la detección de varias moléculas, como citoquinas, moléculas de adhesión, isotipos de anticuerpos y proteínas 2,3.
Para el desarrollo de estos ensayos se utilizan diferentes partículas, entre ellas las perlas de látex, que son un insumo efectivo y de bajo costo. Estos pueden presentar modificaciones en su superficie, como la presencia de grupos funcionales o proteínas que permiten el acoplamiento covalente o no covalente de ciertas moléculas 3,4,5.
Estos inmunoensayos utilizan componentes como antígenos y anticuerpos para realizar la detección de marcadores de enfermedades y, por lo general, requieren anticuerpos de mamíferos como ratones, conejos y cabras. Esto crea problemas relacionados con cuestiones éticas, ya que la inmunización de los mamíferos generalmente requiere de muchos animales para obtener un buen rendimiento, así como la frecuente realización de procedimientos que conducen al sufrimiento de los animales 6,7. Una alternativa a esto es el uso de anticuerpos IgY aislados de las yemas de huevo de pollos inmunizados, ya que en las yemas se pueden encontrar altas concentraciones de los anticuerpos específicos contra los antígenos inoculados; La producción de un pollo equivale a la producción de 4,3 conejos en el transcurso de un año 6,7.
Por lo tanto, el objetivo de este protocolo es proporcionar un método para evaluar los anticuerpos IgY obtenidos de yemas de huevo de gallina mediante citometría de flujo con perlas de látex. Para ello, proponemos un método de estandarización para un inmunoensayo citométrico de perlas en formato sándwich utilizando perlas de látex. Como modelo, utilizamos anticuerpos IgY dirigidos al antígeno de la proteína II rica en histidina de Plasmodium falciparum (IgY-PfHRP2). Describimos un método para extraer los anticuerpos, discutimos los pasos críticos para definir la concentración de acoplamiento de estos a las perlas de látex y presentamos una evaluación del límite de detección del antígeno. La alta precisión de la citometría de flujo, junto con el bajo costo de las perlas de látex, hacen que esta técnica sea aplicable para el análisis de herramientas de inmunoensayo, como anticuerpos y antígenos. Este método se puede utilizar para la detección de diversos objetivos.
Protocolo
NOTA: Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, reactivos e instrumentos utilizados en este protocolo.
1. Extracción de IgY de yemas de huevo
- Higienización de los óvulos
- Sumerja los huevos (recién puestos o hasta 4 días después de la puesta, del linaje Gallus gallus Dekalb White) en una solución diluida al 0,2% de hipoclorito de sodio, enjuague rápidamente con agua corriente y limpie suavemente para su uso posterior o inmediato.
NOTA: Si no se utiliza inmediatamente, manténgalo a 4 °C durante un máximo de 15 días.
- Sumerja los huevos (recién puestos o hasta 4 días después de la puesta, del linaje Gallus gallus Dekalb White) en una solución diluida al 0,2% de hipoclorito de sodio, enjuague rápidamente con agua corriente y limpie suavemente para su uso posterior o inmediato.
- Separación de las yemas
- Rompe el huevo con cuidado, y separa la yema de la clara con ayuda de un separador de yemas.
- Retira el exceso de blanco con ayuda de papel de filtro. Perfore la yema y recoja su interior en un tubo cónico de 50 ml. Conservar la yema a -20 °C durante al menos 24 h antes de su uso.
NOTA: Durante estos experimentos (datos no mostrados), se observó que el uso de yemas que no habían sido congeladas previamente dificultaba el aislamiento de inmunoglobulinas de la porción lipídica de las yemas.
- Acidificación de las yemas
- Descongelar la yema almacenada y diluirla en una proporción de 1:10 en PBS de 1 mM. Ajustar el pH de la solución a 5 con 1 N HCl, e incubar la solución a 4 °C durante 6-24 h.
- Centrifugar la solución a 3.000 × g durante 40 min, recuperar el sobrenadante y filtrarlo con un filtro de celulosa de 0,7 mm.
- Precipitación de lípidos con ácido caprílico
- Reajustar el pH de los sobrenadantes a 5 y añadir el ácido caprílico (≥concentración inicial del 98%) hasta una concentración final del 8,7% con agitación constante durante 30 min a 4 °C.
NOTA: El volumen del sobrenadante puede variar en función de la masa lipídica precipitada en el paso 1.3.2. Así, por ejemplo, se deben añadir 3,107 mL de ácido caprílico a 35 mL del sobrenadante obtenido tras la filtración. - Centrifugar las muestras durante 15 min a 18.600 × g, y separar el sobrenadante del material precipitado.
- Vuelva a ajustar el pH de la solución a 7,4 utilizando NaOH 1 M, cuantifique los anticuerpos utilizando el ensayo de Bradford8 y almacene los anticuerpos a -20 °C hasta el momento de su uso.
NOTA: Los anticuerpos se obtuvieron a una concentración de 1 μg/μL, la cual se verificó mediante un gel SDS-PAGE al 12%.
- Reajustar el pH de los sobrenadantes a 5 y añadir el ácido caprílico (≥concentración inicial del 98%) hasta una concentración final del 8,7% con agitación constante durante 30 min a 4 °C.
2. Curva de saturación de anticuerpos IgY frente a perlas de látex
- Acoplamiento de las perlas a los anticuerpos IgY
- Añadir 21 μL de 1-etil-3-(3-dimetilaminopropil)carbodiimida (EDC, concentración inicial de 367 mM) y 21 μL de N-hidroxisuccinimida (NHS, concentración inicial de 50 mM) a 21 μL de perlas de látex (4% p/v), y ajustar a un volumen final de 2,1 mL con PBS filtrado de 10 mM.
NOTA: El rango de pH de la solución de PBS debe estar entre 7.2 y 7.4, ya que en este trabajo se observó un cambio negativo en el acoplamiento y otros pasos al usar una solución fuera de este rango. - Incubar a 22 °C con agitación rápida durante 3 h.
- Añadir 4 μg, 2 μg, 1 μg, 0,5 μg, 0,25 μg, 0,125 μg y 0 μg del anticuerpo de captura IgY-PfHRP2 previamente extraído (ver paso 1.4.3) a diferentes microtubos que contengan 100 μl de la solución descrita en el paso 2.1.1 (0,04% de concentración final de perlas), e incubar en las mismas condiciones descritas en el paso 2.1.2 durante 16 h.
- Centrifugar las muestras a 857 × g a 15 °C durante 5 min, desechar los sobrenadantes y lavar las perlas de látex dos veces con 500 μL de PBS filtrado de 10 mM (0,008% de concentración final de perlas) mediante ciclos de centrifugación y resuspensión.
NOTA: No exceda los 857 × g, ya que en este trabajo, se observó que más allá de esta velocidad las cuentas sufren deformaciones que alteran negativamente el resultado de la prueba.
- Añadir 21 μL de 1-etil-3-(3-dimetilaminopropil)carbodiimida (EDC, concentración inicial de 367 mM) y 21 μL de N-hidroxisuccinimida (NHS, concentración inicial de 50 mM) a 21 μL de perlas de látex (4% p/v), y ajustar a un volumen final de 2,1 mL con PBS filtrado de 10 mM.
- Bloqueo de las cuentas
- Resuspender las muestras en 1 ml de tampón de bloqueo (0,004% de concentración final de perlas) (10 mM de PBS filtrado + albúmina sérica bovina, BSA, 5%) e incubar en las mismas condiciones descritas en el paso 2.1.2 durante 2 h.
- Después del bloqueo, lavar como se describe en el paso 2.1.4 y volver a suspender en un tampón PBS de 10 mM.
- Incubación con anticuerpos secundarios anti-pollo marcados con Alexa Fluor 488
- Añadir 100 μL de anticuerpo fluorescente anti-pollo (2 mg/mL) diluido a 1:2.000 en 10 mM de PBS + 0,5% de BSA a cada microtubo, como se describe en el paso 2.1.3.
- Incubar las muestras como se describe en el paso 2.1.2, esta vez en la oscuridad, durante 30 min.
- Lave las perlas como en el paso 2.1.4 y vuelva a suspenderlas con 250 μL de 10 mM de PBS filtrado de 10 mM (0,016% de concentración final de perlas). Realice la lectura del citómetro de flujo como se describe en la sección 5.
NOTA: A partir de los datos de porcentaje de fluorescencia obtenidos, obsérvese el punto inicial de formación de la meseta (1 μg, como se observa en este estudio). Recomendamos utilizar el segundo punto de la meseta (2 μg, como se observa aquí) para los siguientes pasos (Figura 1).
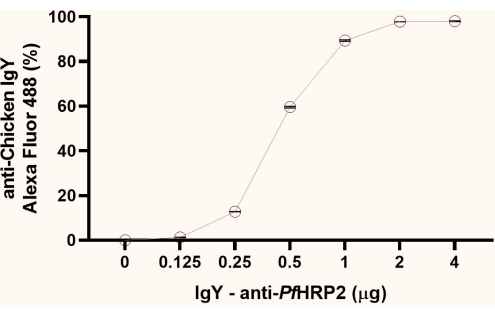
Figura 1: Gráfico del análisis de citometría de flujo para determinar el punto de saturación del acoplamiento del anticuerpo IgY-PfHRP2 a las perlas de látex. El eje x representa la concentración de anticuerpos y el eje Y representa el porcentaje de fluorescencia obtenido. Prueba de Kruskal-Wallis, p < 0,0033. Haga clic aquí para ver una versión más grande de esta figura.
3. Ensayo de citometría de flujo basado en perlas de látex para la detección de antígenos
- Después de determinar el punto de saturación de los anticuerpos IgY frente a las perlas de látex, vuelva a realizar el proceso de activación de las perlas, de acuerdo con el paso 2.1.1.
- Acoplar las perlas a la concentración de saturación observada (como se describe en el paso 2.1.3) e incubar de acuerdo con el paso 2.1.2.
NOTA: En los ensayos realizados con el anticuerpo IgY-Pf HRP2, la condición de saturación fue de 2 μg por cada 1 μL de perlas de látex.
- Acoplar las perlas a la concentración de saturación observada (como se describe en el paso 2.1.3) e incubar de acuerdo con el paso 2.1.2.
- Bloquee y lave las cuentas de acuerdo con el paso 2.2.
- Incubación con el antígeno
- Para determinar el límite de detección, distribuya el equivalente a 100 μL de la preparación de gránulos bloqueados en tubos que contengan diferentes cantidades de la proteína recombinante Pf HRP2 (1 μg/mL) (r PfHRP2, 10 μg, 1 μg, 0,1 μg, 0,01 μg, 0,001 μg, 0,0001 μg y 0 μg) diluidos en 10 mM de PBS + 0,5% de BSA por triplicado.
NOTA: Esta proteína recombinante fue desarrollada en el trabajo de Sousa et al.9. - Incubar las soluciones de perlas con la proteína rPfHRP2 como se describe en el paso 2.1.2 durante 1 h.
- Realice los lavados como se describe en el paso 2.1.4 y deseche el sobrenadante después de la centrifugación.
- Para determinar el límite de detección, distribuya el equivalente a 100 μL de la preparación de gránulos bloqueados en tubos que contengan diferentes cantidades de la proteína recombinante Pf HRP2 (1 μg/mL) (r PfHRP2, 10 μg, 1 μg, 0,1 μg, 0,01 μg, 0,001 μg, 0,0001 μg y 0 μg) diluidos en 10 mM de PBS + 0,5% de BSA por triplicado.
- Incubación con el anticuerpo primario
- Añadir 2 μg de anticuerpo IgG de ratón contra la proteína rPfHRP2 diluido en 10 mM de PBS + 0,5% de BSA hasta un volumen final de 100 μL en cada muestra. Incubar las muestras como se describe en el paso 2.1.2 y desechar el sobrenadante después de la última centrifugación.
NOTA: Este anticuerpo fue desarrollado en el trabajo de Sousa et al.9.
- Añadir 2 μg de anticuerpo IgG de ratón contra la proteína rPfHRP2 diluido en 10 mM de PBS + 0,5% de BSA hasta un volumen final de 100 μL en cada muestra. Incubar las muestras como se describe en el paso 2.1.2 y desechar el sobrenadante después de la última centrifugación.
- Incubación con el anticuerpo secundario
- Añadir 100 μL de anticuerpo fluorescente anti-ratón (2 mg/mL) diluido a 1:2.000 en 10 mM de PBS + 0,5% de BSA a cada muestra. Incubar como se describe en el paso 2.1.2 y volver a suspender en 250 μL (0,016% de concentración final de perlas) de PBS filtrado de 10 mM. Realice la lectura de acuerdo con la sección 5.
4. Lectura del citómetro de flujo de las muestras
- Ajuste de citometría: Alineación de los parámetros ópticos del citómetro acoplado a un ordenador
- Encienda la computadora y el citómetro de flujo, y espere unos minutos para que el equipo se conecte a la computadora.
- Haga clic en el software de citometría instalado en la computadora e inicie sesión en él. En el espacio de trabajo de software, seleccione Citómetro | Puesta en marcha | Modo limpio | Líquidos SIT.
NOTA: Las burbujas de aire y las obstrucciones deben eliminarse durante el proceso de inicio del citómetro antes de la adquisición de la muestra.
- Control de calidad
- Utilice el reactivo de control de calidad para comprobar los voltajes de los tubos fotomultiplicadores y evaluar la sensibilidad del citómetro.
- Coloque el reactivo de configuración del citómetro y las perlas de seguimiento en un tubo de poliestireno con tapa de 12 mm x 75 mm.
- Mezcle suavemente el tubo mediante vórtice.
- Preparación de las perlas de suspensión
- Para definir la línea de base, agregue 0,5 ml de diluyente (10 mM de PBS filtrado, pH 7) y tres gotas de perlas al tubo de poliestireno tapado de 12 mm x 75 mm. Agite el tubo suavemente antes de usarlo.
- En el espacio de trabajo del software del citómetro, seleccione Citómetro | CST y espere a que el citómetro se desconecte de la interfaz del software del citómetro y se conecte a la interfaz CS&T. Observe el siguiente mensaje en la barra de estado del software del citómetro en la parte inferior de la pantalla: Citómetro desconectado.
- Utilice el tubo de poliestireno con tapa de 12 mm x 75 mm que contiene el reactivo de control de calidad y conéctelo a la sonda del citómetro de flujo.
- Verificación de la configuración del citómetro
- En la ventana Resumen del sistema , compruebe que la configuración del citómetro es adecuada para el experimento.
- Configuración para una comprobación de rendimiento
- Seleccione el ID de las cuentas de configuración correspondiente al lote de cuentas de investigación de CS&T.
- Comprobación del rendimiento
- Conecte el tubo a la sonda del citómetro de flujo y haga clic en la ventana Control de configuración . Seleccione Comprobar rendimiento y haga clic en Ejecutar.
- Una vez completada la comprobación de rendimiento, espere a que se abra un cuadro de diálogo. Realice una de las siguientes acciones:
- Para ver el informe de rendimiento del citómetro , haga clic en Ver informe.
- Para completar la comprobación de rendimiento y volver a la vista de configuración del espacio de trabajo, haga clic en Finalizar.
- Observe el resultado final del análisis morfométrico y de sensibilidad a la fluorescencia que aparece en Resumen del sistema | Resultado de rendimiento del citómetro con el estado PASSED.
- Retire el tubo del citómetro. Compruebe los resultados de rendimiento del citómetro que se muestran en la ventana Resumen del sistema .
5. Análisis de muestras mediante citometría de flujo
- Inicie sesión en el software del citómetro.
- En el espacio de trabajo del software del citómetro, seleccione Citómetro | Modo limpio | Líquidos SIT.
- Ajústese al espacio de trabajo del software.
- Definir la estrategia de compuerta en función de las características morfométricas y de fluorescencia de las partículas de control negativo (perlas sin fluorescencia).
- Para determinar la morfometría de la célula, elija Gráfico de diagrama de puntos para el análisis de los parámetros FSC-A utilizando SSC-A (Figura complementaria 1A).
- Determine celdas individuales por SSC usando el gráfico de diagrama de puntos para el análisis de SSC-H en el eje y y SSC-W en el eje x (Figura complementaria 1B), y determine celdas individuales por FSC usando el gráfico de diagrama de puntos para el análisis de FSC-H en el eje y y FSC-W en el eje x (Figura complementaria 1C).
- Para los análisis de fluorescencia, elija Diagramas de puntos FL1 utilizando FCS-A. Utilice un tubo de poliestireno con tapón de 12 mm x 75 mm que contenga muestras sin etiquetar y muestras previamente etiquetadas con Alexa Fluor 488 de un solo color (Figura complementaria 1D, E).
- Adquirir la muestra en citometría de flujo.
- Utilice un tubo de poliestireno tapado de 12 mm x 75 mm que contenga las muestras previamente etiquetadas. Mezcle el contenido del tubo con cuidado, conecte el tubo a la sonda del citómetro de flujo y haga clic con el botón izquierdo en Adquirir.
- Para configurar la potencia de los láseres, haga clic en Parámetros y, en las opciones a continuación, ajuste el voltaje del FSC a 182 V y el voltaje del SSC a 236 V. Para establecer el umbral, haga clic en Citómetro | Umbral, y en las opciones a continuación, ajuste el FSC a 500 V.
- Configure la puerta de análisis para caracterizar las partículas por tamaño y complejidad, así como para realizar análisis de una sola célula.
- Para eliminar la autofluorescencia, analice la muestra sin colorante que contiene solo las perlas de látex y ajuste los voltajes del detector: en las opciones a continuación, ajuste el voltaje del FL1 (FITC) a 332 V.
- Establezca la puerta de análisis de fluorescencia en formato cuadrangular a partir del punto negativo que se muestra en el gráfico de diagrama de puntos.
- Una vez ajustados los análisis morfométricos y fluorescentes, configure el dispositivo para 50.000 eventos: en Adquisición, haga clic en Grabar.
Resultados
La Figura 2 proporciona una representación gráfica del proceso de extracción de anticuerpos IgY mediante acidificación, seguido de la separación mediante ácido caprílico (Figura 2).
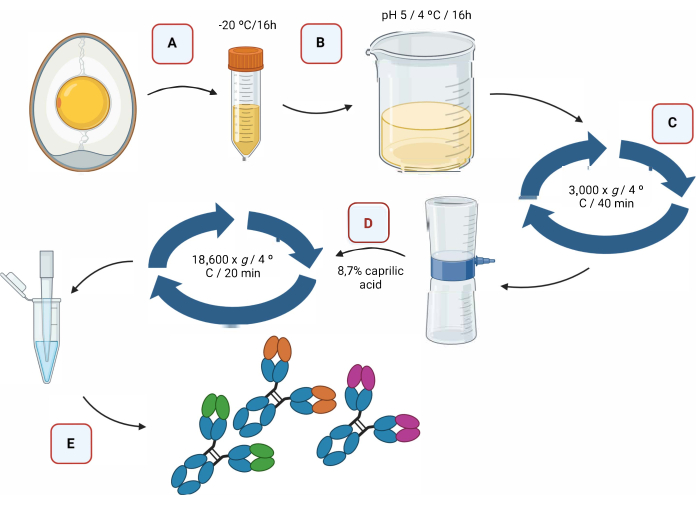
Figura 2: Representación esquemática de la etapa de extracción de antic...
Discusión
El método de precipitación del anticuerpo IgY mediante la reducción del pH seguido de la separación de lípidos mediante ácido caprílico es eficaz para aislar los anticuerpos totales sin pérdida de funcionalidad. El método aquí propuesto es más sencillo y económico que el reportado por Redwan et al.11, que también utilizaron precipitación por acidificación y ácido caprílico, pero con un protocolo más complejo y laborioso. Este método también presenta ventajas sobre las metodolog...
Divulgaciones
Los autores declaran no tener posibles conflictos de intereses con respecto a la investigación, autoría y publicación de este artículo.
Agradecimientos
Agradecemos a la FIOCRUZ (Programa de excelencia en pesquisa básica e aplicada em saúde dos laboratórios do Instituto Leônidas e Maria Deane - ILMD/Fiocruz Amazônia-PROEP-LABS/ILMD FIOCRUZ AMAZÔNIA), al Programa de Posgrado en Biotecnología (PPGBIOTEC de la Universidade Federal do Amazonas - UFAM), a la Coordenação de Aperfeiçoamento de Pessoal de Nível (CAPES) y a la Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM) por la concesión de las becas. La Figura 2 y la Figura 4 se crearon con biorender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-Chicken IgY (H+L), highly cross-adsorbed, CF 488A antibody produced in donkey | Sigma-Aldrich | SAB4600031 | |
| Anti-mouse IgG (H+L), F(ab′)2 | Sigma-Aldrich | SAB4600388 | |
| BD FACSCanto II | BD Biosciences | BF-FACSC2 | |
| BD FACSDiva CS&T research beads (CS&T research beads) | BD Biosciences | 655050 | |
| BD FACSDiva software 7.0 | BD Biosciences | 655677 | |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Caprilic acid | Sigma-Aldrich | O3907 | |
| Centrifuge 5702 R | Eppendorf | Z606936 | |
| Chloride 37% acid molecular grade | NEON | 02618 NEON | |
| CML latex, 4% w/v | Invitrogen | C37253 | |
| Megafuge 8R | Thermo Scientific | TS-HM8R | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide Hydrochloride Powder (EDC) | Sigma-Aldrich | E7750-1G | |
| N-Hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672-25G | |
| Phosphate buffered saline | Sigma-Aldrich | 1003335620 | |
| Sodium hydroxide | Acs Cientifica | P.10.0594.024.00.27 | |
| Sodium hypochlorite | Acs Cientifica | R09211000 | |
| Thermo Mixer Heat/Cool | KASVI | K80-120R |
Referencias
- Salzer, U., Sack, U., Fuchs, I. Flow cytometry in the diagnosis and follow up of human primary immunodeficiencies. Electronic Journal of the International Federation of Clinical Chemistry and Laboratory. 30 (4), 407 (2019).
- de Figueiredo, A. M., Glória, J. C., Chaves, Y. O., Neves, W. L. L., Mariúba, L. A. M. Diagnostic applications of microsphere-based flow cytometry: A review. Experimental Biology and Medicine. 247 (20), 1852-1861 (2022).
- Morgan, E., et al. Cytometric bead array: A multiplexed assay platform with applications in various areas of biology. Clinical Immunology. 110 (3), 252-266 (2004).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Kellar, K. Multiplexed microsphere-based flow cytometric assays. Experimental Hematology. 30 (11), 1227-1237 (2002).
- Schade, R., et al. Chicken egg yolk antibodies (IgY-technology): A review of progress in production and use in research and human and veterinary medicine. ATLA Alternatives to Laboratory Animals. 33 (2), 129-154 (2005).
- Xu, Y., et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: A review. Biotechnology Advances. 29 (6), 860-868 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Sousa, L. P., et al. A novel polyclonal antibody-based sandwich ELISA for detection of Plasmodium vivax developed from two lactate dehydrogenase protein segments. BMC Infectious Diseases. 14 (1), 49 (2014).
- Klimentzou, P., et al. Development and immunochemical evaluation of antibodies Y for the poorly immunogenic polypeptide prothymosin alpha. Peptides. 27 (1), 183-193 (2006).
- Redwan, E. M., Aljadawi, A. A., Uversky, V. N. Simple and efficient protocol for immunoglobulin Y purification from chicken egg yolk. Poultry Science. 100 (3), 100956 (2021).
- Lee, H. Y., Abeyrathne, E. D. N. S., Choi, I., Suh, J. W., Ahn, D. U. K. Sequential separation of immunoglobulin Y and phosvitin from chicken egg yolk without using organic solvents. Poultry Science. 93 (10), 2668-2677 (2014).
- Pauly, D., Chacana, P., Calzado, E., Brembs, B., Schade, R. IgY Technology: Extraction of chicken antibodies from egg yolk by polyethylene glycol (PEG) precipitation. Journal of Visualized Experiments. (51), e3084 (2011).
- Chang, H. M., Lu, T. C., Chen, C. C., Tu, Y. Y., Hwang, J. Y. Isolation of immunoglobulin from egg yolk by anionic polysaccharides. Journal of Agricultural and Food Chemistry. 48 (4), 995-999 (2000).
- Ko, K. Y., Ahn, D. U. Preparation of immunoglobulin Y from egg yolk using ammonium sulfate precipitation and ion exchange chromatography. Poultry Science. 86 (2), 400-407 (2007).
- Polson, A. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure. Immunological Communications. 19 (3), 253-258 (1990).
- Simonova, M. A., et al. xMAP-based analysis of three most prevalent staphylococcal toxins in Staphylococcus aureus cultures. Analytical and Bioanalytical Chemistry. 406 (25), 6447-6452 (2014).
- Sharma, P., et al. A multiplex assay for detection of staphylococcal and streptococcal exotoxins. PLoS One. 10 (8), e0135986 (2015).
- Merbah, M., et al. Standardization of a cytometric p24-capture bead-assay for the detection of main HIV-subtypes. Journal of Virological Methods. 230, 45-52 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados