Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Стандартизация цитометрического анализа на основе антител к яичному желтку
В этой статье
Резюме
В данном протоколе описана методика подготовки латексных шариков для анализов с использованием антител IgY для выявления антигена.
Аннотация
Иммунологические анализы являются важными тестами для обнаружения многочисленных молекулярных мишеней. Среди методов, доступных в настоящее время, цитометрический анализ шариков приобрел известность в последние десятилетия. Каждая микросфера, считываемая оборудованием, представляет собой событие анализа способности к взаимодействию между испытуемыми молекулами. Тысячи этих событий считываются в одном анализе, что обеспечивает высокую точность и воспроизводимость анализа. Эта методология также может быть использована для валидации новых входных данных, таких как антитела IgY, для диагностики заболеваний. Эти антитела получают путем иммунизации цыплят интересующим антигеном и последующего извлечения иммуноглобулина из желтка яиц животных; Таким образом, это безболезненный и высокопродуктивный метод получения антител. В дополнение к методологии высокоточной валидации способности к распознаванию антител в этом анализе, в данной работе также представлен метод извлечения этих антител, определения наилучших условий сопряжения антител и латексных шариков, а также определения чувствительности теста.
Введение
Среди методов иммунологического анализа, направленных на диагностику заболеваний, цитометрический анализ шариков стал высокочувствительным и надежным подходом, поскольку он позволяет анализировать тысячи частиц в одном анализе1. Этот метод, помимо высокой производительности и возможности использования меньших объемов образцов, также обладает большой гибкостью, поскольку позволяет обнаруживать несколько молекул, таких как цитокины, молекулы адгезии, изотипы антител и белки 2,3.
Для разработки этих анализов используются различные частицы, в том числе латексные шарики, которые являются эффективным и недорогим сырьем. Они могут представлять модификации на своей поверхности, такие как наличие функциональных групп или белков, которые допускают ковалентное или нековалентное соединение определенных молекул 3,4,5.
Эти иммунологические анализы используют такие компоненты, как антигены и антитела, для обнаружения маркеров заболеваний и обычно требуют антител от млекопитающих, таких как мыши, кролики и козы. Это создает проблемы, связанные с этическими вопросами, поскольку иммунизация млекопитающих, как правило, требует большого количества животных для получения хорошего урожая, а также частого выполнения процедур, которые приводят к страданиям животных 6,7. Альтернативой этому является использование антител IgY, выделенных из яичных желтков иммунизированных цыплят, поскольку в желтках могут быть обнаружены высокие концентрации специфических антител против инокулированных антигенов; Производство курицы эквивалентно производству 4,3 кроликов в течение года 6,7.
Таким образом, целью данного протокола является предоставление метода оценки антител IgY, полученных из желтков куриных яиц, с помощью проточной цитометрии с латексными шариками. Для этого мы предлагаем метод стандартизации цитометрического шарикового иммуноферментного анализа в формате сэндвича с использованием латексных шариков. В качестве модели использовали антитела IgY, направленные на антиген Plasmodium falciparum , богатый гистидином белка II (IgY-PfHRP2). Мы описываем метод экстракции антител, обсуждаем критические этапы определения их связывающей концентрации с латексными шариками и представляем оценку предела обнаружения антигена. Высокая точность проточной цитометрии в сочетании с низкой стоимостью латексных шариков делают этот метод применимым для анализа иммуноферментных инструментов, таких как антитела и антигены. Этот метод может быть использован для обнаружения разноплановых целей.
протокол
ПРИМЕЧАНИЕ: См. Таблицу материалов для получения подробной информации, относящейся ко всем материалам, реагентам и инструментам, используемым в этом протоколе.
1. Извлечение IgY из яичных желтков
- Гигиена яиц
- Погрузите яйца (только что снесенные или через 4 дня после снесения, из линии Gallus gallus Dekalb White) в 0,2% разбавленный раствор гипохлорита натрия, быстро промойте под проточной водой и аккуратно протрите для последующего или немедленного использования.
ПРИМЕЧАНИЕ: Если не использовать сразу, хранить при температуре 4 °C до 15 дней.
- Погрузите яйца (только что снесенные или через 4 дня после снесения, из линии Gallus gallus Dekalb White) в 0,2% разбавленный раствор гипохлорита натрия, быстро промойте под проточной водой и аккуратно протрите для последующего или немедленного использования.
- Отделение желтков
- Яйцо аккуратно разбить, а желток отделить от белка с помощью желткового сепаратора.
- Излишки белизны удалите с помощью фильтровальной бумаги. Проткните желток и соберите его внутреннюю часть в коническую пробирку объемом 50 мл. Перед употреблением желток храните при температуре −20 °C не менее 24 часов.
ПРИМЕЧАНИЕ: В ходе этих экспериментов (данные не показаны) было замечено, что использование желтков, которые не были предварительно заморожены, препятствовало выделению иммуноглобулинов из липидной части желтков.
- Подкисление желтков
- Разморозьте хранящийся желток и разведите его в соотношении 1:10 в 1 мМ PBS. Доведите рН раствора до 5 с 1 N HCl и инкубируйте раствор при 4 °C в течение 6-24 ч.
- Центрифугируют раствор при 3 000 × г в течение 40 мин, извлекают надосадочную жидкость и фильтруют ее с помощью целлюлозного фильтра 0,7 мм.
- Осаждение липидов каприловой кислотой
- Отрегулируйте рН надосадочной жидкости до 5 и добавьте каприловую кислоту (≥98% начальной концентрации) до конечной концентрации 8,7% при постоянном помешивании в течение 30 мин при 4 °C.
ПРИМЕЧАНИЕ: Объем надосадочной жидкости может варьироваться в зависимости от липидной массы, осажденной на стадии 1.3.2. Так, например, к 35 мл надосадочной жидкости, полученной после фильтрации, следует добавить 3,107 мл каприловой кислоты. - Центрифугируют образцы в течение 15 мин при 18 600 × г и отделяют надосадочную жидкость от осажденного материала.
- Отрегулируйте рН раствора до 7,4 с использованием 1 М NaOH, количественно определите антитела с помощью анализа Брэдфорда8 и храните антитела при −20 °C до момента использования.
ПРИМЕЧАНИЕ: Антитела были получены в концентрации 1 мкг/мкл, которая была проверена с помощью 12% геля SDS-PAGE.
- Отрегулируйте рН надосадочной жидкости до 5 и добавьте каприловую кислоту (≥98% начальной концентрации) до конечной концентрации 8,7% при постоянном помешивании в течение 30 мин при 4 °C.
2. Кривая насыщения антител IgY к латексным шарикам
- Связывание шариков с антителами IgY
- Добавьте 21 мкл 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC, начальная концентрация 367 мМ) и 21 мкл N-гидроксисукцинимида (NHS, начальная концентрация 50 мМ) к 21 мкл латексных шариков (4% по массе) и доведите до конечного объема 2,1 мл с отфильтрованным 10 мМ PBS.
ПРИМЕЧАНИЕ: Диапазон рН раствора ПБС должен быть между 7,2 и 7,4, так как в данной работе наблюдалось отрицательное изменение сцепления и других этапов при использовании раствора вне этого диапазона. - Инкубируют при температуре 22 °C при быстром встряхивании в течение 3 ч.
- Добавляют 4 мкг, 2 мкг, 1 мкг, 0,5 мкг, 0,25 мкг, 0,125 мкг и 0 мкг ранее экстрагированного антитела захвата IgY-PfHRP2 (см. этап 1.4.3) в различные микропробирки, содержащие 100 мкл раствора, описанного на стадии 2.1.1 (конечная концентрация гранул 0,04%), и инкубируют в тех же условиях, что описаны на этапе 2.1.2, в течение 16 ч.
- Центрифугируют образцы при 857 × г при 15 °C в течение 5 мин, выбрасывают надосадочную жидкость и дважды промывают латексные шарики 500 мкл отфильтрованного 10 мМ PBS (0,008% конечная концентрация гранул) с использованием циклов центрифугирования и ресуспендии.
ПРИМЕЧАНИЕ: Не превышайте 857 × г, так как в этой работе было замечено, что при превышении этой скорости шарики подвергаются деформациям, которые отрицательно влияют на результат теста.
- Добавьте 21 мкл 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC, начальная концентрация 367 мМ) и 21 мкл N-гидроксисукцинимида (NHS, начальная концентрация 50 мМ) к 21 мкл латексных шариков (4% по массе) и доведите до конечного объема 2,1 мл с отфильтрованным 10 мМ PBS.
- Блокировка бусин
- Повторно суспендируйте образцы в 1 мл блокирующего буфера (концентрация конечных гранул 0,004%) (отфильтрованный 10 мМ PBS + бычий сывороточный альбумин, BSA, 5%) и инкубируйте в тех же условиях, как описано на этапе 2.1.2, в течение 2 ч.
- После блокировки промыть, как описано в шаге 2.1.4, и повторно выполнить в буфере PBS 10 мМ.
- Инкубация вторичными антителами против курицы, помеченными Alexa Fluor 488
- Добавьте 100 мкл флуоресцентных антикуриных антител (2 мг/мл), разбавленных до 1:2 000 в 10 мМ PBS + 0,5% БСА в каждую микропробирку, как описано в шаге 2.1.3.
- Инкубируйте образцы, как описано в шаге 2.1.2, на этот раз в темноте, в течение 30 минут.
- Промойте шарики, как показано на шаге 2.1.4, и повторно суспендируйте 250 мкл (0,016% конечная концентрация гранулы), отфильтрованного 10 мМ PBS. Выполните считывание показаний проточного цитометра, как описано в разделе 5.
ПРИМЕЧАНИЕ: Исходя из полученных данных о проценте флуоресценции, обратите внимание на начальную точку формирования плато (1 мкг, как в этом исследовании). Мы рекомендуем использовать вторую точку плато (2 мкг, как показано здесь) для следующих шагов (рис. 1).
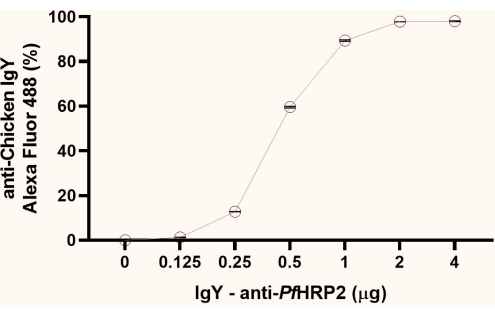
Рисунок 1: График анализа методом проточной цитометрии для определения точки насыщения связывания антител IgY-Pf HRP2 с латексными шариками. Ось X представляет концентрацию антител, а ось Y — процент полученной флуоресценции. Критерий Краскела-Уоллиса, стр < 0,0033. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Анализ проточной цитометрии на основе латексных шариков для обнаружения антигена
- После определения точки насыщения антител IgY к латексным шарикам повторите процесс активации гранул в соответствии с шагом 2.1.1.
- Соедините шарики при наблюдаемой концентрации насыщения (как описано в шаге 2.1.3) и инкубируйте в соответствии с шагом 2.1.2.
ПРИМЕЧАНИЕ: В анализах, выполненных с использованием антител IgY-PfHRP2, условие насыщения составляло 2 мкг на каждый 1 мкл латексных шариков.
- Соедините шарики при наблюдаемой концентрации насыщения (как описано в шаге 2.1.3) и инкубируйте в соответствии с шагом 2.1.2.
- Заблокируйте и промойте бусины в соответствии с шагом 2.2.
- Инкубация с антигеном
- Для определения предела детектирования распределите эквивалент 100 мкл закупки блокированного шарика в пробирки, содержащие различное количество рекомбинантного белка Pf HRP2 (1 мкг/мл) (r PfHRP2, 10 мкг, 1 мкг, 0,1 мкг, 0,01 мкг, 0,001 мкг, 0,0001 мкг и 0 мкг), разведенных в 10 мМ PBS + 0,5% BSA в тройном размере.
ПРИМЕЧАНИЕ: Этот рекомбинантный белок был разработан в работе Sousa et al.9. - Инкубируют растворы гранул с белком rPfHRP2, как описано в шаге 2.1.2, в течение 1 ч.
- Выполните промывку, как описано в шаге 2.1.4, и выбросьте надосадочную жидкость после центрифугирования.
- Для определения предела детектирования распределите эквивалент 100 мкл закупки блокированного шарика в пробирки, содержащие различное количество рекомбинантного белка Pf HRP2 (1 мкг/мл) (r PfHRP2, 10 мкг, 1 мкг, 0,1 мкг, 0,01 мкг, 0,001 мкг, 0,0001 мкг и 0 мкг), разведенных в 10 мМ PBS + 0,5% BSA в тройном размере.
- Инкубация с первичным антителом
- Добавьте 2 мкг мышиного антитела IgG против белка rPfHRP2, разведенного в 10 мМ PBS + 0,5% BSA, до конечного объема 100 мкл в каждом образце. Инкубируйте образцы, как описано в шаге 2.1.2, и выбросьте надосадочную жидкость после последнего центрифугирования.
ПРИМЕЧАНИЕ: Это антитело было разработано в работе Sousa et al.9.
- Добавьте 2 мкг мышиного антитела IgG против белка rPfHRP2, разведенного в 10 мМ PBS + 0,5% BSA, до конечного объема 100 мкл в каждом образце. Инкубируйте образцы, как описано в шаге 2.1.2, и выбросьте надосадочную жидкость после последнего центрифугирования.
- Инкубация со вторичным антителом
- Добавьте 100 мкл флуоресцентных антимышиных антител (2 мг/мл), разбавленных до 1:2 000 в 10 мМ PBS + 0,5% BSA к каждому образцу. Инкубируют, как описано на этапе 2.1.2, и ресуспендируют в 250 мкл (0,016% конечная концентрация гранул) отфильтрованного 10 мМ PBS. Выполните чтение в соответствии с разделом 5.
4. Показания проточного цитометра образцов
- Настройка цитометрии: Выравнивание оптических параметров цитометра, соединенного с компьютером
- Включите компьютер и проточный цитометр и подождите несколько минут, пока оборудование подключится к компьютеру.
- Нажмите на программное обеспечение для цитометрии, установленное на компьютере, и войдите в него. В рабочей области программного обеспечения выберите Цитометр | Стартап | Режим очистки | Жидкости SIT.
ПРИМЕЧАНИЕ: Пузырьки воздуха и препятствия должны быть удалены в процессе запуска цитометра перед взятием образца.
- Контроль качества
- Используйте реагент для контроля качества для проверки напряжений трубок фотоумножителя и оценки чувствительности цитометра.
- Поместите реагент для настройки цитометра и шарики для отслеживания в закрытую полистирольную трубку размером 12 мм x 75 мм.
- Аккуратно перемешайте трубку вихревым способом.
- Приготовление суспензионных валиков
- Для определения исходного уровня добавьте 0,5 мл разбавителя (10 мМ отфильтрованного PBS, pH 7) и три капли гранул в пробирку из полистирола размером 12 мм x 75 мм. Осторожно встряхните трубку перед использованием.
- В рабочей области программного обеспечения цитометра выберите Цитометр | CST и подождите, пока цитометр отключится от интерфейса программного обеспечения цитометра и подключится к интерфейсу CS&T. Обратите внимание на следующее сообщение в строке состояния программного обеспечения цитометра в нижней части экрана: Отключен цитометр.
- Используйте закрытую полистирольную трубку размером 12 мм x 75 мм, содержащую реагент для контроля качества, и присоедините ее к зонду проточного цитометра.
- Проверка конфигурации цитометра
- В окне " Сводка системы" убедитесь, что конфигурация цитометра подходит для эксперимента.
- Настройка для проверки производительности
- Выберите идентификатор установочных бусин, соответствующий лоту исследовательских бусин CS&T.
- Проверка производительности
- Прикрепите пробирку к зонду проточного цитометра и нажмите на окно Setup Control . Выберите «Проверить производительность» и нажмите «Выполнить».
- После завершения проверки производительности дождитесь открытия диалогового окна. Выполните одно из следующих действий.
- Чтобы просмотреть отчет о производительности цитометра, нажмите «Просмотреть отчет».
- Чтобы завершить проверку производительности и вернуться к представлению настройки рабочей области, нажмите кнопку Finish.
- Просмотрите окончательный результат анализа морфометрической и флуоресцентной чувствительности, который отображается в сводке системы | Результат работы цитометра со статусом PASSED.
- Извлеките пробирку из цитометра. Проверьте результаты работы цитометра, отображаемые в окне «Сводка системы ».
5. Анализ образца с помощью проточной цитометрии
- Войдите в программное обеспечение цитометра.
- В рабочей области программного обеспечения цитометра выберите Цитометр | Режим очистки | Жидкости SIT.
- Подстройтесь под рабочее пространство программного обеспечения.
- Определите стратегию стробирования на основе морфометрических и флуоресцентных характеристик отрицательных управляющих частиц (шариков без флуоресценции).
- Чтобы определить морфометрию клеток, выберите Dot Plot Plot Graphic для анализа параметров FSC-A с помощью SSC-A (дополнительный рисунок 1A).
- Определите одиночные ячейки с помощью SSC с помощью точечного графика для анализа SSC-H по оси y и SSC-W по оси x (дополнительный рисунок 1B) и определите отдельные ячейки по FSC с помощью точечного графика для анализа FSC-H по оси y и FSC-W по оси x (дополнительный рисунок 1C).
- Для флуоресцентного анализа выберите FL1 Dot Plot Plots с помощью FCS-A. Используйте пробирку из полистирола размером 12 мм x 75 мм, содержащую немаркированные образцы и образцы, предварительно помеченные одноцветным Alexa Fluor 488 (дополнительный рисунок 1D, E).
- Получение образца методом проточной цитометрии.
- Используйте полистирольную трубку размером 12 мм x 75 мм с пробкой, содержащую ранее промаркированные образцы. Тщательно перемешайте содержимое пробирки, прикрепите пробирку к зонду проточного цитометра и щелкните левой кнопкой мыши на Acquire.
- Чтобы установить мощность лазеров, нажмите «Параметры» и в опциях ниже установите напряжение FSC на 182 В и напряжение SSC на 236 В. Чтобы установить пороговое значение, нажмите на Цитометр | Threshold, а в параметрах ниже отрегулируйте FSC на 500 В.
- Установите вентиль анализа для определения характеристик частиц по размеру и сложности, а также для выполнения анализа отдельных ячеек.
- Чтобы удалить автофлуоресценцию, проанализируйте образец без красителей, содержащий только латексные шарики , и отрегулируйте напряжение детектора: в приведенных ниже вариантах отрегулируйте напряжение FL1 (FITC) до 332 В.
- Задайте вентиль флуоресцентного анализа в четырехугольном формате от отрицательной точки, показанной на точечном графике.
- После настройки морфометрического и флуоресцентного анализов настройте устройство на 50 000 событий: в разделе « Регистрация» нажмите « Запись».
Результаты
На рисунке 2 представлено графическое представление процесса экстракции антител IgY путем подкисления с последующим разделением с помощью каприловой кислоты (рисунок 2).
Обсуждение
Метод осаждения антител IgY путем снижения рН с последующим разделением липидов с помощью каприловой кислоты эффективен для выделения общих антител без потери функциональности. Предложенный здесь метод проще и дешевле, чем тот, о котором сообщили Redwan et al.11, в которых также и...
Раскрытие информации
Авторы заявляют об отсутствии потенциального конфликта интересов в отношении исследования, авторства и публикации данной статьи.
Благодарности
Мы хотели бы поблагодарить FIOCRUZ ("Programa de excelência em pesquisa básica e aplicada em saúde dos laboratórios do Instituto Leônidas e Maria Deane - ILMD/Fiocruz Amazônia-PROEP-LABS/ILMD FIOCRUZ AMAZÔNIA"), Программу последипломного образования в области биотехнологии (PPGBIOTEC at the Universidade Federal do Amazonas - UFAM), Coordenação de Aperfeiçoamento de Pessoal de Nível (CAPES) и Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM) за предоставление стипендий. Рисунки 2 и 4 были созданы с помощью biorender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Anti-Chicken IgY (H+L), highly cross-adsorbed, CF 488A antibody produced in donkey | Sigma-Aldrich | SAB4600031 | |
| Anti-mouse IgG (H+L), F(ab′)2 | Sigma-Aldrich | SAB4600388 | |
| BD FACSCanto II | BD Biosciences | BF-FACSC2 | |
| BD FACSDiva CS&T research beads (CS&T research beads) | BD Biosciences | 655050 | |
| BD FACSDiva software 7.0 | BD Biosciences | 655677 | |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Caprilic acid | Sigma-Aldrich | O3907 | |
| Centrifuge 5702 R | Eppendorf | Z606936 | |
| Chloride 37% acid molecular grade | NEON | 02618 NEON | |
| CML latex, 4% w/v | Invitrogen | C37253 | |
| Megafuge 8R | Thermo Scientific | TS-HM8R | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide Hydrochloride Powder (EDC) | Sigma-Aldrich | E7750-1G | |
| N-Hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672-25G | |
| Phosphate buffered saline | Sigma-Aldrich | 1003335620 | |
| Sodium hydroxide | Acs Cientifica | P.10.0594.024.00.27 | |
| Sodium hypochlorite | Acs Cientifica | R09211000 | |
| Thermo Mixer Heat/Cool | KASVI | K80-120R |
Ссылки
- Salzer, U., Sack, U., Fuchs, I. Flow cytometry in the diagnosis and follow up of human primary immunodeficiencies. Electronic Journal of the International Federation of Clinical Chemistry and Laboratory. 30 (4), 407 (2019).
- de Figueiredo, A. M., Glória, J. C., Chaves, Y. O., Neves, W. L. L., Mariúba, L. A. M. Diagnostic applications of microsphere-based flow cytometry: A review. Experimental Biology and Medicine. 247 (20), 1852-1861 (2022).
- Morgan, E., et al. Cytometric bead array: A multiplexed assay platform with applications in various areas of biology. Clinical Immunology. 110 (3), 252-266 (2004).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Kellar, K. Multiplexed microsphere-based flow cytometric assays. Experimental Hematology. 30 (11), 1227-1237 (2002).
- Schade, R., et al. Chicken egg yolk antibodies (IgY-technology): A review of progress in production and use in research and human and veterinary medicine. ATLA Alternatives to Laboratory Animals. 33 (2), 129-154 (2005).
- Xu, Y., et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: A review. Biotechnology Advances. 29 (6), 860-868 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Sousa, L. P., et al. A novel polyclonal antibody-based sandwich ELISA for detection of Plasmodium vivax developed from two lactate dehydrogenase protein segments. BMC Infectious Diseases. 14 (1), 49 (2014).
- Klimentzou, P., et al. Development and immunochemical evaluation of antibodies Y for the poorly immunogenic polypeptide prothymosin alpha. Peptides. 27 (1), 183-193 (2006).
- Redwan, E. M., Aljadawi, A. A., Uversky, V. N. Simple and efficient protocol for immunoglobulin Y purification from chicken egg yolk. Poultry Science. 100 (3), 100956 (2021).
- Lee, H. Y., Abeyrathne, E. D. N. S., Choi, I., Suh, J. W., Ahn, D. U. K. Sequential separation of immunoglobulin Y and phosvitin from chicken egg yolk without using organic solvents. Poultry Science. 93 (10), 2668-2677 (2014).
- Pauly, D., Chacana, P., Calzado, E., Brembs, B., Schade, R. IgY Technology: Extraction of chicken antibodies from egg yolk by polyethylene glycol (PEG) precipitation. Journal of Visualized Experiments. (51), e3084 (2011).
- Chang, H. M., Lu, T. C., Chen, C. C., Tu, Y. Y., Hwang, J. Y. Isolation of immunoglobulin from egg yolk by anionic polysaccharides. Journal of Agricultural and Food Chemistry. 48 (4), 995-999 (2000).
- Ko, K. Y., Ahn, D. U. Preparation of immunoglobulin Y from egg yolk using ammonium sulfate precipitation and ion exchange chromatography. Poultry Science. 86 (2), 400-407 (2007).
- Polson, A. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure. Immunological Communications. 19 (3), 253-258 (1990).
- Simonova, M. A., et al. xMAP-based analysis of three most prevalent staphylococcal toxins in Staphylococcus aureus cultures. Analytical and Bioanalytical Chemistry. 406 (25), 6447-6452 (2014).
- Sharma, P., et al. A multiplex assay for detection of staphylococcal and streptococcal exotoxins. PLoS One. 10 (8), e0135986 (2015).
- Merbah, M., et al. Standardization of a cytometric p24-capture bead-assay for the detection of main HIV-subtypes. Journal of Virological Methods. 230, 45-52 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены