Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Standardisation d’un dosage cytométrique sur billes à base d’anticorps jaunes d’œuf
Dans cet article
Résumé
Ce protocole décrit une méthodologie pour la préparation de billes de latex pour des tests utilisant des anticorps IgY pour la détection d’antigènes.
Résumé
Les immunoessais sont des tests importants pour la détection de nombreuses cibles moléculaires. Parmi les méthodes actuellement disponibles, le dosage cytométrique sur billes a pris de l’importance au cours des dernières décennies. Chaque microsphère lue par l’équipement représente un événement d’analyse de la capacité d’interaction entre les molécules testées. Des milliers de ces événements sont lus en un seul essai, ce qui garantit une précision et une reproductibilité élevées du test. Cette méthodologie peut également être utilisée dans la validation de nouveaux intrants, tels que les anticorps IgY, pour le diagnostic de maladies. Ces anticorps sont obtenus en immunisant les poulets avec l’antigène d’intérêt, puis en extrayant l’immunoglobuline du jaune des œufs des animaux ; Par conséquent, il s’agit d’une méthode indolore et très productive pour obtenir les anticorps. En plus d’une méthodologie de validation de haute précision de la capacité de reconnaissance d’anticorps de ce test, cet article présente également une méthode d’extraction de ces anticorps, de détermination des meilleures conditions de couplage pour les anticorps et les billes de latex, et de détermination de la sensibilité du test.
Introduction
Parmi les techniques d’immunodosage visant à diagnostiquer les maladies, le dosage cytométrique sur billes s’est imposé comme une approche très sensible et fiable, puisqu’il permet d’analyser des milliers de particules en un seul test1. Cette technique, en plus d’avoir une productivité élevée et de permettre l’utilisation de plus petits volumes d’échantillons, présente également une grande flexibilité, car elle permet la détection de plusieurs molécules, telles que les cytokines, les molécules d’adhésion, les isotypes d’anticorps et les protéines 2,3.
Différentes particules sont utilisées pour le développement de ces dosages, parmi lesquelles des billes de latex, qui constituent un intrant efficace et peu coûteux. Celles-ci peuvent présenter des modifications à leur surface, comme la présence de groupes fonctionnels ou de protéines qui permettent le couplage covalent ou non covalent de certaines molécules 3,4,5.
Ces immunoessais utilisent des composants tels que des antigènes et des anticorps pour détecter les marqueurs de la maladie et nécessitent généralement des anticorps provenant de mammifères tels que les souris, les lapins et les chèvres. Cela crée des problèmes liés à des questions éthiques, car l’immunisation des mammifères nécessite généralement de nombreux animaux pour obtenir un bon rendement, ainsi que l’exécution fréquente de procédures qui conduisent à la souffrance des animaux 6,7. Une alternative à cela est l’utilisation d’anticorps IgY isolés à partir des jaunes d’œufs de poulets immunisés, car des concentrations élevées d’anticorps spécifiques contre les antigènes inoculés peuvent être trouvées dans les jaunes ; La production d’un poulet équivaut à la production de 4,3 lapins au cours d’une année 6,7.
Ainsi, l’objectif de ce protocole est de fournir une méthode d’évaluation des anticorps IgY obtenus à partir de jaunes d’œufs de poule par cytométrie en flux avec des billes de latex. Pour cela, nous proposons une méthode de standardisation d’un immunodosage cytométrique sur billes en format sandwich à l’aide de billes de latex. Comme modèle, nous avons utilisé des anticorps IgY dirigés contre l’antigène de la protéine II riche en histidine de Plasmodium falciparum (IgY-Pf HRP2). Nous décrivons une méthode d’extraction des anticorps, discutons des étapes critiques pour définir la concentration de couplage de ceux-ci aux billes de latex, et présentons une évaluation de la limite de détection de l’antigène. La haute précision de la cytométrie en flux, associée au faible coût des billes de latex, rend cette technique applicable à l’analyse des outils d’immunoessai, tels que les anticorps et les antigènes. Cette méthode peut être utilisée pour la détection de diverses cibles.
Protocole
REMARQUE : Voir le tableau des matériaux pour plus de détails sur tous les matériaux, réactifs et instruments utilisés dans ce protocole.
1. Extraction des IgY à partir des jaunes d’œufs
- Hygiénisation des oeufs
- Plongez les œufs (fraîchement pondus ou jusqu’à 4 jours après la ponte, de la lignée Gallus gallus Dekalb White) dans une solution diluée à 0,2 % d’hypochlorite de sodium, rincez rapidement à l’eau courante et essuyez doucement pour une utilisation ultérieure ou immédiate.
REMARQUE : S’il n’est pas utilisé immédiatement, conserver à 4 °C jusqu’à 15 jours.
- Plongez les œufs (fraîchement pondus ou jusqu’à 4 jours après la ponte, de la lignée Gallus gallus Dekalb White) dans une solution diluée à 0,2 % d’hypochlorite de sodium, rincez rapidement à l’eau courante et essuyez doucement pour une utilisation ultérieure ou immédiate.
- Séparation des jaunes d’œuf
- Cassez soigneusement l’œuf et séparez le jaune du blanc à l’aide d’un séparateur de jaunes.
- Retirez l’excédent de blanc à l’aide d’un papier filtre. Percez le jaune d’œuf et recueillez son intérieur dans un tube conique de 50 ml. Conservez le jaune d’œuf à −20 °C pendant au moins 24 h avant utilisation.
NOTA : Au cours de ces expériences (données non présentées), il a été observé que l’utilisation de jaunes d’œufs qui n’avaient pas été congelés auparavant nuisait à l’isolement des immunoglobulines de la partie lipidique des jaunes.
- Acidification des jaunes d’oeufs
- Décongelez le jaune d’œuf stocké et diluez-le dans un rapport de 1 :10 dans 1 mM de PBS. Ajustez le pH de la solution à 5 avec 1 N HCl et incubez la solution à 4 °C pendant 6 à 24 h.
- Centrifuger la solution à 3 000 × g pendant 40 min, récupérer le surnageant et le filtrer à l’aide d’un filtre en cellulose de 0,7 mm.
- Précipitation des lipides avec de l’acide caprylique
- Réajuster le pH des surnageants à 5, et ajouter l’acide caprylique (≥98 % de concentration initiale) jusqu’à une concentration finale de 8,7 % en agitant constamment pendant 30 min à 4 °C.
REMARQUE : Le volume du surnageant peut varier en fonction de la masse lipidique précipitée à l’étape 1.3.2. Ainsi, par exemple, il faut ajouter 3,107 mL d’acide caprylique à 35 mL de surnageant obtenu après filtration. - Centrifuger les échantillons pendant 15 min à 18 600 × g et séparer le surnageant du matériau précipité.
- Réajustez le pH de la solution à 7,4 à l’aide de 1 M de NaOH, quantifiez les anticorps à l’aide du test de Bradford8 et conservez les anticorps à −20 °C jusqu’au moment de l’utilisation.
REMARQUE : Les anticorps ont été obtenus à une concentration de 1 μg/μL, qui a été vérifiée à l’aide d’un gel SDS-PAGE à 12%.
- Réajuster le pH des surnageants à 5, et ajouter l’acide caprylique (≥98 % de concentration initiale) jusqu’à une concentration finale de 8,7 % en agitant constamment pendant 30 min à 4 °C.
2. Courbe de saturation des anticorps IgY aux billes de latex
- Couplage des billes aux anticorps IgY
- Ajouter 21 μL de 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide (EDC, concentration initiale de 367 mM) et 21 μL de N-hydroxysuccinimide (NHS, concentration initiale de 50 mM) à 21 μL de billes de latex (4 % p/v), et ajuster jusqu’à un volume final de 2,1 mL avec du PBS filtré de 10 mM.
REMARQUE : La plage de pH de la solution de PBS doit être comprise entre 7,2 et 7,4, car dans ce travail, un changement négatif dans le couplage et d’autres étapes a été observé lors de l’utilisation d’une solution en dehors de cette plage. - Incuber à 22 °C avec agitation rapide pendant 3 h.
- Ajouter 4 μg, 2 μg, 1 μg, 0,5 μg, 0,25 μg, 0,125 μg et 0 μg de l’anticorps de capture IgY-PfHRP2 précédemment extrait (voir l’étape 1.4.3) à différents microtubes contenant 100 μL de la solution décrite à l’étape 2.1.1 (concentration finale de 0,04 % en billes) et incuber dans les mêmes conditions que celles décrites à l’étape 2.1.2 pendant 16 h.
- Centrifuger les échantillons à 857 × g à 15 °C pendant 5 min, jeter les surnageants et laver les billes de latex deux fois avec 500 μL de PBS filtré à 10 mM (concentration finale de billes de 0,008 %) en utilisant des cycles de centrifugation et de remise en suspension.
NOTE : Ne pas dépasser 857 × g, car dans ce travail, il a été observé qu’au-delà de cette vitesse, les billes subissent des déformations qui altèrent négativement le résultat de l’essai.
- Ajouter 21 μL de 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide (EDC, concentration initiale de 367 mM) et 21 μL de N-hydroxysuccinimide (NHS, concentration initiale de 50 mM) à 21 μL de billes de latex (4 % p/v), et ajuster jusqu’à un volume final de 2,1 mL avec du PBS filtré de 10 mM.
- Blocage des perles
- Remettre les échantillons en suspension dans 1 mL de tampon bloquant (concentration finale de billes de 0,004 %) (PBS filtré de 10 mM + albumine sérique bovine, BSA, 5 %) et incuber dans les mêmes conditions que celles décrites à l’étape 2.1.2 pendant 2 h.
- Après le blocage, laver comme décrit à l’étape 2.1.4 et remettre en suspension dans une mémoire tampon PBS de 10 mM.
- Incubation avec des anticorps secondaires anti-poulet marqués avec Alexa Fluor 488
- Ajouter 100 μL d’anticorps fluorescents anti-poulet (2 mg/mL) dilués à 1 :2 000 dans 10 mM PBS + 0,5 % BSA à chaque microtube, comme décrit à l’étape 2.1.3.
- Incubez les échantillons comme décrit à l’étape 2.1.2, cette fois dans l’obscurité, pendant 30 minutes.
- Lavez les billes comme à l’étape 2.1.4 et mettez-les en suspension avec 250 μL de PBS filtré à 10 mM (concentration finale de billes de 0,016 %). Effectuez la lecture du cytomètre en flux comme décrit dans la section 5.
NOTA : À partir des données sur le pourcentage de fluorescence obtenues, observer le point initial de formation du plateau (1 μg, tel qu’observé dans cette étude). Nous recommandons d’utiliser le deuxième point du plateau (2 μg, comme observé ici) pour les étapes suivantes (Figure 1).
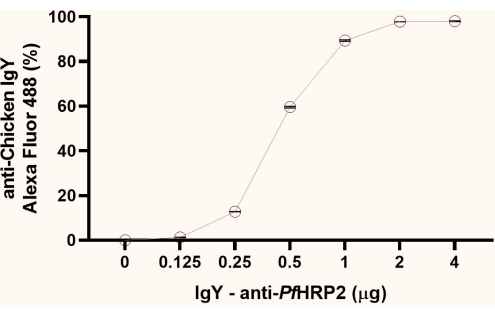
Figure 1 : Graphique de l’analyse par cytométrie en flux pour déterminer le point de saturation de l’anticorps IgY-PfHRP2 couplant aux billes de latex. L’axe des abscisses représente la concentration d’anticorps et l’axe des ordonnées représente le pourcentage de fluorescence obtenu. Test de Kruskal-Wallis, p < 0,0033. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Test de cytométrie en flux basé sur des billes de latex pour la détection d’antigènes
- Après avoir déterminé le point de saturation des anticorps IgY contre les billes de latex, effectuez à nouveau le processus d’activation des billes, conformément à l’étape 2.1.1.
- Couplez les billes à la concentration de saturation observée (comme décrit à l’étape 2.1.3) et incubez selon l’étape 2.1.2.
REMARQUE : Dans les essais effectués à l’aide de l’anticorps IgY-PfHRP2, la condition de saturation était de 2 μg pour 1 μL de billes de latex.
- Couplez les billes à la concentration de saturation observée (comme décrit à l’étape 2.1.3) et incubez selon l’étape 2.1.2.
- Bloquez et lavez les perles selon l’étape 2.2.
- Incubation avec l’antigène
- Pour déterminer la limite de détection, distribuer l’équivalent de 100 μL de la préparation de billes bloquées dans des tubes contenant différentes quantités de la protéine recombinante Pf HRP2 (1 μg/mL) (r PfHRP2, 10 μg, 1 μg, 0,1 μg, 0,01 μg, 0,001 μg et 0 μg) dilués dans 10 mM PBS + 0,5 % BSA en trois exemplaires.
NOTE : Cette protéine recombinante a été développée dans le cadre des travaux de Sousa et al.9. - Incuber les solutions de billes avec la protéiner PfHRP2 comme décrit à l’étape 2.1.2 pendant 1 h.
- Effectuez les lavages comme décrit à l’étape 2.1.4 et jetez le surnageant après centrifugation.
- Pour déterminer la limite de détection, distribuer l’équivalent de 100 μL de la préparation de billes bloquées dans des tubes contenant différentes quantités de la protéine recombinante Pf HRP2 (1 μg/mL) (r PfHRP2, 10 μg, 1 μg, 0,1 μg, 0,01 μg, 0,001 μg et 0 μg) dilués dans 10 mM PBS + 0,5 % BSA en trois exemplaires.
- Incubation avec l’anticorps primaire
- Ajouter 2 μg d’anticorps IgG de souris dirigés contre la protéiner PfHRP2 dilués dans 10 mM de PBS + 0,5 % de BSA jusqu’à un volume final de 100 μL dans chaque échantillon. Incuber les échantillons comme décrit à l’étape 2.1.2 et jeter le surnageant après la dernière centrifugation.
NOTE : Cet anticorps a été développé dans le cadre des travaux de Sousa et al.9.
- Ajouter 2 μg d’anticorps IgG de souris dirigés contre la protéiner PfHRP2 dilués dans 10 mM de PBS + 0,5 % de BSA jusqu’à un volume final de 100 μL dans chaque échantillon. Incuber les échantillons comme décrit à l’étape 2.1.2 et jeter le surnageant après la dernière centrifugation.
- Incubation avec l’anticorps secondaire
- Ajouter 100 μL d’anticorps fluorescents anti-souris (2 mg/mL) dilués à 1 :2 000 dans 10 mM PBS + 0,5 % BSA à chaque échantillon. Incuber comme décrit à l’étape 2.1.2 et remettre en suspension dans 250 μL (concentration finale de billes de 0,016 %) de PBS filtré de 10 mM. Effectuez la lecture conformément à la section 5.
4. Lecture par cytomètre en flux des échantillons
- Paramétrage de la cytométrie : Alignement des paramètres optiques du cytomètre couplé à un ordinateur
- Allumez l’ordinateur et le cytomètre en flux, puis attendez quelques minutes que l’équipement se connecte à l’ordinateur.
- Cliquez sur le logiciel de cytométrie installé sur l’ordinateur et connectez-vous à celui-ci. Dans l’espace de travail du logiciel, sélectionnez Cytomètre | Démarrage | Mode de nettoyage | Fluides SIT.
REMARQUE : Les bulles d’air et les obstructions doivent être éliminées pendant le processus d’initiation du cytomètre avant l’acquisition de l’échantillon.
- Contrôle qualité
- Utilisez le réactif de contrôle de la qualité pour vérifier les tensions des tubes photomultiplicateurs et évaluer la sensibilité du cytomètre.
- Placez le réactif de configuration du cytomètre et les billes de suivi dans un tube en polystyrène bouché de 12 mm x 75 mm.
- Mélangez délicatement le tube par vortex.
- Préparation des billes de suspension
- Pour définir la ligne de base, ajoutez 0,5 mL de diluant (PBS filtré à 10 mM, pH 7) et trois gouttes de billes dans le tube en polystyrène bouché de 12 mm x 75 mm. Tourbillonnez doucement le tube avant utilisation.
- Dans l’espace de travail du logiciel Cytomètre, sélectionnez Cytomètre | CST, et attendez que le cytomètre se déconnecte de l’interface logicielle du cytomètre et se connecte à l’interface CS&T. Observez le message suivant dans la barre d’état du logiciel du cytomètre en bas de l’écran : Cytomètre déconnecté.
- Utilisez le tube en polystyrène bouché de 12 mm x 75 mm contenant le réactif de contrôle qualité et fixez-le à la sonde du cytomètre en flux.
- Vérification de la configuration du cytomètre
- Dans la fenêtre System Summary (Récapitulatif du système ), vérifiez que la configuration du cytomètre est adaptée à l’expérience.
- Configuration pour une vérification des performances
- Sélectionnez l’ID des perles de configuration correspondant au lot de perles de recherche CS&T.
- Vérification des performances
- Fixez le tube à la sonde du cytomètre en flux et cliquez sur la fenêtre Contrôle de configuration . Sélectionnez Vérifier les performances, puis cliquez sur Exécuter.
- Une fois la vérification des performances terminée, attendez qu’une boîte de dialogue s’ouvre. Effectuez l’une des opérations suivantes :
- Pour afficher le rapport sur les performances du cytomètre , cliquez sur Afficher le rapport.
- Pour terminer la vérification des performances et revenir à la vue de configuration de l’espace de travail, cliquez sur Terminer.
- Observez le résultat final de l’analyse morphométrique et de sensibilité à la fluorescence qui apparaît dans le résumé du système | Résultat de performance du cytomètre avec l’état PASSÉ.
- Retirez le tube du cytomètre. Vérifiez les résultats de performance du cytomètre affichés dans la fenêtre Résumé du système .
5. Analyse d’échantillons par cytométrie en flux
- Connectez-vous au logiciel du cytomètre.
- Dans l’espace de travail du logiciel Cytomètre, sélectionnez Cytomètre | Mode de nettoyage | Fluides SIT.
- Adaptez-vous à l’espace de travail du logiciel.
- Définir la stratégie de déclenchement en fonction des caractéristiques morphométriques et de fluorescence des particules témoins négatives (billes sans fluorescence).
- Pour déterminer la morphométrie cellulaire, choisissez Dot Plot Plot Graphic pour l’analyse des paramètres FSC-A à l’aide de SSC-A (Figure 1A supplémentaire).
- Déterminer les cellules individuelles par SSC à l’aide du graphique de tracé à points pour l’analyse de SSC-H sur l’axe des ordonnées et de SSC-W sur l’axe des abscisses (figure 1B supplémentaire), et déterminer les cellules individuelles par FSC à l’aide du graphique de tracé par points pour l’analyse du FSC-H sur l’axe des ordonnées et du FSC-W sur l’axe des abscisses (figure 1C supplémentaire).
- Pour les analyses de fluorescence, choisissez FL1 Dot Plot Plots à l’aide de FCS-A. Utilisez un tube en polystyrène bouché de 12 mm x 75 mm contenant des échantillons non étiquetés et des échantillons préalablement étiquetés avec Alexa Fluor 488 unicolore (Figure supplémentaire 1D, E).
- Acquérir l’échantillon en cytométrie en flux.
- Utilisez un tube en polystyrène bouché de 12 mm x 75 mm contenant les échantillons préalablement étiquetés. Mélangez soigneusement le contenu du tube, fixez le tube à la sonde du cytomètre en flux et cliquez avec le bouton gauche de la souris sur Acquérir.
- Pour régler la puissance des lasers, cliquez sur Paramètres, et dans les options ci-dessous, ajustez la tension du FSC à 182 V et la tension du SSC à 236 V. Pour définir le seuil, cliquez sur Cytomètre | Threshold, et dans les options ci-dessous, ajustez le FSC à 500 V.
- Définissez la porte d’analyse pour caractériser les particules en fonction de leur taille et de leur complexité, ainsi que pour effectuer une analyse à cellule unique.
- Pour supprimer l’autofluorescence, analysez l’échantillon sans colorant contenant uniquement les billes de latex, et ajustez les tensions du détecteur : dans les options ci-dessous, ajustez la tension du FL1 (FITC) à 332 V.
- Définissez la porte d’analyse de fluorescence au format quadrangulaire à partir du point négatif indiqué dans le graphique à points.
- Une fois les analyses morphométriques et fluorescentes ajustées, configurez l’appareil pour 50 000 événements : sous Acquisition, cliquez sur Enregistrer.
Résultats
La figure 2 fournit une représentation graphique du processus d’extraction des anticorps IgY par acidification, suivie d’une séparation à l’aide d’acide caprylique (figure 2).
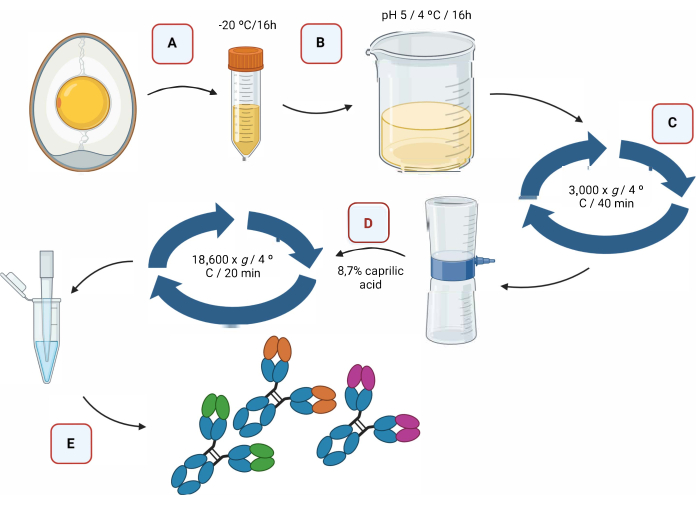
Figure 2 : Représentation schématique de l’étape d’extraction des ant...
Discussion
La méthode de précipitation des anticorps IgY par réduction du pH suivie d’une séparation des lipides à l’aide d’acide caprylique est efficace pour isoler les anticorps totaux sans aucune perte de fonctionnalité. La méthode proposée ici est plus simple et moins coûteuse que celle rapportée par Redwan et al.11, qui utilisaient également la précipitation par acidification et l’acide caprylique mais avec un protocole plus complexe et laborieux. Cette méthode présente également ...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts potentiel en ce qui concerne la recherche, la paternité et la publication de cet article.
Remerciements
Nous tenons à remercier la FIOCRUZ (« Programa de excelência em pesquisa básica e aplicada em saúde dos laboratórios do Instituto Leônidas e Maria Deane - ILMD/Fiocruz Amazônia-PROEP-LABS/ILMD FIOCRUZ AMAZÔNIA »), le Programme de troisième cycle en biotechnologie (PPGBIOTEC de l’Universidade Federal do Amazonas - UFAM), la Coordenação de Aperfeiçoamento de Pessoal de Nível (CAPES) et la Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM) pour l’octroi des bourses. La figure 2 et la figure 4 ont été créées avec biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| Anti-Chicken IgY (H+L), highly cross-adsorbed, CF 488A antibody produced in donkey | Sigma-Aldrich | SAB4600031 | |
| Anti-mouse IgG (H+L), F(ab′)2 | Sigma-Aldrich | SAB4600388 | |
| BD FACSCanto II | BD Biosciences | BF-FACSC2 | |
| BD FACSDiva CS&T research beads (CS&T research beads) | BD Biosciences | 655050 | |
| BD FACSDiva software 7.0 | BD Biosciences | 655677 | |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Caprilic acid | Sigma-Aldrich | O3907 | |
| Centrifuge 5702 R | Eppendorf | Z606936 | |
| Chloride 37% acid molecular grade | NEON | 02618 NEON | |
| CML latex, 4% w/v | Invitrogen | C37253 | |
| Megafuge 8R | Thermo Scientific | TS-HM8R | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide Hydrochloride Powder (EDC) | Sigma-Aldrich | E7750-1G | |
| N-Hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672-25G | |
| Phosphate buffered saline | Sigma-Aldrich | 1003335620 | |
| Sodium hydroxide | Acs Cientifica | P.10.0594.024.00.27 | |
| Sodium hypochlorite | Acs Cientifica | R09211000 | |
| Thermo Mixer Heat/Cool | KASVI | K80-120R |
Références
- Salzer, U., Sack, U., Fuchs, I. Flow cytometry in the diagnosis and follow up of human primary immunodeficiencies. Electronic Journal of the International Federation of Clinical Chemistry and Laboratory. 30 (4), 407 (2019).
- de Figueiredo, A. M., Glória, J. C., Chaves, Y. O., Neves, W. L. L., Mariúba, L. A. M. Diagnostic applications of microsphere-based flow cytometry: A review. Experimental Biology and Medicine. 247 (20), 1852-1861 (2022).
- Morgan, E., et al. Cytometric bead array: A multiplexed assay platform with applications in various areas of biology. Clinical Immunology. 110 (3), 252-266 (2004).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Kellar, K. Multiplexed microsphere-based flow cytometric assays. Experimental Hematology. 30 (11), 1227-1237 (2002).
- Schade, R., et al. Chicken egg yolk antibodies (IgY-technology): A review of progress in production and use in research and human and veterinary medicine. ATLA Alternatives to Laboratory Animals. 33 (2), 129-154 (2005).
- Xu, Y., et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: A review. Biotechnology Advances. 29 (6), 860-868 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Sousa, L. P., et al. A novel polyclonal antibody-based sandwich ELISA for detection of Plasmodium vivax developed from two lactate dehydrogenase protein segments. BMC Infectious Diseases. 14 (1), 49 (2014).
- Klimentzou, P., et al. Development and immunochemical evaluation of antibodies Y for the poorly immunogenic polypeptide prothymosin alpha. Peptides. 27 (1), 183-193 (2006).
- Redwan, E. M., Aljadawi, A. A., Uversky, V. N. Simple and efficient protocol for immunoglobulin Y purification from chicken egg yolk. Poultry Science. 100 (3), 100956 (2021).
- Lee, H. Y., Abeyrathne, E. D. N. S., Choi, I., Suh, J. W., Ahn, D. U. K. Sequential separation of immunoglobulin Y and phosvitin from chicken egg yolk without using organic solvents. Poultry Science. 93 (10), 2668-2677 (2014).
- Pauly, D., Chacana, P., Calzado, E., Brembs, B., Schade, R. IgY Technology: Extraction of chicken antibodies from egg yolk by polyethylene glycol (PEG) precipitation. Journal of Visualized Experiments. (51), e3084 (2011).
- Chang, H. M., Lu, T. C., Chen, C. C., Tu, Y. Y., Hwang, J. Y. Isolation of immunoglobulin from egg yolk by anionic polysaccharides. Journal of Agricultural and Food Chemistry. 48 (4), 995-999 (2000).
- Ko, K. Y., Ahn, D. U. Preparation of immunoglobulin Y from egg yolk using ammonium sulfate precipitation and ion exchange chromatography. Poultry Science. 86 (2), 400-407 (2007).
- Polson, A. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure. Immunological Communications. 19 (3), 253-258 (1990).
- Simonova, M. A., et al. xMAP-based analysis of three most prevalent staphylococcal toxins in Staphylococcus aureus cultures. Analytical and Bioanalytical Chemistry. 406 (25), 6447-6452 (2014).
- Sharma, P., et al. A multiplex assay for detection of staphylococcal and streptococcal exotoxins. PLoS One. 10 (8), e0135986 (2015).
- Merbah, M., et al. Standardization of a cytometric p24-capture bead-assay for the detection of main HIV-subtypes. Journal of Virological Methods. 230, 45-52 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon