È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Standardizzazione di un test citometrico a perline basato su anticorpi tuorlo d'uovo
In questo articolo
Riepilogo
Questo protocollo descrive una metodologia per la preparazione di perle di lattice per saggi che utilizzano anticorpi IgY per la rilevazione dell'antigene.
Abstract
I dosaggi immunologici sono test importanti per l'individuazione di numerosi bersagli molecolari. Tra i metodi attualmente disponibili, il test citometrico a microsfere ha guadagnato importanza negli ultimi decenni. Ogni microsfera che viene letta dall'apparecchiatura rappresenta un evento di analisi della capacità di interazione tra le molecole in prova. Migliaia di questi eventi vengono letti in un unico saggio, garantendo così un'elevata precisione e riproducibilità del saggio. Questa metodologia può essere utilizzata anche nella validazione di nuovi input, come gli anticorpi IgY, per la diagnosi di malattie. Questi anticorpi si ottengono immunizzando i polli con l'antigene di interesse e quindi estraendo l'immunoglobulina dal tuorlo delle uova degli animali; Pertanto, questo è un metodo indolore e altamente produttivo per ottenere gli anticorpi. Oltre a una metodologia per la validazione ad alta precisione della capacità di riconoscimento degli anticorpi di questo test, questo documento presenta anche un metodo per estrarre questi anticorpi, determinare le migliori condizioni di accoppiamento per gli anticorpi e le perle di lattice e determinare la sensibilità del test.
Introduzione
Tra le tecniche di immunodosaggio finalizzate alla diagnosi delle malattie, il test citometrico a microsfere è emerso come un approccio altamente sensibile e affidabile, poiché consente l'analisi di migliaia di particelle in un unico test1. Questa tecnica, oltre ad avere un'elevata produttività e a consentire l'utilizzo di volumi minori di campioni, presenta anche una grande flessibilità, poiché consente la rilevazione di diverse molecole, come citochine, molecole di adesione, isotipi di anticorpi e proteine 2,3.
Per lo sviluppo di questi saggi vengono utilizzate diverse particelle, tra cui le perle di lattice, che sono un input efficace e a basso costo. Questi possono presentare modificazioni sulla loro superficie, come la presenza di gruppi funzionali o proteine che permettono l'accoppiamento covalente o non covalente di alcune molecole 3,4,5.
Questi test immunologici utilizzano componenti come antigeni e anticorpi per eseguire il rilevamento di marcatori di malattia e richiedono comunemente anticorpi da mammiferi come topi, conigli e capre. Questo crea problemi legati a questioni etiche, poiché l'immunizzazione dei mammiferi richiede generalmente molti animali per ottenere una buona resa, nonché la frequente esecuzione di procedure che portano alla sofferenza degli animali 6,7. Un'alternativa a questo è l'uso di anticorpi IgY isolati dai tuorli d'uovo di polli immunizzati, poiché nei tuorli si possono trovare alte concentrazioni di anticorpi specifici contro gli antigeni inoculati; La produzione di un pollo equivale alla produzione di 4,3 conigli nel corso di un anno 6,7.
Pertanto, l'obiettivo di questo protocollo è quello di fornire un metodo per valutare gli anticorpi IgY ottenuti da tuorli d'uovo di gallina utilizzando la citometria a flusso con perline di lattice. Per questo, proponiamo un metodo di standardizzazione per un test immunologico citometrico a microsfere in formato sandwich utilizzando perle di lattice. Come modello, abbiamo utilizzato anticorpi IgY diretti contro l'antigene della proteina II ricca di istidina del Plasmodium falciparum (IgY-PfHRP2). Descriviamo un metodo per l'estrazione degli anticorpi, discutiamo i passaggi critici per definire la concentrazione di accoppiamento di questi alle perle di lattice e presentiamo una valutazione del limite di rilevazione dell'antigene. L'elevata precisione della citometria a flusso, unita al basso costo delle perle di lattice, rendono questa tecnica applicabile per l'analisi di strumenti di immunoanalisi, come anticorpi e antigeni. Questo metodo può essere utilizzato per il rilevamento di diversi obiettivi.
Protocollo
NOTA: Vedere la tabella dei materiali per i dettagli relativi a tutti i materiali, i reagenti e gli strumenti utilizzati in questo protocollo.
1. Estrazione delle IgY dai tuorli d'uovo
- Igienizzazione delle uova
- Immergere le uova (appena deposte o fino a 4 giorni dopo la deposizione, del lignaggio Gallus gallus Dekalb White) in una soluzione diluita allo 0,2% di ipoclorito di sodio, sciacquare rapidamente sotto l'acqua corrente e strofinare delicatamente per un uso successivo o immediato.
NOTA: Se non utilizzato immediatamente, conservare a 4 °C per un massimo di 15 giorni.
- Immergere le uova (appena deposte o fino a 4 giorni dopo la deposizione, del lignaggio Gallus gallus Dekalb White) in una soluzione diluita allo 0,2% di ipoclorito di sodio, sciacquare rapidamente sotto l'acqua corrente e strofinare delicatamente per un uso successivo o immediato.
- Separazione dei tuorli
- Rompete con cura l'uovo e separate il tuorlo dall'albume con l'aiuto di un separatore di tuorli.
- Rimuovere il bianco in eccesso con l'aiuto di carta da filtro. Forare il tuorlo e raccoglierne l'interno in una provetta conica da 50 ml. Conservare il tuorlo a −20 °C per almeno 24 ore prima dell'uso.
NOTA: Durante questi esperimenti (dati non mostrati), è stato osservato che l'uso di tuorli che non erano stati congelati in precedenza ostacolava l'isolamento delle immunoglobuline dalla porzione lipidica dei tuorli.
- Acidificazione dei tuorli
- Scongelare il tuorlo conservato e diluirlo in rapporto 1:10 in 1 mM PBS. Regolare il pH della soluzione a 5 con 1 N HCl e incubare la soluzione a 4 °C per 6-24 ore.
- Centrifugare la soluzione a 3.000 × g per 40 min, recuperare il surnatante e filtrarlo con un filtro in cellulosa da 0,7 mm.
- Precipitazione dei lipidi con acido caprilico
- Regolare nuovamente il pH dei surnatanti a 5 e aggiungere l'acido caprilico (concentrazione iniziale ≥98%) a una concentrazione finale dell'8,7% sotto agitazione costante per 30 minuti a 4 °C.
NOTA: Il volume del surnatante può variare a seconda della massa lipidica precipitata nella fase 1.3.2. Così, ad esempio, 3,107 mL di acido caprilico dovrebbero essere aggiunti a 35 mL del surnatante ottenuto dopo la filtrazione. - Centrifugare i campioni per 15 minuti a 18.600 × g e separare il surnatante dal materiale precipitato.
- Regolare nuovamente il pH della soluzione a 7,4 utilizzando NaOH 1 M, quantificare gli anticorpi utilizzando il test Bradford8 e conservare gli anticorpi a -20 °C fino al momento dell'uso.
NOTA: Gli anticorpi sono stati ottenuti ad una concentrazione di 1 μg/μL, verificata mediante un gel SDS-PAGE al 12%.
- Regolare nuovamente il pH dei surnatanti a 5 e aggiungere l'acido caprilico (concentrazione iniziale ≥98%) a una concentrazione finale dell'8,7% sotto agitazione costante per 30 minuti a 4 °C.
2. Curva di saturazione degli anticorpi IgY contro le perle di lattice
- Accoppiamento delle perle agli anticorpi IgY
- Aggiungere 21 μL di 1-etil-3-(3-dimetilamminopropil)carbodiimmide (EDC, concentrazione iniziale di 367 mM) e 21 μL di N-idrossisuccinimide (NHS, concentrazione iniziale di 50 mM) a 21 μL di perle di lattice (4% p/v) e regolare fino a un volume finale di 2,1 mL con PBS 10 mM filtrato.
NOTA: L'intervallo di pH della soluzione PBS deve essere compreso tra 7,2 e 7,4, poiché in questo lavoro è stato osservato un cambiamento negativo nell'accoppiamento e in altri passaggi quando si utilizza una soluzione al di fuori di questo intervallo. - Incubare a 22 °C agitando rapidamente per 3 ore.
- Aggiungere 4 μg, 2 μg, 1 μg, 0,5 μg, 0,25 μg, 0,125 μg e 0 μg dell'anticorpo di cattura IgY-PfHRP2 precedentemente estratto (vedere passaggio 1.4.3) in diverse microprovette contenenti 100 μL della soluzione descritta al punto 2.1.1 (concentrazione finale del microfono dello 0,04%) e incubare nelle stesse condizioni descritte al punto 2.1.2 per 16 ore.
- Centrifugare i campioni a 857 × g a 15 °C per 5 minuti, scartare i surnatanti e lavare due volte le perle di lattice con 500 μL di PBS filtrato da 10 mM (concentrazione finale di microsfere dello 0,008%) utilizzando cicli di centrifugazione e risospensione.
NOTA: Non superare gli 857 × g, poiché in questo lavoro è stato osservato che oltre questa velocità le perle subiscono deformazioni che alterano negativamente il risultato del test.
- Aggiungere 21 μL di 1-etil-3-(3-dimetilamminopropil)carbodiimmide (EDC, concentrazione iniziale di 367 mM) e 21 μL di N-idrossisuccinimide (NHS, concentrazione iniziale di 50 mM) a 21 μL di perle di lattice (4% p/v) e regolare fino a un volume finale di 2,1 mL con PBS 10 mM filtrato.
- Blocco delle perline
- Risospendere i campioni in 1 mL di tampone bloccante (0,004% di concentrazione finale di microsfere) (PBS 10 mM filtrato + albumina sierica bovina, BSA, 5%) e incubare nelle stesse condizioni descritte al punto 2.1.2 per 2 ore.
- Dopo il blocco, lavare come descritto al punto 2.1.4 e risospendere in un tampone PBS da 10 mM.
- Incubazione con anticorpi secondari anti-pollo marcati con Alexa Fluor 488
- Aggiungere 100 μL di anticorpo fluorescente anti-pollo (2 mg/mL) diluito a 1:2.000 in 10 mM PBS + 0,5% BSA a ciascuna microprovetta, come descritto al punto 2.1.3.
- Incubare i campioni come descritto al punto 2.1.2, questa volta al buio, per 30 minuti.
- Lavare le microsfere come al punto 2.1.4 e risospendere con 250 μL di PBS filtrato da 10 mM (0,016% di concentrazione finale). Eseguire la lettura del citometro a flusso come descritto nel paragrafo 5.
NOTA: Dai dati della percentuale di fluorescenza ottenuti, osservare il punto iniziale di formazione del plateau (1 μg, come osservato in questo studio). Si consiglia di utilizzare il secondo punto del plateau (2 μg, come osservato qui) per i passaggi successivi (Figura 1).
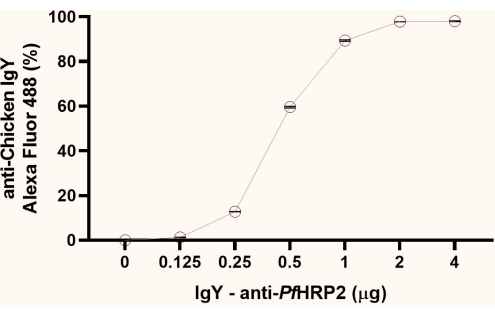
Figura 1: Grafico dell'analisi citofluorimetrica per determinare il punto di saturazione dell'accoppiamento dell'anticorpo IgY-PfHRP2 alle perle di lattice. L'asse x rappresenta la concentrazione di anticorpi e l'asse y rappresenta la percentuale di fluorescenza ottenuta. Test di Kruskal-Wallis, p < 0,0033. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Saggio di citometria a flusso basato su perle di lattice per la rilevazione dell'antigene
- Dopo aver determinato il punto di saturazione degli anticorpi IgY contro le perle di lattice, eseguire nuovamente il processo di attivazione delle perle, secondo il passaggio 2.1.1.
- Accoppiare le perle alla concentrazione di saturazione osservata (come descritto al punto 2.1.3) e incubare secondo il punto 2.1.2.
NOTA: Nei test eseguiti utilizzando l'anticorpo IgY-PfHRP2, la condizione di saturazione è stata di 2 μg per ogni 1 μL di perle di lattice.
- Accoppiare le perle alla concentrazione di saturazione osservata (come descritto al punto 2.1.3) e incubare secondo il punto 2.1.2.
- Bloccare e lavare le perline secondo il passaggio 2.2.
- Incubazione con l'antigene
- Per determinare il limite di rilevazione, distribuire l'equivalente di 100 μL della preparazione di microsfere bloccate in provette contenenti diverse quantità della proteina ricombinante Pf HRP2 (1 μg/mL) (r PfHRP2, 10 μg, 1 μg, 0,1 μg, 0,01 μg, 0,001 μg, 0,0001 μg e 0 μg) diluita in 10 mM PBS + 0,5% BSA in triplice.
NOTA: Questa proteina ricombinante è stata sviluppata nel lavoro di Sousa et al.9. - Incubare le soluzioni di microsfere con la proteina rPfHRP2 come descritto al punto 2.1.2 per 1 ora.
- Eseguire i lavaggi come descritto al punto 2.1.4 ed eliminare il surnatante dopo la centrifugazione.
- Per determinare il limite di rilevazione, distribuire l'equivalente di 100 μL della preparazione di microsfere bloccate in provette contenenti diverse quantità della proteina ricombinante Pf HRP2 (1 μg/mL) (r PfHRP2, 10 μg, 1 μg, 0,1 μg, 0,01 μg, 0,001 μg, 0,0001 μg e 0 μg) diluita in 10 mM PBS + 0,5% BSA in triplice.
- Incubazione con l'anticorpo primario
- Aggiungere 2 μg di anticorpo IgG di topo contro la proteina rPfHRP2 diluito in 10 mM PBS + 0,5% BSA a un volume finale di 100 μL in ciascun campione. Incubare i campioni come descritto al punto 2.1.2 ed eliminare il surnatante dopo l'ultima centrifugazione.
NOTA: Questo anticorpo è stato sviluppato nel lavoro di Sousa et al.9.
- Aggiungere 2 μg di anticorpo IgG di topo contro la proteina rPfHRP2 diluito in 10 mM PBS + 0,5% BSA a un volume finale di 100 μL in ciascun campione. Incubare i campioni come descritto al punto 2.1.2 ed eliminare il surnatante dopo l'ultima centrifugazione.
- Incubazione con l'anticorpo secondario
- Aggiungere 100 μL di anticorpo fluorescente anti-topo (2 mg/mL) diluito a 1:2.000 in PBS 10 mM + 0,5% BSA a ciascun campione. Incubare come descritto al punto 2.1.2 e risospendere in 250 μL (0,016% di concentrazione finale di microsfere) di PBS 10 mM filtrato. Eseguire la lettura secondo la sezione 5.
4. Lettura del citometro a flusso dei campioni
- Impostazione della citometria: Allineamento dei parametri ottici del citometro accoppiato a un computer
- Accendere il computer e il citometro a flusso e attendere alcuni minuti affinché l'apparecchiatura si colleghi al computer.
- Fare clic sul software di citometria installato sul computer e accedere. Dall'area di lavoro del software, selezionare Citometro | Avvio | Modalità di pulizia | Fluidi SIT.
NOTA: Le bolle d'aria e le ostruzioni devono essere rimosse durante il processo di avvio del citometro prima dell'acquisizione del campione.
- Controllo di qualità
- Utilizzare il reagente di controllo qualità per controllare le tensioni delle provette fotomoltiplicatrici e valutare la sensibilità del citometro.
- Posizionare il reagente di configurazione del citometro e le perle di tracciamento in un tubo di polistirene con tappo di 12 mm x 75 mm.
- Mescolare delicatamente il tubo mediante vortice.
- Preparazione delle perline di sospensione
- Per definire la linea di base, aggiungere 0,5 mL di diluente (PBS filtrato 10 mM, pH 7) e tre gocce di microsfere al tubo di polistirene con tappo da 12 mm x 75 mm. Agitare delicatamente il tubo prima dell'uso.
- Nell'area di lavoro del software del citometro, selezionare Citometro | CST e attendere che il citometro si disconnetta dall'interfaccia del software del citometro e si connetta all'interfaccia CS&T. Osservare il seguente messaggio sulla barra di stato del software del citometro nella parte inferiore dello schermo: Citometro disconnesso.
- Utilizzare il tubo di polistirene con tappo da 12 mm x 75 mm contenente il reagente per il controllo qualità e collegarlo alla sonda del citometro a flusso.
- Verifica della configurazione del citometro
- Nella finestra Riepilogo sistema , verificare che la configurazione del citometro sia appropriata per l'esperimento.
- Configurazione per un controllo delle prestazioni
- Seleziona l'ID delle perline di installazione corrispondente al lotto di perline di ricerca CS&T.
- Controllo delle prestazioni
- Collegare il tubo alla sonda del citometro a flusso e fare clic sulla finestra Setup Control . Selezionare Controlla prestazioni e fare clic su Esegui.
- Una volta completato il controllo delle prestazioni, attendere l'apertura di una finestra di dialogo. Effettuate una delle seguenti operazioni:
- Per visualizzare il rapporto sulle prestazioni del citometro , fare clic su Visualizza rapporto.
- Per completare il controllo delle prestazioni e tornare alla visualizzazione di configurazione dell'area di lavoro, fare clic su Fine.
- Osservare il risultato finale dell'analisi morfometrica e di sensibilità alla fluorescenza che appare in System Summary | Prestazioni del citometro Risultato con lo stato SUPERATO.
- Rimuovere la provetta dal citometro. Controllare i risultati delle prestazioni del citometro visualizzati nella finestra Riepilogo sistema .
5. Analisi del campione mediante citometria a flusso
- Accedere al software del citometro.
- Dall'area di lavoro del software del citometro, selezionare Citometro | Modalità di pulizia | Fluidi SIT.
- Adattarsi all'area di lavoro del software.
- Definire la strategia di gating in base alle caratteristiche morfometriche e di fluorescenza delle particelle di controllo negativo (perline senza fluorescenza).
- Per determinare la morfometria cellulare, scegliere Dot Plot Plot Graphic per l'analisi dei parametri FSC-A utilizzando SSC-A (Figura supplementare 1A).
- Determinare le singole celle in base a SSC utilizzando Dot Plot Plot Graphic per l'analisi di SSC-H sull'asse y e SSC-W sull'asse x (Figura supplementare 1B) e determinare le singole celle in base a FSC utilizzando Dot Plot Plot Graphic per l'analisi di FSC-H sull'asse y e FSC-W sull'asse x (Figura 1C supplementare).
- Per le analisi di fluorescenza, scegliere FL1 Dot Plot Plots utilizzando FCS-A. Utilizzare un tubo di polistirene con tappo da 12 mm x 75 mm contenente campioni non etichettati e campioni precedentemente etichettati con Alexa Fluor 488 monocolore (Figura supplementare 1D, E).
- Acquisire il campione in citometria a flusso.
- Utilizzare una provetta di polistirene con tappo da 12 mm x 75 mm contenente i campioni precedentemente etichettati. Mescolare con cura il contenuto della provetta, collegare la provetta alla sonda del citometro a flusso e fare clic con il pulsante sinistro del mouse su Acquisisci.
- Per impostare la potenza dei laser, fare clic su Parametri e, nelle opzioni seguenti, regolare la tensione dell'FSC a 182 V e la tensione dell'SSC a 236 V. Per impostare la soglia, fare clic su Citometro | Soglia e, nelle opzioni seguenti, regolare l'FSC a 500 V.
- Impostare il gate di analisi per caratterizzare le particelle in base alle dimensioni e alla complessità, nonché per eseguire l'analisi di una singola cella.
- Per rimuovere l'autofluorescenza, analizzare il campione privo di colorante contenente solo le perle di lattice e regolare le tensioni del rivelatore: nelle opzioni seguenti, regolare la tensione dell'FL1 (FITC) a 332 V.
- Impostare il gate di analisi della fluorescenza in formato quadrangolare dal punto negativo mostrato nel grafico del dot plot.
- Dopo aver regolato le analisi morfometriche e fluorescenti, configurare il dispositivo per 50.000 eventi: in Acquisizione, cliccare su Registra.
Risultati
La Figura 2 fornisce una rappresentazione grafica del processo di estrazione degli anticorpi IgY tramite acidificazione, seguita da separazione mediante acido caprilico (Figura 2).
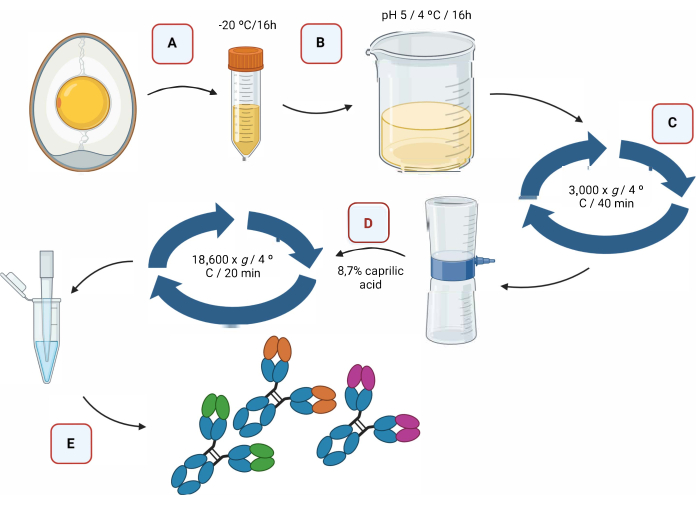
Figura 2: Rappresentazione schematica della fase di estrazione degli anticorpi IgY...
Discussione
Il metodo di precipitazione dell'anticorpo IgY mediante riduzione del pH seguita da separazione lipidica mediante acido caprilico è efficiente nell'isolare gli anticorpi totali senza alcuna perdita di funzionalità. Il metodo qui proposto è più semplice ed economico di quello riportato da Redwan et al.11, che utilizzava anch'esso la precipitazione per acidificazione e acido caprilico ma con un protocollo più complesso e laborioso. Questo metodo presenta anche vantaggi rispetto alle metodologie...
Divulgazioni
Gli autori dichiarano di non avere potenziali conflitti di interesse in relazione alla ricerca, alla paternità e alla pubblicazione di questo articolo.
Riconoscimenti
Ringraziamo il FIOCRUZ ("Programa de excelência em pesquisa básica e aplicada em saúde dos laboratórios do Instituto Leônidas e Maria Deane - ILMD/Fiocruz Amazônia-PROEP-LABS/ILMD FIOCRUZ AMAZÔNIA"), il Programma post-laurea in Biotecnologie (PPGBIOTEC presso l'Universidade Federal do Amazonas - UFAM), il Coordenação de Aperfeiçoamento de Pessoal de Nível (CAPES) e la Fundação de Amparo à Pesquisa do Estado do Amazonas (FAPEAM) per aver fornito le borse di studio. La Figura 2 e la Figura 4 sono state create con biorender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| Anti-Chicken IgY (H+L), highly cross-adsorbed, CF 488A antibody produced in donkey | Sigma-Aldrich | SAB4600031 | |
| Anti-mouse IgG (H+L), F(ab′)2 | Sigma-Aldrich | SAB4600388 | |
| BD FACSCanto II | BD Biosciences | BF-FACSC2 | |
| BD FACSDiva CS&T research beads (CS&T research beads) | BD Biosciences | 655050 | |
| BD FACSDiva software 7.0 | BD Biosciences | 655677 | |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | #5000006 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Caprilic acid | Sigma-Aldrich | O3907 | |
| Centrifuge 5702 R | Eppendorf | Z606936 | |
| Chloride 37% acid molecular grade | NEON | 02618 NEON | |
| CML latex, 4% w/v | Invitrogen | C37253 | |
| Megafuge 8R | Thermo Scientific | TS-HM8R | |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide Hydrochloride Powder (EDC) | Sigma-Aldrich | E7750-1G | |
| N-Hydroxysuccinimide (NHS) | Sigma-Aldrich | 130672-25G | |
| Phosphate buffered saline | Sigma-Aldrich | 1003335620 | |
| Sodium hydroxide | Acs Cientifica | P.10.0594.024.00.27 | |
| Sodium hypochlorite | Acs Cientifica | R09211000 | |
| Thermo Mixer Heat/Cool | KASVI | K80-120R |
Riferimenti
- Salzer, U., Sack, U., Fuchs, I. Flow cytometry in the diagnosis and follow up of human primary immunodeficiencies. Electronic Journal of the International Federation of Clinical Chemistry and Laboratory. 30 (4), 407 (2019).
- de Figueiredo, A. M., Glória, J. C., Chaves, Y. O., Neves, W. L. L., Mariúba, L. A. M. Diagnostic applications of microsphere-based flow cytometry: A review. Experimental Biology and Medicine. 247 (20), 1852-1861 (2022).
- Morgan, E., et al. Cytometric bead array: A multiplexed assay platform with applications in various areas of biology. Clinical Immunology. 110 (3), 252-266 (2004).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Kellar, K. Multiplexed microsphere-based flow cytometric assays. Experimental Hematology. 30 (11), 1227-1237 (2002).
- Schade, R., et al. Chicken egg yolk antibodies (IgY-technology): A review of progress in production and use in research and human and veterinary medicine. ATLA Alternatives to Laboratory Animals. 33 (2), 129-154 (2005).
- Xu, Y., et al. Application of chicken egg yolk immunoglobulins in the control of terrestrial and aquatic animal diseases: A review. Biotechnology Advances. 29 (6), 860-868 (2011).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Sousa, L. P., et al. A novel polyclonal antibody-based sandwich ELISA for detection of Plasmodium vivax developed from two lactate dehydrogenase protein segments. BMC Infectious Diseases. 14 (1), 49 (2014).
- Klimentzou, P., et al. Development and immunochemical evaluation of antibodies Y for the poorly immunogenic polypeptide prothymosin alpha. Peptides. 27 (1), 183-193 (2006).
- Redwan, E. M., Aljadawi, A. A., Uversky, V. N. Simple and efficient protocol for immunoglobulin Y purification from chicken egg yolk. Poultry Science. 100 (3), 100956 (2021).
- Lee, H. Y., Abeyrathne, E. D. N. S., Choi, I., Suh, J. W., Ahn, D. U. K. Sequential separation of immunoglobulin Y and phosvitin from chicken egg yolk without using organic solvents. Poultry Science. 93 (10), 2668-2677 (2014).
- Pauly, D., Chacana, P., Calzado, E., Brembs, B., Schade, R. IgY Technology: Extraction of chicken antibodies from egg yolk by polyethylene glycol (PEG) precipitation. Journal of Visualized Experiments. (51), e3084 (2011).
- Chang, H. M., Lu, T. C., Chen, C. C., Tu, Y. Y., Hwang, J. Y. Isolation of immunoglobulin from egg yolk by anionic polysaccharides. Journal of Agricultural and Food Chemistry. 48 (4), 995-999 (2000).
- Ko, K. Y., Ahn, D. U. Preparation of immunoglobulin Y from egg yolk using ammonium sulfate precipitation and ion exchange chromatography. Poultry Science. 86 (2), 400-407 (2007).
- Polson, A. Isolation of IgY from the yolks of eggs by a chloroform polyethylene glycol procedure. Immunological Communications. 19 (3), 253-258 (1990).
- Simonova, M. A., et al. xMAP-based analysis of three most prevalent staphylococcal toxins in Staphylococcus aureus cultures. Analytical and Bioanalytical Chemistry. 406 (25), 6447-6452 (2014).
- Sharma, P., et al. A multiplex assay for detection of staphylococcal and streptococcal exotoxins. PLoS One. 10 (8), e0135986 (2015).
- Merbah, M., et al. Standardization of a cytometric p24-capture bead-assay for the detection of main HIV-subtypes. Journal of Virological Methods. 230, 45-52 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon