Method Article
多重免疫荧光结合空间图像分析,用于肿瘤微环境的临床和生物学评估
摘要
本文描述了一种手动酪胺信号放大(TSA)多重免疫荧光(mIF)结合图像分析和空间分析的方案。该方案可与福尔马林固定石蜡包埋(FFPE)切片一起使用,根据实验室中可用的玻片扫描仪,每张载玻片可染色两到六种抗原。
摘要
肿瘤微环境(TME)由大量不同的细胞类型组成,例如细胞毒性免疫细胞和免疫调节细胞。根据其组成以及癌细胞与肿瘤周围细胞之间的相互作用,TME可能会影响癌症进展。肿瘤及其复杂微环境的表征可以提高对癌症疾病的理解,并可能有助于科学家和临床医生发现新的生物标志物。
我们最近开发了几种基于酪胺信号放大(TSA)的多重免疫荧光(mIF)组合,用于表征结直肠癌、头颈部鳞状细胞癌、黑色素瘤和肺癌中的TME。完成相应面板的染色和扫描后,在图像分析软件上分析样品。然后将每个细胞的空间位置和染色从该定量软件导出到R中。我们开发了R脚本,不仅可以分析几种肿瘤区室(例如肿瘤中心,肿瘤边缘和基质)中每种细胞类型的密度,还可以在不同细胞类型之间进行基于距离的分析。
此特定工作流为已针对多个标记例行执行的经典密度分析增加了空间维度。mIF分析可以使科学家更好地了解癌细胞与TME之间的复杂相互作用,并发现对治疗反应的新预测生物标志物,例如免疫检查点抑制剂和靶向治疗。
引言
随着靶向治疗和免疫检查点抑制剂的发展,更好地表征癌细胞与其肿瘤微环境之间的相互作用变得至关重要,这是目前转化研究的一个重要领域。TME由大量不同的细胞类型组成,其中免疫细胞毒性细胞靶向癌细胞和免疫调节细胞的平衡可能有利于肿瘤生长和侵袭性1,2,3,4。对这种复杂环境的表征可以提高对癌症疾病的理解,并可能有助于科学家和临床医生发现新的预测和预后生物标志物,以便更好地选择患者进行未来的治疗5,6。例如,Galon和他的团队开发了Immunoscore,这是一种可重复的评分方法,可以用作预测生物标志物。免疫评分是使用侵袭性边缘和肿瘤中心的 CD3+ 和 CD8+ T 细胞的密度计算的7,8。
在过去的几十年中,已经开发了mIF的商业解决方案,但这些解决方案通常很昂贵,并且是为特定的抗原组合设计的。为了克服学术和转化研究中对特定抗原组合的需求,我们开发了一种具有成本效益的方法来对FFPE肿瘤切片进行mIF,允许对添加到细胞核中的两到六种抗原进行染色,对人和小鼠样品进行复染。
一旦整个组织切片被染色并用荧光载玻片扫描仪扫描,就可以通过几个支持大型金字塔数据集的图像分析软件分析样品。最后,原始数据可用于统计计算和图形环境,如 R 软件 (v.4.0.2),以便执行密度和基于空间的分析。
本手稿介绍了针对五标记染色优化的方案,以及优化新面板的技巧和技巧。此外,还解释了图像分析的详细步骤以及用于统计和空间分析的R函数。
研究方案
本协议中使用的所有样品均来自当地伦理委员会批准并经主管当局授权的研究。研究的所有参与者都提供了书面知情同意书。该试验已在 ClinicalTrials.gov 注册(NCT03608046)。
1. 多重免疫荧光
- FFPE切片
- 将组织固定在4%多聚甲醛中,并将固定组织嵌入石蜡中。
- 切割5μm切片,并将它们放在粘性显微镜载玻片上。
- 在室温(RT)下将载玻片干燥过夜。
- 脱蜡和内源性过氧化物酶抑制
- 通过将载玻片浸入甲苯(每个3x,每个5分钟)和甲醇(每个3x,每个5分钟)中来脱蜡组织。
- 通过将载玻片浸入用甲醇稀释的3%过氧化氢中在通风橱下20分钟来抑制内源性过氧化物酶。
- 在蒸馏(d)H2O(1x中冲洗载玻片3分钟)。
- 多重免疫荧光染色
- 将载玻片浸没在含有 10 mM 柠檬酸盐 (pH 6) 或 EDTA (pH 9) 缓冲液并补充有 0.1% TritonX-100 的 300 mL 染色罐中。
注意:使用的缓冲液(pH 6或pH 9)取决于染色的抗原(见 表1)。 - 将染色罐盖在微波炉中以最大功率(例如,900 W)关闭3-5分钟,直到缓冲液开始沸腾。
注意:煮沸的最佳时间取决于微波炉和缓冲液的体积。可能需要进行调整以找到完美的时机。对于一些脆弱的抗原或易碎且贴壁性较差的标本(例如类器官和球状体),微波煮沸可能过于苛刻。在这种情况下,可以使用压力锅代替。 - 通过将封闭的染色罐以低功率(例如90W)放入微波炉中15分钟,将缓冲液保持在接近沸腾的温度。
- 通过将微波炉置于最大功率90秒来执行加热的最后一步。
- 从微波炉中取出罐子,让缓冲液在室温下冷却15分钟。
- 在dH2O中冲洗载玻片3次,每次冲洗5分钟,在含有0.1%吐温20(TBS-T)的三缓冲盐水中冲洗1x5分钟。
- 通过在纸巾上吸干载玻片来取出TBS-T
- 将载玻片(平坦)放在染色室托盘或显微镜载玻片盒上(参见 材料表)。
- 用疏水笔包围组织。
- 通过用溶解在TBS-T中的5%牛血清白蛋白(BSA)覆盖组织30分钟来阻断非特异性结合位点。
- 通过在纸巾上吸干载玻片来去除封闭缓冲液。
注意:阻塞步骤后不要冲洗载玻片。 - 用约300μL溶液覆盖组织,用1%BSA TBS-T稀释的一抗(参见 表1)孵育组织60分钟。
- 用TBS-T冲洗载玻片3次,每次3分钟。
- 用约300μL溶液覆盖组织,用poly-HRP二抗(见 表1)孵育组织40分钟。
- 用TBS-T冲洗载玻片3次3分钟。
- 用荧光染料酪胺试剂(参见表1)在硼酸盐缓冲液(0.1M硼酸盐,pH 7.8,3M NaCl)中稀释200倍,即席补充0.003%H 2 O2,用约300μL溶液覆盖组织,将组织孵育10分钟。
- 用TBS-T冲洗载玻片3次3分钟。
- 重复步骤1.3.1-1.3.16,直到完成所有TSA染色。
- 将组织在4°C下孵育过夜,最后一个一抗(参见表1)在 1%BSA TBS-T中稀释。
注意:由于孵育是过夜的,因此重要的是要盖上染色室托盘或显微镜载玻片盒,并在盒子底部(载玻片下方)的纸巾上添加dH2O,以确保组织在孵育过程中不会干燥。 - 用TBS-T冲洗组织3次,每次5分钟。
- 将组织与在1%BSA TBS-T中稀释200倍的二抗(与荧光染料直接偶联)孵育120分钟。
- 用TBS-T冲洗组织3次,每次5分钟。
- 通过将组织在10%BSA TBS-T中稀释1,000倍的双苯甲酰亚胺(20mM)中孵育5分钟来染色细胞核。
注意:双苯甲酰亚胺可以用DAPI代替,但后者毒性更大,必须在通风橱下小心处理。 - 在dH2O中冲洗组织3次,每次3分钟。
- 使用荧光安装介质和硼硅酸盐盖玻片安装载玻片。
- 将载玻片浸没在含有 10 mM 柠檬酸盐 (pH 6) 或 EDTA (pH 9) 缓冲液并补充有 0.1% TritonX-100 的 300 mL 染色罐中。
2. 玻片扫描
- 通过在荧光载玻片扫描仪上以20倍放大倍率扫描载玻片来数字化载玻片(载玻片扫描仪的详细信息在 材料表中提供)。
注意:最佳多路复用的代表性扫描如图 1所示。
3. 图像分析
- 将扫描导入图像分析软件(文件>打开图像)。
- 转到分类 器 选项卡,然后选择 DenseNet AI V2 插件。
- 训练 DenseNet AI V2 插件通过在一张图像中包围大约 500 个原子核来识别原子核。
- 通过围绕几张载玻片(约 10 张)上的多个细胞核 (50) 来训练来自同一批次的其他几张载玻片和不同批次的 mIF 染色的 AI。
注意:有关如何使用 AI 插件的详细说明,请参阅软件手册。使用 AI 进行细胞核检测是可选的。根据所使用的图像分析软件,可以使用其他检测细胞核的方法。 - 保存经过训练的 AI(分类器操作>保存)。
- 转到“ 注释 ”选项卡,然后使用 “笔注释工具”为每个感兴趣区域 (ROI) 创建注释,例如肿瘤中心和肿瘤边缘。
- 如有必要,请使用“ 排除注释工具”删除具有褶皱的区域和看起来模糊的区域。
注意:可以在mIF染色之前对与用于mIF的部分相邻的部分进行苏木精-伊红染色,以确保标本中存在肿瘤细胞并帮助解剖病理学家确定ROI。 - 转到 “分析 ”选项卡,然后选择 “HighPlex FL ”算法(>加载> HighPlex FL的设置操作)。
- 选择 “染料选择 ”选项卡,然后选择感兴趣的染料。
- 在 “核检测 ”选项卡中,转到“ 核分割类型”,然后选择“AI 自定义”。
- 在 “核分割分类器”中,选择在步骤 3.5 中保存的 AI。
- 在 “膜和 细胞质检测”选项卡中,选择最大细胞质半径(在本研究中,使用 1.5)和膜染料的数量。
- 对于每种染料,选择细胞核阳性阈值、细胞质阳性阈值和膜阳性阈值。
注意:每种染色的阈值不同,应针对每批载玻片和每种抗原染色进行调整。使用“视图 设置 ”工具(“视图>视图设置”)可以帮助通过使用强度峰值末尾(右侧)的强度值来选择适当的阈值。 - 对于每种染料,选择细胞核、膜和细胞质的完整性百分比值。
注意:当两个具有不同染色的细胞彼此靠近时,此参数对于避免假阳性检测非常重要(图2)。 - 保存算法(设置操作>保存)。
- 分析 ROI(分析>注释图层)。
- 转到 “结果 ”选项卡,然后选择 “对象数据 ”(ctrl + A) 中的所有数据。
- 以.csv格式导出数据(右键单击>导出>对象数据。Csv)。
注意:此表包含位置(Xmin,Xmax;Ymin,Ymax)和每个分析细胞的每个标记物的阳性性。
4. 使用R的生物信息学
注意:GitHub 上提供了提供有关以下步骤的更多详细信息的 R 脚本(benidovskaya/Ring:用于分析多重免疫荧光染色的管道。[github.com])
- 使用导出的表格,首先根据共定位染色定义不同的细胞类型。例如,通过双阳性 CD3+/CD8+ 细胞定义细胞毒性 T 细胞。
- 然后,使用从图像分析软件和ggplot2(图3).使用这些数据,可以执行多种类型的分析:
- 密度分析
注意:最简单的分析是密度分析。- 使用整个载玻片进行活检或组织的某些特定区域对所有细胞类型进行密度分析。例如,计算肿瘤中心和肿瘤边缘的CD3 +和CD8 + T细胞的密度(图4A-C)。
- 要计算这些密度,请使用图像分析软件为每个样品生成具有每个细胞表型和坐标的特定数据框。通过R上的聚类函数(k-最近邻),使用所研究的活检的边界创建一个多边形对象,并计算其内部感兴趣细胞类型的密度。
注意:这允许比较不同条件(例如不同的时间点,治疗类型,组织类型和对治疗的反应)和定位(肿瘤中心,肿瘤边缘,基质纤维化和坏死区域)之间不同细胞类型的密度取决于生物学假设。由于癌细胞、肿瘤周围细胞和肿瘤浸润细胞之间的高度接近,图像分析软件可以同时将双阳性细胞检测为免疫细胞和癌细胞。在这种情况下,人们需要通过提及这些双阳性细胞是什么来生物信息学地纠正这个问题。在这种情况下,CD3 + CD8 + 细胞角蛋白+细胞被标记为细胞毒性细胞,因为细胞角蛋白阳性是由于浸润淋巴细胞周围的肿瘤细胞。
- 热图
- 使用来自不同面板的每种细胞类型的密度并应用归一化(例如,缩放居中),绘制表示样品群中细胞丰度的热图(图5)。
- 使用基于细胞密度的分层无监督聚类,对具有相似TME组成的患者进行聚类,并将这些聚类与临床参数(如治疗反应和生存)相关联。
注意:热图和聚类可以使用 R ComplexHeatmap 包9 轻松执行。
- 空间像元分布
- 以生物信息学方式计算细胞(例如,免疫细胞和肿瘤细胞; 图6A,B)基于图像提供的细胞坐标进行分析。使用感兴趣的细胞类型之间的中位数和平均距离来比较队列中所有样本的细胞邻近性。
- 空间描述函数
- 使用通过R spatstat包10提供的十字型最近邻G-cross函数来确定感兴趣的细胞X(例如肿瘤细胞)在细胞X周围的一定半径内遇到最近的细胞Y(例如T细胞)的概率。
- 计算经验曲线下的面积,以获得表示肿瘤细胞11 周围CD3 + T细胞肿瘤浸润的数值(图6C)。使用其他空间描述函数,例如 F 函数或 J 函数12。
- 免疫评分分析
- 计算由Galon7,8团队开发的免疫评分(I),通过使用肿瘤中心的CD3 +和CD8 + T细胞的密度以及肿瘤的侵袭性边缘。
注意:分数范围从 I0 到 I4。肿瘤中心和边缘的CD3+和CD8 + T细胞密度低与I0评分相关,而两个区域的CD3 +和CD8 + T细胞密度均与I4评分相关。最近,Immunocore的预后影响在一项研究中得到了验证,该研究对来自13个国家14个中心的2,681名I-III期结肠癌患者的样本进行了验证7。然而,要计算,免疫评分需要一个包含肿瘤中心和边缘的手术切除标本。对于通常没有边缘的活检,最近开发了适应活检的免疫评分13。 - 要计算活检适应免疫评分,请将 CD3+ 和 CD8+ T 细胞密度的值转换为百分位数,然后使用 CD3+ 和 CD8+ T 细胞的平均百分位数评分分为三类(即低、中和高)之一13。
- 计算由Galon7,8团队开发的免疫评分(I),通过使用肿瘤中心的CD3 +和CD8 + T细胞的密度以及肿瘤的侵袭性边缘。
- 热点分析
- 通过使用四边形计数函数(spatstat)10,使用热点分析来比较组织浸润最多区域中不同细胞类型的密度。例如,可以使用组织浸润最多的方块的CD3和CD8 T细胞密度值来计算“类似免疫评分”评分(图7)。将该方法应用于分析组织中分布不均匀的任何细胞类型。
- 密度分析
结果
按照此协议,应研究几个参数以确保组织正确染色。首先,在扫描过程中使用低曝光时间(通常为2-100毫秒)时,TSA染色应显示出良好的动态范围。低暴露时间意味着在与HRP反应期间已正确进行扩增。对于用与荧光染料直接偶联的二抗染色的抗原,曝光时间可能更长,这可能导致光漂白(由于暴露时间长导致信号强度降低)。其次,重要的是要验证每个染色是否显示高SNR。高背景信号和低抗原信号可能表明一抗特异性不够,内源性过氧化物酶未正确失活,或者方案的某个步骤未充分完成。第三,根据玻片扫描仪和用于扫描的滤光片组,可以看到两种颜色(例如AF555、AF594和AF647)之间的重叠。在扫描仪上选择合适的滤光片组和正确的一抗稀释液对于避免可能的交叉检测至关重要。质量控制包括检测扫描文件上每个标记物的单个染色细胞。最后,为每批染色添加阳性和阴性对照也很重要。对于免疫细胞,扁桃体是一个很好的阳性对照。最佳染色的代表性结果如图 1所示。
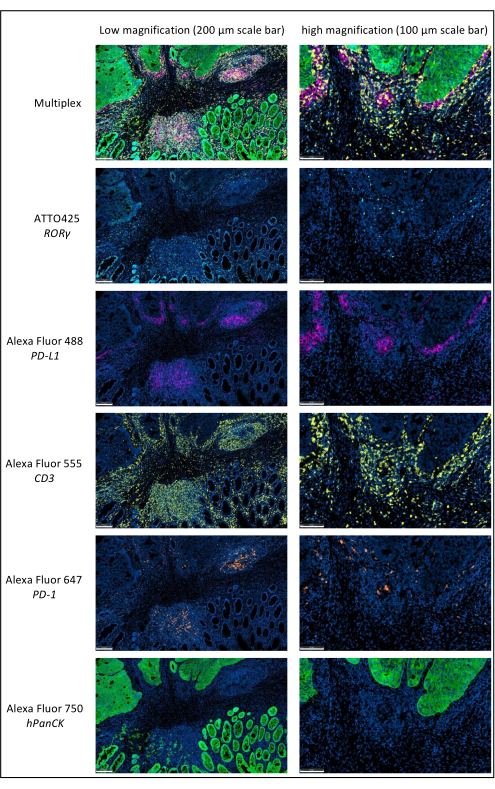
图1:多重免疫荧光染色的局部晚期直肠癌。 缩写:PD-1 = 程序性细胞死亡蛋白 1;PD-L1 = 程序性死亡配体 1;ROR-γ = RAR 相关孤儿受体 γ;CD3 = 分化簇 3;hPanCK = 人全细胞角蛋白。每个抗原染色都以灰度扫描,图中呈现的颜色是伪色。比例尺低放大倍率:200 μm;比例尺高放大倍率:100 μm。 请点击此处查看此图的大图。
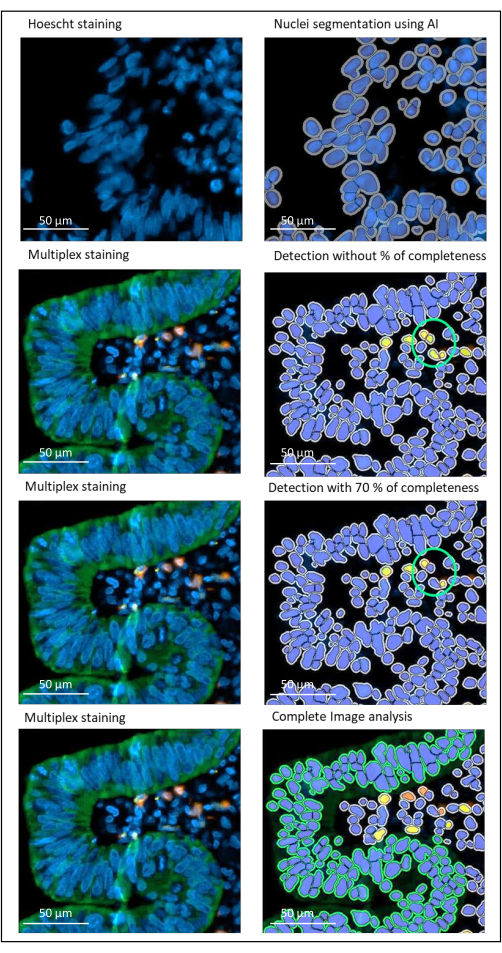
图 2:使用图像分析软件对局部晚期直肠癌进行细胞核和染色检测。 如果没有正确设置完整性百分比参数,软件会检测两个CD8 +细胞(绿色圆圈),因为它们彼此靠近,但只有一个细胞被染色。使用 70% 的完整性有助于避免这种误报检测。绿色 = hPanCK;黄色 = CD3;橙色 = CD8。比例尺: 100 μm 请点击此处查看此图的大图。
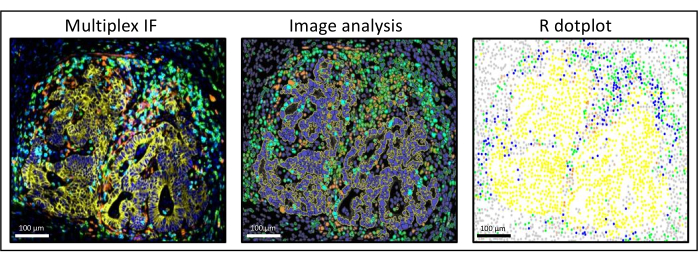
图3:肝结直肠癌转移的图像分析和R点图重建。在多重染色(左)上,人全细胞角蛋白为黄色,CD3为绿色,CD8为浅蓝色,IDO为橙色。在点图(右)上,人泛细胞角蛋白+细胞为黄色,CD3 + CD8−细胞为绿色,CD3 + CD8 +细胞为蓝色,IDO+细胞为橙色。请点击此处查看此图的大图。
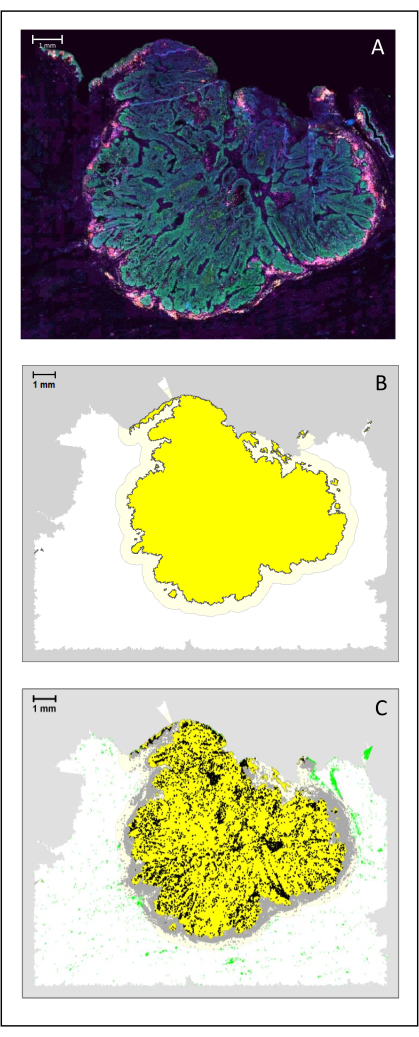
图4:HNSCC的手术切片分析。 (A)HNSCC的手术切片。癌细胞以绿色可见。肿瘤胰岛周围可见肿瘤周围细胞(CD3为黄色,CD8为紫色)。(B)肿瘤的中心(黄色,黑色边框)由k-最近邻算法根据肿瘤岛与单个区域之间的距离进行生物信息学计算。在这个区域周围,以任意500μm计算侵入性边缘(带有灰色边框的浅黄色)。(C)侵袭性T细胞在肿瘤中心用黑点突出显示,在侵袭性边缘用灰点突出显示。其他 T 细胞以浅绿色圆点突出显示。比例尺:1毫米。 请点击此处查看此图的大图。
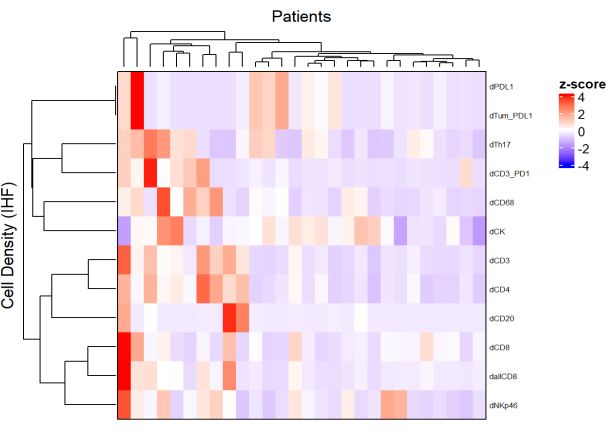
图5:局部晚期直肠癌活检不同细胞类型密度的热图。热图是使用ComplexHeatmap软件包对来自不同多重面板的不同细胞类型的密度进行无监督聚类绘制的。缩放和居中用于归一化。请点击此处查看此图的大图。
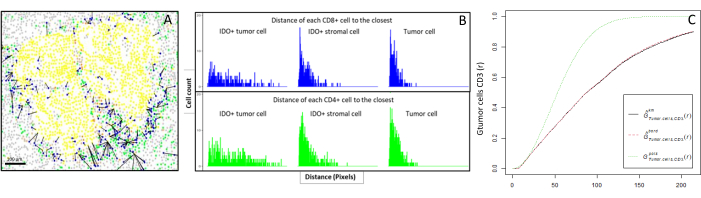
图6:CD4 +和CD8 +细胞到每个IDO +或肿瘤细胞的距离。 人全细胞角蛋白+细胞为黄色,CD3 + CD8−细胞为绿色,CD3 + CD8 +细胞为蓝色,IDO+细胞为橙色。(A)肿瘤细胞与每个CD8+ T细胞之间的最接近距离。(B)IDO+细胞与每个CD8 + T细胞(蓝色)或CD4 + T细胞(绿色)之间距离的条形图。(C) 通过 G 十字函数分析的样品示例。y轴显示肿瘤细胞在肿瘤细胞周围0-200μm半径范围内遇到CD3 +淋巴细胞的概率。显示了三条曲线;理论曲线为绿色虚线(泊松分布),带公里校正的校正经验曲线为黑色,带边框校正的校正经验曲线为红色虚线。 请点击此处查看此图的大图。
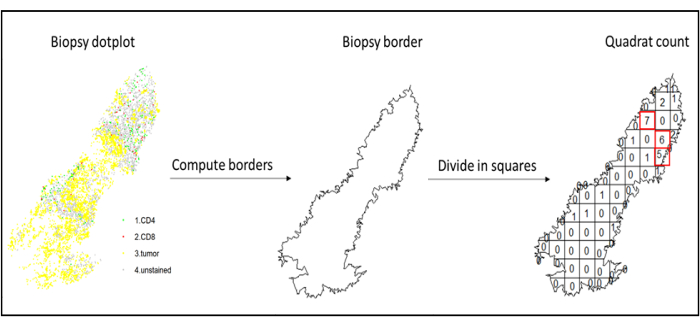
图 7:四方计数的图示。边界计算和四边形计数是使用 spatstats 包执行的。渗透最多的方块(热点)可用于下游统计信息。CD4为绿色,CD8为红色,肿瘤细胞为黄色。请点击此处查看此图的大图。
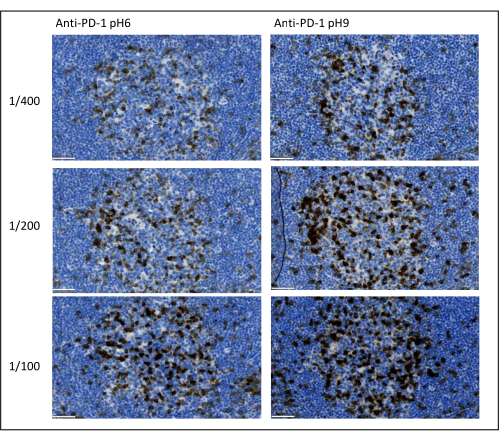
图 8:抗体稀释和抗原修复优化。 使用三种不同的稀释液和两种不同的一抗抗原修复溶液(柠檬酸盐 pH 6 和 EDTA pH 9)对 PD-1 进行显色检测。比例尺:50 μm。 请点击此处查看此图的大图。
| 一抗 | 稀释 | 抗原修复 | 二抗 | 荧光染料 | 位置 |
| PD-1 | 1/100 | 乙二胺四乙酸 (pH 9) | 防兔 | AF647 | 1 |
| PD-L1 | 1/1000 | 乙二胺四乙酸 (pH 9) | 防兔 | AF488 | 2 |
| ROR-γ | 1/200 | 乙二胺四乙酸 (pH 9) | 防鼠标 | ATT0-425 | 3 |
| CD3 | 1/100 | 柠檬酸盐(pH 6) | 防兔 | AF555 | 4 |
| hPanCK | 1/50 | 柠檬酸盐(pH 6) | 防鼠标与AF750耦合 | 5 | |
表 1:优化的多重组合示例。 缩写:PD-1 = 程序性细胞死亡蛋白 1;PD-L1 = 程序性死亡配体 1;ROR-γ = RAR 相关孤儿受体 γ;CD3 = 分化簇 3;hPanCK = 人全细胞角蛋白;AF = 亚历克萨福陆;EDTA = 乙二胺四乙酸。CD3 用于检测 T 淋巴细胞;PD-1用于检测耗尽的淋巴细胞;ROR-γ用于检测Th-17;hPanCK用于检测肿瘤细胞。位置列指示必须执行顺序多路复用的顺序。
讨论
优化多重染色需要考虑的最重要参数是稀释度、特异性和用于每种一抗的抗原修复。在开始多重方案之前,必须使用显色染色(DAB)测试每种一抗的最佳稀释度和最佳表位修复(pH 6或pH 9)。我们建议对每种抗原修复缓冲液测试三种稀释液:通常由品牌指定的稀释度将抗体商业化,相同的稀释度分为两倍,相同的稀释度乘以两倍(图8)。选择正确的稀释度是验证抗体特异性和优化染色信噪比(SNR)的非常重要的步骤。在DAB中选择正确的稀释度后,应使用单重TSA对每种一抗测试相同的稀释度。一旦为每种抗原染色选择了稀释液和表位修复缓冲液,正确设置多重测序也很重要;具体来说,一些抗原在第一个位置染色更好,而另一些抗原在最后一个位置染色更好。我们建议使用所有可能的顺序排列来测试多重标记,以选择哪种抗原染色应该首先、第二等。这也是一个非常重要的步骤,因为一些脆弱的抗原在几轮表位修复后可以降解,而一些抗原在几轮表位修复后染色得更好。例如,CD3 的最后一个位置和 PD-1 染色的第一个位置的 SNR 始终较高。此外,几种共定位抗原的染色可能受到伞效应(酪胺反应位点的饱和度)的阻碍。这可以通过降低酪胺浓度来减弱。当一种抗原的表达受到另一种抗原的表达(CD8仅存在于表达CD3的T细胞上)的条件时,我们建议在另一种抗原之后用最广泛的表达(在本例中为CD3)染色抗原。最后,根据扫描仪的特异性为每种抗原染色选择合适的荧光染料也是避免交叉检测的重要步骤。
该技术的主要优点是放大和获得的信噪比。然而,这种技术有一个局限性,即染色是连续的,并且荧光染料与组织共价结合。然而,在进行所有酪胺信号扩增轮次后,也可以用直接偶联荧光染料(无TSA)的二抗添加最后一次染色。在某些面板中,我们使用这种方法在750通道中添加染色。这是必要的,因为当时没有酪酰胺-AF750市售。值得注意的是,用AF750染色的抗原的暴露时间(在扫描期间)将比用TSA染色的其他抗原长得多。在这种情况下,我们建议对高表达蛋白(如细胞角蛋白)进行染色或增加一抗浓度。通过这样做,根据荧光扫描仪的不同,每批载玻片最多可以染色五到六种抗原。
相反,几种市售技术使用连续染色,包括几轮染色、扫描和剥离或光漂白,以提高可以在单个组织切片上染色的抗原数量。然而,这些技术通常耗时、昂贵,没有信号放大,需要先进的计算步骤才能正确合并系列扫描,并且根据我们的经验,由于众多的程序步骤,可能会引起不可逆转的组织损伤。尽管如此,据报道,使用这种方法可以在单个组织上染色多达30种抗原14。
总之,我们的方法是一种稳健、可重复、易于使用且具有成本效益的免疫组组荧光技术,可用于任何拥有荧光载玻片扫描仪的实验室。可以使用任何适用于IHC的商业化一抗,并且该组合不特定于任何商业试剂盒。图像分析可以在几个不同的程序上进行,包括开源程序,如QuPath和R。然而,我们认为这种方法甚至可以在未来改进用于大型抗原组合,允许使用不同的抗原面板对同一载玻片进行连续染色/扫描,并具有信号放大的优势。
披露声明
作者没有利益冲突需要声明。
致谢
作者要感谢Derouane F博士的帮助和支持。Nicolas Huyghe是一名研究员,由比利时国家科学研究基金会(Télévie/FNRS 7460918F)资助。
材料
| Name | Company | Catalog Number | Comments |
| anti-CD3 primary antibody | Abcam | ab16669 | rabbit monocolonal |
| anti-CD8 primary antibody | DAKO | M710301 | mouse monoclonal |
| anti-hPanCK primary antibody | DAKO | M3515 | mouse monoclonal |
| anti-PD-1 primary antibody | Cell Signalling | D4W2J | rabbit monocolonal |
| anti-PD-L1 primary antibody | Cell Signalling | 13684 | rabbit monocolonal |
| anti-RORC primary antibody | Sigma | MABF81 | mouse monoclonal |
| ATTO-425 | ATTOtec | ||
| Axioscan Z1 | Zeiss | Light source: Colibri 7 (385, 430, 475, 555, 590, 630, 735 nm) Filtersets: Excitation 379/34 – beam splitter 409 – emission 440/40; Excitation 438/24 – beam splitter 458 – emission 483/32; Excitation 490/20 – beam splitter 505 – emission 525/20; Excitation 546/10 – beam splitter 556 – emission 572/23; Excitation 592/21 – beam splitter 610 – emission 630/30; Excitation 635/18 – beam splitter 652 – emission 680/42; Excitation 735/40 – beam splitter QBS 405 + 493 + 611 + 762 - emission QBP 425/30 + 524/51 + 634/38 + 785/38; Objective: Plan-Apochromat 20x/0.8; Camera : Orca Flash 4.0 V3 | |
| Borosilicate Cover Glass | VWR | 631-0146 | |
| Envision+ anti-mouse | DAKO | K4001 | |
| Envision+ anti-rabbit | DAKO | K4003 | |
| Fluorescence mounting medium | DAKO | S3023 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 750 | ThermoFischer | A-21037 | |
| HALO software | Indicalabs | ||
| Hoescht | Sigma | 14533 | |
| Superfrost plus microscope slides | Fisherscientific/Epredia | 10149870 | |
| Tyramide-AF488 | ThermoFischer | B40953 | |
| Tyramide-AF555 | ThermoFischer | B04955 | |
| Tyramide-AF647 | ThermoFischer | B04958 |
参考文献
- Ge, P., et al. Profiles of immune cell infiltration and immune-related genes in the tumor microenvironment of colorectal cancer. Biomedicine & Pharmacotherapy. 118, 109228 (2019).
- Fridman, W. H. The immune microenvironment as a guide for cancer therapies. Oncoimmunology. 1 (3), 261-262 (2012).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: Impact on clinical outcome. in Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Calu, V., et al. Key biomarkers within the colorectal cancer related inflammatory microenvironment. Scientific Reports. 11 (1), 7940 (2021).
- Havel, J. J., Chowell, D., Chan, T. A. The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nature Reviews. Cancer. 19 (3), 133-150 (2019).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Mlecnik, B., et al. Integrative analyses of colorectal cancer show immunoscore is a stronger predictor of patient survival than microsatellite instability. Immunity. 44 (3), 698-711 (2016).
- Gu, Z., Eils, R., Schlesner, M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data. Bioinformatics. 32 (18), 2847-2849 (2016).
- Baddeley, A., Rubak, E., Turner, R. . Spatial Point Patterns: Methodology and Applications with R. , (2022).
- Barua, S., et al. Spatial interaction of tumor cells and regulatory T cells correlates with survival in non-small cell lung cancer. Lung Cancer. 117, 73-79 (2018).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- El Sissy, C., et al. A diagnostic biopsy-adapted immunoscore predicts response to neoadjuvant treatment and selects patients with rectal cancer eligible for a watch-and-wait strategy. Clinical Cancer Research. 26 (19), 5198-5207 (2020).
- Bolognesi, M. M., et al. Multiplex staining by sequential immunostaining and antibody removal on routine tissue sections. The Journal of Histochemistry and Cytochemistry. 65 (8), 431-444 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。