Method Article
腫瘍微小環境の臨床的および生物学的評価のための空間画像解析と組み合わせたマルチプレックス免疫蛍光法
要約
本稿では、チラミドシグナル増幅(TSA)マルチプレックス免疫蛍光法(mIF)と画像解析および空間解析を組み合わせたプロトコルについて説明します。このプロトコルは、実験室で利用可能なスライドスキャナーに応じて、スライドごとに2〜6個の抗原を染色するために、ホルマリン固定パラフィン包埋(FFPE)セクションで使用できます。
要約
腫瘍微小環境(TME)は、細胞傷害性免疫細胞や免疫調節細胞など、さまざまな種類の細胞で構成されています。TMEは、その組成および癌細胞と腫瘍周囲細胞との間の相互作用に応じて、癌の進行に影響を与える可能性があります。腫瘍とその複雑な微小環境の特性評価は、がん疾患の理解を深める可能性があり、科学者や臨床医が新しいバイオマーカーを発見するのに役立つ可能性があります。
私たちは最近、結腸直腸癌、頭頸部扁平上皮癌、黒色腫、および肺癌におけるTMEの特性評価のために、チラミドシグナル増幅(TSA)に基づくいくつかのマルチプレックス免疫蛍光(mIF)パネルを開発しました。対応するパネルの染色とスキャンが完了すると、サンプルは画像分析ソフトウェアで分析されます。次に、各細胞の空間位置と染色が、この定量ソフトウェアからRにエクスポートされます。私たちは、いくつかの腫瘍コンパートメント(腫瘍の中心、腫瘍の縁、間質など)の各細胞タイプの密度を分析するだけでなく、異なる細胞タイプ間の距離ベースの分析も実行できるRスクリプトを開発しました。
この特定のワークフローは、いくつかのマーカーに対してすでに日常的に実行されている古典的な密度解析に空間次元を追加します。mIF解析により、科学者はがん細胞とTMEの複雑な相互作用をよりよく理解し、免疫チェックポイント阻害剤や標的療法などの治療に対する反応の新しい予測バイオマーカーを発見することができます。
概要
標的療法や免疫チェックポイント阻害剤の開発に伴い、がん細胞とその腫瘍微小環境との相互作用をよりよく特徴づけることが最も重要になり、現在、これはトランスレーショナル研究の重要な分野です。TMEは、がん細胞を標的とする免疫細胞傷害性細胞と、腫瘍の増殖と浸潤性を促進する可能性のある免疫調節細胞のバランスを備えた、多数の異なる細胞タイプで構成されています1,2,3,4。この複雑な環境の特性評価は、がん疾患の理解を深める可能性があり、科学者や臨床医が将来の治療のために患者をより適切に選択するために、新しい予測および予後バイオマーカーを発見するのに役立つ可能性があります5,6。たとえば、ガロンと彼のチームは、予測バイオマーカーとして使用できる再現可能なスコアリング方法であるイムノスコアを開発しました。免疫スコアは、浸潤性マージンおよび腫瘍の中心におけるCD3 +およびCD8+ T細胞の密度を使用して計算されます7,8。
過去数十年にわたって、mIFの商用ソリューションが開発されてきましたが、これらは多くの場合高価であり、抗原の特定のパネル用に設計されています。学術研究およびトランスレーショナル研究における抗原の特定のパネルの必要性を克服するために、FFPE腫瘍切片でmIFを実行する費用効果の高い方法を開発し、ヒトおよびマウスサンプルの細胞核に添加された2〜6個の抗原の対比染色を可能にしました。
組織切片全体を染色し、蛍光スライドスキャナーでスキャンすると、大きなピラミッド型データセットをサポートするいくつかの画像解析ソフトウェアでサンプルを分析できます。最後に、生データは、密度および空間ベースの分析を実行するために、Rソフトウェア(v.4.0.2)のような統計計算およびグラフィックス用の環境で使用できます。
この原稿では、5マーカー染色に最適化されたプロトコルと、新しいパネルを最適化するためのトリックとヒントを紹介しています。さらに、画像解析の詳細な手順と、統計的および空間的分析に使用されるR関数について説明します。
プロトコル
本プロトコルで使用されているすべてのサンプルは、地元の倫理委員会によって承認され、管轄当局によって承認された研究からのものです。研究のすべての参加者は、書面によるインフォームドコンセントを提供しました。トライアルは ClinicalTrials.gov に登録されています(NCT03608046)。
1.マルチプレックス免疫蛍光法
- FFPE セクショニング
- 組織を4%パラホルムアルデヒドで固定し、固定した組織をパラフィンに包埋する。
- 5 μmの切片を切り取り、粘着顕微鏡スライドの上に置きます。
- スライドを室温(RT)で一晩乾燥させます。
- 脱パラフィンおよび内因性ペルオキシダーゼ阻害
- スライドをトルエン(各3回5分間)とメタノール(各3回5分間)にドラフトフードの下に沈めて、組織を脱ろうします。
- メタノールで希釈した3%過酸化水素にスライドをヒュームフードの下で20分間沈めることにより、内因性ペルオキシダーゼを阻害します。
- スライドを蒸留(d)H2O(1xで3分間)ですすぐ。
- マルチプレックス免疫蛍光染色
- 0.1% TritonX-100で補完した10 mMクエン酸塩(pH 6)またはEDTA(pH 9)バッファーを含む300 mL染色ジャーにスライドを沈めます。
注:使用するバッファー(pH 6またはpH 9)は、染色する抗原によって異なります( 表1を参照)。 - 蓋を閉めた状態で染色ジャーを電子レンジで最大電力(例:.、900 W)で3〜5分間置きます バッファーが沸騰し始めるまで。
注意: 沸騰に最適な時間は、マイクロ波とバッファーの容量によって異なります。完璧なタイミングを見つけるには、調整が必要になる場合があります。一部の脆弱な抗原や、脆弱で接着性の低い標本(オルガノイドやスフェロイドなど)では、マイクロ波沸騰が厳しすぎる場合があります。この場合、代わりに圧力鍋を使用できます。 - 閉じた染色ジャーを低電力(90 Wなど)の電子レンジに15分間入れて、バッファーを沸騰に近い温度に保ちます。
- 電子レンジを最大電力で90秒間加熱する最後のステップを実行します。
- 電子レンジからジャーを取り出し、バッファーをRTで15分間冷却します。
- スライドをdH2Oでそれぞれ3回5分間、0.1%トゥイーン20(TBS-T)を含むトリス緩衝生理食塩水で1回5分間すすぎます。
- ペーパータオルでスライドを吸い取ってTBS-Tを取り外します
- スライド(フラット)を染色室トレイまたは顕微鏡スライドボックスに置きます( 材料表を参照)。
- 疎水性ペンで組織を囲みます。
- TBS-Tに溶解した5%ウシ血清アルブミン(BSA)で組織を30分間覆うことで、非特異的結合部位をブロックします。
- ペーパータオルでスライドを吸い取ってブロッキングバッファーを取り外します。
注意: ブロッキングステップの後にスライドをすすがないでください。 - 組織を約300 μLの溶液で覆い、1%BSA TBS-Tで希釈した一次抗体( 表1を参照)で組織を60分間インキュベートします。
- スライドをTBS-Tで3分間3回すすぎます。
- 組織を約300 μLの溶液で覆い、ポリHRP二次抗体( 表1を参照)で組織を40分間インキュベートします。
- スライドをTBS-Tで3分間3回すすぎます。
- 組織を約300 μLの溶液で覆うことにより、ホウ酸緩衝液(0.1 Mホウ酸塩、pH 7.8、3 M NaCl)で200倍希釈した蛍光クロム-チラミド試薬(表1を参照)で組織を10分間インキュベートします。
- スライドをTBS-Tで3分間3回すすぎます。
- すべてのTSA染色が実行されるまで、手順1.3.1〜1.3.16を繰り返します。
- 1%BSA TBS-Tで希釈した最後の一次抗体( 表1参照)を用いて組織を4°Cで一晩インキュベートします。
注:インキュベーションは一晩行われるため、染色チャンバートレイまたは顕微鏡スライドボックスを覆い、ボックスの底(スライドの下)のペーパータオルにdH2Oを追加して、インキュベーション中に組織が乾燥しないようにすることが重要です。 - TBS-Tで組織をそれぞれ5分間3回すすぎます。
- 1%BSA TBS-Tで200倍希釈した二次抗体(蛍光色素と直接結合)で組織を120分間インキュベートします。
- TBS-Tで組織をそれぞれ5分間3回すすぎます。
- 組織を10%BSA TBS-Tで1,000倍に希釈したビスベンズイミド(20 mM)中で5分間インキュベートすることにより、核を染色します。
注意: ビスベンズイミドはDAPIに置き換えることができますが、後者はより有毒であり、ヒュームフードの下で慎重に取り扱う必要があります。 - 組織をdH2Oでそれぞれ3分間3回すすぎます。
- 蛍光封入剤とホウケイ酸カバーガラスを使用してスライドをマウントします。
- 0.1% TritonX-100で補完した10 mMクエン酸塩(pH 6)またはEDTA(pH 9)バッファーを含む300 mL染色ジャーにスライドを沈めます。
2.スライドスキャン
- スライドを蛍光スライドスキャナーで20倍の倍率でスキャンしてデジタル化します(スライドスキャナーの詳細は 材料表に記載されています)。
メモ: 最適なマルチプレックスの代表的なスキャンを 図1に示します。
3. 画像解析
- スキャンを画像解析ソフトウェア(ファイル>オープンイメージ)にインポートします。
- 分類子 タブに移動し、DenseNet AI V2 プラグインを選択します。
- DenseNet AI V2 プラグインをトレーニングして、1 つの画像で約 500 個の核を囲むことで核を認識します。
- いくつかのスライド(約10)でいくつかの核(50)を囲むことにより、同じバッチからの他のいくつかのスライドとmIF染色の異なるバッチでAIをトレーニングします。
注意: AIプラグインの使用方法の詳細な手順は、ソフトウェアマニュアルに記載されています。核検出にAIを使用することはオプションです。使用する画像解析ソフトウェアに応じて、核を検出する他の方法が利用可能である。 - トレーニング済みの AI を保存します ([分類子アクション] > [保存])。
- [注釈] タブに移動し、ペン注釈ツールを使用して、腫瘍の中心や腫瘍の余白など、関心領域 (ROI) ごとに注釈を作成します。
- 必要に応じて、折り目のある領域とぼやけて見える領域を 除外注釈ツールで削除します。
注:mIFに使用された切片に隣接する切片のヘマトキシリン-エオジン染色は、mIF染色の前に実行して、腫瘍細胞が標本に存在することを確認し、解剖病理学者がROIを決定するのに役立ちます。 - [分析] タブに移動し、HighPlex FL アルゴリズム ([設定アクション] > [HighPlex FL >の読み込み]) を選択します。
- [色素 の選択 ]タブを選択し、目的の色素を選択します。
- 核 検出 タブで、 核セグメンテーション タイプ に移動し、AI カスタム を選択します。
- 核セグメンテーション分類器で、手順 3.5 で保存した AI を選択します。
- [膜 および細胞質の検出 ]タブで、細胞質の最大半径(この研究では1.5を使用)と膜色素の数を選択します。
- 各色素について、核陽性閾値、細胞質陽性閾値、および膜陽性閾値を選択します。
注:閾値は染色ごとに異なるため、スライドのバッチごとおよび抗原染色ごとに調整する必要があります。ビュー設定ツール(ビュー設定>ビュー設定)を使用すると、強度ピークの最後(右側)にある強度値を使用して、適切なしきい値を選択するのに役立ちます。 - 各色素について、完全性の核、膜、および細胞質の割合の値を選択します。
注:このパラメータは、染色の異なる2つの細胞が互いに接近している場合の誤検出を回避するために重要です(図2)。 - アルゴリズムを保存します ([設定アクション] > [保存])。
- ROI の分析 (アノテーション レイヤーの分析>)。
- [ 結果 ]タブに移動し、[オブジェクト データ]内のすべての データ を選択します(ctrl + A)。
- データを.csv形式でエクスポートします(右クリック>[オブジェクトデータをエクスポート]>。Csv)。
注:このテーブルには、位置(Xmin、Xmax;Ymin、Ymax)および分析された各セルの各マーカーの陽性率。
4. Rを用いたバイオインフォマティクス
注: 次の手順の詳細を提供する R スクリプトは、GitHub (benidovskaya/Ring: マルチプレックス免疫蛍光染色の分析のためのパイプライン) で入手できます。[github.com])
- エクスポートされたテーブルを使用して、まず共局在染色に基づいて異なる細胞タイプを定義します。例えば、細胞傷害性T細胞をダブルポジティブCD3+/CD8+細胞で定義します。
- 次に、画像解析ソフトウェアとggplot2(図 3).これらのデータを使用して、いくつかのタイプの分析を実行できます。
- 密度解析
注: 最も単純な解析は密度解析です。- 生検用のスライド全体または組織の特定の領域を使用して、すべての細胞タイプの密度分析を実行します。たとえば、腫瘍の中心にあるCD3+およびCD8+ T細胞の密度と腫瘍の縁を計算します(図4A-C)。
- これらの密度を計算するには、画像解析ソフトウェアを使用して、各細胞の表現型と座標を含むサンプルごとの特定のデータフレームを生成します。R上のクラスタリング関数(k-最近傍)を使用して、調査対象の生検の境界を使用してポリゴンオブジェクトを作成し、その中の関心のある細胞タイプの密度を計算します。
注:これにより、生物学的仮説に応じて、さまざまな条件(さまざまな時点、治療タイプ、組織タイプ、治療への反応など)および局在(腫瘍の中心、腫瘍の縁、間質線維症、壊死領域)の間で異なる細胞タイプの密度を比較できます。癌細胞、腫瘍周囲細胞、および腫瘍浸潤細胞の間の近接性が高いため、画像解析ソフトウェアは、免疫細胞と癌細胞としてのダブルポジティブ細胞を同時に検出する可能性があります。その場合、これらのダブルポジティブ細胞が何であるかに言及することによって、この問題をバイオインフォマティクス的に修正する必要があります。この場合、CD3+CD8+サイトケラチン+細胞は、サイトケラチン陽性が浸潤リンパ球周囲の腫瘍細胞によるものであったため、細胞傷害性細胞としてタグ付けされた。
- ヒートマップ
- 異なるパネルからの各細胞タイプの密度を使用し、正規化(スケーリングセンタリングなど)を適用して、サンプル集団における細胞の存在量を表すヒートマップ(図5)を描画します。
- 細胞密度に基づく階層的な教師なしクラスタリングを使用して、類似したTME組成を有する患者をクラスタリングし、これらのクラスタを治療反応や生存などの臨床パラメータと相関させる。
注: ヒートマップとクラスタ化は、R ComplexHeatmap パッケージ9 を使用して簡単に実行できます。
- 空間セル分布
- 細胞間の距離をバイオインフォマティクス的に計算します(例:免疫細胞と腫瘍細胞; 図6A、B)に基づく、画像解析により提供された細胞座標。対象の細胞タイプ間の中央値と平均距離を使用して、コホートのすべてのサンプルの細胞近接性を比較します。
- 空間記述関数
- R spatstatパッケージ10を通じて利用可能なクロス型最近傍Gクロス関数を使用して、細胞Xの周りの特定の半径内で、関心のある細胞X(例えば、腫瘍細胞)が、最も近い細胞Y(例えば、T細胞)と出会う確率を決定する。
- 経験曲線下面積を算出し、腫瘍細胞11 周辺のCD3+ T細胞の腫瘍浸潤を表す数値を得た(図6C)。F 関数や J 関数などの他の空間記述関数を使用します12.
- イムノスコア解析
- 腫瘍の中心にあるCD3 +およびCD8 + T細胞の密度と腫瘍の浸潤性マージンを使用して、ガロン7,8のチームによって開発されたイムノスコア(I)を計算します。
注:スコアの範囲はI0からI4です。腫瘍の中心および辺縁におけるCD3+およびCD8+ T細胞の両方の低密度はI0のスコアと関連し、両方の領域のCD3+およびCD8+ T細胞の高密度はI4のスコアと関連している。最近、イムノコアの予後への影響は、13か国の14施設の2,681人のステージI〜IIIの結腸がん患者のサンプルを使用した研究で検証されました7。ただし、計算するには、Immunoscoreには、腫瘍の中心と縁の両方を含む外科的に切除された標本が必要です。通常マージンがない生検の場合、生検に適応したイムノスコアが最近開発されました13。 - 生検に適応したイムノスコアを計算するには、CD3+およびCD8+ T細胞密度の値をパーセンタイルに変換し、CD3+およびCD8+ T細胞の平均パーセンタイルを使用して、3つのカテゴリ(低、中、高)のいずれかにスコアを付けます13。
- 腫瘍の中心にあるCD3 +およびCD8 + T細胞の密度と腫瘍の浸潤性マージンを使用して、ガロン7,8のチームによって開発されたイムノスコア(I)を計算します。
- ホットスポット分析
- ホットスポット分析を使用して、クワッドカウント機能(spatstat)10を使用して、組織の最も浸潤した領域における異なる細胞タイプの密度を比較します。例えば、最も浸潤した組織の正方形のCD3およびCD8 T細胞密度の値を用いて「イムノスコア様」スコアを計算することができる(図7)。この方法を、組織全体に不均一な分布を持つ任意の細胞タイプの分析に適用します。
- 密度解析
結果
このプロトコルに従って、組織が正しく染色されていることを確認するために、いくつかのパラメーターを調査する必要があります。まず、TSA染色は、スキャンプロセス中に低露光時間(通常は2〜100ミリ秒)を使用する場合、良好なダイナミックレンジを表示する必要があります。露光時間が短いということは、HRPとの反応中に増幅が正しく行われたことを意味します。蛍光色素と直接結合した二次抗体で染色された抗原の場合、露光時間ははるかに長くなり、光退色(長時間の露光によるシグナル強度の低下)につながる可能性があります。第二に、各染色が高いSNRを示すことを確認することが重要です。抗原シグナルが低いバックグラウンドシグナルが高い場合は、一次抗体の特異性が十分でない、内因性ペルオキシダーゼが正しく不活性化されなかった、またはプロトコルの1つのステップが適切に行われていないことを示している可能性があります。第三に、スライドスキャナーとスキャンに使用するフィルターセットによっては、2つの色(AF555、AF594、AF647など)の重なりが見られる場合があります。スキャナーで適切なフィルターセットと適切な一次抗体希釈を選択することは、交差検出の可能性を回避するために重要です。品質管理は、スキャンされたファイル上の各マーカーの単一の染色細胞の検出で構成されます。最後に、染色の各バッチにポジティブコントロールとネガティブコントロールを追加することも重要です。免疫細胞にとって、扁桃腺は良いポジティブコントロールです。最適な染色の代表的な結果を 図1に示します。
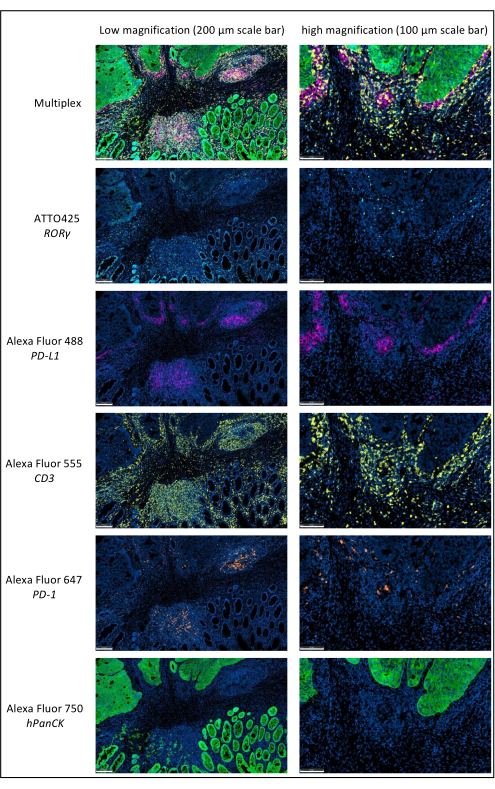
図1:多重免疫蛍光法で染色された局所進行直腸癌。 略語:PD-1 =プログラム細胞死タンパク質1;PD-L1 = プログラムされたデスリガンド1;ROR-γ = RAR関連オーファン受容体ガンマ;CD3 = 分化のクラスター 3;hPanCK = ヒト汎サイトケラチン。各抗原染色はグレースケールでスキャンされ、図に示されている色は疑似色です。スケールバー低倍率:200μm;スケールバー高倍率:100μm。 この図の拡大版を表示するには、ここをクリックしてください。
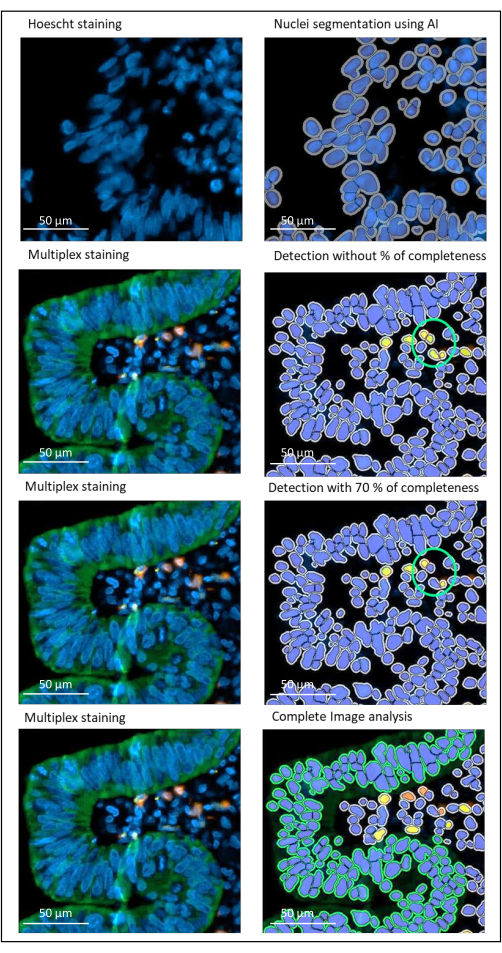
図2:画像解析ソフトを用いた局所進行直腸癌の核および染色検出。 完全性の割合パラメータが正しく設定されていないと、ソフトウェアは2つのCD8+細胞(緑色の円)が互いに接近しているため検出しますが、染色されるのは1つの細胞のみです。70% の完全性を使用すると、この誤検出を回避するのに役立ちます。緑 = hPanCK;黄色 = CD3;オレンジ = CD8。スケールバー:100 μm この図の拡大版を表示するには、ここをクリックしてください。
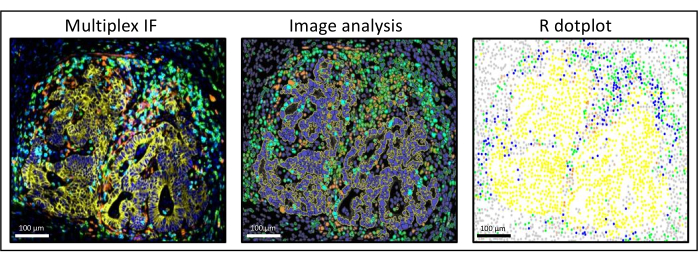
図3:肝結腸直腸癌転移の画像解析とRドットプロット再構成。 マルチプレックス染色(左)では、ヒトパンサイトケラチンは黄色、CD3は緑色、CD8は水色、IDOはオレンジ色です。ドットプロット(右)では、ヒト汎サイトケラチン+細胞は黄色、CD3+CD8-細胞は緑色、CD3+CD8+細胞は青色、IDO+細胞はオレンジ色です。 この図の拡大版を表示するには、ここをクリックしてください。
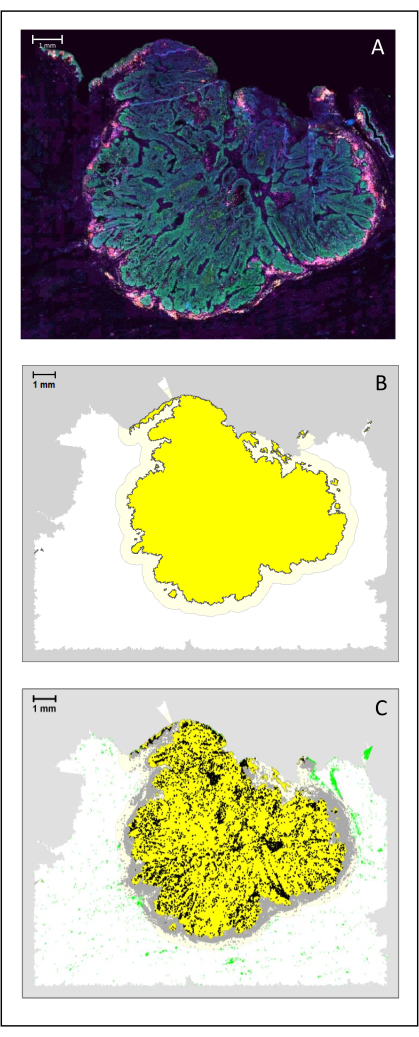
図4:HNSCCの外科セクションの分析。 (A)HNSCCの外科セクション。がん細胞は緑色で表示されます。腫瘍周囲細胞は、腫瘍膵島の周囲で視覚化されます(黄色のCD3と紫色のCD8)。(B)腫瘍の中心(黄色で黒い境界線)は、単一の領域からの腫瘍島間の距離に基づいて、k-最近傍アルゴリズムによって生体情報的に計算されます。この領域周辺では、任意の500μmベースで侵襲マージン(灰色の境界線を持つ明るい黄色)が計算されます。(C)浸潤性T細胞は、腫瘍の中央に黒い点、浸潤性縁に灰色の点で強調表示されます。他のT細胞は薄緑色の点で強調表示されます。スケールバー:1 mm。 この図の拡大版を表示するには、ここをクリックしてください。
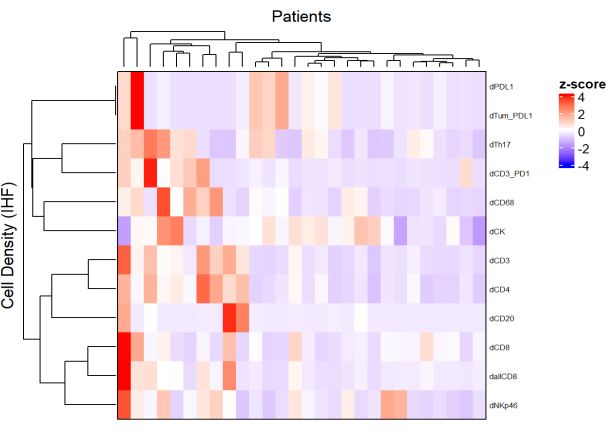
図5:局所進行直腸癌生検の異なる細胞型の密度のヒートマップ。 ヒートマップは、ComplexHeatmapパッケージを使用して、さまざまなマルチプレックスパネルからのさまざまなセルタイプの密度の教師なしクラスタリングを使用して描画されました。正規化にはスケーリングとセンタリングが使用されました。 この図の拡大版を表示するには、ここをクリックしてください。
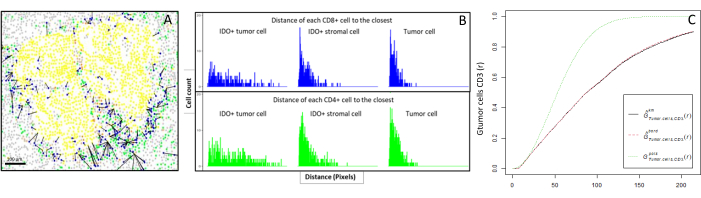
図6:CD4+およびCD8+細胞と各IDO+または腫瘍細胞までの距離。 ヒト汎サイトケラチン+細胞は黄色、CD3+CD8-細胞は緑色、CD3+CD8+細胞は青色、IDO+細胞はオレンジ色です。(A)腫瘍細胞と各CD8+ T細胞との間の最も近い距離。(B)IDO+細胞と各CD8+ T細胞(青)またはCD4+ T細胞(緑)との間の距離の棒グラフ。(C)Gクロス関数で分析したサンプルの例。y軸は、腫瘍細胞が腫瘍細胞の周囲0〜200μmの範囲の半径でCD3+リンパ球に遭遇する確率を示す。3 つの曲線が示されています。理論曲線は緑色の点線(ポアソン分布)、km補正による補正された経験曲線は黒、境界補正による補正された経験曲線は赤色の点線です。 この図の拡大版を表示するには、ここをクリックしてください。
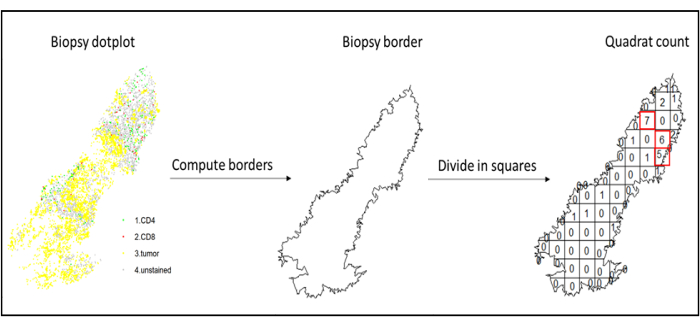
図7:四角形の図。境界の計算と四角形カウントは、spatstatsパッケージを使用して実行されました。最も浸透しているマス目(ホットスポット)は、ダウンストリーム統計に使用できます。CD4は緑色、CD8は赤色、腫瘍細胞は黄色です。この図の拡大版を表示するには、ここをクリックしてください。
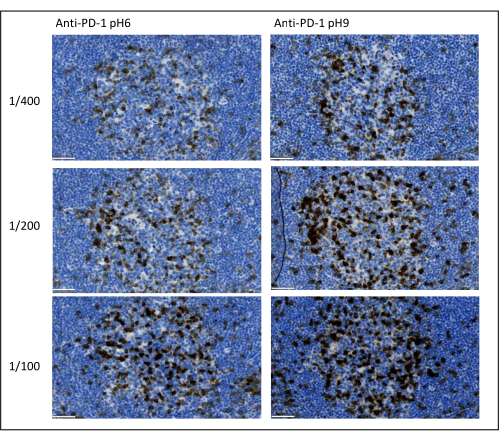
図8:抗体希釈と抗原賦活化の最適化。 一次抗体の3つの異なる希釈液および2つの異なる抗原賦活化溶液(クエン酸塩pH 6およびEDTA pH 9)を用いたPD-1の発色検出。スケールバー:50μm。 この図の拡大版を表示するには、ここをクリックしてください。
| 一次抗体 | 希釈 | 抗原賦活化 | 二次抗体 | 蛍光色素 | 立場 |
| PD-1 | 1/100 | EDTA(pH 9) | 抗ウサギ | AF647 | 1 |
| PD-L1 | 1/1000 | EDTA(pH 9) | 抗ウサギ | AF488 | 2 |
| ROR-γ | 1/200 | EDTA(pH 9) | アンチマウス | ATT0-425 | 3 |
| CD3 | 1/100 | クエン酸塩(pH 6) | 抗ウサギ | AF555 | 4 |
| hパンク | 1/50 | クエン酸塩(pH 6) | AF750と組み合わせたアンチマウス | 5 | |
表1:最適化されたマルチプレックスパネルの例 略語:PD-1 =プログラム細胞死タンパク質1;PD-L1 = プログラムされたデスリガンド1;ROR-γ = RAR関連オーファン受容体ガンマ;CD3 = 分化のクラスター 3;hPanCK = ヒト汎サイトケラチン;AF = アレクサフルー;EDTA = エチレンジアミン四酢酸。CD3はTリンパ球を検出するために使用されます。PD-1は、疲弊したリンパ球を検出するために使用されます。ROR-γはTh-17を検出するために使用されます。hPanCKは腫瘍細胞を検出するために使用されます。位置列は、順次多重化を実行する必要がある順序を示します。
ディスカッション
マルチプレックス染色を最適化するために考慮すべき最も重要なパラメータは、各一次抗体に使用される希釈率、特異性、および抗原賦活化です。マルチプレックスプロトコルを開始する前に、各一次抗体の最適な希釈率と最適なエピトープ検索(pH 6またはpH 9)を発色染色(DAB)を使用してテストする必要があります。抗原賦活化バッファーごとに、抗体を商品化するブランドによって通常指定されている希釈液、同じ希釈液を2倍に分割し、同じ希釈液を2倍にした希釈液の3つの希釈液を試験することをお勧めします(図8)。適切な希釈液を選択することは、抗体の特異性を検証し、染色のシグナル対ノイズ比(SNR)を最適化するための非常に重要なステップです。DABで適切な希釈を選択した後、ユニプレックスTSAを使用して各一次抗体について同じ希釈率をテストする必要があります。抗原染色ごとに希釈バッファーとエピトープ検索バッファーを選択したら、マルチプレックスの配列を正しく設定することも重要です。具体的には、一部の抗原は最初の位置でよりよく染色され、他の抗原は最後の位置でよりよく染色されます。考えられるすべての順序順列を使用してマルチプレックス標識をテストし、どの抗原染色を最初、2番目などを選択するかを選択することをお勧めします。一部の脆弱な抗原は数ラウンドのエピトープ賦活化後に分解される可能性があり、一部の抗原は数ラウンドのエピトープ賦活化後によりよく染色されるため、これも非常に重要なステップです。例えば、SNRは、CD3の最後の位置とPD-1染色の最初の位置で常に高くなります。さらに、いくつかの共局在抗原の染色は、アンブレラ効果(チラミド反応部位の飽和)によって妨げられる可能性があります。これは、チラミド濃度を下げることで弱めることができます。ある抗原の発現が別の抗原の発現によって条件付けられている場合(CD8はCD3発現T細胞にのみ存在します)、他の抗原の後に最も広い発現(この場合はCD3)で抗原を染色することをお勧めします。最後に、スキャナーの特異性に応じて各抗原染色に適した蛍光色素を選択することも、交差検出を回避するための重要なステップです。
この技術の主な利点は、増幅と得られる信号対雑音比です。しかしながら、この技術には、染色が連続的であり、蛍光色素が組織に共有結合しているという制限がある。それにもかかわらず、全てのチラミドシグナル増幅ラウンドを行った後、蛍光色素(TSAなし)と直接結合した二次抗体による最後の染色を加えることもできる。一部のパネルでは、この方法を使用して750チャンネルに染色を追加しました。当時、チラミドAF750は市販されていなかったため、これは必要でした。注目すべきことに、AF750で染色された抗原の曝露時間(スキャン中)は、TSAで染色された他の抗原よりもはるかに長くなります。その場合は、サイトケラチンなどの高発現タンパク質を染色するか、一次抗体の濃度を上げることをお勧めします。そうすることで、蛍光スキャナーに応じて、1回のバッチでスライドあたり最大5〜6個の抗原を染色することができます。
反対に、いくつかの市販の技術は、1つの組織切片で染色できる抗原の数を改善するために、数回の染色、スキャン、およびストリッピングまたは光退色を伴う連続染色を使用する。ただし、これらの手法は、多くの場合、時間と費用がかかり、信号増幅がなく、シリアルスキャンを正しくマージするために高度な計算手順が必要であり、私たちの経験では、多数の手順ステップのために不可逆的な組織損傷を引き起こす可能性があります。それにもかかわらず、この方法を使用すると、1つの組織で最大30の抗原を染色できることが報告されています14。
結論として、私たちの方法は、蛍光スライドスキャナーを所有するあらゆるラボで使用できる、堅牢で再現性があり、使いやすく、費用対効果の高い免疫組織蛍光技術です。IHCに適した市販の一次抗体であればどれでも使用でき、パネルは市販のキットに特異的ではありません。画像解析は、QuPathやRなどのオープンソースプログラムを含むいくつかの異なるプログラムで実行できます。しかし、この方法は将来的には大きな抗原パネルにも改善される可能性があり、異なる抗原パネルで同じスライドの連続染色/スキャンを実行でき、シグナル増幅の利点が得られると考えています。
開示事項
著者は宣言する利益相反はありません。
謝辞
著者らは、Derouane F博士の助けと支援に感謝したい。Nicolas Huygheは、ベルギー国立科学研究基金(Télévie/FNRS 7460918F)からの助成金を受けて支援されている研究員です。
資料
| Name | Company | Catalog Number | Comments |
| anti-CD3 primary antibody | Abcam | ab16669 | rabbit monocolonal |
| anti-CD8 primary antibody | DAKO | M710301 | mouse monoclonal |
| anti-hPanCK primary antibody | DAKO | M3515 | mouse monoclonal |
| anti-PD-1 primary antibody | Cell Signalling | D4W2J | rabbit monocolonal |
| anti-PD-L1 primary antibody | Cell Signalling | 13684 | rabbit monocolonal |
| anti-RORC primary antibody | Sigma | MABF81 | mouse monoclonal |
| ATTO-425 | ATTOtec | ||
| Axioscan Z1 | Zeiss | Light source: Colibri 7 (385, 430, 475, 555, 590, 630, 735 nm) Filtersets: Excitation 379/34 – beam splitter 409 – emission 440/40; Excitation 438/24 – beam splitter 458 – emission 483/32; Excitation 490/20 – beam splitter 505 – emission 525/20; Excitation 546/10 – beam splitter 556 – emission 572/23; Excitation 592/21 – beam splitter 610 – emission 630/30; Excitation 635/18 – beam splitter 652 – emission 680/42; Excitation 735/40 – beam splitter QBS 405 + 493 + 611 + 762 - emission QBP 425/30 + 524/51 + 634/38 + 785/38; Objective: Plan-Apochromat 20x/0.8; Camera : Orca Flash 4.0 V3 | |
| Borosilicate Cover Glass | VWR | 631-0146 | |
| Envision+ anti-mouse | DAKO | K4001 | |
| Envision+ anti-rabbit | DAKO | K4003 | |
| Fluorescence mounting medium | DAKO | S3023 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 750 | ThermoFischer | A-21037 | |
| HALO software | Indicalabs | ||
| Hoescht | Sigma | 14533 | |
| Superfrost plus microscope slides | Fisherscientific/Epredia | 10149870 | |
| Tyramide-AF488 | ThermoFischer | B40953 | |
| Tyramide-AF555 | ThermoFischer | B04955 | |
| Tyramide-AF647 | ThermoFischer | B04958 |
参考文献
- Ge, P., et al. Profiles of immune cell infiltration and immune-related genes in the tumor microenvironment of colorectal cancer. Biomedicine & Pharmacotherapy. 118, 109228 (2019).
- Fridman, W. H. The immune microenvironment as a guide for cancer therapies. Oncoimmunology. 1 (3), 261-262 (2012).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: Impact on clinical outcome. in Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Calu, V., et al. Key biomarkers within the colorectal cancer related inflammatory microenvironment. Scientific Reports. 11 (1), 7940 (2021).
- Havel, J. J., Chowell, D., Chan, T. A. The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nature Reviews. Cancer. 19 (3), 133-150 (2019).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Mlecnik, B., et al. Integrative analyses of colorectal cancer show immunoscore is a stronger predictor of patient survival than microsatellite instability. Immunity. 44 (3), 698-711 (2016).
- Gu, Z., Eils, R., Schlesner, M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data. Bioinformatics. 32 (18), 2847-2849 (2016).
- Baddeley, A., Rubak, E., Turner, R. . Spatial Point Patterns: Methodology and Applications with R. , (2022).
- Barua, S., et al. Spatial interaction of tumor cells and regulatory T cells correlates with survival in non-small cell lung cancer. Lung Cancer. 117, 73-79 (2018).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- El Sissy, C., et al. A diagnostic biopsy-adapted immunoscore predicts response to neoadjuvant treatment and selects patients with rectal cancer eligible for a watch-and-wait strategy. Clinical Cancer Research. 26 (19), 5198-5207 (2020).
- Bolognesi, M. M., et al. Multiplex staining by sequential immunostaining and antibody removal on routine tissue sections. The Journal of Histochemistry and Cytochemistry. 65 (8), 431-444 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved