Method Article
מולטיפלקס אימונופלואורסנציה בשילוב עם ניתוח תמונה מרחבית להערכה קלינית וביולוגית של מיקרו-סביבה של הגידול
In This Article
Summary
במאמר זה מתואר פרוטוקול להגברת אות טירמיד ידנית (TSA) מולטיפלקס אימונופלואורסנציה (mIF) בשילוב עם ניתוח תמונה וניתוח מרחבי. ניתן להשתמש בפרוטוקול זה עם מקטעים משובצי פרפין קבועים פורמלין (FFPE) לצביעה של שניים עד שישה אנטיגנים לכל שקופית, בהתאם לסורק השקופיות הזמין במעבדה.
Abstract
המיקרו-סביבה של הגידול (TME) מורכבת משפע של סוגי תאים שונים, כגון תאי חיסון ציטוטוקסיים ותאים אימונומודולטוריים. בהתאם להרכבו ולאינטראקציות בין תאים סרטניים לתאים פרי-גידוליים, ה-TME עשוי להשפיע על התקדמות הסרטן. אפיון גידולים והמיקרו-סביבה המורכבת שלהם עשוי לשפר את ההבנה של מחלות סרטן ועשוי לסייע למדענים ולקלינאים לגלות סמנים ביולוגיים חדשים.
לאחרונה פיתחנו מספר לוחות אימונופלואורסנציה (mIF) מרובים המבוססים על הגברת אות טירמיד (TSA) לאפיון TME בסרטן המעי הגס, קרצינומה של תאי קשקש בראש ובצוואר, מלנומה וסרטן ריאות. לאחר השלמת הצביעה והסריקה של הלוחות המתאימים, הדגימות מנותחות באמצעות תוכנת ניתוח תמונה. המיקום המרחבי והצביעה של כל תא מיוצאים לאחר מכן מתוכנת כימות זו ל-R. פיתחנו סקריפטים R המאפשרים לנו לא רק לנתח את הצפיפות של כל סוג תא בכמה תאי גידול (למשל מרכז הגידול, שולי הגידול והסטרומה), אלא גם לבצע ניתוחים מבוססי מרחק בין סוגי תאים שונים.
תהליך עבודה מסוים זה מוסיף ממד מרחבי לניתוח הצפיפות הקלאסי שכבר בוצע באופן שגרתי עבור מספר סמנים. ניתוח mIF יכול לאפשר למדענים להבין טוב יותר את האינטראקציה המורכבת בין תאים סרטניים לבין TME ולגלות סמנים ביולוגיים מנבאים חדשים של תגובה לטיפולים, כגון מעכבי נקודות בקרה חיסוניות, וטיפולים ממוקדים.
Introduction
עם התפתחותם של טיפולים ממוקדים ומעכבי בקרה חיסונית, עלתה חשיבות עליונה לאפיון טוב יותר של יחסי הגומלין בין תאים סרטניים לבין המיקרו-סביבה הגידולית שלהם, וזהו כיום תחום חשוב של מחקר תרגומי. ה- TME מורכב משפע של סוגי תאים שונים, עם איזון של תאים ציטוטוקסיים חיסוניים המכוונים לתאים סרטניים ותאים אימונומודולטוריים שיכולים להעדיף צמיחת גידול ופולשניות 1,2,3,4. אפיון סביבה מורכבת זו עשוי לשפר את ההבנה של מחלות סרטן ועשוי לסייע למדענים ולקלינאים לגלות סמנים ביולוגיים מנבאים ופרוגנוסטיים חדשים על מנת לבחור טוב יותר חולים לטיפול עתידי 5,6. לדוגמה, גלאון וצוותו פיתחו את Immunoscore, שהיא שיטת ניקוד הניתנת לשחזור שיכולה לשמש כסמן ביולוגי מנבא. הדירוג החיסוני מחושב באמצעות צפיפות תאי T CD3+ ו- CD8+ בשוליים הפולשניים ובמרכז הגידול 7,8.
במהלך העשורים האחרונים פותחו פתרונות מסחריים עבור mIF, אך אלה לעתים קרובות יקרים ומיועדים לפאנלים ספציפיים של אנטיגנים. כדי להתגבר על הצורך בפאנלים ספציפיים של אנטיגנים במחקר אקדמי ותרגומי, פיתחנו שיטה חסכונית לביצוע mIF על קטעי גידול FFPE, המאפשרת צביעה של שניים עד שישה אנטיגנים שנוספו לגרעיני התא נגד צביעה על דגימות אדם ועכבר.
לאחר שכל חלקי הרקמה מוכתמים ונסרקים באמצעות סורק שקופיות פלואורסצנטי, ניתן לנתח את הדגימות על ידי מספר תוכנות ניתוח תמונה התומכות במערכי נתונים פירמידליים גדולים. לבסוף, הנתונים הגולמיים יכולים לשמש בסביבה למחשוב סטטיסטי וגרפיקה כמו תוכנת R (v.4.0.2) על מנת לבצע צפיפות וניתוחים מרחביים.
פרוטוקול מותאם לצביעת חמישה סמנים, כמו גם טריקים וטיפים לאופטימיזציה של לוחות חדשים, מוצג בכתב יד זה. יתר על כן, מוסברים שלבים מפורטים של ניתוח התמונה ופונקציות R המשמשות לניתוח סטטיסטי ומרחבי.
Protocol
כל הדגימות המשמשות בפרוטוקול הנוכחי הגיעו ממחקר שאושר על ידי ועדות האתיקה המקומיות ואושר על ידי הרשות המוסמכת. כל המשתתפים במחקר סיפקו הסכמה מדעת בכתב. גירסת הניסיון רשומה ב-ClinicalTrials.gov (NCT03608046).
1. מולטיפלקס immunofluorescence
- חלוקת FFPE
- לתקן את הרקמה ב 4% paraformaldehyde, ולהטביע את הרקמה הקבועה בפרפין.
- חותכים חתכים של 5 מיקרומטר, ומניחים אותם על שקופיות מיקרוסקופ דביק.
- יבשו את המגלשות למשך הלילה בטמפרטורת החדר (RT).
- עיכוב פראפיניזציה ופרוקסידאזות אנדוגניות
- יש לטבול את הרקמות על ידי טבילת המגלשות בטולואן (3x למשך 5 דקות כל אחת) ובמתנול (3x למשך 5 דקות כל אחת) תחת מכסה אדים.
- לעכב את peroxidases אנדוגני על ידי טבילת שקופיות 3% מי חמצן מדולל מתנול במשך 20 דקות תחת מכסה אדים.
- שטפו את המגלשות ב-H2Oמזוקק (1x למשך 3 דקות).
- צביעת אימונופלואורסנציה מולטיפלקס
- השקיעו את המגלשות בצנצנת צביעה של 300 מ"ל המכילה 10 mM ציטראט (pH 6) או חיץ EDTA (pH 9) בתוספת 0.1% TritonX-100.
הערה: המאגר שבו נעשה שימוש (pH 6 או pH 9) תלוי באנטיגן המוכתם (ראה טבלה 1). - מניחים את צנצנת הצביעה כשהמכסה סגור במיקרוגל למשך 3-5 דקות בעוצמה מרבית (למשל, 900 W) עד שהמאגר מתחיל לרתיחה.
הערה: הזמן האופטימלי להרתחה תלוי במיקרוגל ובנפח החיץ. ייתכן שיהיה צורך בהתאמות כדי למצוא את העיתוי המושלם. עבור אנטיגנים שבירים מסוימים או דגימות שבירות ופחות דבקות (למשל, אורגנואידים וספרואידים), הרתחה במיקרוגל יכולה להיות קשה מדי. במקרה זה, סיר לחץ יכול לשמש במקום. - שמור את המאגר בטמפרטורת רתיחה קרובה על ידי הנחת צנצנת הכתמים הסגורה במיקרוגל על עוצמה נמוכה (למשל, 90 W) למשך 15 דקות.
- בצע את השלב האחרון של חימום על ידי הצבת המיקרוגל בעוצמה מקסימלית למשך 90 שניות.
- הוציאו את הצנצנת מהמיקרוגל ותנו למאגר להתקרר למשך 15 דקות ב-RT.
- שטפו את המגלשות 3 פעמים במשך 5 דקות כל אחת ב-dH2O ופעם אחת במשך 5 דקות במי מלח חוצצים בתריס המכילים 0.1% Tween 20 (TBS-T).
- הסר את TBS-T על-ידי מחיקת השקופיות על מגבת נייר
- הניחו את השקופיות (שטוחות) על מגש תא צביעה או קופסת שקופיות במיקרוסקופ (ראו טבלת חומרים).
- הקיפו את הרקמה בעט הידרופובי.
- חסום את אתרי הקישור הלא ספציפיים על ידי כיסוי הרקמה באלבומין 5% בסרום בקר (BSA) מומס ב-TBS-T למשך 30 דקות.
- הסר את מאגר החסימה על-ידי מחיקת השקופיות על מגבת נייר.
הערה: אין לשטוף את השקופיות לאחר שלב החסימה. - דגרו על הרקמה במשך 60 דקות עם הנוגדן הראשוני (ראה טבלה 1) מדולל ב-1% BSA TBS-T על ידי כיסוי הרקמה בכ-300 מיקרוליטר של התמיסה.
- שטפו את המגלשות 3 פעמים במשך 3 דקות כל אחת עם TBS-T.
- דגרו על הרקמה במשך 40 דקות עם נוגדן משני poly-HRP (ראו טבלה 1) על ידי כיסוי הרקמה בכ-300 מיקרוליטר של התמיסה.
- שטפו את המגלשות 3 פעמים במשך 3 דקות עם TBS-T.
- לדגור על הרקמה במשך 10 דקות עם מגיב פלואורוכרום-טירמיד (ראה טבלה 1) מדולל פי 200 בחיץ בוראט (0.1 M borate, pH 7.8, 3 M NaCl) בתוספת זמנית עם 0.003% H 2 O2 על ידי כיסוי הרקמה עם כ 300 μL של התמיסה.
- שטפו את המגלשות 3 פעמים במשך 3 דקות עם TBS-T.
- חזור על שלבים 1.3.1-1.3.16 עד לביצוע כל צביעת TSA.
- יש לדגור על הרקמה למשך הלילה בטמפרטורה של 4°C כאשר הנוגדן הראשוני האחרון (ראה טבלה 1) מדולל ב-1% BSA TBS-T.
הערה: מכיוון שהדגירה היא למשך הלילה, חשוב לכסות את מגש תא הצביעה או את קופסת השקופיות במיקרוסקופ ולהוסיף dH2O על מגבת נייר בתחתית הקופסה (מתחת לשקופיות) כדי לוודא שהרקמות אינן מתייבשות במהלך הדגירה. - שטפו את הרקמה 3 פעמים במשך 5 דקות כל אחת עם TBS-T.
- לדגור על הרקמה במשך 120 דקות עם הנוגדן המשני (בשילוב ישיר עם פלואורוכרום) מדולל פי 200 ב-1% BSA TBS-T.
- שטפו את הרקמה 3 פעמים במשך 5 דקות כל אחת עם TBS-T.
- הכתימו את הגרעינים על ידי דגירה של הרקמה למשך 5 דקות בביסבנזימיד (20 מילימטר) מדולל פי 1,000 ב-10% BSA TBS-T.
הערה: ביסבנזימיד יכול להיות מוחלף על ידי DAPI, אבל האחרון הוא רעיל יותר ויש לטפל בזהירות תחת מכסה מנוע אדים. - שטפו את הרקמה 3x במשך 3 דקות כל אחד ב-dH2O.
- הרכיבו את המגלשות באמצעות מדיום הרכבה פלואורסצנטי ומשקפי כיסוי בורוסיליקט.
- השקיעו את המגלשות בצנצנת צביעה של 300 מ"ל המכילה 10 mM ציטראט (pH 6) או חיץ EDTA (pH 9) בתוספת 0.1% TritonX-100.
2. סריקת שקופיות
- הפוך את השקופיות לדיגיטליות על-ידי סריקתן בסורק שקופיות פלואורסצנטי בהגדלה של פי 20 (פרטי סורק השקופיות מופיעים בטבלת החומרים).
הערה: סריקה מייצגת של מולטיפלקס אופטימלי מוצגת באיור 1.
3. ניתוח תמונות
- ייבא את הסריקות לתוכנה לניתוח תמונות (File > Open Image).
- עבור אל מסווגים הכרטיסייה ובחר את תוסף DenseNet AI V2 .
- אמן את תוסף DenseNet AI V2 לזהות גרעינים על ידי הקפת כ-500 גרעינים בתמונה אחת.
- אמן את הבינה המלאכותית על מספר שקופיות אחרות מאותה אצווה ואצוות שונות של צביעת mIF על ידי הקפת מספר גרעינים (50) במספר שקופיות (בסביבות 10).
הערה: הוראות מפורטות כיצד להשתמש בתוסף AI ניתן למצוא במדריך התוכנה. השימוש בבינה מלאכותית לזיהוי גרעינים הוא אופציונלי. שיטות אחרות לזיהוי גרעינים זמינות בהתאם לתוכנת ניתוח התמונה בה נעשה שימוש. - שמור את ה- AI המאומן (פעולות מסווגות > שמור).
- עבור אל הכרטיסיה ביאורים וצור ביאור עבור כל אזור עניין (ROI), כגון מרכז הגידול ושולי הגידול, באמצעות הכלי ביאור עט.
- במקרה הצורך, הסירו את האזורים עם הקיפולים ואת האזורים שנראים מטושטשים בעזרת הכלי ביאור אי-הכללה.
הערה: צביעת Hematoxylin-eosin של קטע הסמוך לזה המשמש עבור mIF יכולה להתבצע לפני צביעת mIF כדי להבטיח שתאי הגידול נמצאים בדגימה ולסייע לאנטומופתולוגים לקבוע את החזר ההשקעה. - עבור אל הכרטיסייה ניתוח ובחר את האלגוריתם HighPlex FL (פעולות הגדרות > טען >- HighPlex FL).
- בחר בכרטיסייה בחירת צבע ובחר את הצבע המעניין.
- בכרטיסיה זיהוי גרעיני, עבור אל סוג פילוח גרעיני ובחר מותאם אישית AI.
- ב מסווג סגמנטציה גרעינית, בחר את הבינה המלאכותית שנשמרה בשלב 3.5.
- בכרטיסייה זיהוי ממברנה וציטופלסמה , בחר את רדיוס הציטופלסמה המרבי (במחקר זה, נעשה שימוש ב -1.5) ואת מספר צבעי הממברנה.
- עבור כל צבע, בחר את הסף החיובי של הגרעין, את הסף החיובי של הציטופלסמה ואת הסף החיובי של הממברנה.
הערה: הסף שונה עבור כל צביעה ויש להתאים אותו לכל קבוצה של שקופיות וכל אנטיגן מוכתם. שימוש בכלי הגדרות תצוגה (View > View Settings) יכול לסייע בבחירת סף מתאים באמצעות ערך העוצמה בסוף שיא העוצמה (מימין). - עבור כל צבע, בחר את הגרעין, הממברנה ואחוז הציטופלסמה של ערכי השלמות.
הערה: פרמטר זה חשוב כדי למנוע זיהוי חיובי מוטעה כאשר שני תאים עם צביעה שונה קרובים זה לזה (איור 2). - שמור את האלגוריתם (Settings Actions > Save).
- ניתוח החזר ההשקעה (ניתוח שכבת הביאור >).
- עבור אל הכרטיסיה תוצאות ובחר את כל הנתונים בנתוני אובייקט (ctrl + A).
- יצא את הנתונים בתבנית .csv (לחץ באמצעות לחצן העכבר הימני > ייצוא > נתוני אובייקט . Csv).
הערה: טבלה זו מכילה את המיקום (Xmin, Xmax; Ymin, Ymax) והחיוביות של כל סמן של כל תא מנותח.
4. ביואינפורמטיקה באמצעות R
הערה: סקריפט R המספק פרטים נוספים על השלבים הבאים זמין ב- GitHub (benidovskaya/Ring: Pipeline לניתוח כתמים אימונופלואורסצנטיים מרובים. [github.com])
- באמצעות הטבלה המיוצאת, הגדר תחילה את סוגי התאים השונים בהתבסס על צביעות הקולוקליזציה. לדוגמה, הגדר תאי T ציטוטוקסיים על ידי תאי CD3+/CD8+ חיוביים כפולים.
- לאחר מכן, בנה מחדש תמונה פשוטה של השקופית על תרשים נקודה באמצעות הקואורדינטות המיוצאות מתוכנת ניתוח התמונות ו- ggplot2 (תרשים 3). באמצעות נתונים אלה, ניתן לבצע מספר סוגים של ניתוח:
- ניתוח צפיפות
הערה: הניתוח הפשוט ביותר הוא ניתוח צפיפות.- בצע ניתוח צפיפות עבור כל סוגי התאים באמצעות השקף כולו עבור ביופסיות או אזור מסוים של הרקמה. לדוגמה, חשבו את צפיפות תאי T CD3+ ו-CD8+ במרכז הגידול ובשולי הגידול (איור 4A-C).
- כדי לחשב צפיפויות אלה, השתמש בתוכנה לניתוח תמונות כדי לייצר מסגרת נתונים ספציפית לכל דגימה עם הפנוטיפ והקואורדינטות של כל תא. באמצעות פונקציית אשכולות (k-השכן הקרוב ביותר) על R, יוצרים אובייקט מצולע באמצעות גבולות הביופסיה הנחקרת, ומחשבים את צפיפות סוגי התאים המעניינים בתוכו.
הערה: זה מאפשר להשוות את הצפיפויות של סוגי תאים שונים בין תנאים שונים (כגון נקודות זמן שונות, סוגי טיפול, סוגי רקמות, ותגובה לטיפול) ולוקליזציה (מרכז הגידול, שולי הגידול, סטרומה פיברוזיס ואזור נמק) בהתאם להשערה הביולוגית. בשל הקרבה הגבוהה בין תאים סרטניים, תאים פרי-גידוליים ותאים חודרי גידול, תוכנת ניתוח התמונה עשויה לזהות תאים חיוביים כפולים כתאי חיסון ותאים סרטניים בו זמנית. במקרה כזה, יש לתקן בעיה זו ביואינפורמטית על ידי אזכור מהם התאים החיוביים הכפולים הללו. במקרה זה, תאי CD3 + CD8 + ציטוקרטין + תויגו כתאים ציטוטוקסיים מכיוון שהחיוביות הציטוקרטין נבעה מתאי הגידול המקיפים את הלימפוציטים החודרים.
- מפות חום
- באמצעות הצפיפות של כל סוג תא מלוחות שונים ועל-ידי החלת נורמליזציה (למשל, מרכוז קנה מידה), ציירו מפות חום (איור 5) המייצגות את שפע התאים באוכלוסיית הדגימות.
- באמצעות אשכולות היררכיים ללא פיקוח המבוססים על צפיפות תאים, מקבצים מטופלים בעלי הרכבים דומים של TME, ומתאמים אשכולות אלה עם פרמטרים קליניים כגון תגובה לטיפול והישרדות.
הערה: מפות חום ואשכולות ניתן לבצע בקלות עם חבילת R ComplexHeatmap9.
- התפלגות תאים מרחבית
- חישוב ביואינפורמטי של המרחקים בין התאים (למשל, תאי מערכת החיסון ותאי הגידול; איור 6A, B) בהתבסס על קואורדינטות התאים שסופקו על-ידי ניתוח התמונות. השתמש במרחקים החציוניים והממוצעים בין סוגי התאים המעניינים כדי להשוות את קרבת התאים בכל הדגימות של עוקבה.
- פונקציות תיאוריות מרחביות
- השתמש בפונקציית G-cross של השכן הקרוב ביותר, הזמינה דרך חבילת R spatstat10, כדי לקבוע את ההסתברות לתא מעניין, X (למשל, תא סרטני), לפגוש את התא הקרוב ביותר, Y (למשל, תא T), ברדיוס מסוים סביב תא X.
- חשב את השטח מתחת לעקומה האמפירית כדי לקבל ערך מספרי המייצג את חדירת הגידול של תאי CD3+ T סביב תאי הגידול11 (איור 6C). השתמש בפונקציות תיאוריות מרחביות אחרות, כגון פונקציית F או פונקציית J12.
- ניתוח אימונוסקור
- חשב את Immunoscore (I), שפותח על ידי הצוות של גלאון7,8, על ידי שימוש בצפיפות של תאי T CD3+ ו- CD8+ במרכז הגידול ובשוליים הפולשניים של הגידול.
הערה: הניקוד נע בין I0 ל- I4. צפיפות נמוכה של תאי T CD3+ ו- CD8+ במרכז הגידול ובשולי הגידול קשורה לציון I0, בעוד צפיפות גבוהה של תאי T CD3+ ו- CD8+ בשני האזורים קשורה לציון I4. לאחרונה, ההשפעה הפרוגנוסטית של האימונוקור אומתה במחקר עם דגימות מ -2,681 חולי סרטן המעי הגס בשלב I-III מ -14 מרכזים ב -13 מדינות7. עם זאת, כדי להיות מחושב, Immunoscore דורש דגימה כירורגית המכילה הן את המרכז והן את השוליים של הגידול. עבור ביופסיות, שבדרך כלל חסרות שוליים, פותחה לאחרונה Immunoscore מותאמת ביופסיה13. - כדי לחשב את Immunoscore המותאם לביופסיה, המר את הערך של צפיפות תאי T CD3+ ו- CD8+ לאחוזון, ולאחר מכן השתמש באחוזון הממוצע של תאי T CD3+ ו- CD8+ לניקוד לאחת משלוש קטגוריות (כלומר, נמוך, בינוני וגבוה)13.
- חשב את Immunoscore (I), שפותח על ידי הצוות של גלאון7,8, על ידי שימוש בצפיפות של תאי T CD3+ ו- CD8+ במרכז הגידול ובשוליים הפולשניים של הגידול.
- ניתוח נקודות חמות
- השתמש בניתוח נקודות חמות, באמצעות הפונקציה quadratcount (spatstat)10, כדי להשוות את הצפיפויות של סוגי תאים שונים באזור המסתנן ביותר של הרקמה. לדוגמה, אפשר לחשב ציון "דמוי אימונוסקורק" באמצעות הערך של צפיפות תאי CD3 ו-CD8 T של הריבועים החדירים ביותר של הרקמה (איור 7). החל שיטה זו לניתוח של כל סוג תא עם התפלגות לא הומוגנית על פני הרקמה.
- ניתוח צפיפות
תוצאות
בעקבות פרוטוקול זה, יש לחקור מספר פרמטרים כדי לוודא שהרקמה מוכתמת כראוי. ראשית, צביעת TSA צריכה להציג טווח דינמי טוב בעת שימוש בזמני חשיפה נמוכים (בדרך כלל 2-100 אלפיות השנייה) במהלך תהליך הסריקה. זמן חשיפה נמוך מרמז על כך שההגברה נעשתה כראוי במהלך התגובה עם HRP. עבור אנטיגנים המוכתמים בנוגדן המשני הצמוד ישירות לפלואורוכרום, זמן החשיפה יכול להיות ארוך בהרבה, מה שעלול להוביל להלבנה (ירידה בעוצמת האות עקב זמן חשיפה ארוך). שנית, חשוב לוודא שכל כתם מציג SNR גבוה. אות רקע גבוה עם אות אנטיגן נמוך יכול להיות אינדיקציה לכך שהנוגדן הראשוני אינו ספציפי מספיק, שהפרוקסידאזות האנדוגניות לא הושבתו כראוי, או ששלב אחד של הפרוטוקול לא נעשה כראוי. שלישית, בהתאם לסורק השקופיות ולערכות המסננים המשמשות לסריקה, ניתן לראות חפיפה בין שני צבעים (לדוגמה, AF555, AF594 ו- AF647). בחירת ערכות הסינון הנכונות בסורק ודילול הנוגדנים הראשוני הנכון הן חיוניות כדי למנוע גילויים צולבים אפשריים. בקרת איכות כוללת זיהוי של תאים מוכתמים בודדים עבור כל סמן בקובץ הסרוק. לבסוף, חשוב גם להוסיף שליטה חיובית ושלילית עבור כל אצווה של צביעה. עבור תאים חיסוניים, השקדים הם שליטה חיובית טובה. תוצאה מייצגת של צביעה אופטימלית מוצגת באיור 1.
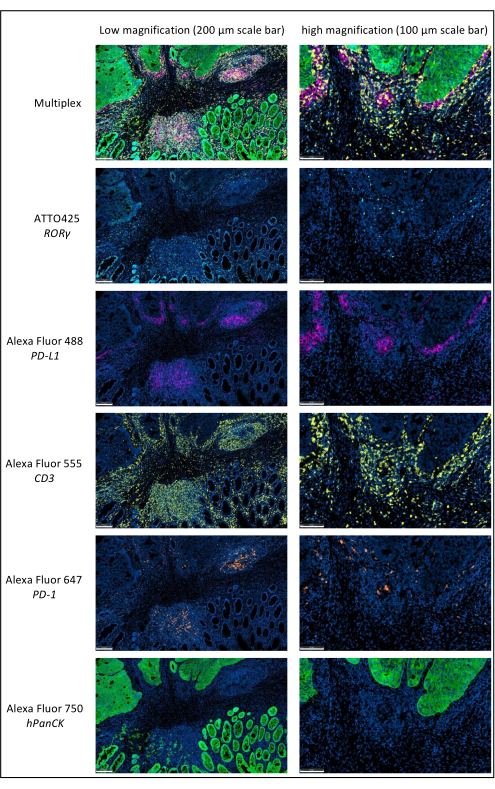
איור 1: סרטן רקטלי מתקדם מקומי המוכתם על-ידי אימונופלואורסנציה מרובה. קיצורים: PD-1 = חלבון מוות תאי מתוכנת 1; PD-L1 = ליגנד מוות מתוכנת 1; ROR-γ = גמא קולטן יתום הקשור ל- RAR; CD3 = אשכול של בידול 3; hPanCK = פאן-ציטוקרטין אנושי. כל צביעת אנטיגן נסרקת בגווני אפור, והצבעים המוצגים באיור הם פסאודו-צבעים. סרגל קנה מידה הגדלה נמוכה: 200 מיקרומטר; סרגל קנה מידה הגדלה גבוהה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
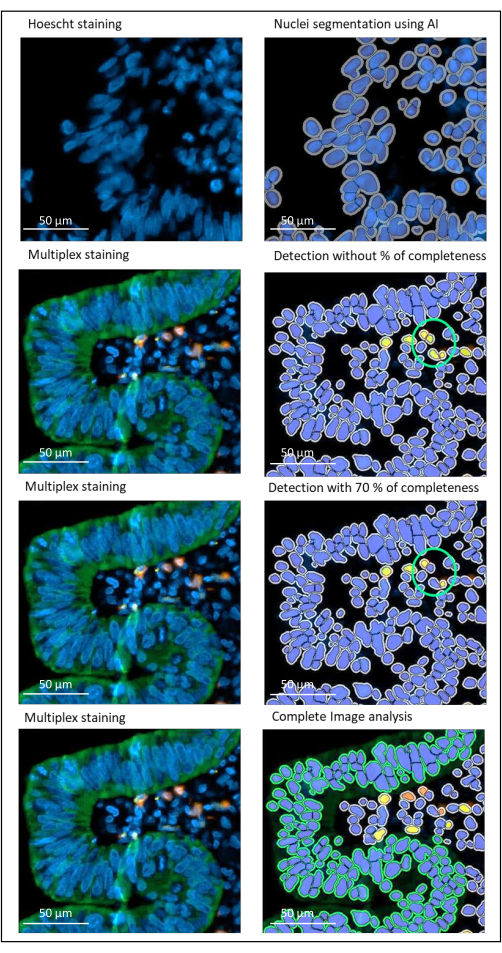
איור 2: זיהוי גרעינים וכתמים של סרטן רקטלי מתקדם מקומי באמצעות תוכנת ניתוח תמונות. ללא פרמטר אחוז השלמות מוגדר כראוי, התוכנה מזהה שני תאי CD8+ (עיגול ירוק) מכיוון שהם קרובים זה לזה, אך רק תא אחד מוכתם. שימוש בשלמות של 70% מסייע למנוע זיהוי חיובי כוזב זה. ירוק = hPanCK; צהוב = CD3; כתום = CD8. סרגל קנה מידה: 100 מיקרומטר אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
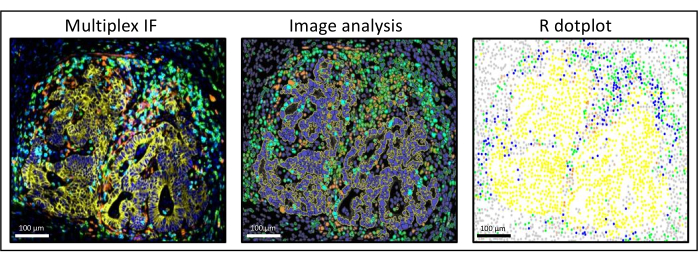
איור 3: ניתוח תמונות ושחזור תרשים R של גרורות בסרטן המעי הגס בכבד. על צביעת המרבב (משמאל), pan-cytokeratin אנושי הוא בצהוב, CD3 הוא בירוק, CD8 הוא בכחול בהיר, ו- IDO הוא בכתום. בתרשים הנקודות (מימין), תאי פאן-ציטוקרטין+ אנושיים הם בצהוב, תאי CD3+CD8− בירוק, תאי CD3+CD8+ בכחול, ותאי IDO+ בכתום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
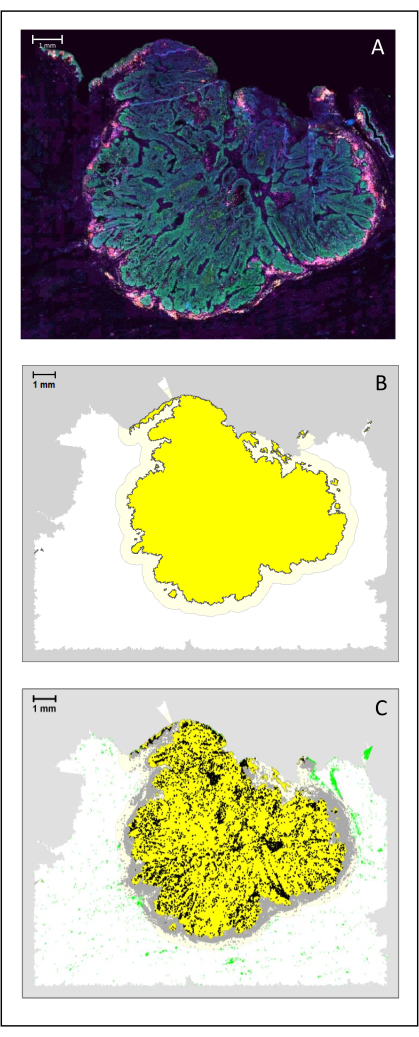
איור 4: ניתוח קטע כירורגי של HNSCC. (A) קטע כירורגי של HNSCC. תאים סרטניים נראים בירוק. תאים פרי-גידוליים מוצגים סביב איי הגידול (CD3 בצהוב ו-CD8 בסגול). (B) מרכז הגידול (בצהוב עם גבול שחור) מחושב ביואינפורמטית על ידי אלגוריתם k-nearest-neighbor בהתבסס על המרחק בין איי הגידול מאזור יחיד. סביב אזור זה, שוליים פולשניים (צהוב בהיר עם גבול אפור) מחושבים על בסיס שרירותי של 500 מיקרומטר. (C) תאי T פולשניים מודגשים עם נקודות שחורות במרכז הגידול ונקודות אפורות בשוליים הפולשניים. תאי T אחרים מודגשים בנקודות ירוקות בהירות. סרגל קנה מידה: 1 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
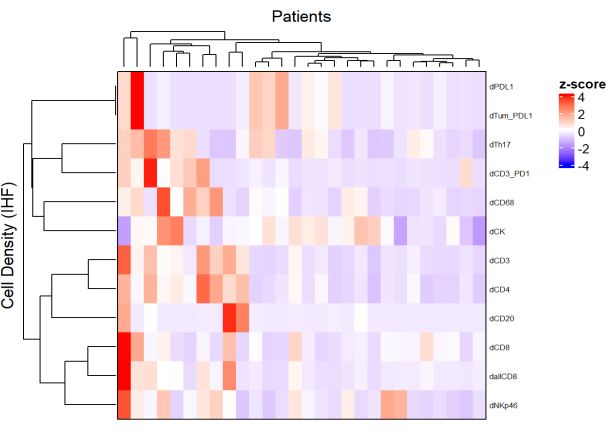
איור 5: מפת חום של צפיפות סוגי תאים שונים של ביופסיות סרטן רקטלי מתקדם מקומי. מפת החום שורטטה באמצעות אשכולות ללא פיקוח של צפיפויות של סוגי תאים שונים מלוחות מולטיפלקס שונים עם חבילת ComplexHeatmap. קנה מידה ומרכוז שימשו לנורמליזציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
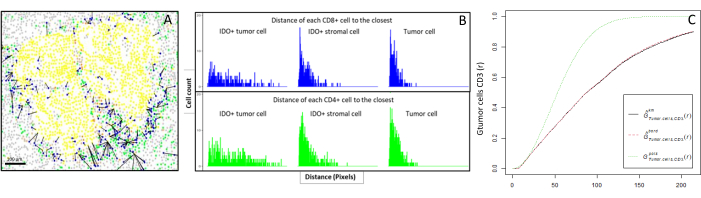
איור 6: מרחקים של תאי CD4+ ו-CD8+ לכל תא IDO+ או תא גידולי. תאי פאן-ציטוקרטין + אנושיים הם בצהוב, תאי CD3+CD8 בירוק, תאי CD3+CD8+ בכחול, ותאי IDO+ בכתום. (A) המרחק הקרוב ביותר בין תאי הגידול לבין כל תא CD8+ T. (B) ברשימים של המרחקים בין תאי IDO+ לבין כל תא T CD8+ (כחול) או CD4+ T (ירוק). (C) דוגמה למדגם שנותח על ידי פונקציית G-cross. ציר ה-y מראה את ההסתברות של תא גידול להיתקל בלימפוציטים CD3+ ברדיוס הנע בין 0-200 מיקרומטר סביב התא הסרטני. מוצגות שלוש עקומות; העקומה התיאורטית היא בירוק מנוקד (התפלגות פואסון), העקומה האמפירית המתוקנת עם תיקון ק"מ היא בשחור, והעקומה האמפירית המתוקנת עם תיקון גבול היא באדום מנוקד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
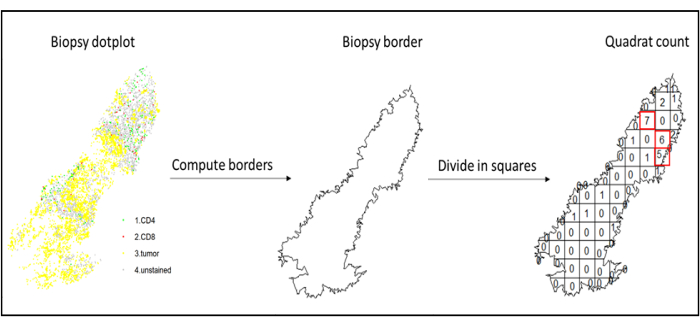
איור 7: איור של ספירת ריבוע. חישוב גבולות וספירת ריבועים בוצעו באמצעות חבילת המרית. ניתן להשתמש בריבועים (נקודות חמות) המסתננים ביותר לסטטיסטיקה במורד הזרם. CD4 הוא בירוק, CD8 הוא באדום, ותאי הגידול הם בצהוב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
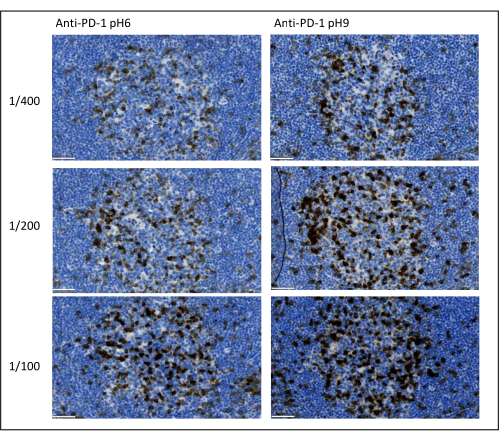
איור 8: דילול נוגדנים ואופטימיזציה של שליפת אנטיגן. זיהוי כרומוגני של PD-1 באמצעות שלושה דילולים שונים ושתי תמיסות שליפת אנטיגן שונות של הנוגדן הראשוני (ציטראט pH 6 ו- EDTA pH 9). סרגל קנה מידה: 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| נוגדן ראשוני | דילול | שליפת אנטיגן | נוגדן משני | פלואורוכרום | מיקום |
| PD-1 | 1/100 | EDTA (pH 9) | נגד ארנב | AF647 | 1 |
| PD-L1 | 1/1000 | EDTA (pH 9) | נגד ארנב | AF488 | 2 |
| ROR-γ | 1/200 | EDTA (pH 9) | אנטי-עכבר | ATT0-425 | 3 |
| CD3 | 1/100 | ציטראט (pH 6) | נגד ארנב | AF555 | 4 |
| hPanCK | 1/50 | ציטראט (pH 6) | אנטי-עכבר בשילוב עם AF750 | 5 | |
טבלה 1: דוגמה לחלונית מולטיפלקס ממוטבת. קיצורים: PD-1 = חלבון מוות תאי מתוכנת 1; PD-L1 = ליגנד מוות מתוכנת 1; ROR-γ = גמא קולטן יתום הקשור ל- RAR; CD3 = אשכול של בידול 3; hPanCK = פאן-ציטוקרטין אנושי; AF = AlexaFluor; EDTA = חומצה ethylenediaminetetraacetic. CD3 משמש לזיהוי לימפוציטים מסוג T; PD-1 משמש לאיתור לימפוציטים מותשים; ROR- γ משמש לגילוי Th-17; ו-hPanCK משמש לזיהוי תאים סרטניים. עמודת המיקום מציינת את הסדר שבו יש לבצע את המרבב הרציף.
Discussion
הפרמטרים החשובים ביותר שיש לקחת בחשבון כדי לייעל את צביעת המרבב הם הדילול, הספציפיות ושליפת האנטיגן המשמשת לכל נוגדן ראשוני. לפני תחילת פרוטוקול מולטיפלקס, יש לבדוק את הדילול האופטימלי של כל נוגדן ראשוני ואת שליפת האפיטופ האופטימלית (pH 6 או pH 9) באמצעות צביעה כרומוגנית (DAB). אנו ממליצים לבדוק שלושה דילולים עבור כל מאגר שליפת אנטיגן: הדילול שמוגדר בדרך כלל על ידי המותג המסחור את הנוגדן, אותו דילול מחולק פי שניים, ואותו דילול מוכפל פי שניים (איור 8). בחירת הדילול הנכון היא צעד חשוב מאוד לאימות ספציפיות הנוגדנים ולאופטימיזציה של יחס אות לרעש (SNR) של הצביעה. לאחר בחירת הדילול הנכון ב- DAB, יש לבדוק את אותו דילול עבור כל נוגדן ראשוני באמצעות Uniplex TSA. לאחר בחירת חיץ הדילול ושליפת האפיטופ עבור כל צביעת אנטיגן, חשוב גם להגדיר נכון את רצף המרבב; באופן ספציפי, אנטיגנים מסוימים מוכתמים טוב יותר במיקום הראשון ואחרים במיקום האחרון. אנו ממליצים לבדוק את התיוג המרובב באמצעות כל תמורות ההזמנה האפשריות כדי לבחור איזה מכתים אנטיגן צריך לבוא ראשון, שני, וכו ' זהו גם צעד חשוב מאוד מכיוון שחלק מהאנטיגנים השבירים יכולים להתפרק לאחר מספר סבבים של שליפת אפיטופים, וחלק מהאנטיגנים מוכתמים טוב יותר לאחר מספר סבבים של שליפת אפיטופים. לדוגמה, SNR הוא תמיד גבוה יותר במיקום האחרון עבור CD3 ובמצב הראשון עבור צביעת PD-1. יתר על כן, הצביעה של מספר אנטיגנים מקומיים יכולים להיות מופרעים על ידי אפקט מטריה (הרוויה של אתרים תגובתיים טירמיד). זה יכול להיות מוחלש על ידי הפחתת ריכוז טירמיד. כאשר ביטוי של אנטיגן אחד מותנה בביטוי של אנטיגן אחר (CD8 קיים רק על תאי T המבטאים CD3), אנו ממליצים לצבוע את האנטיגן בביטוי הרחב ביותר (CD3 במקרה זה) אחרי השני. לבסוף, בחירת הפלואורוכרום הנכון לכל צביעת אנטיגן בהתאם לספציפיות הסורק היא גם צעד חשוב כדי למנוע זיהוי צולב.
היתרונות העיקריים של טכניקה זו הם ההגברה ויחס האות לרעש המתקבל. עם זאת, טכניקה זו מגיעה עם מגבלה, והיא כי מכתים הוא רציף, ואת fluorochromes קשורים באופן קוולנטי לרקמה. עם זאת, לאחר ביצוע כל סבבי הגברת אות הטירמיד, ניתן גם להוסיף צביעה אחרונה עם נוגדן משני המשולב ישירות עם פלואורוכרום (ללא TSA). בחלק מהפאנלים השתמשנו בשיטה זו כדי להוסיף צביעה בערוץ 750. זה היה הכרחי מכיוון שאף טירמיד-AF750 לא היה זמין מסחרית באותה תקופה. יש לציין כי זמן החשיפה (במהלך הסריקה) של האנטיגן המוכתם ב-AF750 יהיה ארוך בהרבה מאשר עבור האנטיגנים האחרים המוכתמים ב-TSA. במקרה זה, אנו ממליצים להכתים חלבון בעל ביטוי גבוה כגון cytokeratin או להגדיל את הריכוז של הנוגדן הראשוני. על ידי כך, ניתן להכתים מקסימום חמישה עד שישה אנטיגנים בכל שקופית באצווה אחת, בהתאם לסורק הפלואורסצנטי.
בניגוד לכך, מספר טכניקות מסחריות משתמשות בצביעה סדרתית עם מספר סבבים של צביעה, סריקה והפשטה או הלבנה כדי לשפר את מספר האנטיגנים שניתן להכתים על קטע רקמה אחד בודד. עם זאת, טכניקות אלה הן לעתים קרובות זמן רב, יקר, אין הגברה אותות, דורשים צעדים חישוביים מתקדמים כדי למזג את הסריקות הטוריות כראוי, ומניסיוננו, יכול לגרום נזק בלתי הפיך לרקמות עקב שלבי הליך רבים. עם זאת, דווח כי ניתן להכתים עד 30 אנטיגנים על רקמה אחת בודדת בשיטה זו14.
לסיכום, השיטה שלנו היא טכניקת אימונוהיסטופלואורסנציה חזקה, ניתנת לשחזור, קלה לשימוש וחסכונית שניתן להשתמש בה בכל מעבדה בעלת סורק שקופיות פלואורסצנטי. ניתן להשתמש בכל נוגדן ראשוני מסחרי המתאים ל-IHC, והפאנלים אינם ספציפיים לערכות מסחריות כלשהן. ניתוח התמונה יכול להיעשות על מספר תוכנות שונות, כולל תוכנות קוד פתוח כגון QuPath ו- R. עם זאת, אנו סבורים כי שיטה זו אף יכולה להשתפר בעתיד עבור לוחות אנטיגן גדולים, ולאפשר ביצוע צביעה/סריקה סדרתית של אותה שקופית עם פאנלים שונים של אנטיגנים ועם היתרון של הגברת אותות.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
המחברים רוצים להודות לד"ר דרואן פ. על עזרתה ותמיכתה. ניקולס הויג הוא עמית מחקר הנתמך על ידי מענק מהקרן הלאומית הבלגית למחקר מדעי (Télévie/FNRS 7460918F).
Materials
| Name | Company | Catalog Number | Comments |
| anti-CD3 primary antibody | Abcam | ab16669 | rabbit monocolonal |
| anti-CD8 primary antibody | DAKO | M710301 | mouse monoclonal |
| anti-hPanCK primary antibody | DAKO | M3515 | mouse monoclonal |
| anti-PD-1 primary antibody | Cell Signalling | D4W2J | rabbit monocolonal |
| anti-PD-L1 primary antibody | Cell Signalling | 13684 | rabbit monocolonal |
| anti-RORC primary antibody | Sigma | MABF81 | mouse monoclonal |
| ATTO-425 | ATTOtec | ||
| Axioscan Z1 | Zeiss | Light source: Colibri 7 (385, 430, 475, 555, 590, 630, 735 nm) Filtersets: Excitation 379/34 – beam splitter 409 – emission 440/40; Excitation 438/24 – beam splitter 458 – emission 483/32; Excitation 490/20 – beam splitter 505 – emission 525/20; Excitation 546/10 – beam splitter 556 – emission 572/23; Excitation 592/21 – beam splitter 610 – emission 630/30; Excitation 635/18 – beam splitter 652 – emission 680/42; Excitation 735/40 – beam splitter QBS 405 + 493 + 611 + 762 - emission QBP 425/30 + 524/51 + 634/38 + 785/38; Objective: Plan-Apochromat 20x/0.8; Camera : Orca Flash 4.0 V3 | |
| Borosilicate Cover Glass | VWR | 631-0146 | |
| Envision+ anti-mouse | DAKO | K4001 | |
| Envision+ anti-rabbit | DAKO | K4003 | |
| Fluorescence mounting medium | DAKO | S3023 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 750 | ThermoFischer | A-21037 | |
| HALO software | Indicalabs | ||
| Hoescht | Sigma | 14533 | |
| Superfrost plus microscope slides | Fisherscientific/Epredia | 10149870 | |
| Tyramide-AF488 | ThermoFischer | B40953 | |
| Tyramide-AF555 | ThermoFischer | B04955 | |
| Tyramide-AF647 | ThermoFischer | B04958 |
References
- Ge, P., et al. Profiles of immune cell infiltration and immune-related genes in the tumor microenvironment of colorectal cancer. Biomedicine & Pharmacotherapy. 118, 109228 (2019).
- Fridman, W. H. The immune microenvironment as a guide for cancer therapies. Oncoimmunology. 1 (3), 261-262 (2012).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: Impact on clinical outcome. in Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Calu, V., et al. Key biomarkers within the colorectal cancer related inflammatory microenvironment. Scientific Reports. 11 (1), 7940 (2021).
- Havel, J. J., Chowell, D., Chan, T. A. The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nature Reviews. Cancer. 19 (3), 133-150 (2019).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Mlecnik, B., et al. Integrative analyses of colorectal cancer show immunoscore is a stronger predictor of patient survival than microsatellite instability. Immunity. 44 (3), 698-711 (2016).
- Gu, Z., Eils, R., Schlesner, M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data. Bioinformatics. 32 (18), 2847-2849 (2016).
- Baddeley, A., Rubak, E., Turner, R. . Spatial Point Patterns: Methodology and Applications with R. , (2022).
- Barua, S., et al. Spatial interaction of tumor cells and regulatory T cells correlates with survival in non-small cell lung cancer. Lung Cancer. 117, 73-79 (2018).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- El Sissy, C., et al. A diagnostic biopsy-adapted immunoscore predicts response to neoadjuvant treatment and selects patients with rectal cancer eligible for a watch-and-wait strategy. Clinical Cancer Research. 26 (19), 5198-5207 (2020).
- Bolognesi, M. M., et al. Multiplex staining by sequential immunostaining and antibody removal on routine tissue sections. The Journal of Histochemistry and Cytochemistry. 65 (8), 431-444 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved