Method Article
Multipleks İmmünofloresan, Tümör Mikroçevresinin Klinik ve Biyolojik Değerlendirmesi için Uzamsal Görüntü Analizi ile Kombine Edildi
Bu Makalede
Özet
Bu makalede, manuel tiramid sinyal amplifikasyonu (TSA) multipleks immünofloresan (mIF) protokolü ile birlikte görüntü analizi ve uzamsal analiz anlatılmaktadır. Bu protokol, laboratuvarda bulunan slayt tarayıcısına bağlı olarak slayt başına iki ila altı antijenin boyanması için formalin sabit parafin gömülü (FFPE) bölümlerle birlikte kullanılabilir.
Özet
Tümör mikroçevresi (TME), sitotoksik bağışıklık hücreleri ve immünomodülatör hücreler gibi farklı hücre tiplerinin bolluğundan oluşur. Bileşimine ve kanser hücreleri ile peri-tümöral hücreler arasındaki etkileşimlere bağlı olarak, TME kanser ilerlemesini etkileyebilir. Tümörlerin ve karmaşık mikro çevrelerinin karakterizasyonu, kanser hastalıklarının anlaşılmasını geliştirebilir ve bilim adamlarının ve klinisyenlerin yeni biyobelirteçler keşfetmelerine yardımcı olabilir.
Son zamanlarda, kolorektal kanser, baş boyun skuamöz hücreli karsinom, melanom ve akciğer kanserinde TME'nin karakterizasyonu için tiramid sinyal amplifikasyonuna (TSA) dayanan birkaç multipleks immünofloresan (mIF) paneli geliştirdik. İlgili panellerin boyanması ve taranması tamamlandıktan sonra, numuneler bir görüntü analiz yazılımı üzerinde analiz edilir. Her hücrenin uzamsal konumu ve boyanması daha sonra bu niceleme yazılımından R'ye aktarılır. Sadece birkaç tümör bölmesindeki (örneğin tümörün merkezi, tümörün marjı ve stroma) her hücre tipinin yoğunluğunu analiz etmemize değil, aynı zamanda farklı hücre tipleri arasında mesafeye dayalı analizler yapmamıza izin veren R komut dosyaları geliştirdik.
Bu özel iş akışı, birkaç işaretleyici için rutin olarak gerçekleştirilen klasik yoğunluk analizine uzamsal bir boyut ekler. mIF analizi, bilim adamlarının kanser hücreleri ve TME arasındaki karmaşık etkileşimi daha iyi anlamalarını ve bağışıklık kontrol noktası inhibitörleri ve hedefli tedaviler gibi tedavilere yanıtın yeni prediktif biyobelirteçlerini keşfetmelerini sağlayabilir.
Giriş
Hedefe yönelik tedavilerin ve immün kontrol noktası inhibitörlerinin gelişmesiyle birlikte, kanser hücreleri ile tümör mikroçevresi arasındaki etkileşimleri daha iyi karakterize etmek son derece önemli hale gelmiştir ve bu şu anda önemli bir translasyonel araştırma alanıdır. TME, kanser hücrelerini hedef alan immün sitotoksik hücrelerin dengesi ve tümör büyümesini ve invazivliğini destekleyebilecek immünomodülatör hücreler 1,2,3,4 ile farklı hücre tiplerinin bolluğundan oluşur. Bu karmaşık ortamın karakterizasyonu, kanser hastalıklarının anlaşılmasını geliştirebilir ve bilim adamlarının ve klinisyenlerin gelecekteki tedavi için hastaları daha iyi seçmek için yeni prediktif ve prognostik biyobelirteçler keşfetmelerine yardımcı olabilir 5,6. Örneğin, Galon ve ekibi, öngörücü bir biyobelirteç olarak kullanılabilecek tekrarlanabilir bir puanlama yöntemi olan Immunoscore'u geliştirdi. İmmünoskor, invaziv sınırda ve tümörün merkezinde CD3 + ve CD8 + T hücrelerinin yoğunluğu kullanılarak hesaplanır 7,8.
Geçtiğimiz on yıllar boyunca, mIF için ticari çözümler geliştirilmiştir, ancak bunlar genellikle pahalıdır ve spesifik antijen panelleri için tasarlanmıştır. Akademik ve translasyonel araştırmalarda spesifik antijen panellerine olan ihtiyacın üstesinden gelmek için, FFPE tümör kesitlerinde mIF'yi gerçekleştirmek için uygun maliyetli bir yöntem geliştirdik ve insan ve fare örneklerinde karşı boyama yapan hücre çekirdeğine eklenen iki ila altı antijenin boyanmasına izin verdik.
Tüm doku bölümleri boyandıktan ve bir floresan slayt tarayıcı ile tarandıktan sonra, örnekler büyük piramidal veri kümelerini destekleyen birkaç görüntü analiz yazılımı tarafından analiz edilebilir. Son olarak, ham veriler, yoğunluk ve mekansal tabanlı analizler gerçekleştirmek için R yazılımı (v.4.0.2) gibi istatistiksel hesaplama ve grafikler için bir ortamda kullanılabilir.
Bu makalede, beş işaretleyicili boyama için optimize edilmiş bir protokol ve yeni panelleri optimize etmek için püf noktaları ve ipuçları sunulmaktadır. Ayrıca, görüntü analizinin ayrıntılı adımları ve istatistiksel ve mekansal analiz için kullanılan R fonksiyonları açıklanmaktadır.
Protokol
Bu protokolde kullanılan tüm örnekler, yerel etik kurullar tarafından onaylanan ve yetkili makam tarafından yetkilendirilen bir çalışmadan alınmıştır. Çalışmaya katılan tüm katılımcılar yazılı bilgilendirilmiş onam vermiştir. Deneme ClinicalTrials.gov (NCT03608046) ile kayıtlıdır.
1. Multipleks immünofloresan
- FFPE bölümleme
- Dokuyu% 4 paraformaldehit içine sabitleyin ve sabit dokuyu parafine gömün.
- 5 μm bölümleri kesin ve yapışkan mikroskop slaytlarına yerleştirin.
- Slaytları gece boyunca oda sıcaklığında (RT) kurutun.
- Deparafinizasyon ve endojen peroksidaz inhibisyonu
- Slaytları toluen (her biri 5 dakika boyunca 3x) ve metanole (her biri 5 dakika boyunca 3x) bir duman başlığının altına batırarak dokuları balmumundan arındırın.
- Slaytları metanol içinde seyreltilmiş % 3 hidrojen peroksit içine 20 dakika boyunca bir duman davlumbazının altına batırarak endojen peroksidazları inhibe edin.
- Slaytları damıtılmış (d) H2O (3 dakika boyunca 1x) içinde durulayın.
- Multipleks immünofloresan boyama
- Slaytları, %0,1 TritonX-100 ile tamamlanan 10 mM sitrat (pH 6) veya EDTA (pH 9) tamponu içeren 300 mL'lik bir boyama kavanozuna batırın.
NOT: Kullanılan tampon (pH 6 veya pH 9) boyanan antijene bağlıdır (bakınız Tablo 1). - Boyama kavanozunu kapağı kapalı olarak mikrodalgada tampon kaynamaya başlayana kadar maksimum güçte (örneğin 900 W) 3-5 dakika bekletin.
NOT: Kaynatma için en uygun süre mikrodalgaya ve tamponun hacmine bağlıdır. Mükemmel zamanlamayı bulmak için ayarlamalar gerekebilir. Bazı kırılgan antijenler veya kırılgan ve daha az yapışkan örnekler (örneğin, organoidler ve sferoidler) için, mikrodalga kaynatma çok sert olabilir. Bu durumda, bunun yerine bir düdüklü tencere kullanılabilir. - Kapalı boyama kavanozunu mikrodalgada düşük güçte (örneğin, 90 W) 15 dakika boyunca koyarak tamponu kaynamaya yakın sıcaklıkta tutun.
- Mikrodalgayı 90 s boyunca maksimum güce koyarak ısıtmanın son adımını gerçekleştirin.
- Kavanozu mikrodalgadan çıkarın ve arabelleğin RT'de 15 dakika soğumasını bekleyin.
- Slaytları her biri dH2O cinsinden 5 dakika boyunca 3x ve 5 dakika boyunca 1x, % 0,1 Tween 20 (TBS-T) içeren tris tamponlu salin içinde durulayın.
- Slaytları bir kağıt havlu üzerinde lekeleyerek TBS-T'yi çıkarın
- Slaytları (düz) bir boyama odası tepsisine veya mikroskop slayt kutusuna yerleştirin (bkz.
- Dokuyu hidrofobik bir kalemle çevreleyin.
- Dokuyu 30 dakika boyunca TBS-T'de çözünmüş% 5 sığır serum albümini (BSA) ile kaplayarak spesifik olmayan bağlanma bölgelerini bloke edin.
- Slaytları bir kağıt havlu üzerinde lekeleyerek engelleme tamponunu çıkarın.
NOT: Engelleme adımından sonra slaytları durulamayın. - Dokuyu yaklaşık 300 μL çözelti ile kaplayarak% 1 BSA TBS-T içinde seyreltilmiş birincil antikor ( bakınız Tablo 1) ile dokuyu 60 dakika boyunca inkübe edin.
- Slaytları TBS-T ile her biri 3 dakika boyunca 3 kez durulayın.
- Dokuyu yaklaşık 300 μL çözelti ile kaplayarak poli-HRP sekonder antikoru ile 40 dakika boyunca inkübe edin (bakınız Tablo 1).
- Slaytları TBS-T ile 3 dakika boyunca 3 kez durulayın.
- Borat tamponunda (0.1 M borat, pH 7.8, 3 M NaCl) 200 kat seyreltilmiş florokrom-tiramid reaktifi (bakınız Tablo 1) ile dokuyu yaklaşık 300 μL çözelti ile kaplayarak eşzamanlı olarak %0.003H2O2ile takviye edilmiş florokrom-tiramid reaktifi (bakınız Tablo 1) ile dokuyu 10 dakika boyunca inkübe edin.
- Slaytları TBS-T ile 3 dakika boyunca 3 kez durulayın.
- Tüm TSA boyamaları yapılana kadar 1.3.1-1.3.16 adımlarını yineleyin.
- Dokuyu gece boyunca 4 ° C'de,% 1 BSA, TBS-T içinde seyreltilmiş son birincil antikor ( bakınız Tablo 1) ile inkübe edin.
NOT: Kuluçka gece boyunca olduğundan, inkübasyon sırasında dokuların kurumadığından emin olmak için boyama odası tepsisini veya mikroskop slayt kutusunu örtmek ve kutunun altındaki (slaytların altındaki) bir kağıt havluya dH2O eklemek önemlidir. - TBS-T ile dokuyu her biri 5 dakika boyunca 3 kez durulayın.
- Dokuyu,% 1 BSA, TBS-T'de 200 kat seyreltilmiş ikincil antikor (doğrudan florokrom ile birleştiğinde) ile 120 dakika boyunca inkübe edin.
- TBS-T ile dokuyu her biri 5 dakika boyunca 3 kez durulayın.
- Dokuyu% 10 BSA TBS-T'de 1.000 kat seyreltilmiş bisbenzimid (20 mM) içinde 5 dakika boyunca inkübe ederek çekirdekleri lekeleyin.
NOT: Bibenzimid DAPI ile değiştirilebilir, ancak ikincisi daha toksiktir ve bir duman davlumbazının altında dikkatlice ele alınmalıdır. - Dokuyu 3x boyunca her biri 3 dakika boyunca dH2O cinsinden durulayın.
- Slaytları floresan montaj ortamı ve borosilikat kapak camları kullanarak monte edin.
- Slaytları, %0,1 TritonX-100 ile tamamlanan 10 mM sitrat (pH 6) veya EDTA (pH 9) tamponu içeren 300 mL'lik bir boyama kavanozuna batırın.
2. Slayt tarama
- Slaytları floresan slayt tarayıcısında 20x büyütmede tarayarak dijitalleştirin (slayt tarayıcı ayrıntıları Malzeme Tablosunda verilmiştir).
NOT: Optimal bir multipleksin temsili taraması Şekil 1'de gösterilmiştir.
3. Görüntü analizi
- Taramaları bir görüntü analiz yazılımına (Dosya > Görüntüyü Aç) içine aktarın.
- Sınıflandırıcılar sekmesine gidin ve DenseNet AI V2 eklentisini seçin.
- DenseNet AI V2 eklentisini, bir görüntüde yaklaşık 500 çekirdeği çevreleyerek çekirdekleri tanıyacak şekilde eğitin.
- AI'yı, birkaç slaytta (yaklaşık 10) birkaç çekirdeği (50) çevreleyerek aynı gruptan ve farklı mIF boyama gruplarından birkaç slayt üzerinde eğitin.
NOT: AI eklentisinin nasıl kullanılacağına ilişkin ayrıntılı talimatlar yazılım kılavuzunda bulunabilir. Çekirdek tespiti için yapay zekanın kullanılması isteğe bağlıdır. Çekirdekleri tespit etmek için kullanılan görüntü analiz yazılımına bağlı olarak başka yöntemler de mevcuttur. - Eğitilen yapay zekayı kaydedin (Sınıflandırıcı Eylemleri > Kaydet).
- Ek Açıklamalar sekmesine gidin ve Kalem Ek Açıklama Aracı'nı kullanarak tümörün merkezi ve tümörün kenar boşluğu gibi her ilgilenilen bölge (ROI) için bir ek açıklama oluşturun.
- Gerekirse, kıvrımlı bölgeleri ve bulanık görünen bölgeleri Hariç Tutma Ek Açıklama Aracı'nı kullanarak kaldırın.
NOT: mIF için kullanılana bitişik bir bölümün hematoksilin-eozin boyaması, numunede tümör hücrelerinin bulunduğundan emin olmak ve anatomopatologların ROI'leri belirlemelerine yardımcı olmak için mIF boyamasından önce yapılabilir. - Analiz sekmesine gidin ve HighPlex FL algoritmasını seçin (HighPlex FL>yi Yükle > Ayarlar Eylemleri).
- Boya Seçimi sekmesini seçin ve ilgilendiğiniz boyayı seçin.
- Nükleer Algılama sekmesinde, Nükleer Segmentasyon Türü'ne gidin ve AI özel'i seçin.
- Nükleer Segmentasyon Sınıflandırıcısı'nda, adım 3.5'te kaydedilen AI'yı seçin.
- Membran ve Sitoplazma Tespiti sekmesinde, maksimum sitoplazma yarıçapını (bu çalışmada 1.5 kullanılmıştır) ve membran boyalarının sayısını seçin.
- Her boya için çekirdek pozitif eşiğini, sitoplazma pozitif eşiğini ve membran pozitif eşiğini seçin.
NOT: Eşik her boyama için farklıdır ve her slayt grubu ve boyanan her antijen için ayarlanmalıdır. Görünüm Ayarları aracını (Ayarları Görüntüle > Görüntüle) kullanmak, yoğunluk zirvesinin sonundaki (sağda) yoğunluk değerini kullanarak yeterli bir eşik seçmenize yardımcı olabilir. - Her boya için, bütünlük değerlerinin çekirdek, membran ve sitoplazma yüzdesini seçin.
NOT: Bu parametre, farklı boyamalara sahip iki hücre birbirine yakın olduğunda yanlış pozitif algılamayı önlemek için önemlidir (Şekil 2). - Algoritmayı kaydedin (Ayarlar İşlemleri > Kaydet).
- YG'leri analiz edin (Ek Açıklama Katmanı> Analiz Edin).
- Sonuçlar sekmesine gidin ve Nesne Verileri'ndeki (ctrl + A) tüm verileri seçin.
- Verileri .csv biçimde dışa aktarın (Nesne Verilerini Dışa Aktar> > sağ tıklayın. CSV).
NOT: Bu tablo konumu içerir (Xmin, Xmax; Ymin, Ymax) ve analiz edilen her hücrenin her bir belirtecinin pozitifliği.
4. R kullanarak biyoinformatik
NOT: Aşağıdaki adımlar hakkında daha fazla ayrıntı sağlayan bir R betiği GitHub (benidovskaya/Ring: Multipleks immünofloresan boyamalarının analizi için işlem hattı. [github.com])
- Dışa aktarılan tabloyu kullanarak, önce kolokalizasyon boyamalarına göre farklı hücre türlerini tanımlayın. Örneğin, sitotoksik T hücrelerini çift pozitif CD3 + / CD8 + hücreleri ile tanımlayın.
- Ardından, görüntü analiz yazılımından ve ggplot2'den dışa aktarılan koordinatları kullanarak bir nokta grafiği üzerinde slaydın basitleştirilmiş bir görüntüsünü yeniden oluşturun (Şekil 3). Bu verileri kullanarak, çeşitli analiz türleri gerçekleştirilebilir:
- Yoğunluk analizi
NOT: En basit analiz yoğunluk analizidir.- Biyopsiler için slaytın tamamını veya dokunun belirli bir alanını kullanarak tüm hücre tipleri için bir yoğunluk analizi yapın. Örneğin, tümörün merkezindeki CD3+ ve CD8+ T hücrelerinin yoğunluğunu ve tümörün kenar boşluğunu hesaplayın (Şekil 4A-C).
- Bu yoğunlukları hesaplamak için, her hücrenin fenotipi ve koordinatları ile numune başına belirli bir veri çerçevesi üretmek üzere görüntü analiz yazılımı kullanın. R üzerindeki bir kümeleme fonksiyonu (k-en yakın komşu) aracılığıyla, çalışılan biyopsinin sınırlarını kullanarak bir çokgen nesnesi oluşturun ve içindeki ilgilenilen hücre tiplerinin yoğunluğunu hesaplayın.
NOT: Bu, biyolojik hipoteze bağlı olarak farklı koşullar (farklı zaman noktaları, tedavi tipleri, doku tipleri ve tedaviye yanıt gibi) ve lokalizasyonlar (tümörün merkezi, tümörün marjı, stroma fibrozu ve nekroz alanı) arasındaki farklı hücre tiplerinin yoğunluklarını karşılaştırmaya olanak tanır. Kanser hücreleri, peri-tümöral hücreler ve tümör sızan hücreler arasındaki yüksek yakınlık nedeniyle, görüntü analiz yazılımı çift pozitif hücreleri aynı anda bağışıklık ve kanser hücreleri olarak tespit edebilir. Bu durumda, bu çift pozitif hücrelerin ne olduğundan bahsederek bu konuyu biyoinformatik olarak düzeltmek gerekir. Bu durumda, CD3 + CD8 + sitokeratin + hücreleri sitotoksik hücreler olarak etiketlendi, çünkü sitokeratin pozitifliği infiltrasyon yapan lenfositleri çevreleyen tümör hücrelerine bağlıydı.
- Isı haritaları
- Her hücre tipinin yoğunluğunu farklı panellerden kullanarak ve bir normalleştirme uygulayarak (örneğin, ölçekleme merkezleme), numune popülasyonundaki hücre bolluğunu temsil eden ısı haritaları çizin (Şekil 5).
- Hücre yoğunluğuna dayalı hiyerarşik denetimsiz kümeleme kullanılarak, benzer TME kompozisyonlarına sahip hastalar kümelenir ve bu kümeler tedavi yanıtı ve sağkalım gibi klinik parametrelerle ilişkilendirilir.
NOT: Isı haritaları ve kümeleme, R ComplexHeatmap paketi9 ile kolayca gerçekleştirilebilir.
- Uzamsal hücre dağılımı
- Hücreler arasındaki mesafeleri biyoinformatik olarak hesaplayın (örneğin, bağışıklık ve tümöral hücreler; Şekil 6A, B) görüntü analizi tarafından sağlanan hücre koordinatlarına dayanmaktadır. Bir kohortun tüm örneklerinde hücre yakınlığını karşılaştırmak için ilgilenilen hücre tipleri arasındaki medyan ve ortalama mesafeleri kullanın.
- Uzamsal tanımlayıcı işlevler
- X hücresi etrafındaki belirli bir yarıçap içinde en yakın hücreyi (örneğin, bir T hücresi) karşılayan ilgili bir hücrenin, X'in (örneğin, bir tümör hücresi) olasılığını belirlemek için R spatstat paketi10 aracılığıyla kullanılabilen çapraz tip en yakın komşu G-çapraz fonksiyonunu kullanın.
- Tümör hücreleri11 etrafındaki CD3 + T hücrelerinin tümör infiltrasyonunu temsil eden sayısal bir değer elde etmek için ampirik eğrinin altındaki alanı hesaplayın (Şekil 6C). F-fonksiyonu veya J-fonksiyonu12 gibi diğer uzamsal tanımlayıcı işlevleri kullanın.
- İmmünoskor analizi
- Galon 7,8 ekibi tarafından geliştirilen İmmünoskoru (I), tümörün merkezindeki CD3 + ve CD8 + T hücrelerinin yoğunluğunu ve tümörün invaziv marjını kullanarak hesaplayın.
NOT: Puan I0 ile I4 arasında değişir. Merkezdeki CD3 + ve CD8 + T hücrelerinin düşük yoğunluğu ve tümörün marjı I0 skoru ile ilişkilendirilirken, her iki bölgedeki CD3 + ve CD8 + T hücrelerinin yüksek yoğunluğu I4 skoru ile ilişkilidir. Son zamanlarda, İmmünocore'un prognostik etkisi, 13 ülkedeki 14 merkezden 2.681 evre I-III kolon kanseri hastasından alınan örneklerle yapılan bir çalışmada doğrulanmıştır7. Bununla birlikte, hesaplanabilmesi için, Immunoscore, tümörün hem merkezini hem de kenarını içeren cerrahi olarak rezeke edilmiş bir örnek gerektirir. Genellikle bir marjı olmayan biyopsiler için, biyopsiye uyarlanmış bir İmmünoskor yakın zamanda geliştirilmiştir13. - Biyopsiye uyarlanmış İmmünoskoru hesaplamak için, CD3+ ve CD8+ T hücre yoğunluğunun değerini bir yüzdelik dilime dönüştürün ve ardından CD3+ ve CD8+ T hücrelerinin ortalama yüzdelik dilimini kullanarak üç kategoriden birine (yani düşük, orta ve yüksek)13 puanlama yapın.
- Galon 7,8 ekibi tarafından geliştirilen İmmünoskoru (I), tümörün merkezindeki CD3 + ve CD8 + T hücrelerinin yoğunluğunu ve tümörün invaziv marjını kullanarak hesaplayın.
- Hotspot analizi
- Dokunun en çok sızan bölgesindeki farklı hücre tiplerinin yoğunluklarını karşılaştırmak için quadratcount fonksiyonunu (spatstat)10 kullanarak sıcak nokta analizini kullanın. Örneğin, dokunun en çok sızan karelerinin CD3 ve CD8 T hücre yoğunluğunun değerini kullanarak "İmmünoskor benzeri" bir skor hesaplamak mümkündür (Şekil 7). Bu yöntemi, doku boyunca homojen olmayan bir dağılıma sahip herhangi bir hücre tipinin analizi için uygulayın.
- Yoğunluk analizi
Sonuçlar
Bu protokolü takiben, dokunun doğru şekilde boyandığından emin olmak için çeşitli parametreler araştırılmalıdır. İlk olarak, TSA boyaması, tarama işlemi sırasında düşük pozlama süreleri (tipik olarak 2-100 ms) kullanıldığında iyi bir dinamik aralık göstermelidir. Düşük maruz kalma süresi, HRP ile reaksiyon sırasında amplifikasyonun doğru bir şekilde yapıldığı anlamına gelir. Doğrudan florokrom ile birleştirilmiş ikincil antikor ile boyanmış antijenler için, maruz kalma süresi çok daha uzun olabilir, bu da fotobeyazlatmaya neden olabilir (uzun maruz kalma süresi nedeniyle sinyal yoğunluğunda bir azalma). İkincisi, her boyamanın yüksek bir SNR gösterdiğini doğrulamak önemlidir. Düşük antijen sinyaline sahip yüksek bir arka plan sinyali, primer antikorun yeterince spesifik olmadığının, endojen peroksidazların doğru şekilde inaktive edilmediğinin veya protokolün bir adımının yeterince yapılmadığının bir göstergesi olabilir. Üçüncü olarak, slayt tarayıcısına ve tarama için kullanılan filtre setlerine bağlı olarak, iki renk (örneğin, AF555, AF594 ve AF647) arasındaki örtüşmeleri görmek mümkündür. Tarayıcıda doğru filtre setlerinin seçilmesi ve doğru birincil antikor seyreltmesi, olası çapraz algılamaları önlemek için çok önemlidir. Kalite kontrol, taranan dosyadaki her bir işaretleyici için tek lekeli hücrelerin algılanmasından oluşur. Son olarak, her boyama partisi için pozitif ve negatif bir kontrol eklemek de önemlidir. Bağışıklık hücreleri için, bademcik iyi bir pozitif kontroldür. Optimal boyamanın temsili bir sonucu Şekil 1'de gösterilmiştir.
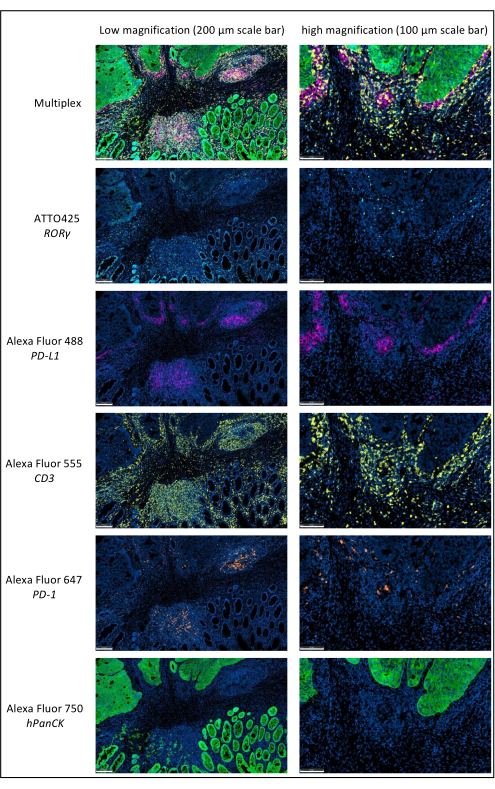
Şekil 1: Multipleks immünofloresan ile boyanmış lokal olarak ilerlemiş rektum kanseri. Kısaltmalar: PD-1 = programlanmış hücre ölüm proteini 1; PD-L1 = Programlanmış ölüm-ligand 1; ROR-γ = RAR ile ilişkili yetim reseptör gama; CD3 = farklılaşma kümesi 3; hPanCK = insan pan-sitokeratin. Her antijen boyama gri tonlamalı olarak taranır ve şekilde sunulan renkler sahte renklerdir. Ölçek çubuğu düşük büyütme: 200 μm; Ölçek çubuğu yüksek büyütme: 100 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
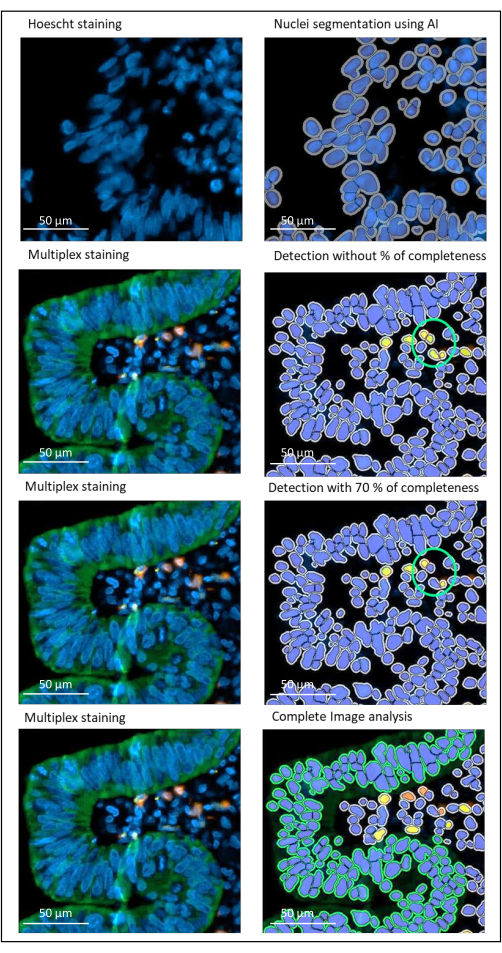
Şekil 2: Bir görüntü analiz yazılımı kullanılarak lokal olarak ilerlemiş bir rektum kanserinin çekirdekleri ve lekelenme tespiti. Tamlık yüzdesi parametresi doğru ayarlanmadan, yazılım birbirine yakın oldukları için iki CD8 + hücresini (yeşil daire) algılar, ancak yalnızca bir hücre boyanır. %70 bütünlük kullanmak, bu yanlış pozitif algılamayı önlemeye yardımcı olur. Yeşil = hPanCK; Sarı = CD3; Turuncu = CD8. Ölçek çubuğu: 100 μm Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
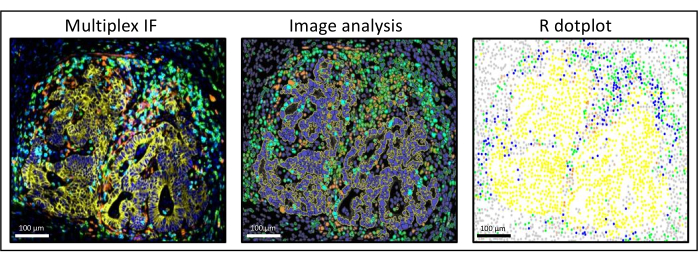
Şekil 3: Görüntü analizi ve karaciğer kolorektal kanser metastazının R nokta grafiği sulandırması. Multipleks boyamada (solda), insan pan-sitokeratini sarı, CD3 yeşil, CD8 açık mavi ve İDO turuncu renktedir. Nokta grafiğinde (sağda), insan pan-sitokeratin + hücreleri sarı, CD3 + CD8 − hücreleri yeşil, CD3 + CD8 + hücreleri mavi ve IDO + hücreleri turuncu renktedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
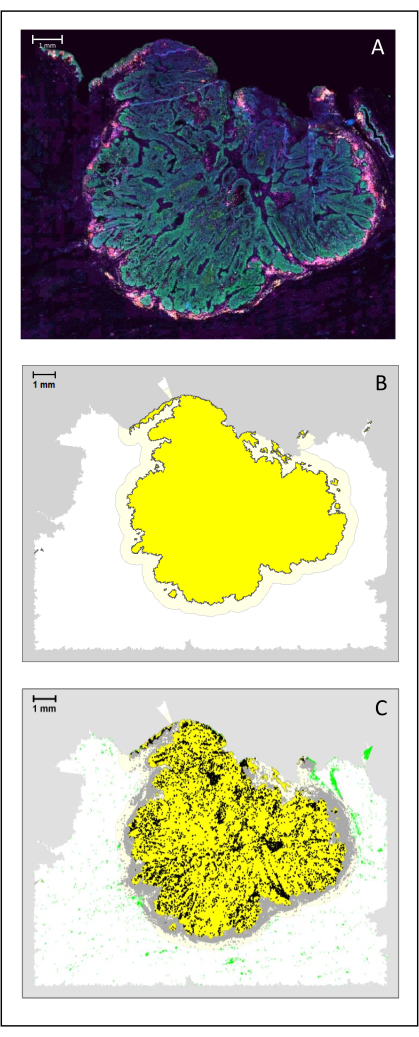
Şekil 4: Bir HNSCC'nin cerrahi bölümünün analizi. (A) Bir HNSCC'nin cerrahi bölümü. Kanser hücreleri yeşil renkte görülebilir. Peri-tümöral hücreler tümör adacıklarının etrafında görselleştirilir (CD3 sarı ve CD8 mor). (B) Tümörün merkezi (siyah kenarlıklı sarı renkte), tümör adaları arasındaki mesafeye dayanan k-en yakın komşu algoritması ile biyoinformatik olarak hesaplanır. Bu alanın etrafında, istilacı bir kenar boşluğu (gri kenarlıklı açık sarı) rastgele 500 μm temelinde hesaplanır. (C) İnvaziv T hücreleri, tümörün merkezinde siyah noktalar ve invaziv sınırda gri noktalarla vurgulanır. Diğer T hücreleri açık yeşil noktalarla vurgulanır. Ölçek çubuğu: 1 mm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
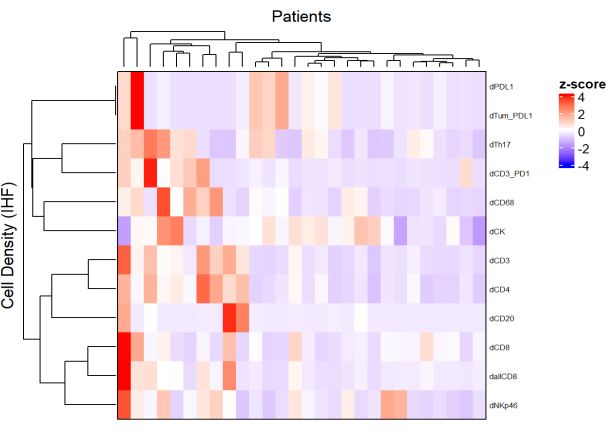
Şekil 5: Lokal olarak ilerlemiş rektum kanseri biyopsilerinin farklı hücre tiplerinin yoğunluğunun ısı haritası. Isı haritası, ComplexHeatmap paketi ile farklı multipleks panellerden farklı hücre tiplerinin yoğunluklarının denetimsiz kümelenmesi kullanılarak çizilmiştir. Normalleştirme için ölçekleme ve merkezleme kullanıldı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
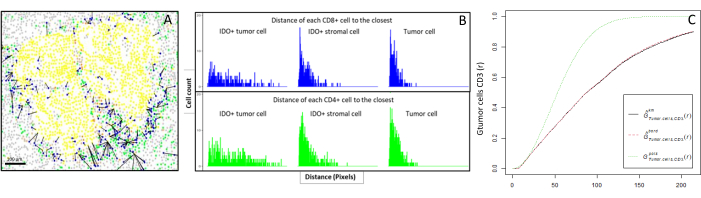
Şekil 6: CD4+ ve CD8+ hücrelerinin her bir IDO+ veya tümöral hücreye uzaklıkları. İnsan pan-sitokeratin+ hücreleri sarı, CD3+CD8− hücreleri yeşil, CD3+CD8+ hücreleri mavi ve IDO+ hücreleri turuncu renktedir. (A) Tümör hücreleri ile her CD8+ T hücresi arasındaki en yakın mesafe. (B) IDO+ hücreleri ile her CD8+ T hücresi (mavi) veya CD4+ T hücresi (yeşil) arasındaki mesafelerin çubukları. (C) G-çapraz fonksiyonu ile analiz edilen bir numune örneği. Y ekseni, bir tümör hücresinin, tümör hücresinin etrafında 0-200 μm arasında değişen bir yarıçap içinde bir CD3 + lenfositle karşılaşma olasılığını gösterir. Üç eğri gösterilir; teorik eğri noktalı yeşil (Poisson dağılımı), km düzeltmeli düzeltilmiş ampirik eğri siyah ve sınır düzeltmeli düzeltilmiş ampirik eğri noktalı kırmızıdır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
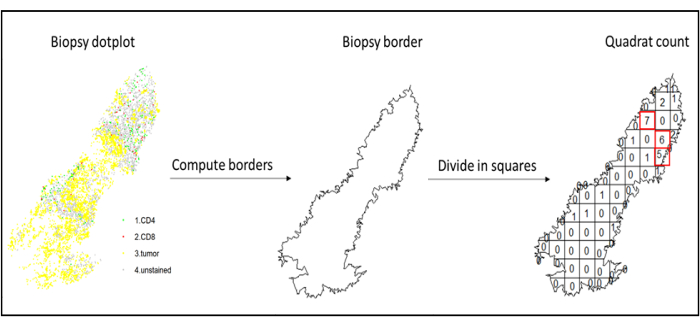
Şekil 7: Quadratcount çizimi. Sınır hesaplaması ve quadratcount, spatstats paketi kullanılarak gerçekleştirildi. En çok sızılan kareler (etkin noktalar) aşağı akış istatistikleri için kullanılabilir. CD4 yeşil, CD8 kırmızı ve tümör hücreleri sarı renktedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
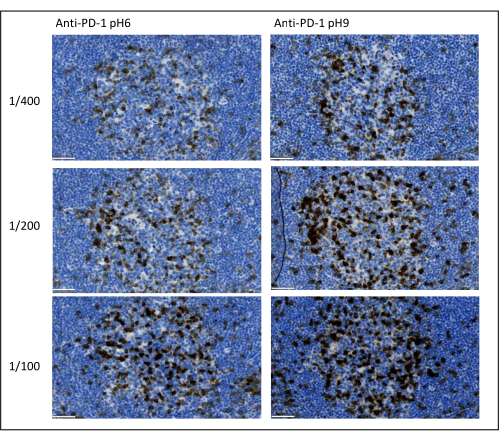
Şekil 8: Antikor seyreltme ve antijen geri kazanımı optimizasyonu. PD-1'in üç farklı seyreltme ve birincil antikorun iki farklı antijen geri kazanım çözeltisi (Sitrat pH 6 ve EDTA pH 9) kullanılarak kromojenik tespiti. Ölçek çubuğu: 50 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Primer antikor | Seyreltme | Antijen geri kazanımı | Sekonder antikor | Florokrom | Konum |
| PD-1 | 1/100 | EDTA (pH 9) | Anti-tavşan | AF647 | 1 |
| PD-L1 | 1/1000 | EDTA (pH 9) | Anti-tavşan | AF488 | 2 |
| ROR-γ | 1/200 | EDTA (pH 9) | Fare önleme | ATT0-425 | 3 |
| CD3 | 1/100 | Sitrat (pH 6) | Anti-tavşan | AF555 | 4 |
| hPanCK | 1/50 | Sitrat (pH 6) | AF750 ile birleştirilmiş fare koruması | 5 | |
Tablo 1: Optimize edilmiş bir multipleks panel örneği. Kısaltmalar: PD-1 = programlanmış hücre ölüm proteini 1; PD-L1 = Programlanmış ölüm-ligand 1; ROR-γ = RAR ile ilişkili yetim reseptör gama; CD3 = farklılaşma kümesi 3; hPanCK = insan pan-sitokeratin; AF = AlexaFluor; EDTA = etilendiamintetraasetik asit. CD3, T lenfositlerini tespit etmek için kullanılır; PD-1, tükenmiş lenfositleri tespit etmek için kullanılır; ROR-γ, Th-17'yi tespit etmek için kullanılır; ve hPanCK tümör hücrelerini tespit etmek için kullanılır. Konum sütunu, sıralı multipleksin gerçekleştirilmesi gereken sırayı gösterir.
Tartışmalar
Multipleks boyamayı optimize etmek için dikkate alınması gereken en önemli parametreler, her bir primer antikor için kullanılan seyreltme, özgüllük ve antijen geri kazanımıdır. Bir multipleks protokolüne başlamadan önce, her bir primer antikorun optimal seyreltmesi ve optimal epitop geri kazanımı (pH 6 veya pH 9), kromojenik boyama (DAB) kullanılarak test edilmelidir. Her antijen geri kazanım tamponu için üç seyreltmenin test edilmesini öneririz: genellikle antikoru ticarileştiren marka tarafından belirtilen seyreltme, aynı seyreltme iki kata bölünür ve aynı seyreltme iki kat çarpılır (Şekil 8). Doğru seyreltmeyi seçmek, antikor özgüllüğünü doğrulamak ve boyamanın sinyal-gürültü oranını (SNR) optimize etmek için çok önemli bir adımdır. DAB'da doğru seyreltmeyi seçtikten sonra, uniplex TSA kullanılarak her birincil antikor için aynı seyreltme test edilmelidir. Her antijen boyaması için seyreltme ve epitop geri alma tamponu seçildikten sonra, multipleks dizisinin doğru şekilde ayarlanması da önemlidir; Spesifik olarak, bazı antijenler ilk pozisyonda ve diğerleri son pozisyonda daha iyi boyanır. Hangi antijen boyamasının birinci, ikinci vb. gelmesi gerektiğini seçmek için multipleks etiketlemeyi olası tüm sipariş permütasyonlarını kullanarak test etmenizi öneririz. Bu aynı zamanda çok önemli bir adımdır, çünkü bazı kırılgan antijenler birkaç tur epitop alımından sonra parçalanabilir ve bazı antijenler birkaç tur epitop alımından sonra daha iyi boyanır. Örneğin, SNR CD3 için son konumda ve PD-1 boyama için ilk konumda her zaman daha yüksektir. Ayrıca, birkaç ko-lokalize antijenin boyanması, bir şemsiye etkisi (tiramid reaktif bölgelerinin doygunluğu) ile engellenebilir. Bu, tiramid konsantrasyonunu azaltarak zayıflatılabilir. Bir antijenin ekspresyonu diğerinin ekspresyonu ile şartlandırıldığında (CD8 sadece CD3 eksprese eden T hücrelerinde bulunur), antijenin diğerinden sonra en geniş ekspresyonla (bu durumda CD3) boyanmasını öneririz. Son olarak, tarayıcı özelliklerine göre her antijen boyaması için doğru florokromun seçilmesi de çapraz tespiti önlemek için önemli bir adımdır.
Bu tekniğin en büyük avantajları, amplifikasyon ve elde edilen sinyal-gürültü oranıdır. Bununla birlikte, bu teknik, boyamanın sıralı olması ve florokromların dokuya kovalent olarak bağlanması olan bir sınırlama ile birlikte gelir. Bununla birlikte, tüm tiramid sinyal amplifikasyon turlarını gerçekleştirdikten sonra, doğrudan bir florokrom (TSA yok) ile birleştirilmiş ikincil bir antikor ile son bir boyama eklemek de mümkündür. Bazı panellerde, 750 kanalına boyama eklemek için bu yöntemi kullandık. Bu gerekliydi çünkü o zamanlar ticari olarak hiçbir tiramid-AF750 mevcut değildi. AF750 ile boyanmış antijenin maruz kalma süresi (tarama sırasında), TSA ile boyanmış diğer antijenlerden çok daha uzun olacaktır. Bu durumda, sitokeratin gibi yüksek oranda eksprese edilen bir proteinin boyanmasını veya birincil antikorun konsantrasyonunun arttırılmasını öneririz. Bunu yaparak, floresan tarayıcıya bağlı olarak bir partide slayt başına maksimum beş ila altı antijeni boyamak mümkündür.
Buna karşılık, ticari olarak temin edilebilen birkaç teknik, tek bir doku bölümünde boyanabilecek antijen sayısını artırmak için birkaç tur boyama, tarama ve sıyırma veya fotobeyazlatma ile seri boyama kullanır. Bununla birlikte, bu teknikler genellikle zaman alıcıdır, pahalıdır, sinyal amplifikasyonu yoktur, seri taramaları doğru bir şekilde birleştirmek için gelişmiş hesaplama adımları gerektirir ve deneyimlerimize göre, sayısız prosedür adımı nedeniyle geri dönüşümsüz doku hasarına neden olabilir. Bununla birlikte, bu yöntem kullanılarak tek bir doku üzerinde 30'a kadar antijenin boyanabileceği bildirilmiştir14.
Sonuç olarak, yöntemimiz floresan slayt tarayıcısına sahip herhangi bir laboratuvarda kullanılabilecek sağlam, tekrarlanabilir, kullanımı kolay ve uygun maliyetli bir immünohistofloresan tekniğidir. IHC için uygun herhangi bir ticarileştirilmiş birincil antikor kullanılabilir ve paneller herhangi bir ticari kitlere özgü değildir. Görüntü analizi, QuPath ve R gibi açık kaynaklı programlar da dahil olmak üzere birkaç farklı programda yapılabilir. Bununla birlikte, bu yöntemin gelecekte büyük antijen panelleri için bile geliştirilebileceğini düşünüyoruz, bu da aynı slaydın farklı antijen panelleriyle seri boyanmasına / taranmasına ve sinyal amplifikasyonunun avantajıyla yapılmasına izin veriyor.
Açıklamalar
Yazarların beyan edecekleri çıkar çatışmaları yoktur.
Teşekkürler
Yazarlar, yardım ve desteği için Dr. Derouane F'ye teşekkür eder. Nicolas Huyghe, Belçika Ulusal Bilimsel Araştırma Fonu'ndan (Télévie/FNRS 7460918F) hibe ile desteklenen bir araştırma görevlisidir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| anti-CD3 primary antibody | Abcam | ab16669 | rabbit monocolonal |
| anti-CD8 primary antibody | DAKO | M710301 | mouse monoclonal |
| anti-hPanCK primary antibody | DAKO | M3515 | mouse monoclonal |
| anti-PD-1 primary antibody | Cell Signalling | D4W2J | rabbit monocolonal |
| anti-PD-L1 primary antibody | Cell Signalling | 13684 | rabbit monocolonal |
| anti-RORC primary antibody | Sigma | MABF81 | mouse monoclonal |
| ATTO-425 | ATTOtec | ||
| Axioscan Z1 | Zeiss | Light source: Colibri 7 (385, 430, 475, 555, 590, 630, 735 nm) Filtersets: Excitation 379/34 – beam splitter 409 – emission 440/40; Excitation 438/24 – beam splitter 458 – emission 483/32; Excitation 490/20 – beam splitter 505 – emission 525/20; Excitation 546/10 – beam splitter 556 – emission 572/23; Excitation 592/21 – beam splitter 610 – emission 630/30; Excitation 635/18 – beam splitter 652 – emission 680/42; Excitation 735/40 – beam splitter QBS 405 + 493 + 611 + 762 - emission QBP 425/30 + 524/51 + 634/38 + 785/38; Objective: Plan-Apochromat 20x/0.8; Camera : Orca Flash 4.0 V3 | |
| Borosilicate Cover Glass | VWR | 631-0146 | |
| Envision+ anti-mouse | DAKO | K4001 | |
| Envision+ anti-rabbit | DAKO | K4003 | |
| Fluorescence mounting medium | DAKO | S3023 | |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 750 | ThermoFischer | A-21037 | |
| HALO software | Indicalabs | ||
| Hoescht | Sigma | 14533 | |
| Superfrost plus microscope slides | Fisherscientific/Epredia | 10149870 | |
| Tyramide-AF488 | ThermoFischer | B40953 | |
| Tyramide-AF555 | ThermoFischer | B04955 | |
| Tyramide-AF647 | ThermoFischer | B04958 |
Referanslar
- Ge, P., et al. Profiles of immune cell infiltration and immune-related genes in the tumor microenvironment of colorectal cancer. Biomedicine & Pharmacotherapy. 118, 109228(2019).
- Fridman, W. H. The immune microenvironment as a guide for cancer therapies. Oncoimmunology. 1 (3), 261-262 (2012).
- Fridman, W. H., Pages, F., Sautes-Fridman, C., Galon, J. The immune contexture in human tumours: Impact on clinical outcome. in Nature Reviews. Cancer. 12 (4), 298-306 (2012).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Calu, V., et al. Key biomarkers within the colorectal cancer related inflammatory microenvironment. Scientific Reports. 11 (1), 7940(2021).
- Havel, J. J., Chowell, D., Chan, T. A. The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nature Reviews. Cancer. 19 (3), 133-150 (2019).
- Pages, F., et al. International validation of the consensus Immunoscore for the classification of colon cancer: a prognostic and accuracy study. Lancet. 391 (10135), 2128-2139 (2018).
- Mlecnik, B., et al. Integrative analyses of colorectal cancer show immunoscore is a stronger predictor of patient survival than microsatellite instability. Immunity. 44 (3), 698-711 (2016).
- Gu, Z., Eils, R., Schlesner, M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data. Bioinformatics. 32 (18), 2847-2849 (2016).
- Baddeley, A., Rubak, E., Turner, R. Spatial Point Patterns: Methodology and Applications with R. , CRC Press. Boca Raton, FL. (2022).
- Barua, S., et al. Spatial interaction of tumor cells and regulatory T cells correlates with survival in non-small cell lung cancer. Lung Cancer. 117, 73-79 (2018).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340(2021).
- El Sissy, C., et al. A diagnostic biopsy-adapted immunoscore predicts response to neoadjuvant treatment and selects patients with rectal cancer eligible for a watch-and-wait strategy. Clinical Cancer Research. 26 (19), 5198-5207 (2020).
- Bolognesi, M. M., et al. Multiplex staining by sequential immunostaining and antibody removal on routine tissue sections. The Journal of Histochemistry and Cytochemistry. 65 (8), 431-444 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır