Method Article
大鼠肠道类器官的产生和操作
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种产生大鼠肠道类器官并将其用于几种下游应用的方案。大鼠通常是首选的临床前模型,强大的肠道类器官系统满足了对 体外 系统伴随 体内 研究的需求。
摘要
当使用类器官评估生理学和细胞命运决策时,使用一个紧密概括 体内 环境的模型是很重要的。因此,患者来源的类器官被用于疾病建模、药物发现和个性化治疗筛选。小鼠肠道类器官通常用于了解肠道功能/生理学和干细胞动力学/命运决定的各个方面。然而,在许多疾病背景下,大鼠通常比小鼠更受欢迎,因为它们在疾病病理生理学方面与人类的生理相似性更高。由于 缺乏体内可用的遗传工具,大鼠肠道类器官已被证明是脆弱的,难以长期培养。在这里,我们建立在先前发表的方案的基础上,从十二指肠和空肠稳健地产生大鼠肠道类器官。我们概述了利用大鼠肠道类器官的几种下游应用,包括功能性肿胀测定、全贴片染色、2D 肠样单层的生成和慢病毒转导。大鼠类器官模型为 该领域对体外 模型的需求提供了一种实用的解决方案,该模型保留了与人类的生理相关性,可以快速进行基因操纵,并且很容易获得,而没有获取人类肠道类器官所涉及的障碍。
引言
人体小肠上皮结构和细胞组成复杂,反映了它们的生理功能。小肠的主要作用是从通过其管腔的食物中吸收营养1.为了最大限度地发挥这一功能,肠道表面被组织成称为绒毛的手指状突起,其增加了吸收表面积,以及称为隐窝的杯状内陷,用于容纳和绝缘干细胞。在上皮细胞内,产生各种专门的吸收和分泌细胞类型以执行不同的功能1.由于这种复杂性,很难在高传代转化永生化细胞系中对肠道等组织进行建模。然而,对干细胞,特别是成体干细胞及其分化机制的研究,已经允许开发 3D 肠道类器官培养物。类器官模型的使用改变了该领域,部分原因是它们概括了完整肠道中发现的一些结构成分和细胞类型异质性。肠道类器官可以长期在 体外 培养,因为活性干细胞群的维持2。
肠道类器官已迅速成为研究干细胞生物学、细胞生理学、遗传疾病和营养学的适应性模型3,4,以及开发新型药物递送方法的工具5。此外,患者来源的类器官被用于疾病建模、药物发现和个性化治疗筛选等 6,7,8,9。然而,人类肠道类器官仍然存在挑战。组织可用性、机构审查委员会批准的要求和伦理问题限制了人类样本的广泛使用。此外,由肠隐窝产生的人肠道类器官需要两种不同的培养条件来维持未分化的干细胞或诱导成熟细胞类型的分化10。这与体内形成鲜明对比,在体内,干细胞和成熟分化的细胞类型同时存在并持续产生/维持1。另一方面,小鼠肠道类器官在不太复杂的生长因子混合物中生长,不需要培养基成分的这种转换,并且可以在相同的培养基环境中维持干细胞和分化细胞2,11。然而,与人类相比,小鼠肠道的关键差异可能使小鼠类器官在许多情况下成为次优模型。总体而言,许多来自大型哺乳动物(包括马、猪、绵羊、牛、狗和猫)的肠道类器官已在与小鼠肠道类器官更接近的培养条件下成功生成,而不是人类肠道类器官的培养条件12。小鼠和人类类器官之间生长因子条件的差异可能反映了干细胞生态位组成的差异以及对干细胞存活、增殖和维持的不同要求。因此,需要一种易于访问的模型类器官系统,该系统 1) 与人类肠道细胞组成非常相似,2) 包含具有与人类肠道类器官相似的生长因子要求的干细胞,以及 3) 能够持续维持未分化和分化的区室。理想情况下,该系统将来自常用的临床前动物模型,以便体内和体外实验可以相互关联并协同使用。
大鼠是肠道生理学和药理学研究的常用临床前模型,因为它们的肠道生理学和生物化学与人类非常相似13,特别是在肠道通透性方面14。与小鼠相比,它们的体型相对较大,使它们更适合外科手术。虽然有时会使用包括猪在内的大型动物模型,但大鼠是一种更实惠的模型,需要更少的饲养空间,并且具有现成的市售标准品系15。使用大鼠模型的一个缺点是,与小鼠相比,用于体内研究的遗传工具包没有得到很好的开发,并且产生新的大鼠系,包括敲除、敲入和转基因,通常成本过高。强大的大鼠肠道类器官模型的开发和优化将允许在一个可访问的模型中进行基因操作、药物治疗和更高的通量研究,该模型保留了与人类的关键生理相关性。然而,一种啮齿类器官模型相对于另一种啮齿类器官模型的优势高度依赖于所研究的特定过程或基因;在人类中发现的某些基因可能是小鼠的假基因,但不是大鼠的假基因16,17。此外,单细胞RNAseq18,19,20越来越多地揭示了物种特异性细胞亚型。最后,大鼠和小鼠肠道疾病模型通常在表型21,22上显示出相当大的差异,因此必须选择更接近人类症状和疾病过程的模型进行下游工作。大鼠肠道类器官模型的生成为研究人员提供了额外的灵活性和选择,以选择最适合其情况的模型系统。在这里,现有的方案23,24被扩展为产生大鼠肠道类器官,并概述了从十二指肠或空肠产生和维持大鼠肠道类器官的方案。此外,还描述了几种下游应用,包括慢病毒感染、全贴片染色和毛喉素肿胀测定。
研究方案
注意:所有细胞培养物都应在组织培养罩中使用适当的无菌技术进行处理。本研究中的所有动物工作均已获得耶鲁大学机构动物护理和使用委员会 (IACUC) 的批准。
1.细胞培养试剂的制备
- 按照制造商的说明准备 R-spondin 1 条件培养基。按照制造商的说明准备 Wnt3a 条件培养基。如 表 1 所述准备 AdDMEM+。
- 将胃泌素重悬于无菌dH2O中以制备100μM原液。分装并储存在-80°C。 将N-乙酰半胱氨酸重悬于无菌水中,制备100mM原液。分装并在-20°C下储存长达1个月。
- 将重组人Noggin重悬于磷酸盐缓冲盐水(PBS)+ 0.1%牛血清白蛋白(BSA)中,以制备250μg/ mL储备液。分装并储存在-80°C。 将重组小鼠表皮生长因子 (EGF) 重悬于 PBS + 0.1% BSA 中以制备 100 μg/mL 原液。分装并储存在-80°C。
- 在 PBS + 0.1% BSA 中稀释重组人 IGF-1 以制备 100 μg/mL 储备液。分装并储存在-80°C。 将重组人 FGF-2 重悬于 5 mM Tris(pH 7.6)中,以制备 100 μg/mL 储备液。分装并储存在-80°C。
注意:对于所有生长因子,在PBS + 0.1%BSA中使用中间稀释液至培养基中最终浓度的100倍。储存在-20°C。
2. 大鼠小肠类器官的建立
注:该方案是从先前发表的两个大鼠肠道类器官方案23,24修改而来的。
- 根据 表2 制备大鼠肠道类器官培养基(rIOM),并将水浴设置为37°C。 该完全培养基在4°C下可稳定保存5天。
- 在 15 mL 锥形管中制备 10 mL 3 mM 乙二胺四乙酸 (EDTA) 的 PBS 溶液,并保持在冰上。在冰上解冻 250 μL 细胞外基质提取物 (EME)。
- 禁食一只老鼠过夜 ,随意 喝水。根据IACUC批准的方案对大鼠实施安乐死。在该方案中,成年雄性Sprague Dawley大鼠(体重~200g) 通过 CO2 吸入(材料表)实施安乐死。宫颈脱位被用作安乐死的次要方法。
- 使用无菌高压灭菌的镊子和解剖剪刀进行解剖。将安乐死的大鼠放在腹侧的解剖面上。用镊子捏住皮肤层;以下切口应在表面进行,因此它们只能切开该皮肤层,而不足以损坏内脏器官。
- 要打开腹腔,使用大而锋利的解剖剪刀,在腹部中央切开一个大的、纵向的、表面水平的切口,穿过皮肤层。接下来,从该切口开始,进行两个较短的水平切口,每侧一个。用镊子将皮肤剥离,露出腹腔。切开腹膜,使腹腔内的内脏器官完全暴露,并随时进入肠道。
- 使用剪刀和镊子,找到胃并识别其远端约 2-3 厘米处的十二指肠,该十二指肠呈淡黄色部分。空肠近端位于 Treitz 韧带远端约 4-5 cm,是十二指肠和空肠之间的标志。
- 将分离的肠碎片放入10厘米的培养皿中。尽可能清洁所需的肠系膜肠段。用 10 mL 冰冷的 PBS 冲洗,直至清除管腔内容物。在纸巾上,将肠段切成~2厘米长的块。纵向打开每个肠块,露出上皮。
- 使用玻璃显微镜载玻片,刮擦暴露的管腔表面以去除绒毛。将肠块放入冰上准备好的EDTA溶液中。在设置为10rpm的管状左轮手枪上在4°C下旋转30分钟。
- 在解剖显微镜下,将锥形管的内容物倒入10cm培养皿中。再加入 ~5 mL 冰冷的 PBS。
- 使用细镊子,握住肠段并用力摇晃。将有可能看到上皮释放到 PBS 中。首先,PBS将主要包含绒毛。
- 继续摇晃。定期丢弃含有绒毛的PBS,并向肠道碎片中加入10mL新鲜冰冷的PBS。继续摇晃碎片并重复此洗涤步骤,直到绒毛不再释放到PBS中,而是PBS主要含有隐窝。隐窝分离不要超过15分钟,以免影响细胞活力。
- 丢弃剩余的肠道碎片。富集培养皿中剩余的PBS,用于肠隐窝。在组织培养罩中,收集含有PBS的隐窝并通过70μm细胞过滤器过滤(材料表)。
- 以250× g 离心5分钟。除去上清液,将沉淀重悬于 5 mL AdDMEM+ 中。再次以250× g 离心5分钟。
注意: 建议使用带有摆动桶转子的离心机。 - 除去上清液,留下 ~50 μL 带有沉淀的培养基。将沉淀重悬于剩余的培养基中,并加入冰上EME的等分试样中。轻轻地上下移液,以在整个EME中均匀地悬挂隐窝。避免引入气泡。
- 将50μLEME圆顶接种到35mm组织培养皿中,并在37°C,5%CO2 组织培养箱中孵育20分钟。
- 加入含有10μM Y27632和10μM CHIR99021(表3)的2mL rIOM(表2)。传代后,可以停用Y27632和CHIR99021。
- 每 2-3 天更换一次 rIOM。根据需要传代,通常在 3-7 天之间,具体取决于类器官的初始数量、大小和生长速度。
3. 传代大鼠肠道类器官
- 在冰上解冻250μL等分试样的EME,并将rIOM预热至37°C。
- 从含有类器官的 35 mm 板中吸出培养基,并加入 1 mL 解离试剂,立即从 EME 圆顶中释放类器官。
- 立即将含有片段化类器官的解离试剂转移到 15 mL 锥形管中。用 2 mL AdDMEM+ 洗涤培养板,并加入到含有片段化类器官的 15 mL 锥形管中。
- 用玻璃巴斯德移液管,轻轻上下移液 15-20 次以碎裂类器官。以350× g 离心2分钟。
- 将 ~50 μL 溶液从锥形管底部加入 EME。轻轻上下移液以混合。避免制造气泡。
- 将 50 μL EME 圆顶接种到 35 mm 培养皿中,并在 37 °C、5% CO2 组织培养箱中孵育 20 分钟。
- 加入含有 10 μM Y27632 和 10 μM CHIR99021 的 2 mL rIOM。每 2-3 天更换一次生长培养基。更换介质时,可以省略 Y27632 和 CHIR99021。
4. 大鼠肠道类器官的冷冻保存和解冻
- 冷冻保存大鼠肠道类器官
注:冻存方案是从之前针对人类和小鼠类器官的方案修改而来的 25.在冷冻之前,类器官在原代培养中必须至少有两次传代。建议在冷冻保存之前将类器官培养到大球状体或略微出芽的类器官,因为这将导致解冻后活类器官的产量更高。这可以通过将R-spondin条件培养基增加到15%和/或通过向类器官培养物中加入10mM烟酰胺(表3)来实现。- 使用显微镜,计算35毫米培养皿上的类器官数量。标记冷冻管,使每个冷冻管中等分 200 个类器官。
- 从 35 毫米培养皿中取出 rIOM。用 2 mL 冷组织培养级 PBS 代替。
- 使用 P1000 吸头,通过上下移液将 EME 圆顶从培养皿底部释放到 PBS 中。继续上下移液 ~20 次以分解 EME 并释放类器官。将类器官和 PBS 收集到 15 mL 锥形管中。
- 将 2 mL 冷 PBS 加入培养皿中,上下移液以将任何剩余的类器官释放到 PBS 中。将 PBS 转移到 15 mL 锥形管中。
- 通过以290× g 离心5分钟来沉淀类器官。在不破坏类器官沉淀的情况下取出并丢弃上清液。
- 通过在 5 mL 冷的 AdDMEM+ 中轻轻重悬来洗涤沉淀。以200× g 离心4分钟。小心地取出并丢弃上清液。
- 将类器官沉淀重悬于每 200 个类器官的 1 mL 冷冷冻培养基中。将 1 mL 类器官分装在每个标记的冻存管的冷冻培养基中。将冷冻管放入冷冻容器中。
- 将类器官储存在-80°C的冷冻容器中24小时,然后将冷冻管转移到液氮中长期储存。
- 解冻大鼠肠道类器官
注:该方案是从先前用于解冻人和小鼠肠道类器官的方案修改而来的26。- 在冰上解冻 250 μL 等分试样的 EME。制备补充有 15% R-spondin 条件培养基、10 μM Y27632 和 10 μM CHIR99021的 rIOM。在37°C下加热。
- 在室温下将 2 mL 解冻培养基(表 3)加入 15 mL 锥形管中。
- 通过将小瓶置于37°C水浴中,直到小瓶几乎完全解冻,从液氮中取出并解冻一小瓶类器官。
- 向小瓶中加入 1 mL 解冻培养基,并将所有内容物转移到含有解冻培养基的锥形管中。用 1 mL 解冻培养基洗涤小瓶两次,然后转移到锥形管中。
- 以200× g 离心5分钟。吸出培养基,留下 ~50 μL 含有类器官的培养基。将含有类器官的培养基转移到 250 μL 的 EME 中。
- 通过上下移液将类器官均匀分布在EME中,避免气泡。将 6 个 50 μL 圆顶移液到 35 mm 组织培养皿中。
- 在组织培养箱中孵育15-20分钟,使EME聚合。将 2 mL 准备好的 rIOM 加入培养皿中。
- 2 天后,将介质更换为 rIOM。Y27632和CHIR99021可以暂停使用。类器官在解冻后的第一次传代中生长可能缓慢。建议在开始实验之前在解冻后通过类器官两次。
5. 从3D类器官生成大鼠肠道2D单层
注:以下方案描述了产生涂有EME的48孔板的24孔所需的体积,从六个50μL(35mm培养皿)的圆顶开始,其中包含~300个肠类器官/圆顶(规模:一个圆顶产生四个孔),但可以根据需要放大或缩小。如上所述,该协议在 4-5 天内达到 ~80% 的汇合度。在更高的汇合度下,细胞再次开始获得 3D 类器官结构。在低汇合度(≤40%)下,细胞保持单层状态,存活~14天。如果研究的目的是使用 2D 单层,请按比例缩小,使一个圆顶产生 8 个 24 孔板的孔。孔中也可以涂有胶原蛋白I以形成单层。
- 涂层表面的准备
- 要用EME涂覆板,请在冷AdDMEM +中按1:20稀释EME(表1)。对于胶原蛋白包衣,请根据制造商的说明准备胶原蛋白 I。将 AdDMEM+ 中的 5 mg/mL 胶原蛋白 I 稀释至 100 μg/mL(本例中为 1:50)。
- 用 200 μL 稀释的 EME 或胶原蛋白涂覆板以完全覆盖孔表面。在37°C下在组织培养箱中孵育1-2小时。如 表4所述制备大鼠肠道类器官培养基用于2D单层培养(rIOM2D)。
- 单层的生成
- 从含有类器官的 35 mm 板中吸出培养基。加入 1 mL PBS。
- 用 P1000 吸头划伤孔中的 EME。上下移液器约 20 次以松开所有 EME。将所有东西转移到 15 mL 锥形管中。
- 向 35 mm 板中加入 1 mL PBS 以回收任何其他类器官并转移到相同的 15 mL 锥形管中。
- 以350× g 离心2分钟并吸出上清液,包括EME残留物。向类器官沉淀中加入1mL胰蛋白酶溶液,并在37°C下孵育2分钟。
- 使用 P1000 吸头上下移液 10 次,并加入 2 mL AdDMEM+ 以中和胰蛋白酶。
- 以350× g 离心5分钟。吸出上清液并加入4.8mL rIOM2D(表4)。重悬细胞沉淀。
- 在放置类器官之前,从孔中取出 AdDMEM+ 中多余的 EME 或胶原蛋白。然后,在每个预包被孔中加入 200 μL rIOM2D 中的类器官和 10 μM Y27632。
- 4-16小时后,收集培养基并以1,000× g 离心1分钟。将上清液转移到新的 15 mL 锥形管中,弃去沉淀。
- 用 300 μL PBS 洗涤每个孔,并向每个孔中加入 200 μL 离心的 rIOM2D。每 2-3 天更换一次 rIOM2D,暂停使用 Y27632。
- 从 2D 单层重整 3D 类器官
注意:在EME上生长的单层可以被诱导重组3D类器官,而在胶原蛋白I上生长的单层不能有效地返回到3D类器官。通常,在第 5 天,可以使用 2-3 个由单层生成的类器官孔来制作一个 50 μL EME 的圆顶。- 在 rIOM2D 中以 1:4 稀释 EME。当单层达到~80%汇合度时,小心地吸出培养基,并将100μL稀释的EME加入含有单层的孔中。
- 在37°C,5%CO2 在组织培养箱中孵育20分钟。之后,加入 100 μL rIOM2D 并返回组织培养箱。3D 类器官将在添加稀释的 EME 后 5 天内生成。
- 小类器官重组后(~第 5 天),制备 rIOM。收集所有孔内容物,上下移液以破坏 EME,然后转移到 15 mL 锥形管中。
- 以350× g 离心2分钟。吸出上清液和EME残留物。
- 加入 1 mL 冷 AdDMEM+ 并以 350 x g 离心 2 分钟。除去上清液,留下~50μL培养基。
- 将 50 μL 培养基和类器官转移到 250 μL EME 等分试样中。上下移液器以将类器官分布在整个 EME 中。
- 将 50 μL EME 圆顶移液到 35 mm 培养皿中,并在组织培养箱中孵育 20 分钟。
- 加入 2 mL rIOM 加 10 μM Y27632。每 2-3 天更换一次生长培养基。更换介质时,可以省略 Y27632。
6. 基因操作
- 瞬时转染 2D 单层
注意:按照第 5.1 节在 48 孔板中制备大鼠肠上皮单层。转染必须以 70%-80% 的汇合度进行。转染前,务必用 200 μL 新鲜 rIOM2D 替换孔中的培养基。计算质粒DNA的260/280nm和260/230nm吸光度比;这些值必须高于 1.8 才能确保良好的转染结果。
注:使用质粒对照计算转染效率。为方便起见,建议使用编码荧光蛋白的质粒。在该协议中,使用pLJM1-EGFP27 。- 制备 1 mg/mL 的 20 kDa 聚乙烯亚胺 (PEI; 表3)。对于每个孔,准备管A(0.6μg质粒+ 50μL还原血清培养基)和管B(1.8μLPEI + 50μL还原血清培养基)。保持 DNA:PEI 比例为 1:3。
- 涡旋两个管30秒。将管A和管B合并,再次涡旋30秒。如有必要,使用离心机降速。在室温下孵育20分钟。
- 轻轻地将DNA/PEI复合物逐滴添加到2D单层中。轻轻旋转盘子进行混合。在37°C,5%CO2下孵育。通常可以在24小时后检测到表达。
注意:如果需要返回 3D 类器官结构,请在转染后等待 48 小时以添加稀释的 EME。
- 大鼠肠道类器官的慢病毒转导
注意:在使用慢病毒之前,请从该机构获得适当的授权和专业培训。处理慢病毒时,务必穿戴适当的个人防护装备 (PPE)。虽然这里没有概述,但高质量、浓缩的慢病毒对于类器官的成功感染至关重要。该协议使用空的pLJM1-EGFP载体27 表达可溶性GFP。该协议是从先前发布的协议修改而来的28.转导效率取决于病毒颗粒的质量和浓度、类器官解离成小细胞簇的有效程度以及表达的基因。在感染后 5 天计算时,选择前的平均转导效率为 19.4%(± 6.5% 标准差)。- 在慢病毒感染前 2 天,计划为将要转导的每种慢病毒传代(第 3 节)两个 24 孔板的致密孔。24 孔板的每个孔可容纳一个 50 μL 圆顶 EME。
- EME 凝固后,加入补充有 10 mM 烟酰胺、10 μM Y27632 和 2.5 μM CHIR99021的 0.5 mL rIOM。这诱导了大的球状体形态,这有利于慢病毒转导的效率。在接种后 2 天内,大鼠类器官应为大球状体。如果观察到明显的分化(即出芽),则重新传代类器官。
- 将浓缩的病毒在冰上解冻。根据 表3制备新鲜的转导培养基。
- 使用 P1000 吸头,通过上下移液将 EME 圆顶从细胞培养皿底部释放到培养基中。继续上下移液 20 次以分解 EME 并释放类器官。
- 将类器官和培养基移液到 15 mL 锥形管中。所有孔都可以汇集在一起,前提是类器官具有相同的基因型并且来自同一系。
- 用 1 mL 冷 AdDMEM+ 洗涤每个孔两次。收集 AdDMEM+ 并将其转移到同一个 15 mL 锥形管中。
- 使用玻璃巴斯德移液管,机械地破坏大鼠类器官。这是关键的一步,因为目标是小型的多细胞细胞簇。上下移液~30次。使用4倍物镜在显微镜下检查破坏的效率。继续这个过程,直到细胞悬液主要由细胞簇组成,只剩下很少的类器官。
注:或者,类器官可以在室温下以200× g 离心5分钟,小心地除去上清液,并重悬于1mL重组酶中,替代常规胰蛋白酶/ EDTA,在组织培养箱中预热至37°C。将类器官在胰蛋白酶替代物中在37°C水浴中孵育2分钟,定期涡旋以促进解离。避免与胰蛋白酶替代物长时间孵育,因为这会促进细胞死亡。定期使用4倍物镜在显微镜下检查破坏效率。当悬浮液主要由单细胞组成,细胞培养物很少时,通过加入 4 mL AdDMEM+ 稀释胰蛋白酶替代物,然后继续执行以下步骤。 - 在4°C下以200× g 旋转含有细胞簇的15mL锥形管5分钟。 小心地取出并丢弃上清液,注意不要干扰细胞沉淀。
- 将细胞簇重悬于每孔 230 μL 要感染的转导培养基中。对于感染,对每个慢病毒使用一个 48 孔板孔。
- 将 230 μL 细胞悬液接种到标记的 48 孔板的每个孔中。向每个孔中加入 20 μL 浓缩病毒。使用 P1000 吸头在每个孔中混合病毒/细胞溶液,并用透明薄膜密封板。
- 进行旋吸:在32°C下以600× g 离心板1小时。 打开板封,在37°C,5%CO2 下孵育6小时。
- 在37°C培养箱中预热24孔板。
- 孵育后,上下移液每个孔,并将内容物转移到标记的 1.5 mL 试管中。用 750 μL AdDMEM+ 洗涤每个孔并转移到试管中。在4°C下以600× g 旋转试管5分钟。
- 从离心机中取出试管并储存在冰上。使用 P1000 吸头小心地取出并妥善处理上清液。
- 将细胞沉淀重悬于EME中,并将50μL圆顶板放入预热的24孔板中。在37°C孵育15-20分钟,直到EME聚合。
- 向每个孔中加入 500 μL 补充有 10 mM 烟酰胺、10 μM Y27632 和 2.5 μM CHIR99021的 rIOM。
- 感染后 1 天用 rIOM 加 10 μM Y27632 替换培养基。每 2-3 天更换一次介质。如果要进行选择,请在感染后 48-72 小时添加选择。对于嘌呤霉素的选择,使用 2 μg/mL 嘌呤霉素。
7. 类器官的免疫荧光全镶嵌染色
- 吸出培养基,将PBS-吐温20(PBS-T)中的4%多聚甲醛(PFA)(表3)添加到细胞培养皿中的类器官中。在室温下孵育10分钟。
- 通过上下移液从EME中释放类器官。将类器官收集到 0.75 mL 试管中。类器官将在几分钟内通过重力沉降到管子底部。如果需要,以100× g 离心1分钟。
- 使用移液管,除去PFA并将类器官重悬于PBS-T中。让类器官沉降到管子底部。取出PBS-T并重悬于200μL块溶液中(表3)。
- 在室温下在摇杆或章动器上孵育45分钟。类器官可以结块并沉降到管的底部。定期用手指轻弹试管以重悬并分散在整个溶液中。
- 让类器官沉降到管子底部。如果需要,以100× g 离心1分钟。去除块状溶液。
- 加入在 100 μL 模块溶液中稀释的一抗。在室温下在章动混合器上以24rpm孵育45分钟。抗体浓度因所用抗体而异。
注意:该步骤可以根据一抗延长至4°C过夜。 - 让类器官沉降到管子底部。如果需要,以100× g 离心1分钟。
- 使用移液管在PBS-T中洗涤五次。在室温下以24rpm的速度在章动混合器上孵育5分钟。重复此步骤两次。
- 加入 1:200 稀释的二抗和 50 μg/mL 在 100 μL 封闭溶液中稀释的 4′,6-二脒基-2-苯基吲哚 (DAPI)。在室温下在章动混合器上以24rpm孵育30分钟。
- 让类器官沉降到管子底部。如果需要,以100× g 离心1分钟。去除二抗。使用移液管在PBS-T中洗涤五次。
- 在室温下以24rpm的速度在章动混合器上孵育5分钟。重复洗涤步骤两次。
- 洗涤类器官时,在40-50°C下加热VALAP密封剂(表3)以液化。使用画笔,在显微镜载玻片上画一个薄的VALAP正方形,大小与盖玻片差不多。使用 22 mm x 22 mm 1.5 号盖玻片。
- 用剪刀剪掉P200移液器吸头的末端。将类器官转移到载玻片上的 VALAP 孔中。使用纸巾擦拭,小心地吸走PBS-T。不要让类器官变干。
- 用抗淬灭封固剂填充VALAP孔(表3)。对于 ~22 mm x 22 mm 的正方形,这将需要 100-150 μL 的抗淬灭剂。
- 类器官可以聚集;如有必要,用移液器吸头旋转抗淬灭剂以重新分配类器官。使用 22 mm x 22 mm 1.5 号盖玻片安装,避免气泡。通过在边缘涂上一层薄薄的VALAP来密封盖玻片。
注意:对于倒置显微镜,类器官也可以安装在 35 mm 玻璃底培养皿中。
8.毛喉素诱导的大鼠肠道类器官肿胀
- 在 rIOM 中传代后培养类器官 3-5 天。建议在 24 孔板中培养类器官,以确保可以轻松重新成像同一区域。在添加毛喉素(T0)之前捕获图像。
- 将毛喉素(表3)直接加入类器官培养基中至终浓度为10μM。 向对照孔中加入相同体积的二甲基亚砜(DMSO)。
- 每15-30分钟定期对控制孔和毛喉素处理的孔进行成像。不成像时,将类器官保留在培养箱中或使用受控成像系统进行孵育。应在120分钟观察到最大肿胀。
- 按照标准方案从采集的图像中计算相对膨胀29.
结果
使用第 2 节中概述的方案生成大鼠十二指肠和空肠类器官。在隐窝分离步骤中,从PBS中有效去除绒毛非常重要。如果在EME中接种过多的绒毛和隐窝,则可能导致整个培养物死亡,并且无法建立类器官系。因此,在解剖镜下分离隐窝是有用的,可以目视确认维拉尔的耗竭。图 1 描绘了具有代表性的维拉尔碎片和隐窝(图1A)。请注意,与绒毛相比,隐窝的尺寸明显更小(图1B)。电镀后,隐窝将在接下来的几天内扩展为球状体,并在第 4-7 天开始发芽和分化(图 2)。一旦类器官达到广泛萌芽阶段,它们就应该被传代。在传代过程中,重要的是破坏类器官以将隐窝芽分开,以便类器官数量可以扩大(图3B)。
类器官在冷冻后的成功回收在很大程度上取决于它们被冷冻的状态。处于高度增殖未分化状态的类器官以最高效率恢复。因此,我们建议诱导它们呈球形和囊形,而不是出芽和分化。为了实现这一点,可以通过增加培养基中 Wnt 配体 R-spondin 的量和在培养基中加入烟酰胺来过度激活 Wnt,烟酰胺已被证明在多种培养系统中支持类器官形成和细胞存活30,31。图 3A 显示了解冻后仅 2 天的健康类器官培养物。在解冻过程中在培养基中加入 BSA 也有助于大鼠肠道类器官培养物的存活,事实证明,这种培养物比小鼠肠道类器官更脆弱。
虽然 3D 类器官培养通常是首选,因为它概括了一些正常的肠道结构,但它使其他方法(包括活成像、转染和慢病毒转导)在技术上更具挑战性。使用由3D类器官32 生成的2D单层(图4)可以更有效地引入质粒。虽然 3D 肠道类器官传统上对瞬时转染具有抗性,但使用基于脂质的转染方法可以成功引入编码 EGFP 的质粒。步骤6.1概述了使用PEI的最具成本效益的方法(图5),但电穿孔和市售转染试剂也产生了类似的结果(数据未显示)。未来的研究将集中在这些方法是否可用于将CRISPR构建体引入单层中。
重要的是,能够在转染后从 2D 单层重组 3D 类器官,以便它们可以保持为具有隐窝 3D 结构组件的可传代系。有趣的是,当EME被加回细胞顶部时,铺在EME上的2D单层很容易重整成小球状体,而胶原I基质不足以重整3D结构(图6)。
虽然瞬时转染对许多研究有用,但稳定细胞系的形成通常更有用,需要将慢病毒引入细胞中。通过修改先前发表的方案,大鼠肠道类器官感染慢病毒(图7)。该协议的一个关键步骤是将类器官分解成小聚集体或细胞簇。如果培养物没有被有效破坏并且类器官保持完整,慢病毒颗粒就不会进入细胞。感染后,类器官必须恢复和再生。这里概述的方案允许在选择前将病毒颗粒摄取10%-48%(平均值:19.4%±6.5%)的细胞。
由于EME残基去除不完全或抗体外显率不完全,类器官的全贴片染色可能很困难。这里概述的方案允许对类器官进行稳健的染色。如果类器官离盖玻片太远,在共聚焦显微镜上对类器官的可视化也可能很困难。通过使用VALAP,可以创建一个具有一定高度的孔,使类器官不会被盖玻片压碎,但仍允许沉降在盖玻片附近,以便于成像。针对顶端阴离子通道囊性纤维化跨膜传导调节因子 (CFTR) 和鬼笔环肽的代表性染色以标记 F-肌动蛋白如图 8 所示。
最后,类器官在功能测定中具有实用性。来自囊性纤维化患者的患者来源类器官已被用于筛选 CFTR 功能,因为用 cAMP 激动剂毛喉素治疗可诱导 CFTR 介导的强力液体分泌,导致类器官肿胀 29,33-37。这项工作的一个目标是确定和开发一种可以与体内临床前研究并行使用的类器官模型。因此,我们旨在确定大鼠肠道类器官是否发生毛喉素诱导的肿胀。事实上,在毛喉素处理后30分钟内,大鼠类器官肿胀,在120分钟内观察到最大效果(图9)。
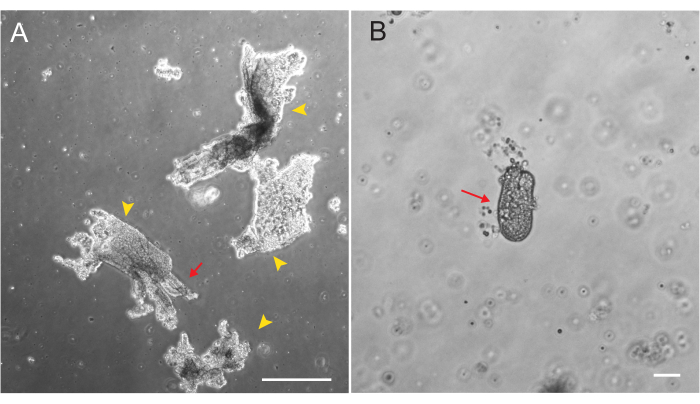
图 1:上皮分离过程中的 Villar 片段和隐 窝。 (A)隐窝分离方案中EDTA溶液中维拉尔片段的代表性图像。黄色箭头标记维拉尔碎片。红色箭头描绘了附着在维拉尔碎片上的地穴。注意相对大小的差异。(B)单个隐窝的更高放大倍率图像(红色箭头),以便可视化形态。比例尺:100 μm。 请点击这里查看此图的较大版本.
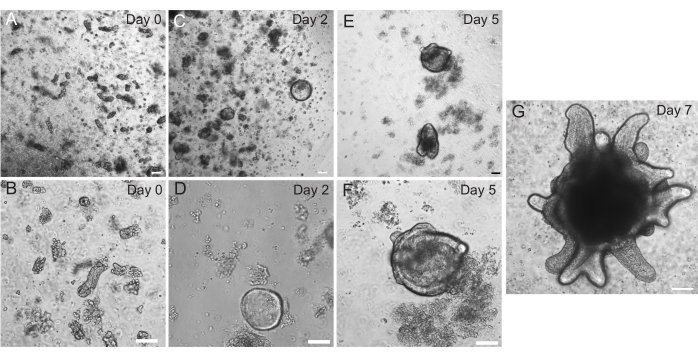
图2:大鼠肠道类器官进展。 分离后立即将大鼠空肠隐窝接种在EME中(A,B)。在2天内,隐窝变成了球状体(C,D)。到第 5 天,它们开始启动隐窝芽 (E,F),并在第 7 天 (G) 详细发展和生长。比例尺:100 μm。 请点击这里查看此图的较大版本.
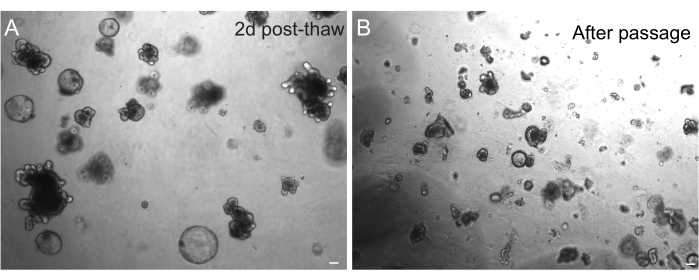
图 3:解冻和传代后的类器官。 (A)冷冻保存后,按照概述的方案解冻大鼠空肠类器官。请注意,解冻后仅 2 天就同时存在球状体和出芽类器官。(B) 按照概述的方案传代后立即在 A 中描绘的相同类器官系。请注意 A 和 B 中结构之间的相对大小差异以及 B 中存在单个隐窝状结构域。比例尺:100 μm。 请点击这里查看此图的较大版本.
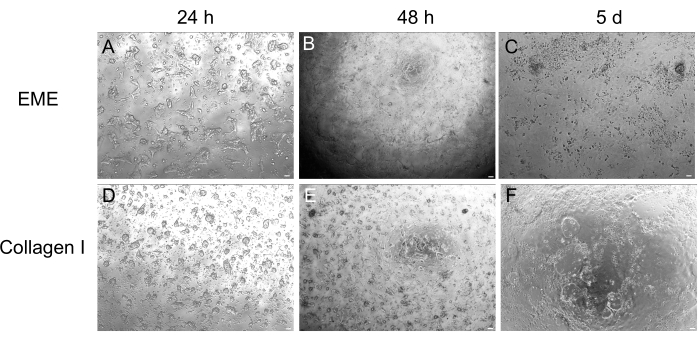
图 4:3D 类器官形成的 2D 单层结构。 (A-C) EME 上的 2D 单层进展。(D-F) I.型胶原蛋白的2D单层进展。到第 5 天,每种条件产生 ~80% 的汇合度。比例尺:100 μm。 请点击这里查看此图的较大版本.
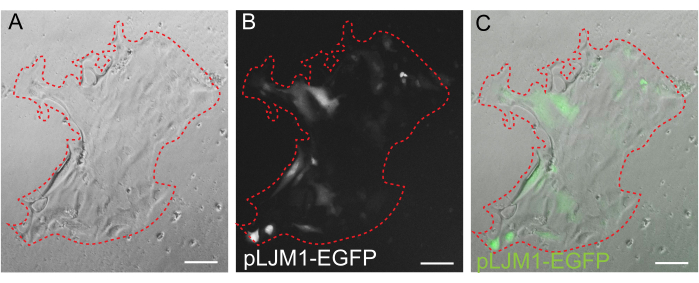
图 5:2D 单层的瞬时转染。 使用 PEI 瞬时转染 pLJM1-EGFP 质粒的 EME 上生长的 2D 单层的代表性图像。(A)明场,(B)荧光(GFP),(C)叠加。红色虚线标记单层边界。比例尺:100 μm。 请点击这里查看此图的较大版本.
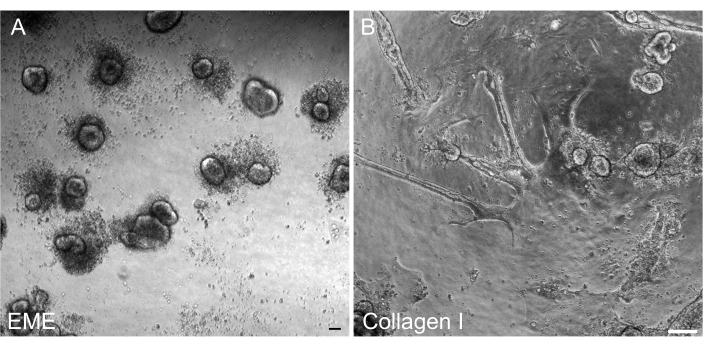
图 6:EME 上 2D 单层的 3D 类器官重整。 (A) 在 EME 上生长的 2D 单层形成 3D 类器官。将EME添加到单层顶端表面后5天有效形成的类器官。注意小 3D 球体周围大量死细胞。(B) 将胶原I添加到胶原I上生长的2D单层的顶端表面5天后2D单层的持久性。 比例尺:100μm。 请点击这里查看此图的较大版本.
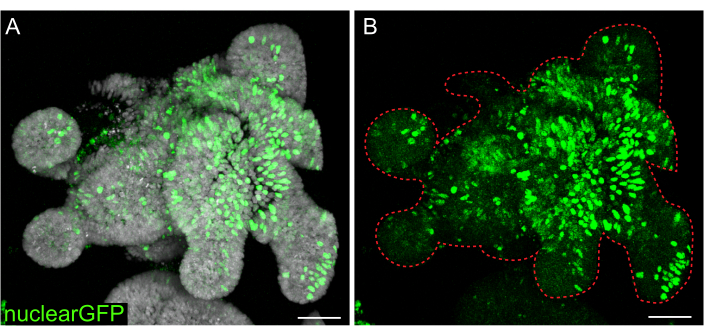
图 7:3D 类器官的慢病毒感染。 使用概述的方案用核GFP慢病毒颗粒感染大鼠空肠类器官。恢复生长5天后,固定类器官并用DAPI复染。(A) DAPI:灰色;nuclearGFP:绿色。(B)核GFP:绿色。红色虚线标记类器官边界。比例尺:50 μm。 请点击这里查看此图的较大版本.
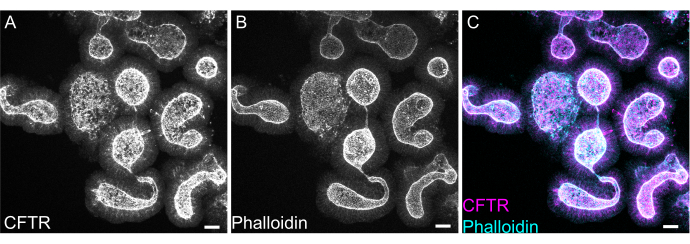
图8:大鼠肠道类器官的全封套免疫荧光 。 (A) CFTR、(B) 鬼笔环肽和 (C) 合并大鼠空肠类器官的全封套免疫荧光。注意类器官中CFTR染色的顶端富集( A为灰色, C为品红色)。鬼笔环肽标记F-肌动蛋白,并突出标记顶端刷状边界( B为灰色, C为青色)。比例尺:25 μm。 请点击这里查看此图的较大版本.
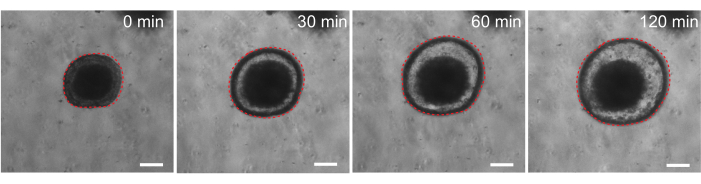
图 9:大鼠肠道类器官在毛喉素刺激下肿胀。 添加 cAMP 激动剂毛喉素后大鼠肠道类器官肿胀的代表性时间过程。0分钟时间表示加入10μM毛喉素之前的时间点。图像以 30 分钟的时间间隔显示相同的类器官。在添加毛喉素后120分钟观察到最大肿胀。红色虚线勾勒出类器官边界。类器官腔中间的深色物质由死细胞组成。比例尺:100 μm。 请点击这里查看此图的较大版本.
表 1:AdDMEM+ 配方。 制作标准 AdDMEM+ 培养基的成分,这是此处所示方法中的基础培养基。 请按此下载此表格。
表2:大鼠肠道类器官培养基(rIOM)配方。 标准大鼠肠道类器官培养基的详细配方,包括重组蛋白的溶剂和储存条件。 请按此下载此表格。
表 3:解决方案。 制作整个协议中使用的其他溶液的配方和说明。 请按此下载此表格。
表 4.用于 2D 单层培养 (rIOM2D) 的大鼠肠道类器官培养基。 针对单层 2D 生长优化的类器官培养基的改良配方。 请按此下载此表格。
讨论
大鼠肠道类器官模型的开发保留了 体内 器官中发现的重要功能特征,是临床前测试、药物筛选和功能测定的有前途的工具。这种 体外 模型可以与 体内 临床前胃肠病学研究并行使用,对于这些研究,大鼠通常是首选模型,因为它们的肠道尺寸更大,与人类共享生理方面,并且在某些情况下是更好的疾病模型38。在这里,概述了用于分离大鼠肠隐窝、大鼠肠道类器官的生成和长期培养以及下游应用(包括功能性毛喉素肿胀测定、全封地免疫荧光、2D 单层培养和慢病毒基因操作)的稳健分步方案。与小鼠肠道类器官相比,大鼠肠道类器官可能与小鼠肠道类器官的病理生理学不合适的许多疾病环境中相关,并且可能为人类肠道生理学提供更好的模型。
为了建立可以传代和扩增的长寿命类器官培养物,必须确定维持肠上皮增殖所需的关键生长因子。小鼠类器官最常在EGF、R-spondin和Noggin的简单混合物中生长,尽管有报道称Noggin不是肠道类器官培养所必需的39。条件培养基可以替代重组生长因子,最常用的细胞系是 L-WRN,它分泌 Wnt3a、Rspondin-3 和 Noggin39、L-Wnt3a 和 HA-Rspondin1-Fc 293T 细胞40。L-WRN 条件培养基不仅足以支持小鼠肠道39 类器官的生长,而且足以支持来自几种农场动物和伴侣动物(包括狗、猫、鸡、马、牛、羊和猪)的肠道类器官的生长12。然而,人类肠道类器官的生长因子需求有很大不同,因为它们的扩增生长期(即从小球体到大球体的进展)与分化阶段(即分化细胞类型的产生和成熟)需要不同的培养基配方10。大鼠肠道类器官的培养基要求与人肠道类器官的扩增生长培养基非常相似,但值得注意的是,大鼠类器官能够在这种培养基环境中生长和分化,大大简化了其培养要求。虽然我们最初的尝试集中在L-WRN条件培养基中建立和培养大鼠肠道类器官,但长期培养很脆弱,并且大鼠肠道类器官系缺乏稳健性(数据未显示)。这可能是因为 L-WRN 细胞系被设计为分泌 R-spondin 3,而这里推荐的 293T-Rspo1 细胞系被设计为分泌 R-spondin 1。大鼠和人类类器官可能更喜欢 R-spondin 1,这可能是 L-WRN 条件培养基中大鼠类器官系失败的原因。
为了最接近地概括 体内 环境,重要的是开发允许干细胞存活、维持和增殖的类器官培养条件,并能够维持细胞更新和同时分化事件为离散细胞类型。因此,重组蛋白和/或条件培养基中蛋白质的浓度需要严格滴定和控制,以达到这种完美的平衡。特别是,最佳的Wnt水平对于避免肠道类器官培养物的损失至关重要。条件培养基中Wnt太少将无法支持生长,导致干细胞丢失和随后的类器官死亡;Wnt 的过度激活会导致类器官呈囊性和未分化10。虽然这里没有详细说明,但强烈建议使用 Wnt 报告荧光素酶测定法(例如 Topflash 细胞系41)测试每批 L-Wnt3a 和 293T-Rspo1 条件培养基。先前的研究已经描述,与 1% 的 L-Wnt3a 相比,最佳批次的 L-Wnt3a 培养基应导致 15 倍的信号增加 12.5% 和 300 倍的信号增加50% 10。由于大鼠类器官比小鼠类器官对培养要求(特别是 Wnt 活化水平)更敏感,因此这些额外的质量控制步骤极大地有助于提高大鼠类器官培养物的稳健性和可靠性。由于没有类似的报告基因线可用于测试Noggin条件培养基中的Bmp活性和相对Noggin浓度,因此建议尽可能使用重组Noggin来精确控制Noggin水平。虽然小鼠肠道类器官可以在没有Noggin39的情况下生长和维持,但尚未尝试将其用于大鼠肠道类器官培养。
除了细胞培养要求外,大鼠类器官系的成功初始建立主要取决于隐窝分离过程中分化绒毛的有效耗竭。高水平的维拉尔污染导致隐窝死亡,可能是由于来自垂死细胞的信号或基本因子的隔离。为了精确和一致地从上皮制剂中去除这些分化的绒毛,建议在立体镜的帮助下进行上皮分离。对释放的上皮细胞的目视检查提供了何时丢弃PBS并更换PBS的明确提示(图1)。在绒毛充分耗竭之前,不应收集隐窝。Villar细胞是终末分化的,不能在培养物中产生类器官。此外,大鼠肠道类器官的后续传代及其用于任何下游应用都需要细致的护理。在解离试剂中孵育较长时间(10分钟)会导致显着的细胞死亡和类器官系的丢失。
在这里,描述了一种从大鼠类器官生成肠道单层的简单快速的方案。EME 和胶原 I 底物对上皮细胞有不同的影响,可以根据研究目的加以利用。EME允许快速有效地粘附单个细胞并形成细胞突起。相比之下,用胶原蛋白I涂覆表面会延迟这些过程。一旦单层达到大约 80% 的汇合度,在 EME 上生长的细胞就会再次开始生成 3D 类器官结构。然而,它们缺乏足够的物理和化学支持来持续增长。通过将EME中的单层保持在50%-80%的汇合度,可以防止这种恢复到类器官状态。在单层的顶端表面添加稀释的EME可促进从头类器官的快速恢复和形成,从而更快、更容易地产生收敛区域。在I型胶原表面上,细胞可以形成均匀的单层并产生小簇。然而,在单层之上添加胶原I不足以诱导类器官的形成。当添加到单层表面时,必须稀释EME,因为新生的类器官将有更强的机械阻力来克服。然而,这种稀释的EME不允许大类器官的稳健形成。任何从头生成的自然脱离表面的大鼠类器官都必须立即去除并转移到未稀释的EME中,以便恢复结构支持和生长。由于此步骤中类器官的尺寸较小,因此在建立稳健生长之前不建议类器官传代。为什么EME可以支持类器官的重组,但胶原蛋白I是否可以做到这一点,其潜在的生物学意义尚不清楚。然而,有报道称,在 3D 胶原蛋白中生长的细胞不能形成带芽的类器官42,43 或支持长期维持。市售的 EME 产品是细胞外蛋白的异质混合物,主要是层粘连蛋白和胶原 IV44。因此,蛋白质的独特组成以及上皮细胞使用不同细胞复合物与细胞外基质结合的能力可能允许在EME中重塑,但不能在胶原I中重塑。I型胶原衍生的单层是否可以放入EME以支持类器官的形成和生长尚未经过测试。
本文描述了大鼠肠道类器官模型的遗传操作,并概述了3D类器官的慢病毒转导和2D单层瞬时转染的方案。为了克服慢病毒类器官转导效率低的问题,开发了一种用于瞬时转染 2D 单层的方案。单层的扁平形态和暴露的顶端结构域使病毒和含DNA的复合物更容易进入。使用pLJM1-EGFP载体表达EGFP报告基因来验证该技术。24 h后观察GFP报告基因表达,单层维持5-6 d。未来专注于单层慢病毒转导的研究可能比 3D 类器官转导具有更高的效率。使用上述方案,可以从感染的 2D 单层中重整 3D 类器官,以促进稳定细胞系的创建。通过谨慎,大鼠肠道类器官系可以成功维持一年以上,在许多传代中保持稳定,冷冻保存,成功解冻,并使用慢病毒转导进行基因修饰,从而满足对易于访问且易于处理的 体外 肠道类器官模型的需求,该模型保留了与人类的生理相关性。
披露声明
没有。
致谢
我们感谢 Sumigray 和 Ameen 实验室的成员进行了深思熟虑的讨论。这项工作得到了 Charles H. Hood 基金会儿童健康补助金和囊性纤维化基金会补助金 (004741P222) 的支持,并得到了美国国立卫生研究院国家糖尿病、消化和肾脏疾病研究所的支持,奖励编号为 2R01DK077065-12。
材料
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
参考文献
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。