Anmelden
Method Article
Generierung und Manipulation von Ratten-Darm-Organoiden
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, um Darmorganoide von Ratten zu generieren und sie in verschiedenen Downstream-Anwendungen zu verwenden. Ratten sind oft ein bevorzugtes präklinisches Modell, und das robuste intestinale Organoidsystem erfüllt den Bedarf an einem In-vitro-System zur Begleitung von In-vivo-Studien.
Zusammenfassung
Bei der Verwendung von Organoiden zur Beurteilung der Physiologie und der Entscheidungen über das Zellschicksal ist es wichtig, ein Modell zu verwenden, das In-vivo-Kontexte genau rekapituliert. Dementsprechend werden von Patienten stammende Organoide für die Krankheitsmodellierung, die Arzneimittelforschung und das personalisierte Behandlungsscreening verwendet. Darmorganoide von Mäusen werden häufig verwendet, um Aspekte sowohl der Darmfunktion/-physiologie als auch der Stammzelldynamik/-schicksalsentscheidungen zu verstehen. In vielen Krankheitskontexten werden Ratten jedoch aufgrund ihrer größeren physiologischen Ähnlichkeit mit dem Menschen in Bezug auf die Pathophysiologie der Krankheit gegenüber Mäusen als Modell bevorzugt. Das Rattenmodell wurde durch einen Mangel an genetischen Werkzeugen eingeschränkt, die in vivo zur Verfügung standen, und die Darmorganoide von Ratten haben sich als zerbrechlich und schwer zu kultivieren erwiesen. Hier bauen wir auf bereits veröffentlichten Protokollen auf, um Ratten-Darm-Organoide aus dem Duodenum und Jejunum robust zu generieren. Wir geben einen Überblick über verschiedene Downstream-Anwendungen, bei denen Darmorganoide von Ratten verwendet werden, darunter funktionelle Schwellungsassays, Whole-Mount-Färbung, die Erzeugung von 2D-enteroiden Monolayern und lentivirale Transduktion. Das Ratten-Organoid-Modell bietet eine praktische Lösung für den Bedarf des Feldes an einem In-vitro-Modell , das physiologische Relevanz für den Menschen behält, schnell genetisch manipuliert werden kann und ohne die Hürden, die mit der Beschaffung menschlicher Darmorganoide verbunden sind, leicht zu erhalten ist.
Einleitung
Die Architektur des menschlichen Dünndarmepithels und die zelluläre Zusammensetzung sind komplex und spiegeln ihre physiologischen Funktionen wider. Die Hauptaufgabe des Dünndarms besteht darin, Nährstoffe aus der Nahrung aufzunehmen, die durch sein Lumen fließt1. Um diese Funktion zu maximieren, ist die Darmoberfläche in fingerartige Ausstülpungen, sogenannte Zotten, organisiert, die die absorbierende Oberfläche vergrößern, und becherartige Einstülpungen, die als Krypten bezeichnet werden und die Stammzellen beherbergen und isolieren. Innerhalb des Epithels werden verschiedene spezialisierte absorptive und sekretorische Zelltypen erzeugt, die unterschiedliche Funktionen erfüllen1. Aufgrund dieser Komplexität war es bisher schwierig, Gewebe wie den Darm in immortalisierten Zelllinien mit hoher Passage zu modellieren. Die Untersuchung von Stammzellen, insbesondere von adulten Stammzellen und ihren Differenzierungsmechanismen, hat jedoch die Entwicklung von 3D-Darmorganoidkulturen ermöglicht. Die Verwendung von Organoidmodellen hat das Feld verändert, zum Teil aufgrund ihrer Rekapitulation einiger architektonischer Komponenten und der Heterogenität der Zelltypen, die im intakten Darm zu finden sind. Darmorganoide können aufgrund der Aufrechterhaltung der aktiven Stammzellpopulation langfristig in vitro kultiviert werden2.
Darmorganoide haben sich schnell zu einem anpassungsfähigen Modell entwickelt, um die Biologie von Stammzellen, die Zellphysiologie, genetische Erkrankungen und die Ernährung zu untersuchen 3,4 sowie ein Werkzeug zur Entwicklung neuartiger Methoden zur Verabreichung von Medikamenten5. Darüber hinaus werden von Patienten stammende Organoide unter anderem für die Krankheitsmodellierung, die Arzneimittelforschung und das personalisierte Behandlungsscreening verwendet 6,7,8,9. Menschliche Darmorganoide stellen jedoch immer noch Herausforderungen dar. Die Verfügbarkeit von Gewebe, die Anforderungen an die Genehmigung durch das Institutional Review Board und ethische Fragen schränken die weit verbreitete Verwendung menschlicher Proben ein. Darüber hinaus benötigen humane Darmorganoide, die aus Darmkrypten erzeugt werden, zwei unterschiedliche Kulturbedingungen für die Erhaltung undifferenzierter Stammzellen oder um die Differenzierung reifer Zelltypen zu induzieren10. Dies steht im Gegensatz zu in vivo, wo Stammzellen und reife differenzierte Zelltypen gleichzeitig vorhanden sind und kontinuierlich erzeugt/erhalten werden1. Auf der anderen Seite benötigen Maus-Darmorganoide, die in einem weniger komplexen Cocktail von Wachstumsfaktoren gezüchtet werden, diesen Wechsel in der Medienzusammensetzung nicht und können Stammzellen und differenzierte Zellen im gleichen Medienkontext erhalten 2,11. Wesentliche Unterschiede im Darm von Mäusen im Vergleich zum Menschen können Maus-Organoide jedoch in vielen Fällen zu einem suboptimalen Modell machen. Insgesamt wurden viele Darmorganoide von größeren Säugetieren, einschließlich Pferden, Schweinen, Schafen, Kühen, Hunden und Katzen, erfolgreich unter Kulturbedingungen erzeugt, die näher an den Darmorganoiden von Mäusen sind als an den Kulturbedingungen menschlicher Darmorganoide12. Die Unterschiede in den Wachstumsfaktorbedingungen zwischen Maus- und menschlichen Organoiden spiegeln wahrscheinlich Unterschiede in der Zusammensetzung der Stammzellnische und unterschiedliche Anforderungen an das Überleben, die Proliferation und die Erhaltung von Stammzellen wider. Daher besteht ein Bedarf an einem leicht zugänglichen Modell-Organoidsystem, das 1) der Zusammensetzung menschlicher Darmzellen sehr ähnlich ist, 2) Stammzellen mit Wachstumsfaktoranforderungen wie die menschlichen Darmorganoide enthält und 3) in der Lage ist, undifferenzierte und differenzierte Kompartimente kontinuierlich aufrechtzuerhalten. Im Idealfall stammt das System aus einem häufig verwendeten präklinischen Tiermodell, so dass In-vivo- und In-vitro-Experimente korreliert und gemeinsam verwendet werden können.
Ratten sind ein häufig verwendetes präklinisches Modell für intestinale physiologische und pharmakologische Studien, da sie dem Menschen sehr ähnlich sind13, insbesondere im Hinblick auf die Darmpermeabilität14. Ihre relativ größere Größe im Vergleich zu Mäusen macht sie für chirurgische Eingriffe zugänglicher. Während manchmal große Tiermodelle, einschließlich Schweine, verwendet werden, sind Ratten ein erschwinglicheres Modell, benötigen weniger Platz für die Haltung und haben leicht kommerziell erhältliche Standardstämme15. Ein Nachteil bei der Verwendung von Rattenmodellen besteht darin, dass das genetische Toolkit für In-vivo-Studien im Vergleich zu Mäusen nicht gut entwickelt ist und die Generierung neuartiger Rattenlinien, einschließlich Knockouts, Knock-Ins und transgener Substanzen, oft unerschwinglich ist. Die Entwicklung und Optimierung eines robusten Ratten-Darm-Organoid-Modells würde genetische Manipulation, pharmakologische Behandlungen und Studien mit höherem Durchsatz in einem zugänglichen Modell ermöglichen, das für den Menschen von entscheidender physiologischer Relevanz ist. Die Vorteile eines Nagetier-Organoidmodells gegenüber einem anderen hängen jedoch stark von dem jeweiligen Prozess oder Gen ab, das untersucht wird. Bestimmte Gene, die beim Menschen gefunden werden, können Pseudogene bei Mäusen sein, aber nicht bei Ratten16,17. Darüber hinaus werden zunehmend speziesspezifische Zellsubtypen durch Einzelzell-RNAseq18,19,20 enthüllt. Schließlich weisen Darmkrankheitsmodelle von Ratten und Mäusen häufig erhebliche Variationen in den Phänotypenauf 21,22, so dass das Modell, das die Symptome und den Krankheitsprozess beim Menschen genauer rekapituliert, für nachgelagerte Arbeiten ausgewählt werden muss. Die Generierung eines Ratten-Darm-Organoid-Modells bietet Forschern zusätzliche Flexibilität und Wahlmöglichkeiten bei der Auswahl eines Modellsystems, das für ihre Umstände am besten geeignet ist. Hier werden bestehende Protokolle23,24 für die Generierung von Ratten-Darm-Organoiden erweitert und ein Protokoll für die Erzeugung und Aufrechterhaltung von Ratten-Darm-Organoiden aus dem Duodenum oder Jejunum skizziert. Darüber hinaus werden mehrere nachgelagerte Anwendungen beschrieben, darunter lentivirale Infektionen, Whole-Mount-Färbungen und Forskolin-Schwellungsassays.
Protokoll
HINWEIS: Alle Zellkulturen sollten mit einer geeigneten aseptischen Technik in einer Gewebekulturhaube gehandhabt werden. Alle Tierversuche in dieser Studie wurden vom Institutional Animal Care and Use Committee (IACUC) der Yale University genehmigt.
1. Herstellung von Zellkulturreagenzien
- Bereiten Sie R-spondin 1 konditionierte Medien gemäß den Anweisungen des Herstellers vor. Bereiten Sie konditionierte Wnt3a-Medien gemäß den Anweisungen des Herstellers vor. Bereiten Sie AdDMEM+ wie in Tabelle 1 beschrieben vor.
- Resuspendieren Sie Gastrin in sterilemdH2O, um einen 100 μM-Stamm herzustellen. Aliquotieren und bei -80 °C lagern. Resuspendieren Sie N-Acetylcystein in sterilem Wasser, um einen 100-mM-Stamm herzustellen. Aliquotieren und bei -20 °C bis zu 1 Monat lagern.
- Resuspendieren Sie rekombinantes humanes Noggin in phosphatgepufferter Kochsalzlösung (PBS) + 0,1 % Rinderserumalbumin (BSA), um einen 250 μg/ml-Stamm herzustellen. Aliquotieren und bei -80 °C lagern. Resuspendieren Sie den rekombinanten epidermalen Wachstumsfaktor (EGF) der Maus in PBS + 0,1 % BSA, um einen 100 μg/ml-Stamm herzustellen. Aliquotieren und bei -80 °C lagern.
- Verdünnen Sie rekombinantes humanes IGF-1 in PBS + 0,1 % BSA, um einen 100 μg/ml-Stamm herzustellen. Aliquotieren und bei -80 °C lagern. Resuspendieren Sie rekombinantes humanes FGF-2 in 5 mM Tris, pH 7,6, um einen 100 μg/ml-Stamm herzustellen. Aliquotieren und bei -80 °C lagern.
HINWEIS: Verwenden Sie für alle Wachstumsfaktoren eine Zwischenverdünnung in PBS + 0,1 % BSA auf das 100-fache der Endkonzentration in den Nährmedien. Bei -20 °C lagern.
2. Etablierung von Ratten-Dünndarm-Organoiden
ANMERKUNG: Dieses Protokoll wurde von zwei zuvor veröffentlichten Protokollen für Darmorganoide von Ratten modifiziert23,24.
- Bereiten Sie das intestinale organoide Medium (rIOM) der Ratte gemäß Tabelle 2 vor und stellen Sie ein Wasserbad auf 37 °C ein. Dieses komplette Medium ist 5 Tage bei 4 °C haltbar.
- 10 ml 3 mM Ethylendiamintetraessigsäure (EDTA) in PBS in einem konischen 15-ml-Röhrchen zubereiten und auf Eis lassen. 250 μl extrazellulären Matrixextrakt (EME) auf Eis auftauen.
- Schnell eine Ratte über Nacht mit Zugang zu Wasser ad libitum. Euthanasieren Sie die Ratte gemäß dem von der IACUC genehmigten Protokoll. In diesem Protokoll wurden erwachsene männliche Sprague-Dawley-Ratten (mit einem Gewicht von ~200 g) durch CO2 - Inhalation euthanasiert (Materialtabelle). Die Zervixluxation wurde als sekundäre Methode der Euthanasie eingesetzt.
- Verwenden Sie zum Sezieren eine sterile autoklavierte Zange und eine Präparierschere. Legen Sie die euthanasierte Ratte mit der ventralen Seite nach oben auf die Sezierfläche. Kneifen Sie die Hautschicht mit einer Pinzette zusammen; Die folgenden Schnitte sollten an der Oberfläche erfolgen, so dass sie nur diese Hautschicht durchschneiden und nicht tief genug, um innere Organe zu schädigen.
- Um die Bauchhöhle zu öffnen, schneidet man mit einer großen, scharfen Präparierschere durch die Hautschicht in einem großen, längs verlaufenden, oberflächennahen Schnitt in der Mitte des Bauches. Als nächstes machst du ausgehend von diesem Schnitt zwei kürzere horizontale Schnitte, einen auf jeder Seite. Verwende eine Pinzette, um die Haut abzuziehen, um die Bauchhöhle freizulegen. Durchtrennen Sie die Peritonealmembran, um die inneren Organe in der Bauchhöhle mit leichtem Zugang zum Darm vollständig freizulegen.
- Lokalisieren Sie mit Schere und Pinzette den Magen und identifizieren Sie den Zwölffingerdarm etwa 2-3 cm distal davon, der als gelbliches Segment erscheint. Das proximale Jejunum befindet sich ca. 4-5 cm distal des Treitz-Bandes, das als Landmarke zwischen Zwölffingerdarm und Jejunum dient.
- Legen Sie das isolierte Darmfragment in eine 10 cm große Petrischale. Reinigen Sie das gewünschte Darmsegment des Mesenteriums so weit wie möglich. Mit 10 ml eiskaltem PBS spülen, bis der luminale Inhalt entfernt ist. Schneiden Sie das Darmsegment auf einem Papiertuch in ~2 cm lange Stücke. Öffnen Sie jedes Darmstück der Länge nach, um das Epithel freizulegen.
- Kratzen Sie mit einem Objektträger aus Glas die freigelegte luminale Oberfläche ab, um Zotten zu entfernen. Darmstücke in die vorbereitete EDTA-Lösung auf Eis legen. Bei 4 °C 30 min auf einem auf 10 U/min eingestellten Rohrrevolver drehen.
- Gießen Sie am Präpariermikroskop den Inhalt des konischen Röhrchens in eine 10 cm lange Petrischale. Fügen Sie zusätzlich ~5 ml eiskaltes PBS hinzu.
- Halten Sie mit einer feinen Pinzette ein Darmsegment fest und schütteln Sie es kräftig. Es wird möglich sein, die Freisetzung des Epithels in das PBS zu sehen. Zunächst wird die PBS in erster Linie Zotten enthalten.
- Schütteln Sie weiter. Entsorgen Sie regelmäßig die PBS-haltigen Zotten und geben Sie 10 ml frisches, eiskaltes PBS zu den Darmfragmenten. Schütteln Sie die Fragmente weiter und wiederholen Sie diesen Waschschritt, bis die Zotten nicht mehr in den PBS entlassen werden, sondern der PBS hauptsächlich Krypten enthält. Überschreiten Sie nicht 15 Minuten für die Kryptenisolierung, damit die Lebensfähigkeit der Zellen nicht beeinträchtigt wird.
- Entsorgen Sie die restlichen Darmfragmente. Reichern Sie das restliche PBS in der Petrischale für Darmkrypten an. In einer Gewebekulturhaube werden die PBS-haltigen Krypten gesammelt und durch ein 70 μm Zellsieb gefiltert (Materialtabelle).
- Bei 250 x g 5 min zentrifugieren. Entfernen Sie den Überstand und resuspendieren Sie das Pellet in 5 ml AdDMEM+. Nochmals bei 250 x g für 5 min zentrifugieren.
HINWEIS: Es wird empfohlen, eine Zentrifuge mit einem Ausschwingrotor zu verwenden. - Entfernen Sie den Überstand und lassen Sie ~50 μl des Mediums mit dem Pellet zurück. Resuspendieren Sie das Pellet in den verbleibenden Medien und geben Sie es zum Aliquot des EME auf Eis. Pipettieren Sie vorsichtig nach oben und unten, um die Krypten gleichmäßig in der EME aufzuhängen. Vermeiden Sie das Einbringen von Blasen.
- 50 μl EME-Kuppeln in eine 35-mm-Gewebekulturschale geben und 20 Minuten lang in einem 37 °C heißen 5 % CO2 -Gewebekultur-Inkubator inkubieren.
- 2 ml rIOM (Tabelle 2) mit 10 μM Y27632 und 10 μM CHIR99021 zugeben (Tabelle 3). Nach der Passage können Y27632 und CHIR99021 abgesetzt werden.
- Wechseln Sie das rIOM alle 2-3 Tage. Passage nach Bedarf, in der Regel zwischen 3 und 7 Tagen, abhängig von der anfänglichen Anzahl der Organoide, der Größe und der Wachstumsrate.
3. Passage von Ratten-Darm-Organoiden
- Ein 250 μl aliquotes EME auf Eis auftauen und das rIOM auf 37 °C vorwärmen.
- Das Medium wird von einer 35-mm-Platte mit Organoiden abgesaugt und 1 ml Dissoziationsreagenz hinzugefügt, um die Organoide sofort aus den EME-Kuppeln freizusetzen.
- Das Dissoziationsreagenz mit fragmentierten Organoiden wird sofort in ein konisches 15-ml-Röhrchen überführt. Waschen Sie die Kulturplatte mit 2 ml AdDMEM+ und geben Sie sie in das konische 15-ml-Röhrchen mit fragmentierten Organoiden.
- Mit einer Pasteur-Glaspipette vorsichtig 15-20 Mal auf und ab pipettieren, um die Organoide zu fragmentieren. Bei 350 x g für 2 Min. zentrifugieren.
- Geben Sie ~50 μl Lösung vom Boden des konischen Röhrchens in das EME. Zum Mischen vorsichtig nach oben und unten pipettieren. Vermeide es, Blasen zu machen.
- 50 μl EME-Kuppeln in eine 35-mm-Schale geben und 20 Minuten lang in einem 37 °C und 5 % CO2 -Gewebekultur-Inkubator inkubieren.
- 2 ml rIOM mit 10 μM Y27632 und 10 μM CHIR99021 zugeben. Wechseln Sie das Nährmedium alle 2-3 Tage. Beim Medienwechsel können Y27632 und CHIR99021 weggelassen werden.
4. Kryokonservierung und Auftauen von Darmorganoiden der Ratte
- Kryokonservierende Darmorganoide von Ratten
ANMERKUNG: Das Kryokonservierungsprotokoll wurde gegenüber einem früheren Protokoll für Organoide von Mensch und Mausmodifiziert 25. Vor dem Einfrieren müssen die Organoide mindestens zwei Passagen in der Primärkultur durchlaufen haben. Es ist ratsam, Organoide vor der Kryokonservierung zu großen Sphäroiden oder leicht knospigen Organoiden zu züchten, da dies nach dem Auftauen zu einer höheren Ausbeute an lebensfähigen Organoiden führt. Dies kann durch Erhöhung des R-Spondin-konditionierten Mediums auf 15% und/oder durch Zugabe von 10 mM Nicotinamid (Tabelle 3) zur Organoidkultur erreicht werden.- Zählen Sie mit einem Mikroskop die Anzahl der Organoide auf der 35-mm-Schale. Beschriften Sie die Kryoröhrchen so, dass 200 Organoide in jedes Kryoröhrchen aliquotiert werden.
- Entfernen Sie das rIOM von der 35-mm-Schale. Ersetzen Sie es durch 2 ml PBS in Kaltgewebekulturqualität.
- Lösen Sie mit einer P1000-Spitze die EME-Kuppeln vom Boden der Kulturschale in den PBS, indem Sie sie auf und ab pipettieren. Pipettieren Sie weiter ~20 Mal auf und ab, um das EME aufzubrechen und die Organoide freizusetzen. Sammeln Sie die Organoide und PBS in einem konischen 15-ml-Röhrchen.
- Geben Sie 2 ml kaltes PBS in die Kulturschale und pipettieren Sie es auf und ab, um alle verbleibenden Organoide in das PBS freizusetzen. Füllen Sie das PBS in das konische 15-ml-Röhrchen.
- Pelletieren Sie die Organoide durch Zentrifugieren bei 290 x g für 5 Minuten. Entfernen und entsorgen Sie den Überstand, ohne das Organoid-Pellet zu stören.
- Waschen Sie das Pellet, indem Sie es vorsichtig in 5 ml kaltem AdDMEM+ resuspendieren. Bei 200 x g 4 Min. zentrifugieren. Entfernen Sie den Überstand vorsichtig und entsorgen Sie ihn.
- Resuspendieren Sie das Organoid-Pellet in 1 ml Gefriermedium pro 200 Organoide. Aliquot 1 ml Organoide in Gefriermedium pro markiertem Kryoröhrchen. Legen Sie die Kryoröhrchen in einen Gefrierbehälter.
- Lagern Sie die Organoide 24 h lang in einem Gefrierbehälter bei -80 °C und überführen Sie die Kryoröhrchen dann zur Langzeitlagerung in flüssigen Stickstoff.
- Auftauen von Ratten-Darm-Organoiden
HINWEIS: Dieses Protokoll wurde gegenüber einem früheren Protokoll zum Auftauen von Darmorganoiden von Mensch und Maus modifiziert26.- Ein 250 μl aliquotes EME auf Eis auftauen. Bereiten Sie rIOM vor, ergänzt mit 15 % R-Spondin-konditionierten Medien, 10 μM Y27632 und 10 μM CHIR99021. Warm bei 37 °C.
- 2 ml Auftaumedium (Tabelle 3) in ein konisches 15-ml-Röhrchen bei Raumtemperatur geben.
- Eine Durchstechflasche mit Organoiden aus flüssigem Stickstoff entnehmen und auftauen, indem Sie die Durchstechflasche in ein 37 °C heißes Wasserbad stellen, bis die Durchstechflasche fast vollständig aufgetaut ist.
- Geben Sie 1 ml Auftaumedium in die Durchstechflasche und füllen Sie den gesamten Inhalt in das konische Röhrchen mit dem Auftaumedium um. Waschen Sie die Durchstechflasche zweimal mit 1 ml Auftaumedium und geben Sie sie in das konische Röhrchen.
- Bei 200 x g 5 Min. zentrifugieren. Saugen Sie das Medium an und lassen Sie ~50 μl Medium bei den Organoiden zurück. Die medien, die Organoide enthalten, werden in 250 μl EME überführt.
- Verteilen Sie die Organoide gleichmäßig durch das EME, indem Sie auf und ab pipettieren, um Blasen zu vermeiden. Pipettieren Sie sechs 50-μl-Kuppeln in eine 35-mm-Gewebekulturschale.
- 15-20 Minuten im Gewebekultur-Inkubator inkubieren, damit das EME polymerisieren kann. 2 ml des vorbereiteten rIOM in die Schüssel geben.
- Ersetzen Sie das Medium nach 2 Tagen durch rIOM. Die Verwendung von Y27632 und CHIR99021 kann ausgesetzt werden. Das Wachstum von Organoiden kann in der ersten Passage nach dem Auftauen langsam sein. Es wird empfohlen, die Organoide nach dem Auftauen zweimal zu passieren, bevor mit den Experimenten begonnen wird.
5. Generierung von 2D-Monolayern aus 3D-Organoiden im Darm von Ratten
HINWEIS: Das folgende Protokoll beschreibt die Volumina, die erforderlich sind, um 24 Wells einer mit EME beschichteten 48-Well-Platte zu erzeugen, beginnend mit sechs Kuppeln mit 50 μl (35-mm-Schale) mit ~300 Darmorganoiden/Kuppel (Skala: eine Kuppel erzeugt vier Wells), kann aber nach Bedarf vergrößert oder verkleinert werden. Wie geschrieben, erreicht dieses Protokoll ~80% Konfluenz in 4-5 Tagen. Bei höherer Konfluenz beginnen die Zellen wieder, 3D-Organoidstrukturen anzunehmen. Bei geringer Konfluenz (≤40%) verbleiben die Zellen als Monolayer und sind ~14 Tage lebensfähig. Wenn der Zweck der Studie darin besteht, 2D-Monoschichten zu verwenden, skalieren Sie sie herunter, so dass eine Kuppel acht Vertiefungen einer 24-Well-Platte erzeugt. Die Vertiefungen können auch mit Kollagen I beschichtet werden, um Monoschichten zu bilden.
- Vorbereitung von beschichteten Oberflächen
- Um die Platte mit EME zu beschichten, verdünnen Sie EME 1:20 in kaltem AdDMEM+ (Tabelle 1). Für die Beschichtung mit Kollagen Kollagen I gemäß den Anweisungen des Herstellers vorbereiten. Verdünnen Sie 5 mg/ml Kollagen I in AdDMEM+ auf 100 μg/ml (in diesem Fall 1:50).
- Beschichten Sie die Platte mit 200 μl verdünntem EME oder Kollagen, um die Well-Oberfläche vollständig zu bedecken. 1-2 h bei 37 °C in einem Gewebekultur-Inkubator inkubieren. Bereiten Sie das intestinale Organoidmedium der Ratte für die 2D-Monolayer-Kultur (rIOM2D) gemäß Tabelle 4 vor.
- Generierung von Monolayern
- Saugen Sie das Medium von einer 35-mm-Platte mit Organoiden ab. Fügen Sie 1 ml PBS hinzu.
- Stören Sie die EME in den Vertiefungen, indem Sie mit einer P1000-Spitze kratzen. Pipettieren Sie etwa 20 Mal nach oben und unten, um die gesamte EME zu lösen. Alles in ein konisches 15-ml-Röhrchen umfüllen.
- Geben Sie 1 ml PBS auf die 35-mm-Platte, um zusätzliche Organoide zurückzugewinnen, und geben Sie sie in dasselbe konische 15-ml-Röhrchen um.
- Bei 350 x g für 2 min zentrifugieren und den Überstand einschließlich EME-Rückstand absaugen. 1 ml Trypsinlösung zum Organoid-Pellet geben und bei 37 °C 2 min inkubieren.
- Pipettieren Sie 10 Mal mit einer P1000-Spitze nach oben und unten und fügen Sie 2 ml AdDMEM+ hinzu, um Trypsin zu neutralisieren.
- Bei 350 x g 5 min zentrifugieren. Den Überstand absaugen und 4,8 mL rIOM2D zugeben (Tabelle 4). Resuspendieren Sie das Zellpellet.
- Bevor Sie die Organoide platzieren, nehmen Sie überschüssiges EME oder Kollagen in AdDMEM+ aus den Vertiefungen. Dann werden 200 μl Organoide in rIOM2D und 10 μM Y27632 in jede vorbeschichtete Vertiefung gegeben.
- Nach 4-16 h wird das Medium aufgefangen und 1 min lang bei 1.000 x g zentrifugiert. Füllen Sie den Überstand in ein neues konisches 15-ml-Röhrchen und entsorgen Sie das Pellet.
- Waschen Sie jede Vertiefung mit 300 μl PBS und geben Sie 200 μl des zentrifugierten rIOM2D in jede Vertiefung. Wechseln Sie die rIOM2D alle 2-3 Tage und setzen Sie die Verwendung von Y27632 aus.
- Reformierung von 3D-Organoiden aus 2D-Monolayern
HINWEIS: Monolayer, die auf EME gewachsen sind, können dazu gebracht werden, 3D-Organoide zu reformieren, während Monolayer, die auf Kollagen I gewachsen sind, nicht effizient zu 3D-Organoiden zurückkehren. Normalerweise können 2-3 Wells mit Organoiden, die aus Monolayern erzeugt werden, verwendet werden, um eine Kuppel mit 50 μl EME an Tag 5 herzustellen.- Verdünnen Sie die EME 1:4 in rIOM2D. Wenn die Monolagen eine Konfluenz von ~80 % erreichen, saugen Sie das Medium vorsichtig an und geben Sie 100 μl verdünntes EME in die Vertiefungen mit den Monoschichten.
- Bei 37 °C, 5 %CO2 in einem Gewebekultur-Inkubator für 20 min inkubieren. Danach 100 μl rIOM2D zugeben und in den Gewebekultur-Inkubator zurückkehren. 3D-Organoide werden innerhalb von 5 Tagen nach Zugabe von verdünntem EME generiert.
- Nachdem sich kleine Organoide neu gebildet haben (~Tag 5), bereiten Sie rIOM vor. Sammeln Sie den gesamten Well-Inhalt, pipettieren Sie ihn auf und ab, um die EME zu unterbrechen, und füllen Sie ihn in ein konisches 15-ml-Röhrchen um.
- Bei 350 x g für 2 Min. zentrifugieren. Saugen Sie den Überstand und den EME-Rückstand ab.
- 1 ml kaltes AdDMEM+ zugeben und bei 350 x g 2 min zentrifugieren. Entfernen Sie den Überstand und lassen Sie ~50 μl des Mediums zurück.
- Die 50 μl Medien und Organoide werden in ein 250 μl EME-Aliquot überführt. Pipettieren Sie auf und ab, um die Organoide in der EME zu verteilen.
- Pipettieren Sie 50 μl EME-Kuppeln in eine 35-mm-Schale und inkubieren Sie sie 20 Minuten lang in einem Gewebekultur-Inkubator.
- Fügen Sie 2 ml rIOM plus 10 μM Y27632 hinzu. Wechseln Sie das Nährmedium alle 2-3 Tage. Beim Wechsel des Mediums kann Y27632 weggelassen werden.
6. Genetische Manipulation
- Transiente Transfektion von 2D-Monolagen
VORSICHT: Bereiten Sie die Darmepithel-Monoschichten der Ratte gemäß Abschnitt 5.1 in einer 48-Well-Platte vor. Die Transfektion muss bei 70%-80% Konfluenz durchgeführt werden. Ersetzen Sie die Medien in den Vertiefungen immer durch 200 μl frisches rIOM2D, bevor Sie transfizieren. Berechnen Sie die Absorptionsverhältnisse von 260/280 nm und 260/230 nm der Plasmid-DNA; Diese müssen über 1,8 liegen, um gute Transfektionsergebnisse zu gewährleisten.
HINWEIS: Verwenden Sie eine Plasmidkontrolle, um die Effizienz der Transfektion zu berechnen. Ein Plasmid, das für ein fluoreszierendes Protein kodiert, wird der Einfachheit halber empfohlen. In diesem Protokoll wurde pLJM1-EGFP27 verwendet.- Bereiten Sie 1 mg/ml 20 kDa Polyethylenimin (PEI; Tabelle 3). Bereiten Sie für jede Vertiefung Röhrchen A (0,6 μg Plasmid + 50 μl reduziertes Serummedium) und Röhrchen B (1,8 μl PEI + 50 μl reduziertes Serummedium) vor. Halten Sie ein DNA:PEI-Verhältnis von 1:3 aufrecht.
- Beide Röhren 30 s lang vortexen. Kombinieren Sie Rohr A und Rohr B und wirbeln Sie erneut 30 s lang vor. Bei Bedarf mit einer Zentrifuge schleudern. 20 Minuten bei Raumtemperatur inkubieren.
- Geben Sie den DNA/PEI-Komplex vorsichtig tropfenweise in die 2D-Monoschicht. Den Teller vorsichtig schwenken, um ihn zu mischen. Inkubieren bei 37 °C, 5 % CO2. Die Expression kann in der Regel nach 24 h nachgewiesen werden.
HINWEIS: Wenn es notwendig ist, zu 3D-Organoidstrukturen zurückzukehren, warten Sie 48 Stunden nach der Transfektion, um verdünntes EME hinzuzufügen.
- Lentivirale Transduktion von Darmorganoiden der Ratte
HINWEIS: Bevor Sie mit Lentiviren arbeiten, holen Sie eine ordnungsgemäße Genehmigung und spezielle Schulung von der Institution ein. Tragen Sie beim Umgang mit Lentiviren immer eine geeignete persönliche Schutzausrüstung (PSA). Obwohl hier nicht beschrieben, ist ein hochwertiges, konzentriertes Lentivirus für die erfolgreiche Infektion von Organoiden unerlässlich. Dieses Protokoll verwendet einen leeren pLJM1-EGFP-Vektor27 um lösliches GFP zu exprimieren. Dieses Protokoll ist eine Modifikation eines zuvor veröffentlichten Protokolls28. Die Transduktionseffizienz hängt von der Qualität und Konzentration der Viruspartikel, der effizienten Dissoziation von Organoiden in kleine Zellcluster und dem exprimierten Gen ab. Bei der Berechnung 5 Tage nach der Infektion betrug die mittlere Transduktionseffizienz vor der Selektion 19,4 % (± 6,5 % Standardabweichung).- Planen Sie 2 Tage vor der lentiviralen Infektion, zwei dichte Vertiefungen einer 24-Well-Platte für jedes Lentivirus, das transduziert werden soll, zu durchlaufen (Abschnitt 3). Jede Vertiefung einer 24-Well-Platte kann eine 50-μl-EME-Kuppel aufnehmen.
- Sobald sich das EME verfestigt hat, fügen Sie 0,5 ml rIOM hinzu, ergänzt mit 10 mM Nicotinamid, 10 μM Y27632 und 2,5 μM CHIR99021. Dies induziert große Sphäroidmorphologien, was für die Effizienz der lentiviralen Transduktion günstig ist. Innerhalb von 2 Tagen nach dem Plattieren sollten Ratten-Organoide große Sphäroide sein. Wenn eine signifikante Differenzierung (d. h. Knospenbildung) beobachtet wird, sollten die Organoide erneut durchlaufen werden.
- Tauen Sie das konzentrierte Virus auf Eis auf. Bereiten Sie frische Transduktionsmedien gemäß Tabelle 3 vor.
- Lösen Sie mit einer P1000-Spitze die EME-Kuppeln vom Boden der Zellkulturschale in das Medium, indem Sie sie auf und ab pipettieren. Pipettieren Sie weiter 20 Mal auf und ab, um das EME aufzubrechen und die Organoide freizusetzen.
- Pipettieren Sie die Organoide und Medien in ein konisches 15-ml-Röhrchen. Alle Wells können zusammengefasst werden, vorausgesetzt, die Organoide haben den gleichen Genotyp und stammen aus der gleichen Linie.
- Waschen Sie jede Vertiefung zweimal mit 1 ml kaltem AdDMEM+. Sammeln Sie das AdDMEM+ und geben Sie es in dasselbe konische 15-ml-Röhrchen.
- Mit einer Pasteur-Glaspipette die Ratten-Organoide mechanisch aufbrechen. Dies ist ein kritischer Schritt, da das Ziel kleine mehrzellige Zellverbände sind. Pipettieren Sie ~30 Mal nach oben und unten. Prüfen Sie die Effizienz der Störung unter dem Mikroskop mit einem 4x-Objektiv. Setzen Sie diesen Prozess fort, bis die Zellsuspension hauptsächlich aus Zellclustern besteht, von denen nur noch wenige Organoide übrig sind.
ANMERKUNG: Alternativ können Organoide bei 200 x g für 5 Minuten bei Raumtemperatur zentrifugiert, der Überstand vorsichtig entfernt und in 1 ml rekombinantem Enzym, das herkömmliches Trypsin/EDTA ersetzt, resuspendiert und im Gewebekultur-Inkubator auf 37 °C vorgewärmt werden. Inkubieren Sie die Organoide in Trypsinersatz für 2 Minuten in einem 37 °C warmen Wasserbad, mit regelmäßigem Wirbeln, um die Dissoziation zu fördern. Vermeiden Sie eine längere Inkubation mit Trypsinersatz, da dies den Zelltod fördern kann. Überprüfen Sie regelmäßig die Effizienz der Störung unter dem Mikroskop mit einem 4x-Objektiv. Wenn die Suspension hauptsächlich aus Einzelzellen mit wenigen Zellkulturen besteht, verdünnen Sie den Trypsinersatz durch Zugabe von 4 ml AdDMEM+ und fahren Sie mit dem nächsten Schritt fort. - Schleudern Sie das konische 15-ml-Röhrchen mit den Zellclustern bei 200 x g 5 Minuten lang bei 4 °C. Entfernen und entsorgen Sie den Überstand vorsichtig und achten Sie darauf, das Zellpellet nicht zu stören.
- Resuspendieren Sie die Zellcluster in 230 μl Transduktionsmedium pro zu infizierender Well. Verwenden Sie für die Infektion eine Vertiefung einer 48-Well-Platte für jedes Lentivirus.
- Platte 230 μl Zellsuspension in jede Vertiefung einer beschrifteten 48-Well-Platte. Geben Sie 20 μl konzentriertes Virus in jede Vertiefung. Verwenden Sie eine P1000-Spitze, um die Virus-/Zelllösung in jeder Vertiefung zu mischen, und versiegeln Sie die Platte mit einer transparenten Folie.
- Spinokulation durchführen: Zentrifugieren Sie die Platte bei 600 x g für 1 h bei 32 °C. Die Platte abdichten und bei 37 °C, 5 % CO2 6 h inkubieren.
- Eine 24-Well-Platte im 37 °C warmen Inkubator vorwärmen.
- Nach der Inkubation pipettieren Sie jede Vertiefung nach oben und unten und geben den Inhalt in ein beschriftetes 1,5-ml-Röhrchen. Waschen Sie jede Vertiefung mit 750 μl AdDMEM+ und geben Sie sie in das Röhrchen. Die Röhrchen werden bei 600 x g 5 min bei 4 °C geschleudert.
- Nehmen Sie die Röhrchen aus der Zentrifuge und lagern Sie sie auf Eis. Verwenden Sie eine P1000-Spitze, um den Überstand vorsichtig zu entfernen und ordnungsgemäß zu entsorgen.
- Resuspendieren Sie das Zellpellet in EME und geben Sie 50-μl-Kuppeln in die vorgewärmte 24-Well-Platte. 15-20 min bei 37 °C inkubieren, bis das EME polymerisiert ist.
- Zu jeder Vertiefung werden 500 μl rIOM hinzugefügt, ergänzt mit 10 mM Nicotinamid, 10 μM Y27632 und 2,5 μM CHIR99021.
- Ersetzen Sie das Medium 1 Tag nach der Infektion durch rIOM plus 10 μM Y27632. Wechseln Sie das Medium alle 2-3 Tage. Wenn eine Selektion durchgeführt wird, fügen Sie die Selektion 48-72 Stunden nach der Infektion hinzu. Für die Puromycin-Auswahl verwenden Sie 2 μg/ml Puromycin.
7. Immunfluoreszenz-Whole-Mount-Färbung von Organoiden
- Das Medium absaugen und 4 % Paraformaldehyd (PFA) in PBS-Tween 20 (PBS-T) (Tabelle 3) zu den Organoiden in einer Zellkulturschale hinzufügen. 10 Minuten bei Raumtemperatur inkubieren.
- Lösen Sie die Organoide aus der EME, indem Sie sie auf und ab pipettieren. Sammeln Sie die Organoide in einem 0,75-ml-Röhrchen. Die Organoide setzen sich durch die Schwerkraft innerhalb weniger Minuten am Boden des Röhrchens ab. Bei Bedarf bei 100 x g 1 min zentrifugieren.
- Entfernen Sie mit einer Transferpipette das PFA und resuspendieren Sie die Organoide in PBS-T. Lassen Sie die Organoide am Boden des Röhrchens absetzen. PBS-T wird entfernt und in 200 μl Blocklösung resuspendiert (Tabelle 3).
- Bei Raumtemperatur auf einer Wippe oder einem Nutator 45 Minuten lang inkubieren. Organoide können verklumpen und sich am Boden des Röhrchens absetzen. Bewegen Sie das Röhrchen regelmäßig mit dem Finger, um es zu resuspendieren und in der Lösung zu verteilen.
- Lassen Sie die Organoide am Boden des Röhrchens absetzen. Bei Bedarf bei 100 x g 1 min zentrifugieren. Blocklösung entfernen.
- Fügen Sie den Primärantikörper hinzu, der in 100 μl Blocklösung verdünnt ist. Bei Raumtemperatur auf einem Nutiermischer 45 Minuten bei 24 U/min inkubieren. Die Antikörperkonzentrationen variieren je nach verwendetem Antikörper.
HINWEIS: Dieser Schritt kann je nach Primärantikörper bis über Nacht bei 4 °C verlängert werden. - Lassen Sie die Organoide am Boden des Röhrchens absetzen. Bei Bedarf bei 100 x g 1 min zentrifugieren.
- Fünfmal mit einer Transferpipette in PBS-T waschen. Bei Raumtemperatur 5 Minuten auf einem Nutiermischer bei 24 U/min inkubieren. Wiederholen Sie diesen Schritt zweimal.
- Sekundärer Antikörper verdünnt 1:200 und 50 μg/ml 4′,6-Diamidino-2-phenylindol (DAPI), verdünnt in 100 μl Blocklösung. Bei Raumtemperatur auf einem Nutiermischer 30 Minuten bei 24 U/min inkubieren.
- Lassen Sie die Organoide am Boden des Röhrchens absetzen. Bei Bedarf bei 100 x g 1 min zentrifugieren. Sekundären Antikörper entfernen. Fünfmal in PBS-T mit einer Transferpipette waschen.
- Bei Raumtemperatur 5 Minuten auf einem Nutiermischer bei 24 U/min inkubieren. Wiederholen Sie den Waschschritt zweimal.
- Während die Organoide gewaschen werden, erhitzen Sie ein aliquotes VALAP-Dichtmittel (Tabelle 3) auf 40-50 °C, um es zu verflüssigen. Malen Sie mit einem Pinsel ein dünnes VALAP-Quadrat auf einen Objektträger, der etwa die Größe eines Deckglases hat. Verwenden Sie ein Deckglas Nr. 1,5 im Format 22 mm x 22 mm.
- Schneiden Sie mit einer Schere das Ende einer P200-Pipettenspitze ab. Organoide in die VALAP-Vertiefung auf dem Objektträger überführen. Verwenden Sie ein Tuchtuch, um den PBS-T vorsichtig zu entfernen. Lassen Sie die Organoide nicht austrocknen.
- Fluten Sie die VALAP-Vertiefung mit einem Antifade-Eindeckmedium (Tabelle 3). Für ein Quadrat von ~22 mm x 22 mm werden 100-150 μl Antifade benötigt.
- Die Organoide können sich anhäufen; Schwenken Sie das Antifade mit einer Pipettenspitze, um die Organoide bei Bedarf neu zu verteilen. Montieren Sie das Deckglas 22 mm x 22 mm Nr. 1,5, um Luftblasen zu vermeiden. Versiegeln Sie das Deckglas, indem Sie eine dünne Schicht VALAP auf die Ränder auftragen.
HINWEIS: Bei inversen Mikroskopen können die Organoide auch in einer 35-mm-Glasbodenschale montiert werden.
8. Forskolin-induzierte Schwellung von Ratten-Darmorganoiden
- Züchten Sie die Organoide 3-5 Tage lang nach der Passage in rIOM. Es ist ratsam, Organoide in einer 24-Well-Platte zu züchten, um sicherzustellen, dass dieselbe Region leicht neu abgebildet werden kann. Erfassen Sie Bilder vor der Zugabe von Forskolin (T0).
- Forskolin (Tabelle 3) wird direkt zu den organoiden Medien bis zu einer Endkonzentration von 10 μM zugegeben. Das gleiche Volumen Dimethylsulfoxid (DMSO) wird in die Kontrollvertiefungen gegeben.
- Bilden Sie die Kontroll- und Forskolin-behandelten Vertiefungen in regelmäßigen Abständen, alle 15-30 Minuten, ab. Wenn Sie keine Bildgebung durchführen, bewahren Sie Organoide im Inkubator auf oder verwenden Sie ein kontrolliertes Bildgebungssystem mit Inkubation. Die maximale Schwellung sollte nach 120 Minuten beobachtet werden.
- Befolgen Sie Standardprotokolle, um die relative Schwellung aus den aufgenommenen Bildernzu berechnen 29.
Ergebnisse
Duodenal- und Jejunal-Organoide der Ratte wurden unter Verwendung des in Abschnitt 2 beschriebenen Protokolls erzeugt. Es ist sehr wichtig, dass während der Schritte zur Isolierung der Krypta die Zotten effizient aus dem PBS entfernt werden. Wenn zu viele Zotten in der EME mit Krypten überzogen sind, kann dies zum Absterben der gesamten Kultur und zum Scheitern der Etablierung einer Organoidlinie führen. Aus diesem Grund ist es nützlich, Krypten unter einem Sezierbereich zu isolieren, um eine visuelle Bestätigung der Villar-Erschöpfung zu ermöglichen. Abbildung 1 zeigt repräsentative Villar-Fragmente und Krypten (Abbildung 1A). Man beachte die deutlich geringere Größe der Krypten im Vergleich zu den Zotten (Abbildung 1B). Nach dem Plattieren dehnen sich die Krypten in den nächsten Tagen zu Sphäroiden aus und beginnen am 4. bis 7. Tag zu knospen und sich zu differenzieren (Abbildung 2). Sobald die Organoide ein ausgedehntes Knospenstadium erreicht haben, sollten sie durchgelassen werden. Während der Passage ist es wichtig, die Organoide so weit zu stören, dass die Kryptenknospen auseinandergerissen werden, damit die Anzahl der Organoide erweitert werden kann (Abbildung 3B).
Die erfolgreiche Rückgewinnung von Organoiden nach dem Einfrieren hängt stark von dem Zustand ab, in dem sie eingefroren werden. Organoide in einem hochproliferativen, undifferenzierten Zustand erholen sich mit höchster Effizienz. Daher empfehlen wir, sie dazu zu bringen, kugelförmig und zystisch zu sein, anstatt knospen und differenziert. Um dies zu erreichen, kann Wnt hyperaktiviert werden, indem die Menge des Wnt-Liganden R-Spondin in den Medien erhöht und Nicotinamid in die Medien aufgenommen wird, was nachweislich die Organoidbildung und das Zellüberleben in mehreren Kultursystemen unterstützt30,31. Abbildung 3A zeigt eine gesunde Organoidkultur nur 2 Tage nach dem Auftauen. Die Aufnahme von BSA in die Medien während des Auftauens hat auch zum Überleben von Darmorganoidkulturen von Ratten beigetragen, die sich als empfindlicher erwiesen haben als Darmorganoide von Mäusen.
Während die 3D-Organoidkultur oft bevorzugt wird, weil sie einen Teil der normalen Darmarchitektur rekapituliert, macht sie andere Ansätze, einschließlich Live-Bildgebung, Transfektionen und lentivirale Transduktionen, technisch schwieriger. Die Verwendung von 2D-Monoschichten, die aus 3D-Organoiden32 (Abbildung 4) erzeugt werden, ermöglicht eine effizientere Einführung der Plasmide. Während 3D-Darmorganoide traditionell resistent gegen transiente Transfektionen sind, können Plasmide, die für EGFP kodieren, mit Hilfe von lipidbasierten Transfektionsmethoden erfolgreich eingeführt werden. Der kostengünstigste Ansatz unter Verwendung von PEI wird in Schritt 6.1 (Abbildung 5) beschrieben, aber auch die Elektroporation und kommerziell erhältliche Transfektionsreagenzien haben zu vergleichbaren Ergebnissen geführt (Daten nicht gezeigt). Zukünftige Studien werden sich darauf konzentrieren, ob diese Ansätze genutzt werden können, um CRISPR-Konstrukte in Monoschichten einzubringen.
Es war wichtig, 3D-Organoide aus 2D-Monolayern nach der Transfektion so reformieren zu können, dass sie als passierbare Linie mit 3D-Architekturkomponenten von Krypten erhalten werden können. Interessanterweise bildeten sich 2D-Monoschichten, die auf dem EME plattiert waren, leicht in kleine Sphäroide um, wenn EME wieder an die Oberseite der Zellen gegeben wurde, während ein Kollagen-I-Substrat für die Neubildung von 3D-Strukturen nicht ausreichte (Abbildung 6).
Während transiente Transfektionen für viele Studien nützlich sind, ist die Bildung stabiler Linien oft nützlicher und erfordert die Einführung von Lentiviren in die Zellen. Darmorganoide von Ratten wurden mit Lentiviren infiziert, indem zuvor veröffentlichte Protokolle modifiziert wurden (Abbildung 7). Ein wichtiger Schritt im Protokoll ist der Aufschluss von Organoiden in kleine Aggregate oder Zellcluster. Wenn Kulturen nicht effizient aufgebrochen werden und Organoide intakt bleiben, gelangen die lentiviralen Partikel nicht in die Zellen. Nach der Infektion müssen sich die Organoide erholen und nachwachsen. Das hier beschriebene Protokoll ermöglicht die Aufnahme von Viruspartikeln durch 10%-48% (Mittelwert: 19,4% ± 6,5%) der Zellen vor der Selektion.
Die Whole-Mount-Färbung von Organoiden kann sich aufgrund der unvollständigen Entfernung von EME-Rückständen oder der unvollständigen Antikörperpenetranz als schwierig erweisen. Das hier beschriebene Protokoll ermöglicht die robuste Färbung von Organoiden. Auch die Visualisierung von Organoiden auf einem konfokalen Mikroskop kann sich als schwierig erweisen, wenn sie zu weit vom Deckglas entfernt sind. Durch die Verwendung von VALAP wird eine Vertiefung mit einer gewissen Höhe erzeugt, so dass Organoide nicht durch das Deckglas zerquetscht werden, sich aber dennoch in der Nähe des Deckglases absetzen können, um die Bildgebung zu erleichtern. Die repräsentative Färbung gegen den apikalen Anionenkanal, den Mukoviszidose-Transmembran-Leitfähigkeitsregulator (CFTR) und Phalloidin zur Markierung von F-Aktin ist in Abbildung 8 dargestellt.
Schließlich haben Organoide einen Nutzen in funktionellen Assays. Patienten-Organoide von Mukoviszidose-Patienten wurden verwendet, um die CFTR-Funktion zu screenen, da die Behandlung mit dem cAMP-Agonisten Forskolin eine robuste CFTR-vermittelte Flüssigkeitssekretion induziert, die eine Organoidschwellung verursacht 29,33-37. Ein Ziel dieser Arbeit war es, ein Organoidmodell zu identifizieren und zu entwickeln, das parallel zu präklinischen in vivo Studien verwendet werden kann. Daher wollten wir herausfinden, ob die Darmorganoide der Ratte eine Forskolin-induzierte Schwellung aufweisen. In der Tat schwoll die Ratten-Organoide innerhalb von 30 Minuten nach der Behandlung mit Forskolin an, wobei eine maximale Wirkung von 120 Minuten beobachtet wurde (Abbildung 9).
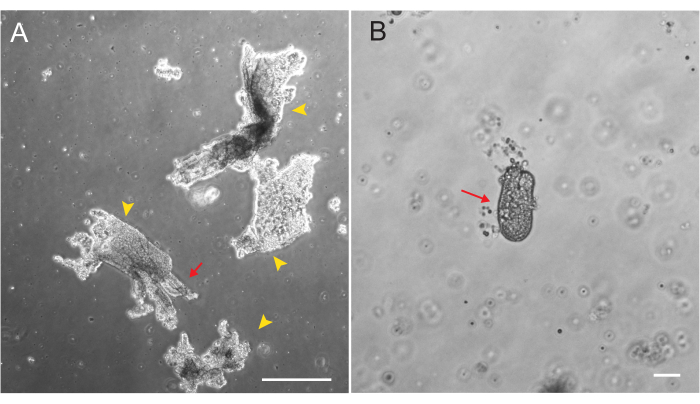
Abbildung 1: Villar-Fragmente und Krypten während der epithelialen Isolation. (A) Repräsentatives Bild von Villar-Fragmenten in EDTA-Lösung während des Kryptenisolationsprotokolls. Gelbe Pfeilspitzen markieren Villar-Fragmente. Rote Pfeile zeigen Krypten, die an einem Villar-Fragment befestigt sind. Beachten Sie den Unterschied in den relativen Größen. (B) Bild einer einzelnen Krypta mit höherer Vergrößerung (roter Pfeil), damit die Morphologie visualisiert werden kann. Maßstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
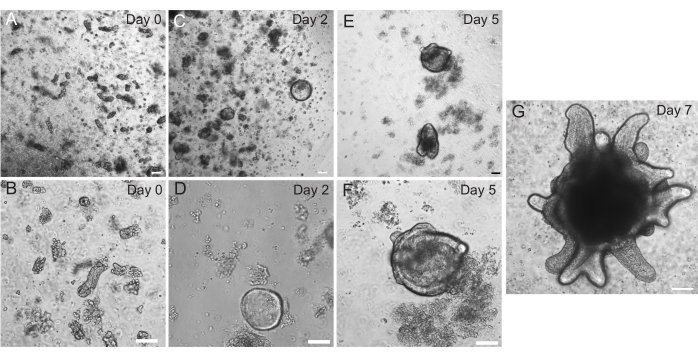
Abbildung 2: Progression der Organoide im Darm der Ratte. Die Krypten des Ratten-Jejunums wurden unmittelbar nach der Isolierung in EME plattiert (A,B). Innerhalb von 2 Tagen wurden die Krypten zu Sphäroiden (C,D). Am 5. Tag begannen sie, Kryptenknospen (E,F) zu initiieren, die sich bis zum 7. Tag (G) entwickelten und wuchsen. Maßstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
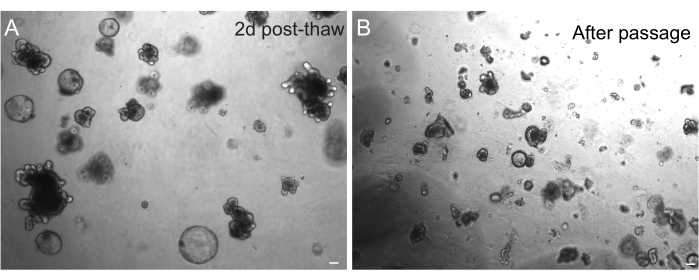
Abbildung 3: Organoide nach dem Auftauen und der Passage. (A) Die jejunalen Organoide der Ratte wurden nach der Kryokonservierung gemäß den beschriebenen Protokollen aufgetaut. Man beachte das Vorhandensein von Sphäroiden und knospigen Organoiden nur 2 Tage nach dem Auftauen. (B) Die gleiche Organoid-Linie, die in A dargestellt ist, unmittelbar nach der Passage gemäß dem beschriebenen Protokoll. Man beachte den relativen Größenunterschied zwischen Strukturen in A und B und das Vorhandensein einzelner kryptenähnlicher Domänen in B. Maßstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
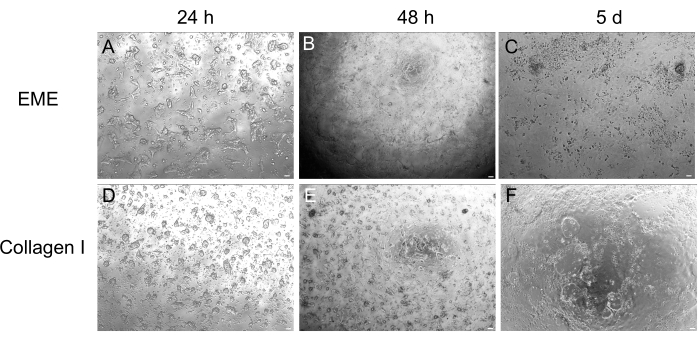
Abbildung 4: 2D-Monolayer-Bildung aus 3D-Organoiden. (A-C) 2D-Monolayer-Progression auf EME. (D-F) 2D-Monolayer-Progression auf Kollagen I. An Tag 5 ergab jede Bedingung eine ~80%ige Konfluenz. Maßstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
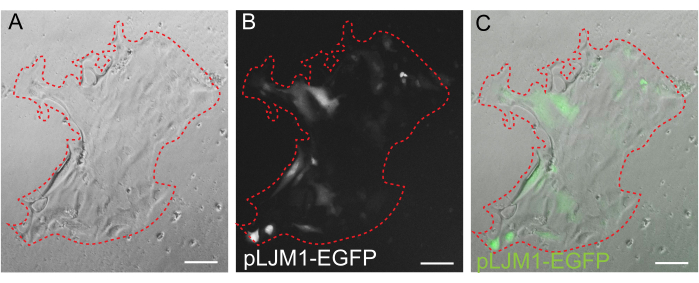
Abbildung 5: Transiente Transfektion einer 2D-Monoschicht. Repräsentatives Bild einer 2D-Monoschicht, die auf EME gewachsen ist und transient mit pLJM1-EGFP-Plasmid unter Verwendung von PEI transfiziert wurde. (A) Hellfeld, (B) Fluoreszenz (GFP), (C) Überlagerung. Die gestrichelte rote Linie markiert die Monolayer-Grenze. Maßstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
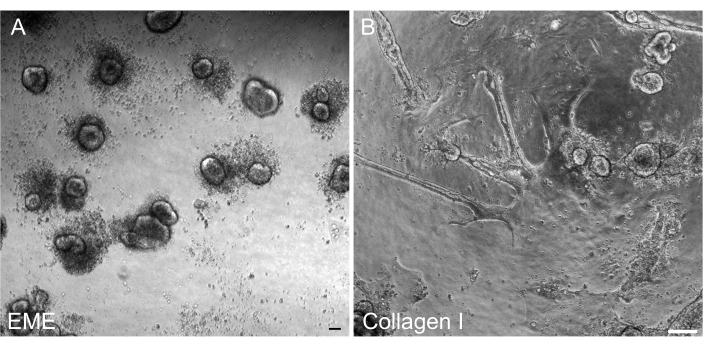
Abbildung 6: Reformation von 3D-Organoiden aus 2D-Monolayern auf EME. (A) Bildung von 3D-Organoiden aus 2D-Monolayern, die auf EME gewachsen sind. Organoide werden 5 Tage nach Zugabe von EME auf der apikalen Oberfläche der Monoschicht effizient gebildet. Man beachte die Fülle an toten Zellen, die die kleinen 3D-Sphäroide umgeben. (B) Persistenz von 2D-Monoschichten 5 Tage nach Zugabe von Kollagen I zur apikalen Oberfläche von 2D-Monoschichten, die auf Kollagen I gewachsen sind. Maßstabsbalken: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
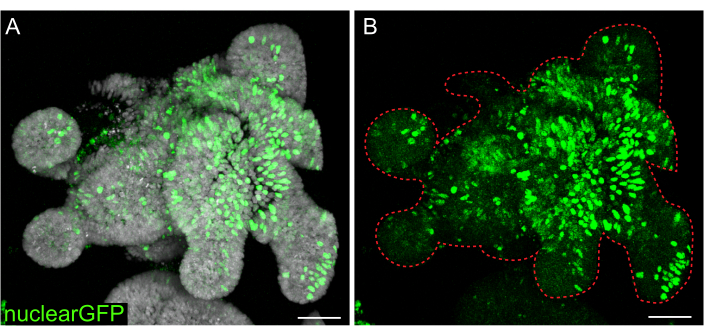
Abbildung 7: Lentivirale Infektion von 3D-Organoiden. Die Jejunum-Organoide der Ratte wurden unter Verwendung des beschriebenen Protokolls mit lentiviralen Partikeln aus dem Kern-GFP infiziert. Nach Erholung und Wachstum für 5 Tage wurden die Organoide fixiert und mit DAPI gegengefärbt. (A) DAPI: grau; nuklearGFK: grün. (B) nukleares GFP: grün. Die gestrichelte rote Linie markiert die Organoidgrenze. Maßstabsleisten: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
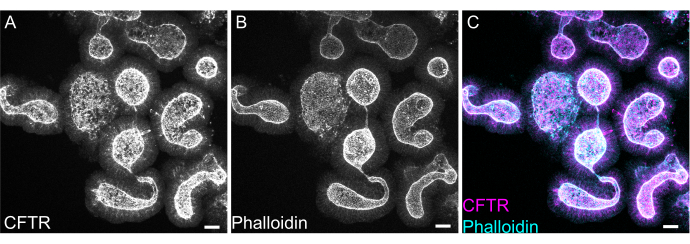
Abbildung 8: Immunfluoreszenz des gesamten Mounts von Darmorganoiden der Ratte. (A) CFTR, (B) Phalloidin und (C) verschmolzene Immunfluoreszenz von jejunalen Organoiden der Ratte. Man beachte die apikale Anreicherung der CFTR-Färbung in Organoiden (grau in A, magenta in C). Phalloidin markiert F-Aktin und markiert prominent den apikalen Pinselrand (grau in B, Cyan in C). Maßstabsleisten: 25 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
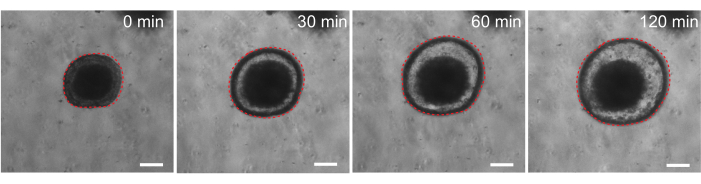
Abbildung 9: Die Darmorganoide der Ratte schwellen nach Forskolin-Stimulation an. Repräsentativer zeitlicher Verlauf der Schwellung des Darmorganoids der Ratte nach Zugabe des cAMP-Agonisten Forskolin. Die 0-Minuten-Zeit stellt den Zeitpunkt unmittelbar vor der Zugabe von 10 μM Forskolin dar. Die Bilder zeigen das gleiche Organoid in Zeitintervallen von 30 Minuten. Die maximale Schwellung wurde 120 min nach der Zugabe von Forskolin beobachtet. Die gestrichelte rote Linie umreißt die Organoidgrenze. Das dunkle Material in der Mitte des organoiden Lumens besteht aus abgestorbenen Zellen. Maßstab: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: AdDMEM+ Rezept. Zutaten für die Herstellung der Standard-AdDMEM+-Medien, die die Basismedien für die hier gezeigten Methoden sind. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Rezept für intestinale organoide Medien (rIOM) der Ratte. Detailliertes Rezept der organoiden Standardmedien für den Darm der Ratte, einschließlich Lösungsmittel und Lagerbedingungen für rekombinante Proteine. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Lösungen. Rezepte und Anweisungen zur Herstellung anderer Lösungen, die im gesamten Protokoll verwendet werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 4. Ratten-Darm-Organoid-Medium für 2D-Monolayer-Kultur (rIOM2D). Modifizierte Rezeptur von organoiden Nährmedien, die für das 2D-Wachstum von Monolayern optimiert sind. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die Entwicklung eines Ratten-Darm-Organoid-Modells bewahrt wichtige funktionelle Eigenschaften, die im Organ in vivo gefunden wurden, und ist ein vielversprechendes Werkzeug für präklinische Tests, Wirkstoff-Screenings und funktionelle Assays. Dieses In-vitro-Modell kann parallel zu präklinischen gastroenterologischen In-vivo-Studien verwendet werden, für die Ratten aufgrund ihrer größeren Darmgröße, ihrer gemeinsamen physiologischen Aspekte und in einigen Fällen aufgrund ihrer besseren Krankheitsmodelle oft ein bevorzugtes Modell sind38. Hier wird ein robustes Schritt-für-Schritt-Protokoll für die Isolierung von Ratten-Darmkrypten, die Generierung und Langzeitkultur von Ratten-Darm-Organoiden sowie Downstream-Anwendungen wie funktionelle Forskolin-Schwellungsassays, Whole-Mount-Immunfluoreszenz, 2D-Monolayer-Kultur und lentivirale Genmanipulation skizziert. Darmorganoide von Ratten sind wahrscheinlich in vielen Krankheitskontexten relevant, in denen die Pathophysiologie von Mausmodellen unangemessen ist, und können im Vergleich zu Maus-Darmorganoiden ein besseres Modell für die menschliche Darmphysiologie darstellen.
Um langlebige Organoidkulturen zu etablieren, die durchgelassen und expandiert werden können, ist es wichtig, die wichtigsten Wachstumsfaktoren zu identifizieren, die für die Aufrechterhaltung der intestinalen Epithelproliferation erforderlich sind. Maus-Organoide werden am häufigsten in einem einfachen Cocktail aus EGF, R-Spondin und Noggin gezüchtet, obwohl berichtet wurde, dass Noggin für die Darm-Organoid-Kultur nicht notwendig ist39. Konditionierte Medien können rekombinante Wachstumsfaktoren ersetzen, und die am häufigsten verwendeten Zelllinien sind L-WRN, das Wnt3a-, Rspondin-3- und Noggin-39-, L-Wnt3a- und HA-Rspondin1-Fc-293T-Zellensezerniert 40. L-WRN-konditionierte Medien sind ausreichend, um nicht nur das Wachstum von Organoiden im Darm von Mäusen zu unterstützen, sondern auch das Wachstum von Darmorganoidenvon verschiedenen Nutztieren und Haustieren, einschließlich Hunden, Katzen, Hühnern, Pferden, Kühen, Schafen und Schweinen12. Menschliche Darmorganoide unterscheiden sich jedoch stark in ihren Anforderungen an Wachstumsfaktoren, da sie für ihre Expansionswachstumsphase (d. h. die Progression von kleinen zu großen Sphäroide) im Vergleich zu ihrer Differenzierungsphase (d. h. die Erzeugung und Reifung differenzierter Zelltypen) unterschiedliche Medienformulierungen benötigen10. Die Medienanforderungen von Ratten-Darm-Organoiden ähneln denen der Expansionswachstumsmedien für menschliche Darm-Organoide, aber bemerkenswerterweise sind Ratten-Organoide in der Lage, in dieser Medienumgebung sowohl zu wachsen als auch zu differenzieren, was ihre Kulturanforderungen erheblich vereinfacht. Während sich unsere ersten Versuche auf die Etablierung und Züchtung von Ratten-Darm-Organoiden in L-WRN-konditionierten Medien konzentrierten, war die Langzeitkultur schwach und die Ratten-Darm-Organoidlinien litten unter einem Mangel an Robustheit (Daten nicht gezeigt). Dies könnte daran liegen, dass L-WRN-Zelllinien so konstruiert sind, dass sie R-Spondin 3 sezernieren, während die hier empfohlene 293T-Rspo1-Zelllinie so konstruiert ist, dass sie R-Spondin 1 sezerniert. Es ist möglich, dass Ratten- und Humanorganoide R-Spondin 1 bevorzugen, was möglicherweise für das Versagen von Ratten-Organoidlinien in L-WRN-konditionierten Medien verantwortlich ist.
Um die In-vivo-Umgebung möglichst genau zu rekapitulieren, ist es wichtig, organoide Kulturbedingungen zu entwickeln, die das Überleben, die Erhaltung und die Proliferation von Stammzellen ermöglichen und die den Zellumsatz und die gleichzeitigen Differenzierungsereignisse in diskrete Zelltypen aufrechterhalten können. Daher müssen die Konzentrationen von rekombinanten Proteinen und/oder Proteinen in konditionierten Medien streng titriert und kontrolliert werden, um dieses perfekte Gleichgewicht zu erreichen. Insbesondere ein optimaler Wnt-Spiegel ist unerlässlich, um den Verlust von Darmorganoidkulturen zu vermeiden. Zu wenig Wnt in konditionierten Medien ist nicht in der Lage, das Wachstum zu unterstützen, was zu einem Verlust von Stammzellen und anschließendem Absterben von Organoiden führt. Eine Überaktivierung von Wnt führt dazu, dass Organoide zystisch und undifferenziert sind10. Obwohl hier nicht näher beschrieben, wird dringend empfohlen, jede Charge von L-Wnt3a- und 293T-Rspo1-konditionierten Medien mit einem Wnt-Reporter-Luciferase-Assay, wie z. B. einer Topflash-Zelllinie41, zu testen. Frühere Studien haben beschrieben, dass eine optimale Charge von L-Wnt3a-Medien zu einer 15-fachen Signalerhöhung bei 12,5 % und einer 300-fachen Signalerhöhung bei 50 % führen sollte, verglichen mit 1 % L-Wnt3a10. Da Ratten-Organoide empfindlicher auf Kulturanforderungen reagieren als Maus-Organoide, insbesondere auf die Wnt-Aktivierungswerte, tragen diese zusätzlichen Qualitätskontrollschritte erheblich dazu bei, die Robustheit und Zuverlässigkeit von Ratten-Organoidkulturen zu verbessern. Da eine ähnliche Reporterlinie nicht für die Prüfung der Bmp-Aktivität und der relativen Noggin-Konzentrationen in Noggin-konditionierten Medien zur Verfügung steht, ist es ratsam, nach Möglichkeit rekombinantes Noggin zu verwenden, um den Noggin-Spiegel genau zu kontrollieren. Während Maus-Darm-Organoide in Abwesenheit von Noggin39 gezüchtet und erhalten werden können, wurde dies für Darm-Organoid-Kulturen von Ratten nicht versucht.
Abgesehen von den Anforderungen an die Zellkultur hängt die erfolgreiche Etablierung einer Ratten-Organoidlinie entscheidend von der effizienten Depletion differenzierter Zotten während der Kryptenisolierung ab. Ein hohes Maß an Villar-Kontamination führt zum Tod der Krypta, vermutlich aufgrund von Signalen der sterbenden Zellen oder der Sequestrierung wesentlicher Faktoren. Um diese differenzierten Zotten präzise und konsistent aus Epithelpräparaten zu entfernen, empfiehlt es sich, Epithelisolierungen mit Hilfe eines Stereoskops durchzuführen. Die visuelle Untersuchung des freigesetzten Epithels liefert einen klaren Hinweis darauf, wann das PBS verworfen und ersetzt werden muss (Abbildung 1). Krypten sollten erst dann gesammelt werden, wenn die Zotten ausreichend erschöpft sind. Villar-Zellen sind terminal, differenziert und können in Kultur keine Organoide bilden. Darüber hinaus erfordert die anschließende Passage von Ratten-Darmorganoiden und ihre Verwendung für nachgelagerte Anwendungen sorgfältige Sorgfalt. Die Inkubation in Dissoziationsreagenzien über einen längeren Zeitraum (10 min) führt zu einem signifikanten Zelltod und Verlust der Organoidlinie.
Hier wird ein einfaches und schnelles Protokoll zur Erzeugung von Darmmonolayern aus Ratten-Organoiden beschrieben. EME- und Kollagen-I-Substrate haben unterschiedliche Wirkungen auf das Epithel, die je nach Zweck der Studie genutzt werden können. EME ermöglicht die schnelle und effiziente Adhäsion einzelner Zellen und die Bildung von Zellfortsätzen. Im Gegensatz dazu verzögert die Beschichtung der Oberfläche mit Kollagen I diese Prozesse. Sobald Monolayer eine Konfluenz von etwa 80 % erreicht haben, beginnen die auf EME gezüchteten Zellen wieder, 3D-Organoidstrukturen zu erzeugen. Es fehlt ihnen jedoch an ausreichender physikalischer und chemischer Unterstützung für weiteres Wachstum. Dieser Rückfall in den organoiden Zustand kann verhindert werden, indem Monolagen in EME bei einer Konfluenz von 50%-80% gehalten werden. Die Zugabe von verdünntem EME zur apikalen Oberfläche von Monolagen fördert die schnelle Rückgewinnung und Bildung von de novo Organoiden, wodurch Konvergenzregionen schneller und leichter erzeugt werden. Auf einer Kollagen-I-Oberfläche können Zellen eine gleichmäßige Monoschicht bilden und kleine Cluster bilden. Die Zugabe von Kollagen I auf Monolagen reicht jedoch nicht aus, um die Bildung von Organoiden zu induzieren. EME muss bei der Zugabe zur Monoschichtoberfläche verdünnt werden, da es einen stärkeren mechanischen Widerstand für das entstehende Organoid gibt, den es zu überwinden gilt. Dieses verdünnte EME erlaubt jedoch nicht die robuste Bildung großer Organoide. Alle de novo erzeugten Rattenorganoide, die sich auf natürliche Weise von der Oberfläche lösen, müssen sofort entfernt und in unverdünntes EME überführt werden, damit die strukturelle Unterstützung und das Wachstum wiederhergestellt werden können. Aufgrund der geringen Größe der Organoide in diesem Schritt wird die Passage von Organoiden erst empfohlen, wenn ein robustes Wachstum etabliert ist. Die zugrundeliegende biologische Bedeutung, warum EME die Neubildung von Organoiden unterstützen kann, aber ob Kollagen I dies kann oder nicht, ist nicht klar. Es gibt jedoch Berichte, dass Zellen, die in 3D-Kollagen gezüchtet wurden, keine knospigen Organoidebilden können 42,43 oder die langfristige Aufrechterhaltung unterstützen. Kommerziell erhältliche EME-Produkte sind heterogene Mischungen extrazellulärer Proteine, vor allem Laminin und Kollagen IV44. Daher könnten die unterschiedliche Zusammensetzung der Proteine und die Fähigkeit einer Epithelzelle, sich mit der extrazellulären Matrix unter Verwendung verschiedener zellulärer Komplexe zu verbinden, einen Umbau in EME, aber nicht Kollagen I ermöglichen. Ob Kollagen-I-abgeleitete Monoschichten in EME eingebracht werden können, um die Bildung und das Wachstum von Organoiden zu unterstützen, wurde nicht getestet.
Die genetische Manipulation des Darm-Organoid-Modells der Ratte wird hier beschrieben, und Protokolle für die lentivirale Transduktion von 3D-Organoiden und die transiente Transfektion von 2D-Monolayern werden skizziert. Um die geringe Effizienz der lentiviralen Organoid-Transduktion zu überwinden, wurde ein Protokoll für die transiente Transfektion von 2D-Monolayern entwickelt. Die flache Morphologie und die freigelegten apikalen Domänen von Monolayern ermöglichen einen leichteren Zugang zu Viren und DNA-haltigen Komplexen. Für die Validierung dieser Technik wurde die Expression eines EGFP-Reporters unter Verwendung des pLJM1-EGFP-Vektors verwendet. Die GFP-Reporterexpression wurde nach 24 h beobachtet und für 5-6 Tage in Monolagen aufrechterhalten. Zukünftige Studien, die sich auf die lentivirale Transduktion von Monolayern konzentrieren, werden wahrscheinlich eine höhere Effizienz aufweisen als die 3D-Organoid-Transduktion. Mit den oben genannten Protokollen können 3D-Organoide aus infizierten 2D-Monoschichten reformiert werden, um die Erstellung stabiler Linien zu erleichtern. Mit Vorsicht können die Darmorganoidlinien der Ratte über ein Jahr lang erfolgreich aufrechterhalten werden, über viele Passagen hinweg stabil bleiben, kryokonserviert, erfolgreich aufgetaut und durch lentivirale Transduktion genetisch modifiziert werden, wodurch der Bedarf an einem zugänglichen und handhabbaren In-vitro-Darmorganoidmodell gedeckt wird, das für den Menschen physiologisch relevant bleibt.
Offenlegungen
Nichts.
Danksagungen
Wir danken den Mitgliedern der Laboratorien Sumigray und Ameen für ihre aufmerksamen Diskussionen. Diese Arbeit wurde durch einen Zuschuss der Charles H. Hood Foundation für Kindergesundheit und einen Zuschuss der Cystic Fibrosis Foundation (004741P222) an KS und durch das National Institute of Diabetes and Digestive and Kidney Diseases der National Institutes of Health an NA unter der Fördernummer 2R01DK077065-12 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes/Thermo Fisher | D1306 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
Referenzen
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.