Method Article
יצירה ומניפולציה של אורגנואידים במעיים של חולדות
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים פרוטוקול ליצירת אורגנואידים במעיים של חולדות ומשתמשים בהם במספר יישומים במורד הזרם. חולדות הן לעתים קרובות מודל פרה-קליני מועדף, ומערכת אורגנואיד המעי החזקה ממלאת את הצורך במערכת חוץ גופית שתלווה מחקרי vivo .
Abstract
כאשר משתמשים באורגנואידים כדי להעריך פיזיולוגיה והחלטות לגבי גורל התא, חשוב להשתמש במודל שחוזר מקרוב בהקשרים של in vivo . בהתאם לכך, אורגנואידים שמקורם בחולה משמשים למידול מחלות, גילוי תרופות וסינון טיפול מותאם אישית. אורגנואידים של עכברי מעיים משמשים בדרך כלל להבנת היבטים של תפקוד המעי / פיזיולוגיה ודינמיקה של תאי גזע / החלטות גורל. עם זאת, בהקשרים רבים של מחלות, חולדות מועדפות לעתים קרובות על עכברים כמודל בשל הדמיון הפיזיולוגי הגדול יותר שלהן לבני אדם במונחים של פתופיזיולוגיה של מחלות. מודל החולדות הוגבל בשל מחסור בכלים גנטיים זמינים in vivo, ואורגנואידים של חולדות במעיים הוכחו כשבריריים וקשים לתרבית לטווח ארוך. כאן, אנו מתבססים על פרוטוקולים שפורסמו בעבר כדי ליצור אורגנואידים של חולדות מהתריסריון והג'ג'ונום. אנו מספקים סקירה כללית של מספר יישומים במורד הזרם המשתמשים באורגנואידים של מעי חולדות, כולל בדיקות נפיחות פונקציונליות, צביעת הר שלם, יצירת חד-שכבות אנטרואידים דו-ממדיות והתמרה לנטיוויראלית. מודל אורגנואיד החולדות מספק פתרון מעשי לצורך של השדה במודל in vitro השומר על רלוונטיות פיזיולוגית לבני אדם, ניתן למניפולציה גנטית מהירה, וניתן להשיגו בקלות ללא המחסומים הכרוכים ברכישת אורגנואידים במעי אנושי.
Introduction
ארכיטקטורת אפיתל המעי הדק האנושית והרכב התאים מורכבים, ומשקפים את תפקודיהם הפיזיולוגיים. תפקידו העיקרי של המעי הדק הוא לספוג חומרים מזינים מהמזון העובר דרך לומן1. כדי למקסם את הפונקציה הזו, פני השטח של המעי מאורגנים בבלטות דמויות אצבע שנקראות וילי (villi), המגדילות את שטח הפנים הספיגה, ובליטות דמויות הנקראות קריפטות (crypts), המאחסנות ומבודדות את תאי הגזע. בתוך האפיתל נוצרים סוגים שונים של תאי ספיחה והפרשה מיוחדים לביצוע פונקציות נפרדות1. בגלל מורכבות זו, היה קשה למדל רקמות כמו המעי בקווי תאים אימורטליים בעלי מעבר גבוה. עם זאת, המחקר של תאי גזע, במיוחד תאי גזע בוגרים ומנגנוני ההתמיינות שלהם, איפשר התפתחות של תרביות אורגנואידים במעי 3D. השימוש במודלים אורגנואידים שינה את התחום, בין השאר בשל הסיכום שלהם של כמה מרכיבים אדריכליים והטרוגניות סוג התא שנמצאו במעי השלם. אורגנואידים במעיים יכולים להיות בתרבית לטווח ארוך במבחנה עקב שמירה על אוכלוסיית תאי גזע פעילה2.
אורגנואידים במעיים הפכו במהירות למודל הסתגלות לחקר ביולוגיה של תאי גזע, פיזיולוגיה של התא, מחלות גנטיות ותזונה3,4, כמו גם כלי לפיתוח שיטות חדשות למתן תרופות5. בנוסף, אורגנואידים שמקורם בחולים משמשים למידול מחלות, גילוי תרופות וסינון טיפול מותאם אישית, בין היתר 6,7,8,9. עם זאת, אורגנואידים במעיים אנושיים עדיין מציבים אתגרים. זמינות רקמות, דרישות לאישור ועדת ביקורת מוסדית וסוגיות אתיות מגבילות את השימוש הנרחב בדגימות אנושיות. בנוסף, אורגנואידי מעיים אנושיים הנוצרים מקריפטות מעיים דורשים שני תנאי תרבית נפרדים לשמירה על תאי גזע לא ממוינים או כדי לגרום להתמיינות של סוגי תאים בוגרים10. זאת בניגוד ל-in vivo, שבו תאי גזע וסוגי תאים ממוינים בוגרים נוכחים בו זמנית ונוצרים/מתוחזקים ברציפות1. מצד שני, אורגנואידי מעיים של עכברים, הגדלים בקוקטייל פחות מורכב של גורמי גדילה, אינם דורשים את המתג הזה בהרכב המדיה ויכולים לשמור על תאי גזע ותאים ממוינים באותו הקשר מדיה 2,11. עם זאת, הבדלים עיקריים במעי עכבר בהשוואה לבני אדם יכולים להפוך אורגנואידים של עכברים למודל לא אופטימלי במקרים רבים. באופן כללי, אורגנואידי מעיים רבים מיונקים גדולים יותר, כולל סוסים, חזירים, כבשים, פרות, כלבים וחתולים, נוצרו בהצלחה בתנאי תרבית המיושרים יותר עם אורגנואידים של מעי עכברים מאשר תנאי התרבית של אורגנואידי מעיים אנושיים12. ההבדלים בתנאי גורם הגדילה בין אורגנואידים עכבריים לבני אדם משקפים ככל הנראה הבדלים בהרכב נישות תאי גזע ודרישות שונות להישרדות, שגשוג ותחזוקת תאי גזע. לכן, יש צורך במערכת אורגנואידים מודל נגישה ש-1) דומה מאוד להרכב תאי המעי האנושי, 2) מכילה תאי גזע עם דרישות לגורמי גדילה כמו אלה של אורגנואידים אנושיים במעי, ו-3) מסוגלת לשמור ברציפות על תאים לא ממוינים ומובחנים. באופן אידיאלי, המערכת תהיה ממודל נפוץ של בעלי חיים פרה-קליניים, כך שניתן יהיה לתאם ניסויים in vivo ו-in vitro ולהשתמש בהם במקביל.
חולדות הן מודל פרה-קליני נפוץ למחקרים בפיזיולוגיה של המעי ובפרמקולוגיה בשל פיזיולוגיה וביוכימיה של המעי הדומות מאוד שלהן לבני אדם13, במיוחד בכל הנוגע לחדירות מעיים14. גודלם הגדול יחסית בהשוואה לעכברים הופך אותם לנוחים יותר להליכים כירורגיים. בעוד שלעתים משתמשים במודלים של בעלי חיים גדולים, כולל חזירים, חולדות הן מודל זול יותר, דורשות פחות מקום לגידול, ויש להן זנים סטנדרטיים זמינים מסחרית15. החיסרון בשימוש במודלים של חולדות הוא שערכת הכלים הגנטית למחקרי in vivo אינה מפותחת היטב בהשוואה לעכברים, ויצירת קווי חולדות חדשניים, כולל נוקאאוטים, נוק-אין ומהונדסים, היא לעתים קרובות יקרה. פיתוח ואופטימיזציה של מודל אורגנואיד מעיים חזק של חולדות יאפשר מניפולציה גנטית, טיפולים תרופתיים ומחקרי תפוקה גבוהה יותר במודל נגיש השומר על רלוונטיות פיזיולוגית מרכזית לבני אדם. עם זאת, היתרונות של מודל אורגנואיד מכרסם אחד לעומת אחר תלויים מאוד בתהליך או בגן מסוים הנחקר; גנים מסוימים הנמצאים בבני אדם עשויים להיות פסאודוגנים בעכברים, אך לא בחולדות16,17. בנוסף, תת-סוגים ספציפיים של תאים נחשפים יותר ויותר על ידי RNAseq18,19,20 של תא יחיד. לבסוף, מודלים של מחלות מעיים של חולדות ועכבר מציגים לעתים קרובות שינויים ניכרים בפנוטיפים21,22 כך שיש לבחור את המודל המשחזר באופן הדוק יותר את הסימפטומים ואת תהליך המחלה הנראים בבני אדם לעבודה במורד הזרם. יצירת מודל אורגנואיד מעיים של חולדה מספקת גמישות נוספת ובחירה לחוקרים בבחירת מערכת המודל המתאימה ביותר לנסיבות חייהם. כאן, פרוטוקולים קיימים23,24 מורחבים לייצור אורגנואידים במעי חולדות ומתואר פרוטוקול ליצירה ותחזוקה של אורגנואידים במעי חולדות מהתריסריון או הג'ג'ונום. בנוסף, מתוארים מספר יישומים במורד הזרם, כולל זיהום לנטיויראלי, צביעת הר שלם ומבחני נפיחות פורסקולין.
Protocol
הערה: יש לטפל בכל תרביות התאים בטכניקה אספטית נכונה בתרבית רקמה. כל עבודות בעלי החיים במחקר זה אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של ייל (IACUC).
1. הכנת ריאגנטים של תרבית תאים
- הכן מדיה מותנית R-spondin 1 בהתאם להוראות היצרן. הכן מדיה מותנית Wnt3a בהתאם להוראות היצרן. הכינו את AdDMEM+ כמתואר בטבלה 1.
- להשהות גסטרין ב dHסטרילי 2O כדי להכין מלאי 100 מיקרומטר. Aliquot ולאחסן ב -80 °C. להשהות N-אצטיל-ציסטאין במים סטריליים כדי להכין מלאי 100 mM. Aliquot ולאחסן ב -20 °C עד 1 חודש.
- השהה מחדש נוגין אנושי רקומביננטי במי מלח חוצצים פוספט (PBS) + אלבומין בסרום בקר 0.1% (BSA) להכנת ציר של 250 מיקרוגרם/מ"ל. Aliquot ולאחסן ב -80 °C. השהה מחדש גורם גדילה אפידרמיס רקומביננטי של עכבר (EGF) ב- PBS + 0.1% BSA להכנת מלאי של 100 מיקרוגרם / מ"ל. Aliquot ולאחסן ב -80 °C.
- לדלל רקומביננטי אנושי IGF-1 ב PBS + 0.1% BSA כדי להכין מלאי 100 מיקרוגרם / מ"ל. Aliquot ולאחסן ב -80 °C. השהה מחדש FGF-2 אנושי רקומביננטי ב- 5 mM Tris, pH 7.6, כדי להכין מלאי של 100 מיקרוגרם/מ"ל. Aliquot ולאחסן ב -80 °C.
הערה: עבור כל גורמי הגדילה, השתמש בדילול ביניים ב- PBS + 0.1% BSA עד פי 100 מהריכוז הסופי במדיה התרבותית. יש לאחסן בטמפרטורה של -20°C.
2. הקמת אורגנואידים של חולדה במעי הדק
הערה: פרוטוקול זה שונה משני פרוטוקולים שפורסמו בעבר עבור אורגנואידים של מעי חולדות23,24.
- הכינו חומר אורגנואיד מעיים של חולדות (rIOM) לפי טבלה 2 וכוונו אמבט מים לטמפרטורה של 37°C. מדיום שלם זה יציב במשך 5 ימים ב 4 °C (75 °F).
- הכינו 10 מ"ל של חומצה אתילאנדיאמין-טטראצטית (EDTA) ב-PBS בצינור חרוטי של 15 מ"ל ושמרו על קרח. הפשירו 250 μL של תמצית מטריצה חוץ-תאית (EME) על קרח.
- צום חולדה לילה עם גישה למים ad libitum. הרדימו את החולדה בהתאם לפרוטוקול שאושר על ידי IACUC. בפרוטוקול זה, חולדות Sprague Dawley זכרים בוגרים (במשקל ~200 גרם) הומתו באמצעות שאיפת CO2 (טבלה של חומרים). נקע צוואר הרחם שימש כשיטה משנית להמתת חסד.
- השתמש במלקחיים אוטומטיים סטריליים ובמספריים לדיסקציה לדיסקציה. הניחו את החולדה המורדמת על משטח הדיסקציה בצד הגחוני כלפי מעלה. צבוט את שכבת העור עם מלקחיים; החתכים הבאים צריכים להיעשות בגובה פני השטח, ולכן הם רק חותכים דרך שכבת העור הזו ולא עמוק מספיק כדי לפגוע באיברים פנימיים.
- כדי לפתוח את חלל הבטן, באמצעות מספריים דיסקציה גדולים וחדים, חותכים דרך שכבת העור בחתך גדול, אורכי, בגובה פני השטח במרכז הבטן. לאחר מכן, כתוצאה מחיתוך זה, בצע שני חתכים אופקיים קצרים יותר, אחד מכל צד. השתמש במלקחיים כדי לקלף את העור כדי לחשוף את חלל הבטן. לחתוך דרך קרום הצפק כדי לחשוף באופן מלא את האיברים הפנימיים בחלל הבטן עם גישה מוכנה למעי.
- בעזרת מספריים ומלקחיים, מאתרים את הקיבה ומזהים את התריסריון כ-2-3 ס"מ דיסטלי אליה, המופיע כמקטע צהבהב. הג'ג'ונום הפרוקסימלי ממוקם כ-4-5 ס"מ דיסטלי לרצועה של טרייץ, המשמשת כנקודת ציון בין התריסריון לג'ג'ונום.
- מניחים את שבר המעי המבודד לתוך צלחת פטרי 10 ס"מ. נקה את קטע המעי הרצוי של mesentery ככל האפשר. יש לשטוף ב-10 מ"ל של PBS קר כקרח עד לניקוי תכולת הלומינל. על מגבת נייר, לחתוך את קטע המעי לחתיכות ~ 2 ס"מ אורך. פתח כל פיסת מעיים לאורך כדי לחשוף את האפיתל.
- באמצעות שקופית מיקרוסקופ זכוכית, לגרד את המשטח המואר החשוף כדי להסיר villi. מניחים חתיכות מעיים לתוך תמיסת EDTA מוכן על קרח. סובב ב-4°C למשך 30 דקות על אקדח צינור המוגדר ל-10 סל"ד.
- במיקרוסקופ המנתח, יוצקים את תוכן הצינור החרוטי לצלחת פטרי בקוטר 10 ס"מ. הוסף עוד ~ 5 מ"ל של PBS קר כקרח.
- בעזרת מלקחיים עדינים, להחזיק קטע מעיים ולנער במרץ. ניתן יהיה לראות את שחרור האפיתל לתוך PBS. בתחילה, PBS יכיל בעיקר villi.
- המשיכו לרעוד. מעת לעת להשליך את PBS המכיל villi ולהוסיף 10 מ"ל של PBS טרי קר כקרח לשברי המעי. המשיכו לנער את השברים וחזרו על שלב השטיפה הזה עד שהווילי כבר לא ישוחרר ל-PBS, אלא במקום זאת ה-PBS מכיל בעיקר קריפטות. אין לחרוג מ-15 דקות לצורך בידוד קריפטה, כך שיכולת הקיום של התא לא תיפגע.
- השליכו את שברי המעי הנותרים. העשירו את ה-PBS הנותר בצלחת הפטרי עבור קריפטים במעיים. במכסה מנוע של תרבית רקמה, אספו את הקריפטות המכילות PBS וסננו דרך מסננת תאים של 70 מיקרומטר (טבלה של חומרים).
- צנטריפוגה ב 250 x גרם במשך 5 דקות. הסר את supernatant ו resuspend את הגלולה ב 5 מ"ל של AdDMEM+. צנטריפוגה שוב ב 250 x גרם במשך 5 דקות.
הערה: מומלץ להשתמש בצנטריפוגה עם רוטור דלי נדנדה. - הסר את supernatant, משאיר ~ 50 μL של מדיה עם הכדור. להשעות מחדש את הגלולה במדיה הנותרת ולהוסיף aliquot של EME על קרח. פיפטה בעדינות למעלה ולמטה כדי להשעות את הקריפטות באופן שווה לאורך EME. הימנעו מהחדרת בועות.
- צלחת 50 μL של כיפות EME לתוך צלחת תרבית רקמה 35 מ"מ ולדגור במשך 20 דקות ב 37 ° C, 5% CO2 אינקובטור תרבית רקמה.
- הוסף 2 מ"ל של rIOM (טבלה 2) המכיל 10 מיקרומטר Y27632 ו- 10 מיקרומטר CHIR99021 (טבלה 3). לאחר המעבר, ניתן להפסיק את הנסיעה ב־27632 יו' ואת CHIR99021.
- שנה את rIOM כל 2-3 ימים. מעבר לפי הצורך, בדרך כלל בין 3-7 ימים, תלוי במספר הראשוני של אורגנואידים, גודל, וקצב גדילה.
3. אורגנואידים במעיים של חולדות עוברות
- הפשירו אליקוט של 250 μL של EME על קרח וחממו מראש את ה-rIOM ל-37°C.
- שאפו את התווך מצלחת 35 מ"מ המכילה אורגנואידים והוסיפו 1 מ"ל של מגיב דיסוציאציה כדי לשחרר מיד את האורגנואידים מכיפות EME.
- מיד להעביר מגיב דיסוציאציה עם אורגנואידים מקוטעים לצינור חרוטי 15 מ"ל. שטפו את צלחת התרבית עם 2 מ"ל של AdDMEM+ והוסיפו לצינור החרוטי 15 מ"ל המכיל אורגנואידים מקוטעים.
- בעזרת פיפטה פסטר מזכוכית, פיפטה עדינה למעלה ולמטה 15-20 פעמים כדי לפרק את האורגנואידים. צנטריפוגה ב 350 x גרם במשך 2 דקות.
- הוסף ~ 50 μL של תמיסה מתחתית הצינור החרוטי לתוך EME. יש לערבב בעדינות פיפטה למעלה ולמטה. הימנעו מיצירת בועות.
- צלחת 50 μL של כיפות EME לתוך צלחת 35 מ"מ ולדגור במשך 20 דקות ב 37 ° C, 5% CO2 רקמה אינקובטור.
- הוסף 2 מ"ל של rIOM עם 10 μM Y27632 ו- 10 μM CHIR99021. שנה את מצע הגידול כל 2-3 ימים. בעת החלפת מדיה, ניתן להשמיט CHIR99021 27632 יו'.
4. שימור והפשרה בהקפאה של אורגנואידי מעיים של חולדות
- אורגנואידים במעיים של חולדות Cryopreserving
הערה: פרוטוקול השימור הקריוגני שונה מפרוטוקול קודם עבור אורגנואידים אנושיים ועכבר25. לפני ההקפאה, האורגנואידים חייבים לכלול לפחות שני מעברים בתרבות הראשונית. מומלץ לגדל אורגנואידים עד כדי ספרואידים גדולים או אורגנואידים מעט ניצנים לפני שימור בהקפאה, מכיוון שהדבר יביא לתפוקה גבוהה יותר של אורגנואידים בני קיימא לאחר ההפשרה. ניתן להשיג זאת על ידי הגדלת המצע המותנה R-spondin ל -15% ו / או על ידי הוספת ניקוטינאמיד 10 mM (טבלה 3) לתרבית האורגנואידים.- באמצעות מיקרוסקופ, ספרו את מספר האורגנואידים על צלחת 35 מ"מ. תייגו את הקריובלים כך ש-200 אורגנואידים יוכנסו לכל קריוביאלי.
- מוציאים את ה-rIOM מצלחת ה-35 מ"מ. החלף עם 2 מ"ל של PBS כיתה תרבית רקמה קרה.
- באמצעות קצה P1000, שחררו את כיפות EME מתחתית צלחת התרבית לתוך PBS על ידי פיטום למעלה ולמטה. המשך פיפטה למעלה ולמטה ~ 20 פעמים כדי לשבור את EME ולשחרר את האורגנואידים. אספו את האורגנואידים ואת PBS לתוך צינור חרוטי של 15 מ"ל.
- הוסף 2 מ"ל של PBS קר לצלחת התרבית ופיפטה למעלה ולמטה כדי לשחרר את כל האורגנואידים שנותרו לתוך PBS. העבר את PBS לצינור החרוטי 15 מ"ל.
- מכלים את האורגנואידים על ידי צנטריפוגה ב 290 x גרם במשך 5 דקות. מוציאים ומשליכים את הסופרנאטנט מבלי להפריע לכדורית האורגנואידים.
- לשטוף את הגלולה על ידי השעיה עדינה ב 5 מ"ל של AdDMEM קר +. צנטריפוגה ב 200 x גרם במשך 4 דקות. בזהירות להסיר ולהשליך את supernatant.
- השהה מחדש את גלולת האורגנואיד ב 1 מ"ל של מדיום הקפאה קר לכל 200 אורגנואידים. Aliquot 1 מ"ל של אורגנואידים במדיום הקפאה לכל cryovial שכותרתו. מניחים את cryovials במיכל הקפאה.
- אחסנו את האורגנואידים במיכל הקפאה בטמפרטורה של -80°C למשך 24 שעות, ולאחר מכן העבירו את הקרוביאלים לחנקן נוזלי לאחסון לטווח ארוך.
- הפשרת אורגנואידים במעיים של חולדות
הערה: פרוטוקול זה שונה מפרוטוקול קודם להפשרת אורגנואידים במעיים של בני אדם ועכבר26.- להפשיר aliquot 250 μL של EME על קרח. הכינו rIOM בתוספת 15% R-spondin מותנה מדיה, 10 μM Y27632 ו-10 μM CHIR99021. חם ב 37 °C (77 °F).
- הוסף 2 מ"ל של מדיום הפשרה (טבלה 3) לצינור חרוטי של 15 מ"ל בטמפרטורת החדר.
- שלפו והפשירו בקבוקון של אורגנואידים מחנקן נוזלי על ידי הנחת הבקבוקון באמבט מים של 37 מעלות צלזיוס עד שהבקבוקון מופשר כמעט לחלוטין.
- מוסיפים 1 מ"ל של מדיום הפשרה לבקבוקון ומעבירים את כל התוכן לצינור החרוטי המכיל מדיום הפשרה. לשטוף את הבקבוקון פעמיים עם 1 מ"ל של מדיום הפשרה ולהעביר צינור חרוט.
- צנטריפוגה ב 200 x גרם במשך 5 דקות. לשאוף את התקשורת, משאיר ~ 50 μL של מדיום עם אורגנואידים. העבר את המדיה המכילה אורגנואידים ל 250 μL של EME.
- פיזר באופן שווה את האורגנואידים דרך EME על ידי pipeting למעלה ולמטה, הימנעות בועות. פיפטה שש כיפות 50 μL לתוך צלחת תרבית רקמה 35 מ"מ.
- יש לדגור באינקובטור תרביות הרקמה למשך 15-20 דקות כדי לאפשר ל-EME להתפלמר. מוסיפים 2 מ"ל של rIOM מוכן למנה.
- לאחר יומיים, החלף את המדיה ב- rIOM. ניתן להשעות את השימוש ב-Y27632 וב-CHIR99021. צמיחת אורגנואידים עשויה להיות איטית במעבר הראשון לאחר ההפשרה. מומלץ לעבור את האורגנואידים פעמיים לאחר ההפשרה לפני תחילת הניסויים.
5. יצירת חד-שכבות דו-ממדיות של מעי חולדות מאורגנואידים תלת-ממדיים
הערה: הפרוטוקול הבא מתאר את הנפחים הדרושים ליצירת 24 בארות של צלחת 48 בארות מצופות ב-EME, החל משש כיפות של 50 μL (צלחת של 35 מ"מ) המכילות ~300 אורגנואידים/כיפה במעיים (קנה מידה: כיפה אחת מייצרת ארבע בארות), אך ניתן להגדיל או להקטין אותן לפי הצורך. כפי שנכתב, פרוטוקול זה משיג ~ 80% מפגש תוך 4-5 ימים. במפגש גבוה יותר, התאים מתחילים לרכוש מבנים אורגנואידים תלת-ממדיים שוב. במפגש נמוך (≤40%) , התאים נשארים כחד-שכבות והם בני קיימא במשך ~14 יום. אם מטרת המחקר היא להשתמש בחד-שכבות דו-ממדיות, יש להקטין כך שכיפה אחת תייצר שמונה בארות של צלחת בת 24 בארות. ניתן גם לצפות את הבארות בקולגן I ליצירת חד-שכבות.
- הכנת משטחים מצופים
- כדי לצפות את הצלחת ב-EME, דללו את EME 1:20 ב-AdDMEM+ קר (טבלה 1). לציפוי בקולגן מכינים קולגן I לפי הוראות היצרן. לדלל 5 מ"ג/מ"ל קולגן I ב-AdDMEM+ ל-100 מיקרוגרם/מ"ל (1:50 במקרה זה).
- צפו את הצלחת ב-200 מיקרוליטר של EME או קולגן מדולל כדי לכסות את פני הבאר לחלוטין. דגירה במשך 1-2 שעות ב 37 ° C באינקובטור תרבית רקמות. הכינו מדיום אורגנואיד מעיים של חולדות לתרבית חד-שכבתית דו-ממדית (rIOM2D) לפי טבלה 4.
- דור של monolayers
- שאפו את המדיה מצלחת 35 מ"מ המכילה אורגנואידים. הוסף 1 מ"ל של PBS.
- לשבש את EME בבארות על ידי גירוד עם קצה P1000. פיפטה למעלה ולמטה בערך 20 פעמים כדי לשחרר את כל EME. מעבירים הכל לצינור חרוטי של 15 מ"ל.
- הוסף 1 מ"ל PBS לצלחת 35 מ"מ כדי לשחזר אורגנואידים נוספים ולהעביר לאותו צינור חרוטי 15 מ"ל.
- צנטריפוגה ב 350 x גרם במשך 2 דקות ולשאוף את supernatant, כולל שאריות EME. הוסף 1 מ"ל של תמיסת טריפסין לגלולת האורגנואיד ודגר ב 37 ° C במשך 2 דקות.
- פיפטה למעלה ולמטה 10 פעמים באמצעות קצה P1000 ולהוסיף 2 מ"ל של AdDMEM+ כדי לנטרל טריפסין.
- צנטריפוגה ב 350 x גרם במשך 5 דקות. שאפו את הסופרנאטנט והוסיפו 4.8 מ"ל של rIOM2D (טבלה 4). השהה מחדש את גלולת התא.
- לפני הנחת האורגנואידים, הוציאו עודפי EME או קולגן ב-AdDMEM+ מהבארות. לאחר מכן, הוסף 200 μL של אורגנואידים ב- rIOM2D ו- 10 μM Y27632 לכל באר מצופה מראש.
- לאחר 4-16 שעות, לאסוף את המדיה ואת הצנטריפוגה ב 1,000 x גרם במשך 1 דקה. מעבירים את הסופרנאטנט לצינור חרוטי חדש בנפח 15 מ"ל ומשליכים את הכדורית.
- לשטוף כל באר עם 300 μL של PBS ולהוסיף 200 μL של rIOM2D צנטריפוגה לכל באר. החליפו את rIOM2D כל 2-3 ימים, והשעו את השימוש ב-Y27632.
- רפורמה באורגנואידים תלת-ממדיים מחד-שכבות דו-ממדיות
הערה: ניתן לגרום לחד-שכבות הגדלות על EME לבצע רפורמה באורגנואידים תלת-ממדיים, בעוד שחד-שכבות הגדלות על קולגן I אינן חוזרות ביעילות לאורגנואידים תלת-ממדיים. בדרך כלל, 2-3 בארות של אורגנואידים שנוצרו monolayers ניתן להשתמש כדי ליצור כיפה אחת של 50 μL של EME ביום 5.- לדלל את EME 1:4 ב- rIOM2D. כאשר החד-שכבות מגיעות למפגש ~80%, שאפו בזהירות את המדיה והוסיפו 100 מיקרוליטר של EME מדולל לבארות המכילות מונושכבות.
- יש לדגור בטמפרטורה של 37°C, 5% CO2 באינקובטור של תרביות רקמה למשך 20 דקות. לאחר מכן, להוסיף 100 μL של rIOM2D ולחזור לחממה תרבית רקמות. אורגנואידים תלת-ממדיים ייווצרו תוך 5 ימים מהוספת EME מדולל.
- לאחר שאורגנואידים קטנים עברו רפורמה (~ יום 5), הכינו את rIOM. לאסוף את כל תוכן הבאר, pipetting למעלה ולמטה כדי לשבש את EME, ולהעביר צינור חרוטי 15 מ"ל.
- צנטריפוגה ב 350 x גרם במשך 2 דקות. שאפו את שאריות הסופרנאטנט וה-EME.
- הוסף 1 מ"ל של AdDMEM+ קר וצנטריפוגה ב 350 x גרם במשך 2 דקות. הסר את supernatant, משאיר ~ 50 μL של מדיה.
- העבר את 50 μL של מדיה ואורגנואידים ל 250 μL EME aliquot. פיפטה למעלה ולמטה כדי להפיץ את האורגנואידים ברחבי EME.
- פיפטה 50 מיקרוליטר של EME מתכוננת לצלחת 35 מ"מ ודוגרת במשך 20 דקות באינקובטור תרביות רקמות.
- הוסף 2 מ"ל של rIOM בתוספת 10 מיקרומטר Y27632. שנה את מצע הגידול כל 2-3 ימים. בעת שינוי המדיה, ניתן להשמיט את Y27632.
6. מניפולציה גנטית
- טרנספקציה חולפת של חד-שכבות דו-ממדיות
אזהרה: יש להכין חד-שכבות אפיתל מעי של חולדות לפי סעיף 5.1 בצלחת של 48 בארות. הטרנספקציה חייבת להתבצע במפגש של 70%-80%. החלף תמיד את המדיה בבארות עם 200 μL של rIOM2D טרי לפני ההדבקה. חישוב יחסי ספיגה של 260/280 ננומטר ו- 260/230 ננומטר של DNA פלסמיד; אלה חייבים להיות מעל 1.8 כדי להבטיח תוצאות טרנספקציה טובות.
הערה: השתמש בבקרת פלסמיד כדי לחשב את יעילות ההעברה. פלסמיד המקודד חלבון פלואורסצנטי מומלץ בקלות. בפרוטוקול זה נעשה שימוש ב-pLJM1-EGFP27 .- להכין 1 מ"ג / מ"ל של 20 kDa פוליאתילנימין (PEI; טבלה 3). עבור כל באר, להכין צינור A (0.6 מיקרוגרם של פלסמיד + 50 μL של מדיום סרום מופחת) וצינור B (1.8 μL של PEI + 50 μL של מדיום סרום מופחת). שמור על יחס DNA:PEI של 1:3.
- מערבול שני הצינורות במשך 30 שניות. מערבבים צינור A וצינור B, ומערבלים שוב למשך 30 שניות. במידת הצורך, השתמש בצנטריפוגה כדי להסתובב למטה. יש לדגור במשך 20 דקות בטמפרטורת החדר.
- הוסיפו בעדינות את קומפלקס ה-DNA/PEI בטיפה לחד-שכבה דו-ממדית. מערבבים בעדינות את הצלחת כדי לערבב. יש לדגור ב-37°C, 5% CO2. בדרך כלל ניתן לזהות את הביטוי לאחר 24 שעות.
הערה: אם יש צורך לחזור למבנים אורגנואידים תלת-ממדיים, המתן 48 שעות לאחר הטרנספקציה להוספת EME מדולל.
- התמרה Lentiviral של אורגנואידים מעיים חולדה
הערה: לפני עבודה עם lentiviruses, לקבל אישור מתאים הכשרה מיוחדת מן המוסד. יש ללבוש תמיד ציוד מגן אישי (PPE) מתאים בעת טיפול באנטי-וירוסים. אמנם לא מתואר כאן, באיכות גבוהה, מרוכז lentivirus חיוני עבור זיהום מוצלח של אורגנואידים. פרוטוקול זה השתמש בווקטור pLJM1-EGFP ריק27 כדי לבטא GFP מסיס. פרוטוקול זה שונה מפרוטוקול שפורסם בעבר28. יעילות ההתמרה תלויה באיכות ובריכוז של חלקיקים נגיפיים, דיסוציאציה יעילה של אורגנואידים לצברי תאים קטנים, והגן המתבטא. בחישוב 5 ימים לאחר ההדבקה, יעילות ההתמרה הממוצעת לפני הבחירה הייתה 19.4% (± 6.5% סטיית תקן).- יומיים לפני ההדבקה הלנטיוויראלית, תכננו לעבור (קטע 3) שתי בארות צפופות של צלחת בת 24 בארות עבור כל לנטיוירוס שיועבר. כל באר של צלחת 24 בארות יכולה להכיל כיפה אחת של 50 μL של EME.
- לאחר שה-EME מתמצק, יש להוסיף 0.5 מ"ל של rIOM בתוספת ניקוטינאמיד של 10 mM, 10 μM Y27632 ו-2.5 μM CHIR99021. זה גורם מורפולוגיות ספרואיד גדול, אשר חיובי עבור היעילות של transduction lentiviral. תוך יומיים מהציפוי, אורגנואידים של חולדות צריכים להיות ספרואידים גדולים. אם נצפתה התמיינות משמעותית (כלומר, ניצנים), יש לחזור על האורגנואידים.
- הפשירו את הנגיף המרוכז על קרח. הכינו אמצעי התמרה טריים, לפי טבלה 3.
- באמצעות קצה P1000, שחררו את כיפות ה-EME מתחתית צלחת תרבית התאים אל תוך המדיה על ידי פיטום למעלה ולמטה. המשך פיפטה למעלה ולמטה 20 פעמים כדי לפרק את EME ולשחרר את האורגנואידים.
- פיפטה את האורגנואידים והמדיה לתוך צינור חרוטי 15 מ"ל. ניתן לאגד את כל הבארות יחד, בתנאי שלאורגנואידים יש אותו גנוטיפ והם מאותו קו.
- לשטוף כל באר פעמיים עם 1 מ"ל של AdDMEM קר +. אסוף את AdDMEM+ והעבר אותו לאותו צינור חרוטי של 15 מ"ל.
- באמצעות פיפטה פסטר זכוכית, מכנית לשבש את אורגנואידים חולדה. זהו צעד קריטי, שכן המטרה היא צבירי תאים רב-תאיים קטנים. פיפטה למעלה ולמטה ~ 30 פעמים. בדוק את יעילות ההפרעה תחת המיקרוסקופ באמצעות מטרה 4x. המשיכו בתהליך זה עד שתרחיף התא מורכב בעיקר מצברי תאים עם מעט אורגנואידים שנותרו.
הערה: לחלופין, אורגנואידים יכולים להיות צנטריפוגות ב 200 x גרם במשך 5 דקות בטמפרטורת החדר, supernatant הוסר בזהירות, ו resuspended ב 1 מ"ל של אנזים רקומביננטי מחליף טריפסין/EDTA קונבנציונאלי, מחומם מראש ל 37 ° C באינקובטור תרבית רקמה. יש לדגור על האורגנואידים בתחליפי טריפסין למשך 2 דקות באמבט מים בטמפרטורה של 37 מעלות צלזיוס, עם מערבולות קבועות לקידום דיסוציאציה. הימנע דגירה ממושכת עם תחליף טריפסין, שכן זה יכול לקדם מוות תאי. בדוק באופן קבוע את יעילות השיבוש תחת המיקרוסקופ באמצעות מטרה 4x. כאשר התרחיף מורכב בעיקר מתאים בודדים עם מעט תרביות תאים, לדלל את החלפת הטריפסין על ידי הוספת 4 מ"ל של AdDMEM+ ולהמשיך לשלב הבא. - סובב את הצינור החרוטי 15 מ"ל המכיל את אשכולות התאים ב 200 x גרם במשך 5 דקות ב 4 ° C. בזהירות להסיר ולהשליך את supernatant, נזהר לא להפריע את כדור התא.
- להשעות מחדש את אשכולות התאים ב 230 μL של תווך התמרה לכל באר להיות נגוע. עבור הזיהום, השתמש באר אחת של צלחת 48 באר עבור כל lentivirus.
- צלחת 230 μL של תרחיף תאים לתוך כל באר של צלחת מסומנת 48 באר. הוסף 20 μL של וירוס מרוכז לכל באר. השתמש בקצה P1000 כדי לערבב את תמיסת הנגיף/תא בכל באר ואטם את הצלחת בסרט שקוף.
- בצע ספינוקולציה: צנטריפוגה את הצלחת ב 600 x גרם במשך 1 שעה ב 32 ° C. יש לפתוח את האטימה של הצלחת ולדגור בטמפרטורה של 37°C, 5% CO2 למשך 6 שעות.
- מחממים צלחת 24 בארות באינקובטור של 37 מעלות צלזיוס.
- לאחר הדגירה, פיפטה כל באר מעלה ומטה ולהעביר את התוכן לצינור מסומן 1.5 מ"ל. לשטוף כל באר עם 750 μL של AdDMEM+ ולהעביר את הצינור. סובב את הצינורות ב 600 x גרם במשך 5 דקות ב 4 ° C.
- מוציאים את הצינורות מהצנטריפוגה ומאחסנים על קרח. השתמש בקצה P1000 כדי להסיר בזהירות ולהיפטר כראוי מהסופרנטנט.
- השהה מחדש את גלולת התא ב- EME וצלחת 50 μL כיפות לתוך צלחת 24 באר שחוממה מראש. יש לדגור במשך 15-20 דקות בטמפרטורה של 37°C עד שה-EME עובר פולימריזציה.
- לכל באר, הוסף 500 μL של rIOM בתוספת ניקוטינאמיד 10 mM, 10 μM Y27632, ו 2.5 μM CHIR99021.
- החלף את המדיה עם rIOM בתוספת 10 מיקרומטר Y27632 יום אחד לאחר ההדבקה. שנה את המדיה כל 2-3 ימים. אם הבחירה תבוצע, להוסיף בחירה 48-72 שעות לאחר ההדבקה. לבחירת פורומיצין, יש להשתמש בפורומיצין 2 מיקרוגרם/מ"ל.
7. אימונופלואורסנציה צביעת הר שלם של אורגנואידים
- שאפו את המדיה והוסיפו 4% פרפורמלדהיד (PFA) ב-PBS-Tween 20 (PBS-T) (טבלה 3) לאורגנואידים בצלחת תרבית תאים. יש לדגור בטמפרטורת החדר למשך 10 דקות.
- שחררו את האורגנואידים מה-EME על ידי פיפטציה למעלה ולמטה. אספו את האורגנואידים לתוך צינור של 0.75 מ"ל. האורגנואידים ישקעו לתחתית הצינור על ידי כוח הכבידה תוך מספר דקות. במידת הצורך, צנטריפוגה ב 100 x גרם למשך 1 דקה.
- באמצעות פיפטת העברה, הסר את ה- PFA והשהה מחדש את האורגנואידים ב- PBS-T. תנו לאורגנואידים לשקוע בתחתית הצינור. הסר את PBS-T והשהה מחדש ב- 200 μL של תמיסת בלוק (טבלה 3).
- יש לדגור בטמפרטורת החדר על נדנדה או אגוז במשך 45 דקות. אורגנואידים יכולים להתגבש ולהתיישב בתחתית הצינור. מעת לעת אצבע להעיף את הצינור כדי להשהות מחדש ולהתפזר לאורך כל התמיסה.
- תנו לאורגנואידים לשקוע בתחתית הצינור. במידת הצורך, צנטריפוגה ב 100 x גרם למשך 1 דקה. הסר פתרון חסימה.
- הוסף נוגדן ראשוני מדולל ב 100 μL של תמיסת בלוקים. דוגרים בטמפרטורת החדר על מיקסר אגוזים במשך 45 דקות ב-24 סל"ד. ריכוזי הנוגדנים משתנים בהתאם לנוגדן בו משתמשים.
הערה: ניתן להאריך שלב זה בהתבסס על הנוגדן הראשוני, עד לילה ב 4 °C. - תנו לאורגנואידים לשקוע בתחתית הצינור. במידת הצורך, צנטריפוגה ב 100 x גרם למשך 1 דקה.
- שטפו ב-PBS-T חמש פעמים באמצעות פיפטת העברה. דוגרים בטמפרטורת החדר במשך 5 דקות על מיקסר אגוזים ב-24 סל"ד. חזור על שלב זה פעמיים.
- הוסף נוגדן משני מדולל 1:200 ו 50 מיקרוגרם / מ"ל 4′,6-diamidino-2-phenylindole (DAPI) מדולל ב 100 μL של תמיסת בלוקים. דוגרים בטמפרטורת החדר על מיקסר אגוזים במשך 30 דקות ב-24 סל"ד.
- תנו לאורגנואידים לשקוע בתחתית הצינור. במידת הצורך, צנטריפוגה ב 100 x גרם למשך 1 דקה. הסר נוגדן משני. יש לשטוף חמש פעמים ב-PBS-T באמצעות פיפטת העברה.
- דוגרים בטמפרטורת החדר במשך 5 דקות על מיקסר אגוזים ב-24 סל"ד. חזרו על שלב הכביסה פעמיים.
- בזמן שהאורגנואידים שוטפים, חממו אליציטוט של חומר איטום VALAP (טבלה 3) בטמפרטורה של 40-50 מעלות צלזיוס כדי להנזיל. באמצעות מכחול, צבעו ריבוע דק של VALAP על שקופית מיקרוסקופ בערך בגודל של תלוש כיסוי. השתמש בכיסוי מס' 1.5 בגודל 22 מ"מ x 22 מ"מ .
- בעזרת מספריים, חותכים את קצהו של קצה פיפטה P200. העבר אורגנואידים ל- VALAP היטב בשקופית. בעזרת מגבון טישו, מנדפים בזהירות את PBS-T. אין לתת לאורגנואידים להתייבש.
- הציפו היטב את ה-VALAP באמצעי הרכבה נגד דהייה (טבלה 3). עבור ~ 22 מ"מ x 22 מ"מ מרובע, זה ידרוש 100-150 μL של antifade.
- האורגנואידים יכולים להתקבץ; מערבלים את האנטי-דהייה עם קצה פיפטה כדי לפזר מחדש את האורגנואידים, במידת הצורך. הרכבה עם כיסוי מס' 1.5 בגודל 22 מ"מ x 22 מ"מ, למניעת בועות אוויר. אטמו את הכיסוי על ידי צביעת שכבה דקה של VALAP בקצוות.
הערה: עבור מיקרוסקופים הפוכים, ניתן להרכיב את האורגנואידים גם בצלחת בעלת תחתית זכוכית בקוטר 35 מ"מ.
8. נפיחות הנגרמת על ידי פורסקולין של אורגנואידים במעיים של חולדות
- לגדל את האורגנואידים במשך 3-5 ימים לאחר המעבר ב- rIOM. מומלץ לגדל אורגנואידים בצלחת של 24 בארות כדי להבטיח שניתן יהיה לצלם מחדש את אותו אזור בקלות. צלם תמונות לפני הוספת פורסקולין (T0).
- הוסף פורסקולין (טבלה 3) ישירות למצע האורגנואיד לריכוז סופי של 10 מיקרומטר. הוסף את אותו נפח של דימתיל סולפוקסיד (DMSO) לבארות הבקרה.
- דמיינו את בארות הבקרה והפורסקולין במרווחי זמן קבועים, כל 15-30 דקות. כאשר אין הדמיה, יש לשמור אורגנואידים באינקובטור או להשתמש במערכת הדמיה מבוקרת עם הדגירה. נפיחות מקסימלית יש לראות על ידי 120 דקות.
- עקוב אחר פרוטוקולים סטנדרטיים כדי לחשב נפיחות יחסית מהתמונות שנרכשו29.
תוצאות
תריסריון חולדות ואורגנואידים ג'ג'ונליים נוצרו באמצעות הפרוטוקול המתואר בסעיף 2. חשוב מאוד במהלך שלבי בידוד הקריפטה כי villi מתרוקנים ביעילות מן PBS. אם יותר מדי וילי מצופים ב- EME עם קריפטות, זה יכול לגרום למוות של התרבות כולה וכישלון להקים קו אורגנואידים. בגלל זה, כדאי לבודד קריפטות תחת טווח ניתוח, המאפשר אישור חזותי של דלדול villar. איור 1 מתאר שברי וילרים וקריפטות מייצגים (איור 1A). שימו לב לגודל הקטן משמעותית של קריפטות בהשוואה לווילי (איור 1B). לאחר הציפוי, הקריפטות יתרחבו לכדוריות במהלך הימים הקרובים, ויתחילו לנבוט ולהתמיין ביום 4-7 (איור 2). ברגע שהאורגנואידים מגיעים לשלב ניצנים נרחב, יש לעבור אותם. במהלך המעבר, חשוב לשבש את האורגנואידים מספיק כדי לפצל את ניצני הקריפטה זה מזה, כך שניתן יהיה להרחיב את מספרי האורגנואידים (איור 3B).
ההתאוששות המוצלחת של אורגנואידים לאחר הקפאה תלויה מאוד במצב שבו הם קפואים. אורגנואידים במצב שגשוג מאוד בלתי מובחן מתאוששים ביעילות הגבוהה ביותר. לכן, אנו ממליצים לגרום להם להיות כדוריים וציסטיים במקום ניצנים ומובחנים. כדי להשיג זאת, Wnt יכול להיות hyperactivated על ידי הגדלת כמות ליגנד Wnt R-spondin בתקשורת ועל ידי הכללת ניקוטינאמיד במדיה, אשר הוכח לתמוך היווצרות אורגנואידים והישרדות תאים במספר מערכות תרבית30,31. איור 3A מדגים תרבית אורגנואידים בריאה רק יומיים לאחר ההפשרה. הכללת BSA בתקשורת במהלך ההפשרה סייעה גם בהישרדותן של תרביות אורגנואידים במעי חולדות, שהוכחו כעדינות יותר מאורגנואידים של עכברים.
בעוד שתרבות אורגנואידים תלת-ממדית מועדפת לעתים קרובות מכיוון שהיא משחזרת חלק מארכיטקטורת המעי הרגילה, היא הופכת גישות אחרות, כולל הדמיה חיה, טרנספקציות והתמרה לנטי-ויראלית, למאתגרות יותר מבחינה טכנית. השימוש בחד-שכבות דו-ממדיות שנוצרו מאורגנואידיםתלת-ממדיים 32 (איור 4) מאפשר החדרת פלסמידים ביעילות גבוהה יותר. בעוד אורגנואידים תלת-ממדיים במעיים עמידים באופן מסורתי בפני טרנספקציות חולפות, ניתן להציג בהצלחה פלסמידים המקודדים ל-EGFP באמצעות שיטות טרנספקציה מבוססות שומנים. הגישה החסכונית ביותר באמצעות PEI מתוארת בשלב 6.1 (איור 5), אך אלקטרופורציה וריאגנטים טרנספקציה הזמינים מסחרית הניבו גם הם תוצאות דומות (הנתונים לא מוצגים). מחקרים עתידיים יתמקדו בשאלה האם ניתן להשתמש בגישות אלה להחדרת מבני CRISPR למונו-שכבות.
היה חשוב להיות מסוגלים לשנות אורגנואידים תלת-ממדיים מחד-שכבות דו-ממדיות לאחר טרנספקציה, כך שניתן יהיה לשמור עליהם כקו מעבר עם רכיבים אדריכליים תלת-ממדיים של קריפטות. באופן מעניין, חד-שכבות דו-ממדיות שצופו ב-EME השתנו בקלות לכדוריות קטנות כאשר EME נוסף בחזרה לחלק העליון של התאים, בעוד שמצע קולגן I לא הספיק לבנייה מחדש של מבנים תלת-ממדיים (איור 6).
בעוד transfections חולפות שימושיים עבור מחקרים רבים, היווצרות של קווים יציבים הם לעתים קרובות שימושי יותר, הדורשים הכנסת lentivirus לתוך התאים. אורגנואידי מעיים של חולדות נדבקו בלנטיוירוס על-ידי שינוי פרוטוקולים שפורסמו בעבר (איור 7). שלב מפתח בפרוטוקול הוא הפרעה של אורגנואידים לצברים קטנים או לצברי תאים. אם התרביות אינן משובשות ביעילות והאורגנואידים נשארים שלמים, החלקיקים הלנטי-ויראליים לא ייכנסו לתאים. לאחר ההדבקה, אורגנואידים חייבים להתאושש ולגדול מחדש. הפרוטוקול המתואר כאן מאפשר ספיגה של חלקיקים נגיפיים על ידי 10%-48% (ממוצע: 19.4% ± 6.5%) של תאים לפני הבחירה.
צביעה שלמה של אורגנואידים יכולה להיות קשה עקב הסרה חלקית של שאריות EME או חדירה לא שלמה של נוגדנים. הפרוטוקול המתואר כאן מאפשר צביעה חזקה של אורגנואידים. הדמיה של אורגנואידים במיקרוסקופ קונפוקלי יכולה גם להיות קשה אם הם רחוקים מדי מהכיסוי. על ידי שימוש ב- VALAP, נוצרת באר עם גובה מסוים כך שאורגנואידים אינם נמעכים על ידי הכיסוי, אך עדיין מורשים להתיישב קרוב למכסה כדי להקל על ההדמיה. צביעה מייצגת כנגד מווסת ההולכה הטרנסממברנלית של תעלת האניון האפיקלית (CFTR) ופאלואידין כדי לסמן F-actin מוצגת באיור 8.
לבסוף, אורגנואידים יש תועלת בבדיקות פונקציונליות. אורגנואידים שמקורם בחולה מחולי סיסטיק פיברוזיס שימשו לסינון תפקוד CFTR, שכן הטיפול באגוניסט cAMP פורסקולין גורם להפרשת נוזלים חזקה בתיווך CFTR, וגורם לנפיחות אורגנואידים 29,33-37. אחת המטרות של עבודה זו הייתה לזהות ולפתח מודל אורגנואידים שניתן להשתמש בו במקביל למחקרים פרה-קליניים in vivo. לכן, רצינו לקבוע אם אורגנואידים במעיים של חולדות עוברים נפיחות הנגרמת על ידי פורסקולין. ואכן, בתוך 30 דקות מהטיפול בפורסקולין, אורגנואידים של חולדות התנפחו, עם השפעה מקסימלית שנצפתה ב-120 דקות (איור 9).
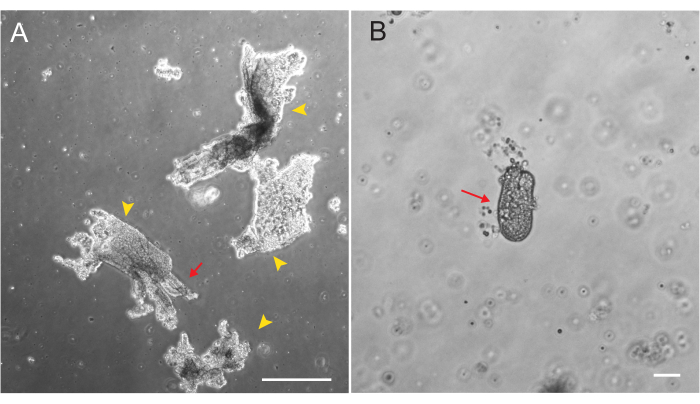
איור 1: שברי וילאר וקריפטות במהלך בידוד אפיתל. (A) תמונה מייצגת של שברי וילאר בתמיסת EDTA במהלך פרוטוקול בידוד הקריפטה. ראשי חץ צהובים מסמנים שברי וילאר. חיצים אדומים מתארים קריפטות המחוברות לשבר וילאר. שימו לב להבדל בגדלים היחסיים. (B) תמונת הגדלה גבוהה יותר של קריפטה בודדת (חץ אדום) כך שניתן יהיה להמחיש מורפולוגיה. פסי קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
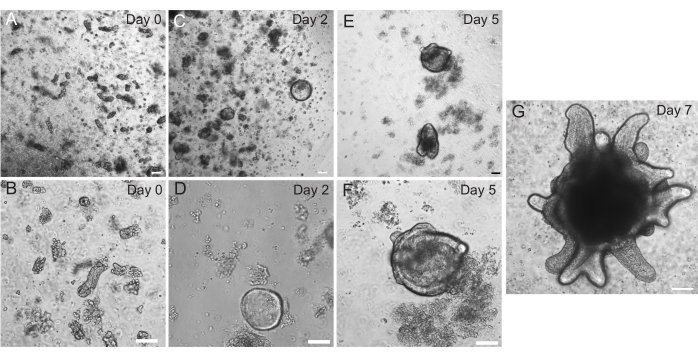
איור 2: התקדמות אורגנואיד במעי חולדה. קריפטים של חולדות ג'ג'ונום צופו ב-EME מיד לאחר הבידוד (A,B). תוך יומיים, הקריפטות הפכו לספרואידים (C,D). ביום 5, הם החלו ליזום ניצני קריפטה (E,F), אשר התרחבו וגדלו עד יום 7 (G). פסי קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
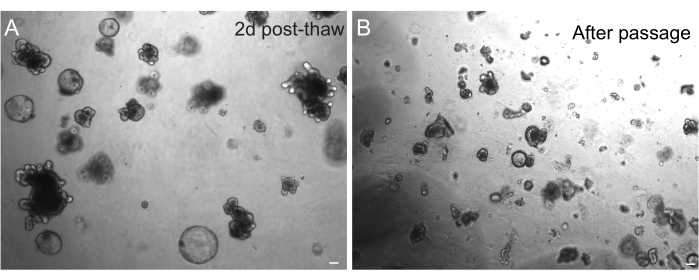
איור 3: אורגנואידים לאחר הפשרה ומעבר. (A) אורגנואידים ג'ג'ונליים של חולדות הופשרו בהתאם לפרוטוקולים המתוארים לאחר שימור בהקפאה. שימו לב לנוכחות של ספרואידים ואורגנואידים ניצנים רק יומיים לאחר ההפשרה. (B) אותו קו אורגנואידים המתואר ב-A מיד לאחר המעבר בהתאם לפרוטוקול המתואר. שים לב להפרש הגודל היחסי בין מבנים ב- A ו- B ולנוכחות של תחומים דמויי קריפטה בודדים ב- B. פסי קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
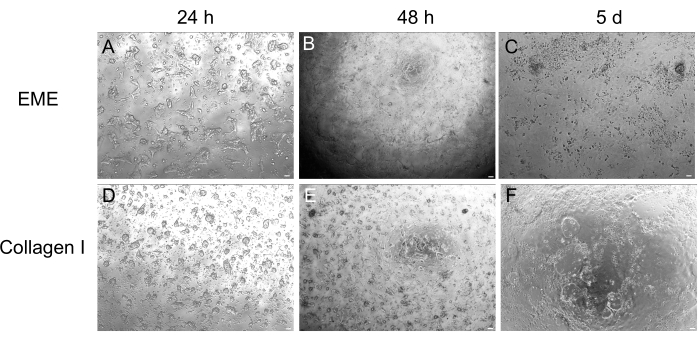
איור 4: היווצרות חד-שכבתית דו-ממדית מאורגנואידים תלת-ממדיים. (A-C) התקדמות חד-שכבתית דו-ממדית ב-EME. (D-F) התקדמות חד-שכבתית דו-ממדית בקולגן I. ביום החמישי, כל מצב הניב ~80% מפגש. פסי קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
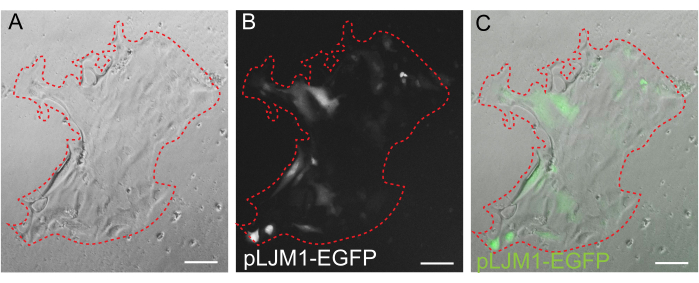
איור 5: טרנספקציה חולפת של חד-שכבה דו-ממדית. תמונה מייצגת של חד-שכבה דו-ממדית הגדלה על EME באופן זמני עם פלסמיד pLJM1-EGFP באמצעות PEI. (A) שדה בהיר, (B) פלואורסצנטיות (GFP), (C) כיסוי. הקו האדום המקווקו מסמן את הגבול החד-שכבתי. פסי קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
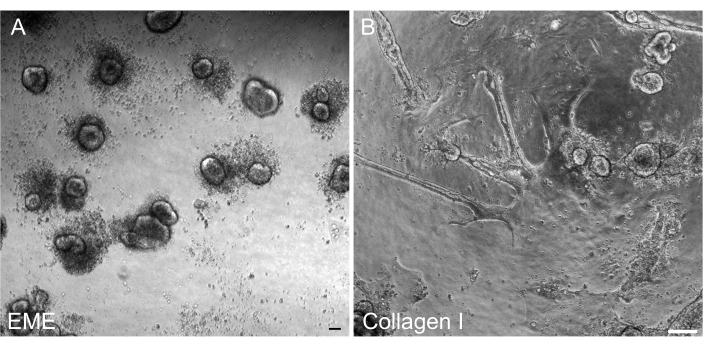
איור 6: רפורמציה של אורגנואידים תלת-ממדיים מחד-שכבות דו-ממדיות ב-EME. (A) היווצרות אורגנואידים תלת-ממדיים מחד-שכבות דו-ממדיות שגדלו ב-EME. אורגנואידים שנוצרו ביעילות על ידי 5 ימים לאחר הוספת EME למשטח האפי של monolayer. שימו לב לשפע התאים המתים המקיפים את הספרואידים התלת-ממדיים הקטנים. (B) התמדה של חד-שכבות דו-ממדיות 5 ימים לאחר הוספת קולגן I למשטח האפי של חד-שכבות דו-ממדיות שגדלו על קולגן I. מוטות קנה מידה: 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
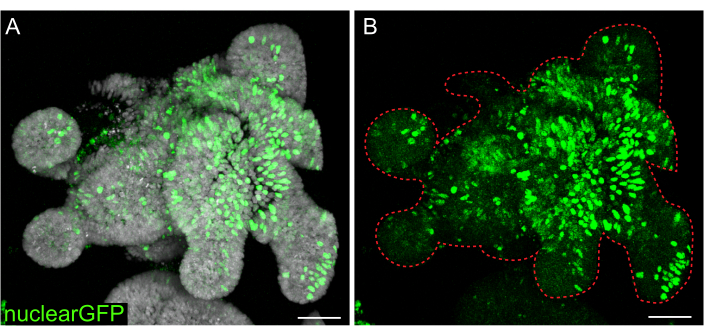
איור 7: זיהום לנטיויראלי של אורגנואידים תלת-ממדיים. אורגנואידים מסוג Rat jejunum היו נגועים בחלקיקים גרעיניים GFP lentiviral באמצעות הפרוטוקול המתואר. לאחר התאוששות וצמיחה במשך 5 ימים, אורגנואידים תוקנו ומוכתמים ב- DAPI. (א) DAPI: אפור; גרעיניGFP: ירוק. (B) גרעיניGFP:ירוק. הקו האדום המקווקו מסמן את גבול האורגנואידים. פסי קנה מידה: 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
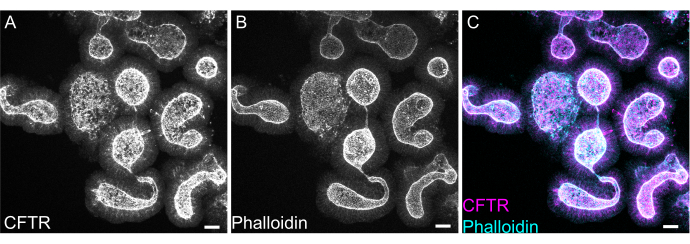
איור 8: אימונופלואורסנציה שלמה של אורגנואידים במעי חולדה . (A) CFTR, (B) phalloidin ו-(C) התמזגו של הר שלם של אורגנואידים ג'ג'ונליים של חולדות. שימו לב להעשרה אפית של צביעת CFTR באורגנואידים (אפור ב-A, מגנטה ב-C). פלואדין מסמן F- אקטין ומסמן באופן בולט את גבול המברשת האפיקלית (אפור ב-B, ציאן ב-C). פסי קנה מידה: 25 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
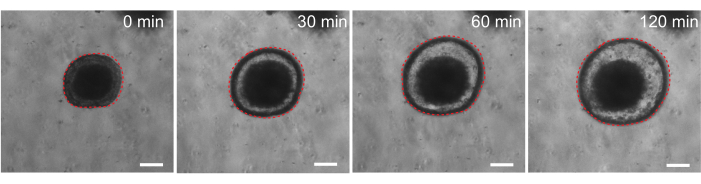
איור 9: אורגנואידים של חולדות במעיים מתנפחים בעקבות גירוי פורסקולין. מהלך זמן מייצג של נפיחות אורגנואיד מעיים של חולדה לאחר הוספת אגוניסט cAMP forskolin. הזמן של 0 דקות מייצג את נקודת הזמן שלפני התוספת של 10 מיקרומטר פורסקולין. התמונות מראות את אותו אורגנואיד במרווחי זמן של 30 דקות. נפיחות מקסימלית נצפתה ב 120 דקות לאחר תוספת forskolin. הקו האדום המקווקו מתאר את גבול האורגנואידים. החומר הכהה במרכז לומן האורגנואיד מורכב מתאים מתים. פסי קנה מידה: 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: מתכון AdDMEM+. מרכיבים להכנת מדיית AdDMEM+ סטנדרטית, שהיא המדיה הבסיסית בכל השיטות המוצגות כאן. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: מתכון של חולדה לאורגנואיד מעיים (rIOM). מתכון מפורט של מצע אורגנואיד המעי הסטנדרטי של חולדות, כולל ממס ותנאי אחסון לחלבונים רקומביננטיים. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: פתרונות. מתכונים והוראות להכנת פתרונות אחרים המשמשים לאורך כל הפרוטוקול. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4. מדיום אורגנואיד מעיים של חולדה לתרבית חד-שכבתית דו-ממדית (rIOM2D). מתכון שונה של מדיה תרבותית אורגנואידית המותאמת לצמיחה דו-ממדית של חד-שכבות. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
פיתוח מודל אורגנואיד מעיים של חולדה משמר מאפיינים תפקודיים חשובים הנמצאים באיבר in vivo והוא כלי מבטיח לבדיקות פרה-קליניות, סינון תרופות ובדיקות תפקודיות. מודל זה במבחנה יכול לשמש במקביל למחקרי גסטרואנטרולוגיה פרה-קליניים in vivo , שעבורם חולדות הן לעתים קרובות מודל מועדף בשל גודל המעי הגדול שלהן, היבטים פיזיולוגיים משותפים עם בני אדם, ובמקרים מסוימים היותן מודלים טובים יותר למחלות38. כאן, מתואר פרוטוקול חזק שלב אחר שלב לבידוד של קריפטות מעיים של חולדות, יצירה ותרבית ארוכת טווח של אורגנואידים במעי חולדות, כמו גם יישומים במורד הזרם, כולל בדיקות פונקציונליות של נפיחות פורסקולין, אימונופלואורסנציה של הר שלם, תרבית חד-שכבתית דו-ממדית ומניפולציה גנטית לנטי-ויראלית. אורגנואידים של עכברי עכברוש עשויים להיות רלוונטיים בהקשרים רבים של מחלות שבהם הפתופיזיולוגיה של מודלים של עכברים אינה הולמת, ועשויים לספק מודל טוב יותר לפיזיולוגיה של המעי האנושי בהשוואה לאורגנואידים של מעי עכברים.
כדי לבסס תרביות אורגנואידים ארוכות טווח שניתן לעבור ולהרחיב, חיוני לזהות את גורמי הגדילה העיקריים הדרושים לשמירה על שגשוג אפיתל המעי. אורגנואידים עכבריים גדלים לרוב בקוקטייל פשוט של EGF, R-ספונדין ונוגין, אם כי דווח כי נוגין אינו הכרחי לתרבית אורגנואידים במעיים39. מדיה מותנית יכולה להחליף גורמי גדילה רקומביננטיים וקווי התאים הנפוצים ביותר הם L-WRN, המפריש תאים Wnt3a, Rspondin-3 ו- Noggin39, L-Wnt3a ו- HA-Rspondin1-Fc 293T40. מדיה מותנית L-WRN מספיקה כדי לתמוך לא רק בצמיחת אורגנואידים במעי עכבר 39, אלא גם בצמיחה של אורגנואידיםבמעיים ממספר חיות משק וחיות מחמד, כולל כלבים, חתולים, תרנגולות, סוסים, פרות, כבשים וחזירים12. עם זאת, אורגנואידים במעיים אנושיים שונים מאוד בדרישות גורמי הגדילה שלהם, מכיוון שהם דורשים פורמולציות מדיה נפרדות לשלב צמיחת ההתפשטות שלהם (כלומר, ההתקדמות מספרואידים קטנים לגדולים) לעומת שלב ההתמיינות שלהם (כלומר, יצירה והבשלה של סוגי תאים ממוינים)10. דרישות המדיה של אורגנואידים במעי חולדות דומות מאוד לאלה של מצע הגידול המתפשט עבור אורגנואידים במעיים אנושיים, עם זאת, יש לציין, אורגנואידים של חולדות מסוגלים הן לגדילה והן להתמיינות בסביבת מדיה זו, מה שמפשט במידה ניכרת את דרישות התרבות שלהם. בעוד שהניסיונות הראשונים שלנו התמקדו בביסוס וגידול אורגנואידים במעיים של חולדות במדיה מותנית L-WRN, התרבית ארוכת הטווח הייתה רופפת, וקווי אורגנואידים במעיים של חולדות סבלו מחוסר חוסן (הנתונים לא הוצגו). ייתכן שהסיבה לכך היא שקווי תאי L-WRN מהונדסים להפריש R-spondin 3, בעוד שקו התאים 293T-Rspo1 המומלץ כאן מתוכנן להפריש R-spondin 1. ייתכן שאורגנואידים של חולדות ובני אדם מעדיפים R-spondin 1, מה שעשוי להסביר את הכשל של קווי אורגנואידים של חולדות במדיה מותנית L-WRN.
כדי לשחזר בצורה הקרובה ביותר את הגדרת in vivo , חשוב לפתח תנאי תרבית אורגנואידים המאפשרים הישרדות, תחזוקה ושגשוג של תאי גזע, ושיכולים לשמור על תחלופת תאים ואירועי התמיינות בו זמנית לסוגי תאים בדידים. לכן, הריכוזים של חלבונים רקומביננטיים ו / או חלבונים במדיה מותנית צריכים להיות טיטרציה הדוקה ומבוקרת כדי להגיע לאיזון מושלם זה. בפרט, רמות Wnt אופטימליות חיוניות כדי למנוע אובדן של תרביות אורגנואידים במעי. מעט מדי Wnt במדיה המותנית לא יהיה מסוגל לתמוך בצמיחה, מה שיוביל לאובדן תאי גזע ומוות אורגנואידים לאחר מכן; הפעלת יתר של Wnt תגרום לאורגנואידים להיות ציסטיים ובלתי מובחנים10. אמנם לא מפורט כאן, מומלץ מאוד לבדוק כל אצווה של מדיה מותנית L-Wnt3a ו- 293T-Rspo1 באמצעות בדיקת לוציפראז של כתב Wnt, כגון קו תא Topflash41. מחקרים קודמים תיארו כי אצווה אופטימלית של מדיה L-Wnt3a צריכה לגרום לעלייה של פי 15 באות ב-12.5% ועלייה של פי 300 באות ב-50%, בהשוואה ל-1% L-Wnt3a10. מכיוון שאורגנואידים של חולדות רגישים יותר מאורגנואידים של עכברים לדרישות התרבית, במיוחד לרמות ההפעלה של Wnt, צעדי בקרת איכות נוספים אלה מסייעים מאוד להקל על החוסן והאמינות של תרביות אורגנואידים של חולדות. מכיוון שקו כתבים דומה אינו זמין לבדיקת פעילות Bmp וריכוזי Noggin יחסיים במדיה מותנית Noggin, מומלץ להשתמש ב- Noggin רקומביננטי במידת האפשר כדי לשלוט במדויק ברמות Noggin. בעוד שניתן לגדל ולתחזק אורגנואידים במעיים של עכברים בהיעדר Noggin39, זה לא נוסה עבור תרביות אורגנואידים של חולדות.
מעבר לדרישות תרבית תאים, ההקמה הראשונית המוצלחת של קו אורגנואידים של חולדה תלויה באופן קריטי בדלדול יעיל של וילי ממוין במהלך בידוד קריפטה. רמות גבוהות של זיהום וילאר גורמות למוות של קריפטות, ככל הנראה בשל אותות מהתאים הגוססים, או בשל השתלטות על גורמים חיוניים. כדי לרוקן את הווילי המובחן הזה מתכשירי אפיתל בצורה מדויקת ועקבית, מומלץ לבצע בידודי אפיתל בעזרת סטריאוסקופ. בחינה חזותית של האפיתל המשתחרר מספקת רמז ברור מתי להשליך את PBS ולהחליף אותו (איור 1). אין לאסוף קריפטות עד שיש דלדול מספיק של וילי. תאי וילאר הם בעלי התמיינות סופנית ואינם יכולים לייצר אורגנואידים בתרבית. בנוסף, העברה לאחר מכן של אורגנואידים במעיים של חולדות והשימוש בהם לכל יישום במורד הזרם דורשים טיפול עדין. דגירה בריאגנטים דיסוציאציה לפרקי זמן ארוכים יותר (10 דקות) גורמת למוות תאי משמעותי ולאובדן קו האורגנואידים.
כאן מתואר פרוטוקול פשוט ומהיר ליצירת חד-שכבות מעיים מאורגנואידים של חולדות. למצעי EME וקולגן I יש השפעות שונות על האפיתל, שניתן למנף בהתאם למטרת המחקר. EME מאפשר הידבקות מהירה ויעילה של תאים בודדים ויצירת הקרנות תאים. לעומת זאת, ציפוי פני השטח בקולגן I מעכב תהליכים אלה. ברגע שחד-שכבות מגיעות למפגש של כ-80%, תאים הגדלים ב-EME מתחילים לייצר שוב מבנים אורגנואידים תלת-ממדיים. עם זאת, הם חסרים תמיכה פיזית וכימית מספקת להמשך הצמיחה. ניתן למנוע חזרה זו למצב אורגנואידי על ידי שמירה על חד-שכבות ב-EME במפגש של 50%-80%. תוספת של EME מדולל על פני השטח האפי של monolayers מקדם התאוששות מהירה היווצרות של אורגנואידים דה נובו, יצירת אזורים של התכנסות מהר יותר ובקלות. על משטח קולגן I, תאים יכולים ליצור חד-שכבה אחידה וליצור אשכולות קטנים. עם זאת, תוספת של קולגן I על גבי monolayers אינו מספיק כדי לגרום להיווצרות אורגנואידים. EME חייב להיות מדולל בעת הוספת משטח monolayer, כמו תהיה התנגדות מכנית חזקה יותר עבור אורגנואיד המתהווה להתגבר. עם זאת, EME מדולל זה אינו מאפשר היווצרות חזקה של אורגנואידים גדולים. כל אורגנואיד חולדה שנוצר דה נובו ומתנתק באופן טבעי מפני השטח חייב להיות מוסר מיד ומועבר EME לא מדולל כך שניתן יהיה לשחזר תמיכה מבנית וגדילה. בשל גודלם הקטן של האורגנואידים בשלב זה, המעבר של אורגנואידים אינו מומלץ עד לצמיחה חזקה הוקמה. המשמעות הביולוגית הבסיסית של מדוע EME יכול לתמוך ברפורמציה של אורגנואידים, אך האם קולגן I יכול או לא יכול לעשות זאת, אינה ברורה. עם זאת, היו דיווחים כי תאים שגדלו בקולגן תלת-ממדי אינם יכולים ליצור אורגנואידים ניצנים42,43 או לתמוך בתחזוקה לטווח ארוך. מוצרי EME הזמינים מסחרית הם תערובות הטרוגניות של חלבונים חוץ-תאיים, בעיקר למינין וקולגן IV44. לכן, ההרכב הייחודי של חלבונים והיכולת של תא אפיתל לתקשר עם המטריצה החוץ תאית באמצעות קומפלקסים תאיים שונים יכולים לאפשר עיצוב מחדש ב- EME אך לא בקולגן I. לא נבדקה השאלה אם ניתן להכניס חד-שכבות שמקורן בקולגן I ל-EME כדי לתמוך בהיווצרות וגדילה של אורגנואידים.
מניפולציה גנטית של מודל אורגנואיד המעי של חולדה מתוארת כאן, ומתוארים פרוטוקולים להתמרה לנטיויראלית של אורגנואידים תלת-ממדיים וטרנספקציה חולפת של חד-שכבות דו-ממדיות. כדי להתגבר על היעילות הנמוכה של התמרה אורגנואידית לנטיוויראלית, פותח פרוטוקול לטרנספקציה חולפת של חד-שכבות דו-ממדיות. המורפולוגיה השטוחה והתחומים האפיקליים החשופים של חד-שכבות מספקים גישה קלה יותר לנגיפים ולקומפלקסים המכילים DNA. הביטוי של כתב EGFP באמצעות וקטור pLJM1-EGFP שימש לאימות של טכניקה זו. ביטוי כתב GFP נצפה לאחר 24 שעות, ונשמר במשך 5-6 ימים בחד-שכבות. מחקרים עתידיים שיתמקדו בהתמרה לנטיויראלית של חד-שכבות צפויים להיות בעלי יעילות גבוהה יותר מאשר התמרה אורגנואידית תלת-ממדית. באמצעות הפרוטוקולים לעיל, אורגנואידים תלת ממדיים יכולים להיות מחדש מ monolayers 2D נגוע כדי להקל על יצירת קווים יציבים. בזהירות, ניתן לשמור בהצלחה על קווי אורגנואידים של מעי חולדות במשך למעלה משנה, להישאר יציבים לאורך מעברים רבים, להישמר בהקפאה, להפשיר בהצלחה ולהונדסים גנטית באמצעות התמרה לנטיויראלית, ובכך לענות על הצורך במודל אורגנואיד מעי במבחנה נגיש וניתן להעברה השומר על הרלוונטיות הפיזיולוגית לבני אדם.
Disclosures
ללא.
Acknowledgements
אנו מודים לחברי מעבדות Sumigray ו- Ameen על הדיונים המעמיקים שלהם. עבודה זו נתמכה על ידי מענק בריאות הילד של קרן צ'ארלס הוד ומענק של קרן סיסטיק פיברוזיס (004741P222) ל- KS ועל ידי המכון הלאומי לסוכרת ומחלות עיכול וכליות של המכונים הלאומיים לבריאות ל- NA תחת פרס מספר 2R01DK077065-12.
Materials
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes/Thermo Fisher | D1306 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
References
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved