Method Article
Génération et manipulation d’organoïdes intestinaux de rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un protocole permettant de générer des organoïdes intestinaux de rat et de les utiliser dans plusieurs applications en aval. Les rats sont souvent un modèle préclinique privilégié, et le système organoïde intestinal robuste répond au besoin d’un système in vitro pour accompagner les études in vivo .
Résumé
Lors de l’utilisation d’organoïdes pour évaluer la physiologie et les décisions relatives au destin cellulaire, il est important d’utiliser un modèle qui récapitule étroitement les contextes in vivo . En conséquence, les organoïdes dérivés des patients sont utilisés pour la modélisation des maladies, la découverte de médicaments et le dépistage de traitements personnalisés. Les organoïdes intestinaux de souris sont couramment utilisés pour comprendre les aspects de la fonction/physiologie intestinale et de la dynamique/décision de destin des cellules souches. Cependant, dans de nombreux contextes de maladie, les rats sont souvent préférés aux souris comme modèle en raison de leur plus grande similitude physiologique avec les humains en termes de physiopathologie de la maladie. Le modèle du rat a été limité par le manque d’outils génétiques disponibles in vivo, et les organoïdes intestinaux de rat se sont avérés fragiles et difficiles à cultiver à long terme. Ici, nous nous appuyons sur des protocoles précédemment publiés pour générer de manière robuste des organoïdes intestinaux de rat à partir du duodénum et du jéjunum. Nous donnons un aperçu de plusieurs applications en aval utilisant des organoïdes intestinaux de rat, y compris les tests de gonflement fonctionnel, la coloration de la monture entière, la génération de monocouches entéroïdes 2D et la transduction lentivirale. Le modèle organoïde de rat fournit une solution pratique au besoin du domaine d’un modèle in vitro qui conserve une pertinence physiologique pour l’homme, peut être rapidement manipulé génétiquement et est facilement obtenu sans les obstacles impliqués dans l’obtention d’organoïdes intestinaux humains.
Introduction
L’architecture épithéliale et la composition cellulaire de l’intestin grêle humain sont complexes, reflétant leurs fonctions physiologiques. Le rôle principal de l’intestin grêle est d’absorber les nutriments des aliments qui passent par sa lumière1. Pour maximiser cette fonction, la surface intestinale est organisée en protubérances en forme de doigts appelées villosités, qui augmentent la surface d’absorption, et en invaginations en forme de coupe appelées cryptes, qui abritent et isolent les cellules souches. Au sein de l’épithélium, divers types de cellules absorbantes et sécrétoires spécialisées sont générés pour remplir des fonctions distinctes1. En raison de cette complexité, il a été difficile de modéliser des tissus comme l’intestin dans des lignées cellulaires immortalisées à haut passage transformé. Cependant, l’étude des cellules souches, en particulier des cellules souches adultes et de leurs mécanismes de différenciation, a permis le développement de cultures d’organoïdes intestinaux en 3D. L’utilisation de modèles organoïdes a transformé le domaine, en partie en raison de leur récapitulation de certains composants architecturaux et de l’hétérogénéité des types cellulaires trouvés dans l’intestin intact. Les organoïdes intestinaux peuvent être cultivés in vitro à long terme en raison du maintien de la population active de cellules souches2.
Les organoïdes intestinaux sont rapidement devenus un modèle adaptable pour étudier la biologie des cellules souches, la physiologie cellulaire, les maladies génétiques et la nutrition3,4, ainsi qu’un outil pour développer de nouvelles méthodes d’administration de médicaments5. En outre, les organoïdes dérivés des patients sont utilisés pour la modélisation des maladies, la découverte de médicaments et le dépistage de traitements personnalisés, entre autres 6,7,8,9. Cependant, les organoïdes intestinaux humains présentent encore des défis. La disponibilité des tissus, les exigences relatives à l’approbation du comité d’examen institutionnel et les questions éthiques limitent l’utilisation généralisée d’échantillons humains. De plus, les organoïdes intestinaux humains générés à partir de cryptes intestinales nécessitent deux conditions de culture distinctes pour le maintien de cellules souches indifférenciées ou pour induire la différenciation de types de cellules matures10. Cela contraste avec l’in vivo, où les cellules souches et les types de cellules différenciées matures sont simultanément présents et générés/maintenus en continu1. D’autre part, les organoïdes intestinaux de souris, qui sont cultivés dans un cocktail moins complexe de facteurs de croissance, n’ont pas besoin de ce changement dans la composition du milieu et peuvent maintenir les cellules souches et les cellules différenciées dans le même contexte de milieu 2,11. Cependant, les différences clés dans l’intestin de la souris par rapport aux humains peuvent faire des organoïdes de souris un modèle sous-optimal dans de nombreux cas. Dans l’ensemble, de nombreux organoïdes intestinaux provenant de grands mammifères, y compris les chevaux, les porcs, les moutons, les vaches, les chiens et les chats, ont été générés avec succès dans des conditions de culture plus proches des organoïdes intestinaux de souris que les conditions de culture des organoïdes intestinaux humains12. Les différences dans les conditions des facteurs de croissance entre les organoïdes de souris et les organoïdes humains reflètent probablement des différences dans la composition de la niche des cellules souches et des exigences différentes pour la survie, la prolifération et le maintien des cellules souches. Par conséquent, il est nécessaire de disposer d’un système organoïde modèle facilement accessible qui 1) ressemble beaucoup à la composition des cellules intestinales humaines, 2) contient des cellules souches ayant des besoins en facteurs de croissance comme ceux des organoïdes intestinaux humains, et 3) est capable de maintenir en permanence des compartiments indifférenciés et différenciés. Idéalement, le système devrait provenir d’un modèle animal préclinique couramment utilisé, de sorte que les expériences in vivo et in vitro puissent être corrélées et utilisées en tandem.
Les rats sont un modèle préclinique couramment utilisé pour les études de physiologie et de pharmacologie intestinales en raison de leur physiologie intestinale et de leur biochimie très similaires à celles des humains13, en particulier en ce qui concerne la perméabilité intestinale14. Leur taille relativement plus grande que celle des souris les rend plus aptes aux interventions chirurgicales. Bien que des modèles animaux de grande taille, y compris des porcs, soient parfois utilisés, les rats sont un modèle plus abordable, nécessitent moins d’espace pour l’élevage et ont des souches standard facilement disponibles dans le commerce15. L’un des inconvénients de l’utilisation de modèles de rats est que la boîte à outils génétique pour les études in vivo n’est pas bien développée par rapport à celle des souris, et que la génération de nouvelles lignées de rats, y compris les knock-outs, les knock-ins et les transgéniques, est souvent d’un coût prohibitif. Le développement et l’optimisation d’un modèle robuste d’organoïdes intestinaux de rat permettraient des manipulations génétiques, des traitements pharmacologiques et des études à plus haut débit dans un modèle accessible qui conserve une pertinence physiologique clé pour les humains. Cependant, les avantages d’un modèle d’organoïde de rongeur par rapport à un autre dépendent fortement du processus ou du gène particulier étudié ; Certains gènes trouvés chez l’homme peuvent être des pseudogènes chez la souris, mais pas chez le rat16,17. De plus, les sous-types cellulaires spécifiques à l’espèce sont de plus en plus dévoilés par le RNAseq18,19,20 unicellulaire. Enfin, les modèles de maladies intestinales chez le rat et la souris présentent souvent des variations considérables dans les phénotypes21,22, de sorte que le modèle qui récapitule le plus fidèlement les symptômes et le processus pathologique observés chez l’homme doit être sélectionné pour un travail en aval. La génération d’un modèle d’organoïde intestinal de rat offre aux chercheurs une flexibilité et un choix supplémentaires dans le choix du système modèle le plus approprié à leur situation. Ici, les protocoles existants23,24 sont développés pour la génération d’organoïdes intestinaux de rat et un protocole est décrit pour la génération et le maintien d’organoïdes intestinaux de rat à partir du duodénum ou du jéjunum. En outre, plusieurs applications en aval, y compris l’infection lentivirale, la coloration de la monture entière et les tests de gonflement de la forskoline, sont décrites.
Protocole
REMARQUE : Toute culture cellulaire doit être manipulée à l’aide d’une technique aseptique appropriée dans une hotte de culture tissulaire. Tous les travaux sur les animaux dans cette étude ont été approuvés par le Comité institutionnel de protection et d’utilisation des animaux (IACUC) de Yale.
1. Préparation des réactifs de culture cellulaire
- Préparez le milieu conditionné à la R-spondine 1 en suivant les instructions du fabricant. Préparez le support conditionné Wnt3a en suivant les instructions du fabricant. Préparez AdDMEM+ comme décrit dans le tableau 1.
- Remettre en suspension la gastrine dans un dH2O stérile pour préparer un bouillon de 100 μM. Aliquote et conserver à -80 °C. Remettre en suspension la N-acétylcystéine dans de l’eau stérile pour préparer un bouillon de 100 mM. Aliquote et conserver à -20 °C jusqu’à 1 mois.
- Remettre en suspension de la caboche humaine recombinante dans une solution saline tamponnée au phosphate (PBS) + 0,1 % d’albumine sérique bovine (BSA) pour préparer une souche de 250 μg/mL. Aliquote et conserver à -80 °C. Remettre en suspension le facteur de croissance épidermique (EGF) recombinant de la souris dans du PBS + 0,1 % de BSA pour préparer un stock de 100 μg/mL. Aliquote et conserver à -80 °C.
- Diluer l’IGF-1 humain recombinant dans du PBS + 0,1 % de BSA pour préparer un stock de 100 μg/mL. Aliquote et conserver à -80 °C. Remettre en suspension du FGF-2 humain recombinant dans 5 mM Tris, pH 7,6, pour préparer un bouillon de 100 μg/mL. Aliquote et conserver à -80 °C.
REMARQUE : Pour tous les facteurs de croissance, utiliser une dilution intermédiaire dans du PBS + 0,1 % BSA jusqu’à 100 fois la concentration finale dans le milieu de culture. Conserver à -20 °C.
2. Mise en place d’organoïdes de l’intestin grêle chez le rat
NOTE : Ce protocole a été modifié à partir de deux protocoles publiés précédemment pour les organoïdes intestinaux de rat23,24.
- Préparer les milieux organoïdes intestinaux de rat (rIOM) conformément au tableau 2 et régler un bain-marie à 37 °C. Ce milieu complet est stable pendant 5 jours à 4 °C.
- Préparer 10 mL d’acide éthylènediaminetétraacétique (EDTA) 3 mM dans du PBS dans un tube conique de 15 mL et conserver sur glace. Décongeler 250 μL d’extrait de matrice extracellulaire (EME) sur de la glace.
- Faites jeûner un rat pendant la nuit avec un accès à l’eau ad libitum. Euthanasier le rat selon le protocole approuvé par l’IACUC. Dans ce protocole, des rats Sprague Dawley mâles adultes (pesant ~200 g) ont été euthanasiés par inhalation de CO2 (tableau des matériaux). La luxation cervicale a été utilisée comme méthode secondaire d’euthanasie.
- Utilisez des pinces stériles autoclavées et des ciseaux de dissection pour la dissection. Placez le rat euthanasié sur la surface de dissection, face ventrale vers le haut. Pincez la couche de peau avec une pince ; Les coupes suivantes doivent être effectuées au niveau de la surface, de sorte qu’elles ne coupent que cette couche de peau et ne sont pas assez profondes pour endommager les organes internes.
- Pour ouvrir la cavité abdominale, à l’aide de grands ciseaux de dissection tranchants, coupez la couche de peau dans une grande incision longitudinale au niveau de la surface au centre de l’abdomen. Ensuite, à partir de cette coupe, faites deux coupes horizontales plus courtes, une de chaque côté. Utilisez une pince pour décoller la peau afin d’exposer la cavité abdominale. Coupez à travers la membrane péritonéale pour exposer complètement les organes internes de la cavité abdominale avec un accès facile à l’intestin.
- À l’aide de ciseaux et d’une pince, localisez l’estomac et identifiez le duodénum à environ 2-3 cm distal de celui-ci, qui apparaît comme un segment jaunâtre. Le jéjunum proximal est situé à environ 4-5 cm à l’écart du ligament de Treitz, qui sert de point de repère entre le duodénum et le jéjunum.
- Placez le fragment intestinal isolé dans une boîte de Pétri de 10 cm. Nettoyez autant que possible le segment intestinal souhaité du mésentère. Rincer avec 10 mL de PBS glacé jusqu’à élimination du contenu luminal. Sur un essuie-tout, coupez le segment intestinal en morceaux de ~2 cm de long. Ouvrez chaque morceau d’intestin longitudinalement pour exposer l’épithélium.
- À l’aide d’une lame de microscope en verre, grattez la surface luminale exposée pour enlever les villosités. Placez les morceaux intestinaux dans la solution d’EDTA préparée sur de la glace. Tourner à 4 °C pendant 30 min sur un revolver à tube réglé sur 10 tr/min.
- Au microscope de dissection, versez le contenu du tube conique dans une boîte de Pétri de 10 cm. Ajouter ~5 ml supplémentaires de PBS glacé.
- À l’aide d’une pince fine, maintenez un segment intestinal et secouez vigoureusement. Il sera possible de voir la libération de l’épithélium dans le PBS. Dans un premier temps, le PBS contiendra principalement des villosités.
- Continuez à secouer. Jetez périodiquement les PBS contenant des villosités et ajoutez 10 mL de PBS frais et glacés aux fragments intestinaux. Continuez à secouer les fragments et répétez cette étape de lavage jusqu’à ce que les villosités ne soient plus libérées dans le PBS, mais que le PBS contienne principalement des cryptes. Ne dépassez pas 15 minutes pour l’isolement de la crypte, afin que la viabilité des cellules ne soit pas compromise.
- Jetez les fragments intestinaux restants. Enrichissez le PBS restant dans la boîte de Pétri pour les cryptes intestinales. Dans une hotte de culture tissulaire, recueillir les cryptes contenant du PBS et les filtrer à travers un tamis cellulaire de 70 μm (tableau des matériaux).
- Centrifuger à 250 x g pendant 5 min. Retirer le surnageant et remettre la pastille en suspension dans 5 mL d’AdDMEM+. Centrifuger à nouveau à 250 x g pendant 5 min.
REMARQUE : Il est recommandé d’utiliser une centrifugeuse avec un rotor à godets pivotants. - Retirez le surnageant en laissant ~50 μL de média avec la pastille. Remettre la pastille en suspension dans le milieu restant et l’ajouter à l’aliquote de l’EME sur glace. Pipetez doucement de haut en bas pour suspendre les cryptes uniformément dans tout l’EME. Évitez d’introduire des bulles.
- Plaquer 50 μL de dômes EME dans une boîte de culture tissulaire de 35 mm et incuber pendant 20 min dans un incubateur de culture tissulaire à 37 °C, 5 % de CO2 .
- Ajouter 2 mL de rIOM (tableau 2) contenant 10 μM Y27632 et 10 μM CHIR99021 (tableau 3). Après le passage, Y27632 et CHIR99021 peuvent être abandonnés.
- Changez le rIOM tous les 2-3 jours. Passage au besoin, généralement entre 3 et 7 jours, en fonction du nombre initial d’organoïdes, de la taille et du taux de croissance.
3. Passage d’organoïdes intestinaux de rat
- Décongeler une aliquote de 250 μL d’EME sur de la glace et préchauffer le rIOM à 37 °C.
- Aspirer le milieu à partir d’une plaque de 35 mm contenant des organoïdes et ajouter 1 mL de réactif de dissociation pour libérer immédiatement les organoïdes des dômes EME.
- Transférer immédiatement le réactif de dissociation avec les organoïdes fragmentés dans un tube conique de 15 mL. Lavez la plaque de culture avec 2 mL d’AdDMEM+ et ajoutez-la au tube conique de 15 mL contenant les organoïdes fragmentés.
- À l’aide d’une pipette Pasteur en verre, pipetez doucement de haut en bas 15 à 20 fois pour fragmenter les organoïdes. Centrifuger à 350 x g pendant 2 min.
- Ajouter ~50 μL de solution du fond du tube conique dans l’EME. Pipeter doucement de haut en bas pour mélanger. Évitez de faire des bulles.
- Plaquer 50 μL de dômes EME dans une boîte de 35 mm et incuber pendant 20 min dans un incubateur de culture tissulaire à 37 °C, 5 % de CO2 .
- Ajouter 2 mL de rIOM avec 10 μM Y27632 et 10 μM CHIR99021. Changez le milieu de culture tous les 2-3 jours. Lors du changement de support, Y27632 et CHIR99021 peuvent être omis.
4. Cryoconservation et décongélation d’organoïdes intestinaux de rat
- Cryoconservation d’organoïdes intestinaux de rat
NOTE : Le protocole de cryoconservation a été modifié par rapport à un protocole antérieur pour les organoïdes humains et murins25. Avant la congélation, les organoïdes doivent avoir au moins deux passages en culture primaire. Il est conseillé de cultiver des organoïdes jusqu’à ce qu’ils soient de gros sphéroïdes ou des organoïdes légèrement bourgeonnés avant la cryoconservation, car cela se traduira par un rendement plus élevé d’organoïdes viables après décongélation. Pour ce faire, il suffit d’augmenter le milieu conditionné par la R-spondine à 15 % et/ou d’ajouter 10 mM de nicotinamide (tableau 3) à la culture d’organoïdes.- À l’aide d’un microscope, comptez le nombre d’organoïdes sur la boîte de 35 mm. Étiquetez les cryoflacons de manière à ce que 200 organoïdes soient aliquotes dans chaque cryoflacon.
- Retirez le rIOM de la coupelle de 35 mm. Remplacer par 2 mL de PBS de culture tissulaire à froid.
- À l’aide d’un embout P1000, libérez les dômes EME du fond de la boîte de culture dans le PBS en pipetant de haut en bas. Continuez à pipeter de haut en bas ~20 fois pour briser l’EME et libérer les organoïdes. Recueillir les organoïdes et le PBS dans un tube conique de 15 ml.
- Ajouter 2 mL de PBS froid dans la boîte de culture et pipeter de haut en bas pour libérer les organoïdes restants dans le PBS. Transférer le PBS dans le tube conique de 15 ml.
- Pelleter les organoïdes par centrifugation à 290 x g pendant 5 min. Retirez et jetez le surnageant sans perturber la pastille organoïde.
- Lavez la pastille en la remettant délicatement en suspension dans 5 ml d’AdDMEM+ froid. Centrifuger à 200 x g pendant 4 min. Retirez et jetez soigneusement le surnageant.
- Remettre en suspension la pastille organoïde dans 1 mL de milieu de congélation à froid pour 200 organoïdes. Aliquote : 1 mL d’organoïdes dans un milieu de congélation par flacon cryogénique marqué. Placez les cryoflacons dans un récipient de congélation.
- Conservez les organoïdes dans un récipient de congélation à -80 °C pendant 24 h, puis transférez les flacons cryogéniques dans de l’azote liquide pour un stockage à long terme.
- Décongélation d’organoïdes intestinaux de rat
NOTA : Ce protocole a été modifié par rapport à un protocole antérieur pour la décongélation d’organoïdes intestinaux humains et de souris26.- Décongeler une aliquote de 250 μL d’EME sur la glace. Préparer la rIOM complétée par un milieu conditionné à 15 % de R-spondine, 10 μM Y27632 et 10 μM CHIR99021. Chaud à 37 °C.
- Ajouter 2 mL de milieu de décongélation (tableau 3) dans un tube conique de 15 mL à température ambiante.
- Prélever et décongeler un flacon d’organoïdes à partir d’azote liquide en plaçant le flacon dans un bain-marie à 37 °C jusqu’à ce que le flacon soit presque complètement décongelé.
- Ajouter 1 mL de milieu de décongélation dans le flacon et transférer tout le contenu dans le tube conique contenant le milieu de décongélation. Lavez le flacon deux fois avec 1 mL de milieu de décongélation et transférez-le dans le tube conique.
- Centrifuger à 200 x g pendant 5 min. Aspirer le milieu en laissant ~50 μL de milieu avec les organoïdes. Transférer le milieu contenant des organoïdes dans 250 μL d’EME.
- Répartissez uniformément les organoïdes dans l’EME en pipetant de haut en bas, en évitant les bulles. Pipeter six dômes de 50 μL dans une boîte de culture tissulaire de 35 mm.
- Incuber dans l’incubateur de culture tissulaire pendant 15 à 20 minutes pour permettre à l’EME de polymériser. Ajouter 2 mL de rIOM préparé dans le plat.
- Au bout de 2 jours, remplacez le support par rIOM. L’utilisation de Y27632 et de CHIR99021 peut être suspendue. La croissance des organoïdes peut être lente lors du premier passage après la décongélation. Il est conseillé de faire passer les organoïdes deux fois après la décongélation avant de commencer les expériences.
5. Génération de monocouches 2D intestinales de rat à partir d’organoïdes 3D
REMARQUE : Le protocole suivant décrit les volumes requis pour générer 24 puits d’une plaque de 48 puits recouverte d’EME, en commençant par six dômes de 50 μL (boîte de 35 mm) contenant ~300 organoïdes intestinaux/dôme (échelle : un dôme génère quatre puits), mais peut être augmenté ou réduit selon les besoins. Tel qu’il est écrit, ce protocole permet d’atteindre ~80% de confluence en 4-5 jours. À une confluence plus élevée, les cellules recommencent à acquérir des structures organoïdes 3D. À faible confluence (≤40%), les cellules restent sous forme de monocouches et sont viables pendant ~14 jours. Si le but de l’étude est d’utiliser des monocouches 2D, réduisez l’échelle de manière à ce qu’un dôme génère huit puits d’une plaque de 24 puits. Les puits peuvent également être recouverts de collagène I pour former des monocouches.
- Préparation des surfaces revêtues
- Pour enrober la plaque d’EME, diluez l’EME 1 :20 dans de l’AdDMEM+ froid (tableau 1). Pour l’enrobage de collagène, préparez le collagène I selon les instructions du fabricant. Diluer 5 mg/mL de collagène I dans AdDMEM+ à 100 μg/mL (1 :50 dans ce cas).
- Enduisez la plaque de 200 μL d’EME ou de collagène dilué pour recouvrir entièrement la surface du puits. Incuber pendant 1 à 2 h à 37 °C dans un incubateur de culture tissulaire. Préparer le milieu organoïde intestinal de rat pour la culture monocouche 2D (rIOM2D) conformément au tableau 4.
- Génération de monocouches
- Aspirer le milieu à partir d’une plaque de 35 mm contenant des organoïdes. Ajouter 1 mL de PBS.
- Perturbez l’EME dans les puits en grattant avec une pointe P1000. Pipeter de haut en bas environ 20 fois pour desserrer tout l’EME. Transférez le tout dans un tube conique de 15 ml.
- Ajouter 1 mL de PBS dans la plaque de 35 mm pour récupérer les organoïdes supplémentaires et transférer dans le même tube conique de 15 mL.
- Centrifuger à 350 x g pendant 2 min et aspirer le surnageant, y compris les résidus d’EME. Ajouter 1 mL de solution de trypsine à la pastille organoïde et incuber à 37 °C pendant 2 min.
- Pipeter 10 fois de haut en bas à l’aide d’un embout P1000 et ajouter 2 mL d’AdDMEM+ pour neutraliser la trypsine.
- Centrifuger à 350 x g pendant 5 min. Aspirer le surnageant et ajouter 4,8 mL de rIOM2D (tableau 4). Remettre en suspension la pastille cellulaire.
- Avant de placer les organoïdes, retirez tout excès d’EME ou de collagène dans AdDMEM+ des puits. Ensuite, ajoutez 200 μL d’organoïdes dans rIOM2D et 10 μM Y27632 dans chaque puits pré-enrobé.
- Après 4 à 16 h, recueillir le milieu et la centrifugeuse à 1 000 x g pendant 1 min. Transférez le surnageant dans un nouveau tube conique de 15 mL et jetez la pastille.
- Lavez chaque puits avec 300 μL de PBS et ajoutez 200 μL de rIOM2D centrifugé dans chaque puits. Changez le rIOM2D tous les 2-3 jours, en suspendant l’utilisation de Y27632.
- Reformation d’organoïdes 3D à partir de monocouches 2D
REMARQUE : Les monocouches cultivées sur EME peuvent être induites à reformer les organoïdes 3D, tandis que les monocouches cultivées sur le collagène I ne reviennent pas efficacement aux organoïdes 3D. Habituellement, 2 à 3 puits d’organoïdes générés à partir de monocouches peuvent être utilisés pour fabriquer un dôme de 50 μL d’EME au jour 5.- Diluer l’EME 1 :4 dans rIOM2D. Lorsque les monocouches atteignent ~80 % de confluence, aspirez soigneusement le milieu et ajoutez 100 μL d’EME dilué dans les puits contenant des monocouches.
- Incuber à 37 °C, 5% de CO2 dans un incubateur de culture tissulaire pendant 20 min. Ensuite, ajoutez 100 μL de rIOM2D et retournez dans l’incubateur de culture tissulaire. Les organoïdes 3D seront générés dans les 5 jours suivant l’ajout d’EME dilué.
- Une fois que les petits organoïdes se sont reformés (~jour 5), préparez rIOM. Recueillir tout le contenu du puits, pipeter de haut en bas pour perturber l’EME, et transférer dans un tube conique de 15 ml.
- Centrifuger à 350 x g pendant 2 min. Aspirer le surnageant et le résidu EME.
- Ajouter 1 mL d’AdDMEM+ froid et centrifuger à 350 x g pendant 2 min. Retirez le surnageant en laissant ~50 μL de milieu.
- Transférez les 50 μL de milieux et d’organoïdes dans une aliquote EME de 250 μL. Pipeter de haut en bas pour répartir les organoïdes dans tout l’EME.
- Pipeter 50 μL de dômes EME dans une boîte de 35 mm et incuber pendant 20 min dans un incubateur de culture tissulaire.
- Ajouter 2 mL de rIOM plus 10 μM Y27632. Changez le milieu de culture tous les 2-3 jours. Lors du changement de support, Y27632 peut être omis.
6. Manipulation génétique
- Transfection transitoire de monocouches 2D
ATTENTION : Préparer les monocouches de l’épithélium intestinal du rat conformément à la section 5.1 dans une plaque à 48 puits. La transfection doit être effectuée à 70 % à 80 % de confluence. Remplacez toujours le média dans les puits par 200 μL de rIOM2D frais avant le transfectage. Calculer les rapports d’absorbance de 260/280 nm et 260/230 nm de l’ADN plasmidique ; Ceux-ci doivent être supérieurs à 1,8 pour garantir de bons résultats de transfection.
REMARQUE : Utilisez un contrôle plasmidique pour calculer l’efficacité de la transfection. Un plasmide codant pour une protéine fluorescente est recommandé pour plus de facilité. Dans ce protocole, le pLJM1-EGFP27 a été utilisé.- Préparer 1 mg/mL de polyéthylénimine à 20 kDa (PEI ; Tableau 3). Pour chaque puits, préparer le tube A (0,6 μg de plasmide + 50 μL de milieu sérique réduit) et le tube B (1,8 μL de PEI + 50 μL de milieu sérique réduit). Maintenir un rapport ADN :PEI de 1 :3.
- Vortex des deux tubes pendant 30 s. Combiner le tube A et le tube B, et tourbillonner à nouveau pendant 30 s. Si nécessaire, utilisez une centrifugeuse pour faire tourner. Incuber pendant 20 min à température ambiante.
- Ajouter délicatement le complexe ADN/PEI goutte à goutte à la monocouche 2D. Remuez doucement l’assiette pour mélanger. Incuber à 37 °C, 5 % de CO2. L’expression peut généralement être détectée après 24 h.
REMARQUE : S’il est nécessaire de revenir à des structures organoïdes 3D, attendez 48 h après la transfection pour ajouter de l’EME dilué.
- Transduction lentivirale d’organoïdes intestinaux de rat
REMARQUE : Avant de travailler avec des lentivirus, obtenir l’autorisation appropriée et une formation spécialisée de l’établissement. Portez toujours un équipement de protection individuelle (EPI) approprié lorsque vous manipulez des lentivirus. Bien que cela ne soit pas décrit ici, un lentivirus concentré de haute qualité est essentiel pour une infection réussie des organoïdes. Ce protocole utilisait un vecteur pLJM1-EGFP vide27 pour exprimer la GFP soluble. Ce protocole est modifié à partir d’un protocole précédemment publié28. L’efficacité de la transduction dépend de la qualité et de la concentration des particules virales, de l’efficacité de la dissociation des organoïdes en petits amas de cellules et du gène exprimé. Lorsqu’elle a été calculée 5 jours après l’infection, l’efficacité moyenne de la transduction avant la sélection était de 19,4 % (± un écart-type de 6,5 %).- À 2 jours avant l’infection par le lentivirus, prévoir le passage (section 3) de deux puits denses d’une plaque de 24 puits pour chaque lentivirus qui sera transduit. Chaque puits d’une plaque de 24 puits peut accueillir un dôme de 50 μL d’EME.
- Une fois l’EME solidifié, ajoutez 0,5 mL de rIOM complété par 10 mM de nicotinamide, 10 μM Y27632 et 2,5 μM CHIR99021. Cela induit de grandes morphologies sphéroïdales, ce qui est favorable à l’efficacité de la transduction lentivirale. Dans les 2 jours suivant le placage, les organoïdes de rat doivent être de gros sphéroïdes. Si une différenciation significative (c.-à-d. bourgeonnement) est observée, repasser les organoïdes.
- Décongeler le virus concentré sur la glace. Préparer un nouveau milieu de transduction, conformément au tableau 3.
- À l’aide d’une pointe P1000, libérez les dômes EME du fond de la boîte de culture cellulaire dans le milieu en pipetant de haut en bas. Continuez à pipeter de haut en bas 20 fois pour briser l’EME et libérer les organoïdes.
- Pipeter les organoïdes et les milieux dans un tube conique de 15 ml. Tous les puits peuvent être regroupés, à condition que les organoïdes aient le même génotype et soient issus de la même lignée.
- Lavez chaque puits deux fois avec 1 mL d’AdDMEM+ froid. Récupérez l’AdDMEM+ et transférez-le dans le même tube conique de 15 ml.
- À l’aide d’une pipette Pasteur en verre, perturber mécaniquement les organoïdes de rat. Il s’agit d’une étape cruciale, car l’objectif est de créer de petits amas multicellulaires de cellules. Pipeter de haut en bas ~30 fois. Vérifiez l’efficacité de la perturbation au microscope à l’aide d’un objectif 4x. Continuez ce processus jusqu’à ce que la suspension cellulaire soit principalement composée d’amas cellulaires avec peu d’organoïdes restants.
REMARQUE : Alternativement, les organoïdes peuvent être centrifugés à 200 x g pendant 5 min à température ambiante, le surnageant soigneusement retiré et remis en suspension dans 1 mL d’enzyme recombinante remplaçant la trypsine/EDTA conventionnelle, préchauffée à 37 °C dans l’incubateur de culture tissulaire. Incuber les organoïdes en remplacement de la trypsine pendant 2 min dans un bain-marie à 37 °C, avec des vortex réguliers pour favoriser la dissociation. Évitez l’incubation prolongée avec remplacement de la trypsine, car cela peut favoriser la mort cellulaire. Vérifiez régulièrement l’efficacité de la perturbation au microscope à l’aide d’un objectif 4x. Lorsque la suspension est composée principalement de cellules uniques avec peu de cultures cellulaires, diluez le remplacement de la trypsine en ajoutant 4 mL d’AdDMEM+ et passez à l’étape suivante. - Essorer le tube conique de 15 mL contenant les amas de cellules à 200 x g pendant 5 min à 4 °C. Retirez et jetez soigneusement le surnageant, en prenant soin de ne pas perturber la pastille cellulaire.
- Remettre en suspension les amas cellulaires dans 230 μL de milieu de transduction par puits à infecter. Pour l’infection, utilisez un puits d’une plaque de 48 puits pour chaque lentivirus.
- Plaquer 230 μL de suspension cellulaire dans chaque puits d’une plaque étiquetée à 48 puits. Ajouter 20 μL de virus concentré dans chaque puits. À l’aide d’un embout P1000, mélangez la solution virale/cellulaire dans chaque puits et scellez la plaque avec un film transparent.
- Effectuer la spinoculation : centrifuger la plaque à 600 x g pendant 1 h à 32 °C. Desceller la plaque et incuber à 37 °C, 5% CO2 pendant 6 h.
- Préchauffez une plaque de 24 puits dans l’incubateur à 37 °C.
- Après l’incubation, pipeter chaque puits de haut en bas et transférer le contenu dans un tube étiqueté de 1,5 ml. Lavez chaque puits avec 750 μL d’AdDMEM+ et transférez-les dans le tube. Essorer les tubes à 600 x g pendant 5 min à 4 °C.
- Retirez les tubes de la centrifugeuse et conservez-les sur de la glace. Utilisez un embout P1000 pour retirer soigneusement et éliminer correctement le surnageant.
- Remettre en suspension la pastille de cellule dans l’EME et plaquer des dômes de 50 μL dans la plaque préchauffée à 24 puits. Incuber pendant 15-20 min à 37 °C jusqu’à ce que l’EME soit polymérisé.
- Dans chaque puits, ajoutez 500 μL de rIOM complété par 10 mM de nicotinamide, 10 μM Y27632 et 2,5 μM CHIR99021.
- Remplacez le milieu par rIOM plus 10 μM Y27632 1 jour après l’infection. Changez le support tous les 2-3 jours. Si une sélection doit être effectuée, ajouter la sélection 48 à 72 h après l’infection. Pour la sélection de la puromycine, utilisez 2 μg/mL de puromycine.
7. Coloration par immunofluorescence des organoïdes
- Aspirer le milieu et ajouter 4 % de paraformaldéhyde (PFA) dans le PBS-Tween 20 (PBS-T) (tableau 3) aux organoïdes dans une boîte de culture cellulaire. Incuber à température ambiante pendant 10 min.
- Libérez les organoïdes de l’EME en pipetant de haut en bas. Recueillir les organoïdes dans un tube de 0,75 ml. Les organoïdes se déposeront au fond du tube par gravité en quelques minutes. Si nécessaire, centrifuger à 100 x g pendant 1 min.
- À l’aide d’une pipette de transfert, retirez le PFA et remettez les organoïdes en suspension dans le PBS-T. Laissez les organoïdes se déposer au fond du tube. Retirer le PBS-T et le remettre en suspension dans 200 μL de solution en bloc (tableau 3).
- Incuber à température ambiante sur un rocker ou un nutator pendant 45 min. Les organoïdes peuvent s’agglutiner et se déposer au fond du tube. Effleurez périodiquement le tube avec les doigts pour le remettre en suspension et le disperser dans toute la solution.
- Laissez les organoïdes se déposer au fond du tube. Si nécessaire, centrifuger à 100 x g pendant 1 min. Retirez la solution de bloc.
- Ajouter l’anticorps primaire dilué dans 100 μL de solution en bloc. Incuber à température ambiante sur un mélangeur à nutation pendant 45 min à 24 tr/min. Les concentrations d’anticorps varient en fonction de l’anticorps utilisé.
REMARQUE : Cette étape peut être prolongée en fonction de l’anticorps primaire, jusqu’à une nuit à 4 °C. - Laissez les organoïdes se déposer au fond du tube. Si nécessaire, centrifuger à 100 x g pendant 1 min.
- Laver dans le PBS-T cinq fois à l’aide d’une pipette de transfert. Incuber à température ambiante pendant 5 min sur un mélangeur à nuter à 24 tr/min. Répétez cette étape deux fois.
- Ajouter l’anticorps secondaire dilué 1 :200 et 50 μg/mL de 4′,6-diamidino-2-phénylindole (DAPI) dilué dans 100 μL de solution en bloc. Incuber à température ambiante sur un mélangeur à nuter pendant 30 min à 24 tr/min.
- Laissez les organoïdes se déposer au fond du tube. Si nécessaire, centrifuger à 100 x g pendant 1 min. Retirez l’anticorps secondaire. Laver cinq fois dans du PBS-T à l’aide d’une pipette transfert.
- Incuber à température ambiante pendant 5 min sur un mélangeur à nuter à 24 tr/min. Répétez l’étape de lavage deux fois.
- Pendant le lavage des organoïdes, chauffer une aliquote de mastic VALAP (tableau 3) à 40-50 °C pour qu’elle se liquéfie. À l’aide d’un pinceau, peignez un mince carré de VALAP sur une lame de microscope de la taille d’une lamelle de recouvrement. Utilisez une lamelle de 22 mm x 22 mm n° 1,5.
- À l’aide de ciseaux, coupez l’extrémité d’une pointe de pipette P200. Transférez les organoïdes dans le puits VALAP sur la lame. À l’aide d’une lingette en papier, évacuez soigneusement le PBS-T. Ne laissez pas les organoïdes se dessécher.
- Arrosez le puits VALAP d’un support de montage anti-décoloration (tableau 3). Pour un carré de ~22 mm x 22 mm, cela nécessitera 100-150 μL d’anti-décoloration.
- Les organoïdes peuvent se regrouper ; Agitez l’Antifade avec une pointe de pipette pour redistribuer les organoïdes, si nécessaire. Montage avec lamelle de 22 mm x 22 mm n° 1,5, en évitant les bulles d’air. Scellez la lamelle en peignant une fine couche de VALAP sur les bords.
REMARQUE : Pour les microscopes inversés, les organoïdes peuvent également être montés dans une boîte à fond en verre de 35 mm.
8. Gonflement induit par la forskoline des organoïdes intestinaux de rat
- Cultivez les organoïdes pendant 3 à 5 jours après le passage dans rIOM. Il est conseillé de cultiver des organoïdes dans une plaque à 24 puits pour s’assurer que la même région peut être facilement recréée. Capturez des images avant l’ajout de forskoline (T0).
- Ajouter la forskoline (tableau 3) directement dans le milieu organoïde jusqu’à une concentration finale de 10 μM. Ajouter le même volume de diméthylsulfoxyde (DMSO) dans les puits témoins.
- Imagez les puits témoins et traités à la forskoline à intervalles réguliers, toutes les 15 à 30 minutes. Lorsqu’il n’y a pas d’imagerie, conservez les organoïdes dans l’incubateur ou utilisez un système d’imagerie contrôlée avec incubation. Le gonflement maximal doit être observé à 120 min.
- Suivre les protocoles standard pour calculer l’enflure relative à partir des images acquises29.
Résultats
Les organoïdes duodénaux et jéjunaux de rat ont été générés à l’aide du protocole décrit à la section 2. Il est très important pendant les étapes d’isolement de la crypte que les villosités soient efficacement épuisées du PBS. Si trop de villosités sont plaquées dans l’EME avec des cryptes, cela peut entraîner la mort de toute la culture et l’échec de l’établissement d’une lignée organoïde. Pour cette raison, il est utile d’isoler les cryptes sous une lunette de dissection, ce qui permet de confirmer visuellement l’épuisement du villar. La figure 1 représente des fragments de villar et des cryptes représentatifs (figure 1A). Notez la taille significativement plus petite des cryptes par rapport aux villosités (Figure 1B). Après le placage, les cryptes se développeront en sphéroïdes au cours des prochains jours et commenceront à bourgeonner et à se différencier entre le 4e et le 7e jour (figure 2). Une fois que les organoïdes ont atteint un stade de bourgeonnement important, ils doivent être passés. Pendant le passage, il est important de perturber suffisamment les organoïdes pour séparer les bourgeons de la crypte, afin que le nombre d’organoïdes puisse être augmenté (Figure 3B).
La récupération réussie des organoïdes après congélation dépend fortement de l’état dans lequel ils sont congelés. Les organoïdes à l’état indifférencié hautement prolifératif se rétablissent avec la plus grande efficacité. Par conséquent, nous recommandons de les induire pour qu’ils soient sphériques et kystiques au lieu d’être bourgeonnés et différenciés. Pour y parvenir, Wnt peut être hyperactivé en augmentant la quantité du ligand Wnt R-spondine dans le milieu et en incluant du nicotinamide dans le milieu, dont il a été démontré qu’il favorise la formation d’organoïdes et la survie cellulaire dans plusieurs systèmes de culture30,31. La figure 3A montre une culture d’organoïdes saine seulement 2 jours après la décongélation. L’inclusion de BSA dans les milieux pendant la décongélation a également contribué à la survie des cultures d’organoïdes intestinaux de rat, qui se sont avérées plus délicates que les organoïdes intestinaux de souris.
Bien que la culture d’organoïdes 3D soit souvent préférée parce qu’elle récapitule une partie de l’architecture intestinale normale, elle rend d’autres approches, notamment l’imagerie en direct, les transfections et les transductions lentivirales, plus difficiles sur le plan technique. L’utilisation de monocouches 2D générées à partir d’organoïdes3D 32 (Figure 4) permet une introduction plus efficace des plasmides. Alors que les organoïdes intestinaux 3D sont traditionnellement résistants aux transfections transitoires, les plasmides codant pour l’EGFP peuvent être introduits avec succès à l’aide de méthodes de transfection à base de lipides. L’approche la plus rentable utilisant l’IPE est décrite à l’étape 6.1 (figure 5), mais l’électroporation et les réactifs de transfection disponibles dans le commerce ont également donné des résultats comparables (données non présentées). Les études futures se concentreront sur la question de savoir si ces approches peuvent être utilisées pour introduire des constructions CRISPR dans des monocouches.
Il était important de pouvoir reformer les organoïdes 3D à partir de monocouches 2D après la transfection afin qu’ils puissent être maintenus comme une ligne passable avec les composants architecturaux 3D des cryptes. Il est intéressant de noter que les monocouches 2D plaquées sur l’EME se sont facilement reformées en petits sphéroïdes lorsque l’EME a été rajoutée au sommet des cellules, alors qu’un substrat de collagène I n’était pas suffisant pour la reformation des structures 3D (Figure 6).
Bien que les transfections transitoires soient utiles pour de nombreuses études, la formation de lignées stables est souvent plus utile, nécessitant l’introduction de lentivirus dans les cellules. Des organoïdes intestinaux de rats ont été infectés par des lentivirus en modifiant des protocoles précédemment publiés (Figure 7). Une étape clé du protocole est la perturbation des organoïdes en petits agrégats ou en amas de cellules. Si les cultures ne sont pas efficacement perturbées et que les organoïdes restent intacts, les particules lentivirales ne pénètrent pas dans les cellules. Après l’infection, les organoïdes doivent se rétablir et repousser. Le protocole décrit ici permet l’absorption des particules virales par 10 % à 48 % (moyenne : 19,4 % ± 6,5 %) des cellules avant la sélection.
La coloration complète des organoïdes peut s’avérer difficile en raison de l’élimination incomplète des résidus d’EME ou de la pénétrance incomplète des anticorps. Le protocole décrit ici permet la coloration robuste des organoïdes. La visualisation des organoïdes au microscope confocal peut également s’avérer difficile s’ils sont trop éloignés de la lamelle. En utilisant VALAP, un puits avec une certaine hauteur est créé de sorte que les organoïdes ne sont pas écrasés par la lamelle, mais sont toujours autorisés à se déposer près de la lamelle pour faciliter l’imagerie. La figure 8 montre une coloration représentative contre le canal anionique apical, le régulateur de la conductance transmembranaire de la mucoviscidose (CFTR) et la phalloïdine pour marquer la F-actine.
Enfin, les organoïdes ont une utilité dans les essais fonctionnels. Des organoïdes dérivés de patients atteints de fibrose kystique ont été utilisés pour dépister la fonction CFTR, car le traitement par l’agoniste de l’AMPc, la forskoline, induit une sécrétion liquidienne robuste médiée par CFTR, provoquant un gonflement des organoïdes 29,33-37. L’un des objectifs de ce travail était d’identifier et de développer un modèle organoïde pouvant être utilisé en parallèle d’études précliniques in vivo. Par conséquent, nous avons cherché à déterminer si les organoïdes intestinaux de rat subissent un gonflement induit par la forskoline. En effet, dans les 30 minutes suivant le traitement à la forskoline, les organoïdes de rat ont gonflé, avec un effet maximal observé à 120 min (Figure 9).
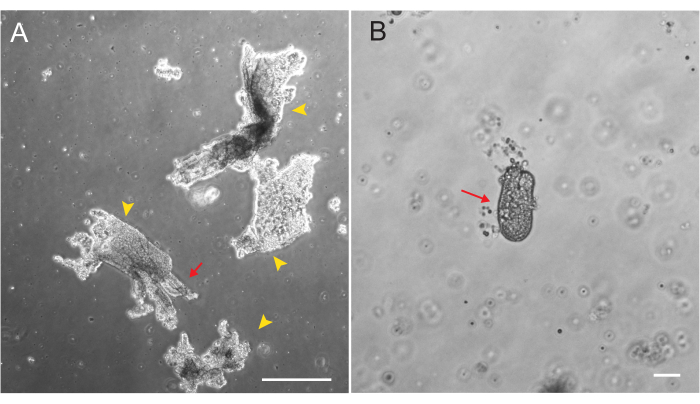
Figure 1 : Fragments de Villar et cryptes lors de l’isolement épithélial. (A) Image représentative de fragments de Villar dans une solution d’EDTA pendant le protocole d’isolement de la crypte. Des pointes de flèches jaunes marquent les fragments de villar. Les flèches rouges représentent des cryptes attachées à un fragment de villar. Notez la différence dans les tailles relatives. (B) Image à fort grossissement d’une seule crypte (flèche rouge) afin que la morphologie puisse être visualisée. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
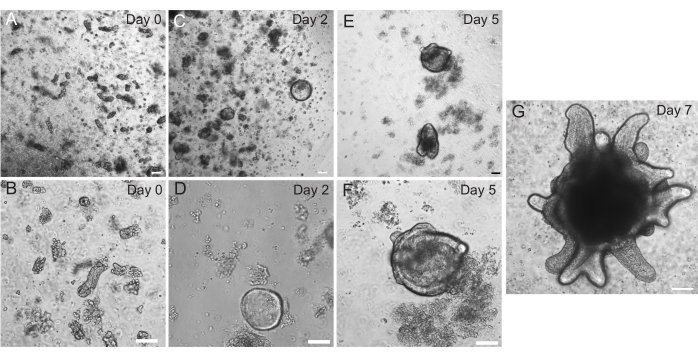
Figure 2 : Progression des organoïdes intestinaux chez le rat. Les cryptes du jéjunum des rats ont été plaquées dans l’EME immédiatement après l’isolement (A, B). En 2 jours, les cryptes sont devenues des sphéroïdes (C,D). Au jour 5, ils ont commencé à initier les bourgeons de la crypte (E, F), qui se sont élaborés et ont grandi au jour 7 (G). Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
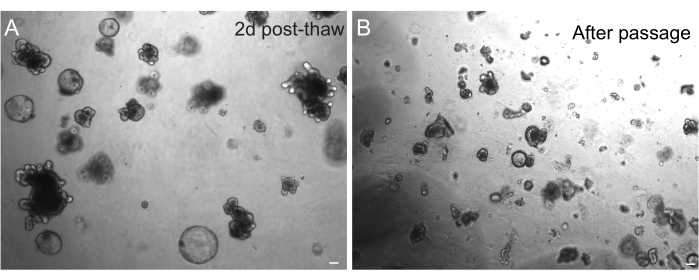
Figure 3 : Organoïdes après décongélation et passage. (A) Les organoïdes jéjunaux de rat ont été décongelés selon les protocoles décrits après la cryoconservation. Notez la présence à la fois de sphéroïdes et d’organoïdes bourgeonnés seulement 2 jours après la décongélation. (B) La même lignée organoïde représentée en A immédiatement après le passage selon le protocole décrit. Notez la différence de taille relative entre les structures de A et B et la présence de domaines uniques de type crypte dans B. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
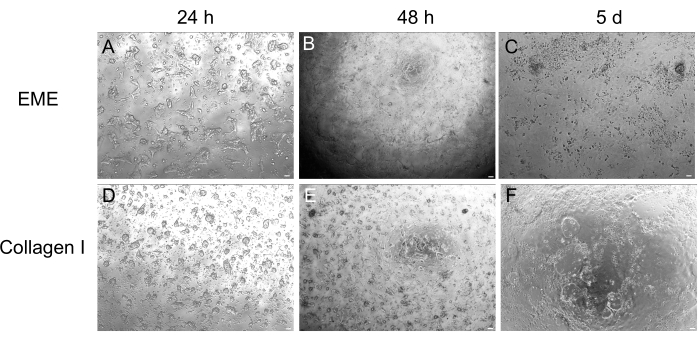
Figure 4 : Formation de monocouches 2D à partir d’organoïdes 3D. (A-C) Progression monocouche 2D sur EME. (D-F) Progression monocouche 2D sur collagène I. Au jour 5, chaque condition a donné ~80% de confluence. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
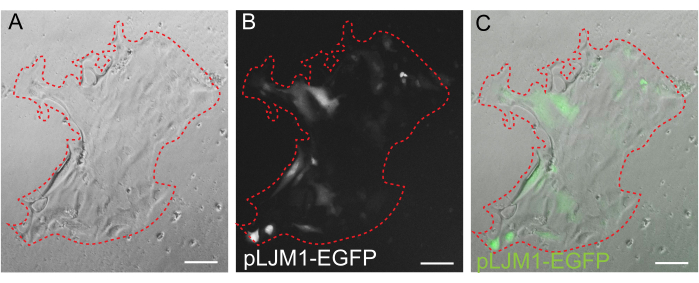
Figure 5 : Transfection transitoire d’une monocouche 2D. Image représentative d’une monocouche 2D cultivée sur EME transfectée transitoirement avec un plasmide pLJM1-EGFP à l’aide de PEI. (A) fond clair, (B) fluorescence (GFP), (C) superposition. La ligne pointillée rouge marque la limite de la monocouche. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
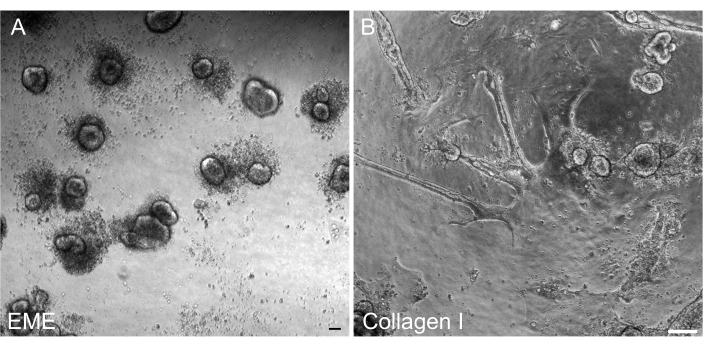
Figure 6 : Reformation d’organoïdes 3D à partir de monocouches 2D sur EME. (A) Formation d’organoïdes 3D à partir de monocouches 2D cultivées sur EME. Les organoïdes se forment efficacement 5 jours après l’ajout d’EME à la surface apicale de la monocouche. Notez l’abondance de cellules mortes entourant les petits sphéroïdes 3D. (B) Persistance des monocouches 2D 5 jours après l’ajout du collagène I à la surface apicale des monocouches 2D cultivées sur du collagène I. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
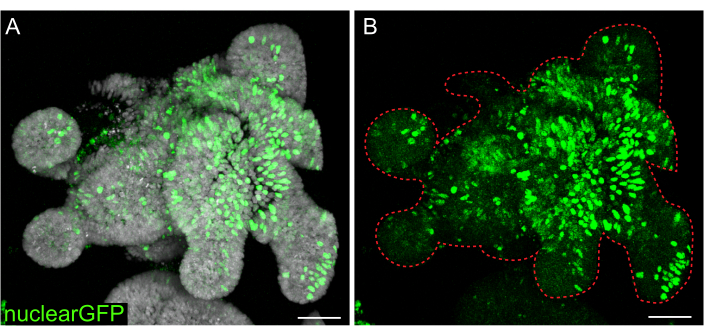
Figure 7 : Infection lentivirale d’organoïdes 3D. Les organoïdes du jéjunum de rat ont été infectés par des particules lentivirales GFP nucléaires en utilisant le protocole décrit. Après récupération et croissance pendant 5 jours, les organoïdes ont été fixés et contre-colorés avec du DAPI. (A) DAPI : gris ; nucléaireGFP : vert. (B) nucléaireGFP :vert. La ligne pointillée rouge marque la limite de l’organoïde. Barres d’échelle : 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
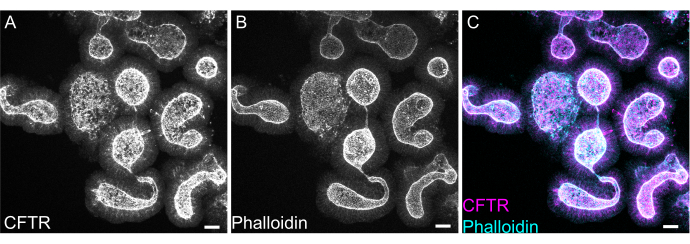
Figure 8 : Immunofluorescence de la monture entière des organoïdes intestinaux de rat. (A) CFTR, (B) phalloïdine, et (C) immunofluorescence de la monture entière fusionnée des organoïdes jéjunaux de rat. A noter l’enrichissement apical de la coloration CFTR dans les organoïdes (gris en A, magenta en C). La phalloïdine marque la Factine et marque de manière proéminente le bord apical du pinceau (gris en B, cyan en C). Barres d’échelle : 25 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
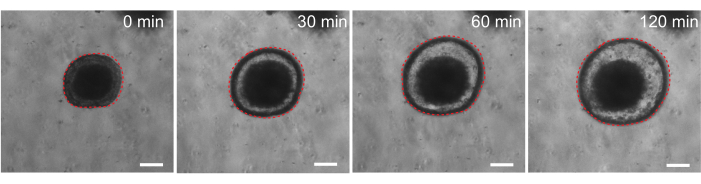
Figure 9 : Les organoïdes intestinaux de rat gonflent lors de la stimulation de la forskoline. Évolution temporelle représentative du gonflement des organoïdes intestinaux de rat après l’ajout de l’agoniste de l’AMPc, la forskoline. Le temps de 0 min représente le point de temps immédiatement avant l’ajout de 10 μM de forskoline. Les images montrent le même organoïde à des intervalles de temps de 30 minutes. Un gonflement maximal a été observé 120 min après l’ajout de forskoline. La ligne rouge pointillée délimite l’organoïde. La matière sombre au milieu de la lumière organoïde est composée de cellules mortes. Barres d’échelle : 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Recette AdDMEM+. Ingrédients pour fabriquer le média AdDMEM+ standard, qui est le média de base dans toutes les méthodes présentées ici. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Recette des milieux organoïdes intestinaux de rat (rIOM). Recette détaillée du milieu organoïde intestinal standard du rat, y compris le solvant et les conditions de stockage des protéines recombinantes. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Solutions. Recettes et instructions pour faire d’autres solutions utilisées tout au long du protocole. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4. Milieu organoïde intestinal de rat pour la culture monocouche 2D (rIOM2D). Recette modifiée de milieux de culture organoïdes optimisés pour la croissance 2D de monocouches. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le développement d’un modèle d’organoïde intestinal de rat préserve les caractéristiques fonctionnelles importantes trouvées dans l’organe in vivo et constitue un outil prometteur pour les essais précliniques, le dépistage de médicaments et les tests fonctionnels. Ce modèle in vitro peut être utilisé en parallèle d’études précliniques in vivo en gastro-entérologie, pour lesquelles les rats sont souvent un modèle privilégié en raison de leur plus grande taille intestinale, de leurs aspects physiologiques communs avec les humains et, dans certains cas, de meilleurs modèles de maladies38. Ici, un protocole robuste étape par étape pour l’isolement des cryptes intestinales de rat, la génération et la culture à long terme d’organoïdes intestinaux de rat, ainsi que les applications en aval, y compris les tests fonctionnels de gonflement de la forskoline, l’immunofluorescence de la monture entière, la culture monocouche 2D et la manipulation génétique lentivirale est décrit. Les organoïdes intestinaux de rat sont susceptibles d’être pertinents dans de nombreux contextes de maladie où la physiopathologie des modèles murins est inappropriée et peuvent fournir un meilleur modèle pour la physiologie intestinale humaine par rapport aux organoïdes intestinaux de souris.
Pour établir des cultures organoïdes à longue durée de vie qui peuvent être passées et étendues, il est essentiel d’identifier les facteurs de croissance clés nécessaires au maintien de la prolifération épithéliale intestinale. Les organoïdes de souris sont le plus souvent cultivés dans un simple cocktail d’EGF, de R-spondine et de Noggin, bien qu’il ait été rapporté que Noggin n’est pas nécessaire pour la culture d’organoïdes intestinaux39. Les milieux conditionnés peuvent remplacer les facteurs de croissance recombinants et les lignées cellulaires les plus couramment utilisées sont les cellules L-WRN, qui sécrètent les cellules Wnt3a, Rspondin-3 et Noggin39, L-Wnt3a et HA-Rspondin1-Fc 293T40. Les milieux conditionnés au L-WRN sont suffisants pour soutenir non seulement la croissance des organoïdes intestinaux de souris39 , mais aussi la croissance des organoïdes intestinaux de plusieurs animaux de ferme et animaux de compagnie, y compris les chiens, les chats, les poulets, les chevaux, les vaches, les moutons et les porcs12. Cependant, les organoïdes intestinaux humains sont très différents dans leurs besoins en facteurs de croissance, car ils nécessitent des formulations de milieux distinctes pour leur phase de croissance d’expansion (c’est-à-dire la progression des petits vers les grands sphéroïdes) par rapport à leur phase de différenciation (c’est-à-dire la génération et la maturation de types cellulaires différenciés)10. Les besoins en milieux des organoïdes intestinaux de rat reflètent étroitement ceux des milieux de croissance d’expansion pour les organoïdes intestinaux humains, mais, notamment, les organoïdes de rat sont capables à la fois de croissance et de différenciation dans cet environnement de milieu, ce qui simplifie considérablement leurs exigences de culture. Alors que nos premières tentatives se sont concentrées sur l’établissement et la croissance d’organoïdes intestinaux de rat dans des milieux conditionnés au L-WRN, la culture à long terme était ténue et les lignées d’organoïdes intestinaux de rat souffraient d’un manque de robustesse (données non présentées). Cela peut être dû au fait que les lignées cellulaires L-WRN sont conçues pour sécréter de la R-spondine 3, tandis que la lignée cellulaire 293T-Rspo1 recommandée ici est conçue pour sécréter de la R-spondine 1. Il est possible que les organoïdes de rat et d’homme préfèrent la R-spondine 1, ce qui pourrait expliquer l’échec des lignées organoïdes de rat dans les milieux conditionnés en L-WRN.
Pour récapituler le plus fidèlement possible le contexte in vivo , il est important de développer des conditions de culture d’organoïdes qui permettent la survie, le maintien et la prolifération des cellules souches, et qui peuvent maintenir le renouvellement cellulaire et les événements de différenciation simultanés en types cellulaires distincts. Par conséquent, les concentrations de protéines recombinantes et/ou de protéines dans les milieux conditionnés doivent être étroitement titrées et contrôlées pour atteindre cet équilibre parfait. En particulier, des niveaux optimaux de Wnt sont essentiels pour éviter la perte de cultures d’organoïdes intestinaux. Trop peu de Wnt dans les milieux conditionnés seront incapables de soutenir la croissance, ce qui entraînera une perte de cellules souches et la mort subséquente des organoïdes ; La suractivation de Wnt rendra les organoïdes kystiques et indifférenciés10. Bien que cela ne soit pas détaillé ici, il est fortement recommandé de tester chaque lot de milieux conditionnés L-Wnt3a et 293T-Rspo1 à l’aide d’un test de luciférase rapporteur Wnt, tel qu’une lignée cellulaire Topflash41. Des études antérieures ont décrit qu’un lot optimal de support L-Wnt3a devrait entraîner une augmentation du signal de 15 fois à 12,5 % et une augmentation de 300 fois du signal à 50 %, par rapport à 1 % de L-Wnt3a10. Étant donné que les organoïdes de rat sont plus sensibles que les organoïdes de souris aux exigences de culture, en particulier aux niveaux d’activation de Wnt, ces étapes supplémentaires de contrôle de la qualité aident grandement à faciliter la robustesse et la fiabilité des cultures d’organoïdes de rat. Étant donné qu’il n’existe pas de ligne rapporteur similaire pour tester l’activité de Bmp et les concentrations relatives de Noggin dans les milieux conditionnés par Noggin, il est conseillé d’utiliser Noggin recombinant lorsque cela est possible pour contrôler avec précision les niveaux de Noggin. Alors que les organoïdes intestinaux de souris peuvent être cultivés et maintenus en l’absence de Noggin39, cela n’a pas été tenté pour les cultures d’organoïdes intestinaux de rat.
Au-delà des exigences de la culture cellulaire, la réussite de l’établissement initial d’une lignée organoïde de rat dépend de manière critique de l’épuisement efficace des villosités différenciées pendant l’isolement de la crypte. Des niveaux élevés de contamination par les villars provoquent la mort des cryptes, probablement en raison de signaux provenant des cellules mourantes ou de la séquestration de facteurs essentiels. Pour épuiser ces villosités différenciées des préparations épithéliales de manière précise et cohérente, il est recommandé d’effectuer des isolements épithéliaux à l’aide d’un stéréoscope. L’examen visuel de l’épithélium libéré permet de savoir clairement quand jeter le PBS et le remplacer (figure 1). Les cryptes ne doivent pas être collectées tant qu’il n’y a pas suffisamment de villosités. Les cellules de Villar sont différenciées en phase terminale et ne peuvent pas générer d’organoïdes en culture. De plus, le passage ultérieur d’organoïdes intestinaux de rat et leur utilisation pour toute application en aval nécessitent des soins délicats. L’incubation dans des réactifs de dissociation pendant de plus longues périodes (10 min) entraîne une mort cellulaire importante et une perte de la lignée organoïde.
Ici, un protocole simple et rapide pour générer des monocouches intestinales à partir d’organoïdes de rat est décrit. Les substrats EME et collagène I ont des effets différents sur l’épithélium, qui peuvent être exploités en fonction de l’objectif de l’étude. L’EME permet l’adhésion rapide et efficace de cellules individuelles et la formation de projections cellulaires. En revanche, le revêtement de la surface avec du collagène I retarde ces processus. Une fois que les monocouches atteignent environ 80 % de confluence, les cellules cultivées sur EME recommencent à générer des structures organoïdes 3D. Cependant, ils ne disposent pas d’un soutien physique et chimique suffisant pour poursuivre leur croissance. Ce retour à l’état organoïde peut être évité en maintenant des monocouches dans l’EME à une confluence de 50 % à 80 %. L’ajout d’EME dilué à la surface apicale des monocouches favorise la récupération rapide et la formation d’organoïdes de novo, générant des régions de convergence plus rapidement et plus facilement. Sur une surface de collagène I, les cellules peuvent former une monocouche uniforme et générer de petits amas. Cependant, l’ajout de collagène I sur les monocouches n’est pas suffisant pour induire la formation d’organoïdes. L’EME doit être dilué lors de l’ajout à la surface de la monocouche, car il y aura une résistance mécanique plus forte que l’organoïde naissant devra surmonter. Cependant, cette EME diluée ne permet pas la formation robuste de gros organoïdes. Tous les organoïdes de rat générés de novo qui se détachent naturellement de la surface doivent être immédiatement retirés et transférés dans de l’EME non dilué afin que le soutien structurel et la croissance puissent être restaurés. En raison de la petite taille des organoïdes à cette étape, le passage des organoïdes n’est pas recommandé tant qu’une croissance robuste n’a pas été établie. La signification biologique sous-jacente de la raison pour laquelle l’EME peut soutenir la reformation des organoïdes, mais si le collagène I peut ou ne peut pas le faire, n’est pas claire. Cependant, il a été rapporté que les cellules cultivées dans le collagène 3D ne peuvent pas former d’organoïdes bourgeonnés42,43 ou soutenir l’entretien à long terme. Les produits EME disponibles dans le commerce sont des mélanges hétérogènes de protéines extracellulaires, principalement de la laminine et du collagène IV44. Par conséquent, la composition distincte des protéines et la capacité d’une cellule épithéliale à s’engager dans la matrice extracellulaire à l’aide de différents complexes cellulaires pourraient permettre un remodelage dans l’EME, mais pas dans le collagène I. La question de savoir si les monocouches dérivées du collagène I peuvent être placées dans l’EME pour soutenir la formation et la croissance d’organoïdes n’a pas été testée.
La manipulation génétique du modèle d’organoïde intestinal de rat est décrite ici, et les protocoles de transduction lentivirale d’organoïdes 3D et de transfection transitoire de monocouches 2D sont décrits. Pour pallier la faible efficacité de la transduction des organoïdes lentiviraux, un protocole a été développé pour la transfection transitoire de monocouches 2D. La morphologie plate et les domaines apicaux exposés des monocouches facilitent l’accès aux virus et aux complexes contenant de l’ADN. L’expression d’un rapporteur EGFP utilisant le vecteur pLJM1-EGFP a été utilisée pour la validation de cette technique. L’expression rapporteure de la GFP a été observée après 24 h et a été maintenue pendant 5 à 6 jours dans les monocouches. Les études futures portant sur la transduction lentivirale des monocouches sont susceptibles d’avoir une efficacité supérieure à celle de la transduction organoïde 3D. En utilisant les protocoles ci-dessus, les organoïdes 3D peuvent être reformés à partir de monocouches 2D infectées pour faciliter la création de lignées stables. Avec soin, les lignées d’organoïdes intestinaux de rat peuvent être maintenues avec succès pendant plus d’un an, rester stables sur de nombreux passages, cryoconservées, décongelées avec succès et génétiquement modifiées à l’aide de la transduction lentivirale, répondant ainsi au besoin d’un modèle d’organoïde intestinal in vitro accessible et traitable qui conserve une pertinence physiologique pour les humains.
Déclarations de divulgation
Aucun.
Remerciements
Nous remercions les membres des laboratoires Sumigray et Ameen pour leurs discussions approfondies. Ce travail a été soutenu par une subvention de la Fondation Charles H. Hood pour la santé de l’enfant et une subvention de la Fondation de la fibrose kystique (004741P222) à KS et par l’Institut national du diabète et des maladies digestives et rénales des National Institutes of Health à NA sous le numéro d’attribution 2R01DK077065-12.
matériels
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
Références
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon