Method Article
Генерация и манипуляции с органоидами кишечника крыс
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем протокол для создания органоидов кишечника крыс и использования их в нескольких последующих приложениях. Крысы часто являются предпочтительной доклинической моделью, а надежная система кишечных органоидов удовлетворяет потребность в системе in vitro для сопровождения исследований in vivo .
Аннотация
При использовании органоидов для оценки физиологии и принятия решений о судьбе клеток важно использовать модель, которая точно повторяет контексты in vivo . Соответственно, органоиды, полученные от пациентов, используются для моделирования заболеваний, разработки лекарств и персонализированного скрининга лечения. Органоиды кишечника мышей обычно используются для понимания аспектов как функции / физиологии кишечника, так и динамики стволовых клеток. Тем не менее, во многих случаях крысы часто предпочтительнее мышей в качестве модели из-за их большего физиологического сходства с людьми с точки зрения патофизиологии заболевания. Модель крыс была ограничена отсутствием генетических инструментов, доступных in vivo, а органоиды кишечника крыс оказались хрупкими и трудно культивируемыми в долгосрочной перспективе. Здесь мы опираемся на ранее опубликованные протоколы для надежной генерации органоидов кишечника крыс из двенадцатиперстной кишки и тощей кишки. Мы представляем обзор нескольких последующих применений с использованием органоидов кишечника крыс, включая функциональный анализ набухания, окрашивание всего маунта, генерацию 2D-энтероидных монослоев и лентивирусную трансдукцию. Модель органоида крысы представляет собой практическое решение потребности в модели in vitro , которая сохраняет физиологическую значимость для человека, может быть быстро генетически изменена и легко получена без барьеров, связанных с получением органоидов кишечника человека.
Введение
Архитектура эпителия тонкой кишки человека и клеточный состав сложны, что отражает его физиологические функции. Основная роль тонкой кишки заключается в поглощении питательных веществ из пищи, проходящей через ее просвет1. Чтобы максимизировать эту функцию, поверхность кишечника организована в пальцеобразные выступы, называемые ворсинками, которые увеличивают площадь всасывающей поверхности, и чашеобразные инвагинации, называемые криптами, в которых размещаются и изолируются стволовые клетки. В эпителии образуются различные специализированные абсорбционные и секреторные типы клеток, выполняющие различные функции1. Из-за этой сложности было трудно моделировать такие ткани, как кишечник, в иммортализированных клеточных линиях с высоким пассажем. Однако изучение стволовых клеток, особенно взрослых стволовых клеток, и механизмов их дифференцировки позволило разработать 3D-культуры органоидов кишечника. Использование органоидных моделей изменило эту область, отчасти из-за того, что они повторяют некоторые архитектурные компоненты и гетерогенность типов клеток, обнаруженную в интактной кишке. Кишечные органоиды могут культивироваться в течение длительного времени in vitro благодаря поддержанию популяции активных стволовых клеток2.
Органоиды кишечника быстро стали адаптируемой моделью для изучения биологии стволовых клеток, клеточной физиологии, генетических заболеваний и питания3,4, а также инструментом для разработки новых методов доставки лекарств5. Кроме того, органоиды, полученные от пациентов, используются для моделирования заболеваний, разработки лекарств и персонализированного скрининга лечения, среди прочего 6,7,8,9. Тем не менее, органоиды кишечника человека по-прежнему представляют собой проблему. Доступность тканей, требования к одобрению Наблюдательного совета и этические вопросы ограничивают широкое использование образцов на людях. Кроме того, органоиды кишечника человека, полученные из кишечных крипт, требуют двух различных условий культивирования для поддержания недифференцированных стволовых клеток или для индуцирования дифференцировки зрелых типов клеток10. Это контрастирует с in vivo, когда стволовые клетки и зрелые дифференцированные типы клеток одновременно присутствуют и непрерывно генерируются/поддерживаются1. С другой стороны, органоиды кишечника мышей, выращенные в менее сложном коктейле факторов роста, не нуждаются в таком изменении состава среды и могут поддерживать стволовые клетки и дифференцированные клетки в одном и том же контексте среды 2,11. Тем не менее, ключевые различия в кишечнике мышей по сравнению с человеческим могут сделать органоиды мышей неоптимальной моделью во многих случаях. В целом, многие кишечные органоиды более крупных млекопитающих, включая лошадей, свиней, овец, коров, собак и кошек, были успешно получены в культурных условиях, более близких к кишечным органоидам мышей, чем условия культивирования кишечныхорганоидов человека. Различия в условиях факторов роста между мышиными и человеческими органоидами, вероятно, отражают различия в составе ниши стволовых клеток и различные требования к выживанию, пролиферации и поддержанию стволовых клеток. Таким образом, существует потребность в легкодоступной модельной органоидной системе, которая 1) очень похожа на состав клеток кишечника человека, 2) содержит стволовые клетки с требованиями к фактору роста, как у органоидов кишечника человека, и 3) способна постоянно поддерживать недифференцированные и дифференцированные компартменты. В идеале система должна быть основана на широко используемой доклинической модели на животных, чтобы эксперименты in vivo и in vitro можно было коррелировать и использовать в тандеме.
Крысы являются широко используемой доклинической моделью для исследований физиологии и фармакологии кишечника из-за их очень похожей физиологии и биохимии кишечника на человека13, особенно в отношении проницаемости кишечника14. Их относительно больший размер по сравнению с мышами делает их более восприимчивыми к хирургическим процедурам. В то время как модели крупных животных, включая свиней, иногда используются, крысы являются более доступной моделью, требуют меньше места для содержания и имеют легко доступные коммерчески доступные стандартные штаммы15. Недостаток использования моделей на крысах заключается в том, что генетический инструментарий для исследований in vivo недостаточно развит по сравнению с мышами, а создание новых линий крыс, включая нокауты, нокауты и трансгены, часто является непомерно дорогим. Разработка и оптимизация надежной модели органоида кишечника крысы позволит проводить генетические манипуляции, фармакологические методы лечения и исследования с более высокой пропускной способностью в доступной модели, которая сохраняет ключевую физиологическую значимость для человека. Тем не менее, преимущества одной модели органоида грызунов по сравнению с другой сильно зависят от конкретного изучаемого процесса или гена; Некоторые гены, обнаруженные у людей, могут быть псевдогенами у мышей, но не у крыс16,17. Кроме того, видоспецифичные подтипы клеток все чаще раскрываются с помощью одноклеточной РНК-секвенации18,19,20. Наконец, модели кишечных заболеваний крыс и мышей часто демонстрируют значительные различия в фенотипах21,22, так что модель, которая более точно повторяет симптомы и процесс заболевания, наблюдаемые у людей, должна быть выбрана для последующей работы. Создание модели органоида кишечника крысы обеспечивает исследователям дополнительную гибкость и возможность выбора модельной системы, наиболее подходящей для их условий. Здесь расширены существующие протоколы23,24 для получения органоидов кишечника крыс и описан протокол для генерации и поддержания органоидов кишечника крыс из двенадцатиперстной кишки или тощей кишки. Кроме того, описаны несколько последующих применений, включая лентивирусную инфекцию, окрашивание всего маунта и анализ набухания форсколина.
протокол
ПРИМЕЧАНИЕ: Все клеточные культуры должны обрабатываться с использованием надлежащей асептической техники в вытяжке для тканевых культур. Все работы с животными в этом исследовании были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) Йельского университета.
1. Приготовление реагентов для клеточных культур
- Приготовьте кондиционированную среду R-спондин 1 в соответствии с инструкциями производителя. Приготовьте кондиционированную среду Wnt3a в соответствии с инструкциями производителя. Подготовьте AdDMEM+, как описано в таблице 1.
- Гастрин ресуспендировать в стерильном dH2O для получения исходного материала 100 мкМ. Аликвотировать и хранить при -80 °C. Ресуспендант N-ацетилцистеина в стерильной воде для приготовления подвоя 100 мМ. Аликвотировать и хранить при -20 °C до 1 месяца.
- Ресуспендировать рекомбинантный человеческий Noggin в фосфатно-солевом буфере (PBS) + 0,1% бычий сывороточный альбумин (BSA) для получения бульона 250 мкг/мл. Аликвотировать и хранить при -80 °C. Ресуспендировать рекомбинантный эпидермальный фактор роста (EGF) мыши в PBS + 0,1% BSA для приготовления запаса 100 мкг/мл. Аликвотировать и хранить при -80 °C.
- Разбавляют рекомбинантный человеческий ИФР-1 в PBS + 0,1% БСА для получения бульона 100 мкг/мл. Аликвотировать и хранить при -80 °C. Ресуспендировать рекомбинантный человеческий FGF-2 в 5 мМ Tris, рН 7,6, чтобы получить запас 100 мкг/мл. Аликвотировать и хранить при -80 °C.
ПРИМЕЧАНИЕ: Для всех факторов роста используйте промежуточное разбавление PBS + 0,1% BSA до 100-кратной конечной концентрации в питательной среде. Хранить при температуре -20 °C.
2. Установление органоидов тонкой кишки крыс
ПРИМЕЧАНИЕ: Этот протокол был модифицирован из двух ранее опубликованных протоколов для кишечных органоидов крыс23,24.
- Приготовьте кишечную органоидную среду (rIOM) крысы в соответствии с таблицей 2 и установите водяную баню при температуре 37 °C. Эта полная среда стабильна в течение 5 дней при температуре 4 °C.
- Приготовьте 10 мл 3 мл этилендиаминтетрауксусной кислоты (ЭДТА) в PBS в конической пробирке объемом 15 мл и держите на льду. Разморозьте 250 мкл экстракта внеклеточного матрикса (ЭМЭ) на льду.
- Голодайте крысу на ночь с доступом к воде вволю. Усыпьте крысу в соответствии с протоколом, утвержденным IACUC. В этом протоколе взрослые самцы крыс Sprague Dawley (весом ~200 г) были подвергнуты эвтаназии путем ингаляции CO2 (Таблица материалов). Вывих шейки шейки матки применялся как вторичный метод эвтаназии.
- Для препарирования используйте стерильные автоклавные щипцы и ножницы для препарирования. Поместите усыпленную крысу на поверхность препарирования вентральной стороной вверх. Защипните слой кожи щипцами; Следующие надрезы должны быть сделаны на поверхностном уровне, поэтому они прорезают только этот слой кожи и недостаточно глубоки, чтобы повредить внутренние органы.
- Чтобы вскрыть брюшную полость, с помощью больших, острых ножниц для вскрытия разрезают слой кожи в большом, продольном, поверхностном разрезе на уровне поверхности в центре живота. Затем, исходя из этого разреза, сделайте два коротких горизонтальных надреза, по одному с каждой стороны. Используйте щипцы, чтобы отклеить кожу, чтобы обнажить брюшную полость. Разрезают перитонеальную оболочку, чтобы полностью обнажить внутренние органы брюшной полости со свободным доступом к кишечнику.
- С помощью ножниц и щипцов найдите живот и определите двенадцатиперстную кишку примерно на 2-3 см дистальнее него, которая выглядит как желтоватый сегмент. Проксимальный отдел тощей кишки расположен примерно на 4-5 см дистальнее связки Трейца, которая служит ориентиром между двенадцатиперстной кишкой и тощей кишкой.
- Изолированный фрагмент кишечника поместить в чашку Петри диаметром 10 см. Очистите нужный сегмент кишечника от брыжейки настолько, насколько это возможно. Смыть 10 мл ледяного PBS до очищения от содержимого просвета. На бумажном полотенце разрежьте сегмент кишечника на кусочки длиной ~2 см. Вскрывайте каждый кусочек кишечника продольно, чтобы обнажить эпителий.
- С помощью предметного стекла микроскопа соскребите открытую поверхность просвета, чтобы удалить ворсинки. Поместите кусочки кишечника в приготовленный раствор ЭДТА на льду. Вращайте при 4 °C в течение 30 минут на трубчатом револьвере, установленном на 10 оборотов в минуту.
- У препарирующего микроскопа вылейте содержимое конической трубки в чашку Петри диаметром 10 см. Добавьте дополнительно ~5 мл ледяного PBS.
- Тонкими щипцами зажмите сегмент кишечника и энергично встряхните. Можно будет увидеть выход эпителия в ПБС. На первых порах PBS будет содержать в основном ворсинки.
- Продолжайте встряхивать. Периодически выбрасывайте ПБС, содержащие ворсинки, и добавляйте 10 мл свежего ледяного ПБС к фрагментам кишечника. Продолжайте встряхивать фрагменты и повторяйте этот этап промывки до тех пор, пока ворсинки не перестанут попадать в PBS, а вместо этого PBS в основном содержат крипты. Не превышайте 15 минут для изоляции крипты, чтобы не нарушить жизнеспособность клеток.
- Оставшиеся фрагменты кишечника выбросить. Обогатите оставшийся PBS в чашке Петри для кишечных крипт. В колпаке для культуры тканей соберите крипты, содержащие PBS, и отфильтруйте через ситечко для клеток 70 мкм (таблица материалов).
- Центрифуга при 250 x g в течение 5 мин. Удалите надосадочную жидкость и повторно суспендируйте гранулу в 5 мл AdDMEM+. Снова центрифугируйте при 250 x g в течение 5 мин.
ПРИМЕЧАНИЕ: Рекомендуется использовать центрифугу с поворотным ковшовым ротором. - Удалите надосадочную жидкость, оставив ~50 мкл среды с гранулой. Повторно суспендируйте гранулу в оставшейся среде и добавьте в аликвоту EME на льду. Осторожно поднимите и опустите пипетку, чтобы равномерно подвешивать крипты по всему EME. Избегайте появления пузырей.
- Планшет объемом 50 мкл EME помещают в 35-миллиметровую чашку для тканевых культур и инкубируют в течение 20 минут в инкубаторе для тканевых культур с температурой 37 °C, 5%CO2 .
- Добавьте 2 мл rIOM (Таблица 2), содержащую 10 мкМ Y27632 и 10 мкМ CHIR99021 (Таблица 3). После прохождения Y27632 и CHIR99021 могут быть сняты с производства.
- Меняйте rIOM каждые 2-3 дня. Пассаж по мере необходимости, обычно между 3-7 днями, в зависимости от начального количества органоидов, размера и скорости роста.
3. Пассирующие органоиды кишечника крыс
- Разморозьте 250 мкл аликвоты EME на льду и предварительно подогрейте rIOM до 37 °C.
- Аспирируйте среду из 35-миллиметровой пластины, содержащей органоиды, и добавьте 1 мл диссоциационного реагента, чтобы немедленно высвободить органоиды из куполов ЭМЭ.
- Немедленно перенести диссоциационный реагент с фрагментированными органоидами в коническую пробирку объемом 15 мл. Промойте культуральную пробирку 2 мл AdDMEM+ и добавьте в коническую пробирку объемом 15 мл, содержащую фрагментированные органоиды.
- Стеклянной пипеткой Пастера осторожно покачайте пипеткой вверх и вниз 15-20 раз, чтобы фрагментировать органоиды. Центрифуга при 350 x g в течение 2 мин.
- Добавьте ~50 мкл раствора со дна конической пробирки в ЭМЭ. Осторожно пипеткой вверх и вниз, чтобы перемешать. Избегайте образования пузырей.
- Поместите 50 мкл EME в чашку диаметром 35 мм и инкубируйте в течение 20 минут в инкубаторе для тканевых культур с температурой 37 °C, 5%CO2 .
- Добавьте 2 мл rIOM с 10 мкМ Y27632 и 10 мкМ CHIR99021. Меняйте питательную среду каждые 2-3 дня. При смене носителя Y27632 и CHIR99021 можно опустить.
4. Криоконсервация и размораживание органоидов кишечника крыс
- Криоконсервирующие органоиды кишечника крыс
ПРИМЕЧАНИЕ: Протокол криоконсервации был изменен по сравнению с предыдущим протоколом для органоидов человека и мыши25. Перед замораживанием органоиды должны иметь не менее двух ходов в первичной культуре. Перед криоконсервацией рекомендуется выращивать органоиды до крупных сфероидов или слегка почковатых органоидов, так как это приведет к более высокому выходу жизнеспособных органоидов после оттаивания. Этого можно достичь, увеличив кондиционированную R-спондин среды до 15% и/или добавив 10 мМ никотинамида (табл. 3) в органоидную культуру.- С помощью микроскопа подсчитайте количество органоидов на 35-миллиметровой чашке. Маркируйте криовиалы таким образом, чтобы в каждый криовиал было аликвотировано 200 органоидов.
- Извлеките rIOM из чашки диаметром 35 мм. Замените 2 мл культуры холодных тканей PBS.
- С помощью наконечника P1000 выпустите купола EME со дна чашки для культивирования в PBS, пипетируя вверх и вниз. Продолжайте пипетировать вверх и вниз ~20 раз, чтобы разбить EME и высвободить органоиды. Соберите органоиды и PBS в коническую пробирку объемом 15 мл.
- Добавьте 2 мл холодного PBS в чашку для культивирования и пипетку вверх и вниз, чтобы удалить оставшиеся органоиды в PBS. Перелейте PBS в коническую пробирку объемом 15 мл.
- Гранулируйте органоиды центрифугированием при 290 x g в течение 5 мин. Удалите и выбросьте надосадочную жидкость, не нарушая органоидную гранулу.
- Промойте гранулы, аккуратно суспендировав их в 5 мл холодного AdDMEM+. Центрифуга при 200 x g в течение 4 мин. Осторожно извлеките и выбросьте надосадочную жидкость.
- Ресуспендировать органоидную гранулу в 1 мл среды холодной заморозки на 200 органоидов. Аликвота 1 мл органоидов в морозильной среде на меченый криовиал. Поместите криовиалы в контейнер для замораживания.
- Храните органоиды в морозильном контейнере при температуре -80 °C в течение 24 часов, затем переведите криовиалы в жидкий азот для длительного хранения.
- Размораживание органоидов кишечника крыс
ПРИМЕЧАНИЕ: Этот протокол был изменен по сравнению с предыдущим протоколом размораживания органоидов кишечника человека и мыши26.- Разморозьте 250 мкл аликвоты ЭМЭ на льду. Приготовьте rIOM с добавлением 15% R-спондина, кондиционированной среды, 10 мкМ Y27632 и 10 мкМ CHIR99021. Прогреть до 37 °C.
- Добавьте 2 мл размораживающей среды (таблица 3) в коническую пробирку объемом 15 мл при комнатной температуре.
- Извлеките и разморозьте флакон с органоидами из жидкого азота, поместив флакон на водяную баню с температурой 37 °C, пока флакон не станет почти полностью размороженным.
- Добавьте 1 мл размораживающей среды во флакон и перелейте все содержимое в коническую пробирку, содержащую размораживающую среду. Дважды промойте флакон 1 мл размораживающей среды и переложите в коническую пробирку.
- Центрифуга при 200 x g в течение 5 мин. Отсасывайте среду, оставляя ~50 мкл среды с органоидами. Перенесите среду, содержащую органоиды, в 250 мкл EME.
- Равномерно распределите органоиды по ЭМЭ, пипетируя вверх и вниз, избегая пузырьков. Пипетка с шестью куполами по 50 мкл помещается в 35-миллиметровую чашку для культивирования тканей.
- Инкубируйте в инкубаторе для тканевых культур в течение 15-20 минут, чтобы дать ЭМЭ полимеризоваться. Добавьте в блюдо 2 мл приготовленного rIOM.
- Через 2 дня замените носитель на rIOM. Использование Y27632 и CHIR99021 может быть приостановлено. Рост органоидов может быть медленным в первом прохождении после оттаивания. Перед началом опытов рекомендуется дважды пройти органоиды после размораживания.
5. Генерация 2D монослоев кишечника крысы из 3D органоидов
ПРИМЕЧАНИЕ: Следующий протокол описывает объемы, необходимые для генерации 24 лунок из 48-луночной пластины, покрытой EME, начиная с шести куполов по 50 мкл (35-мм тарелка), содержащих ~300 кишечных органоидов/купол (масштаб: один купол генерирует четыре лунки), но могут быть увеличены или уменьшены по мере необходимости. Как написано, этот протокол достигает ~80% слияния за 4-5 дней. При более высоком слиянии клетки снова начинают приобретать 3D органоидные структуры. При низкой конфлюенции (≤40%) клетки остаются в виде монослоев и жизнеспособны в течение ~14 дней. Если целью исследования является использование 2D-монослоев, уменьшите масштаб так, чтобы один купол генерировал восемь лунок 24-луночной пластины. Лунки также могут быть покрыты коллагеном I для формирования монослоев.
- Подготовка окрашенных поверхностей
- Чтобы покрыть пластину EME, разбавьте EME 1:20 в холодном AdDMEM+ (табл. 1). Для покрытия коллагеном приготовьте коллаген I в соответствии с инструкцией производителя. Разбавьте 5 мг/мл коллагена I в AdDMEM+ до 100 мкг/мл (в данном случае 1:50).
- Покройте планшет 200 мкл разбавленного EME или коллагена, чтобы полностью покрыть поверхность лунки. Инкубируют в течение 1-2 ч при 37 °C в инкубаторе для тканевых культур. Приготовьте органоидную среду кишечника крысы для 2D монослойной культуры (rIOM2D) в соответствии с таблицей 4.
- Генерация монослоев
- Аспирируйте среду из 35-миллиметровой пластины, содержащей органоиды. Добавьте 1 мл PBS.
- Нарушите EME в скважинах, поцарапав наконечником P1000. Поднимите и опустите пипетку примерно 20 раз, чтобы ослабить все EME. Перелейте все в коническую пробирку объемом 15 мл.
- Добавьте 1 мл PBS в 35-миллиметровую пластину, чтобы извлечь дополнительные органоиды, и переложите в ту же коническую пробирку объемом 15 мл.
- Центрифугу при 350 х г в течение 2 мин и аспирировать надосадочную жидкость, включая остаток ЭМЭ. Добавьте 1 мл раствора трипсина к грануле органоида и инкубируйте при 37 °C в течение 2 минут.
- Проведите пипеткой вверх и вниз 10 раз с помощью наконечника P1000 и добавьте 2 мл AdDMEM+ для нейтрализации трипсина.
- Центрифуга при 350 x g в течение 5 мин. Аспирируют надосадочную жидкость и добавляют 4,8 мл rIOM2D (табл. 4). Ресуспендируйте гранулу ячейки.
- Перед размещением органоидов извлеките из лунок излишки EME или коллагена в AdDMEM+. Затем добавьте 200 мкл органоидов в rIOM2D и 10 мкМ Y27632 в каждую лунку с предварительно нанесенным покрытием.
- Через 4-16 ч соберите среду и центрифугируйте при 1 000 x g в течение 1 мин. Перелейте надосадочную жидкость в новую коническую пробирку объемом 15 мл и выбросьте гранулу.
- Промойте каждую лунку 300 мкл PBS и добавьте 200 мкл центрифугированного rIOM2D в каждую лунку. Меняйте rIOM2D каждые 2-3 дня, приостанавливая использование Y27632.
- Риформинг 3D органоидов из 2D монослоев
ПРИМЕЧАНИЕ: Монослои, выращенные на ЭМЕ, могут быть индуцированы к преобразованию 3D-органоидов, в то время как монослои, выращенные на коллагене I, не могут эффективно вернуться к 3D-органоидам. Обычно 2-3 лунки органоидов, сгенерированных из монослоев, могут быть использованы для создания одного купола из 50 мкл ЭМЭ на 5-й день.- Разбавьте EME 1:4 в rIOM2D. Когда монослои достигнут слияния ~80%, осторожно аспирируйте среду и добавьте 100 мкл разбавленного ЭМЭ в лунки, содержащие монослои.
- Инкубируют при 37 °C, 5%CO2 в инкубаторе для тканевых культур в течение 20 мин. После этого добавьте 100 мкл rIOM2D и верните в инкубатор для тканевых культур. 3D-органоиды будут сгенерированы в течение 5 дней после добавления разбавленного EME.
- После того, как мелкие органоиды переформируются (~ день 5), приготовьте rIOM. Соберите все содержимое лунки, пипетируя вверх и вниз, чтобы нарушить ЭМЭ, и перелейте в коническую пробирку объемом 15 мл.
- Центрифуга при 350 x g в течение 2 мин. Отсасывайте надосадочную жидкость и остаток ЭМЭ.
- Добавьте 1 мл холодного AdDMEM+ и центрифугу при 350 x g в течение 2 минут. Удалите надосадочную жидкость, оставив ~50 мкл среды.
- Перенесите 50 мкл среды и органоидов в аликвоту EME объемом 250 мкл. Пипетки вверх и вниз для распределения органоидов по всему EME.
- Пипетку объемом 50 мкл EME помещают в чашку диаметром 35 мм и инкубируют в течение 20 мин в инкубаторе для тканевых культур.
- Добавьте 2 мл rIOM плюс 10 мкМ Y27632. Меняйте питательную среду каждые 2-3 дня. При смене носителя Y27632 можно опустить.
6. Генетические манипуляции
- Транзиентная трансфекция 2D монослоев
ВНИМАНИЕ: Подготовьте монослои эпителия кишечника крысы в соответствии с разделом 5.1 в 48-луночном планшете. Трансфекция должна проводиться при слиянии 70%-80%. Перед трансфекцией всегда заменяйте среду в лунках 200 мкл свежего rIOM2D. Рассчитать коэффициенты поглощения плазмидной ДНК 260/280 нм и 260/230 нм; Они должны быть выше 1,8, чтобы обеспечить хорошие результаты трансфекции.
ПРИМЕЧАНИЕ: Используйте плазмидный контроль для расчета эффективности трансфекции. Для простоты рекомендуется использовать плазмиду, кодирующую флуоресцентный белок. В этом протоколе использовался pLJM1-EGFP27 .- Приготовьте 1 мг/мл полиэтиленимина 20 кДа (PEI; Таблица 3). Для каждой лунки подготавливают пробирку А (0,6 мкг плазмиды + 50 мкл восстановленной сывороточной среды) и пробирку В (1,8 мкл ПЭИ + 50 мкл восстановленной сывороточной среды). Поддерживайте соотношение ДНК:ПЭИ 1:3.
- Встряхните обе трубки в течение 30 с. Соедините трубку А и трубку Б и снова вихрь в течение 30 с. При необходимости используйте центрифугу для отжима. Выдерживать 20 мин при комнатной температуре.
- Аккуратно добавьте комплекс ДНК/ПЭИ по каплям в 2D-монослой. Аккуратно покрутите тарелку, чтобы перемешать. Инкубируют при 37 °C, 5%СО2. Выражение обычно обнаруживается через 24 часа.
ПРИМЕЧАНИЕ: Если необходимо вернуться к 3D органоидным структурам, подождите 48 ч после трансфекции для добавления разбавленного ЭМЭ.
- Лентивирусная трансдукция органоидов кишечника крыс
ПРИМЕЧАНИЕ: Прежде чем работать с лентивирусами, получите соответствующее разрешение и специализированное обучение в учреждении. Всегда надевайте соответствующие средства индивидуальной защиты (СИЗ) при контакте с лентивирусами. Несмотря на то, что здесь не описано, высококачественный, концентрированный лентивирус необходим для успешной инфекции органоидов. Этот протокол использовал пустой вектор pLJM1-EGFP27 для выражения растворимого GFP. Этот протокол является модификацией ранее опубликованного протокола28. Эффективность трансдукции зависит от качества и концентрации вирусных частиц, эффективной диссоциации органоидов на кластеры мелких клеток и экспрессируемого гена. При расчете через 5 дней после заражения средняя эффективность трансдукции до отбора составила 19,4% (± 6,5% стандартного отклонения).- За 2 дня до лентивирусной инфекции запланируйте прохождение (раздел 3) двух плотных лунок 24-луночной пластины для каждого лентивируса, который будет трансдуцирован. Каждая лунка 24-луночного планшета может вместить один купол EME объемом 50 мкл.
- Как только EME затвердеет, добавьте 0,5 мл rIOM с добавлением 10 мМ никотинамида, 10 мкМ Y27632 и 2,5 мкМ CHIR99021. Это индуцирует крупные сфероидные морфологии, что благоприятно сказывается на эффективности лентивирусной трансдукции. В течение 2 дней после нанесения покрытия органоиды крыс должны стать крупными сфероидами. Если наблюдается значительная дифференциация (т.е. почкование), проводят повторный пассаж органоидов.
- Разморозьте концентрированный вирус на льду. Подготовьте свежую трансдукционную среду в соответствии с таблицей 3.
- С помощью наконечника P1000 выпустите купола EME со дна чашки для клеточных культур в среду, пипетируя вверх и вниз. Продолжайте пипетировать вверх и вниз 20 раз, чтобы разрушить EME и высвободить органоиды.
- Пипетку органоидов и среды поместить в коническую пробирку объемом 15 мл. Все лунки могут быть объединены вместе, при условии, что органоиды имеют одинаковый генотип и происходят из одной линии.
- Промойте каждую лунку дважды 1 мл холодного AdDMEM+. Соберите AdDMEM+ и перенесите его в ту же коническую пробирку объемом 15 мл.
- С помощью стеклянной пипетки Пастера механически нарушите органоиды крысы. Это критически важный шаг, так как целью является создание небольших многоклеточных кластеров клеток. Пипетка вверх и вниз ~30 раз. Проверьте эффективность разрушения под микроскопом с помощью 4-кратного объектива. Продолжайте этот процесс до тех пор, пока клеточная суспензия не будет состоять в основном из клеточных кластеров с небольшим количеством органических элементов.
ПРИМЕЧАНИЕ: В качестве альтернативы органоиды можно центрифугировать при 200 x g в течение 5 минут при комнатной температуре, надосадочную жидкость осторожно удалить и повторно суспендировать в 1 мл рекомбинантного фермента, заменяющего обычный трипсин/ЭДТА, предварительно подогретый до 37 °C в инкубаторе для тканевых культур. Инкубируйте органоиды в заменителе трипсина в течение 2 мин на водяной бане с температурой 37 °C с регулярным вихрьком, чтобы способствовать диссоциации. Избегайте длительной инкубации с заменой трипсина, так как это может способствовать гибели клеток. Регулярно проверяйте эффективность разрушения под микроскопом с помощью 4-кратного объектива. Если суспензия состоит в основном из одиночных клеток с небольшим количеством клеточных культур, разбавьте трипсин-заместитель, добавив 4 мл AdDMEM+, и перейдите к следующему шагу. - Вращайте коническую пробирку объемом 15 мл, содержащую клеточные кластеры, при 200 x g в течение 5 мин при 4 °C. Осторожно извлеките и выбросьте надосадочную жидкость, стараясь не потревожить гранулу клетки.
- Ресуспендировать клеточные кластеры в 230 мкл трансдукционной среды на лунку, которую необходимо инфицировать. При заражении используют одну лунку из 48-луночной пластины для каждого лентивируса.
- Планшет 230 мкл клеточной суспензии в каждую лунку меченой 48-луночной пластины. Добавьте 20 мкл концентрированного вируса в каждую лунку. Используйте наконечник P1000, чтобы смешать раствор вируса/клетки в каждой лунке и запечатать пластину прозрачной пленкой.
- Проводят спинокуляцию: центрифугируют планшет при 600 x g в течение 1 ч при 32 °C. Разгерметизируйте планшет и инкубируйте при 37 °C, 5% CO2 в течение 6 ч.
- Разогрейте 24-луночную тарелку в инкубаторе с температурой 37 °C.
- После инкубации пипетками проведите каждую лунку вверх и вниз и переложите содержимое в пробирку объемом 1,5 мл с этикеткой. Промойте каждую лунку 750 мкл AdDMEM+ и перелейте в пробирку. Вращайте пробирки при 600 x g в течение 5 минут при 4 °C.
- Выньте пробирки из центрифуги и храните на льду. Используйте наконечник P1000, чтобы осторожно удалить и правильно утилизировать надосадочную жидкость.
- Ресуспендируйте клеточную гранулу в EME и поместите купола объемом 50 мкл в предварительно нагретую 24-луночную пластину. Инкубировать 15-20 мин при 37 °C до полимеризации ЭМЭ.
- В каждую лунку добавьте 500 мкл rIOM с добавлением 10 мМ никотинамида, 10 мкМ Y27632 и 2,5 мкМ CHIR99021.
- Замените носитель на rIOM plus 10 мкМ Y27632 через 1 день после заражения. Меняйте носитель каждые 2-3 дня. Если отбор будет производиться, добавьте отбор через 48-72 ч после заражения. Для выбора пуромицина используют 2 мкг/мл пуромицина.
7. Иммунофлуоресцентное окрашивание органоидов
- Аспирируют среду и добавляют 4% параформальдегида (PFA) в PBS-Tween 20 (PBS-T) (Таблица 3) к органоидам в чашке для клеточных культур. Выдерживают при комнатной температуре 10 мин.
- Высвобождите органоиды из EME, пипетируя вверх и вниз. Соберите органоиды в пробирку объемом 0,75 мл. Органоиды осядут на дно пробирки под действием силы тяжести в течение нескольких минут. При необходимости центрифугу при 100 x g в течение 1 мин.
- С помощью пипетки для переноса удалите PFA и повторно суспендируйте органоиды в PBS-T. Дайте органоидам осесть на дно пробирки. Извлеките PBS-T и ресуспендируйте в 200 мкл блочного раствора (Таблица 3).
- Инкубируют при комнатной температуре на коромысле или нутаторе в течение 45 мин. Органоиды могут слипаться и оседать на дно пробирки. Периодически проводите пальцем по трубке, чтобы она снова суспендировалась и рассеялась по всему раствору.
- Дайте органоидам осесть на дно пробирки. При необходимости центрифугу при 100 x g в течение 1 мин. Удалите блочный раствор.
- Добавьте первичные антитела, разведенные в 100 мкл раствора блока. Инкубировать при комнатной температуре на миксере для нутирования в течение 45 мин при 24 об/мин. Концентрация антител варьируется в зависимости от используемого антитела.
ПРИМЕЧАНИЕ: Этот этап может быть продлен в зависимости от первичного антитела до ночи при 4 °C. - Дайте органоидам осесть на дно пробирки. При необходимости центрифугу при 100 x g в течение 1 мин.
- Промыть в PBS-T пять раз с помощью пипетки для переноса. Инкубировать при комнатной температуре в течение 5 мин на миксере для нутирования при 24 об/мин. Повторите этот шаг дважды.
- Добавляют вторичные антитела, разведенные 1:200 и 50 мкг/мл 4',6-диамидино-2-фенилиндол (DAPI), разведенные в 100 мкл раствора блока. Инкубировать при комнатной температуре на миксере для нутирования в течение 30 мин при 24 об/мин.
- Дайте органоидам осесть на дно пробирки. При необходимости центрифугу при 100 x g в течение 1 мин. Удалить вторичные антитела. Промыть пять раз в PBS-T с помощью трансферной пипетки.
- Инкубировать при комнатной температуре в течение 5 мин на миксере для нутирования при 24 об/мин. Повторите этап стирки дважды.
- Во время промывки органоидов нагрейте аликвоту герметика VALAP (табл. 3) до 40-50 °C для разжижения. С помощью кисти нарисуйте тонкий квадрат VALAP на предметном стекле микроскопа размером примерно с покровное стекло. Используйте покровный лист размером 22 мм x 22 мм No 1,5.
- Ножницами отрежьте конец наконечника пипетки P200. Перенести органоиды в VALAP хорошо на предметной горке. С помощью салфетки осторожно удалите PBS-T. Не допускайте пересыхания органоидов.
- Залейте VALAP хорошо монтажной средой для защиты от затухания (табл. 3). Для квадрата ~22 мм x 22 мм потребуется 100-150 мкл антифейда.
- Органоиды могут группироваться; При необходимости перемешайте антифейд наконечником пипетки, чтобы перераспределить органоиды. Крепление с помощью защитного стекла 22 мм x 22 мм No 1,5, предотвращающего образование пузырьков воздуха. Запечатайте покровное стекло, нанеся тонкий слой VALAP по краям.
ПРИМЕЧАНИЕ: Для инвертированных микроскопов органоиды также могут быть установлены в чашке со стеклянным дном диаметром 35 мм.
8. Форсколин-индуцированный набухание органоидов кишечника крыс
- Выращивают органоиды в течение 3-5 дней после прохождения в rIOM. Рекомендуется выращивать органоиды в 24-луночном планшете, чтобы гарантировать, что одна и та же область может быть легко повторно визуализирована. Сделайте снимки до добавления форсколина (T0).
- Добавляют форсколин (табл. 3) непосредственно в органоидную среду до конечной концентрации 10 мкМ. Добавляют такой же объем диметилсульфоксида (ДМСО) в контрольные лунки.
- Визуализируйте контрольные и обработанные форсколином скважины через равные промежутки времени, каждые 15-30 мин. Когда органоиды не визуализируются, храните их в инкубаторе или используйте контролируемую систему визуализации с инкубацией. Максимальный отек должен наблюдаться к 120 мин.
- Следуйте стандартным протоколам для расчета относительного набухания по полученным изображениям29.
Результаты
Органоиды двенадцатиперстной и тощей кишки крыс были получены с использованием протокола, описанного в разделе 2. Очень важно, чтобы на этапах изоляции крипты ворсинки эффективно истощались из PBS. Если в ЭМЕ будет покрыто криптами слишком много ворсинок, это может привести к гибели всей культуры и невозможности установления органоидной линии. Из-за этого полезно изолировать крипты под препарирующим прицелом, что позволяет визуально подтвердить истощение Виллара. На рисунке 1 изображены репрезентативные фрагменты виллара и склепы (рис. 1А). Обратите внимание на значительно меньший размер крипт по сравнению с ворсинками (рис. 1Б). После покрытия крипты расширяются в сфероиды в течение следующих нескольких дней и начинают распускаться и дифференцироваться к 4-7 дню (рис. 2). Как только органоиды достигнут стадии обширных бутонов, их следует пассировать. Во время пассажа важно разрушить органоиды настолько, чтобы расщепить почки крипты, чтобы можно было увеличить количество органоидов (рис. 3B).
Успешное восстановление органоидов после замораживания сильно зависит от состояния, в котором они заморожены. Органоиды в высокопролиферативном недифференцированном состоянии восстанавливаются с наибольшей эффективностью. Поэтому мы рекомендуем индуцировать их шаровидными и кистозными, а не распускающимися и дифференцированными. Для достижения этой цели Wnt может быть гиперактивирован путем увеличения количества R-спондина лиганда Wnt в среде и включения никотинамида в среду, который, как было показано, поддерживает образование органоидов и выживание клеток в нескольких культуральных системах30,31. На рисунке 3А показана здоровая органоидная культура всего через 2 дня после оттаивания. Включение BSA в среду во время размораживания также помогло в выживании культур кишечных органоидов крыс, которые оказались более хрупкими, чем кишечные органоиды мышей.
Несмотря на то, что 3D-культивирование органоидов часто является предпочтительным, поскольку оно воспроизводит часть нормальной архитектуры кишечника, оно делает другие подходы, включая живую визуализацию, трансфекцию и лентивирусную трансдукцию, более технически сложными. Использование 2D монослоев, полученных из 3D органоидов32 (рис. 4), позволяет более эффективно вводить плазмиды. В то время как 3D-органоиды кишечника традиционно устойчивы к транзиторным трансфекциям, плазмиды, кодирующие EGFP, могут быть успешно введены с помощью методов трансфекции на основе липидов. Наиболее экономически эффективный подход с использованием PEI описан на этапе 6.1 (рис. 5), но электропорация и коммерчески доступные реагенты для трансфекции также дали сопоставимые результаты (данные не показаны). Будущие исследования будут сосредоточены на том, можно ли использовать эти подходы для внедрения CRISPR-конструкций в монослои.
Важно было иметь возможность преобразовывать 3D-органоиды из 2D-монослоев после трансфекции, чтобы их можно было поддерживать в виде проходной линии с 3D-архитектурными компонентами склепов. Интересно, что двумерные монослои, покрытые ЭМЭ, легко трансформировались в небольшие сфероиды, когда ЭМЭ добавляли обратно в верхнюю часть клеток, в то время как коллагеновый субстрат I был недостаточен для преобразования 3D-структур (рис. 6).
В то время как транзиторные трансфекции полезны для многих исследований, образование стабильных линий часто более полезно, что требует введения лентивируса в клетки. Органоиды кишечника крыс заражали лентивирусом путем модификации ранее опубликованных протоколов (рис. 7). Ключевым этапом в протоколе является разрушение органоидов на небольшие агрегаты или клеточные кластеры. Если культуры не разрушаются эффективно, а органоиды остаются неповрежденными, лентивирусные частицы не попадут в клетки. После заражения органоиды должны восстановиться и отрастить вновь. Протокол, описанный здесь, позволяет захватывать вирусные частицы 10%-48% (в среднем: 19,4% ± 6,5%) клеток до отбора.
Окрашивание органоидов целиком может оказаться затруднительным из-за неполного удаления остатков ЭМЭ или неполной пенетрантности антител. Протокол, описанный здесь, позволяет обеспечить надежное окрашивание органоидов. Визуализация органоидов на конфокальном микроскопе также может оказаться затруднительной, если они находятся слишком далеко от покровного стекла. С помощью VALAP создается лунка с некоторой высотой, в которой органоиды не раздавливаются покровным остелением, но все же могут оседать близко к покровному остеклению для удобства визуализации. На рисунке 8 показано репрезентативное окрашивание апикального анионного канала, трансмембранного регулятора проводимости (CFTR) и фаллоидина с маркировкой F-актина.
Наконец, органоиды полезны в функциональных анализах. Органоиды, полученные от пациентов с муковисцидозом, были использованы для скрининга функции CFTR, поскольку лечение агонистом цАМФ форсколином индуцирует устойчивую секрецию жидкости, опосредованную CFTR, вызывая отек органоидов 29,33-37. Одной из целей этой работы была идентификация и разработка органоидной модели, которая может быть использована параллельно с доклиническими исследованиями in vivo. Поэтому мы стремились определить, подвергаются ли органоиды кишечника крыс индуцированному форсколином. Действительно, в течение 30 мин после лечения форсколином органоиды крыс набухали, причем максимальный эффект наблюдался через 120 мин (рис. 9).
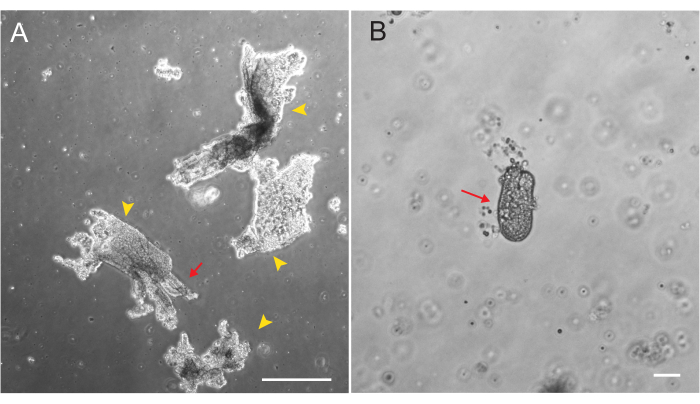
Рисунок 1: Фрагменты и крипты Виллара при выделении эпителия . (A) Репрезентативное изображение фрагментов Виллара в растворе ЭДТА во время протокола изоляции крипты. Желтыми стрелками отмечены фрагменты виллара. Красными стрелками изображены склепы, прикрепленные к фрагменту виллара. Обратите внимание на разницу в относительных размерах. (B) Изображение одного крипта с большим увеличением (красная стрелка), чтобы можно было визуализировать морфологию. Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
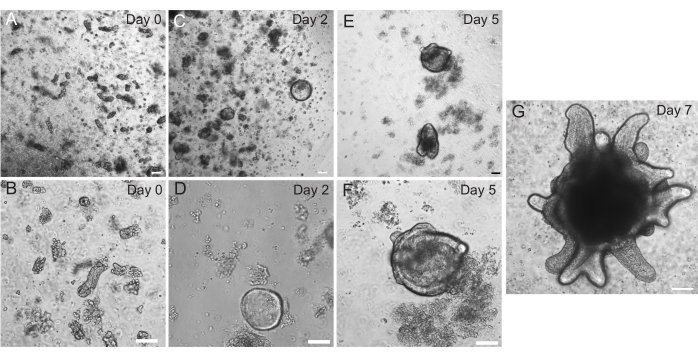
Рисунок 2: Прогрессия органоидов кишечника крысы. Крипты тощей кишки крысы были покрыты в ЭМЕ сразу после выделения (А,В). В течение 2 дней крипты превратились в сфероиды (C,D). К 5-му дню у них начинали зарождаться почки крипты (E,F), которые развивались и росли к 7-му дню (G). Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
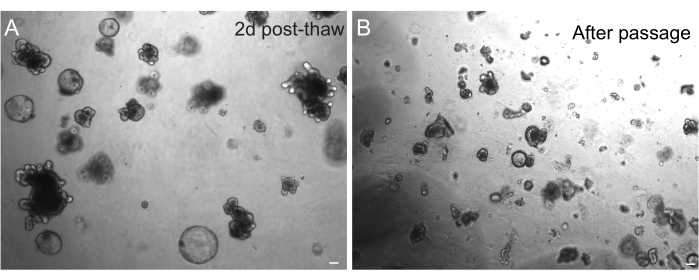
Рисунок 3: Органоиды после размораживания и пассажа. (А) Органоиды тощей кишки крыс размораживали в соответствии с изложенными протоколами после криоконсервации. Обратите внимание на наличие как сфероидов, так и распустившихся органоидов всего через 2 дня после оттаивания. (Б) Та же органоидная линия, изображенная на рисунке А, сразу после прохождения в соответствии с изложенным протоколом. Обратите внимание на относительную разницу в размерах между структурами в А и В и наличие единичных криптоподобных доменов в В. Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
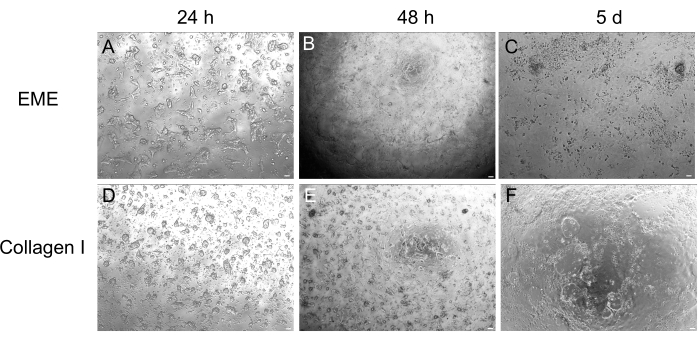
Рисунок 4: Формирование 2D монослоя из 3D органоидов. (A-C) 2D монослойная прогрессия на EME. (D-F) 2D монослойная прогрессия на коллагене I. К 5-му дню каждое условие дало ~80% слияния. Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
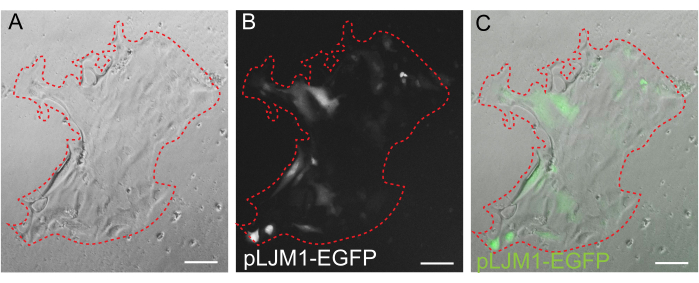
Рисунок 5: Переходная трансфекция 2D монослоя. Репрезентативное изображение 2D монослоя, выращенного на ЭМЭ, трансфицированного плазмидой pLJM1-EGFP с использованием PEI. (А) Светлое поле, (Б) флуоресценция (GFP), (В) наложение. Пунктирной красной линией отмечена граница монослоя. Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
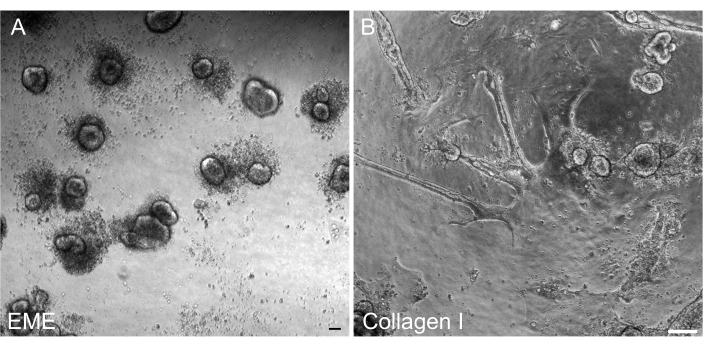
Рисунок 6: Преобразование 3D органоидов из 2D монослоев на EME. (A) Формирование 3D органоидов из 2D монослоев, выращенных на EME. Органоиды эффективно образуются через 5 суток после добавления ЭМЭ на апикальную поверхность монослоя. Обратите внимание на обилие мертвых клеток, окружающих маленькие 3D-сфероиды. (B) Персистенция 2D монослоев через 5 дней после того, как коллаген I был добавлен на апикальную поверхность 2D монослоев, выращенных на коллагене I. Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
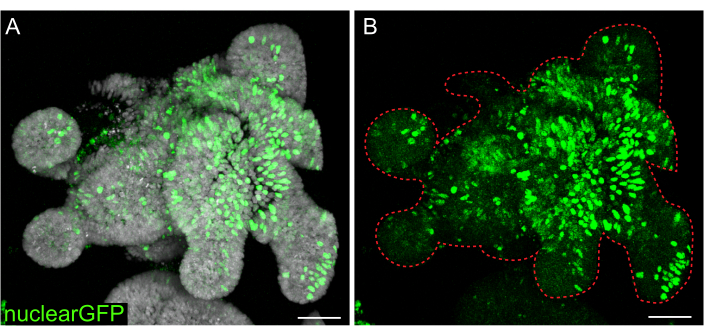
Рисунок 7: Лентивирусная инфекция 3D органоидов. Органоиды тощей кишки крысы инфицировали ядерными лентивирусными частицами GFP по описанному протоколу. После восстановления и роста в течение 5 дней органоиды фиксировали и окрашивали DAPI. (A) DAPI: серый; nuclearGFP: зеленый. (B) nuclearGFP:зеленый. Пунктирной красной линией отмечена граница органоида. Масштабные линейки: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
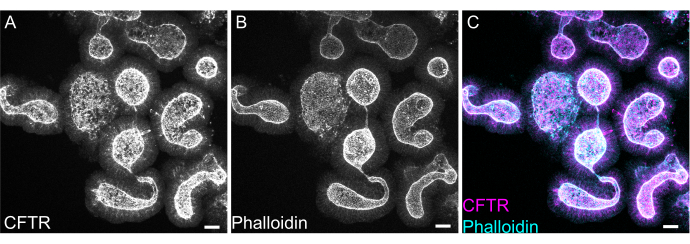
Рисунок 8: Иммунофлюоресценция органоидов кишечника крыс . (A) CFTR, (B) фаллоидин и (C) объединенная цельная гидрофлуоресценция органоидов тощей кишки крысы. Обратите внимание на апикальное обогащение окрашиванием CFTR органоидами (серый у А, пурпурный у С). Фаллоидин маркирует F-актин и заметно помечает верхушечную границу кисти (серый в B, голубой в C). Масштабные линейки: 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
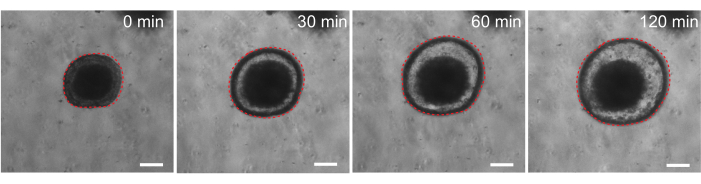
Рисунок 9: Органоиды кишечника крыс набухают при стимуляции форсколином. Репрезентативное течение набухания органоидов кишечника крыс после добавления агониста цАМФ форсколина. Время 0 мин представляет собой момент времени, непосредственно предшествующий добавлению 10 мкМ форсколина. На изображениях показан один и тот же органоид с интервалом в 30 минут. Максимальный отек наблюдался через 120 мин после введения форсколина. Пунктирной красной линией очерчена граница органоида. Темное вещество в середине просвета органоида состоит из мертвых клеток. Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Рецепт AdDMEM+. Ингредиенты для изготовления стандартной среды AdDMEM+, которая является основной средой для всех методов, показанных здесь. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Рецепт органоидной среды кишечника крысы (rIOM). Подробная рецептура стандартной кишечной органоидной среды крысы, включая растворитель и условия хранения рекомбинантных белков. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Решения. Рецепты и инструкции по приготовлению других растворов, используемые на протяжении всего протокола. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 4. Кишечная органоидная среда крыс для 2D монослойной культуры (rIOM2D). Модифицированная рецептура органоидных питательных сред, оптимизированная для 2D роста монослоев. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Разработка модели органоида кишечника крысы сохраняет важные функциональные характеристики, обнаруженные в органе in vivo , и является перспективным инструментом для доклинических испытаний, скрининга лекарств и функциональных анализов. Эта модель in vitro может быть использована параллельно с доклиническими гастроэнтерологическими исследованиями in vivo , для которых крысы часто являются предпочтительной моделью из-за их большего размера кишечника, общих физиологических аспектов с людьми и в некоторых случаях более совершенныхмоделей заболевания. Здесь изложен надежный пошаговый протокол для выделения кишечных крипт крыс, генерации и долгосрочного культивирования органоидов кишечника крыс, а также последующих применений, включая функциональный анализ набухания форсколина, иммунофлюоресценцию всего маунта, 2D-монослойную культуру и лентивирусные генетические манипуляции. Органоиды кишечника крыс, вероятно, будут иметь значение во многих контекстах заболеваний, где патофизиология мышиных моделей неуместна, и могут обеспечить лучшую модель физиологии кишечника человека по сравнению с кишечными органоидами мышей.
Для создания долгоживущих органоидных культур, которые могут пассироваться и размножаться, необходимо определить ключевые факторы роста, необходимые для поддержания пролиферации кишечного эпителия. Мышиные органоиды чаще всего выращиваются в простом коктейле из EGF, R-спондина и ноггина, хотя сообщалось, что ноггин не является необходимымдля кишечной органоидной культуры. Кондиционированные среды могут заменить рекомбинантные факторы роста, и наиболее часто используемыми клеточными линиями являются L-WRN, которая секретирует Wnt3a, Rspondin-3 и Noggin39, L-Wnt3a и HA-Rspondin1-Fc 293T клетки40. L-WRN кондиционированная среда достаточна для поддержки роста органоидов не только кишечника мышей39 , но и роста органоидов кишечника нескольких сельскохозяйственных животных и животных-компаньонов, включая собак, кошек, кур, лошадей, коров, овец и свиней12. Тем не менее, органоиды кишечника человека сильно отличаются в своих требованиях к фактору роста, поскольку они требуют различных формул среды для фазы роста экспансии (т.е. прогрессии от малых сфероидов к большим) по сравнению с фазой дифференцировки (т.е. генерации и созревания дифференцированных типов клеток)10. Требования к питательным средам для органоидов кишечника крыс очень похожи на требования к питательным средам для распространения органоидов кишечника человека, но, что примечательно, органоиды крыс способны как к росту, так и к дифференцировке в этой среде, что значительно упрощает их культурные требования. В то время как наши первоначальные попытки были сосредоточены на создании и выращивании органоидов кишечника крыс в средах, кондиционированных L-WRN, долгосрочное культивирование было недостаточным, и линии органоидов кишечника крыс страдали от недостаточной надежности (данные не показаны). Это может быть связано с тем, что клеточные линии L-WRN спроектированы так, чтобы секретировать R-спондин 3, в то время как рекомендуемая здесь клеточная линия 293T-Rspo1 спроектирована для секреции R-спондина 1. Возможно, что органоиды крыс и человека предпочитают R-спондин 1, что потенциально объясняет разрушение органоидных линий крыс в средах, кондиционированных L-WRN.
Для наиболее точного повторения ситуации in vivo важно разработать условия культивирования органоидов, которые обеспечивают выживание, поддержание и пролиферацию стволовых клеток, а также могут поддерживать клеточный оборот и одновременную дифференцировку в дискретные типы клеток. Таким образом, концентрации рекомбинантных белков и/или белков в кондиционированных средах должны быть жестко титрованы и контролироваться для достижения идеального баланса. В частности, оптимальный уровень Wnt необходим для того, чтобы избежать потери кишечных органоидных культур. Слишком малое количество Wnt в кондиционированных средах будет неспособно поддерживать рост, что приведет к потере стволовых клеток и последующей гибели органоидов; Чрезмерная активация Wnt приведет к тому, что органоиды станут кистозными и недифференцированными10. Несмотря на то, что здесь нет подробностей, настоятельно рекомендуется тестировать каждую партию кондиционированных сред L-Wnt3a и 293T-Rspo1 с помощью Wnt-репортерного люциферазного анализа, такого как клеточная линия Topflash41. В предыдущих исследованиях было описано, что оптимальная партия среды L-Wnt3a должна приводить к увеличению сигнала в 15 раз при 12,5% и к увеличению сигнала в 300 раз при 50% по сравнению с 1% L-Wnt3a10. Поскольку органоиды крыс более чувствительны, чем органоиды мышей, к требованиям к культуре, особенно к уровням активации Wnt, эти дополнительные этапы контроля качества в значительной степени помогают повысить устойчивость и надежность культур органоидов крыс. Поскольку аналогичная репортерная линия недоступна для тестирования активности Bmp и относительных концентраций Noggin в кондиционированных средах Noggin, рекомендуется использовать рекомбинантный Noggin, когда это возможно, для точного контроля уровней Noggin. В то время как органоиды кишечника мышей могут быть выращены и поддерживаться в отсутствие Noggin39, это не было сделано для культур кишечных органоидов крыс.
Помимо требований к клеточной культуре, успешное начальное создание органоидной линии крысы в решающей степени зависит от эффективного истощения дифференцированных ворсинок во время изоляции крипт. Высокий уровень загрязнения вилларом вызывает гибель крипты, предположительно из-за сигналов от умирающих клеток или секвестрации важных факторов. Для точного и последовательного выделения этих дифференцированных ворсинок из эпителиальных препаратов рекомендуется проводить выделение эпителия с помощью стереоскопа. Визуальный осмотр высвобождаемого эпителия дает четкую подсказку, когда следует отказаться от PBS и заменить его (рис. 1). Крипты не следует собирать до тех пор, пока не произойдет достаточное истощение ворсинок. Клетки Виллара терминально дифференцированы и не могут генерировать органоиды в культуре. Кроме того, последующее прохождение органоидов кишечника крыс и их использование для любого последующего применения требует деликатной осторожности. Инкубация в диссоциационных реагентах в течение более длительных периодов времени (10 мин) приводит к значительной гибели клеток и потере органоидной линии.
Здесь описан простой и быстрый протокол генерации кишечных монослоев из органоидов крыс. Субстраты EME и коллагена I оказывают различное воздействие на эпителий, которое может быть использовано в зависимости от цели исследования. EME обеспечивает быструю и эффективную адгезию отдельных клеток и формирование клеточных проекций. Напротив, покрытие поверхности коллагеном I задерживает эти процессы. Как только монослои достигают примерно 80% слияния, клетки, выращенные на ЭМЕ, снова начинают генерировать 3D-органоидные структуры. Тем не менее, они не имеют достаточной физической и химической поддержки для дальнейшего роста. Этот возврат к органоидному состоянию можно предотвратить, поддерживая монослои в ЭМЭ на уровне слияния 50%-80%. Добавление разбавленного ЭМЭ к апикальной поверхности монослоев способствует быстрому восстановлению и образованию de novo органоидов, более быстро и легко генерируя области конвергенции. На поверхности коллагена I клетки могут образовывать однородный монослой и генерировать небольшие кластеры. Однако добавление коллагена I поверх монослоев недостаточно для того, чтобы индуцировать образование органоидов. ЭМЭ необходимо разбавлять при добавлении на поверхность монослоя, так как зарождающемуся органоиду придется преодолевать более сильное механическое сопротивление. Однако этот разбавленный ЭМЭ не позволяет устойчиво образовывать крупные органоиды. Любые de novo органоиды крыс, которые естественным образом отделяются от поверхности, должны быть немедленно удалены и перенесены в неразбавленный EME для восстановления структурной поддержки и роста. Из-за небольшого размера органоидов на этом этапе не рекомендуется прохождение органоидов до тех пор, пока не будет установлен устойчивый рост. Биологическое значение того, почему ЭМЭ может способствовать преобразованию органоидов, но может ли коллаген I делать это или нет, неясно. Тем не менее, были сообщения о том, что клетки, выращенные в 3D-коллагене, не могут образовывать почковавшиеся органоиды42,43 или поддерживать долгосрочное поддержание. Коммерчески доступные продукты EME представляют собой гетерогенные смеси внеклеточных белков, в первую очередь ламинина и коллагена IV44. Таким образом, различный состав белков и способность эпителиальной клетки взаимодействовать с внеклеточным матриксом с помощью различных клеточных комплексов могут позволить ремоделирование в EME, но не в коллагене I. Вопрос о том, можно ли помещать монослои, полученные из коллагена I, в EME для поддержки образования и роста органоидов, не проверялся.
Описаны генетические манипуляции с моделью органоида кишечника крысы, а также описаны протоколы лентивирусной трансдукции 3D-органоидов и транзиторной трансфекции 2D-монослоев. Для преодоления низкой эффективности лентивирусной органоидной трансдукции был разработан протокол транзиентной трансфекции 2D монослоев. Плоская морфология и обнаженные апикальные домены монослоев обеспечивают более легкий доступ к вирусам и ДНК-содержащим комплексам. Для валидации данного метода было использовано выражение репортера EGFP с использованием вектора pLJM1-EGFP. Экспрессия репортеров GFP наблюдалась через 24 ч и сохранялась в течение 5-6 дней в монослоях. Будущие исследования, посвященные лентивирусной трансдукции монослоев, вероятно, будут иметь более высокую эффективность, чем 3D-трансдукция органоидов. Используя описанные выше протоколы, 3D-органоиды могут быть преобразованы из зараженных 2D-монослоев, чтобы облегчить создание стабильных линий. При осторожности линии органоидов кишечника крыс могут успешно поддерживаться в течение более года, оставаясь стабильными в течение многих проходов, криоконсервированными, успешно размороженными и генетически модифицированными с помощью лентивирусной трансдукции, тем самым удовлетворяя потребность в доступной и податливой модели кишечного органоида in vitro , которая сохраняет физиологическую значимость для человека.
Раскрытие информации
Никакой.
Благодарности
Благодарим сотрудников лабораторий «Сумиграй» и «Амин» за содержательные обсуждения. Эта работа была поддержана грантом Фонда Чарльза Х. Худа на детское здоровье и грантом Фонда муковисцидоза (004741P222) для КС и Национальным институтом диабета, заболеваний пищеварительной системы и почек Национальных институтов здоровья для Северной Америки под номером 2R01DK077065-12.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
Ссылки
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены