Method Article
쥐 장 오가노이드의 생성과 조작
* 이 저자들은 동등하게 기여했습니다
요약
여기서는 쥐의 장 오가노이드를 생성하고 여러 다운스트림 응용 분야에서 사용하는 프로토콜을 제시합니다. 쥐는 종종 선호되는 전임상 모델이며, 강력한 장 오가노이드 시스템은 in vivo 연구에 수반되는 in vitro 시스템의 필요성을 충족시킵니다.
초록
오가노이드를 사용하여 생리학 및 세포 운명 결정을 평가할 때는 생체 내 맥락을 면밀히 요약하는 모델을 사용하는 것이 중요합니다. 따라서 환자 유래 오가노이드는 질병 모델링, 신약 개발 및 개인 맞춤형 치료 스크리닝에 사용됩니다. 마우스 장 오가노이드는 일반적으로 장 기능/생리학 및 줄기 세포 역학/운명 결정의 측면을 이해하는 데 사용됩니다. 그러나 많은 질병 맥락에서 쥐는 질병 병태 생리학 측면에서 인간과 생리적 유사성이 더 크기 때문에 생쥐보다 모델로 선호되는 경우가 많습니다. 쥐 모델은 생체 내에서 사용할 수 있는 유전 도구의 부족으로 인해 제한되어 왔으며, 쥐의 장 오가노이드는 깨지기 쉽고 장기적으로 배양하기 어려운 것으로 입증되었습니다. 여기서는 이전에 발표된 프로토콜을 기반으로 십이지장과 제주넘에서 쥐의 장 오가노이드를 강력하게 생성합니다. 쥐의 장 오가노이드를 활용하는 여러 다운스트림 응용 분야에 대한 개요를 제공하며, 여기에는 기능적 팽창 분석, 전체 마운트 염색, 2D 장내 단층 생성, 렌티바이러스 형질도입 등이 포함됩니다. 쥐 오가노이드 모델은 인간과의 생리학적 관련성을 유지하고, 신속하게 유전자 조작이 가능하며, 인간 장내 오가노이드 조달과 관련된 장벽 없이 쉽게 얻을 수 있는 in vitro 모델에 대한 현장의 요구에 대한 실용적인 솔루션을 제공합니다.
서문
인간의 소장 상피 구조와 세포 구성은 생리적 기능을 반영하여 복잡합니다. 소장의 주요 역할은 내강을 통과하는 음식물로부터 영양분을 흡수하는 것이다1. 이 기능을 극대화하기 위해 장 표면은 흡수 표면적을 증가시키는 융모라고 하는 손가락 모양의 돌출부와 줄기세포를 수용하고 단열하는 크립트(crypt)라고 하는 컵 모양의 침출부로 구성됩니다. 상피 내에서는 다양한 특수 흡수 및 분비 세포 유형이 생성되어 뚜렷한 기능을 수행합니다1. 이러한 복잡성 때문에 고통로 형질전환된 불멸의 세포주에서 장과 같은 조직을 모델링하는 것은 어려웠습니다. 그러나 줄기세포, 특히 성체 줄기세포와 그 분화 메커니즘에 대한 연구는 3D 장 오가노이드 배양의 개발을 가능하게 했습니다. 오가노이드 모델의 사용은 부분적으로 일부 아키텍처 구성 요소의 재현과 온전한 장에서 발견되는 세포 유형 이질성으로 인해 이 분야를 변화시켰습니다. 장내 오가노이드는 활성 줄기세포 집단의 유지로 인해 in vitro 에서 장기간 배양할 수 있다2.
장내 오가노이드는 줄기세포 생물학, 세포 생리학, 유전 질환 및 영양 3,4을 연구하는 데 적합한 모델로 빠르게 자리잡았을 뿐만 아니라 새로운 약물 전달 방법을 개발하는 도구이기도 하다5. 또한 환자 유래 오가노이드는 질병 모델링, 약물 발견 및 맞춤형 치료 스크리닝에 활용되고 있습니다 6,7,8,9. 그러나 인간의 장내 오가노이드는 여전히 도전 과제를 안고 있습니다. 조직 가용성, 기관 검토 위원회 승인 요건 및 윤리적 문제로 인해 인체 샘플의 광범위한 사용이 제한됩니다. 또한, 장낭샘에서 생성된 인간 장 오가노이드는 미분화 줄기세포의 유지를 위해 또는 성숙한 세포 유형의 분화를 유도하기 위해 두 가지 뚜렷한 배양 조건을 필요로 한다10. 이는 줄기세포와 성숙한 분화 세포 유형이 동시에 존재하고 지속적으로 생성/유지되는 in vivo와 대조됩니다1. 반면에, 성장 인자의 덜 복잡한 칵테일에서 성장한 마우스 장 오가노이드는 배지 조성에서 이러한 전환을 필요로 하지 않으며 동일한 배지 컨텍스트에서 줄기 세포와 분화된 세포를 유지할 수 있습니다 2,11. 그러나 인간과 비교할 때 마우스 장의 주요 차이로 인해 많은 경우 마우스 오가노이드가 차선의 모델이 될 수 있습니다. 전반적으로, 말, 돼지, 양, 소, 개, 고양이를 포함한 대형 포유류의 많은 장 오가노이드는 인간 장 오가노이드의 배양 조건보다 마우스 장 오가노이드와 더 밀접하게 일치하는 배양 조건에서 성공적으로 생성되었습니다12. 마우스와 인간 오가노이드 간의 성장 인자 조건의 차이는 줄기 세포 틈새 구성의 차이와 줄기 세포 생존, 증식 및 유지에 대한 요구 사항의 차이를 반영할 수 있습니다. 따라서 1) 인간의 장내 세포 구성과 매우 유사하고, 2) 인간의 장 오가노이드와 같은 성장 인자 요구 사항을 가진 줄기세포를 포함하며, 3) 미분화 및 분화 구획을 지속적으로 유지할 수 있는 쉽게 접근할 수 있는 모델 오가노이드 시스템이 필요합니다. 이상적으로, 시스템은 일반적으로 사용되는 전임상 동물 모델에서 가져온 것으로, 생체 내 및 시험관 내 실험이 상호 연관되어 함께 사용될 수 있습니다.
랫트는 장 생리학 및 생화학이 인간과 매우 유사하기 때문에 장 생리학 및 약리학 연구에서 일반적으로 사용되는 전임상 모델이다13, 특히 장 투과성과 관련하여14. 생쥐에 비해 상대적으로 크기가 커서 수술 절차에 더 적합합니다. 돼지를 포함한 대형 동물 모델이 때때로 사용되지만, 쥐는 더 저렴한 모델이고, 사육을 위한 공간이 덜 필요하며, 쉽게 상업적으로 이용 가능한 표준 균주를 가지고 있다15. 쥐 모델 사용의 단점은 생체 내 연구를 위한 유전자 툴킷이 마우스에 비해 잘 개발되지 않았고 녹아웃, 넉인, 형질전환을 포함한 새로운 쥐 계통의 생성에 비용이 많이 든다는 것입니다. 강력한 쥐 장 오가노이드 모델의 개발 및 최적화는 인간과의 주요 생리학적 관련성을 유지하는 접근 가능한 모델에서 유전자 조작, 약리학적 치료 및 더 높은 처리량의 연구를 가능하게 할 것입니다. 그러나 한 설치류 오가노이드 모델과 다른 설치류 오가노이드 모델의 장점은 연구 중인 특정 과정이나 유전자에 따라 크게 달라집니다. 인간에서 발견되는 특정 유전자는 쥐의 유사 유전자일 수 있지만 쥐의 유사 유전자는 아닐 수 있다16,17. 또한 종 특이적 세포 아형은 단일 세포 RNAseq18,19,20에 의해 점점 더 밝혀지고 있습니다. 마지막으로, 쥐와 생쥐의 장 질환 모델은 종종 표현형에서 상당한 변화를 보이기 때문에21,22 인간에서 볼 수 있는 증상과 질병 과정을 보다 밀접하게 요약하는 모델을 다운스트림 작업을 위해 선택해야 합니다. 쥐 장 오가노이드 모델의 생성은 연구자가 자신의 상황에 가장 적합한 모델 시스템을 선택할 수 있는 추가적인 유연성과 선택권을 제공합니다. 여기서, 기존 프로토콜23,24는 쥐의 장 오가노이드 생성을 위해 확장되고, 십이지장 또는 제주눔에서 쥐의 장 오가노이드의 생성 및 유지를 위한 프로토콜이 개략적으로 설명된다. 또한 렌티바이러스 감염, 전체 마운트 염색 및 포스콜린 팽창 분석을 포함한 여러 다운스트림 응용 분야에 대해 설명합니다.
프로토콜
알림: 모든 세포 배양은 조직 배양 후드에서 적절한 무균 기술을 사용하여 처리해야 합니다. 이 연구의 모든 동물 연구는 Yale의 IACUC(Institutional Animal Care and Use Committee)의 승인을 받았습니다.
1. 세포 배양 시약의 제조
- 제조업체의 지침에 따라 R-spondin 1 컨디셔닝 미디어를 준비합니다. 제조업체의 지침에 따라 Wnt3a 컨디셔닝된 미디어를 준비합니다. 표 1에 설명된 대로 AdDMEM+를 준비합니다.
- 가스트린을 멸균 dH2O에 재현탁시켜 100μM 스톡을 준비합니다. 분취하여 -80 °C에서 보관하십시오. N-아세틸시스테인을 멸균수에 재현탁시켜 100mM 스톡을 준비합니다. 분취 및 -20 °C에서 최대 1개월 동안 보관하십시오.
- 인산염 완충 식염수 (PBS) + 0.1 % 소 혈청 알부민 (BSA)에 재조합 인간 Noggin을 재현탁시켜 250 μg / mL 스톡을 준비합니다. 분취하여 -80 °C에서 보관하십시오. PBS + 0.1% BSA에서 재조합 마우스 표피 성장 인자(EGF)를 재현탁하여 100μg/mL 스톡을 준비합니다. 분취하여 -80 °C에서 보관하십시오.
- 재조합 인간 IGF-1을 PBS + 0.1% BSA에 희석하여 100μg/mL 스톡을 준비합니다. 분취하여 -80 °C에서 보관하십시오. 재조합 인간 FGF-2를 5mM Tris, pH 7.6에 재현탁시켜 100μg/mL 스톡을 준비합니다. 분취하여 -80 °C에서 보관하십시오.
참고: 모든 성장 인자에 대해 PBS + 0.1% BSA의 중간 희석액을 배양 배지의 최종 농도의 100배로 사용합니다. -20 °C에서 보관하십시오.
2. 쥐 소장 오가노이드 구축
참고: 이 프로토콜은 쥐 장 오가노이드23,24에 대해 이전에 발표된 두 가지 프로토콜에서 수정되었습니다.
- 표 2에 따라 쥐의 장 오가노이드 배지(rIOM)를 준비하고 37°C의 수조를 설정합니다. 이 완전한 배지는 4°C에서 5일 동안 안정적입니다.
- PBS에서 15mL 원뿔형 튜브에 10mM 에틸렌디아민테트라아세트산(EDTA) 10mL를 준비하고 얼음 위에 보관합니다. 얼음 위에서 250μL의 세포외 기질 추출물(EME)을 해동합니다.
- 하룻밤 사이에 쥐를 단식하고 물을 마실 수 있습니다. IACUC가 승인한 프로토콜에 따라 쥐를 안락사시킵니다. 이 프로토콜에서 성인 수컷 Sprague Dawley 쥐(체중~200g)는CO2 흡입을 통해 안락사되었습니다(재료 표). 자궁경부 탈구는 안락사의 2차 방법으로 사용되었다.
- 해부를 위해 멸균 오토클레이브 겸자와 해부 가위를 사용하십시오. 안락사된 쥐를 해부면의 복부 면이 위로 향하게 놓습니다. 집게로 피부층을 꼬집습니다. 다음 절개는 표면 수준에서 이루어져야 하므로 이 피부층만 절개하고 내부 장기를 손상시킬 만큼 깊지 않습니다.
- 복강을 열려면 크고 날카로운 해부 가위를 사용하여 복부 중앙의 크고 세로로 표면 높이를 절단하여 피부층을 절단합니다. 다음으로, 그 절단에서 벗어나 양쪽에 하나씩 두 개의 더 짧은 수평 절단을 만듭니다. 집게를 사용하여 피부를 벗겨내어 복강을 노출시킵니다. 복막(peritoneal membrane)을 절단하여 복강의 내부 장기를 완전히 노출시켜 장에 쉽게 접근할 수 있도록 합니다.
- 가위와 집게를 사용하여 위의 위치를 찾고 약 2-3cm 원위부의 십이지장을 식별하면 노란색 분절로 나타납니다. 근위 jejunum은 Treitz 인대에서 약 4-5cm 원위부에 위치하며, 십이지장과 jejunum 사이의 랜드 마크 역할을합니다.
- 분리된 장 조각을 10cm 페트리 접시에 담습니다. 장간막의 원하는 장 부분을 가능한 한 많이 청소하십시오. 발광 내용물이 제거될 때까지 얼음처럼 차가운 PBS 10mL로 씻어냅니다. 종이 타월에 장 부분을 ~ 2cm 길이로 자릅니다. 각 장 조각을 세로로 열어 상피를 노출시킵니다.
- 유리 현미경 슬라이드를 사용하여 노출된 내강 표면을 긁어 융모를 제거합니다. 얼음 위에 준비된 EDTA 용액에 장 조각을 넣습니다. 4rpm으로 설정된 튜브 리볼버에서 30분 동안 10°C로 회전합니다.
- 해부 현미경에서 원뿔형 튜브의 내용물을 10cm 페트리 접시에 붓습니다. 얼음처럼 차가운 PBS를 ~5mL를 추가합니다.
- 미세한 집게를 사용하여 장 부분을 잡고 세게 흔듭니다. 상피가 PBS로 방출되는 것을 볼 수 있습니다. 처음에 PBS는 주로 융모를 포함합니다.
- 계속 흔듭니다. 융모가 함유된 PBS를 주기적으로 버리고 10mL의 신선한 얼음처럼 차가운 PBS를 장 조각에 추가합니다. 조각을 계속 흔들고 융모가 더 이상 PBS로 방출되지 않고 대신 PBS에 주로 크립트가 포함될 때까지 이 세척 단계를 반복합니다. 세포 생존력이 손상되지 않도록 crypt 분리의 경우 15분을 초과하지 마십시오.
- 남은 장 조각은 버립니다. 장 크립트를 위해 페트리 접시에 남아 있는 PBS를 풍부하게 합니다. 조직 배양 후드에서 PBS 함유 크립트를 수집하고 70μm 세포 스트레이너를 통해 여과합니다(재료 표).
- 250 x g 에서 5분 동안 원심분리기 상층액을 제거하고 펠릿을 5mL의 AdDMEM+에 재현탁시킵니다. 250 x g 에서 5분 동안 다시 원심분리합니다.
알림: 스윙 버킷 로터가 있는 원심분리기를 사용하는 것이 좋습니다. - 상층액을 제거하고 펠릿과 함께 ~50μL의 배지를 남깁니다. 펠릿을 나머지 매체에 다시 현탁시키고 얼음 위의 EME 부분 표본에 추가합니다. EME 전체에 크립트가 고르게 매달릴 수 있도록 위아래로 부드럽게 피펫팅합니다. 거품이 생기지 않도록 하십시오.
- 50μL의 EME 돔을 35mm 조직 배양 접시에 담고 37°C, 5%CO2 조직 배양 인큐베이터에서 20분 동안 배양합니다.
- 10μM Y27632 및 10μM CHIR99021를 포함하는 2mL의 rIOM(표 2)을 추가합니다(표 3). 통과 후 Y27632 및 CHIR99021는 중단될 수 있습니다.
- 2-3일마다 rIOM을 변경합니다. 필요에 따라 통과하며, 일반적으로 초기 오가노이드 수, 크기 및 성장 속도에 따라 3-7일 사이입니다.
3. 쥐의 장 오가노이드 통과
- 얼음 위에서 EME 250μL 부분 표본을 해동하고 rIOM을 37°C로 예열합니다.
- 오가노이드가 포함된 35mm 플레이트에서 배지를 흡입하고 1mL의 해리 시약을 추가하여 EME 돔에서 오가노이드를 즉시 방출합니다.
- 조각난 오가노이드가 있는 해리 시약을 15mL 코니컬 튜브로 즉시 옮깁니다. 2mL의 AdDMEM+로 배양 플레이트를 세척하고 조각난 오가노이드가 들어 있는 15mL 코니컬 튜브에 추가합니다.
- 유리 파스퇴르 피펫을 사용하여 15-20회 위아래로 부드럽게 피펫팅하여 오가노이드를 조각냅니다. 350 x g 에서 2분 동안 원심분리기
- 원뿔형 튜브 바닥에서 EME로 ~50μL의 용액을 추가합니다. 부드럽게 위아래로 피펫팅하여 혼합합니다. 거품을 만들지 마십시오.
- 50μL의 EME 돔을 35mm 접시에 담고 37°C, 5%CO2 조직 배양 인큐베이터에서 20분 동안 배양합니다.
- 10 μM Y27632 및 10 μM CHIR99021와 함께 2mL의 rIOM을 추가합니다. 2-3일마다 성장 배지를 교체하십시오. 미디어를 변경할 때 Y27632 및 CHIR99021 생략할 수 있습니다.
4. 쥐 장 오가노이드의 냉동 보존 및 해동
- 쥐의 장 오가노이드를 냉동 보존하는
참고: 동결 보존 프로토콜은 인간 및 마우스 오가노이드25에 대한 이전 프로토콜에서 수정되었습니다. 동결하기 전에 오가노이드는 1차 배양에서 최소 2개의 통로를 가지고 있어야 합니다. 냉동 보존 전에 오가노이드를 큰 스페로이드 또는 약간 싹이 트는 오가노이드 지점까지 성장시키는 것이 좋으며, 이는 해동 후 생존 가능한 오가노이드의 수율을 높일 수 있기 때문입니다. 이는 R-spondin 조절 배지를 15%로 증가시키거나 오가노이드 배양에 10mM 니코틴아미드(표 3)를 첨가하여 달성할 수 있습니다.- 현미경을 사용하여 35mm 접시의 오가노이드 수를 계산합니다. 200개의 오가노이드가 각 극저온 비알에 분주되도록 극저온 비셜에 라벨을 붙입니다.
- 35mm 접시에서 rIOM을 제거합니다. 2mL의 저온 조직 배양 등급 PBS로 교체합니다.
- P1000 팁을 사용하여 위아래로 피펫팅하여 배양 접시 바닥에서 PBS로 EME 돔을 분리합니다. EME를 분해하고 오가노이드를 방출하기 위해 위아래로 20회 피펫팅을 계속합니다. 오가노이드와 PBS를 15mL 코니컬 튜브에 수집합니다.
- 배양 접시에 2mL의 차가운 PBS를 추가하고 피펫팅을 위아래로 하여 남아 있는 오가노이드를 PBS로 방출합니다. PBS를 15mL 코니컬 튜브로 옮깁니다.
- 290 x g 에서 5분 동안 원심분리하여 오가노이드를 펠트합니다. 오가노이드 펠릿을 방해하지 않고 상층액을 제거하고 폐기하십시오.
- 5mL의 차가운 AdDMEM+에 부드럽게 재현탁하여 펠릿을 세척합니다. 200 x g 에서 4분 동안 원심분리기 상층액을 조심스럽게 제거하고 폐기하십시오.
- 오가노이드 펠릿을 200개의 오가노이드당 1mL의 저온 동결 배지에 재현탁시킵니다. 라벨링된 cryovial당 동결 배지에서 1mL의 오가노이드를 분취합니다. 냉동 용기에 냉동 용기를 넣습니다.
- 오가노이드를 -80°C의 냉동 용기에 24시간 동안 보관한 다음 극저온 수소를 액체 질소로 옮겨 장기간 보관합니다.
- 쥐 장 오가노이드 해동
참고: 이 프로토콜은 인간 및 마우스 장 오가노이드26을 해동하기 위한 이전 프로토콜에서 수정되었습니다.- 얼음 위에서 EME 250μL 분취액을 해동합니다. 15% R-spondin 컨디셔닝 배지, 10μM Y27632 및 10μM CHIR99021로 보충된 rIOM을 준비합니다. 37 °C에서 데우십시오.
- 실온에서 2mL의 원뿔형 튜브에 해동 배지(표 3)(표 3)를 추가합니다.
- 바이알이 거의 완전히 해동될 때까지 바이알을 37°C 수조에 넣어 액체 질소에서 오가노이드 바이알을 회수하고 해동합니다.
- 바이알에 해동 배지 1mL를 추가하고 모든 내용물을 해동 배지가 들어 있는 원뿔형 튜브로 옮깁니다. 1mL의 해동 배지로 바이알을 두 번 세척하고 원뿔형 튜브로 옮깁니다.
- 200 x g 에서 5분 동안 원심분리기 매체를 흡인하고 오가노이드에 ~50μL의 매체를 남깁니다. 오가노이드가 포함된 배지를 250μL의 EME로 옮깁니다.
- 기포를 피펫팅하여 EME를 통해 오가노이드를 고르게 분배합니다. 6개의 50μL 돔을 35mm 조직 배양 접시에 피펫팅합니다.
- EME가 중합될 수 있도록 조직 배양 인큐베이터에서 15-20분 동안 배양합니다. 준비된 rIOM 2mL를 접시에 추가합니다.
- 2일 후 미디어를 rIOM으로 교체합니다. Y27632 및 CHIR99021의 사용을 일시 중단할 수 있습니다. 오가노이드 성장은 해동 후 첫 번째 통로에서 느릴 수 있습니다. 실험을 시작하기 전에 해동 후 오가노이드를 두 번 통과시키는 것이 좋습니다.
5. 3D 오가노이드에서 쥐 장 2D 단층 생성
참고: 다음 프로토콜은 ~300개의 장 오가노이드/돔(스케일: 하나의 돔이 4개의 웰을 생성함)을 포함하는 50μL(35mm 접시)의 6개 돔으로 시작하여 EME로 코팅된 48웰 플레이트의 24개 웰을 생성하는 데 필요한 부피를 설명하지만 필요에 따라 확장 또는 축소할 수 있습니다. 쓰여진 바와 같이이 프로토콜은 4-5 일 안에 ~ 80 %의 합류를 달성합니다. 밀도가 높을수록 세포는 3D 오가노이드 구조를 다시 획득하기 시작합니다. 낮은 합류도(≤40%)에서 세포는 단층으로 남아 있으며 ~14일 동안 생존할 수 있습니다. 연구의 목적이 2D 단층을 사용하는 것이라면 하나의 돔이 24웰 플레이트의 8웰을 생성하도록 축소합니다. 웰은 또한 콜라겐 I로 코팅되어 단층을 형성할 수 있습니다.
- 코팅된 표면의 준비
- 플레이트를 EME로 코팅하려면 EME를 차가운 AdDMEM+에 1:20으로 희석합니다(표 1). 콜라겐 코팅을 위해 제조업체의 지침에 따라 콜라겐 I을 준비하십시오. AdDMEM+에서 5mg/mL 콜라겐 I을 100μg/mL(이 경우 1:50)로 희석합니다.
- 200μL의 희석된 EME 또는 콜라겐으로 플레이트를 코팅하여 웰 표면을 완전히 덮습니다. 조직 배양 인큐베이터에서 37°C에서 1-2시간 동안 배양합니다. 표 4에 따라 2D 단층 배양(rIOM2D)을 위한 쥐 장 오가노이드 배지를 준비합니다.
- 단층 생성
- 오가노이드가 들어 있는 35mm 플레이트에서 배지를 흡입합니다. PBS 1mL를 추가합니다.
- P1000 팁으로 긁어 우물의 EME를 방해합니다. 피펫을 위아래로 약 20회 움직여 모든 EME를 풉니다. 모든 것을 15mL 코니컬 튜브로 옮깁니다.
- 35mm 플레이트에 PBS 1mL를 추가하여 추가 오가노이드를 회수하고 동일한 15mL 코니컬 튜브로 옮깁니다.
- 350 x g 에서 2분 동안 원심분리하고 EME 잔류물을 포함한 상층액을 흡입합니다. 오가노이드 펠릿에 트립신 용액 1mL를 추가하고 37°C에서 2분 동안 배양합니다.
- P1000 팁을 사용하여 위아래로 10회 피펫팅하고 AdDMEM+ 2mL를 추가하여 트립신을 중화합니다.
- 350 x g 에서 5분 동안 원심분리기 상층액을 흡인하고 4.8mL의 rIOM2D를 추가합니다(표 4). 세포 펠릿을 재현탁시킵니다.
- 오가노이드를 배치하기 전에 웰에서 AdDMEM+의 과도한 EME 또는 콜라겐을 제거합니다. 그런 다음 rIOM2D에 200μL의 오가노이드와 10μM Y27632를 사전 코팅된 각 웰에 추가합니다.
- 4-16시간 후 배지와 원심분리기를 1,000 x g 에서 1분 동안 수집합니다. 상층액을 새 15mL 코니컬 튜브로 옮기고 펠릿을 버립니다.
- 각 웰을 300μL의 PBS로 세척하고 원심분리된 rIOM2D 200μL를 각 웰에 추가합니다. 2-3일마다 rIOM2D를 교체하고 Y27632의 사용을 일시 중단합니다.
- 2D 단층에서 3D 오가노이드 개질
참고: EME에서 성장한 단층은 3D 오가노이드를 재형성하도록 유도할 수 있는 반면, 콜라겐 I에서 성장한 단층은 3D 오가노이드로 효율적으로 돌아가지 않습니다. 일반적으로 단층에서 생성된 오가노이드 2-3웰을 사용하여 5일차에 50μL의 EME 돔 하나를 만들 수 있습니다.- EME를 rIOM1D에서 4:2로 희석합니다. 단층이 ~80% 밀도에 도달하면 배지를 조심스럽게 흡입하고 단층이 포함된 웰에 100μL의 희석된 EME를 추가합니다.
- 37 °C, 5 % CO2 조직 배양 인큐베이터에서 20 분 동안 배양 합니다. 그런 다음 100μL의 rIOM2D를 추가하고 조직 배양 인큐베이터로 돌아갑니다. 3D 오가노이드는 희석된 EME를 첨가한 후 5일 이내에 생성됩니다.
- 작은 오가노이드가 재형성된 후(~5일차) rIOM을 준비합니다. 모든 웰 내용물을 수집하고, 위아래로 피펫팅하여 EME를 방해하고, 15mL 코니컬 튜브로 옮깁니다.
- 350 x g 에서 2분 동안 원심분리기 상층액과 EME 잔류물을 흡인합니다.
- 차가운 AdDMEM+ 1mL를 넣고 350 x g 에서 2분 동안 원심분리합니다. ~50μL의 배지를 남기고 상층액을 제거합니다.
- 50μL의 배지 및 오가노이드를 250μL EME 부분 표본으로 옮깁니다. 피펫을 위아래로 움직여 EME 전체에 오가노이드를 분배합니다.
- 50μL의 EME 돔을 35mm 접시에 피펫팅하고 조직 배양 인큐베이터에서 20분 동안 배양합니다.
- 2mL의 rIOM에 10μM Y27632를 추가합니다. 2-3일마다 성장 배지를 교체하십시오. 미디어를 변경할 때 Y27632를 생략할 수 있습니다.
6. 유전자 조작
- 2D 단층의 과도 transfection
주의: 섹션 5.1에 따라 48웰 플레이트에서 쥐의 장 상피 단층을 준비합니다. transfection은 70%-80% 밀도에서 수행해야 합니다. transfection하기 전에 항상 well의 배지를 200μL의 새 rIOM2D로 교체하십시오. 플라스미드 DNA의 260/280 nm 및 260/230 nm 흡광도를 계산합니다. 이 수치는 1.8 이상이어야 우수한 transfection 결과를 얻을 수 있습니다.
NOTE: plasmid control을 사용하여 transfection의 효율을 계산합니다. 형광 단백질을 암호화하는 플라스미드를 사용하는 것이 좋습니다. 이 프로토콜에서는 pLJM1-EGFP27 을 사용하였다.- 1mg/mL의 20kDa 폴리에틸렌시민(PEI; 표 3). 각 웰에 대해 튜브 A(플라스미드 0.6μg + 환원 혈청 배지 50μL)와 튜브 B(PEI 1.8μL + 환원 혈청 배지 50μL)를 준비합니다. DNA:PEI 비율을 1:3으로 유지합니다.
- 30초 동안 두 튜브를 모두 소용돌이칩니다. 튜브 A와 튜브 B를 결합하고 다시 30초 동안 소용돌이칩니다. 필요한 경우 원심분리기를 사용하여 회전합니다. 실온에서 20분 동안 배양합니다.
- DNA/PEI 복합체를 2D 단층에 적하 방향으로 부드럽게 추가합니다. 접시를 부드럽게 휘저어 섞습니다. 37 °C, 5 % CO2 에서 배양합니다. 이 발현은 일반적으로 24시간 후에 감지할 수 있습니다.
참고: 3D 오가노이드 구조로 돌아가야 하는 경우 transfection 후 희석된 EME를 추가하기 위해 48시간 동안 기다리십시오.
- 쥐 장 오가노이드의 렌티바이러스 형질도입
참고: 렌티바이러스를 사용하기 전에 해당 기관에서 적절한 승인과 전문 교육을 받으십시오. 렌티바이러스를 취급할 때는 항상 적절한 개인 보호 장비(PPE)를 착용하십시오. 여기에 설명되어 있지는 않지만, 고품질의 농축 렌티바이러스는 오가노이드의 성공적인 감염에 필수적입니다. 이 프로토콜은 빈 pLJM1-EGFP 벡터를 사용했습니다.27 가용성 GFP를 발현합니다. 이 프로토콜은 이전에 게시된 프로토콜에서 수정되었습니다28. transduction 효율은 바이러스 입자의 품질과 농도, 오가노이드를 작은 세포 클러스터로 효율적으로 분리하고 발현되는 유전자에 따라 달라집니다. 감염 5일 후 계산했을 때, 선택 전 평균 형질도입 효율은 19.4%(± 6.5% 표준편차)였다.- 렌티바이러스 감염 2일 전, 형질도입될 각 렌티바이러스에 대해 24웰 플레이트의 조밀한 웰 2개를 통과할 계획(섹션 3)합니다. 24웰 플레이트의 각 웰은 EME의 50μL 돔 1개를 수용할 수 있습니다.
- EME가 응고되면 10mM 니코틴아미드, 10μM Y27632 및 2.5μM CHIR99021가 보충된 0.5mL의 rIOM을 추가합니다. 이는 큰 스페로이드 형태를 유도하며, 이는 렌티바이러스 형질도입의 효율성에 유리합니다. 도금 후 2일 이내에 쥐 오가노이드는 큰 스페로이드가 되어야 합니다. 유의미한 분화(즉, 발아)가 관찰되면 오가노이드를 다시 통과시킵니다.
- 농축된 바이러스를 얼음 위에서 해동합니다. 표 3에 따라 새로운 형질주입 배지를 준비합니다.
- P1000 팁을 사용하여 피펫팅을 위아래로 하여 EME 돔을 세포 배양 접시 바닥에서 배지로 방출합니다. 위아래로 20회 피펫팅을 계속하여 EME를 분해하고 오가노이드를 방출합니다.
- 오가노이드와 배지를 15mL 코니컬 튜브에 피펫팅합니다. 오가노이드가 동일한 유전자형을 가지고 있고 동일한 계통에서 온 경우 모든 웰을 함께 모을 수 있습니다.
- 차가운 AdDMEM+ 1mL로 각각 두 번 잘 씻습니다. AdDMEM+를 채취하여 동일한 15mL 코니컬 튜브로 옮깁니다.
- 유리 파스퇴르 피펫을 사용하여 쥐 오가노이드를 기계적으로 파괴합니다. 이것은 작은 다세포 세포 클러스터가 목표이기 때문에 중요한 단계입니다. 피펫을 위아래로 ~30회 합니다. 4x 대물렌즈를 사용하여 현미경으로 파쇄의 효율성을 확인하십시오. 세포 현탁액이 오가노이드가 거의 남아 있지 않은 세포 클러스터로 주로 구성될 때까지 이 과정을 계속합니다.
참고: 또는 오가노이드를 실온에서 200 x g 에서 5분 동안 원심분리하고, 상층액을 조심스럽게 제거하고, 조직 배양 인큐베이터에서 37°C로 예열하여 기존 트립신/EDTA를 대체하는 1mL의 재조합 효소에 재현탁할 수 있습니다. 트립신 보충 오가노이드를 37°C 수조에서 2분 동안 배양하고 해리를 촉진하기 위해 정기적으로 볼텍싱합니다. 트립신 대체품으로 장기간 배양하면 세포 사멸을 촉진할 수 있으므로 피하십시오. 4x 대물렌즈를 사용하여 현미경으로 파괴의 효율성을 정기적으로 확인하십시오. 현탁액이 세포 배양이 거의 없는 주로 단일 세포로 구성된 경우 AdDMEM+ 4mL를 추가하여 트립신 대체물을 희석하고 다음 단계를 진행합니다. - 세포 클러스터가 들어 있는 15mL 코니컬 튜브를 200 x g 에서 4°C에서 5분 동안 회전시킵니다. 세포 펠릿을 방해하지 않도록 주의하면서 상층액을 조심스럽게 제거하고 폐기하십시오.
- 감염시킬 웰당 230μL의 형질주입 배지에 세포 클러스터를 재현탁시킵니다. 감염의 경우, 각 렌티바이러스에 대해 48웰 플레이트 중 하나의 웰을 사용하십시오.
- 230μL의 셀 현탁액을 라벨링된 48웰 플레이트의 각 웰에 플레이트합니다. 각 웰에 농축된 바이러스 20μL를 추가합니다. P1000 팁을 사용하여 각 웰에 바이러스/세포 용액을 혼합하고 투명 필름으로 플레이트를 밀봉합니다.
- 회전 수행: 플레이트를 600 x g 에서 32°C에서 1시간 동안 원심분리합니다. 플레이트의 밀봉을 풀고 37°C, 5% CO2 에서 6시간 동안 배양합니다.
- 37°C 인큐베이터에서 24웰 플레이트를 예열합니다.
- 배양 후 각 웰을 위아래로 피펫팅하고 내용물을 라벨링된 1.5mL 튜브로 옮깁니다. 각각 750μL의 AdDMEM+로 잘 세척하고 튜브로 옮깁니다. 600 x g 에서 4°C에서 5분 동안 튜브를 회전시킵니다.
- 원심분리기에서 튜브를 제거하고 얼음 위에 보관합니다. P1000 팁을 사용하여 상층액을 조심스럽게 제거하고 적절하게 폐기하십시오.
- 셀 펠릿을 EME에 재현탁시키고 50μL 돔을 예열된 24웰 플레이트에 플레이트합니다. EME가 중합될 때까지 37°C에서 15-20분 동안 배양합니다.
- 각 웰에 10mM 니코틴아미드, 10μM Y27632 및 2.5μM CHIR99021가 보충된 500μL의 rIOM을 추가합니다.
- 감염 1일 후 배지를 rIOM과 10μM Y27632로 교체합니다. 2-3일마다 미디어를 교체하십시오. 선택을 수행하는 경우 감염 후 48-72시간 후에 선택을 추가합니다. 퓨로마이신 선택에는 2μg/mL 퓨로마이신을 사용합니다.
7. 오가노이드의 면역형광 전체 마운트 염색
- 배지를 흡인하고 PBS-Tween 20(PBS-T)의 4% 파라포름알데히드(PFA)(표 3)를 세포 배양 접시의 오가노이드에 추가합니다. 실온에서 10분 동안 배양합니다.
- 위아래로 피펫팅하여 EME에서 오가노이드를 방출합니다. 오가노이드를 0.75mL 튜브에 수집합니다. 오가노이드는 몇 분 안에 중력에 의해 튜브 바닥에 가라앉습니다. 필요한 경우 100 x g 에서 1분 동안 원심분리합니다.
- 이송 피펫을 사용하여 PFA를 제거하고 PBS-T에 오가노이드를 재현탁시킵니다. 오가노이드가 튜브 바닥에 가라앉도록 합니다. PBS-T를 제거하고 200μL의 블록 용액에 재현탁합니다(표 3).
- 실온에서 로커 또는 너트레이터에서 45분 동안 배양합니다. 오가노이드는 뭉쳐서 튜브 바닥에 가라앉을 수 있습니다. 주기적으로 튜브를 손가락으로 튕겨 용액 전체에 재현탁 및 분산시킵니다.
- 오가노이드가 튜브 바닥에 가라앉도록 합니다. 필요한 경우 100 x g 에서 1분 동안 원심분리합니다. 블록 용액을 제거합니다.
- 100μL의 블록 용액에 희석된 1차 항체를 추가합니다. 실온에서 너트 믹서에서 24rpm에서 45분 동안 배양합니다. 항체 농도는 사용하는 항체에 따라 다릅니다.
참고: 이 단계는 1차 항체에 따라 4°C에서 최대 하룻밤까지 연장할 수 있습니다. - 오가노이드가 튜브 바닥에 가라앉도록 합니다. 필요한 경우 100 x g 에서 1분 동안 원심분리합니다.
- 전사 피펫을 사용하여 PBS-T에서 5회 세척합니다. 24 rpm의 너트 믹서에서 5 분 동안 실온에서 배양합니다. 이 단계를 두 번 반복합니다.
- 1:200으로 희석한 2차 항체와 100μL의 블록 용액에 희석한 50μg/mL 4′,6-디아미디노-2-페닐린돌(DAPI)을 추가합니다. 실온에서 너트 믹서에서 24rpm에서 30분 동안 배양합니다.
- 오가노이드가 튜브 바닥에 가라앉도록 합니다. 필요한 경우 100 x g 에서 1분 동안 원심분리합니다. 2차 항체를 제거합니다. 전사 피펫을 사용하여 PBS-T에서 5회 세척합니다.
- 24 rpm의 너트 믹서에서 실온에서 5 분 동안 배양합니다. 세탁 단계를 두 번 반복합니다.
- 오가노이드를 세척하는 동안 VALAP 실란트(표 3)의 부분 표본(표 3)을 40-50°C에서 가열하여 액화합니다. 붓을 사용하여 현미경 슬라이드에 커버슬립 크기의 얇은 사각형 VALAP을 칠합니다. 22mm x 22mm No. 1.5 커버슬립을 사용합니다.
- 가위를 사용하여 P200 피펫 팁의 끝을 자릅니다. 오가노이드를 슬라이드의 VALAP 웰로 옮깁니다. 티슈 물티슈를 사용하여 PBS-T를 조심스럽게 닦아냅니다. 오가노이드가 마르지 않도록 하십시오.
- VALAP을 페이드 방지 장착 매체로 잘 채우십시오(표 3). ~22mm x 22mm 정사각형의 경우 100-150μL의 안티페이드가 필요합니다.
- 오가노이드는 군집할 수 있습니다. 필요한 경우 피펫 팁으로 안티페이드를 휘저어 오가노이드를 재분배합니다. 22mm x 22mm No. 1.5 커버슬립으로 장착하여 기포를 방지합니다. 가장자리에 VALAP의 얇은 층을 칠하여 커버슬립을 밀봉합니다.
참고: 도립 현미경의 경우 오가노이드를 35mm 유리 바닥 접시에 장착할 수도 있습니다.
8. 쥐 장 오가노이드의 Forskolin-induced 팽윤
- rIOM에서 통과한 후 3-5일 동안 오가노이드를 성장시킵니다. 동일한 영역을 쉽게 이미지화할 수 있도록 24웰 플레이트에서 오가노이드를 성장시키는 것이 좋습니다. forskolin (T0)의 추가의 앞에 심상을 붙잡으십시오.
- 포스콜린(표 3)을 오가노이드 배지에 직접 최종 농도 10μM까지 첨가합니다. 동일한 부피의 디메틸 설폭사이드(DMSO)를 대조군에 추가합니다.
- 15-30 분마다 일정한 간격으로 대조군 및 forskolin 대우한 우물을 심상하십시오. 이미징을 하지 않을 때는 오가노이드를 인큐베이터에 보관하거나 인큐베이션과 함께 제어된 이미징 시스템을 사용하십시오. 최대 붓기는 120분까지 관찰되어야 합니다.
- 표준 프로토콜에 따라 획득된 이미지로부터 상대적 팽창을 계산한다29.
결과
쥐 십이지장 및 제주날 오가노이드는 섹션 2에 설명된 프로토콜을 사용하여 생성되었습니다. 크립트 격리 단계에서 융모가 PBS에서 효율적으로 고갈되는 것이 매우 중요합니다. 너무 많은 융모가 EME에 크립트로 도금되면 전체 배양이 죽고 오가노이드 라인을 구축하지 못할 수 있습니다. 이 때문에 해부 범위에서 지하실을 격리하여 빌라 고갈을 시각적으로 확인할 수 있습니다. 그림 1 은 대표적인 빌라르 조각과 지하실을 보여줍니다(그림 1A). 융모에 비해 크립트의 크기가 훨씬 작다는 점에 유의하십시오(그림 1B). 도금 후 크립트는 다음 며칠 동안 스페로이드로 확장되고 4-7일째에 싹이 트고 분화하기 시작합니다(그림 2). 오가노이드가 광범위하게 싹을 틔우는 단계에 도달하면 통과해야 합니다. passaging 중에는 오가노이드 수가 확장될 수 있도록 crypt buds를 분리할 수 있을 만큼 오가노이드를 파괴하는 것이 중요합니다(그림 3B).
동결 후 오가노이드의 성공적인 회수는 동결 상태에 따라 크게 달라집니다. 증식성이 높은 미분화 상태의 오가노이드는 가장 높은 효율로 회복됩니다. 따라서 싹이 트고 분화되는 대신 구형이고 낭포성이 되도록 유도하는 것이 좋습니다. 이를 달성하기 위해, Wnt는 배지에서 Wnt 리간드 R-스폰딘의 양을 증가시킴으로써 과활성화될 수 있으며, 배지에 니코틴아미드를 포함시킴으로써, 이는 여러 배양 시스템에서 오가노이드 형성 및 세포 생존을 지원하는 것으로 나타났다30,31. 그림 3A는 해동 후 2일 만에 건강한 오가노이드 배양을 보여줍니다. 해동 중 배지에 BSA를 포함시키는 것은 쥐의 장 오가노이드보다 더 섬세한 것으로 입증된 쥐의 장 오가노이드 배양물의 생존에도 도움이 되었습니다.
3D 오가노이드 배양은 정상적인 장 구조의 일부를 재현하기 때문에 선호되는 경우가 많지만, 실시간 이미징, 형질 주입 및 렌티바이러스 형질 주입을 포함한 다른 접근 방식을 기술적으로 더 어렵게 만듭니다. 3D 오가노이드32 (그림 4)로부터 생성된 2D 단층을 사용하면 플라스미드를 더 효율적으로 도입할 수 있습니다. 3D 장 오가노이드는 전통적으로 일시적인 transfection에 내성이 있는 반면, EGFP를 암호화하는 plasmid는 지질 기반 transfection 방법을 사용하여 성공적으로 도입할 수 있습니다. PEI를 사용한 가장 비용 효율적인 접근법은 6.1단계(그림 5)에 요약되어 있지만, 전기천공법 및 상업적으로 이용 가능한 transfection 시약도 유사한 결과를 산출했습니다(데이터는 표시되지 않음). 향후 연구는 이러한 접근 방식이 CRISPR 구조를 단층에 도입하는 데 사용될 수 있는지 여부에 중점을 둘 것입니다.
형질주입 후 2D 단층에서 3D 오가노이드를 개질하여 크립트의 3D 아키텍처 구성 요소와 함께 통과 가능한 라인으로 유지할 수 있도록 하는 것이 중요했습니다. 흥미롭게도, EME에 도금된 2D 단층은 EME를 세포 상단에 다시 추가할 때 작은 스페로이드로 쉽게 재형성되는 반면, 콜라겐 I 기질은 3D 구조의 재구성에 충분하지 않았습니다(그림 6).
일시적인 형질주입은 많은 연구에서 유용하지만, 안정된 세포주를 형성하는 것이 더 유용한 경우가 많기 때문에 세포에 렌티바이러스를 도입해야 합니다. 쥐의 장내 오가노이드는 이전에 발표된 프로토콜을 수정하여 렌티바이러스에 감염되었습니다(그림 7). 프로토콜의 핵심 단계는 오가노이드를 작은 응집체 또는 세포 클러스터로 분할하는 것입니다. 배양이 효율적으로 파괴되지 않고 오가노이드가 손상되지 않은 상태로 유지되면 렌티바이러스 입자가 세포에 들어가지 않습니다. 감염 후 오가노이드는 회복되고 다시 자라야 합니다. 여기에 설명된 프로토콜은 선택 전에 세포의 10%-48%(평균: 19.4% ± 6.5%)까지 바이러스 입자를 흡수할 수 있도록 합니다.
오가노이드의 전체 마운트 염색은 EME 잔류물의 불완전한 제거 또는 불완전한 항체 침투로 인해 어려울 수 있습니다. 여기에 설명된 프로토콜은 오가노이드의 강력한 염색을 가능하게 합니다. 컨포칼 현미경에서 오가노이드를 시각화하는 것도 커버슬립에서 너무 멀리 떨어져 있는 경우 어려울 수 있습니다. VALAP을 사용하면 오가노이드가 커버슬립에 의해 찌그러지지 않고 커버슬립 가까이에 가라앉을 수 있도록 높이가 어느 정도 있는 웰이 생성되어 이미징이 용이합니다. F-actin을 표지하기 위한 정점 음이온 채널 낭성 섬유증 막횡단 전도도 조절제(CFTR) 및 팔로이딘에 대한 대표적인 염색은 그림 8에 나와 있습니다.
마지막으로, 오가노이드는 기능 분석에서 유용합니다. 낭포성 섬유증 환자의 환자 유래 오가노이드는 cAMP 작용제 포스콜린을 사용한 치료가 오가노이드팽창 29,33-37을 유발하는 강력한 CFTR 매개 유체 분비를 유도하기 때문에 CFTR 기능을 선별하는 데 사용되었습니다. 이 연구의 목표 중 하나는 생체 내 전임상 연구와 병행하여 사용할 수 있는 오가노이드 모델을 식별하고 개발하는 것이었습니다. 따라서 쥐의 장 오가노이드가 포스콜린에 의한 팽창을 겪는지 여부를 확인하는 것을 목표로 했습니다. 실제로, 포스콜린 처리 후 30분 이내에 쥐 오가노이드가 부풀어 올랐고, 120분 동안 최대 효과가 관찰되었습니다(그림 9).
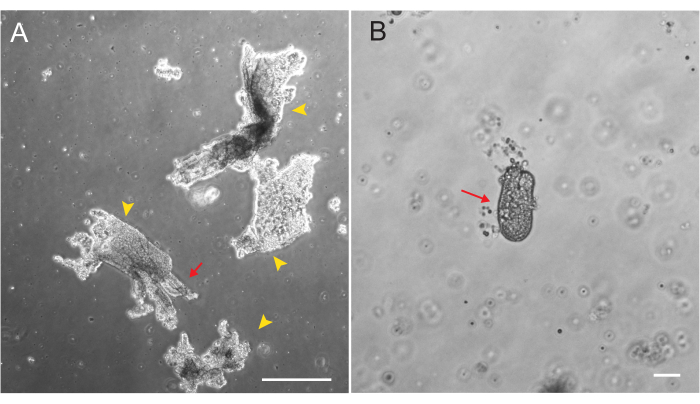
그림 1: 상피 분리 중 Villar 단편 및 크립트 . (A) crypt 분리 프로토콜 동안 EDTA 용액에서 villar fragments의 대표 이미지. 노란색 화살촉은 빌라 파편을 표시합니다. 빨간색 화살표는 빌라르 조각에 부착된 지하실을 나타냅니다. 상대적 크기의 차이에 유의하십시오. (B) 형태를 시각화할 수 있도록 단일 지하실(빨간색 화살표)의 고배율 이미지. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
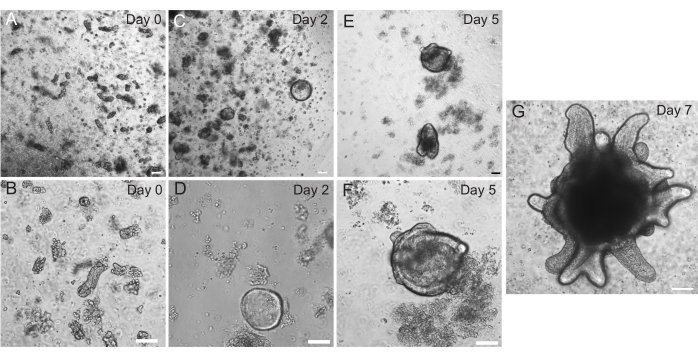
그림 2: 쥐의 장 오가노이드 진행. 쥐 jejunum 크립트는 분리 직후 EME에서 도금되었습니다 (A, B). 2일 이내에 크립트는 스페로이드(C,D)가 되었습니다. 5일째가 되자 크립트 새싹(E,F)이 시작되었고, 7일째(G)까지 정교해지고 성장했습니다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
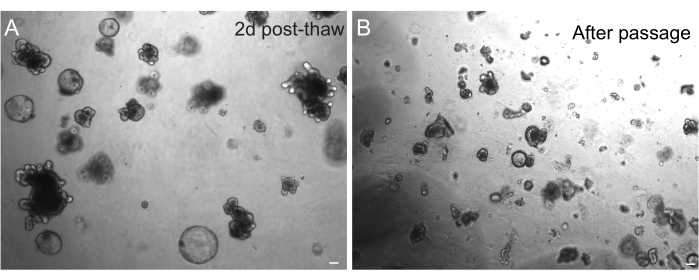
그림 3: 해동 및 통과 후의 오가노이드. (A) 쥐 제주날 오가노이드는 냉동 보존 후 설명된 프로토콜에 따라 해동되었습니다. 스페로이드와 싹이 난 오가노이드는 해동 후 2일 만에 존재합니다. (B) A에 묘사된 것과 동일한 오가노이드 라인은 설명된 프로토콜에 따라 통과한 직후입니다. A와 B의 구조 간의 상대적 크기 차이와 B의 단일 crypt와 유사한 도메인의 존재에 주목하십시오. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
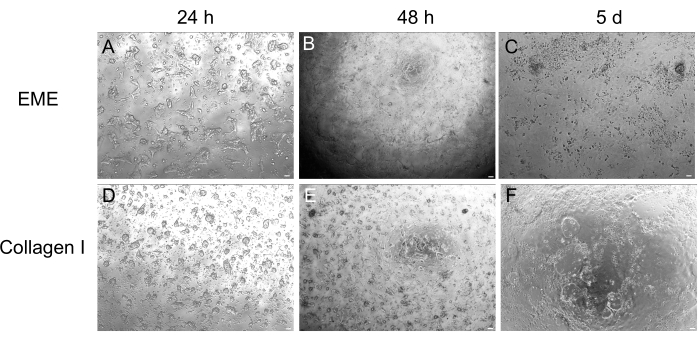
그림 4: 3D 오가노이드에서 2D 단층 형성. (A-C) EME에서 2D 단층 진행. (D-F) 콜라겐에 대한 2D 단층 진행 I. 5일째까지 각 조건은 ~80%의 밀도를 산출했습니다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
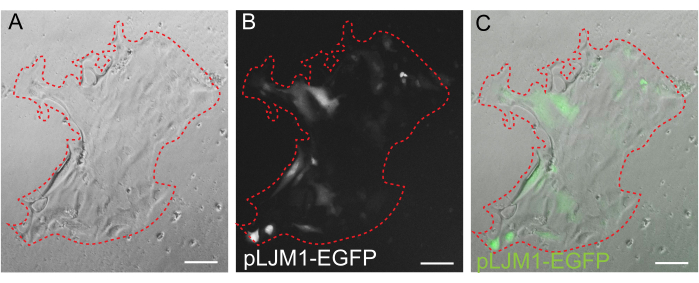
그림 5: 2D 단층의 일시적인 transfection. PEI를 사용하여 pLJM1-EGFP 플라스미드로 transfection된 EME에서 일시적으로 성장한 2D 단층의 대표 이미지. (A) 명시야, (B) 형광(GFP), (C) 오버레이. 빨간색 점선은 단층 경계를 표시합니다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
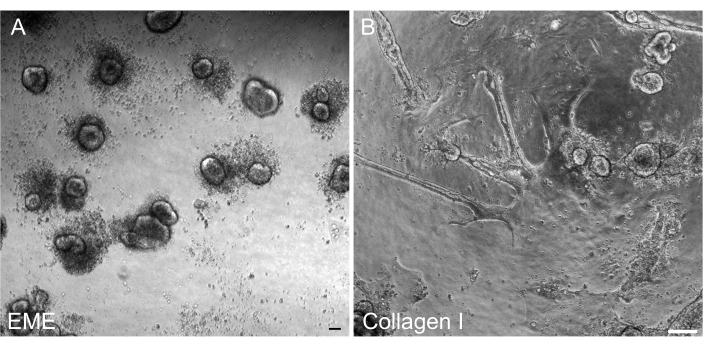
그림 6: EME의 2D 단층에서 3D 오가노이드의 변형. (A) EME에서 성장한 2D 단층으로부터 3D 오가노이드 형성. 단층의 정점 표면에 EME를 첨가한 후 5일 이내에 효율적으로 형성된 오가노이드. 작은 3D 스페로이드를 둘러싼 죽은 세포가 풍부하다는 것을 주목하십시오. (B) 콜라겐 I에서 성장한 2D 단층의 정점 표면에 콜라겐 I을 첨가한 후 5일 후 2D 단층의 지속성 스케일 바: 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
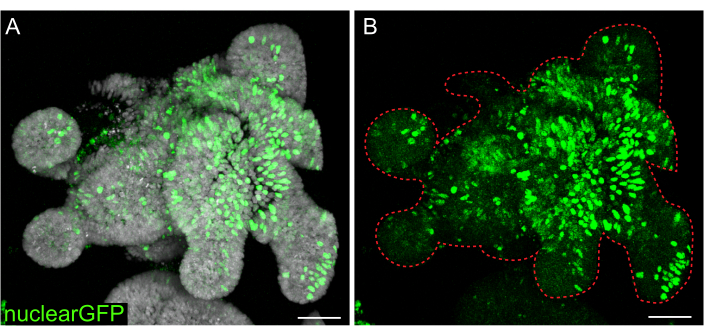
그림 7: 3D 오가노이드의 렌티바이러스 감염. 쥐 jejunum 오가노이드는 설명된 프로토콜을 사용하여 핵 GFP 렌티바이러스 입자에 감염되었습니다. 5일 동안 회복 및 성장한 후 오가노이드를 고정하고 DAPI로 대조염색했습니다. (A) DAPI: 회색; nuclearGFP: 녹색. (B) 핵GFP : 녹색. 빨간색 점선은 오가노이드 경계를 표시합니다. 스케일 바: 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
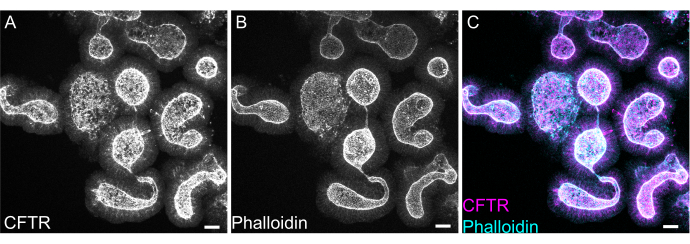
그림 8: 쥐 장 오가노이드의 전체 마운트 면역형광. (A) CFTR, (B) 팔로이딘 및 (C) 쥐 제주날 오가노이드의 병합된 전체 마운트 면역형광. 오가노이드에서 CFTR 염색의 정점 농축에 유의하십시오(A의 경우 회색, C의 경우 자홍색). Phalloidin은 F-actin을 표시하고 정점 브러시 테두리 (B는 회색, C는 청록색)를 눈에 띄게 표시합니다. 스케일 바: 25 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
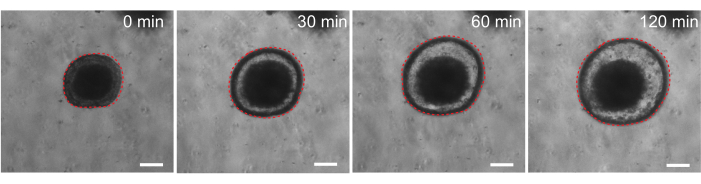
그림 9: 쥐의 장 오가노이드는 포스콜린 자극에 따라 팽창합니다. cAMP 작용제 포스콜린을 첨가한 후 쥐 장 오가노이드 팽창의 대표 시간 경과. 0 분 시간은 10 μM forskolin의 추가의 직전에 시간 점을 나타냅니다. 이미지는 30분 간격으로 동일한 오가노이드를 보여줍니다. 최대 팽윤은 forskolin 추가 후에 120 분에 관찰되었습니다. 빨간색 점선은 오가노이드 경계의 윤곽을 나타냅니다. 오가노이드 내강 중간에 있는 어두운 물질은 죽은 세포로 구성되어 있습니다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: AdDMEM+ 레시피. 여기에 표시된 방법 전체에서 기본 미디어인 표준 AdDMEM+ 미디어를 만들기 위한 구성 요소. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 쥐의 장 오가노이드 배지(rIOM) 레시피. 재조합 단백질의 용매 및 보관 조건을 포함한 표준 쥐 장 오가노이드 배지의 자세한 레시피. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: 솔루션. 프로토콜 전체에서 사용되는 다른 솔루션을 만들기 위한 레시피 및 지침. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 4. 2D 단층 배양을 위한 쥐 장 오가노이드 배지(rIOM2D). 단층의 2D 성장에 최적화된 오가노이드 배양 배지의 수정된 레시피. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
쥐 장 오가노이드 모델의 개발은 생체 내 장기에서 발견되는 중요한 기능적 특성을 보존하고 전임상 테스트, 약물 스크리닝 및 기능 분석을 위한 유망한 도구입니다. 이 in vitro 모델은 in vivo 전임상 위장병학 연구와 병행하여 사용될 수 있으며, 쥐는 더 큰 장 크기, 인간과 공유되는 생리학적 측면, 그리고 어떤 경우에는 더 나은 질병 모델이기 때문에 종종 선호되는 모델이다38. 여기에서는 쥐 장 크립트의 분리, 쥐 장 오가노이드의 생성 및 장기 배양, 기능적 포스콜린 팽창 분석, 전체 마운트 면역형광, 2D 단층 배양 및 렌티바이러스 유전자 조작을 포함한 다운스트림 응용 분야를 위한 강력한 단계별 프로토콜이 간략하게 설명되어 있습니다. 쥐 장 오가노이드는 마우스 모델의 병태생리학이 부적절하고 마우스 장 오가노이드에 비해 인간 장 생리학에 더 나은 모델을 제공할 수 있는 많은 질병 맥락과 관련이 있을 수 있습니다.
통과 및 확장이 가능한 수명이 긴 오가노이드 배양을 확립하려면 장 상피 증식을 유지하는 데 필요한 주요 성장 인자를 식별하는 것이 필수적입니다. 마우스 오가노이드는 EGF, R-spondin 및 Noggin의 간단한 칵테일에서 가장 자주 성장하지만 Noggin은 장내 오가노이드 배양에 필요하지 않은 것으로 보고되었습니다39. 조절된 배지는 재조합 성장 인자를 대체할 수 있으며, 가장 일반적으로 사용되는 세포주는 Wnt3a, Rspondin-3 및 Noggin39, L-Wnt3a 및 HA-Rspondin1-Fc 293T 세포(40)를 분비하는 L-WRN입니다. L-WRN 조절 배지는 마우스 장39 오가노이드 성장뿐만 아니라 개, 고양이, 닭, 말, 소, 양, 돼지를 포함한 여러 농장 동물 및 반려동물의 장 오가노이드 성장을 지원하기에 충분하다12. 그러나 인간의 장내 오가노이드는 확장 성장 단계(즉, 작은 스페로이드에서 큰 스페로이드로의 진행)와 분화 단계(즉, 분화된 세포 유형의 생성 및 성숙)에 대해 뚜렷한 배지 제형이 필요하기 때문에 성장 인자 요구 사항이 매우 다릅니다10. 쥐 장 오가노이드의 배지 요구 사항은 인간 장 오가노이드에 대한 확장 성장 배지의 요구 사항과 매우 유사하지만, 특히 쥐 오가노이드는 이 배지 환경에서 성장과 분화가 모두 가능하여 배양 요구 사항을 상당히 단순화합니다. 우리의 초기 시도는 L-WRN 조건 배지에서 쥐의 장 오가노이드를 확립하고 성장시키는 데 중점을 두었지만 장기적인 배양은 미약했고 쥐의 장 오가노이드 라인은 견고성 부족으로 어려움을 겪었습니다(데이터 표시 안 됨). 이는 L-WRN 세포주가 R-spondin 3을 분비하도록 조작된 반면, 여기서 권장하는 293T-Rspo1 세포주는 R-spondin 1을 분비하도록 설계되었기 때문일 수 있습니다. 쥐와 인간 오가노이드는 R-spondin 1을 선호할 수 있으며, 이는 잠재적으로 L-WRN 조건 배지에서 쥐 오가노이드 라인의 실패를 설명할 수 있습니다.
in vivo 설정을 가장 밀접하게 요약하려면 줄기 세포의 생존, 유지 및 증식을 허용하고 세포 회전율과 개별 세포 유형으로의 동시 분화 이벤트를 유지할 수 있는 오가노이드 배양 조건을 개발하는 것이 중요합니다. 따라서 재조합 단백질 및/또는 조건화된 배지 내 단백질의 농도는 이러한 완벽한 균형을 이루기 위해 엄격하게 적정되고 제어되어야 합니다. 특히, 최적의 Wnt 수치는 장내 오가노이드 배양물의 손실을 방지하는 데 필수적입니다. 조건화된 배지에 Wnt가 너무 적으면 성장을 지원할 수 없어 줄기 세포가 손실되고 오가노이드가 사멸됩니다. Wnt의 과활성화는 오가노이드를 낭포성 및 미분화 상태로 만든다10. 여기에 상세히 설명되지는 않았지만, Topflash 세포주(41)와 같은 Wnt 리포터 루시페라아제 분석을 사용하여 L-Wnt3a 및 293T-Rspo1 컨디셔닝된 배지의 각 배치를 테스트하는 것이 강력히 권장된다. 이전 연구에서는 L-Wnt3a 매체의 최적 배치가 1% L-Wnt3a 10에 비해 12.5%에서15배 신호 증가, 50%에서 300배 신호 증가를 초래해야 한다고 설명했습니다. 쥐 오가노이드는 배양 요구 사항, 특히 Wnt 활성화 수준에 마우스 오가노이드보다 더 민감하기 때문에 이러한 추가 품질 관리 단계는 쥐 오가노이드 배양의 견고성과 신뢰성을 촉진하는 데 큰 도움이 됩니다. Noggin 컨디셔닝 미디어에서 Bmp 활동 및 상대 Noggin 농도를 테스트하는 데 유사한 리포터 라인을 사용할 수 없기 때문에 Noggin 수준을 정확하게 제어하기 위해 가능한 경우 재조합 Noggin을 사용하는 것이 좋습니다. 마우스 장 오가노이드는 Noggin39가 없는 경우에도 성장 및 유지될 수 있지만 쥐 장 오가노이드 배양에는 시도되지 않았습니다.
세포 배양 요구 사항 외에도 쥐 오가노이드 라인의 성공적인 초기 확립은 크립트 분리 중 분화된 융모의 효율적인 고갈에 크게 좌우됩니다. 높은 수준의 빌라르 오염은 죽어가는 세포의 신호 또는 필수 요소의 격리로 인해 크립트 사멸을 유발합니다. 이러한 분화된 융모를 상피 제제에서 정확하고 일관되게 고갈시키려면 입체경을 사용하여 상피 분리를 수행하는 것이 좋습니다. 방출되는 상피를 육안으로 검사하면 PBS를 폐기하고 교체해야 하는 명확한 단서를 얻을 수 있습니다(그림 1). 융모가 충분히 고갈될 때까지 크립트를 수집해서는 안 됩니다. Villar 세포는 말단 분화되어 배양에서 오가노이드를 생성할 수 없습니다. 또한 쥐의 장 오가노이드를 통과시키고 다운스트림 응용 분야에 사용하려면 섬세한 관리가 필요합니다. 해리 시약에서 더 오랜 시간(10분) 동안 배양하면 상당한 세포 사멸과 오가노이드 라인의 손실이 발생합니다.
여기에서는 쥐 오가노이드에서 장 단층을 생성하기 위한 간단하고 빠른 프로토콜에 대해 설명합니다. EME와 콜라겐 I 기질은 상피에 서로 다른 영향을 미치며, 이는 연구 목적에 따라 활용될 수 있습니다. EME는 단일 셀의 빠르고 효율적인 접착과 셀 돌출부의 형성을 가능하게 합니다. 대조적으로, 표면을 콜라겐 I로 코팅하면 이러한 과정이 지연됩니다. 단층이 약 80%의 밀도에 도달하면 EME에서 성장한 세포가 다시 3D 오가노이드 구조를 생성하기 시작합니다. 그러나 지속적인 성장을 위한 충분한 물리적, 화학적 지원이 부족합니다. 이러한 오가노이드 상태로의 회귀는 EME의 단층을 50%-80%의 밀도로 유지함으로써 방지할 수 있습니다. 단층의 정점 표면에 희석된 EME를 추가하면 de novo 오가노이드의 빠른 회복 및 형성이 촉진되어 수렴 영역을 보다 빠르고 쉽게 생성할 수 있습니다. 콜라겐 I 표면에서 세포는 균일한 단층을 형성하고 작은 클러스터를 생성할 수 있습니다. 그러나 단층 위에 콜라겐 I을 추가하는 것만으로는 오가노이드 형성을 유도하기에 충분하지 않습니다. EME는 초기 오가노이드가 극복하기 위해 더 강한 기계적 저항이 있기 때문에 단층 표면에 추가할 때 희석해야 합니다. 그러나 이 희석된 EME는 대형 오가노이드의 강력한 형성을 허용하지 않습니다. 표면에서 자연적으로 분리되는 de novo 생성 쥐 오가노이드는 즉시 제거하고 희석되지 않은 EME로 옮겨 구조적 지지와 성장을 복원해야 합니다. 이 단계에서 오가노이드의 크기가 작기 때문에 강력한 성장이 확립될 때까지 오가노이드의 통과는 권장되지 않습니다. EME가 오가노이드의 재구성을 지원할 수 있는 이유에 대한 근본적인 생물학적 중요성은 있지만 콜라겐 I이 이를 수행할 수 있는지 여부는 명확하지 않습니다. 그러나 3D 콜라겐에서 성장한 세포는 싹이 트인 오가노이드42,43을 형성하거나 장기적인 유지를 지원할 수 없다는 보고가 있습니다. 상업적으로 이용 가능한 EME 제품은 세포외 단백질, 주로 라미닌 및 콜라겐 IV44의 이질적인 혼합물입니다. 그러므로, 단백질의 뚜렷한 구성과 상피 세포가 다른 세포 복합체를 사용하여 세포외 기질과 관여할 수 있는 능력은 EME에서 리모델링을 허용할 수 있지만 콜라겐 I에서는 허용하지 않을 수 있습니다. 콜라겐 I 유래 단층을 EME에 넣어 오가노이드 형성 및 성장을 지원할 수 있는지 여부는 테스트되지 않았습니다.
쥐 장 오가노이드 모델의 유전자 조작에 대해 설명하고, 3D 오가노이드의 렌티바이러스 transduction 및 2D 단층의 transient transfection에 대한 프로토콜을 간략하게 설명합니다. 렌티바이러스 오가노이드 transduction의 낮은 효율을 극복하기 위해 2D 단층의 transfection을 위한 프로토콜이 개발되었습니다. 단층의 평평한 형태와 노출된 정점 도메인은 바이러스 및 DNA 함유 복합체에 더 쉽게 접근할 수 있도록 합니다. pLJM1-EGFP 벡터를 이용한 EGFP 리포터의 발현은 이 기법의 검증을 위해 사용되었다. GFP 리포터 발현은 24시간 후에 관찰되었고, 단층에서 5-6일 동안 유지되었다. 단층의 렌티바이러스 형질도입에 초점을 맞춘 향후 연구는 3D 오가노이드 형질도입보다 효율성이 높을 것으로 보입니다. 위의 프로토콜을 사용하면 감염된 2D 단층에서 3D 오가노이드를 개질하여 안정적인 라인을 쉽게 생성할 수 있습니다. 쥐의 장내 오가노이드 계통은 여러 통로에서 안정적으로 유지되고, 동결 보존되고, 성공적으로 해동되고, 렌티바이러스 형질도입을 사용하여 유전자 변형되어 1년 이상 성공적으로 유지될 수 있으며, 이를 통해 인간과의 생리학적 관련성을 유지하는 접근 가능하고 다루기 쉬운 체외 장 오가노이드 모델의 필요성을 해결할 수 있습니다.
공개
없음.
감사의 말
사려 깊은 토론을 해주신 Sumigray 및 Ameen 연구소 구성원 여러분께 감사드립니다. 이 연구는 찰스 H. 후드 재단(Charles H. Hood Foundation)의 아동 건강 보조금(Child Health Grant)과 낭포성 섬유증 재단(Cystic Fibrosis Foundation)의 보조금(004741P222)과 미국 국립보건원(National Institutes of Health)의 국립 당뇨병 및 소화기 및 신장 질환 연구소(National Institute of Diabetes and Digestive and Kidney Diseases)의 지원을 받았습니다(수상 번호 2R01DK077065-12).
자료
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes/Thermo Fisher | D1306 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
참고문헌
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유