Method Article
Generación y manipulación de organoides intestinales de rata
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo para generar organoides intestinales de ratas y usarlos en varias aplicaciones posteriores. Las ratas suelen ser un modelo preclínico preferido, y el robusto sistema de organoides intestinales satisface la necesidad de un sistema in vitro para acompañar los estudios in vivo .
Resumen
Cuando se utilizan organoides para evaluar la fisiología y las decisiones sobre el destino celular, es importante utilizar un modelo que recapitule estrechamente los contextos in vivo . En consecuencia, los organoides derivados del paciente se utilizan para el modelado de enfermedades, el descubrimiento de fármacos y la detección de tratamientos personalizados. Los organoides intestinales de ratón se utilizan comúnmente para comprender aspectos tanto de la función/fisiología intestinal como de la dinámica/decisión de destino de las células madre. Sin embargo, en muchos contextos de enfermedades, a menudo se prefieren las ratas a los ratones como modelo debido a su mayor similitud fisiológica con los humanos en términos de fisiopatología de la enfermedad. El modelo de rata se ha visto limitado por la falta de herramientas genéticas disponibles in vivo, y los organoides intestinales de rata han demostrado ser frágiles y difíciles de cultivar a largo plazo. Aquí, nos basamos en protocolos publicados anteriormente para generar organoides intestinales de ratas de forma robusta a partir del duodeno y el yeyuno. Proporcionamos una visión general de varias aplicaciones posteriores que utilizan organoides intestinales de ratas, incluidos los ensayos de hinchazón funcional, la tinción de montaje completo, la generación de monocapas enteroides, 2D y la transducción lentiviral. El modelo de organoide de rata proporciona una solución práctica a la necesidad del campo de un modelo in vitro que conserve la relevancia fisiológica para los seres humanos, que pueda manipularse genéticamente rápidamente y que se obtenga fácilmente sin las barreras involucradas en la obtención de organoides intestinales humanos.
Introducción
La arquitectura epitelial del intestino delgado humano y su composición celular son complejas, lo que refleja sus funciones fisiológicas. La función principal del intestino delgado es absorber los nutrientes de los alimentos que pasan a través de su lumen1. Para maximizar esta función, la superficie intestinal se organiza en protuberancias en forma de dedos llamadas vellosidades, que aumentan el área de superficie de absorción, e invaginaciones en forma de copa llamadas criptas, que albergan y aíslan las células madre. Dentro del epitelio, se generan varios tipos de células absorbentes y secretoras especializadas para realizar distintas funciones1. Debido a esta complejidad, ha sido difícil modelar tejidos como el intestino en líneas celulares inmortalizadas transformadas de alto paso. Sin embargo, el estudio de las células madre, especialmente las células madre adultas y sus mecanismos de diferenciación, ha permitido el desarrollo de cultivos de organoides intestinales en 3D. El uso de modelos organoides ha transformado el campo, en parte debido a su recapitulación de algunos componentes arquitectónicos y la heterogeneidad del tipo de célula que se encuentra en el intestino intacto. Los organoides intestinales pueden ser cultivados in vitro a largo plazo debido al mantenimiento de la población activa de células madre2.
Los organoides intestinales se han convertido rápidamente en un modelo adaptable para estudiar la biología de las células madre, la fisiología celular, las enfermedades genéticas y la nutrición3,4, así como en una herramienta para desarrollar nuevos métodos de administración de fármacos5. Además, los organoides derivados de pacientes se están utilizando para el modelado de enfermedades, el descubrimiento de fármacos y la detección de tratamientos personalizados, entre otros 6,7,8,9. Sin embargo, los organoides intestinales humanos aún presentan desafíos. La disponibilidad de tejidos, los requisitos para la aprobación de la Junta de Revisión Institucional y las cuestiones éticas limitan el uso generalizado de muestras humanas. Además, los organoides intestinales humanos generados a partir de criptas intestinales requieren dos condiciones de cultivo distintas para el mantenimiento de células madre indiferenciadas o para inducir la diferenciación de tipos celulares maduros10. Esto contrasta con el in vivo, donde las células madre y los tipos de células maduras diferenciadas están presentes simultáneamente y se generan/mantienen continuamente1. Por otro lado, los organoides intestinales de ratón, que se cultivan en un cóctel menos complejo de factores de crecimiento, no requieren este cambio en la composición del medio y pueden mantener las células madre y las células diferenciadas en el mismo contexto del medio 2,11. Sin embargo, las diferencias clave en el intestino del ratón en comparación con los humanos pueden hacer que los organoides del ratón sean un modelo subóptimo en muchos casos. En general, muchos organoides intestinales de mamíferos más grandes, incluidos caballos, cerdos, ovejas, vacas, perros y gatos, se han generado con éxito en condiciones de cultivo más estrechamente alineadas con los organoides intestinales de ratón que las condiciones de cultivo de organoides intestinales humanos12. Las diferencias en las condiciones del factor de crecimiento entre los organoides de ratón y humanos probablemente reflejan diferencias en la composición del nicho de células madre y diferentes requisitos para la supervivencia, proliferación y mantenimiento de las células madre. Por lo tanto, existe la necesidad de un sistema organoide modelo de fácil acceso que 1) se parezca mucho a la composición de las células intestinales humanas, 2) contenga células madre con requisitos de factor de crecimiento como los de los organoides intestinales humanos, y 3) sea capaz de mantener continuamente compartimentos indiferenciados y diferenciados. Idealmente, el sistema sería a partir de un modelo animal preclínico de uso común, de modo que los experimentos in vivo e in vitro puedan correlacionarse y usarse en tándem.
Las ratas son un modelo preclínico comúnmente utilizado para estudios de fisiología intestinal y farmacología debido a su fisiología intestinal y bioquímica muy similares a las humanas13, particularmente en lo que respecta a la permeabilidad intestinal14. Su tamaño relativamente más grande en comparación con los ratones los hace más susceptibles a los procedimientos quirúrgicos. Si bien a veces se utilizan modelos de animales grandes, incluidos los cerdos, las ratas son un modelo más asequible, requieren menos espacio para la cría y tienen cepas estándar fácilmente disponibles comercialmente15. Un inconveniente del uso de modelos de ratas es que el conjunto de herramientas genéticas para estudios in vivo no está bien desarrollado en comparación con los ratones, y la generación de nuevas líneas de ratas, incluidos knockouts, knock-ins y transgénicos, a menudo tiene un costo prohibitivo. El desarrollo y la optimización de un modelo robusto de organoide intestinal de rata permitiría la manipulación genética, los tratamientos farmacológicos y los estudios de mayor rendimiento en un modelo accesible que conserva una relevancia fisiológica clave para los seres humanos. Sin embargo, las ventajas de un modelo de organoide de roedores frente a otro dependen en gran medida del proceso o gen particular que se esté estudiando; Ciertos genes que se encuentran en los seres humanos pueden ser pseudogenes en ratones, pero no en ratas16,17. Además, los subtipos celulares específicos de la especie están siendo revelados cada vez más por RNAseq18,19,20 de una sola célula. Por último, los modelos de enfermedades intestinales en ratas y ratones a menudo muestran variaciones considerables en los fenotipos21,22, de modo que el modelo que recapitula más fielmente los síntomas y el proceso de la enfermedad observado en los seres humanos debe seleccionarse para el trabajo posterior. La generación de un modelo de organoide intestinal de rata proporciona flexibilidad y opciones adicionales para los investigadores a la hora de seleccionar el sistema modelo más apropiado para sus circunstancias. Aquí, se amplían los protocolos existentes23,24 para la generación de organoides intestinales de rata y se esboza un protocolo para la generación y mantenimiento de organoides intestinales de rata a partir del duodeno o yeyuno. Además, se describen varias aplicaciones posteriores, como la infección lentiviral, la tinción de montaje completo y los ensayos de hinchazón por forskolina.
Protocolo
NOTA: Todos los cultivos celulares deben manipularse utilizando una técnica aséptica adecuada en una campana de cultivo de tejidos. Todo el trabajo con animales en este estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de Yale.
1. Preparación de reactivos de cultivo celular
- Prepare los medios acondicionados con R-espondina 1 siguiendo las instrucciones del fabricante. Prepare los medios acondicionados Wnt3a siguiendo las instrucciones del fabricante. Prepare AdDMEM+ como se describe en la Tabla 1.
- Vuelva a suspender la gastrina en dH2O estéril para preparar un caldo de 100 μM. Alícuota y almacenar a -80 °C. Resuspender la N-acetilcisteína en agua estéril para preparar un caldo de 100 mM. Alícuota y almacenar a -20 °C hasta por 1 mes.
- Resuspender Noggin humano recombinante en solución salina tamponada con fosfato (PBS) + 0,1% de albúmina sérica bovina (BSA) para preparar un caldo de 250 μg/mL. Alícuota y almacenar a -80 °C. Resuspender el factor de crecimiento epidérmico (EGF) recombinante de ratón en PBS + 0,1% BSA para preparar un stock de 100 μg/mL. Alícuota y almacenar a -80 °C.
- Diluir IGF-1 humano recombinante en PBS + 0,1% BSA para preparar un stock de 100 μg/mL. Alícuota y almacenar a -80 °C. Resuspender FGF-2 humano recombinante en Tris de 5 mM, pH 7,6, para preparar un stock de 100 μg/mL. Alícuota y almacenar a -80 °C.
NOTA: Para todos los factores de crecimiento, utilice una dilución intermedia en PBS + 0,1% BSA a 100 veces la concentración final en el medio de cultivo. Conservar a -20 °C.
2. Establecimiento de organoides del intestino delgado de rata
NOTA: Este protocolo fue modificado a partir de dos protocolos previamente publicados para organoides intestinales de rata23,24.
- Prepare el medio organoide intestinal de rata (rIOM) según la Tabla 2 y fije un baño de agua a 37 °C. Este medio completo es estable durante 5 días a 4 °C.
- Prepare 10 mL de ácido etilendiaminotetraacético (EDTA) 3 mM en PBS en un tubo cónico de 15 mL y manténgalo en hielo. Descongelar 250 μL de extracto de matriz extracelular (EME) en hielo.
- Ayuna a una rata durante la noche con acceso al agua ad libitum. Sacrificar a la rata de acuerdo con el protocolo aprobado por la IACUC. En este protocolo, ratas Sprague Dawley macho adultas (con un peso de ~200 g) fueron sacrificadas mediante inhalación de CO2 (Tabla de Materiales). Se utilizó la luxación cervical como método secundario de eutanasia.
- Use pinzas estériles esterilizadas en autoclave y tijeras de disección para la disección. Coloque la rata sacrificada sobre la superficie de disección con el lado ventral hacia arriba. Pellizque la capa de la piel con fórceps; Los siguientes cortes deben hacerse a nivel de la superficie, por lo que solo atraviesan esta capa de la piel y no lo suficientemente profundos como para dañar los órganos internos.
- Para abrir la cavidad abdominal, con unas tijeras de disección grandes y afiladas, corte a través de la capa de piel en un corte grande, longitudinal y a nivel de la superficie en el centro del abdomen. A continuación, a partir de ese corte, haz dos cortes horizontales más cortos, uno a cada lado. Use fórceps para pelar la piel y exponer la cavidad abdominal. Cortar a través de la membrana peritoneal para exponer completamente los órganos internos en la cavidad abdominal con fácil acceso al intestino.
- Con ayuda de unas tijeras y unas pinzas, localiza el estómago e identifica el duodeno aproximadamente 2-3 cm distal a él, que aparece como un segmento amarillento. El yeyuno proximal se encuentra aproximadamente a 4-5 cm distal del ligamento de Treitz, que sirve como punto de referencia entre el duodeno y el yeyuno.
- Coloque el fragmento intestinal aislado en una placa de Petri de 10 cm. Limpie el segmento intestinal deseado del mesenterio tanto como sea posible. Enjuague con 10 ml de PBS helado hasta que se elimine el contenido luminal. Sobre una toalla de papel, corte el segmento intestinal en trozos de ~2 cm de largo. Abra cada pieza intestinal longitudinalmente para exponer el epitelio.
- Con un portaobjetos de microscopio de vidrio, raspe la superficie luminal expuesta para eliminar las vellosidades. Coloque los trozos intestinales en la solución de EDTA preparada sobre hielo. Gire a 4 °C durante 30 minutos en un revólver de tubo ajustado a 10 rpm.
- En el microscopio de disección, vierta el contenido del tubo cónico en una placa de Petri de 10 cm. Agregue ~ 5 ml adicionales de PBS helado.
- Con unas pinzas finas, sostenga un segmento intestinal y agite vigorosamente. Será posible ver la liberación de epitelio en el PBS. Al principio, el PBS contendrá principalmente vellosidades.
- Continúa agitando. Deseche periódicamente las vellosidades que contengan PBS y agregue 10 ml de PBS fresco helado a los fragmentos intestinales. Continúe agitando los fragmentos y repita este paso de lavado hasta que las vellosidades ya no se liberen en el PBS, sino que el PBS contenga principalmente criptas. No exceda los 15 minutos para el aislamiento de la cripta, de modo que la viabilidad celular no se vea comprometida.
- Deseche los fragmentos intestinales restantes. Enriquezca el PBS restante en la placa de Petri para las criptas intestinales. En una campana de cultivo de tejidos, recoja las criptas que contienen PBS y filtre a través de un filtro celular de 70 μm (Tabla de materiales).
- Centrifugar a 250 x g durante 5 min. Retirar el sobrenadante y volver a suspender el pellet en 5 mL de AdDMEM+. Centrifugar de nuevo a 250 x g durante 5 min.
NOTA: Se recomienda utilizar una centrífuga con rotor de cangilón oscilante. - Retire el sobrenadante, dejando ~50 μL de medio con el gránulo. Vuelva a suspender el gránulo en el medio restante y agréguelo a la alícuota del EME en hielo. Pipetea suavemente hacia arriba y hacia abajo para suspender las criptas de manera uniforme en todo el EME. Evite introducir burbujas.
- Colocar 50 μL de domos EME en una placa de cultivo de tejidos de 35 mm e incubar durante 20 minutos en una incubadora de cultivo de tejidos a 37 °C y 5% de CO2 .
- Agregue 2 mL de rIOM (Tabla 2) que contenga 10 μM Y27632 y 10 μM CHIR99021 (Tabla 3). Después de la aprobación, Y27632 y CHIR99021 se pueden descontinuar.
- Cambie el rIOM cada 2-3 días. Paso según sea necesario, generalmente entre 3 y 7 días, dependiendo del número inicial de organoides, el tamaño y la tasa de crecimiento.
3. Organoides intestinales de ratas de paso
- Descongelar una alícuota de 250 μL de EME en hielo y precalentar el rIOM a 37 °C.
- Aspirar el medio de una placa de 35 mm que contenga organoides y añadir 1 ml de reactivo de disociación para liberar inmediatamente los organoides de las cúpulas EME.
- Transfiera inmediatamente el reactivo de disociación con organoides fragmentados a un tubo cónico de 15 mL. Lavar la placa de cultivo con 2 mL de AdDMEM+ y añadir al tubo cónico de 15 mL que contiene organoides fragmentados.
- Con una pipeta Pasteur de vidrio, pipetear suavemente hacia arriba y hacia abajo 15-20 veces para fragmentar los organoides. Centrifugar a 350 x g durante 2 min.
- Agregue ~ 50 μL de solución desde el fondo del tubo cónico en el EME. Pipetea suavemente hacia arriba y hacia abajo para mezclar. Evita hacer burbujas.
- Colocar 50 μL de cúpulas EME en una placa de 35 mm e incubar durante 20 min en una incubadora de cultivo de tejidos a 37 °C y 5% de CO2 .
- Agregue 2 ml de rIOM con 10 μM Y27632 y 10 μM CHIR99021. Cambie el medio de cultivo cada 2-3 días. Al cambiar de soporte, se pueden omitir Y27632 y CHIR99021.
4. Criopreservación y descongelación de organoides intestinales de ratas
- Organoides intestinales criopreservadores de ratas
NOTA: El protocolo de criopreservación fue modificado a partir de un protocolo anterior para organoides humanos y de ratón25. Antes de la congelación, los organoides deben tener al menos dos pasajes en cultivo primario. Es aconsejable cultivar organoides hasta el punto de esferoides grandes u organoides ligeramente brotados antes de la criopreservación, ya que esto dará como resultado un mayor rendimiento de organoides viables después de la descongelación. Esto puede lograrse aumentando el medio acondicionado con R-espondina al 15% y/o añadiendo 10 mM de nicotinamida (Tabla 3) al cultivo de organoides.- Con un microscopio, cuente el número de organoides en el plato de 35 mm. Etiquete los crioviales de manera que se alícute 200 organoides en cada criovial.
- Retire el rIOM del plato de 35 mm. Reemplácelo con 2 ml de PBS de grado de cultivo de tejidos fríos.
- Con una punta P1000, suelte las cúpulas EME desde el fondo de la placa de cultivo en el PBS pipeteando hacia arriba y hacia abajo. Continúe pipeteando hacia arriba y hacia abajo ~ 20 veces para romper el EME y liberar los organoides. Recoja los organoides y el PBS en un tubo cónico de 15 ml.
- Agregue 2 ml de PBS frío a la placa de cultivo y pipetee hacia arriba y hacia abajo para liberar los organoides restantes en el PBS. Transfiera el PBS al tubo cónico de 15 ml.
- Granular los organoides centrifugando a 290 x g durante 5 min. Retire y deseche el sobrenadante sin alterar el gránulo del organoide.
- Lave el gránulo resuspendiéndolo suavemente en 5 ml de AdDMEM+ frío. Centrifugar a 200 x g durante 4 min. Retire y deseche con cuidado el sobrenadante.
- Resuspender el gránulo de organoide en 1 ml de medio de congelación en frío por cada 200 organoides. Alícuota 1 mL de organoides en medio de congelación por criovial marcado. Coloque los crioviales en un recipiente para congelar.
- Almacene los organoides en un recipiente de congelación a -80 °C durante 24 h, luego transfiera los crioviales a nitrógeno líquido para su almacenamiento a largo plazo.
- Descongelación de organoides intestinales de ratas
NOTA: Este protocolo fue modificado a partir de un protocolo anterior para la descongelación de organoides intestinales humanos y de ratón26.- Descongelar una alícuota de 250 μL de EME en hielo. Prepare rIOM suplementado con medios acondicionados con R-espondina al 15%, 10 μM Y27632 y 10 μM CHIR99021. Cálido a 37 °C.
- Agregue 2 mL de medio de descongelación (Tabla 3) a un tubo cónico de 15 mL a temperatura ambiente.
- Extraer y descongelar un vial de organoides a partir de nitrógeno líquido colocando el vial en un baño de agua a 37 °C hasta que el vial esté casi completamente descongelado.
- Agregue 1 ml de medio de descongelación al vial y transfiera todo el contenido al tubo cónico que contiene el medio de descongelación. Lave el vial dos veces con 1 ml de medio descongelante y transfiéralo al tubo cónico.
- Centrifugar a 200 x g durante 5 min. Aspirar el medio, dejando ~50 μL de medio con los organoides. Transfiera el medio que contiene organoides a 250 μL de EME.
- Distribuya uniformemente los organoides a través del EME pipeteando hacia arriba y hacia abajo, evitando burbujas. Pipetear seis cúpulas de 50 μL en una placa de cultivo de tejidos de 35 mm.
- Incubar en la incubadora de cultivo de tejidos durante 15-20 minutos para permitir que el EME se polimerice. Agregue 2 ml del rIOM preparado al plato.
- Después de 2 días, reemplace el medio con rIOM. Se puede suspender el uso de Y27632 y CHIR99021. El crecimiento de los organoides puede ser lento en el primer paso después de la descongelación. Se recomienda pasar los organoides dos veces después de descongelarlos antes de comenzar los experimentos.
5. Generación de monocapas 2D intestinales de rata a partir de organoides 3D
NOTA: El siguiente protocolo describe los volúmenes necesarios para generar 24 pocillos de una placa de 48 pocillos recubierta con EME, comenzando con seis domos de 50 μL (plato de 35 mm) que contienen ~300 organoides intestinales/domo (escala: un domo genera cuatro pocillos), pero se puede escalar hacia arriba o hacia abajo según sea necesario. Tal como está escrito, este protocolo logra ~80% de confluencia en 4-5 días. A mayor confluencia, las células comienzan a adquirir estructuras organoides 3D nuevamente. A baja confluencia (≤40%), las células permanecen como monocapas y son viables durante ~14 días. Si el propósito del estudio es utilizar monocapas 2D, reduzca la escala para que un domo genere ocho pocillos de una placa de 24 pocillos. Los pocillos también se pueden recubrir con colágeno I para formar monocapas.
- Preparación de superficies revestidas
- Para recubrir la placa con EME, diluir EME 1:20 en AdDMEM+ frío (Tabla 1). Para recubrir con colágeno, prepare el colágeno I de acuerdo con las instrucciones del fabricante. Diluir 5 mg/mL de colágeno I en AdDMEM+ a 100 μg/mL (1:50 en este caso).
- Cubra la placa con 200 μL de EME diluido o colágeno para cubrir completamente la superficie del pocillo. Incubar durante 1-2 h a 37 °C en una incubadora de cultivo de tejidos. Prepare el medio organoide intestinal de rata para el cultivo de monocapa 2D (rIOM2D) según la Tabla 4.
- Generación de monocapas
- Aspire el medio de una placa de 35 mm que contenga organoides. Agregue 1 ml de PBS.
- Interrumpa el EME en los pozos rascando con una punta P1000. Pipetea hacia arriba y hacia abajo aproximadamente 20 veces para aflojar todo el EME. Transfiera todo a un tubo cónico de 15 ml.
- Agregue 1 mL de PBS a la placa de 35 mm para recuperar cualquier organoide adicional y transfiéralo al mismo tubo cónico de 15 mL.
- Centrifugar a 350 x g durante 2 min y aspirar el sobrenadante, incluido el residuo EME. Añadir 1 ml de solución de tripsina al gránulo de organoide e incubar a 37 °C durante 2 min.
- Pipetear hacia arriba y hacia abajo 10 veces con una punta P1000 y añadir 2 ml de AdDMEM+ para neutralizar la tripsina.
- Centrifugar a 350 x g durante 5 min. Aspirar el sobrenadante y añadir 4,8 mL de rIOM2D (Tabla 4). Vuelva a suspender el gránulo celular.
- Antes de colocar los organoides, saque de los pocillos el exceso de EME o colágeno en AdDMEM+. A continuación, añadir 200 μL de organoides en rIOM2D y 10 μM Y27632 a cada pocillo prerrecubierto.
- Después de 4-16 h, recoja el medio y centrifugue a 1.000 x g durante 1 min. Transfiera el sobrenadante a un nuevo tubo cónico de 15 ml y deseche el gránulo.
- Lave cada pocillo con 300 μL de PBS y agregue 200 μL del rIOM2D centrifugado a cada pocillo. Cambie el rIOM2D cada 2-3 días, suspendiendo el uso de Y27632.
- Reformado de organoides 3D a partir de monocapas 2D
NOTA: Las monocapas cultivadas en EME pueden ser inducidas a reformar organoides 3D, mientras que las monocapas cultivadas en colágeno I no regresan eficientemente a organoides 3D. Por lo general, se pueden usar 2-3 pocillos de organoides generados a partir de monocapas para hacer un domo de 50 μL de EME en el día 5.- Diluir el EME 1:4 en rIOM2D. Cuando las monocapas alcancen ~80% de confluencia, aspire cuidadosamente el medio y agregue 100 μL de EME diluido a los pocillos que contienen monocapas.
- Incubar a 37 °C, 5% de CO2 en una incubadora de cultivo de tejidos durante 20 min. A continuación, añadir 100 μL de rIOM2D y volver a la incubadora de cultivo de tejidos. Los organoides 3D se generarán dentro de los 5 días posteriores a la adición de EME diluido.
- Después de que los organoides pequeños se hayan reformado (~día 5), prepare rIOM. Recoja todo el contenido del pocillo, pipetee hacia arriba y hacia abajo para interrumpir el EME, y transfiéralo a un tubo cónico de 15 ml.
- Centrifugar a 350 x g durante 2 min. Aspirar el sobrenadante y el residuo EME.
- Añadir 1 ml de AdDMEM+ frío y centrifugar a 350 x g durante 2 min. Retire el sobrenadante, dejando ~50 μL de medio.
- Transfiera los 50 μL de medios y organoides a una alícuota EME de 250 μL. Pipetear hacia arriba y hacia abajo para distribuir los organoides por todo el EME.
- Pipetear 50 μL de cúpulas EME en una placa de 35 mm e incubar durante 20 min en una incubadora de cultivo de tejidos.
- Agregue 2 ml de rIOM más 10 μM de Y27632. Cambie el medio de cultivo cada 2-3 días. Al cambiar el medio, se puede omitir Y27632.
6. Manipulación genética
- Transfección transitoria de monocapas 2D
PRECAUCIÓN: Prepare monocapas epiteliales intestinales de rata siguiendo la sección 5.1 en una placa de 48 pocillos. La transfección debe realizarse al 70%-80% de confluencia. Sustituya siempre los medios de los pocillos por 200 μl de rIOM2D fresco antes de transfectar. Calcular las relaciones de absorbancia de 260/280 nm y 260/230 nm del ADN plasmídico; Estos deben estar por encima de 1,8 para garantizar buenos resultados de transfección.
NOTA: Utilice un control de plásmido para calcular la eficiencia de la transfección. Se recomienda un plásmido que codifique una proteína fluorescente para facilitar la instalación. En este protocolo se utilizó pLJM1-EGFP27 .- Preparar 1 mg/mL de polietilenimina de 20 kDa (PEI; Tabla 3). Para cada pocillo, prepare el tubo A (0,6 μg de plásmido + 50 μL de medio sérico reducido) y el tubo B (1,8 μL de PEI + 50 μL de medio sérico reducido). Mantenga una relación ADN:PEI de 1:3.
- Vórtice ambos tubos durante 30 s. Combine el tubo A y el tubo B, y vuelva a vórtice durante 30 s. Si es necesario, use una centrífuga para centrifugar. Incubar durante 20 minutos a temperatura ambiente.
- Agregue suavemente el complejo ADN/PEI gota a gota a la monocapa 2D. Agite suavemente el plato para mezclar. Incubar a 37 °C, 5% CO2. Por lo general, la expresión se puede detectar después de 24 h.
NOTA: Si es necesario volver a las estructuras organoides 3D, espere 48 h después de la transfección para agregar EME diluido.
- Transducción lentiviral de organoides intestinales de ratas
NOTA: Antes de trabajar con lentivirus, obtenga la debida autorización y capacitación especializada de la institución. Siempre use el equipo de protección personal (EPP) adecuado cuando manipule lentivirus. Si bien no se describe aquí, el lentivirus concentrado de alta calidad es esencial para la infección exitosa de los organoides. Este protocolo utilizó un vector pLJM1-EGFP vacío27 para expresar GFP soluble. Este protocolo es una modificación de un protocolo publicado anteriormente28. La eficiencia de la transducción depende de la calidad y concentración de las partículas virales, de la disociación eficiente de los organoides en pequeños grupos celulares y del gen que se expresa. Cuando se calculó 5 días después de la infección, la eficiencia media de la transducción antes de la selección fue del 19,4% (± 6,5% de desviación estándar).- A los 2 días previos a la infección lentiviral, planifique el paso (sección 3) de dos pocillos densos de una placa de 24 pocillos por cada lentivirus que se transducirá. Cada pocillo de una placa de 24 pocillos puede acomodar un domo de EME de 50 μL.
- Una vez que el EME se solidifique, agregue 0,5 ml de rIOM suplementado con 10 mM de nicotinamida, 10 μM Y27632 y 2,5 μM CHIR99021. Esto induce grandes morfologías esferoides, lo que es favorable para la eficiencia de la transducción lentiviral. Dentro de los 2 días posteriores a la siembra, los organoides de rata deben ser esferoides grandes. Si se observa una diferenciación significativa (es decir, gemación), vuelva a pasar los organoides.
- Descongele el virus concentrado en hielo. Prepare medios de transducción nuevos, según la Tabla 3.
- Con una punta P1000, suelte las cúpulas EME desde el fondo de la placa de cultivo celular en el medio pipeteando hacia arriba y hacia abajo. Continúe pipeteando hacia arriba y hacia abajo 20 veces para romper el EME y liberar los organoides.
- Pipetear los organoides y los medios en un tubo cónico de 15 ml. Todos los pocillos se pueden agrupar, siempre que los organoides tengan el mismo genotipo y sean de la misma línea.
- Lave cada pocillo dos veces con 1 ml de AdDMEM+ frío. Recoja el AdDMEM+ y transfiéralo al mismo tubo cónico de 15 ml.
- Con una pipeta Pasteur de vidrio, altere mecánicamente los organoides de las ratas. Este es un paso crítico, ya que el objetivo son pequeños grupos multicelulares de células. Pipetear hacia arriba y hacia abajo ~30 veces. Compruebe la eficiencia de la interrupción bajo el microscopio utilizando un objetivo 4x. Continúe este proceso hasta que la suspensión celular esté compuesta principalmente por grupos celulares con pocos organoides restantes.
NOTA: Alternativamente, los organoides pueden centrifugarse a 200 x g durante 5 min a temperatura ambiente, el sobrenadante se retira cuidadosamente y se resuspende en 1 mL de enzima recombinante que sustituye a la tripsina/EDTA convencional, precalentada a 37 °C en la incubadora de cultivo de tejidos. Incubar los organoides en reemplazo de tripsina durante 2 min en un baño de agua a 37 °C, con vórtice regular para promover la disociación. Evite la incubación prolongada con reemplazo de tripsina, ya que esto puede promover la muerte celular. Compruebe regularmente la eficiencia de la interrupción bajo el microscopio utilizando un objetivo 4x. Cuando la suspensión esté compuesta principalmente por células individuales con pocos cultivos celulares, diluya el reemplazo de tripsina agregando 4 ml de AdDMEM+ y continúe con el siguiente paso. - Centrifugar el tubo cónico de 15 ml que contiene los grupos celulares a 200 x g durante 5 min a 4 °C. Retire y deseche con cuidado el sobrenadante, teniendo cuidado de no alterar la gránula celular.
- Resuspender los grupos celulares en 230 μL de medio de transducción por pocillo a infectar. Para la infección, use un pocillo de una placa de 48 pocillos para cada lentivirus.
- Coloque 230 μL de suspensión celular en cada pocillo de una placa de 48 pocillos marcada. Agregue 20 μL de virus concentrado a cada pocillo. Use una punta P1000 para mezclar la solución de virus/célula en cada pocillo y selle la placa con una película transparente.
- Realizar espinoculación: centrifugar la placa a 600 x g durante 1 h a 32 °C. Desprecintar la placa e incubar a 37 °C, 5% CO2 durante 6 h.
- Precalentar una placa de 24 pocillos en la incubadora a 37 °C.
- Después de la incubación, pipetee cada pocillo hacia arriba y hacia abajo y transfiera el contenido a un tubo de 1,5 ml etiquetado. Lavar cada pocillo con 750 μL de AdDMEM+ y transferir al tubo. Girar los tubos a 600 x g durante 5 min a 4 °C.
- Retire los tubos de la centrífuga y guárdelos en hielo. Use una punta P1000 para retirar con cuidado y desechar adecuadamente el sobrenadante.
- Vuelva a suspender el gránulo de celda en EME y coloque domos de 50 μL en la placa precalentada de 24 pocillos. Incubar durante 15-20 min a 37 °C hasta que el EME esté polimerizado.
- A cada pocillo, agregue 500 μL de rIOM suplementado con 10 mM de nicotinamida, 10 μM de Y27632 y 2,5 μM de CHIR99021.
- Reemplace el medio con rIOM más 10 μM Y27632 1 día después de la infección. Cambie los medios cada 2-3 días. Si se va a realizar la selección, añadir la selección 48-72 h después de la infección. Para la selección de puromicina, use 2 μg/mL de puromicina.
7. Tinción de montaje completo de organoides con inmunofluorescencia
- Aspirar el medio y añadir un 4% de paraformaldehído (PFA) en PBS-Tween 20 (PBS-T) (Tabla 3) a los organoides en una placa de cultivo celular. Incubar a temperatura ambiente durante 10 min.
- Libere los organoides del EME pipeteando hacia arriba y hacia abajo. Recoja los organoides en un tubo de 0,75 ml. Los organoides se depositarán en el fondo del tubo por gravedad en unos pocos minutos. Si es necesario, centrifugar a 100 x g durante 1 min.
- Con una pipeta de transferencia, retire el PFA y vuelva a suspender los organoides en PBS-T. Deja que los organoides se asienten en el fondo del tubo. Retirar el PBS-T y volver a suspender en 200 μL de solución en bloque (Tabla 3).
- Incubar a temperatura ambiente en un balancín o nutator durante 45 min. Los organoides pueden agruparse y depositarse en el fondo del tubo. Periódicamente golpee el tubo con los dedos para volver a suspenderlo y dispersarlo por toda la solución.
- Deja que los organoides se asienten en el fondo del tubo. Si es necesario, centrifugar a 100 x g durante 1 min. Retire la solución de bloqueo.
- Añadir anticuerpo primario diluido en 100 μL de solución en bloque. Incubar a temperatura ambiente en una mezcladora nutante durante 45 min a 24 rpm. Las concentraciones de anticuerpos varían según el anticuerpo utilizado.
NOTA: Este paso puede extenderse en función del anticuerpo primario, hasta toda la noche a 4 °C. - Deja que los organoides se asienten en el fondo del tubo. Si es necesario, centrifugar a 100 x g durante 1 min.
- Lavar en PBS-T cinco veces con una pipeta de transferencia. Incubar a temperatura ambiente durante 5 min en una batidora nutante a 24 rpm. Repita este paso dos veces.
- Añadir anticuerpo secundario diluido 1:200 y 50 μg/mL de 4′,6-diamidino-2-fenilindol (DAPI) diluido en 100 μL de solución en bloque. Incubar a temperatura ambiente en una mezcladora nutante durante 30 min a 24 rpm.
- Deja que los organoides se asienten en el fondo del tubo. Si es necesario, centrifugar a 100 x g durante 1 min. Eliminar el anticuerpo secundario. Lavar cinco veces en PBS-T con una pipeta de transferencia.
- Incubar a temperatura ambiente durante 5 min en una batidora nutante a 24 rpm. Repita el paso de lavado dos veces.
- Mientras se lavan los organoides, calentar una alícuota de sellador VALAP (Tabla 3) a 40-50 °C para licuar. Con un pincel, pinte un cuadrado delgado de VALAP en un portaobjetos de microscopio aproximadamente del tamaño de un cubreobjetos. Utilice un cubreobjetos n.º 1.5 de 22 mm x 22 mm.
- Con unas tijeras, corte el extremo de la punta de una pipeta P200. Transfiera los organoides al pocillo VALAP en el portaobjetos. Con una toallita de tela, absorba con cuidado el PBS-T. No dejes que los organoides se sequen.
- Inundar el pocillo VALAP con un medio de montaje antidecoloración (Tabla 3). Para un cuadrado de ~22 mm x 22 mm, esto requerirá 100-150 μL de antidecoloración.
- Los organoides pueden agruparse; Agite el antidecoloración con la punta de una pipeta para redistribuir los organoides, si es necesario. Montar con cubreobjetos n.º 1.5 de 22 mm x 22 mm, evitando burbujas de aire. Selle el cubreobjetos pintando una fina capa de VALAP en los bordes.
NOTA: En el caso de los microscopios invertidos, los organoides también pueden montarse en una placa con fondo de cristal de 35 mm.
8. Hinchazón de organoides intestinales de rata inducida por forskolina
- Cultive los organoides durante 3-5 días después de la aprobación en rIOM. Es aconsejable cultivar organoides en una placa de 24 pocillos para garantizar que la misma región se pueda volver a crear fácilmente una imagen. Capturar imágenes antes de la adición de forskolina (T0).
- Añadir forskolina (Tabla 3) directamente al medio organoide hasta una concentración final de 10 μM. Añadir el mismo volumen de dimetilsulfóxido (DMSO) a los pocillos de control.
- Tome imágenes de los pozos de control y tratados con forskolina a intervalos regulares, cada 15-30 minutos. Cuando no esté tomando imágenes, mantenga los organoides en la incubadora o use un sistema de imágenes controlado con incubación. La hinchazón máxima debe observarse a los 120 minutos.
- Seguir los protocolos estándar para calcular la hinchazón relativa a partir de las imágenes adquiridas29.
Resultados
Los organoides duodenales y yeyunales de rata se generaron utilizando el protocolo descrito en la sección 2. Es muy importante durante los pasos de aislamiento de la cripta que las vellosidades se agoten eficientemente del PBS. Si se siembran demasiadas vellosidades en el EME con criptas, puede causar la muerte de todo el cultivo y la imposibilidad de establecer una línea de organoide. Debido a esto, es útil aislar las criptas bajo un telescopio de disección, lo que permite la confirmación visual del agotamiento del villar. La Figura 1 muestra fragmentos y criptas representativas de villar (Figura 1A). Obsérvese el tamaño significativamente menor de las criptas en comparación con las vellosidades (Figura 1B). Después de la siembra, las criptas se expandirán en esferoides durante los próximos días y comenzarán a brotar y diferenciarse en el día 4-7 (Figura 2). Una vez que los organoides alcanzan una etapa de gemación extensa, deben ser dejados. Durante el paso, es importante alterar los organoides lo suficiente como para separar las yemas de la cripta, de modo que se pueda ampliar el número de organoides (Figura 3B).
La recuperación exitosa de los organoides después de la congelación depende en gran medida del estado en el que se congelan. Los organoides en estado indiferenciado altamente proliferativo se recuperan con la mayor eficiencia. Por lo tanto, recomendamos inducirlos para que sean esféricos y quísticos en lugar de gemados y diferenciados. Para lograr esto, Wnt puede ser hiperactivado aumentando la cantidad del ligando Wnt R-espondina en el medio e incluyendo nicotinamida en el medio, lo que ha demostrado apoyar la formación de organoides y la supervivencia celular en varios sistemas de cultivo30,31. La Figura 3A muestra un cultivo de organoides sano solo 2 días después de la descongelación. La inclusión de BSA en los medios durante la descongelación también ha ayudado a la supervivencia de los cultivos de organoides intestinales de ratas, que han demostrado ser más delicados que los organoides intestinales de ratones.
Si bien a menudo se prefiere el cultivo de organoides en 3D porque recapitula parte de la arquitectura intestinal normal, hace que otros enfoques, incluidas las imágenes en vivo, las transfecciones y las transducciones lentivirales, sean más desafiantes desde el punto de vista técnico. El uso de monocapas 2D generadas a partir de organoides3D 32 (Figura 4) permite una introducción más eficiente de los plásmidos. Mientras que los organoides intestinales 3D son tradicionalmente resistentes a las transfecciones transitorias, los plásmidos que codifican para el EGFP pueden introducirse con éxito utilizando métodos de transfección basados en lípidos. El enfoque más rentable que utiliza PEI se describe en el paso 6.1 (Figura 5), pero la electroporación y los reactivos de transfección disponibles comercialmente también han arrojado resultados comparables (datos no mostrados). Los estudios futuros se centrarán en si estos enfoques pueden utilizarse para introducir construcciones CRISPR en monocapas.
Era importante poder reformar organoides 3D a partir de monocapas 2D después de la transfección para que pudieran mantenerse como una línea transitable con componentes arquitectónicos 3D de las criptas. Curiosamente, las monocapas 2D colocadas en el EME se reformaron fácilmente en pequeños esferoides cuando se volvió a añadir el EME a la parte superior de las células, mientras que un sustrato de colágeno I no fue suficiente para la reformación de las estructuras 3D (Figura 6).
Si bien las transfecciones transitorias son útiles para muchos estudios, la formación de líneas estables suele ser más útil, ya que requiere la introducción de lentivirus en las células. Los organoides intestinales de ratas se infectaron con lentivirus modificando los protocolos publicados previamente (Figura 7). Un paso clave en el protocolo es la disrupción de organoides en pequeños agregados o grupos de células. Si los cultivos no se interrumpen de manera eficiente y los organoides permanecen intactos, las partículas lentivirales no entrarán en las células. Después de la infección, los organoides deben recuperarse y volver a crecer. El protocolo descrito aquí permite la absorción de partículas virales por parte del 10%-48% (media: 19,4% ± 6,5%) de las células antes de la selección.
La tinción de todo el montaje de organoides puede resultar difícil debido a la eliminación incompleta del residuo de EME o a la penetrancia incompleta de los anticuerpos. El protocolo descrito aquí permite la tinción robusta de organoides. La visualización de organoides en un microscopio confocal también puede resultar difícil si están demasiado lejos del cubreobjetos. Mediante el uso de VALAP, se crea un pocillo con cierta altura de modo que los organoides no sean aplastados por el cubreobjetos, sino que aún se permite que se asienten cerca del cubreobjetos para facilitar la obtención de imágenes. En la Figura 8 se muestra la tinción representativa contra el regulador de la conductancia transmembrana de la fibrosis quística del canal aniónico apical (CFTR) y la faloidina para marcar la F-actina.
Por último, los organoides tienen utilidad en ensayos funcionales. Los organoides derivados de pacientes con fibrosis quística se han utilizado para detectar la función de CFTR, ya que el tratamiento con el agonista del AMPc forskolina induce una secreción robusta de líquido mediada por CFTR, causando inflamación de los organoides 29,33-37. Uno de los objetivos de este trabajo fue identificar y desarrollar un modelo de organoide que pueda utilizarse en paralelo a los estudios preclínicos in vivo. Por lo tanto, nuestro objetivo fue determinar si los organoides intestinales de ratas experimentan hinchazón inducida por forskolina. De hecho, a los 30 minutos del tratamiento con forskolina, los organoides de rata se hincharon, con un efecto máximo observado a los 120 minutos (Figura 9).
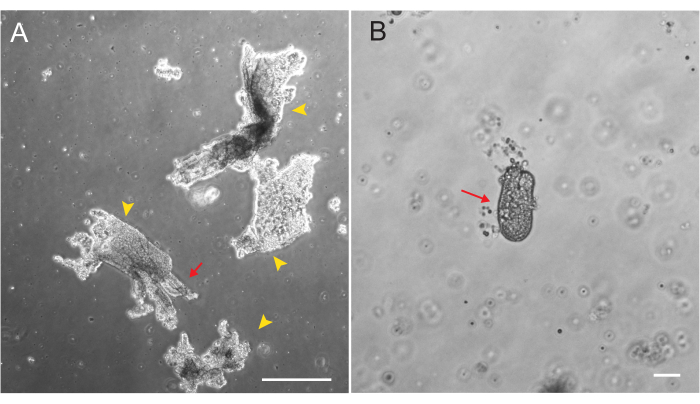
Figura 1: Fragmentos y criptas de Villar durante el aislamiento epitelial. (A) Imagen representativa de fragmentos de Villar en solución de EDTA durante el protocolo de aislamiento de criptas. Las puntas de flecha amarillas marcan los fragmentos de villar. Las flechas rojas representan criptas unidas a un fragmento de villar. Tenga en cuenta la diferencia en los tamaños relativos. (B) Imagen de mayor aumento de una sola cripta (flecha roja) para que se pueda visualizar la morfología. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
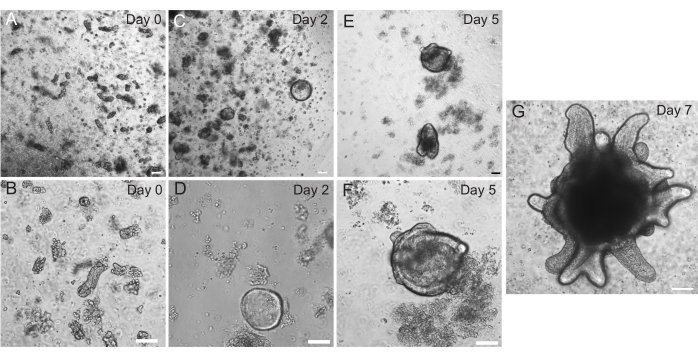
Figura 2: Progresión de organoides intestinales de ratas. Las criptas de yeyuno de rata se sembraron en EME inmediatamente después del aislamiento (A,B). En 2 días, las criptas se convirtieron en esferoides (C,D). Para el día 5, comenzaron a iniciar brotes de cripta (E, F), que se elaboraron y crecieron en el día 7 (G). Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
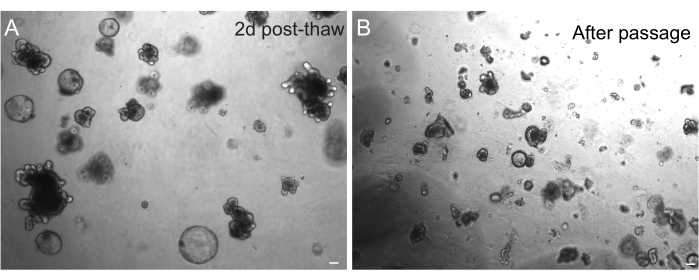
Figura 3: Organoides después de la descongelación y el paso. (A) Los organoides yeyunales de rata se descongelaron siguiendo los protocolos descritos después de la criopreservación. Tenga en cuenta la presencia de esferoides y organoides gemados solo 2 días después de la descongelación. (B) La misma línea organoide representada en A inmediatamente después de la pasada siguiendo el protocolo descrito. Obsérvese la diferencia de tamaño relativo entre las estructuras de A y B y la presencia de dominios de una sola cripta en B. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
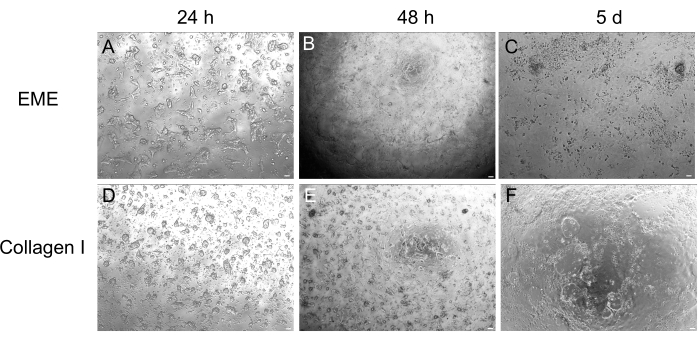
Figura 4: Formación de monocapas 2D a partir de organoides 3D. (A-C) Progresión de monocapas 2D en EME. (D-F) Progresión de monocapa 2D sobre colágeno I. Para el día 5, cada condición produjo ~80% de confluencia. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
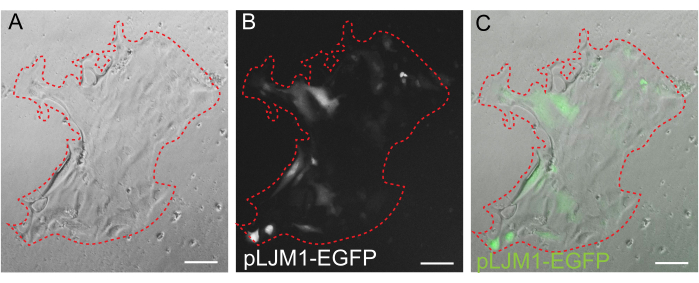
Figura 5: Transfección transitoria de una monocapa 2D. Imagen representativa de una monocapa 2D cultivada en EME transfectada transitoriamente con plásmido pLJM1-EGFP utilizando PEI. (A) Campo claro, (B) fluorescencia (GFP), (C) superposición. La línea roja punteada marca el límite de la monocapa. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
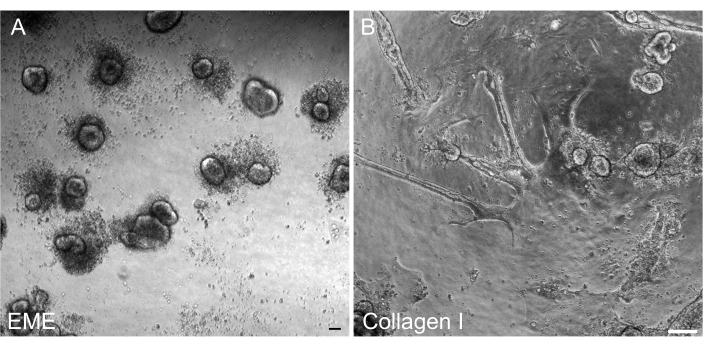
Figura 6: Reformación de organoides 3D a partir de monocapas 2D en EME. (A) Formación de organoides 3D a partir de monocapas 2D cultivadas en EME. Organoides formados eficientemente a los 5 días de añadir EME a la superficie apical de la monocapa. Nótese la abundancia de células muertas que rodean a los pequeños esferoides 3D. (B) Persistencia de monocapas 2D 5 días después de que se añadiera colágeno I a la superficie apical de monocapas 2D cultivadas sobre colágeno I. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
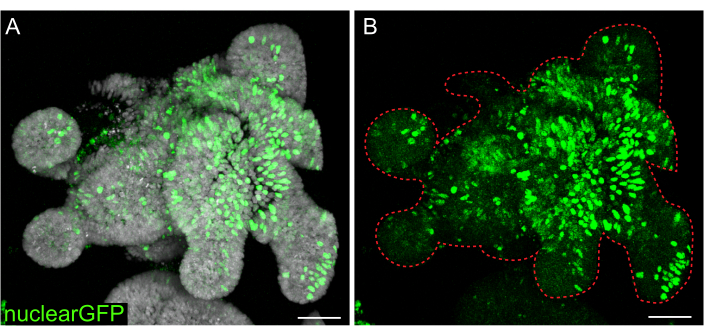
Figura 7: Infección lentiviral de organoides 3D. Los organoides de rata yeyuno se infectaron con partículas lentivirales nucleares de GFP utilizando el protocolo descrito. Después de la recuperación y el crecimiento durante 5 días, los organoides se fijaron y se contratiñeron con DAPI. (A) DAPI: gris; nuclearGFP: verde. (B) nuclearGFP:verde. La línea roja punteada marca el límite del organoide. Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
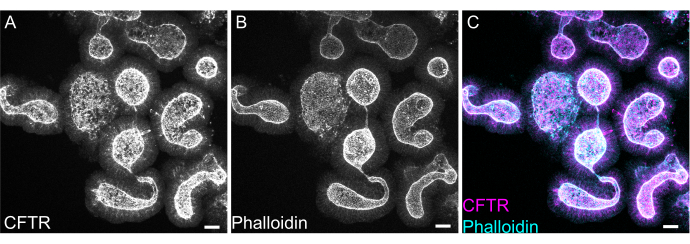
Figura 8: Inmunofluorescencia de montaje completo de organoides intestinales de rata. (A) CFTR, (B) faloidina y (C) inmunofluorescencia de montaje completo fusionado de organoides yeyunales de rata. Obsérvese el enriquecimiento apical de la tinción con CFTR en organoides (gris en A, magenta en C). La faloidina marca la F-actina y etiqueta de forma prominente el borde apical en forma de pincel (gris en B, cian en C). Barras de escala: 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
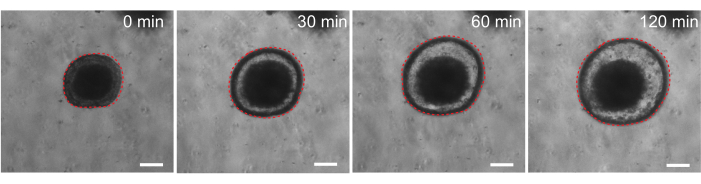
Figura 9: Los organoides intestinales de las ratas se hinchan tras la estimulación de la forskolina. Evolución temporal representativa de la inflamación de los organoides intestinales de rata después de la adición del agonista del AMPc forskolina. El tiempo de 0 min representa el punto de tiempo inmediatamente anterior a la adición de 10 μM de forskolina. Las imágenes muestran el mismo organoide a intervalos de tiempo de 30 minutos. Se observó hinchazón máxima a los 120 min después de la adición de forskolina. La línea roja punteada delinea el límite del organoide. El material oscuro en el medio de la luz del organoide está compuesto por células muertas. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Receta de AdDMEM+. Ingredientes para hacer el medio AdDMEM+ estándar, que es el medio base a través de los métodos que se muestran aquí. Haga clic aquí para descargar esta tabla.
Tabla 2: Receta de medios organoides intestinales para ratas (rIOM). Receta detallada de los medios organoides intestinales estándar de rata, incluyendo el disolvente y las condiciones de almacenamiento de las proteínas recombinantes. Haga clic aquí para descargar esta tabla.
Tabla 3: Soluciones. Recetas e instrucciones para elaborar otras soluciones utilizadas a lo largo del protocolo. Haga clic aquí para descargar esta tabla.
Tabla 4. Medio organoide intestinal de rata para cultivo 2D monocapa (rIOM2D). Receta modificada de medios de cultivo de organoides optimizados para el crecimiento 2D de monocapas. Haga clic aquí para descargar esta tabla.
Discusión
El desarrollo de un modelo de organoide intestinal de rata conserva importantes características funcionales que se encuentran en el órgano in vivo y es una herramienta prometedora para las pruebas preclínicas, el cribado de fármacos y los ensayos funcionales. Este modelo in vitro puede ser utilizado en paralelo a los estudios preclínicos de gastroenterología in vivo , para los cuales las ratas suelen ser un modelo preferido debido a su mayor tamaño intestinal, aspectos fisiológicos compartidos con los humanos y, en algunos casos, por ser mejores modelos de enfermedad38. Aquí, se describe un sólido protocolo paso a paso para el aislamiento de criptas intestinales de ratas, la generación y el cultivo a largo plazo de organoides intestinales de ratas, así como aplicaciones posteriores que incluyen ensayos de hinchazón funcional de forskolina, inmunofluorescencia de montaje completo, cultivo de monocapa 2D y manipulación genética lentiviral. Es probable que los organoides intestinales de rata sean relevantes en muchos contextos de enfermedad en los que la fisiopatología de los modelos de ratón es inapropiada y pueden proporcionar un mejor modelo para la fisiología intestinal humana en comparación con los organoides intestinales de ratón.
Para establecer cultivos organoides de larga vida que puedan ser transitados y expandidos, es esencial identificar los factores de crecimiento clave necesarios para mantener la proliferación epitelial intestinal. Los organoides de ratón se cultivan con mayor frecuencia en un cóctel simple de EGF, R-espondina y Noggin, aunque se ha informado que Noggin no es necesario para el cultivo de organoides intestinales39. Los medios acondicionados pueden reemplazar los factores de crecimiento recombinantes y las líneas celulares más utilizadas son L-WRN, que secreta Wnt3a, Rspondin-3 y Noggin39, L-Wnt3a y HA-Rspondin1-Fc 293Tcells 40. Los medios acondicionados con L-WRN son suficientes para apoyar no solo el crecimiento de organoides intestinales de ratón39 , sino también el crecimiento de organoides intestinales de varios animales de granja y animales de compañía, incluidos perros, gatos, pollos, caballos, vacas, ovejas y cerdos12. Sin embargo, los organoides intestinales humanos son muy diferentes en sus requerimientos de factores de crecimiento, ya que requieren formulaciones de medios distintas para su fase de crecimiento de expansión (es decir, la progresión de esferoides pequeños a grandes) frente a su fase de diferenciación (es decir, la generación y maduración de tipos celulares diferenciados)10. Los requisitos de medios de los organoides intestinales de rata son muy similares a los de los medios de crecimiento de expansión para los organoides intestinales humanos, sin embargo, en particular, los organoides de rata son capaces tanto de crecer como de diferenciarse en este entorno de medios, lo que simplifica considerablemente sus requisitos de cultivo. Si bien nuestros intentos iniciales se centraron en establecer y cultivar organoides intestinales de rata en medios acondicionados con L-WRN, el cultivo a largo plazo fue tenue y las líneas de organoides intestinales de rata sufrieron una falta de robustez (datos no mostrados). Esto puede deberse a que las líneas celulares L-WRN están diseñadas para secretar R-espondina 3, mientras que la línea celular 293T-Rspo1 recomendada aquí está diseñada para secretar R-espondina 1. Es posible que los organoides de ratas y humanos prefieran la R-espondina 1, lo que podría explicar el fracaso de las líneas de organoides de rata en medios acondicionados con L-WRN.
Para recapitular de la manera más cercana posible el entorno in vivo , es importante desarrollar condiciones de cultivo de organoides que permitan la supervivencia, el mantenimiento y la proliferación de las células madre, y que puedan mantener el recambio celular y los eventos de diferenciación simultáneos en tipos celulares discretos. Por lo tanto, las concentraciones de proteínas recombinantes y/o proteínas en medios acondicionados deben ser ajustadamente tituladas y controladas para lograr este equilibrio perfecto. En particular, los niveles óptimos de Wnt son esenciales para evitar la pérdida de cultivos de organoides intestinales. Muy poco Wnt en medios acondicionados será incapaz de soportar el crecimiento, lo que conducirá a una pérdida de células madre y la posterior muerte de organoides; La sobreactivación de Wnt hará que los organoides sean quísticos e indiferenciados10. Si bien no se detalla aquí, se recomienda encarecidamente probar cada lote de medios acondicionados L-Wnt3a y 293T-Rspo1 utilizando un ensayo de luciferasa reportera Wnt, como una línea celular Topflash41. Estudios anteriores han descrito que un lote óptimo de medios L-Wnt3a debería dar como resultado un aumento de la señal de 15 veces al 12,5% y un aumento de la señal de 300 veces al 50%, en comparación con el 1% de L-Wnt3a10. Dado que los organoides de rata son más sensibles que los organoides de ratón a los requisitos de cultivo, en particular a los niveles de activación de Wnt, estos pasos adicionales de control de calidad ayudan en gran medida a facilitar la robustez y fiabilidad de los cultivos de organoides de rata. Debido a que no se dispone de una línea reportera similar para analizar la actividad de Bmp y las concentraciones relativas de Noggin en medios acondicionados de Noggin, se recomienda utilizar Noggin recombinante cuando sea posible para controlar con precisión los niveles de Noggin. Si bien los organoides intestinales de ratón pueden cultivarse y mantenerse en ausencia de Noggin39, esto no se ha intentado para los cultivos de organoides intestinales de rata.
Más allá de los requisitos de cultivo celular, el establecimiento inicial exitoso de una línea de organoides de rata depende críticamente del agotamiento eficiente de las vellosidades diferenciadas durante el aislamiento de la cripta. Los altos niveles de contaminación de villar causan la muerte de las criptas, presumiblemente debido a las señales de las células moribundas o al secuestro de factores esenciales. Para agotar estas vellosidades diferenciadas de las preparaciones epiteliales de manera precisa y consistente, se recomienda realizar aislamientos epiteliales con la ayuda de un estereoscopio. El examen visual del epitelio que se libera proporciona una indicación clara de cuándo desechar el PBS y reemplazarlo (Figura 1). Las criptas no deben recolectarse hasta que haya suficiente agotamiento de vellosidades. Las células de Villar están diferenciadas terminalmente y no pueden generar organoides en cultivo. Además, el paso posterior de organoides intestinales de rata y su uso para cualquier aplicación posterior requiere un cuidado delicado. La incubación en reactivos de disociación durante períodos de tiempo más largos (10 min) da como resultado una muerte celular significativa y la pérdida de la línea de organoides.
Aquí se describe un protocolo simple y rápido para generar monocapas intestinales a partir de organoides de rata. Los sustratos de EME y colágeno I tienen diferentes efectos sobre el epitelio, que pueden aprovecharse según el propósito del estudio. La EME permite la adhesión rápida y eficiente de células individuales y la formación de proyecciones celulares. Por el contrario, recubrir la superficie con colágeno I retrasa estos procesos. Una vez que las monocapas alcanzan aproximadamente el 80% de confluencia, las células cultivadas en EME comienzan a generar estructuras organoides 3D nuevamente. Sin embargo, carecen de suficiente apoyo físico y químico para un crecimiento continuo. Esta reversión al estado organoide puede evitarse manteniendo las monocapas en EME a una confluencia del 50%-80%. La adición de EME diluido a la superficie apical de las monocapas promueve la rápida recuperación y formación de organoides de novo, generando regiones de convergencia de forma más rápida y rápida. En una superficie de colágeno I, las células pueden formar una monocapa uniforme y generar pequeños grupos. Sin embargo, la adición de colágeno I sobre monocapas no es suficiente para inducir la formación de organoides. La EME debe diluirse cuando se agrega a la superficie de la monocapa, ya que habrá una resistencia mecánica más fuerte para que el organoide naciente la supere. Sin embargo, esta EME diluida no permite la formación robusta de grandes organoides. Cualquier organoide de rata generado de novo que se desprenda naturalmente de la superficie debe eliminarse inmediatamente y transferirse a EME sin diluir para que se pueda restaurar el soporte estructural y el crecimiento. Debido al pequeño tamaño de los organoides en este paso, no se recomienda el paso de organoides hasta que se haya establecido un crecimiento robusto. No está claro el significado biológico subyacente de por qué la EME puede apoyar la reforma de los organoides, pero no está claro si el colágeno I puede o no puede hacerlo. Sin embargo, ha habido informes de que las células cultivadas en colágeno 3D no pueden formar organoides en brotes42,43 o apoyar el mantenimiento a largo plazo. Los productos EME disponibles en el mercado son mezclas heterogéneas de proteínas extracelulares, principalmente laminina y colágeno IV44. Por lo tanto, la composición distinta de las proteínas y la capacidad de una célula epitelial para interactuar con la matriz extracelular utilizando diferentes complejos celulares podrían permitir la remodelación en EME pero no en el colágeno I. No se ha probado si las monocapas derivadas del colágeno I se pueden poner en EME para apoyar la formación y el crecimiento de organoides.
Aquí se describe la manipulación genética del modelo de organoide intestinal de rata, y se describen los protocolos para la transducción lentiviral de organoides 3D y la transfección transitoria de monocapas 2D. Para superar la baja eficiencia de la transducción de organoides lentivirales, se desarrolló un protocolo para la transfección transitoria de monocapas 2D. La morfología plana y los dominios apicales expuestos de las monocapas proporcionan un acceso más fácil a los virus y a los complejos que contienen ADN. Para la validación de esta técnica se utilizó la expresión de un reportero de EGFP utilizando el vector pLJM1-EGFP. La expresión del GFP reportero se observó después de 24 h, y se mantuvo durante 5-6 días en monocapas. Es probable que los estudios futuros centrados en la transducción lentiviral de monocapas tengan una mayor eficiencia que la transducción de organoides 3D. Utilizando los protocolos anteriores, los organoides 3D pueden reformarse a partir de monocapas 2D infectadas para facilitar la creación de líneas estables. Con cuidado, las líneas de organoides intestinales de rata se pueden mantener con éxito durante más de un año, permaneciendo estables en muchos pasajes, criopreservadas, descongeladas con éxito y modificadas genéticamente mediante transducción lentiviral, abordando así la necesidad de un modelo de organoide intestinal in vitro accesible y manejable que conserve la relevancia fisiológica para los seres humanos.
Divulgaciones
Ninguno.
Agradecimientos
Agradecemos a los miembros de los laboratorios Sumigray y Ameen por sus reflexivas discusiones. Este trabajo fue apoyado por una beca de salud infantil de la Fundación Charles H. Hood y una subvención de la Fundación de Fibrosis Quística (004741P222) a KS y por el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales de los Institutos Nacionales de Salud a NA bajo el número de adjudicación 2R01DK077065-12.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-D Culture Matrix Rat Collagen I | Cultrex/R&D Systems | 3447-020-01 | |
| 70 µm cell strainer | Corning/Falcon | 352350 | |
| Advanced DMEM/F12 | Gibco/Thermo Fisher | 12634010 | |
| Amphotericin B | Sigma Aldrich | A2942-20ML | |
| B-27 Supplement (50X), serum free | Thermo Fisher | 17504044 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| CryoStor | Stem Cell Technologies | 100-1061 | |
| Cultrex HA-Rspondin1-Fc 293T cells | R & D Systems | 3710-001-01 | |
| FBS | Gibco/Thermo Fisher | 16-000-044 | |
| Gastrin I (human) | Sigma Aldrich | G9145 | |
| Gentle Cell Dissociation Reagent | Stem Cell Technologies | 100-0485 | |
| Glutamax | Thermo Fisher | 35-050-061 | |
| Growth factor-reduced Matrigel, phenol red-free | Corning | 356231 | |
| HEPES | AmericanBio | AB06021 | |
| Lanolin | Beantown Chemical | 144255-250G | |
| L-glutamine | Gibco/Thermo Fisher | A2916801 | |
| L-Wnt3a cells | ATCC | CRL-2647 | |
| N-2 Supplement (100X) | Thermo Fisher | 17502-048 | |
| N-acetylcysteine | Sigma Aldrich | A9165-5G | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Opti-MEM I Reduced Serum Medium | Gibco/Thermo Fisher | 31985070 | |
| Paraffin | Fisher Scientific | P31-500 | |
| Parafilm | Sigma Aldrich | P7793 | transparent film |
| PBS | Thermo Fisher | 10010023 | |
| Penicillin/Streptomycin | Gibco/Thermo Fisher | 15140122 | |
| pLJM1-EGFP | Addgene | 19319 | |
| Polybrene | Millipore | TR-1003-G | |
| Polyethylenimine hydrochloride (PEI) | Sigma Aldrich | 764965 | |
| p-phenylenediamine | Acros Organics/Thermo Fisher | 417481000 | |
| Puromycin | VWR | J593-25mg | |
| Recombinant human FGF2 protein | Peprotech | 100-18B-250ug | |
| Recombinant human IGF-1 protein | Biolegend | B356441 | |
| Recombinant human Noggin protein | R & D Systems | 6057-NG-100 | |
| Recombinant mouse EGF protein | Thermo Fisher | PMG8041 | |
| Sprague Dawley rat | Charles River Laboratories | Strain 001 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| TrypLE Express Enzyme | Gibco/Thermo Fisher | 12604013 | |
| Y27632 dihydrochloride | Sigma Aldrich | Y0503 |
Referencias
- Beumer, J., Clevers, H. Cell fate specification and differentiation in the adult mammalian intestine. Nature Reviews. Molecular Cell BiologyI. 22 (1), 39-53 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Yin, Y. -. B., de Jonge, H. R., Wu, X., Yin, Y. -. L. Enteroids for nutritional studies. Molecular Nutrition & Food Research. 63 (16), 1801143 (2019).
- Cai, T., et al. Effects of six common dietary nutrients on murine intestinal organoid growth. PLoS One. 13 (2), e0191517 (2018).
- Davoudi, Z., et al. Gut Organoid as a new platform to study alginate and chitosan mediated PLGA nanoparticles for drug delivery. Marine Drugs. 19 (5), 282 (2021).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Yin, Y. B., de Jonge, H. R., Wu, X., Yin, Y. L. Mini-gut: a promising model for drug development. Drug Discovery Today. 24 (9), 1784-1794 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Gunther, C., Winner, B., Neurath, M. F., Stappenbeck, T. S. Organoids in gastrointestinal diseases: from experimental models to clinical translation. Gut. 71 (9), 1892-1908 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Zhao, Z., et al. Organoids. Nature Reviews Methods Primers. 2 (1), 94 (2022).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Fagerholm, U., Johansson, M., Lennernas, H. Comparison between permeability coefficients in rat and human jejunum. Pharmaceutical Research. 13 (9), 1336-1342 (1996).
- Dubbelboer, I. R., Dahlgren, D., Sjogren, E., Lennernas, H. Rat intestinal drug permeability: A status report and summary of repeated determinations. European Journal of Pharmaceutics and Biopharmaceutics. 142, 364-376 (2019).
- Bryda, E. C. The Mighty Mouse: the impact of rodents on advances in biomedical research. Missouri Medicine. 110 (3), 207-211 (2013).
- Zhang, Z., Carriero, N., Gerstein, M. Comparative analysis of processed pseudogenes in the mouse and human genomes. Trends in Genetics. 20 (2), 62-67 (2004).
- Lambracht-Washington, D., Fischer Lindahl, K. Active MHC class Ib genes in rat are pseudogenes in the mouse. Immunogenetics. 56 (2), 118-121 (2004).
- Busslinger, G. A., et al. Human gastrointestinal epithelia of the esophagus, stomach, and duodenum resolved at single-cell resolution. Cell Reports. 34 (10), 108819 (2021).
- Burclaff, J., et al. A proximal-to-distal survey of healthy adult human small intestine and colon epithelium by single-cell transcriptomics. Cellular and Molecular Gastroenterology and Hepatology. 13 (5), 1554-1589 (2022).
- Haber, A. L., et al. A single-cell survey of the small intestinal epithelium. Nature. 551 (7680), 333-339 (2017).
- Olivier, A. K., Gibson-Corley, K. N., Meyerholz, D. K. Animal models of gastrointestinal and liver diseases. Animal models of cystic fibrosis: gastrointestinal, pancreatic, and hepatobiliary disease and pathophysiology. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (6), G459-G471 (2015).
- Lu, P., et al. Animal models of gastrointestinal and liver diseases. Animal models of necrotizing enterocolitis: pathophysiology, translational relevance, and challenges. American Journal of Physiology. Gastrointestinal and Liver Physiology. 306 (11), G917-G928 (2014).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Hedrich, W. D., et al. Development and characterization of rat duodenal organoids for ADME and toxicology applications. Toxicology. 446, 152614 (2020).
- How to Cryopreserve Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/area-of-interest/organoid-research/intestinal-research/tech-tips-protocols/how-to-cryopreserve-intestinal-organoids.html (2023)
- How to Thaw Intestinal Organoids. STEMCELL Available from: https://www.stemcell.com/technical-resources/educational-materials/protocols/how-to-thaw-intestinal-organoids.html (2023)
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Van Lidth de Jeude, J. F., Vermeulen, J. L., Montenegro-Miranda, P. S., Vanden Brink, G. R., Heijmans, J. A protocol for lentiviral transduction and downstream analysis of intestinal organoids. Journal of Visualized Experiments. (98), e52531 (2015).
- Boj, S. F., et al. Forskolin-induced swelling in intestinal organoids: an in vitro assay for assessing drug response in cystic fibrosis patients. Journal of Visualized Experiments. (120), e55159 (2017).
- Regent, F., et al. Nicotinamide promotes formation of retinal organoids from human pluripotent stem cells via enhanced neural cell fate commitment. Frontiers in Cellular Neuroscience. 16, 878351 (2022).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Breau, K. A., et al. Efficient transgenesis and homology-directed gene targeting in monolayers of primary human small intestinal and colonic epithelial stem cells. Stem Cell Reports. 17 (6), 1493-1506 (2022).
- Berkers, G., et al. Rectal organoids enable personalized treatment of cystic fibrosis. Cell Reports. 26 (7), 1701-1708 (2019).
- deWinter-de Groot, K. M., et al. Forskolin-induced swelling of intestinal organoids correlates with disease severity in adults with cystic fibrosis and homozygous F508del mutations. Journal of Cystic Fibrosis. 19 (4), 614-619 (2020).
- Dekkers, J. F., vander Ent, C. K., Beekman, J. M. Novel opportunities for CFTR-targeting drug development using organoids. Rare Diseases. 1, 27112 (2013).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- van Mourik, P., Beekman, J. M., vander Ent, C. K. Intestinal organoids to model cystic fibrosis. European Respiratory Journal. 54 (1), 1802379 (2019).
- Tong, T., et al. Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells. Nanoscale. 12 (30), 16339-16347 (2020).
- Miyoshi, H., Stappenbeck, T. S. In vitro expansion and genetic modification of gastrointestinal stem cells in spheroid culture. Nature Protocols. 8 (12), 2471-2482 (2013).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nature Medicine. 15 (6), 701-706 (2009).
- Xu, Q., et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 116 (6), 883-895 (2004).
- Jabaji, Z., et al. Type I collagen as an extracellular matrix for the in vitro growth of human small intestinal epithelium. PLoS One. 9 (9), e107814 (2014).
- Sachs, N., Tsukamoto, Y., Kujala, P., Peters, P. J., Clevers, H. Intestinal epithelial organoids fuse to form self-organizing tubes in floating collagen gels. Development. 144 (6), 1107-1112 (2017).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados