Method Article
成像 ATG9A,一种多跨膜蛋白
摘要
该协议描述了有助于研究ATG9A生物学的各种方法,包括免疫荧光,然后进行图像分析,瞬时过表达考虑,以及使用蛋白质印迹研究ATG9A糖基化状态。
摘要
自噬是一种高度保守的途径,细胞用它来维持体内平衡、降解受损的细胞器、对抗入侵的病原体和在病理条件下生存。一组称为ATG蛋白的蛋白质组成了核心自噬机制,并在定义的层次结构中协同工作。近年来的研究提高了我们对自噬途径的了解。最近,有人提出ATG9A囊泡是自噬的核心,因为它们控制着一种称为吞噬团的细胞器的快速 从头 合成。ATG9A的研究已被证明具有挑战性,因为ATG9A是一种跨膜蛋白,并且它存在于不同的膜室中。因此,了解其贩运是理解自噬的重要因素。在这里,提出了可用于研究ATG9A的详细方法,特别是使用免疫荧光技术对其进行定位,可以对其进行评估和量化。还讨论了瞬时过度表达的缺陷。ATG9A功能的正确表征和分析其运输技术的标准化对于进一步表征控制自噬起始的事件至关重要。
引言
ATG9A 是核心自噬机制中唯一的跨膜蛋白,在高尔基体和胞质 ATG9A 囊泡区室之间运输,通过内体区室1 转运。长期以来,ATG9A一直是一个谜,最近被描述为一种脂质加扰酶,因为它平衡了膜双层上的脂质2,3。现在很明显,ATG9A 位于自噬体形成层次结构的顶部,因此,它的研究对于理解自噬至关重要 4,5。因此,ATG9A 囊泡最近被提议作为自噬体 6,7 的"种子"。然而,先前的研究表明,ATG9A仅在其成熟的不同步骤中与形成的自噬体短暂相互作用,并且不会整合到自噬膜中6,8,9,10,11。因此,需要进一步的研究来完全揭示ATG9A在自噬体形成中的作用和潜在的多种功能。然而,当前模型与先前数据之间的差异只能通过使用经过验证的定量方法和细胞内标记物解决ATG9A运输的靶向实验来解决。
有多种工具用于研究 ATG9A,每种工具都有优点和缺点,并且这些工具的使用因 ATG9A 的结构、分子功能和细胞运输而变得复杂 2,8,12。ATG9A 形成同源三聚体,被糖基化,并在整个细胞中运输到高尔基体、内体和质膜等区室13,14。鉴于其复杂的行程,在解释读数方面存在一些挑战,例如ATG9A在特定治疗或刺激(如营养和血清饥饿)下从高尔基体扩散。ATG9A在囊泡运输方面具有极强的动态性;事实上,在饥饿诱导的自噬背景下,含有 ATG9A 的囊泡已被定义为 ATG9A 区室。由这些动态囊泡形成的ATG9A区室与几个细胞内细胞器瞬时相互作用8,15,16,17。本文描述的技术,包括免疫荧光、活体成像和糖基化测定,应有助于检测和理解 ATG9A 生物学。特别是,本文中描述的方法将有助于解决有关定位到特定细胞区室以及与特定蛋白质伴侣和/或膜区室相互作用的问题。由于 ATG9A 疏水保守核心结构域(PFAM 结构域 PF04109)具有独特的拓扑结构和 ATG9A 在多个膜室之间循环,因此研究人员应注意瞬时过表达 ATG9A 时的某些陷阱和伪影,包括但不限于内质网 (ER) 保留。由于蛋白质的错误折叠、正常生长条件下的人工聚集或由于免疫荧光透化方案欠佳而导致的囊泡区室检测不足,可能会出现其他可能的问题。
在对内源性ATG9A进行成像时,必须注意样品制备和图像采集,以确保后续定量分析的质量和数据的正确解释。将本文中描述的技术与标准生化方法(例如此处未描述的免疫沉淀或下拉实验)相结合,应该可以提高我们对ATG9A功能的理解。该实验工具包旨在帮助新研究人员进行一些测定,以确定ATG9A在其生物系统中的功能。
研究方案
本研究中使用的所有试剂均可市售,但 ATG9A DNA 构建体和自制 STO-215 抗体(参见 材料表)除外,可根据要求提供。此处描述的分析工具基于开源软件(FIJI/ImageJ)18。
1. 细胞培养
- 将 T150 组织培养处理的烧瓶中的HEK293A细胞在补充有 10% FBS(胎牛血清)和 4 mM L-谷氨酰胺的高葡萄糖 DMEM(Dulbecco 改良 Eagle 培养基)中维持至 80%-90% 汇合(参见 材料表)。将细胞在37°C下在10%CO2的湿润组织培养箱中孵育。
注:本研究使用HEK293A细胞,因为它们在氨基酸饥饿时具有强大的典型自噬反应,特别是通过脂质化膜相关LC3 1,9,19的增加来检测,并且适用于成像。 - 通过使用血清移液管从烧瓶中吸出培养基来传代细胞。用 15 mL 1x PBS(磷酸盐缓冲盐水)或类似溶液洗涤细胞一次,然后加入 2 mL 胰蛋白酶-EDTA(乙二胺四乙酸)溶液以分离细胞。用 8 mL DMEM 收集分离的细胞,并接种回一定数量的细胞,以便在 2 天后达到 80%-90% 的汇合度,用于此处描述的实验。
2. ATG9A的内源性染色
- 将HEK293A细胞(或选择的细胞)接种在无菌的 1.5 号玻璃盖玻片上,放入 24 孔板中,使其在第二天汇合 ~80%。这通常在 500 μL DMEM 中得到 7 x 104 个细胞/孔。
注意:对于HEK293A细胞或其他松散贴壁的细胞系,需要在去离子水中用 0.1 mg/mL 的聚-D-赖氨酸包被盖玻片。在室温(RT)下将500μL聚-D-赖氨酸(参见 材料表)加入盖玻片的顶部,放入孔中10分钟,然后用去离子水洗涤三次,最后一次在DMEM中洗涤。包被后继续接种细胞,并注意它们在培养皿中均匀分布。 - 根据特定的实验条件(即,在EBSS [厄尔平衡盐溶液]中饥饿2小时)处理细胞。
注:EBSS组合物为溶解在蒸馏水中的1 g/L D-葡萄糖、6.8 g/L NaCl、0.4 g/L KCl、0.151 g/L CaCl 2.2H 2 O、0.2 g/L mM MgSO 4.7H 2 O、0.124 g/L NaH 2 HPO4.2H 2 O和2.2 g/LNaHCO 3(参见材料表)。 - 吸出培养基,并在室温下用补充有 0.1 mM CaCl 2 和 0.1 mM MgCl2 的 PBS 溶液的 500 μL 4% 甲醛溶液小心地更换 20 分钟以固定细胞。
- 从每个孔中吸出 4% 甲醛溶液,用 500 μL PBS 代替。重复此洗涤步骤三次。不要让盖玻片变干或没有液体。
- 在室温下使用 500 μL 的 50 mM NH4Cl 溶液在 PBS 中淬灭游离醛基团 10 分钟。
- 吸出PBS,并用500μL的50μg/ mL洋地黄皂苷溶液在PBS中(去离子水中的储备溶液1mg / mL,参见 材料表)在室温下5分钟以透化细胞。
- 从每个孔中吸出洋地黄皂苷溶液,并用 500 μL PBS 代替。重复此洗涤步骤三次。
- 从每个孔中吸出PBS,并在室温下用500μL封闭溶液(在PBS中稀释的5%BSA [牛血清白蛋白])替换30分钟。
- 吸出封闭溶液,并用 500 μL PBS 代替。
- 使用镊子,从孔中收集盖玻片,使用薄纸巾或纤维素滤纸小心地除去多余的PBS溶液,然后轻轻地将每个盖玻片,细胞面朝下,滴到50μL一抗溶液上(例如,亚美尼亚仓鼠14F2在1%BSA / PBS溶液中稀释至0.9μg/ mL,参见 材料表)。在室温下在加湿室中孵育1小时。
注意:为了便于处理,可以将抗体溶液滴放在另一个容器内的自密封热塑性薄膜(参见 材料表)上,而不是直接放在固体表面上。 - 使用镊子收集盖玻片,并使用薄纸巾轻轻排出多余的一抗溶液后,更换 24 孔板中的盖玻片(细胞面朝上),并用 PBS 洗涤三次。
- 重复步骤 2.10。使用镊子,从每个孔中收集盖玻片,用薄纸巾小心地排出多余的PBS,然后轻轻地将每个盖玻片(细胞面朝下)滴到50μL的二抗溶液上,该溶液在1%BSA / PBS溶液中以1:1,000稀释(例如,Cy3山羊抗亚美尼亚仓鼠IgG,其与牛,人,, 小鼠、兔和大鼠血清蛋白,参见 材料表)。在室温下在加湿室中孵育1小时。
注:可选:除二抗外,还可以使用细胞骨架标记物进行后续图像分析(即 Alexa Fluor 647 鬼笔环肽以 1:1,000 稀释,参见 材料表)。为了便于处理,可以将抗体溶液滴放在另一个容器内的密封膜上,而不是直接放在固体表面上。 - 使用镊子收集盖玻片,排出多余的二抗溶液后,将盖玻片放入 24 孔板(细胞面朝上)中,并用 500 μL PBS 洗涤 3 次。
- 使用镊子,收集盖玻片,用薄纸巾小心地排出多余的PBS,然后轻轻地将每个盖玻片(细胞面朝下)滴到PBS中的50μL滴1:4,000Hoechst溶液(Hoechst 33342)上。在室温下在湿度室中孵育5分钟。
注意:为了便于处理,可以将抗体溶液滴放在另一个容器内的密封膜上,而不是直接放在固体表面上。 - 使用镊子收集盖玻片,并使用薄纸巾轻轻排出多余的Hoechst溶液后,更换24孔板中的盖玻片,并用PBS洗涤三次,用去离子水洗涤一次(每次洗涤500μL)。
- 使用薄纸巾小心地排出多余的去离子水,然后轻轻地将每个盖玻片(细胞面朝下)放在10-20μL的安装溶液滴(参见 材料表)上,该溶液点在显微镜载玻片上进行免疫荧光,避免气泡的形成。
注意:此处使用的封固剂具有与浸油相同的折射率,并在室温下或在4°C下过夜数小时后变硬。 可以使用非硬化安装解决方案,但必须注意用指甲油密封盖玻片。 - 通过抽吸除去多余的封片溶液,让样品在室温下在黑暗中平放过夜,放在载玻片架中或用铝箔覆盖。
3.图像采集
- 打开共聚焦显微镜。打开成像软件(参见 材料表)以开始图像采集设置。
- 在 功能 选项卡中,选择 Plan-Apochromat 63x/1.4 Oil DIC M27 物镜以捕获图像进行分析。
- 在采集功能选项卡中,打开控制面板激光区域中的相应激光器(氩气、二极管-405-30、DPSS 561-10 和氦氖633)。
- 在控制面板的"成像设置"区域中,创建四个轨道,每个轨道对应一个通道,以执行顺序采集。
- 在"采集模式"窗口中设置图像的适当分辨率。将分辨率设置为 1,024 x 1,024(帧大小),然后选择 16 位的位深度。
- 对于每个通道,调整激光功率和增益以获得良好的信号,而不会出现饱和像素,这会阻碍图像强度分析。使用实时按钮,设置激光输出电平和增益(主)。
注意: 建议使用范围指示器选项进行饱和像素检测。将激光功率保持在 1% 到 10% 之间,增益(主)保持在 850 以下,以避免背景噪音。 - 在控制面板的通道区域中,为每个通道设置相同的针孔孔径,为波长最高的通道考虑 1 个艾里单元 (AU)。
- 获取 10 个包含相似数量细胞的随机字段(每个字段 20-30 个细胞)。每种条件下采集 100-200 个细胞将为以后的图像分析提供良好的功率。
4. ATG9A色散的图像分析
- 从互联网下载FIJI软件(见材料表)。通过单击 Bio-Formats > BioFormats Importer > 插件打开带有 FIJI 的图像。
- 单击" 分析>设置测量值",然后在测量窗口中选择 "平均灰度"值 以进行强度分析。
- 单击 "图像>颜色>拆分通道",并将通道分成三个图像(高尔基体标记、细胞骨架、ATG9A 信号)。
- 转到 "图像">"调整>阈值",然后在通道中定义与高尔基标记对应的阈值。
- 单击" 编辑>选择">"创建选择",然后从二进制映像创建选择。
- 转到 "编辑>选择">添加到管理器>重命名 (高尔基体),将选择保存在 ROI 管理器中,然后将其重命名为高尔基体。
- 单击 "图像">"调整>阈值",并在与细胞骨架标记物对应的通道中定义阈值以定义细胞轮廓。
- 转到 "编辑>选区">"创建选区",然后从二进制映像创建选区。
- 单击 "编辑>选择">"添加到管理器">重命名 (总计)),将选择保存在 ROI 管理器中,然后将其重命名为"总计"。
- 选择与ATG9A染色相对应的图像。
- 在" 分析>测量"中,通过单击应用 ROI 高尔 基体,并测量高尔基体区域的强度。
- 单击" 分析>测量",单击它来应用 "ROI Total ",然后测量"Total"区域的强度。
- 在所有图像中重复该过程,将结果另存为 .csv 文件,并使用以下公式处理数据:
ATG9A扩散速率=高尔基体强度/总强度
5. ATG9A构建体的活细胞成像
- 将 HEK293A 细胞(或选择的细胞)在 2 mL 培养基中接种到 60 mm 组织培养皿中,使其在第二天达到 ~65%-70% 汇合度;这通常给出 1 x 10 6-2 x 106 个细胞。
- 第二天,按如下方式制备Lipofectamine:DNA混合物(或合适的替代DNA转染试剂,参见 材料表):
- 根据构建体表达效率,将 0.5-2 μg 质粒 DNA 稀释到 100 μL 合适的无血清培养基中,并通过上下移液轻轻混合溶液。将混合物在室温下孵育 5 分钟。
注:质粒DNA构建体具有实验特异性。研究人员可以自己克隆,也可以根据要求从作者那里获得。 - 将 Lipofectamine 2000 转染试剂以 3:1 的比例将 Lipofectamine:DNA 稀释到 100 μL 合适的无血清培养基中,并通过上下移液轻轻混合溶液。在室温下孵育该混合物 5 分钟。
- 通过轻轻上下移液并在室温下孵育 20 分钟,将两种溶液混合在一起。
- 根据构建体表达效率,将 0.5-2 μg 质粒 DNA 稀释到 100 μL 合适的无血清培养基中,并通过上下移液轻轻混合溶液。将混合物在室温下孵育 5 分钟。
- 将 Lipofectamine:DNA 混合物添加到每个含有 4 mL 生长培养基的细胞培养板中,轻轻来回摇动板以均匀分布混合物。将细胞在37°C下在10%CO2的湿润细胞培养箱中孵育。
- 转染后4小时用新鲜生长培养基替换培养基,并将细胞在37°C下在10%CO2 的湿润细胞培养箱中孵育过夜。
- 第二天,胰蛋白酶消化,计数,并在适合活细胞显微镜的培养皿上重新接种细胞(用1.5号玻璃盖玻片培养皿,参见材料表)。将 0.4 x 10 6-0.7 x 106 个细胞接种到培养皿上,以在成像时在盖玻片上达到 ~60%-75% 的汇合度。
注意:如步骤2.1所述,建议对HEK293A细胞使用聚-D-赖氨酸包被。 - 第二天(转染后48小时),对细胞进行成像。
6. 研究ATG9A的糖基化状态
- 如果计划研究内源性 ATG9A,则将 HEK293A 细胞(或选择的细胞)接种在 10 cm 组织培养皿中,以便它们在第二天达到 ~80% 汇合度,这通常在 10 mL 中提供 1.5 x 10 6-2.5 x 106 个细胞。或者,如果转染 ATG9A 构建体,则接种细胞,使其达到 ~65%-70% 汇合度,这通常在 10 mL 中得到 1 x 10 6-1.5 x 106 个细胞。
- 第二天用100μg/ mL环己酰胺(CHX,参见 材料表)或载体处理细胞。孵育24小时(或直到所需的时间点)。
- 从培养箱中取出细胞,吸出培养基,然后置于冰上。用 5 mL 冰冷的 1x PBS 代替。使用细胞刮刀将细胞从培养皿中物理分离,并将 PBS 细胞溶液移液到 15 mL 锥形底管中。在4°C下以800× g 离心5分钟以沉淀细胞。
- 吸出上清液,将细胞重悬于~100μL(取决于细胞沉淀的大小)冰冷的TNTE裂解缓冲液(1%Triton,150mM NaCl,20mM Tris-HCl,pH 7.4,0.5mM EDTA)中,补充有蛋白酶抑制剂混合物片剂(参见 材料表),并转移到1.5mL微量离心管中。
- 将裂解物在冰上孵育15分钟。之后,将裂解物在4°C下以20,000× g 离心10分钟以沉淀细胞核和不溶性碎片,并将上清液转移到新鲜的微量离心管中。
- 使用Bradford方法20 和可在595nm波长下测量的分光光度计定量裂解物的蛋白质浓度。
- 将蛋白质量归一化,并根据制造商的说明将 16 μL 裂解物(总共含有不超过 100 μg 蛋白质)与 5x PNGase F(肽:N-糖苷酶 F)缓冲液混合,然后加入 1 μL PNGase F 酶(参见 材料表)。按照PNGase F制造商的指示孵育。
- 加入体积的3x Laemmli样品缓冲液以达到1x浓度,并在65°C下孵育5分钟,然后使用Tris-乙酸盐凝胶进行电泳,以最大限度地分离蛋白质。使用标准蛋白质印迹方案21 将蛋白质从凝胶转移到合适的膜(即PVDF [聚偏二氟乙烯])上(参见 材料表)。
注意:在95°C下煮沸样品将导致ATG9A聚集,从而降低ATG9A的检测。 - 使用ATG9A特异性抗体(STO-215抗体,内部生产1)进行蛋白质印迹(参见 材料表)。将膜的高分子量部分保留为未切割,以可视化较高的ATG9A分子量物质。
结果
ATG9A 是一种跨膜蛋白,与多个细胞内膜区室8、17、22、23、24 相关。在基础条件下,ATG9A主要定位于反式高尔基体网络(TGN),如内源性蛋白的免疫荧光和与顺式高尔基体标志物GM130的重叠(图1A)以及与内吞循环区(ERC)部分重叠的小囊泡所示23。可以使用不同的免疫荧光方案检测高尔基体的ATG9A定位。然而,ATG9A的囊泡部分,以及其定位的变化,特别是囊泡池的增加,对特定刺激(如营养和血清饥饿)的响应,在强度上可能有很大的变化,并且难以用传统的成像方法可视化。定位于高尔基体的 ATG9A 与定位于囊泡部分的 ATG9A 之间的比率称为 ATG9A 分散速率。为了检测ATG9A扩散速率的变化,例如在EBSS处理(用于消耗血清和氨基酸)时,高尔基体标记物(如GM130或TGN46)和细胞骨架标记物(如鬼笔环肽)染色细胞轮廓25,可用于轻松量化ATG9A分散(图1B)。重要的是,平均荧光比分析只能解释为条件之间的比较测量,而不是固定的扩散速率。区室之间的比率高度依赖于生物学和非生物学因素,例如所用的细胞系、染色质量或应用的阈值方法(图 1B)。出于这个原因,研究人员需要建立一个能够在其特定实验条件下检测ATG9A高尔基体富集的管道,然后使用相同的参数将分析扩展到要分析的集合中的所有图像。图1B所示为ATG9A平均荧光分析的代表性二元图像和区域。
ATG9A 具有多个跨膜结构域,两侧是两个相对灵活且非结构化的 N 端和 C 端结构域,其中 C 端序列几乎包含蛋白质的一半12。重要的是,过表达的ATG9A的定位模式可以受到标记的蛋白质末端的影响(图2A)。特别是,当使用瞬时表达系统并用荧光标签(例如eGFP、mRFP或衍生物)直接在其N末端标记ATG9A时,其高尔基体定位可能会部分受损,在基础(即喂养)条件下观察到的富集较少,而ATG9A囊泡仍然很容易看到(图2A)。在其 C 末端标记 ATG9A 似乎会略微诱导更大的 GFP 阳性簇,这些簇可以聚集。最后,mRFP-ATG9A的单体版本在过表达的细胞中也显示出类似的囊泡荧光簇和少量高尔基体染色(图2A)。
ATG9A 在转运到高尔基体和 ATG9A 囊泡之前在内质网膜中折叠。在内质网中驻留期间,ATG9A 被天冬酰胺 99 上的 N-连接聚糖修饰,然后在到达高尔基体时,获得复杂的成熟 N 连接聚糖 1,14。糖基化的这种修饰可以通过蛋白质印迹检测,通过双条带的出现14。与其细胞内定位一致,大多数内源性ATG9A含有复杂的N-连接聚糖,因此,高分子量条带占主导地位,也可见微弱的低分子量条带(图2B)。当使用Tris-乙酸盐凝胶提高高分子量蛋白质的分辨率时,最容易看到双条带的存在(图2B,对照,t = 0)。当内源性蛋白质经受PNGase F(肽:N-糖苷酶F)处理时,去除大部分复杂的N-连接聚糖,蛋白质作为单条带运行(图2B,PNGase F,t = 0)。因此,ATG9A的N-连接糖基化状态可以作为监测ATG9A从内质网到高尔基体的退出的代理,这反映在两个条带之间的相对比率上。
当瞬时转染 mRFP-ATG9A 构建体时,过表达的蛋白最初在内质网中积累,可能是因为运输机制无法折叠和运输所有 ATG9A,并且低分子量条带占主导地位(图 2C,对照 t = 0)。值得注意的是,在mRFP-ATG9A表达24小时后,上条带和下条带之间的分布大致相等,表明mRFP-ATG9A池正在进入高尔基体(图2C,对照,t = 24)。如果用环己酰亚胺 (CHX) 处理细胞,其阻断从头蛋白质合成26,则可以澄清 ATG9A 从 ER 的折叠和退出。由于内源性蛋白质被折叠,糖基化并驻留在高尔基体中,用CHX处理不会显着改变低分子量和高分子量条带的比率(图2B,对照)。然而,使用mRFP-ATG9A的瞬时表达,CHX处理促进了高分子量条带的积累(图2C,对照,CHX t = 24)。用PNGase F处理后,较高分子量过表达的mRFP-ATG9A条带塌陷到较低的条带中(图2C,PNGase F,t = 24)。这些数据表明,内源性蛋白质迅速获得成熟的聚糖,这反映在高分子量条带的优势上,并且CHX追逐不影响双条带的比率(图2B)。在瞬时过表达mRFP-ATG9A的情况下,CHX处理诱导上条带的积累,表明随着内质网池折叠并离开内质网到高尔基体,获得更成熟的聚糖(图2C)。
在ATG9A序列和荧光标签之间添加连接子有助于促进蛋白质的生理定位和运输。在 N 末端荧光基团和 ATG9A 之间融合 3x-FLAG 序列(24 个氨基酸)有助于过表达蛋白的行为与内源性蛋白相似(图 3)。事实上,在进料条件下,过表达的mCherry-3xFLAG-ATG9A与高尔基体标记物GM130共定位(图3A)。重要的是,这种定位和ATG9A囊泡室随着时间的推移而保留,从而可以对ATG9A的运输进行时空研究(图3B)。
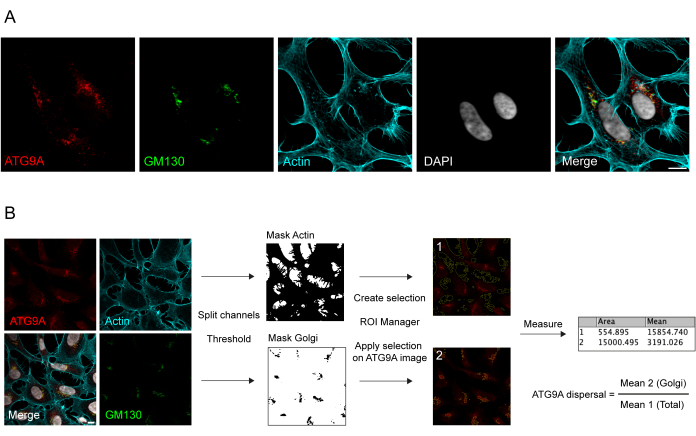
图 1:内源性 ATG9A 定位的图像分析。 (A) 内源性 ATG9A(红色)、GM130 作为高尔基体标志物(绿色)和鬼笔环肽的代表性免疫荧光图像,以可视化肌动蛋白细胞骨架(青色)。比例尺 = 10 μm。(B) 图像分析的工作流程,以确定位于高尔基体区域的内源性 ATG9A 的比例。比例尺 = 10 μm。请点击这里查看此图的较大版本.
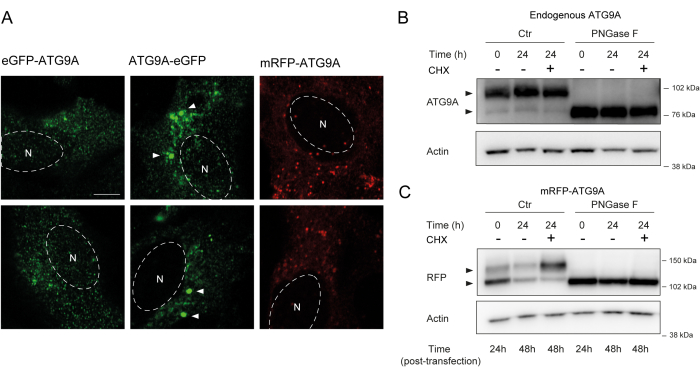
图 2:通过定位和糖基化分析荧光 标记的 ATG9A 构建体。 (A) eGFP N-末端标记的ATG9A在高尔基体的定位较少,主要驻留在囊泡中。eGFP C末端标记的ATG9A在细胞内表现出聚集体(一些例子用白色箭头标记;eGFP-ATG9A和ATG9A-eGFP为绿色)。mRFP N 末端标记的 ATG9A 在高尔基体的定位较少,主要驻留在囊泡中。N 表示细胞核的大致位置,mRFP-ATG9A 为红色。比例尺 = 5 μm。(B) 当通过蛋白质印迹(箭头)分析时,内源性 ATG9A 显示为两个条带:上条带(复合 N-连接聚糖)和下条带(无成熟 N 连接聚糖)。用环己胺(CHX)治疗不影响上条带和下条带之间的比率。用PNGase F治疗会导致上带消失。(C) 在HEK293A细胞中瞬时转染 mRFP 标记的 ATG9A 后,在蛋白质印迹上可见两条明显的条带(箭头)。用PNGase F治疗会导致上带消失。转染后用CHX处理导致糖基化增加,因为转染的ATG9A池从内质网转运到高尔基体。 请点击这里查看此图的较大版本.
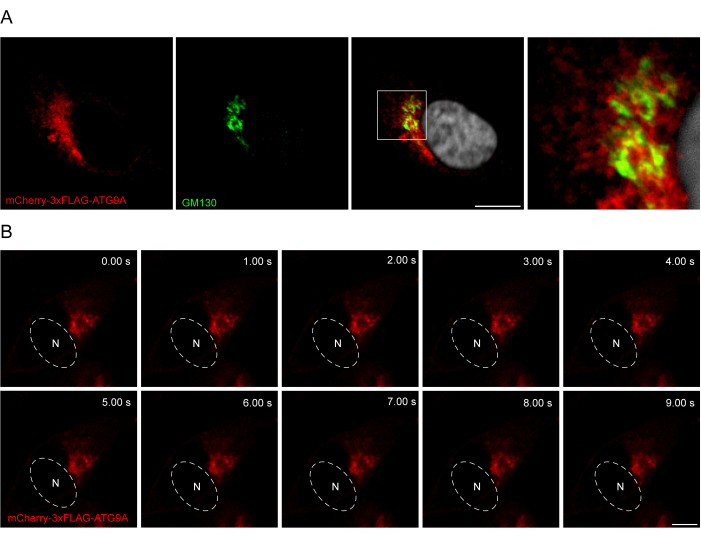
图 3:通过免疫荧光和活体成像分析 mCherry-3xFLAG-ATG9A 定位。 (A) 瞬时过表达 mCherry-3xFLAG-ATG9A 并用高尔基体标记物 GM130 染色的HEK293A细胞的免疫荧光实验。比例尺 = 10 μm。mCherry-3xFLAG-ATG9A 为红色,GM130 高尔基体标记为绿色。(B) 瞬时过表达 mCherry-3xFLAG-ATG9A 的 HEK293A 细胞活体成像实验的蒙太奇。N 表示细胞核的大致位置。时间范围 = 1 fps。比例尺 = 10 μm。mCherry-3xFLAG-ATG9A 为红色。请点击这里查看此图的较大版本.
讨论
本研究说明了可用于研究 ATG9A 定位的各种工具。首先,本研究描述了如何通过免疫荧光可视化ATG9A以及如何对其进行量化。其次,比较了可用于用荧光标记物标记ATG9A以在固定细胞或活细胞中可视化的策略。最后,本文描述了如何研究和使用 ATG9A 的糖基化状态来确定 ATG9A 是否已经退出内质网并通过高尔基体运输。
关于通过免疫荧光表征内源性ATG9A定位,必须注意实验采用的固定和透化方法。根据此处描述的标准程序,多聚甲醛固定与洋地黄皂苷通透相结合是可视化高尔基体相关 ATG9A 和 ATG9A 阳性囊泡的良好条件7。除了固定和透化外,与一抗溶液一起孵育的时机也至关重要。我们已经观察到,但尚未记录,较高浓度的一抗溶液和较长的孵育时间会导致 ATG9A 的高尔基体染色出现错误描述性增加,最终影响 ATG9A 重新分布到其他膜室的检测。此外,由于 ATG9A 存在于许多细胞内区室1、13、17、22、23、24、27、28 中,因此使用特定的膜标记物和 ATG9A 来识别 ATG9A 的位置非常重要。过去曾使用过几种方法来量化 ATG9A 定位,包括共定位的 Pearson 相关系数29。然而,ATG9A与高尔基体的部分重叠以及明显的囊泡室导致了大量的像素异常值,这可能会使相关系数的解释产生偏差。出于这个原因,首选基于待分析的两个隔室中平均荧光比率的更简单的方法,并且这种方法对细胞间变异性不太敏感。有关通过显微镜进行图像分析的更多信息,请将读者引导至本书第30 章。
在研究ATG9A的糖基化状态时,选择用于运行蛋白质印迹的凝胶非常重要。对于该方案,首选3%-8%Tris-乙酸凝胶,因为它们为较大的蛋白质提供最高分辨率,但也可以使用替代凝胶组合物或电泳缓冲液,以提供高分子量蛋白质的良好分离。实验者可以通过增加电泳时间来确保蛋白质的最大分离。
当制备样品以在蛋白质印迹上可视化ATG9A时,应注意不要在加入Laemmli缓冲液后煮沸样品;在95°C下沸腾诱导ATG9A聚集体的形成,随后,ATG9A不能有效地迁移到凝胶1中。建议在65°C下加热样品5分钟27。
高水平的转染通常会导致 ATG9A 在内质网中的更高积累,而中等表达水平有助于蛋白质的生理定位。有趣的是,72 小时而不是 48 小时的孵育时间通常有助于减少 ER 定位伪影。值得注意的是,mRFP-ATG9A 可以准确报告 ATG9A 运输和功能,如果通过表达水平或使用稳定细胞系8、9、22、27 来控制水平。
过表达的 ATG9A 群体未能获得成熟的 N-连接聚糖可用作 ATG9A 转运受干扰的读数。当突变或删除ATG9A的某些区域时,存在内质网保留增加的风险,这可能导致无法获得成熟的N-连接聚糖,从而导致蛋白质印迹上ATG9A条带迁移更快。使用截短的 ATG9A 构建体的研究人员应检查内质网保留、糖基化状态和高尔基体定位。
对于ATG9A的活细胞成像,Airyscan显微镜依靠快速Airyscan功能,提供通常约为120 nm的最佳分辨率。为了实现定位精度,在超分辨率模式下,帧速率约为每秒 1-2 帧 (fps),具体取决于成像的通道数。类似的可以高速成像的共聚焦显微镜也可用于ATG9A囊泡的成像;但是,应该注意的是,成像速度会直接影响事件的检测,从而影响数据的解释。
总之,所提出的方案描述了通过免疫荧光、活细胞显微镜及其糖基化状态量化和表征ATG9A定位的方法。这些协议可以帮助研究人员使用ATG9A,并帮助避免一些陷阱。
披露声明
S.A.T. 是 Casma Therapeutics 的科学顾问委员会成员。
致谢
作者感谢Rocco D'Antuono对手稿的校对,以及自噬分子细胞生物学(MCBA)实验室的所有现任和前任成员的讨论,这些讨论导致了这些协议的完善。A. V.V., S.D.T., E.A., S.A.T, 得到了弗朗西斯·克里克研究所的支持,该研究所的核心资金来自英国癌症研究中心 (CC2134)、英国医学研究委员会 (CC2134)。这项研究全部或部分由Wellcome Trust(CC2134)资助。出于开放获取的目的,作者已将 CC BY 公共版权许可应用于由此提交产生的任何作者接受的手稿版本。
材料
| Name | Company | Catalog Number | Comments |
| 24 multiwell plates | Falcon | 353047 | For tissue culture |
| 35 mm Dish | No. 1.5 Coverslip | 14 mm Glass Diameter | Uncoated | MATTEK | P35G-1.5-14-C | Cell culture dish for live-cell microscopy |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 60 mm tissue culture dish | Thermofisher Scientific | 10099170 | For tissue culture |
| Alexa Fluor 647 Phalloidin | Thermofisher Scientific | A22287 | Actin stain |
| anti-ATG9A antibody | home made | STO-215 | Rabbit anti N-terminal peptide ATG9A |
| anti-Rabbit IgG, peroxidase-linked | Invitrogen | 10794347/NA934-1ml | Secondary antibody for rabbit polyclonal STO-215 |
| anti-RFP antibody | Evrogen | AB233 | for Western Blot |
| ATG9A Monoclonal Antibody (14F2 8B1), Invitrogen | Invitrogen | 15232826 | Antibody for immunofluorescence |
| ATG9A-eGFP | home made | Construct which expresses tagged ATG9A | |
| Bemis Parafilm | Thermofisher Scientific | 11747487 | self-sealing thermoplastic film |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | For determining protein concentration |
| Bovine serum albumin (BSA) | Merck | 10735086001 | For blocking non-specific labelling |
| CaCl2.2H2O | / | For PBS and EBSS | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | Supplement in lysis buffer to prevent protein degradation |
| Cy3 AffiniPure Goat Anti-Armenian Hamster IgG | Jackson ImmunoResearch | 127-165-099 | Secondary antibody for i14F2 8B1 antibody for mmunofluorescence |
| Cyclohexamide | Sigma Aldrich | 66-81-9 | To stop protein translation |
| D-Glucose | / | For EBSS | |
| Digitonin | Merck | 300410 | For permeabilizing cells |
| DMEM | Merck | D6546-6x500ml | For tissue culture |
| eGFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Fetal Bovine Serum | Gibco | 10270-106 | Supplement for DMEM for cell culture |
| FIJI (ImageJ) | / | https:/fiji.sc/ | Open source image analysis software |
| Hoechst | Thermofisher Scientific | H3570 | Stains the nucleus |
| KCl | / | For EBSS | |
| L-glutamine | Sigma | 67513 | For tissue culture |
| Lipofectamine 2000 | Invitrogen | 11668-019 | For Cell Transfection |
| LSM880 Airyscan microscope | Zeiss | / | Confocal microscopy |
| MgCl2 | / | For PBS | |
| MgSO4.7H2O | / | For EBSS | |
| Mowiol mounting solution | Millipore | 475904 | for permanent mounting glass coverslips |
| NaCl | / | For EBSS | |
| NaH2PO4.2H2O | / | For EBSS | |
| NaHCO3 | / | For EBSS | |
| NuPAGE 3 to 8%, Tris-Acetate, 1.5 mm, Mini Protein Gels | Thermofisher Scientific | EA0378BOX | for Western Blotting |
| NuPAGE MES SDS Running Buffer (20x) | Life Tech | NP0002 | for Western Blotting |
| Opti-MEM I Reduced Serum Medium | Thermofisher Scientific | 31985062 | For Cell Transfection |
| Paraformaldehyde | Agar Scientific | R1026 | For fixing cells |
| pcDNA3.1-mCherry-3xFlag-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Phosphate Buffered Saline (PBS) | / | For tissue culture | |
| PNGaseF | NEB | P0710S | To remove N-linked glycans |
| Poly-D-lysine hydrobromide mol wt 70,000-150,000 | Merck | P0899 | For coating coverslips |
| Rapid PNGase F enzyme | NEB | P07105 | To remove N-linked glycans |
| RFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Triton X-100 | Thermofisher Scientific | 13454259 | Detergent for Cell lysis |
| Trypsin-EDTA solution | Sigma | T4049 | For tissue culture |
| Whatman Filter Paper | Merck | WHA1001325 | For Western Blot and IF |
| XCell SureLock Mini-Cell Electrophoresis System | Invitrogen | EI0001 | For Western Blotting |
| Zen Black edition | Zeiss | / | Used to operate the LSM 880 |
参考文献
- Young, A. R., et al. Starvation and ULK1-dependent cycling of mammalian Atg9 between the TGN and endosomes. Journal of Cell Science. 119, 3888-3900 (2006).
- Maeda, S., et al. lipid scrambling activity and role in autophagosome formation of ATG9A. Nature Structural & Molecular Biology. 27 (12), 1194-1201 (2020).
- Matoba, K., et al. Atg9 is a lipid scramblase that mediates autophagosomal membrane expansion. Nature Structural & Molecular Biology. 27 (12), 1185-1193 (2020).
- Mercer, T. J., Gubas, A., Tooze, S. A. A molecular perspective of mammalian autophagosome biogenesis. Journal of Biological Chemistry. 293 (15), 5386-5395 (2018).
- Yamamoto, H., Zhang, S., Mizushima, N. Autophagy genes in biology and disease. Nature Reviews: Genetics. , (2023).
- Sawa-Makarska, J., et al. Reconstitution of autophagosome nucleation defines Atg9 vesicles as seeds for membrane formation. Science. 369 (6508), (2020).
- Melia, T. J., Lystad, A. H., Simonsen, A. Autophagosome biogenesis: From membrane growth to closure. Journal of Cell Biology. 219 (6), 202002085 (2020).
- Orsi, A., et al. Dynamic and transient interactions of Atg9 with autophagosomes, but not membrane integration, are required for autophagy. Molecular Biology of the Cell. 23 (10), 1860-1873 (2012).
- Judith, D., et al. ATG9A shapes the forming autophagosome through Arfaptin 2 and phosphatidylinositol 4-kinase IIIbeta. Journal of Cell Biology. 218 (5), 1634-1652 (2019).
- Karanasios, E., et al. Autophagy initiation by ULK complex assembly on ER tubulovesicular regions marked by ATG9 vesicles. Nature Communications. 7, 12420 (2016).
- Koyama-Honda, I., Itakura, E., Fujiwara, T. K., Mizushima, N. Temporal analysis of recruitment of mammalian ATG proteins to the autophagosome formation site. Autophagy. 9 (10), 1491-1499 (2013).
- Guardia, C. M., et al. Structure of human ATG9A, the only transmembrane protein of the core autophagy machinery. Cell Reports. 31 (13), 107837 (2020).
- Soreng, K., et al. SNX18 regulates ATG9A trafficking from recycling endosomes by recruiting Dynamin-2. EMBO Reports. 19 (4), e44837 (2018).
- Staudt, C., Gilis, F., Boonen, M., Jadot, M. Molecular determinants that mediate the sorting of human ATG9A from the endoplasmic reticulum. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1863 (9), 2299-2310 (2016).
- Knaevelsrud, H., Carlsson, S. R., Simonsen, A. SNX18 tubulates recycling endosomes for autophagosome biogenesis. Autophagy. 9 (10), 1639-1641 (2013).
- Takahashi, Y., et al. The Bif-1-Dynamin 2 membrane fission machinery regulates Atg9-containing vesicle generation at the Rab11-positive reservoirs. Oncotarget. 7 (15), 20855-20868 (2016).
- Imai, K., et al. Atg9A trafficking through the recycling endosomes is required for autophagosome formation. Journal of Cell Science. 129 (20), 3781-3791 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- van Vliet, A. R., et al. ATG9A and ATG2A form a heteromeric complex essential for autophagosome formation. Molecular Cell. 82 (22), 4324-4339 (2022).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Bradford assay for determining protein concentration. Cold Spring Harbor Protocols. 2020 (4), 102269 (2020).
- Kurien, B. T., Scofield, R. H. Validating antibody specificities for immunohistochemistry by protein blotting. Methods in Molecular Biology. 2593, 21-33 (2023).
- Lamb, C. A., et al. TBC1D14 regulates autophagy via the TRAPP complex and ATG9 traffic. EMBO Journal. 35 (3), 281-301 (2016).
- Longatti, A., et al. TBC1D14 regulates autophagosome formation via Rab11- and ULK1-positive recycling endosomes. Journal of Cell Biology. 197 (5), 659-675 (2012).
- Ravussin, A., Brech, A., Tooze, S. A., Stenmark, H. The phosphatidylinositol 3-phosphate-binding protein SNX4 controls ATG9A recycling and autophagy. Journal of Cell Science. 134 (3), (2021).
- DesMarais, V., Eddy, R. J., Sharma, V. P., Stone, O., Condeelis, J. S. Optimizing leading edge F-actin labeling using multiple actin probes, fixation methods and imaging modalities. BioTechniques. 66 (3), 113-119 (2019).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of inhibition of protein synthesis in mammalian cells. Science. 146 (3650), 1474-1476 (1964).
- Webber, J. L., Tooze, S. A. Coordinated regulation of autophagy by p38alpha MAPK through mAtg9 and p38IP. EMBO Journal. 29 (1), 27-40 (2010).
- Claude-Taupin, A., et al. ATG9A protects the plasma membrane from programmed and incidental permeabilization. Nature Cell Biology. 23 (8), 846-858 (2021).
- Aaron, J. S., Taylor, A. B., Chew, T. L. Image co-localization - Co-occurrence versus correlation. Journal of Cell Science. 131 (3), 211847 (2018).
- D'Antuono, R., Nechyporuk-Zloy, V. Basic digital image acquisition, design, processing, analysis, management, and presentation. Principles of Light Microscopy: From Basic to Advanced. , 77-104 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。