Method Article
Çok Kapsamlı Bir Membran Proteini Olan ATG9A'nın Görüntülenmesi
Bu Makalede
Özet
Bu protokol, immünofloresan ve ardından görüntü analizi, geçici aşırı ekspresyon hususları ve western blot kullanılarak ATG9A glikozilasyon durumunun araştırılması dahil olmak üzere ATG9A biyolojisinin incelenmesine yardımcı olabilecek çeşitli yöntemleri açıklar.
Özet
Otofaji, hücrenin homeostazı korumak, hasarlı organelleri parçalamak, istilacı patojenlerle savaşmak ve patolojik durumlardan kurtulmak için kullandığı yüksek oranda korunmuş bir yoldur. ATG proteinleri adı verilen bir dizi protein, çekirdek otofaji mekanizmasını oluşturur ve tanımlanmış bir hiyerarşide birlikte çalışır. Son yıllarda yapılan çalışmalar otofaji yolu hakkındaki bilgilerimizi geliştirmiştir. Son zamanlarda, ATG9A veziküllerinin, fagofor adı verilen bir organelin hızlı de novo sentezini kontrol ettikleri için otofajinin kalbinde olduğu öne sürülmüştür. ATG9A'nın çalışmasının zor olduğu kanıtlanmıştır, çünkü ATG9A bir transmembran proteinidir ve farklı membran bölmelerinde bulunur. Bu nedenle, kaçakçılığını anlamak, otofajiyi anlamak için önemli bir unsurdur. Burada, ATG9A'yı ve özellikle değerlendirilebilen ve ölçülebilen immünofloresan teknikleri kullanılarak lokalizasyonunu incelemek için kullanılabilecek ayrıntılı yöntemler sunulmaktadır. Geçici aşırı ifadenin tuzakları da ele alınmaktadır. ATG9A fonksiyonunun doğru karakterizasyonu ve trafiğini analiz etmek için tekniklerin standardizasyonu, otofaji başlangıcını yöneten olayları daha fazla karakterize etmek için çok önemlidir.
Giriş
ATG9A, çekirdek otofaji mekanizmasının tek transmembran proteinidir ve endozomal bölme1'den geçerek Golgi ile sitozolik bir ATG9A vezikül bölmesi arasında kaçakçılığı yapılır. Uzun zamandır esrarengiz olan ATG9A'nın, membran çift katmanları 2,3 boyunca lipitleri dengelediği için son zamanlarda bir lipit scramblase olarak işlev gördüğü tanımlanmıştır. ATG9A'nın otofagozom oluşumunda hiyerarşinin en üstünde yer aldığı ve bu nedenle çalışmasının otofajiyi anlamak için hayati önem taşıdığıaçıktır 4,5. Bu nedenle, ATG9A vezikülleri yakın zamanda otofagozom 6,7'nin "tohumu" olarak önerilmiştir. Bununla birlikte, önceki çalışmalar, ATG9A'nın olgunlaşmasının farklı aşamalarında oluşan otofagozom ile yalnızca geçici olarak etkileşime girdiğini ve otofajik membran 6,8,9,10,11 ile bütünleşmediğini göstermiştir. Bu nedenle, ATG9A'nın otofagozom oluşumundaki rolünü ve potansiyel çoklu fonksiyonlarını tamamen çözmek için daha fazla araştırmaya ihtiyaç vardır. Bununla birlikte, mevcut modeller ile önceki veriler arasındaki tutarsızlık, yalnızca doğrulanmış kantitatif yaklaşımlar ve hücre içi belirteçler kullanılarak ATG9A'nın kaçakçılığını ele alan hedefli deneylerle çözülebilir.
ATG9A'yı incelemek için her biri avantaj ve dezavantajlara sahip çeşitli araçlar vardır ve bu araçların kullanımı ATG9A'nın yapısı, moleküler işlevi ve hücresel trafiğinedeniyle karmaşıktır 2,8,12. ATG9A bir homotrimer oluşturur, glikosile edilir ve hücre boyunca Golgi, endozomlar ve plazma zarı13,14 gibi bölmelere aktarılır. Karmaşık güzergahı göz önüne alındığında, belirli tedaviler veya uyaranlar (besin ve serum açlığı gibi) üzerine Golgi'den ATG9A dağılımı gibi okumaları yorumlamada çeşitli zorluklar vardır. ATG9A, veziküler kaçakçılık açısından son derece dinamiktir; gerçekten de, ATG9A içeren veziküller, açlığa bağlı otofaji bağlamında ATG9A bölmesi olarak tanımlanmıştır. Bu dinamik veziküller tarafından oluşturulan ATG9A bölmesi, birkaç hücre içi organel 8,15,16,17 ile geçici olarak etkileşime girer. İmmünofloresan, canlı görüntüleme ve glikozilasyon deneyleri dahil olmak üzere burada açıklanan teknikler, ATG9A biyolojisinin saptanmasına ve anlaşılmasına yardımcı olmalıdır. Özellikle, bu makalede açıklanan yaklaşımlar, belirli hücresel bölmelere lokalizasyon ve belirli protein ortakları ve/veya zar bölmeleri ile etkileşimler hakkındaki soruların ele alınmasına yardımcı olacaktır. ATG9A hidrofobik korunmuş çekirdek alanı (PFAM etki alanı PF04109) benzersiz bir topolojiye ve ATG9A'nın birkaç zar bölmesi arasında döngülerine sahip olduğundan, araştırmacılar ATG9A'yı geçici olarak aşırı eksprese ederken endoplazmik retikulum (ER) retansiyonu dahil ancak bunlarla sınırlı olmamak üzere bazı tuzakların ve artefaktların farkında olmalıdır. Proteinin yanlış katlanması, normal yetiştirme koşullarında artefakt agregasyonu veya immünofloresan için suboptimal geçirgenlik protokolleri nedeniyle veziküler bölmenin yetersiz tespiti nedeniyle diğer olası sorunlar ortaya çıkabilir.
Endojen ATG9A'yı görüntülerken, sonraki kantitatif analizin kalitesini ve verilerin doğru yorumlanmasını sağlamak için numune hazırlama ve görüntü elde etme konusunda dikkatli olunmalıdır. Bu makalede açıklanan teknikleri standart biyokimyasal yaklaşımlarla (burada açıklanmayan immünopresipitasyon veya aşağı çekme deneyleri gibi) birleştirmek, ATG9A fonksiyonunu anlamamızı geliştirmelidir. Bu deneysel araç seti, yeni araştırmacıların ATG9A'nın biyolojik sistemlerindeki işlevini belirlemek için gereken bazı tahlillerde gezinmelerine yardımcı olmayı amaçlamaktadır.
Protokol
Bu çalışmada kullanılan tüm reaktifler, talep üzerine temin edilebilen ATG9A DNA yapıları ve ev yapımı STO-215 antikoru (bkz. Burada açıklanan analiz araçları, açık kaynaklı yazılıma (FIJI/ImageJ)18 dayanmaktadır.
1. Hücre kültürü
- T150 doku kültürü ile muamele edilmiş bir şişedeki HEK293A hücreleri,% 10 FBS (fetal sığır serumu) ve 4 mM L-glutamin ile desteklenmiş yüksek glikozlu DMEM'de% 80 -% 90 birleşmeye kadar koruyun (bkz. Hücreleri 37 °C'de% 10 CO2'de nemlendirilmiş bir doku kültürü inkübatöründe inkübe edin.
NOT: Bu çalışmada HEK293A hücreler kullanılmıştır, çünkü amino asit açlığı üzerine sağlam bir kanonik otofaji tepkisine sahiptirler, bu da özellikle lipidlenmiş, membranla ilişkili LC3 1,9,19'daki bir artışla tespit edilir ve görüntüleme için uygundur. - Serolojik bir pipet kullanarak besiyerini şişeden aspire ederek hücreleri geçirin. Hücreleri ayırmak için 2 mL Tripsin-EDTA (etilendiamintetraasetik asit) çözeltisi eklemeden önce hücreleri bir kez 15 mL 1x PBS (fosfat tamponlu salin) veya benzer bir çözelti ile yıkayın. Ayrılmış hücreleri 8 mL DMEM ile toplayın ve burada açıklanan deneyler için 2 gün sonra% 80 -% 90 birleşmeye ulaşılacak şekilde bir dizi hücreyi geri tohumlayın.
2. ATG9A'nın endojen boyanması
- Tohum HEK293A hücreleri (veya tercih edilen hücreleri) steril No. 1.5 cam lameller üzerine yerleştirin ve ertesi gün ~% 80 birleşik olacak şekilde 24 oyuklu bir plakaya yerleştirilir. Bu tipik olarak 500 μL DMEM'de 7 x 104 hücre/kuyu verir.
NOT: HEK293A hücreleri veya diğer gevşek yapışan hücre hatları için, lamellerin deiyonize suda 0.1 mg / mL'de poli-D-Lizin ile kaplanması gerekir. Oda sıcaklığında (RT) 10 dakika boyunca kuyucuklara yerleştirilen lamellerin üstüne 500 μL poli-D-lizin ekleyin ( Malzeme Tablosuna bakınız), ardından deiyonize su ile üç yıkama ve DMEM'de son bir yıkama. Kaplamadan sonra hücreleri tohumlamaya devam edin ve kültür kabına eşit şekilde dağılmalarına dikkat edin. - Hücreleri spesifik deneysel koşullara göre tedavi edin (yani, EBSS'de [Earle's Balanced Salt Solution] 2 saat açlık).
NOT: EBSS bileşimi 1 g/L D-glikoz, 6.8 g/L NaCl, 0.4 g/L KCl, 0.151 g/L CaCl 2.2H2O, 0.2 g/L mM MgSO 4.7H 2 O,0.124g/L NaH 2 HPO 4.2H 2 O ve2.2 g / LNaHCO3'tür (Malzeme Tablosuna bakınız) damıtılmış suda çözülür. - Ortamı aspire edin ve hücreleri sabitlemek için RT'de 20 dakika boyunca 0.1 mM CaCl 2 ve 0.1 mM MgCl2 ile desteklenmiş PBS'de 500 μL% 4 formaldehit çözeltisi ile dikkatlice değiştirin.
- Her kuyucuktan% 4 formaldehit çözeltisini aspire edin ve 500 μL PBS ile değiştirin. Bu yıkama adımını üç kez tekrarlayın. Lamellerin kurumasına veya sıvısız kalmasına izin vermeyin.
- RT'de 10 dakika boyunca PBS'de 500 μL 50 mMNH4Cl çözeltisi kullanarak serbest aldehit gruplarını söndürün.
- PBS'yi aspire edin ve hücrelere nüfuz etmek için RT'de 5 dakika boyunca PBS'de 500 μL 50 μg / mL digitonin çözeltisi (deiyonize suda stok çözeltisi 1 mg / mL, Malzeme Tablosuna bakınız) ile değiştirin.
- Digitonin çözeltisini her kuyucuktan aspire edin ve 500 μL PBS ile değiştirin. Bu yıkama adımını üç kez tekrarlayın.
- PBS'yi her bir oyuktan aspire edin ve RT'de 30 dakika boyunca 500 μL bloke edici solüsyon (PBS'de seyreltilmiş% 5 BSA [sığır serum albümini]) ile değiştirin.
- Engelleme solüsyonunu aspire edin ve 500 μL PBS ile değiştirin.
- Cımbız kullanarak, lamelleri kuyudan toplayın, ince mendil veya selüloz filtre kağıdı kullanarak fazla PBS solüsyonunu dikkatlice çıkarın ve her bir lamel hücre tarafı aşağı bakacak şekilde 50 μL'lik bir primer antikor solüsyonu damlası üzerine nazikçe yatırın (örneğin, Ermeni Hamster 14F2 %1 BSA/PBS solüsyonunda 0,9 μg/mL'ye seyreltilmiş , bkz. RT'de 1 saat nemlendirilmiş bir odada inkübe edin.
NOT: Kolay kullanım için, antikor çözeltisi damlaları, doğrudan katı bir yüzey yerine başka bir kap içinde kendinden sızdırmaz bir termoplastik film tabakasına (Malzeme Tablosuna bakınız) yerleştirilebilir. - Lamelleri cımbız kullanarak toplayın ve ince doku mendilleri kullanarak fazla primer antikor solüsyonunu nazikçe boşalttıktan sonra, lamelleri (hücre tarafı yukarı) 24 oyuklu plakaya yerleştirin ve PBS ile üç kez yıkayın.
- Adım 2.10'u tekrarlayın. Cımbız kullanarak, her bir oyuktan lamelleri toplayın, ince doku mendilleri kullanarak fazla PBS'yi dikkatlice boşaltın ve her bir lameli (hücre tarafı aşağı) 1:1,000 oranında seyreltilmiş 50 μL'lik bir ikincil antikor çözeltisi damlası üzerine nazikçe yatırın %1 BSA/PBS çözeltisi (örneğin, sığır, insan ile minimum çapraz reaktiviteye sahip olan Cy3 Keçi Anti-Ermeni Hamster IgG, fare, tavşan ve sıçan serum proteinleri, Malzeme Tablosuna bakınız). RT'de 1 saat nemlendirilmiş bir odada inkübe edin.
NOT: İsteğe bağlı: Sonraki görüntü analizi için ikincil antikora ek olarak bir hücre iskeleti işaretleyicisi kullanılabilir (yani, 1:1.000 seyreltilmiş Alexa Fluor 647 Phalloidin , bkz. Kolay kullanım için, antikor çözeltisi damlaları, doğrudan katı bir yüzey yerine başka bir kap içindeki bir sızdırmazlık filmi tabakasına yerleştirilebilir. - Lamelleri cımbız kullanarak toplayın ve fazla ikincil antikor solüsyonunu boşalttıktan sonra, lamelleri 24 oyuklu plakaya (hücre tarafı yukarı) yerleştirin ve 500 μL PBS ile üç kez yıkayın.
- Cımbız kullanarak, lamelleri toplayın, ince mendil mendilleri kullanarak fazla PBS'yi dikkatlice boşaltın ve her bir lamel (hücre tarafı aşağı bakacak şekilde) PBS'de 50 μL'lik 1:4,000 Hoechst çözeltisi (Hoechst 33342) damlasına nazikçe yatırın. RT'de 5 dakika boyunca bir nem odasında inkübe edin.
NOT: Kolay kullanım için, antikor çözeltisi damlaları, doğrudan katı bir yüzey yerine başka bir kap içindeki bir sızdırmazlık filmi tabakasına yerleştirilebilir. - Lamelleri cımbız kullanarak toplayın ve ince mendil mendilleri kullanarak fazla Hoechst solüsyonunu nazikçe boşalttıktan sonra, 24 oyuklu plakadaki lamelleri değiştirin ve üç kez PBS ile ve bir kez deiyonize su ile yıkayın (yıkama başına 500 μL).
- İnce mendil mendilleri kullanarak fazla deiyonize suyu dikkatlice boşaltın ve her bir lamel (hücre tarafı aşağı bakacak şekilde) immünofloresan için bir mikroskop lamı üzerinde lekelenmiş 10-20 μL'lik bir montaj çözeltisi damlası üzerine nazikçe yerleştirin ve hava kabarcıklarının oluşmasını önleyin.
NOT: Burada kullanılan montaj ortamı, daldırma yağı ile aynı kırılma indisine sahiptir ve RT'de birkaç saat sonra veya gece boyunca 4 °C'de sertleşir. Sertleşmeyen montaj solüsyonları kullanılabilir, ancak lamel oje ile kapatılmasına özen gösterilmelidir. - Fazla montaj solüsyonunu aspirasyonla çıkarın ve numuneleri gece boyunca karanlıkta, bir sürgü tutucuda veya alüminyum folyo ile kaplanmış olarak RT'de düz yatarken kurumasını bekleyin.
3. Görüntü edinme
- Konfokal mikroskobu açın. Görüntü alma kurulumunu başlatmak için görüntüleme yazılımını açın (bkz. Malzeme Tablosu).
- İşlev sekmesinde, analiz için görüntüleri yakalamak üzere Plan-Apochromat 63x/1.4 Oil DIC M27 objektif lensini seçin.
- Edinme İşlevi sekmesinde, Kontrol Panelinin Lazer bölgesinde uygun lazerleri açın (Argon, Diyot-405-30, DPSS 561-10 ve HeNe633).
- Kontrol Panelinin Görüntüleme Kurulumu alanında, sıralı alım gerçekleştirmek için her biri bir kanala karşılık gelen dört kanal oluşturun.
- Çekim Modu penceresinde görüntülerin uygun çözünürlüğünü ayarlayın. Çözünürlüğü 1.024 x 1.024 (Çerçeve boyutu) olarak ayarlayın ve 16 bitlik bir Bit derinliği seçin.
- Her kanal için, görüntü yoğunluğu analizini engelleyecek doygun pikseller olmadan iyi bir sinyal elde etmek için lazer gücünü ve kazancını ayarlayın. Canlı düğmesini kullanarak Lazer çıkış seviyesini ve Kazancı (Master) ayarlayın.
NOT: Doygun piksel algılaması için aralık göstergesi seçeneğinin kullanılması önerilir. Arka plan gürültüsünü önlemek için lazer gücünü %1 ile %10 arasında ve Kazancı (Master) 850'nin altında tutun. - Kontrol Panelinin Kanallar bölgesinde, en yüksek dalga boyuna sahip kanal için 1 Havadar Birimi (AU) göz önünde bulundurarak her kanal için aynı iğne deliği açıklığını ayarlayın.
- Benzer miktarda hücre içeren 10 rastgele alan alın (alan başına 20-30 hücre). Koşul başına 100-200 hücrenin alınması, daha sonraki görüntü analizi için iyi bir güç sağlayacaktır.
4. ATG9A dağılımının görüntü analizi
- FIJI yazılımını internetten indirin (Malzeme Tablosuna bakın). Eklentiler > Bio-Formats > BioFormats Importer'a tıklayarak görüntüyü FIJI ile açın.
- Ölçümleri analiz et > ayarla'ya tıklayın ve yoğunluk analizi için ölçümler penceresinde Ortalama gri değerini seçin.
- Görüntü > Renk > Bölünmüş Kanallar'a tıklayın ve kanalları üç görüntüye ayırın (Golgi işaretleyici, hücre iskeleti, ATG9A sinyali).
- Görüntü > > Eşiği Ayarla'ya gidin ve kanalda Golgi işaretçisine karşılık gelen bir eşik tanımlayın.
- Edit > Selection > Create Selection'a tıklayın ve ikili görüntüden bir seçim oluşturun.
- > Seçimini Düzenle > Yöneticiye Ekle > Yeniden Adlandır'a (Golgi) gidin, seçimi ROI yöneticisine kaydedin ve Golgi olarak yeniden adlandırın.
- Eşiği Ayarla > Görüntü > tıklayın ve hücre konturunu tanımlamak için hücre iskeleti işaretleyicisine karşılık gelen kanalda bir eşik tanımlayın.
- > Seçimi Düzenle > Seçim Oluştur'a gidin ve ikili görüntüden bir seçim oluşturun.
- > Seçimi Düzenle > Yeniden Adlandır > Yöneticiye Ekle (Toplam) seçeneğine tıklayın, seçimi ROI yöneticisine kaydedin ve Toplam olarak yeniden adlandırın.
- ATG9A boyamaya karşılık gelen görüntüyü seçin.
- Analiz > Ölçü'de, üzerine tıklayarak ROI Golgi'yi uygulayın ve Golgi bölgesinin yoğunluğunu ölçün.
- Analiz Et > Ölç'e tıklayın, üzerine tıklayarak ROI Toplamını uygulayın ve Toplam bölgesinin yoğunluğunu ölçün.
- Prosedürü tüm görüntülerde tekrarlayın, sonuçları .csv dosyaları olarak kaydedin ve aşağıdaki formülü kullanarak verileri işleyin:
ATG9A dağılım hızı = Golgi yoğunluğu/Toplam yoğunluk
5. ATG9A yapılarının canlı hücre görüntülemesi
- Tohum HEK293A hücreleri (veya tercih edilen hücreleri) 2 mL ortamda 60 mm'lik bir doku kültürü kabına tohumlayın, böylece ertesi gün ~%65-%70 birleşmeye ulaşırlar; Bu genellikle 1 x 10 6-2 x 106 hücre verir.
- Ertesi gün, Lipofektamin hazırlayın: DNA karışımları (veya uygun bir alternatif DNA transfeksiyon reaktifi, Malzeme Tablosuna bakınız):
- Yapı ekspresyon verimliliğine bağlı olarak, 0.5-2 μg plazmit DNA'yı 100 μL'lik uygun bir serumsuz ortama seyreltin ve çözeltiyi yukarı ve aşağı pipetleyerek hafifçe karıştırın. Karışımı RT'de 5 dakika inkübe edin.
NOT: Plazmit DNA yapısı deneye özgüdür. Araştırmacılar kendi başlarına klonlayabilir veya talep etmeleri halinde yazarlardan temin edebilirler. - Lipofectamine 2000 transfeksiyon reaktifini 3:1 Lipofektamin:DNA oranında 100 μL'lik uygun bir serum içermeyen ortama seyreltin ve çözeltiyi yukarı ve aşağı pipetleyerek nazikçe karıştırın. Bu karışımı RT'de 5 dakika inkübe edin.
- Her iki çözeltiyi hafifçe yukarı ve aşağı pipetleyerek ve RT'de 20 dakika inkübe ederek karıştırın.
- Yapı ekspresyon verimliliğine bağlı olarak, 0.5-2 μg plazmit DNA'yı 100 μL'lik uygun bir serumsuz ortama seyreltin ve çözeltiyi yukarı ve aşağı pipetleyerek hafifçe karıştırın. Karışımı RT'de 5 dakika inkübe edin.
- Lipofektamin: DNA karışımını 4 mL büyüme ortamı içeren her hücre kültürü plakasına ekleyin ve karışımı eşit olarak dağıtmak için plakayı hafifçe ileri geri sallayın. Hücreleri% 10 CO2'de nemlendirilmiş bir hücre kültürü inkübatöründe 37 ° C'de inkübe edin.
- Ortamı, transfeksiyondan 4 saat sonra taze büyüme ortamı ile değiştirin ve hücreleri, gece boyunca% 10 CO2'de nemlendirilmiş bir hücre kültürü inkübatöründe 37 ° C'de inkübe edin.
- Ertesi gün, canlı hücre mikroskobu için uygun kültür kaplarında hücreleri deneyin, sayın ve yeniden tohumlayın (1.5 No'lu cam lamel ile kültür kapları, bkz. Görüntüleme sırasında lamel üzerinde ~% 60 -% 75 birleşmeye ulaşmak için bulaşıkların üzerine 0.4 x 10 6-0.7 x10 6 hücre tohumlayın.
NOT: Adım 2.1'de açıklandığı gibi poli-D-lizin ile kaplama, HEK293A hücreleri için önerilir. - Ertesi gün (transfeksiyondan 48 saat sonra), hücreleri görüntüleyin.
6. ATG9A'nın glikozilasyon durumunun araştırılması
- Tohum HEK293A hücreleri (veya tercih edilen hücreleri) 10 cm'lik bir doku kültürü kabına koyun, böylece tipik olarak 10 mL'de 1.5 x 106 hücre veren endojen ATG9A'yı araştırmayı planlıyorsanız, ertesi gün ~% 80 birleşmeye ulaşırlar. Alternatif olarak, tipik olarak 10 mL'de 1 x 10 6-1.5 x 10 6 hücre veren ATG9A yapılarını transfekte ederse hücreleri ~% 65 -%70 birleşmeye ulaşacak şekilde tohumlayın.
- Ertesi gün hücrelere 100 μg / mL sikloheksamit (CHX, Malzeme Tablosuna bakınız) veya araç uygulayın. 24 saat (veya istenen bir zaman noktasına kadar) inkübe edin.
- Hücreleri inkübatörden çıkarın, ortamı aspire edin ve buzun üzerine yerleştirin. 5 mL buz gibi soğuk 1x PBS ile değiştirin. Bir hücre kazıyıcı kullanarak hücreleri tabaktan fiziksel olarak ayırın ve PBS hücre çözeltisini 15 mL'lik konik tabanlı bir tüpe pipetleyin. Hücreleri peletlemek için 4 ° C'de 5 dakika boyunca 800 x g'da santrifüjleyin.
- Süpernatanı aspire edin ve hücreleri ~ 100 μL'de (hücre peletinin boyutuna bağlı olarak) buz gibi soğuk TNTE lizis tamponunda (% 1 Triton, 150 mM NaCl, 20 mM Tris-HCl, pH 7.4, 0.5 mM EDTA) proteaz inhibitörü kokteyl tabletleri ile desteklenmiş (bkz. Malzeme Tablosu) ve 1.5 mL'lik bir mikrosantrifüj tüpüne aktarın.
- Lizatı buz üzerinde 15 dakika inkübe edin. Bundan sonra, çekirdekleri ve çözünmeyen kalıntıları çökeltmek için lizatı 20.000 x g'da 4 ° C'de 10 dakika santrifüjleyin ve süpernatanı taze bir mikrosantrifüj tüpüne aktarın.
- Bradford yöntemi20 ve 595 nm dalga boyunda ölçüm yapabilen bir spektrofotometre kullanarak lizatın protein konsantrasyonunu ölçün.
- Protein miktarlarını normalleştirin ve 1 μL PNGase F enzimi eklemeden önce üreticinin talimatlarına göre 16 μL lizatı (toplamda 100 μg'dan fazla protein içermeyen) 5x PNGase F (Peptit: N-glikosidaz F) tamponu ile birleştirin (bkz. PNGase F üreticisinin talimatına göre inkübe edin.
- 1x konsantrasyon elde etmek için 3x Laemmli numune tamponu ekleyin ve proteinlerin ayrılmasını en üst düzeye çıkarmak için bir Tris-asetat jeli kullanarak elektroforez için yüklemeden önce 65 °C'de 5 dakika inkübe edin. Proteinleri jelden uygun bir zara aktarın (yani, PVDF [poliviniliden diflorür]) standart western blot protokollerini21 kullanarak (bkz.
NOT: Numunelerin 95 °C'de kaynatılması ATG9A'nın toplanmasına neden olacak ve böylece ATG9A'nın tespitini azaltacaktır. - ATG9A için spesifik antikorlar (STO-215 antikoru, kurumiçi 1) kullanarak western blot'u gerçekleştirin (bkz. Daha yüksek ATG9A moleküler ağırlıklı türleri görselleştirmek için zarın daha yüksek moleküler ağırlıklı bölümünü kesmeden bırakın.
Sonuçlar
ATG9A, birkaç hücre içi zar bölmesi 8,17,22,23,24 ile ilişkili bir transmembran proteinidir. Bazal koşullarda, ATG9A, endojen proteinin immünofloresansı ve bir cis-Golgi belirteci olan GM130 (Şekil 1A) ile örtüşmelerin yanı sıra endositik geri dönüşüm bölmesi (ERC) ile kısmen örtüşen küçük veziküllerde gösterildiği gibi, esas olarak trans-Golgi ağında (TGN) lokalizedir.23. Golgi'deki ATG9A lokalizasyonu, farklı immünofloresan protokolleri kullanılarak tespit edilebilir. Bununla birlikte, ATG9A'nın veziküler fraksiyonu ve lokalizasyonunun değişmesi, özellikle veziküler havuzdaki artış, besin ve serum açlığı gibi spesifik uyaranlara yanıt olarak, yoğunluk açısından oldukça değişken olabilir ve geleneksel görüntüleme yaklaşımlarıyla görselleştirilmesi zor olabilir. Golgi'de lokalize ATG9A ile veziküler fraksiyona lokalize ATG9A arasındaki oran, ATG9A dağılım hızı olarak adlandırılır. ATG9A dağılım hızındaki değişiklikleri tespit etmek için, örneğin hem serum hem de amino asitleri tüketmek için kullanılan EBSS tedavisinde, GM130 veya TGN46 gibi bir Golgi belirteci ve hücre konturu25'i boyayan Phalloidin gibi bir hücre iskeleti belirteci, ATG9A dağılımını kolayca ölçmek için yararlıdır (Şekil 1B). Daha da önemlisi, ortalama floresan oranı analizi, sabit bir dağılım oranı olarak değil, yalnızca koşullar arasında karşılaştırmalı bir ölçü olarak yorumlanabilir. Bölmeler arasındaki oran, kullanılan hücre hattı, boyama kalitesi veya uygulanan eşikleme yöntemleri gibi biyolojik ve biyolojik olmayan faktörlere büyük ölçüde bağlıdır (Şekil 1B). Bu nedenle, araştırmacının ATG9A Golgi zenginleştirmesini kendi özel deneysel koşullarında tespit edebilen bir boru hattı kurması ve ardından analizi aynı parametrelerle analiz edilecek setteki tüm görüntülere genişletmesi gerekir. ATG9A ortalama floresansının analizi için seçilen temsili ikili görüntüler ve alanlar, Şekil 1B'de bir kılavuz olarak gösterilmiştir.
ATG9A, C-terminal dizisinin protein12'nin neredeyse yarısını kapsadığı, nispeten esnek ve yapılandırılmamış iki N- ve C-terminal alanı ile çevrili birkaç transmembran alanı barındırır. Daha da önemlisi, aşırı eksprese edilen ATG9A'nın lokalizasyon modeli, hangi protein ucunun etiketlendiğinden etkilenebilir (Şekil 2A). Özellikle, geçici ekspresyon sistemleri kullanıldığında ve ATG9A'yı doğrudan N-terminalinde bir floresan etiketle (örneğin, eGFP, mRFP veya türevleri) etiketlerken, Golgi lokalizasyonu kısmen tehlikeye girebilir, bazal (yani beslenen) koşullarda daha az zenginleştirme görülürken, ATG9A vezikülleri hala kolayca görülebilir (Şekil 2A). ATG9A'yı C-terminalinde etiketlemek, toplanabilecek daha büyük GFP pozitif kümelerini hafifçe indüklüyor gibi görünüyor. Son olarak, mRFP-ATG9A'nın monomerik bir versiyonu, aşırı eksprese eden hücrelerde benzer floresan vezikül kümeleri ve küçük Golgi boyaması gösterir (Şekil 2A).
ATG9A, Golgi ve ATG9A veziküllerine gönderilmeden önce ER membranında katlanır. Acil serviste ikamet etmesi sırasında, ATG9A, Asparagin 99 üzerindeki N-bağlı glikanlar tarafından modifiye edilir ve daha sonra Golgi'ye ulaştığında, karmaşık, olgun N-bağlı glikanlar 1,14 elde eder. Glikozilasyon ile bu modifikasyon, bir çift bant14'ün ortaya çıkmasıyla western blot yoluyla tespit edilebilir. Hücre içi lokalizasyonu ile tutarlı olarak, çoğu endojen ATG9A, kompleks N-bağlı glikanları barındırır ve bu nedenle, daha yüksek moleküler ağırlık bandı baskındır ve soluk bir düşük moleküler ağırlık bandı da görülebilir (Şekil 2B). Bir çift bandın varlığı, daha yüksek moleküler ağırlıklı proteinlerin çözünürlüğünü iyileştirmek için Tris-asetat jelleri kullanıldığında en kolay şekilde görülür (Şekil 2B, kontrol, t = 0). Endojen protein, kompleks N-bağlı glikanların çoğunu uzaklaştıran PNGase F (Peptit: N-glikozidaz F) tedavisine tabi tutulduğunda, protein tek bir bant olarak çalışır (Şekil 2B, PNGase F, t = 0). Bu nedenle, ATG9A'nın N-bağlı glikozilasyon durumu, ATG9A'nın ER'den Golgi'ye çıkışını izlemek için bir vekil olarak kullanılabilir, bu da iki bant arasındaki nispi oran tarafından yansıtılır.
mRFP-ATG9A geçici olarak transfekte edildiğinde, aşırı eksprese edilen protein başlangıçta ER'de birikir, çünkü potansiyel olarak kaçakçılık makinesi tüm ATG9A'yı katlayamaz ve trafiğe çıkaramaz ve daha düşük moleküler ağırlık bandı baskındır (Şekil 2C, kontrol t = 0). Özellikle, mRFP-ATG9A'nın 24 saatlik ekspresyonundan sonra, üst ve alt bantlar arasında yaklaşık olarak eşit bir dağılım vardır, bu da mRFP-ATG9A havuzunun Golgi'ye doğru hareket ettiğini düşündürür (Şekil 2C, Kontrol, t = 24). Hücreler, de novo protein sentezini bloke eden sikloheksimid (CHX) ile tedavi edilirse26, ATG9A'nın ER'den katlanması ve çıkışı açıklığa kavuşturulabilir. Endojen protein katlandığından, glikosile edildiğinden ve Golgi'de yerleşik olduğundan, CHX ile tedavi, düşük ve yüksek moleküler ağırlık bantlarının oranını önemli ölçüde değiştirmez (Şekil 2B, Kontrol). Bununla birlikte, mRFP-ATG9A'nın geçici ekspresyonunu kullanarak, CHX tedavisi daha yüksek moleküler ağırlık bandının birikimini teşvik eder (Şekil 2C, Kontrol, CHX t = 24). Daha yüksek moleküler ağırlıklı aşırı eksprese edilen mRFP-ATG9A bandı, PNGase F ile tedaviden sonra alt banda çöker (Şekil 2C, PNGase F, t = 24). Bu veriler, endojen proteinin, daha yüksek moleküler ağırlık bandının baskınlığı ile yansıtıldığı gibi, hızlı bir şekilde olgun glikanlar edindiğini ve CHX takibinin çift bantların oranını etkilemediğini göstermektedir (Şekil 2B). Geçici olarak aşırı eksprese edilen mRFP-ATG9A durumunda, CHX tedavisi üst bandın birikmesini indükler, bu da ER havuzu katlanıp ER'den Golgi'ye çıktıkça daha olgun glikanların elde edildiğini gösterir (Şekil 2C).
ATG9A dizisi ve floresan etiketler arasına bir bağlayıcının eklenmesi, proteinin daha fizyolojik bir lokalizasyonunu ve ticaretini teşvik etmede yardımcı olabilir. Bir N-terminal florofor ve ATG9A arasında bir 3x-FLAG dizisinin (24 amino asit) kaynaştırılması, aşırı eksprese edilen proteinin endojen olana benzer şekilde davranmasına yardımcı olur (Şekil 3). Gerçekten de, aşırı eksprese edilen mCherry-3xFLAG-ATG9A, beslenen koşullarda Golgi işaretleyici GM130 ile birlikte bulunur (Şekil 3A). Daha da önemlisi, bu lokalizasyon ve ATG9A veziküler kompartmanı zaman içinde korunur ve ATG9A kaçakçılığının uzay-zamansal çalışmasına izin verir (Şekil 3B).
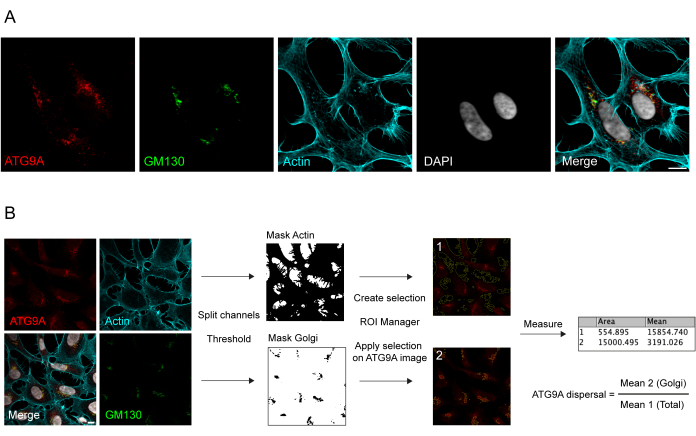
Şekil 1: Endojen ATG9A lokalizasyonunun görüntü analizi. (A) Aktin hücre iskeletini (camgöbeği) görselleştirmek için endojen ATG9A (kırmızı), Golgi belirteci olarak GM130 (yeşil) ve Phalloidin'in temsili immünofloresan görüntüsü. Ölçek çubuğu = 10 μm. (B) Golgi bölgesinde lokalize olan endojen ATG9A fraksiyonunu belirlemek için görüntü analizinin iş akışı. Ölçek çubuğu = 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
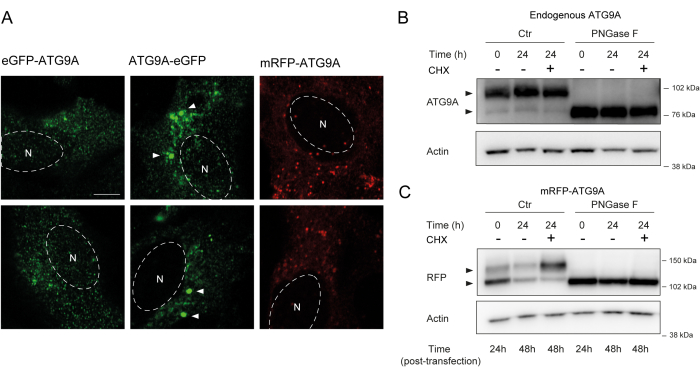
Şekil 2: Floresan etiketli ATG9A yapılarının lokalizasyon ve glikozilasyon ile analizi . (A) eGFP N-terminal etiketli ATG9A, Golgi'de daha az lokalizedir ve esas olarak veziküllerde bulunur. eGFP C-terminal etiketli ATG9A, hücre içinde agregalar sergiler (bazı örnekler beyaz ok uçlarıyla işaretlenmiştir; eGFP-ATG9A ve ATG9A-eGFP yeşil renktedir). mRFP N-terminal etiketli ATG9A, Golgi'de daha az lokalizedir ve öncelikle veziküllerde bulunur. N, hücre çekirdeğinin yaklaşık konumunu gösterir ve mRFP-ATG9A kırmızı renktedir. Ölçek çubuğu = 5 μm. (B) Endojen ATG9A, western blot (ok uçları) ile analiz edildiğinde iki bant olarak görünür: bir üst bant (kompleks N-bağlı glikanlar) ve bir alt bant (olgun N-bağlı glikanlar yok). Sikloheksamit (CHX) ile tedavi, üst ve alt bantlar arasındaki oranı etkilemez. PNGase F ile tedavi, üst bandın kaybolmasına neden olur. (C) HEK293A hücrelerde mRFP etiketli ATG9A'nın geçici transfeksiyonundan sonra, batı lekesinde (ok uçları) iki belirgin bant görülebilir. PNGase F ile tedavi, üst bandın kaybolmasına neden olur. Transfeksiyondan sonra CHX ile tedavi, transfekte edilmiş ATG9A havuzu ER'den Golgi'ye kaçırılırken glikozilasyonun artmasına neden olur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
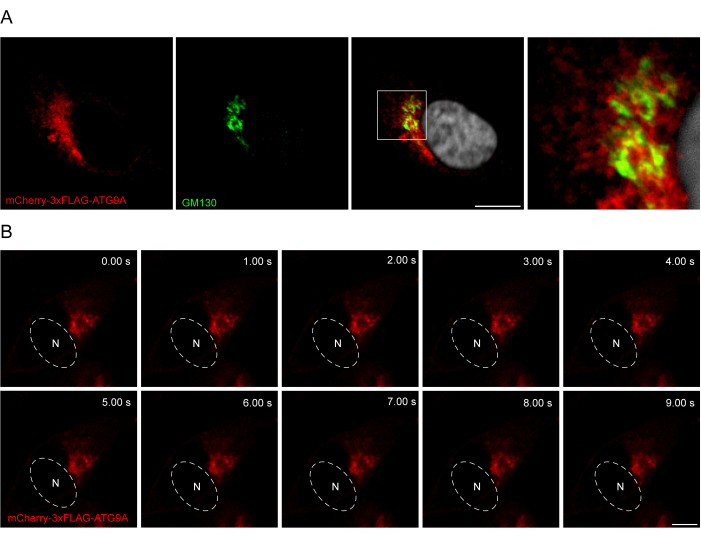
Şekil 3: İmmünofloresan ve canlı görüntüleme ile mCherry-3xFLAG-ATG9A lokalizasyonunun analizi. (A) mCherry-3xFLAG-ATG9A'yı geçici olarak aşırı eksprese eden ve Golgi marker GM130 ile boyanan HEK293A hücrelerin immünofloresan deneyleri. Ölçek çubuğu = 10 μm. mCherry-3xFLAG-ATG9A kırmızı renktedir ve GM130 Golgi işareti yeşil renktedir. (B) mCherry-3xFLAG-ATG9A'yı geçici olarak aşırı eksprese eden HEK293A hücrelerinde yapılan canlı görüntüleme deneylerinden montaj. N, çekirdeğin yaklaşık konumunu gösterir. Zaman çerçevesi = 1 fps. Ölçek çubuğu = 10 μm. mCherry-3xFLAG-ATG9A kırmızı renktedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışma, ATG9A lokalizasyonunu araştırmak için kullanılabilecek çeşitli araçları göstermektedir. İlk olarak, bu çalışma ATG9A'nın immünofloresan ile nasıl görselleştirilebileceğini ve bunun nasıl ölçülebileceğini açıklamaktadır. İkinci olarak, ATG9A'yı sabit veya canlı hücrelerde görselleştirme için bir floresan işaretleyici ile etiketlemek için kullanılabilecek stratejiler karşılaştırılır. Son olarak, bu çalışma, ATG9A'nın ER'den çıkıp çıkmadığını ve Golgi'den geçip geçmediğini belirlemek için ATG9A'nın glikozilasyon durumunun nasıl araştırılacağını ve kullanılacağını açıklamaktadır.
İmmünofloresan ile endojen ATG9A lokalizasyonunun karakterizasyonu ile ilgili olarak, deney için kullanılan fiksasyon ve geçirgenleştirme yöntemlerine dikkat edilmelidir. Burada açıklanan standart prosedürlere göre, digitonin geçirgenliği ile birleştirilmiş paraformaldehit fiksasyonu, hem Golgi ile ilişkili ATG9A hem de ATG9A pozitif veziküllerigörselleştirmek için iyi koşullardır 7. Fiksasyon ve geçirgenleştirme ile birlikte, birincil antikor çözeltisi ile inkübasyonun zamanlaması da kritiktir. Daha yüksek primer antikor çözeltisi konsantrasyonlarının ve daha uzun inkübasyon sürelerinin, ATG9A'nın Golgi boyamasında yanlış temsili bir artışa yol açabileceğini gözlemledik, ancak belgelenmedik, bu da sonunda ATG9A'nın diğer membran bölmelerine yeniden dağılımının tespitini tehlikeye atıyor. Ek olarak, ATG9A birçok hücre içi bölmedebulunduğundan 1,13,17,22,23,24,27,28, ATG9A'nın nerede bulunduğunu belirlemek için ATG9A ile birlikte spesifik membran belirteçlerinin kullanılması önemlidir. Geçmişte, ATG9A lokalizasyonunu ölçmek için, Pearson'ın kolokalizasyon için korelasyon katsayısı29 dahil olmak üzere çeşitli yaklaşımlar kullanılmıştır. Bununla birlikte, ATG9A'nın Golgi ve farklı veziküler bölme ile kısmi örtüşmesi, korelasyon katsayısının yorumlanmasını saptırabilecek çok sayıda piksel aykırı değerine yol açar. Bu nedenle, analiz edilecek iki bölmedeki ortalama floresan oranına dayanan daha basit bir yaklaşım tercih edilir ve bu yaklaşım hücreden hücreye değişkenliğe daha az duyarlıdır. Mikroskopi ile görüntü analizi hakkında daha fazla bilgi için okuyucular bu kitabın30. bölümüne yönlendirilir.
ATG9A'nın glikozilasyon durumunu araştırırken, batı lekelerini çalıştırmak için jel seçimi önemlidir. Bu protokol için, daha büyük proteinler için en yüksek çözünürlüğü sundukları için %3-8 Tris-asetat jelleri tercih edilir, ancak yüksek moleküler ağırlıklı proteinlerin iyi bir şekilde ayrılmasını sağlayan alternatif jel bileşimleri veya çalışan tamponlar da kullanılabilir. Deneyci, elektroforez süresini artırarak proteinlerin maksimum ayrılmasını sağlayabilir.
ATG9A'yı western blot üzerinde görselleştirmek için numuneleri hazırlarken, Laemmli tamponu eklendikten sonra numunelerin kaynatılmamasına dikkat edilmelidir; 95 °C'de kaynatma, ATG9A agregalarının oluşumunu indükler ve daha sonra ATG9A, jel1'e verimli bir şekilde göç etmez. Numunelerin 65 °C'de 5 dakika ısıtılması önerilir27.
Yüksek transfeksiyon seviyeleri genellikle ER'de daha yüksek ATG9A birikimine yol açarken, orta ekspresyon seviyeleri proteinin fizyolojik lokalizasyonuna yardımcı olur. Anekdot olarak, 48 saat yerine 72 saatlik inkübasyon süreleri genellikle ER lokalizasyon artefaktlarını azaltmaya yardımcı olur. Özellikle, mRFP-ATG9A, ATG9A trafiğini doğru bir şekilde raporlayabilir ve seviyeler ifade seviyeleri aracılığıyla veya kararlı hücre hatları 8,9,22,27 kullanılarak kontrol edilirse işlev görebilir.
Aşırı eksprese edilmiş bir ATG9A popülasyonunun olgun N-bağlı glikanları elde edememesi, bozulmuş ATG9A kaçakçılığı için bir okuma olarak kullanılabilir. ATG9A'nın belirli bölgelerini mutasyona uğratırken veya silerken, olgun N-bağlı glikanların elde edilememesine ve dolayısıyla batı blot üzerinde daha hızlı göç eden bir ATG9A bandına yol açabilecek artan ER tutulumu riski vardır. Kesik ATG9A yapılarıyla çalışan araştırmacılar, ER tutulmasını, glikozilasyon durumlarını ve Golgi lokalizasyonunu kontrol etmelidir.
ATG9A'nın canlı hücre görüntülemesi için, hızlı Airyscan işlevine dayanan bir Airyscan mikroskobu, tipik olarak yaklaşık 120 nm'lik optimum çözünürlük sağlar. Yerelleştirme doğruluğu için, süper çözünürlük modunda saniyede yaklaşık 1-2 kare (fps) kare hızları, kaç kanalın görüntülendiğine bağlı olarak idealdir. ATG9A veziküllerinin görüntülenmesi için yüksek hızda görüntüleme yapabilen benzer konfokal mikroskoplar da kullanılabilir; Bununla birlikte, görüntüleme hızının olayların tespitini doğrudan etkileyebileceği ve dolayısıyla verilerin yorumlanmasını etkileyebileceği unutulmamalıdır.
Özetle, sunulan protokoller, immünofloresan, canlı hücre mikroskobu ve glikosilasyon durumu ile ATG9A lokalizasyonunu ölçmenin ve karakterize etmenin yollarını açıklar. Bu protokoller, ATG9A ile çalışan araştırmacılara yardımcı olabilir ve bazı tuzaklardan kaçınmaya yardımcı olabilir.
Açıklamalar
S.A.T., Casma Therapeutics'in bilimsel danışma kurulunda görev yapmaktadır.
Teşekkürler
Yazarlar, el yazmasının redaksiyon yönleri için Rocco D'Antuono'ya ve bu protokollerin iyileştirilmesine yol açan tartışmalar için Otofajinin Moleküler Hücre Biyolojisi (MCBA) laboratuvarının tüm mevcut ve geçmiş üyelerine teşekkür eder. A. V.V., S.D.T., E.A., S.A.T, temel finansmanını Cancer Research UK (CC2134), UK Medical Research Council'den (CC2134) alan Francis Crick Enstitüsü tarafından desteklenmiştir. Bu araştırma tamamen veya kısmen Wellcome Trust (CC2134) tarafından finanse edilmiştir. Açık erişim amacıyla, yazar, bu gönderimden kaynaklanan herhangi bir Yazar Tarafından Kabul Edilen Makale sürümüne bir CC BY kamu telif hakkı lisansı uygulamıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 24 multiwell plates | Falcon | 353047 | For tissue culture |
| 35 mm Dish | No. 1.5 Coverslip | 14 mm Glass Diameter | Uncoated | MATTEK | P35G-1.5-14-C | Cell culture dish for live-cell microscopy |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 60 mm tissue culture dish | Thermofisher Scientific | 10099170 | For tissue culture |
| Alexa Fluor 647 Phalloidin | Thermofisher Scientific | A22287 | Actin stain |
| anti-ATG9A antibody | home made | STO-215 | Rabbit anti N-terminal peptide ATG9A |
| anti-Rabbit IgG, peroxidase-linked | Invitrogen | 10794347/NA934-1ml | Secondary antibody for rabbit polyclonal STO-215 |
| anti-RFP antibody | Evrogen | AB233 | for Western Blot |
| ATG9A Monoclonal Antibody (14F2 8B1), Invitrogen | Invitrogen | 15232826 | Antibody for immunofluorescence |
| ATG9A-eGFP | home made | Construct which expresses tagged ATG9A | |
| Bemis Parafilm | Thermofisher Scientific | 11747487 | self-sealing thermoplastic film |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | For determining protein concentration |
| Bovine serum albumin (BSA) | Merck | 10735086001 | For blocking non-specific labelling |
| CaCl2.2H2O | / | For PBS and EBSS | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | Supplement in lysis buffer to prevent protein degradation |
| Cy3 AffiniPure Goat Anti-Armenian Hamster IgG | Jackson ImmunoResearch | 127-165-099 | Secondary antibody for i14F2 8B1 antibody for mmunofluorescence |
| Cyclohexamide | Sigma Aldrich | 66-81-9 | To stop protein translation |
| D-Glucose | / | For EBSS | |
| Digitonin | Merck | 300410 | For permeabilizing cells |
| DMEM | Merck | D6546-6x500ml | For tissue culture |
| eGFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Fetal Bovine Serum | Gibco | 10270-106 | Supplement for DMEM for cell culture |
| FIJI (ImageJ) | / | https:/fiji.sc/ | Open source image analysis software |
| Hoechst | Thermofisher Scientific | H3570 | Stains the nucleus |
| KCl | / | For EBSS | |
| L-glutamine | Sigma | 67513 | For tissue culture |
| Lipofectamine 2000 | Invitrogen | 11668-019 | For Cell Transfection |
| LSM880 Airyscan microscope | Zeiss | / | Confocal microscopy |
| MgCl2 | / | For PBS | |
| MgSO4.7H2O | / | For EBSS | |
| Mowiol mounting solution | Millipore | 475904 | for permanent mounting glass coverslips |
| NaCl | / | For EBSS | |
| NaH2PO4.2H2O | / | For EBSS | |
| NaHCO3 | / | For EBSS | |
| NuPAGE 3 to 8%, Tris-Acetate, 1.5 mm, Mini Protein Gels | Thermofisher Scientific | EA0378BOX | for Western Blotting |
| NuPAGE MES SDS Running Buffer (20x) | Life Tech | NP0002 | for Western Blotting |
| Opti-MEM I Reduced Serum Medium | Thermofisher Scientific | 31985062 | For Cell Transfection |
| Paraformaldehyde | Agar Scientific | R1026 | For fixing cells |
| pcDNA3.1-mCherry-3xFlag-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Phosphate Buffered Saline (PBS) | / | For tissue culture | |
| PNGaseF | NEB | P0710S | To remove N-linked glycans |
| Poly-D-lysine hydrobromide mol wt 70,000-150,000 | Merck | P0899 | For coating coverslips |
| Rapid PNGase F enzyme | NEB | P07105 | To remove N-linked glycans |
| RFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Triton X-100 | Thermofisher Scientific | 13454259 | Detergent for Cell lysis |
| Trypsin-EDTA solution | Sigma | T4049 | For tissue culture |
| Whatman Filter Paper | Merck | WHA1001325 | For Western Blot and IF |
| XCell SureLock Mini-Cell Electrophoresis System | Invitrogen | EI0001 | For Western Blotting |
| Zen Black edition | Zeiss | / | Used to operate the LSM 880 |
Referanslar
- Young, A. R., et al. Starvation and ULK1-dependent cycling of mammalian Atg9 between the TGN and endosomes. Journal of Cell Science. 119, 3888-3900 (2006).
- Maeda, S., et al. lipid scrambling activity and role in autophagosome formation of ATG9A. Nature Structural & Molecular Biology. 27 (12), 1194-1201 (2020).
- Matoba, K., et al. Atg9 is a lipid scramblase that mediates autophagosomal membrane expansion. Nature Structural & Molecular Biology. 27 (12), 1185-1193 (2020).
- Mercer, T. J., Gubas, A., Tooze, S. A. A molecular perspective of mammalian autophagosome biogenesis. Journal of Biological Chemistry. 293 (15), 5386-5395 (2018).
- Yamamoto, H., Zhang, S., Mizushima, N. Autophagy genes in biology and disease. Nature Reviews: Genetics. , (2023).
- Sawa-Makarska, J., et al. Reconstitution of autophagosome nucleation defines Atg9 vesicles as seeds for membrane formation. Science. 369 (6508), (2020).
- Melia, T. J., Lystad, A. H., Simonsen, A. Autophagosome biogenesis: From membrane growth to closure. Journal of Cell Biology. 219 (6), 202002085 (2020).
- Orsi, A., et al. Dynamic and transient interactions of Atg9 with autophagosomes, but not membrane integration, are required for autophagy. Molecular Biology of the Cell. 23 (10), 1860-1873 (2012).
- Judith, D., et al. ATG9A shapes the forming autophagosome through Arfaptin 2 and phosphatidylinositol 4-kinase IIIbeta. Journal of Cell Biology. 218 (5), 1634-1652 (2019).
- Karanasios, E., et al. Autophagy initiation by ULK complex assembly on ER tubulovesicular regions marked by ATG9 vesicles. Nature Communications. 7, 12420 (2016).
- Koyama-Honda, I., Itakura, E., Fujiwara, T. K., Mizushima, N. Temporal analysis of recruitment of mammalian ATG proteins to the autophagosome formation site. Autophagy. 9 (10), 1491-1499 (2013).
- Guardia, C. M., et al. Structure of human ATG9A, the only transmembrane protein of the core autophagy machinery. Cell Reports. 31 (13), 107837 (2020).
- Soreng, K., et al. SNX18 regulates ATG9A trafficking from recycling endosomes by recruiting Dynamin-2. EMBO Reports. 19 (4), e44837 (2018).
- Staudt, C., Gilis, F., Boonen, M., Jadot, M. Molecular determinants that mediate the sorting of human ATG9A from the endoplasmic reticulum. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1863 (9), 2299-2310 (2016).
- Knaevelsrud, H., Carlsson, S. R., Simonsen, A. SNX18 tubulates recycling endosomes for autophagosome biogenesis. Autophagy. 9 (10), 1639-1641 (2013).
- Takahashi, Y., et al. The Bif-1-Dynamin 2 membrane fission machinery regulates Atg9-containing vesicle generation at the Rab11-positive reservoirs. Oncotarget. 7 (15), 20855-20868 (2016).
- Imai, K., et al. Atg9A trafficking through the recycling endosomes is required for autophagosome formation. Journal of Cell Science. 129 (20), 3781-3791 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- van Vliet, A. R., et al. ATG9A and ATG2A form a heteromeric complex essential for autophagosome formation. Molecular Cell. 82 (22), 4324-4339 (2022).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Bradford assay for determining protein concentration. Cold Spring Harbor Protocols. 2020 (4), 102269 (2020).
- Kurien, B. T., Scofield, R. H. Validating antibody specificities for immunohistochemistry by protein blotting. Methods in Molecular Biology. 2593, 21-33 (2023).
- Lamb, C. A., et al. TBC1D14 regulates autophagy via the TRAPP complex and ATG9 traffic. EMBO Journal. 35 (3), 281-301 (2016).
- Longatti, A., et al. TBC1D14 regulates autophagosome formation via Rab11- and ULK1-positive recycling endosomes. Journal of Cell Biology. 197 (5), 659-675 (2012).
- Ravussin, A., Brech, A., Tooze, S. A., Stenmark, H. The phosphatidylinositol 3-phosphate-binding protein SNX4 controls ATG9A recycling and autophagy. Journal of Cell Science. 134 (3), (2021).
- DesMarais, V., Eddy, R. J., Sharma, V. P., Stone, O., Condeelis, J. S. Optimizing leading edge F-actin labeling using multiple actin probes, fixation methods and imaging modalities. BioTechniques. 66 (3), 113-119 (2019).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of inhibition of protein synthesis in mammalian cells. Science. 146 (3650), 1474-1476 (1964).
- Webber, J. L., Tooze, S. A. Coordinated regulation of autophagy by p38alpha MAPK through mAtg9 and p38IP. EMBO Journal. 29 (1), 27-40 (2010).
- Claude-Taupin, A., et al. ATG9A protects the plasma membrane from programmed and incidental permeabilization. Nature Cell Biology. 23 (8), 846-858 (2021).
- Aaron, J. S., Taylor, A. B., Chew, T. L. Image co-localization - Co-occurrence versus correlation. Journal of Cell Science. 131 (3), 211847 (2018).
- D'Antuono, R., Nechyporuk-Zloy, V. Basic digital image acquisition, design, processing, analysis, management, and presentation. Principles of Light Microscopy: From Basic to Advanced. , 77-104 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır