Method Article
הדמיה ATG9A, חלבון ממברנה רב-מורחב
In This Article
Summary
פרוטוקול זה מתאר שיטות שונות שיכולות לסייע בחקר הביולוגיה של ATG9A, כולל אימונופלואורסנציה ואחריה ניתוח תמונה, שיקולי ביטוי יתר חולפים, וחקירת מצב הגליקוזילציה ATG9A באמצעות כתם מערבי.
Abstract
אוטופגיה היא מסלול שמור מאוד שהתא משתמש בו כדי לשמור על הומאוסטזיס, לפרק אברונים פגומים, להילחם בפתוגנים פולשים ולשרוד בתנאים פתולוגיים. קבוצה של חלבונים, הנקראת חלבוני ATG, מרכיבים את מנגנון הליבה של אוטופגיה ועובדים יחד בהיררכיה מוגדרת. מחקרים בשנים האחרונות שיפרו את הידע שלנו על מסלול האוטופגיה. לאחרונה, הוצע כי שלפוחיות ATG9A נמצאות בלב האוטופגיה, מכיוון שהן שולטות בסינתזה דה נובו מהירה של אברון הנקרא פאגופור. המחקר של ATG9A הוכח כמאתגר, שכן ATG9A הוא חלבון טרנסממברנלי, והוא נמצא בתאי ממברנה שונים. ככזה, הבנת הסחר בו הוא מרכיב חשוב להבנת האוטופגיה. כאן מוצגות שיטות מפורטות שניתן להשתמש בהן כדי ללמוד ATG9A, ובפרט, לוקליזציה שלה באמצעות טכניקות immunofluorescence, אשר ניתן להעריך ולכמת. המלכודות של ביטוי יתר ארעי מטופלות גם הן. האפיון הנכון של פונקציית ATG9A והסטנדרטיזציה של טכניקות לניתוח הסחר בה חיוניים לאפיון נוסף של האירועים השולטים בהתחלת אוטופגיה.
Introduction
ATG9A הוא החלבון הטרנסממברנלי היחיד של מנגנון הליבה של אוטופגיה והוא מועבר בין גולג'י לבין תא שלפוחית ציטוסולי ATG9A, העובר דרך התא האנדוזומלי1. ATG9A, שהיה חידתי זמן רב, תואר לאחרונה כמתפקד כסקרמבלז שומנים, שכן הוא מאזן שומנים על פני דו-שכבות קרום 2,3. כעת ברור כי ATG9A שוכן בראש ההיררכיה בהיווצרות אוטופגוזום, והמחקר שלו הוא, לפיכך, חיוני להבנת אוטופגיה 4,5. לכן, שלפוחיות ATG9A הוצעו לאחרונה כ"זרע" של אוטופגוזום 6,7. עם זאת, מחקרים קודמים הראו כי ATG9A רק אינטראקציה זמנית עם אוטופגוזום יוצר בשלבים שונים של הבשלתו ואינו משתלב בקרום האוטופגי 6,8,9,10,11. לפיכך, יש צורך בחקירות נוספות כדי לפענח לחלוטין את התפקיד ואת הפונקציות המרובות הפוטנציאליות של ATG9A בהיווצרות אוטופגוזום. עם זאת, הפער בין המודלים הנוכחיים לנתונים הקודמים יכול להיפתר רק באמצעות ניסויים ממוקדים המטפלים בסחר ב- ATG9A באמצעות גישות כמותיות מתוקפות וסמנים תוך תאיים.
ישנם כלים שונים המשמשים לחקר ATG9A, כל אחד עם יתרונות וחסרונות, והשימוש בכלים אלה מסובך בגלל המבנה של ATG9A, הפונקציה המולקולרית שלו, והסחר הסלולרי 2,8,12. ATG9A יוצר הומוטרימר, הוא glycosylated, והוא מועבר ברחבי התא לתאים כגון Golgi, אנדוזומים, ואת קרום פלזמה13,14. בהתחשב במסלול המורכב שלו, ישנם מספר אתגרים בפירוש קריאות כגון פיזור ATG9A מהגולג'י על טיפולים או גירויים ספציפיים (כגון רעב חומרים מזינים וסרום). ATG9A הוא דינמי ביותר במונחים של סחר שלפוחית; ואכן, שלפוחיות המכילות ATG9A הוגדרו כתא ATG9A בהקשר של אוטופגיה הנגרמת מרעב. תא ATG9A, שנוצר על ידי שלפוחיות דינמיות אלה, מקיים אינטראקציה זמנית עם מספר אברונים תוך תאיים 8,15,16,17. הטכניקות המתוארות כאן, כולל immunofluorescence, הדמיה חיה, בדיקות glycosylation, אמור לסייע בזיהוי והבנה של ביולוגיה ATG9A. בפרט, הגישות המתוארות במאמר זה יסייעו לענות על שאלות לגבי לוקליזציה למדורי תאים ספציפיים ואינטראקציות עם שותפי חלבון ספציפיים ו/או תאי ממברנה. מכיוון שלתחום הליבה ההידרופובית המשומרת ATG9A (תחום PFAM PF04109) יש טופולוגיה ייחודית ומחזורי ATG9A בין מספר תאי ממברנה, החוקרים צריכים להיות מודעים למלכודות וממצאים מסוימים בעת ביטוי יתר זמני של ATG9A, כולל, אך לא רק, שימור רשתית אנדופלסמית (ER). בעיות אפשריות אחרות עלולות להתעורר עקב קיפול שגוי של החלבון, צבירה מלאכותית בתנאי גידול רגילים, או זיהוי לא מספיק של תא השלפוחית עקב פרוטוקולי חדירות תת-אופטימליים לאימונופלואורסנציה.
בעת הדמיה אנדוגנית ATG9A, יש להקפיד על הכנת הדגימה ורכישת התמונה כדי להבטיח את איכות הניתוח הכמותי הבא ואת הפרשנות הנכונה של הנתונים. שילוב הטכניקות המתוארות במאמר זה עם גישות ביוכימיות סטנדרטיות (כגון משקעים חיסוניים או ניסויים מושכים למטה שאינם מתוארים כאן) אמור לשפר את הבנתנו את תפקוד ATG9A. ערכת כלים ניסיונית זו נועדה לסייע לחוקרים חדשים לנווט בחלק מהבדיקות הדרושות כדי לקבוע את תפקודו של ATG9A במערכת הביולוגית שלהם.
Protocol
כל הריאגנטים המשמשים במחקר זה זמינים מסחרית, למעט מבני הדנ"א ATG9A ונוגדן STO-215 תוצרת בית (ראה טבלת חומרים), הזמינים לפי בקשה. כלי הניתוח המתוארים כאן מבוססים על תוכנת קוד פתוח (FIJI/ImageJ)18.
1. תרבית תאים
- שמור על HEK293A תאים בבקבוק מטופל בתרבית רקמה T150 למפגש של 80%-90% ב- DMEM עתיר גלוקוז (מדיום הנשר המעובד של Dulbecco) בתוספת 10% FBS (נסיוב בקר עוברי) ו- 4 mM L-גלוטמין (ראה טבלת חומרים). לדגור על התאים ב 37 ° C באינקובטור תרבית רקמה לח ב 10% CO2.
הערה: HEK293A תאים משמשים במחקר הנוכחי, שכן יש להם תגובה אוטופגית קנונית חזקה על רעב חומצות אמינו, אשר, בפרט, מזוהה על ידי עלייה בשומנים הקשורים לקרוםLC3 1,9,19, והם מתאימים להדמיה. - מעבר התאים על ידי שאיפת המדיום מהבקבוק באמצעות פיפטה סרולוגית. שטפו את התאים פעם אחת עם 15 מ"ל של 1x PBS (מלוחים חוצצי פוספט) או תמיסה דומה לפני הוספת 2 מ"ל של תמיסת טריפסין-EDTA (חומצה אתילאנדיאמיןטטראצטית) כדי לנתק את התאים. לאסוף את התאים מנותקים עם 8 מ"ל של DMEM, ולזרוע בחזרה מספר תאים, כך 80%-90% מפגש הוא הגיע לאחר 2 ימים עבור הניסויים המתוארים כאן.
2. צביעה אנדוגנית של ATG9A
- זרע HEK293A תאים (או תאים לפי בחירה) על כיסויי זכוכית סטריליים מס '1.5 שהונחו לתוך צלחת 24 בארות כך שהם ~ 80% מתמזגים למחרת. זה בדרך כלל נותן 7 x 104 תאים / באר ב 500 μL של DMEM.
הערה: עבור תאים HEK293A או קווי תאים אחרים הנצמדים באופן רופף, יש לצפות את החלקות הכיסוי בפולי-D-ליזין במינון של 0.1 מ"ג/מ"ל במים שעברו דה-יוניזציה. הוסף 500 μL של פולי-D-ליזין (ראה טבלת חומרים) בחלק העליון של הכיסויים שהוכנסו לבארות למשך 10 דקות בטמפרטורת החדר (RT), ולאחר מכן שלוש שטיפות עם מים נטולי יונים, ושטיפה אחרונה ב- DMEM. המשיכו לזרוע את התאים לאחר הציפוי, ודאגו שהם מפוזרים באופן שווה בצלחת התרבית. - טפל בתאים בהתאם לתנאי הניסוי הספציפיים (כלומר, רעב במשך שעתיים ב- EBSS [תמיסת המלח המאוזנת של ארל]).
הערה: הרכב EBSS הוא 1 גרם/ליטר D-גלוקוז, 6.8 גרם/ליטר NaCl, 0.4 גרם/ליטר KCl, 0.151 גרם/ליטר CaCl 2.2H 2 O, 0.2 גרם/ליטר mM MgSO 4.7H 2 O, 0.124 גרם/ליטר NaH 2 HPO4.2H 2 O ו-2.2 גרם/ליטר NaHCO 3 (ראה טבלת חומרים) מומסים במים מזוקקים. - שאפו את המדיום, והחליפו אותו בזהירות ב-500 מיקרוליטר של תמיסת פורמלדהיד 4% ב-PBS בתוספת 0.1 mM CaCl 2 ו-0.1 mM MgCl2 למשך 20 דקות ב-RT כדי לתקן את התאים.
- שאפו את תמיסת הפורמלדהיד 4% מכל באר, והחליפו אותה ב-500 מיקרוליטר של PBS. חזור על שלב השטיפה שלוש פעמים. אין לתת לכיסויים להתייבש או להישאר ללא נוזלים.
- הרוו את קבוצות אלדהיד החופשיות באמצעות 500 μL של תמיסת 50 mM NH4Cl ב- PBS למשך 10 דקות ב- RT.
- שאפו את PBS, והחליפו אותו בתמיסת דיגיטונין של 50 מיקרוגרם/מ"ל ב-PBS (תמיסת מלאי של 1 מ"ג/מ"ל במים נטולי יונים, ראו טבלת חומרים) למשך 5 דקות ב-RT כדי לחדור לתאים.
- שאפו את תמיסת הדיגיטונין מכל באר, והחליפו אותה ב-500 מיקרוליטר של PBS. חזור על שלב השטיפה שלוש פעמים.
- שאפו את ה-PBS מכל באר, והחליפו אותו בתמיסת חסימה של 500 מיקרוליטר (5% BSA [אלבומין בסרום בקר] מדולל ב-PBS) למשך 30 דקות ב-RT.
- שאפו את פתרון החסימה, והחליפו אותו ב-500 מיקרוליטר של PBS.
- באמצעות פינצטה, אספו את הכיסויים מהבאר, הסירו בזהירות את תמיסת PBS העודפת באמצעות מגבוני רקמות דקים או נייר סינון תאית, והניחו בעדינות כל כיסוי, צד התא כלפי מטה, על טיפה של 50 מיקרוליטר של תמיסת נוגדנים ראשונית (למשל, אוגר ארמני 14F2 מדולל ל-0.9 מיקרוגרם/מ"ל בתמיסת 1% BSA/PBS, ראו טבלת חומרים). לדגור בתא לח במשך 1 שעה ב RT.
הערה: לטיפול קל, ניתן להניח את טיפות תמיסת הנוגדנים על יריעה של סרט תרמופלסטי אוטם את עצמו (ראה טבלת חומרים) בתוך מיכל אחר במקום ישירות על משטח מוצק. - אספו את הכיסויים באמצעות פינצטה, ולאחר ניקוז עדין של תמיסת הנוגדנים הראשונית העודפת באמצעות מגבוני רקמות דקים, החליפו את הכיסויים (צד התא כלפי מעלה) בצלחת בת 24 הבארות, ושטפו אותם שלוש פעמים עם PBS.
- חזור על שלב 2.10. באמצעות פינצטה, אספו את הכיסויים מכל באר, רוקנו בזהירות את עודפי PBS באמצעות מגבוני רקמות דקים, והניחו בעדינות כל מכסה (צד התא כלפי מטה) על טיפה של 50 μL של תמיסת נוגדנים משנית מדוללת 1:1,000 בתמיסת BSA/PBS 1% (למשל, Cy3 Goat Anti-Armenian Hamster IgG, שיש לו תגובתיות צולבת מינימלית עם בקר, אדם, חלבונים בסרום עכברים, ארנבים וחולדות, ראו טבלת חומרים). לדגור בתא לח במשך 1 שעה ב RT.
הערה: אופציונלי: ניתן להשתמש בסמן שלד ציטוסקלטון בנוסף לנוגדן המשני לניתוח התמונה הבא (כלומר, Alexa Fluor 647 Phalloidin מדולל ביחס 1:1,000, ראה טבלת חומרים). לטיפול קל, ניתן להניח את טיפות תמיסת הנוגדנים על יריעה של סרט איטום בתוך מיכל אחר במקום ישירות על משטח מוצק. - אספו את הכיסויים באמצעות פינצטה, ולאחר ניקוז תמיסת הנוגדנים המשנית העודפת, הניחו את הכיסויים בצלחת 24 בארות (צד התא כלפי מעלה) ושטפו אותם שלוש פעמים עם PBS של 500 מיקרוליטר.
- בעזרת פינצטה, אספו את הכיסויים, רוקנו בזהירות את עודפי ה-PBS באמצעות מגבוני רקמה דקים, והניחו בעדינות כל מכסה (צד התא כלפי מטה) על טיפה של 50 מיקרוליטר של תמיסת Hoechst בקנ"מ 1:4,000 (Hoechst 33342) ב-PBS. יש לדגור בתא לחות למשך 5 דקות ב-RT.
הערה: לטיפול קל, ניתן להניח את טיפות תמיסת הנוגדנים על יריעת סרט איטום בתוך מיכל אחר במקום ישירות על משטח מוצק. - אספו את הכיסויים באמצעות פינצטה, ולאחר ניקוז עדין של תמיסת Hoechst העודפת באמצעות מגבוני רקמות דקים, החליפו את הכיסויים בצלחת בעלת 24 הקידוחים, ושטפו שלוש פעמים עם PBS ופעם אחת במים דה-יוניים (500 מיקרוליטר לשטיפה).
- יש לנקז בזהירות את עודפי המים שעברו דה-יוניזציה באמצעות מגבוני רקמה דקים, ולהניח בעדינות כל מכסה (צד התא כלפי מטה) על טיפה של 10-20 מיקרוליטר של תמיסת הרכבה (ראו טבלת חומרים) המנומרת על מגלשת מיקרוסקופ לאימונופלואורסצנטיות, תוך הימנעות מהיווצרות בועות אוויר.
הערה: למדיום ההרכבה המשמש כאן יש את אותו מקדם שבירה כמו שמן טבילה ומתקשה לאחר מספר שעות ב- RT או לילה ב- 4 °C. ניתן להשתמש בתמיסות הרכבה ללא הקשחה, אך יש להקפיד לאטום את הכיסוי בלק. - הסר את תמיסת ההרכבה העודפת על ידי שאיפה, ותן לדגימות להתייבש בעודן שוכבות שטוחות ב- RT למשך הלילה בחושך, במחזיק שקופיות או מכוסה ברדיד אלומיניום.
3. רכישת תמונות
- הפעל את המיקרוסקופ הקונפוקלי. פתח את תוכנת ההדמיה (ראה רשימת חומרים) כדי להתחיל בהגדרת רכישת התמונה.
- בכרטיסייה פונקציה , בחר בעדשה האובייקטיבית Plan-Apochromat 63x/1.4 Oil DIC M27 כדי ללכוד את התמונות לניתוח.
- בכרטיסיה פונקציית רכישה , הפעל את הלייזרים המתאימים באזור הלייזר של לוח הבקרה (ארגון, דיודה-405-30, DPSS 561-10 ו- HeNe633).
- באזור Imaging Setup בלוח הבקרה, צור ארבע רצועות, כאשר כל רצועה מתאימה לערוץ אחד, כדי לבצע רכישה רציפה.
- הגדר את הרזולוציה המתאימה של התמונות בחלון מצב רכישה . הגדר את הרזולוציה ל- 1,024 x 1,024 (גודל מסגרת) ובחר עומק סיביות של 16 סיביות.
- עבור כל ערוץ, התאם את עוצמת הלייזר והרווח כדי לקבל אות טוב ללא פיקסלים רוויים, מה שיעכב את ניתוח עוצמת התמונה. באמצעות הלחצן Live , הגדר את רמת פלט הלייזר ואת Gain (Master).
הערה: מומלץ להשתמש באפשרות מחוון הטווח לזיהוי פיקסלים רוויים. שמור על עוצמת לייזר בין 1% ל- 10% ועל רווח (מאסטר) מתחת ל- 850 כדי למנוע רעשי רקע. - באזור ' ערוצים' בלוח הבקרה, הגדר את אותו מפתח צמצם עבור כל ערוץ, בהתחשב ביחידה אוורירית אחת (AU) עבור הערוץ בעל אורך הגל הגבוה ביותר.
- רכוש 10 שדות אקראיים המכילים כמויות דומות של תאים (20-30 תאים לכל שדה). רכישת 100-200 תאים לכל מצב תספק כוח טוב לניתוח התמונה מאוחר יותר.
4. ניתוח תמונה של פיזור ATG9A
- הורד תוכנת FIJI מהאינטרנט (ראה טבלת חומרים). פתח את התמונה עם FIJI על ידי לחיצה על תוספים > Bio-Formats > BioFormats Importer.
- לחצו על ' אנליזה' > 'קבע מדידות' ובחרו בערך האפור הממוצע בחלון המדידות לניתוח העוצמה.
- לחץ על תמונה > צבע > ערוצים מפוצלים, והפרד את הערוצים לשלוש תמונות (סמן Golgi, cytoskeleton, אות ATG9A).
- עברו אל ' תמונה' > 'התאם סף >' והגדירו סף בערוץ המתאים לסמן Golgi.
- לחצו על Edit > Selection > Create Selection, וצרו בחירה מהתמונה הבינארית.
- עבור אל ערוך בחירה > > הוסף למנהל > שנה שם (Golgi), שמור את הבחירה במנהל החזר ההשקעה ושנה את שמה ל- Golgi.
- לחץ על Image > Adjust > Threshold, והגדר סף בערוץ המתאים לסמן שלד התא כדי להגדיר את מתאר התא.
- עברו אל ' ערוך בחירה >' > 'צור בחירה' וצרו בחירה מהתמונה הבינארית.
- לחץ על ערוך בחירת > > הוסף למנהל > שנה שם (סה"כ), שמור את הבחירה במנהל החזר ההשקעה ושנה את שמה לסכום.
- בחר את התמונה המתאימה לצביעת ATG9A.
- ב - Analyse > Measure, החל את החזר ההשקעה Golgi על ידי לחיצה עליו, ומדוד את עוצמת אזור Golgi.
- לחץ על ניתוח > מדידה, החל את סכום החזר ההשקעה על ידי לחיצה עליו, ומדוד את עוצמת האזור הכולל.
- חזור על התהליך בכל התמונות, שמור את התוצאות כקבצי .csv ועבד את הנתונים באמצעות הנוסחה הבאה:
קצב פיזור ATG9A = עוצמת גולג'י/עוצמה כוללת
5. הדמיה של תאים חיים של מבני ATG9A
- זרע HEK293A תאים (או תאים לפי בחירה) ב 2 מ"ל של בינוני לתוך צלחת תרבית רקמה 60 מ"מ כך שהם מגיעים ~ 65%-70% מפגש למחרת; זה בדרך כלל נותן 1 x 10 6-2 x 106 תאים.
- למחרת, הכינו Lipofectamine:DNA mixes (או מגיב חלופי מתאים להעברת DNA, ראו טבלת חומרים) באופן הבא:
- בהתאם ליעילות ביטוי המבנה, יש לדלל 0.5-2 מיקרוגרם של DNA פלסמיד ל-100 μL של תווך מתאים ללא סרום, ולערבב בעדינות את התמיסה על ידי פיפטציה למעלה ולמטה. דוגרים על התערובת במשך 5 דקות ב-RT.
הערה: מבנה הדנ"א של פלסמיד הוא ספציפי לניסוי. החוקרים יכולים לשכפל בעצמם או לקבל מהמחברים על פי בקשה. - לדלל מגיב טרנספקציה Lipofectamine 2000 ביחס של 3:1 Lipofectamine:DNA לתוך 100 μL של מדיום מתאים ללא סרום ולערבב בעדינות את התמיסה על ידי pipeting למעלה ולמטה. דגרו על תערובת זו במשך 5 דקות ב- RT.
- ערבבו את שני הפתרונות יחד על ידי פיטום עדין למעלה ולמטה ודגירת במשך 20 דקות ב-RT.
- בהתאם ליעילות ביטוי המבנה, יש לדלל 0.5-2 מיקרוגרם של DNA פלסמיד ל-100 μL של תווך מתאים ללא סרום, ולערבב בעדינות את התמיסה על ידי פיפטציה למעלה ולמטה. דוגרים על התערובת במשך 5 דקות ב-RT.
- הוסף את תערובת Lipofectamine:DNA לכל צלחת תרבית תאים המכילה 4 מ"ל של מצע גידול, ונענע בעדינות את הצלחת קדימה ואחורה כדי לפזר את התערובת באופן שווה. לדגור את התאים ב 37 ° C באינקובטור תרבית תאים לחות ב 10% CO2.
- החליפו את המדיום במדיום גידול טרי 4 שעות לאחר הטרנספקציה, ודגרו על התאים בטמפרטורה של 37°C באינקובטור תרבית תאים לח ב-10%CO2 למשך הלילה.
- למחרת, טריפסינים, סופרים וזורעים מחדש את התאים על צלחות תרבית המתאימות למיקרוסקופ תאים חיים (צלחות תרבית עם כיסוי זכוכית מס' 1.5, ראו טבלת חומרים). זרע 0.4 x 10 6-0.7 x 106 תאים על הכלים כדי להגיע ~ 60%-75% מפגש על הכיסוי בזמן ההדמיה.
הערה: ציפוי עם פולי-D-ליזין, כפי שמוסבר בשלב 2.1, מומלץ עבור תאים HEK293A. - למחרת (48 שעות לאחר הטרנספקציה), דמיינו את התאים.
6. חקירת מצב הגליקוזילציה של ATG9A
- זרעו HEK293A תאים (או תאים לפי בחירה) בצלחת תרבית רקמה של 10 ס"מ כך שהם יגיעו למפגש ~80% למחרת אם מתכננים לחקור ATG9A אנדוגני, אשר בדרך כלל נותן 1.5 x 10 6-2.5 x 10 6 תאים ב 10 מ"ל. לחלופין, זרעו את התאים כך שהם יגיעו ~ 65%-70% מפגש אם מדביקים ATG9A מבנים, אשר בדרך כלל נותן 1 x 10 6-1.5 x 106 תאים ב 10 מ"ל.
- טפלו בתאים עם ציקלוהקסמיד 100 מיקרוגרם/מ"ל (CHX, ראו טבלת חומרים) או רכב למחרת. יש לדגור במשך 24 שעות (או עד לנקודת זמן רצויה).
- מוציאים את התאים מהאינקובטור, שואפים את התווך ומניחים על קרח. החלף אותו עם 5 מ"ל של קר כקרח 1x PBS. נתקו פיזית את התאים מהצלחת באמצעות מגרד תאים, והכניסו את תמיסת תאי PBS לצינור בעל תחתית חרוטית בנפח 15 מ"ל. צנטריפוגה ב 800 x גרם במשך 5 דקות ב 4 ° C כדי pellet את התאים.
- שאפו את הסופר-נאטנט, והשעו מחדש את התאים ב~100 μL (תלוי בגודל כדורית התא) של חיץ TNTE ליזיס קר כקרח (1% טריטון, 150 mM NaCl, 20 mM Tris-HCl, pH 7.4, 0.5 mM EDTA) בתוספת טבליות קוקטייל מעכבי פרוטאז (ראו טבלת חומרים), והעבירו לצינור מיקרוצנטריפוגה בנפח 1.5 מ"ל.
- דוגרים על הליזט על קרח במשך 15 דקות. לאחר מכן, צנטריפוגה את הליזט ב 20,000 x גרם במשך 10 דקות ב 4 ° C כדי לשקוע גרעינים ופסולת בלתי מסיסה, ולהעביר את supernatant לצינור microcentrifuge טרי.
- לכמת את ריכוז החלבון של הליזט באמצעות שיטת ברדפורד20 וספקטרופוטומטר שיכול למדוד באורך גל של 595 ננומטר.
- לנרמל את כמויות החלבון, ולשלב 16 μL של lysate (המכיל לא יותר מ 100 מיקרוגרם של חלבון בסך הכל) עם 5x PNGase F (Peptide:N-glycosidase F) חיץ על פי הוראות היצרן לפני הוספת 1 μL של אנזים PNGase F (ראה טבלה של חומרים). יש לדגור בהתאם להוראות יצרן PNGase F.
- הוסף נפח של 3x מאגר דגימות Laemmli כדי להשיג ריכוז 1x, ודגר ב 65 ° C במשך 5 דקות לפני העמסה עבור אלקטרופורזה באמצעות ג'ל Tris-אצטט כדי למקסם את ההפרדה של חלבונים. מעבירים את החלבונים מהג'ל לממברנה מתאימה (כלומר, PVDF [polyvinylidene difluoride]) באמצעות פרוטוקולי כתם מערביים סטנדרטיים21 (ראה טבלת חומרים).
הערה: הרתחת הדגימות ב-95°C תגרום לצבירה של ATG9A, ובכך תפחית את הזיהוי של ATG9A. - בצע את הכתם המערבי באמצעות נוגדנים ספציפיים עבור ATG9A (נוגדן STO-215, המיוצר בתוך הבית1) (ראה טבלת חומרים). השאירו את החלק בעל המשקל המולקולרי הגבוה יותר של הממברנה לא חתוך כדי לדמיין את המינים בעלי המשקל המולקולרי ATG9A הגבוה יותר.
תוצאות
ATG9A הוא חלבון טרנסממברנה הקשור למספר תאי קרום 8,17,22,23,24. בתנאים בסיסיים, ATG9A ממוקם בעיקר ברשת טרנס-גולג'י (TGN), כפי שמצוין על-ידי האימונופלואורסצנטיות של החלבון האנדוגני והחפיפה עם GM130, סמן cis-Golgi (איור 1A), כמו גם בשלפוחיות קטנות החופפות חלקית לתא המיחזור האנדוציטי (ERC)23. ניתן לזהות לוקליזציה ATG9A בגולג'י באמצעות פרוטוקולים שונים של אימונופלואורסנציה. עם זאת, החלק השלפוחית של ATG9A, כמו גם שינוי הלוקליזציה שלו, במיוחד הגידול במאגר השלפוחית, בתגובה לגירויים ספציפיים כגון רעב מזין וסרום, יכול להיות משתנה למדי בעוצמתו וקשה לדמיין עם גישות הדמיה קונבנציונליות. היחס בין ATG9A מקומי בגולג'י לבין ATG9A מקומי לשבר שלפוחית נקרא קצב פיזור ATG9A. כדי לזהות שינויים בקצב פיזור ATG9A, למשל בטיפול EBSS, המשמש לדלדול חומצות סרום ואמינו, סמן גולג'י כגון GM130 או TGN46 וסמן שלד ציטו-שלד כגון פאלואדין, אשר מכתים את מתאר התא25, שימושיים לכימות קל של פיזור ATG9A (איור 1B). חשוב לציין, ניתוח יחס הפלואורסצנטיות הממוצע יכול להתפרש רק כמדד השוואתי בין תנאים ולא כשיעור פיזור קבוע. היחס בין המדורים תלוי מאוד בגורמים ביולוגיים ולא ביולוגיים כמו קו התאים שבו משתמשים, איכות הצביעה או שיטות הסף המיושמות (איור 1B). מסיבה זו, החוקר צריך להקים צינור המסוגל לזהות העשרת ATG9A Golgi בתנאי הניסוי הספציפיים שלהם ולאחר מכן להרחיב את הניתוח עם אותם פרמטרים לכל התמונות בקבוצה להיות מנותח. תמונות בינאריות מייצגות ואזורים שנבחרו לניתוח פלואורסצנטיות ממוצעת ATG9A מוצגים כמדריך באיור 1B.
ATG9A מכיל מספר תחומים טרנסממברנליים שמשני צדדיהם שני תחומים גמישים יחסית ובלתי מובנים N ו-C טרמינליים, מתוכם רצף C-terminal מקיף כמעט מחצית מהחלבון12. חשוב לציין, דפוס הלוקליזציה של ATG9A בעל ביטוי יתר יכול להיות מושפע מאיזה קצה חלבון מתויג (איור 2A). בפרט, כאשר משתמשים במערכות ביטוי ארעיות ומתייגים ATG9A ישירות על מסוף N שלו עם תג פלואורסצנטי (למשל, eGFP, mRFP או נגזרות), לוקליזציה Golgi שלו יכולה להיפגע חלקית, עם פחות העשרה נראית בתנאי בסיס (כלומר, מוזן), בעוד שלפוחיות ATG9A עדיין נראות בקלות (איור 2A). נראה כי תיוג ATG9A על מסוף C שלו גורם מעט לצבירים חיוביים גדולים יותר של GFP שניתן לצבור. לבסוף, גרסה מונומרית של mRFP-ATG9A מראה גם צבירים פלואורסצנטיים דומים של שלפוחיות וצביעת גולג'י קטנה בתאים בעלי ביטוי יתר (איור 2A).
ATG9A מתקפל בקרום חדר המיון לפני שהוא מועבר לשלפוחיות גולג'י ו-ATG9A. במהלך שהותו בחדר המיון, ATG9A משתנה על ידי גליקנים מקושרי N על אספרגין 99, ולאחר מכן עם הגעתו לגולג'י, הוא רוכש גליקנים מורכבים ובוגרים מקושרי N 1,14. שינוי זה על ידי גליקוזילציה יכול להיות מזוהה באמצעות כתם מערבי על ידי הופעת פס כפול14. בהתאם ללוקליזציה התוך-תאית שלו, רוב ATG9A האנדוגני מכיל גליקנים מורכבים מקושרי N, ולכן רצועת המשקל המולקולרי הגבוהה יותר היא הדומיננטית, עם רצועת משקל מולקולרית נמוכה יותר שנראית גם היא (איור 2B). הנוכחות של פס כפול נראית בקלות רבה ביותר כאשר משתמשים בג'ל Tris-אצטט כדי לשפר את הרזולוציה של חלבונים בעלי משקל מולקולרי גבוה יותר (איור 2B, בקרה, t = 0). כאשר החלבון האנדוגני עובר טיפול PNGase F (פפטיד:N-גליקוזידאז F), אשר מסיר את רוב הגליקנים המורכבים המקושרים ל-N, החלבון פועל כפס יחיד (איור 2B, PNGase F, t = 0). לכן, מצב הגליקוזילציה N-linked של ATG9A יכול לשמש כפרוקסי לניטור היציאה של ATG9A מה-ER ל-Golgi, אשר משתקף ביחס היחסי בין שני הפסים.
כאשר mRFP-ATG9A בונה מבנה ארעי, החלבון בעל ביטוי יתר מצטבר בתחילה בחדר המיון, אולי מאחר שמכונות הסחר אינן מסוגלות לקפל ולהעביר את כל ATG9A, ורצועת המשקל המולקולרי הנמוכה יותר היא הדומיננטית (איור 2C, בקרה t = 0). יש לציין כי לאחר 24 שעות של ביטוי mRFP-ATG9A, קיימת התפלגות שווה בקירוב בין הפסים העליונים והתחתונים, מה שמרמז על כך שמאגר mRFP-ATG9A נע לתוך גולג'י (איור 2C, Control, t = 24). אם התאים מטופלים עם cycloheximide (CHX), אשר חוסם סינתזת חלבון דה נובו 26, קיפול ויציאה של ATG9A מן המיון ניתן להבהיר. כאשר החלבון האנדוגני מקופל, מסוכרר ושוכן בגולג'י, הטיפול ב-CHX אינו משנה באופן משמעותי את היחס בין פסי המשקל המולקולריים הנמוכים והגבוהים יותר (איור 2B, בקרה). אולם באמצעות שימוש בביטוי הארעי של mRFP-ATG9A, טיפול CHX מקדם הצטברות של רצועת משקל מולקולרית גבוהה יותר (איור 2C, Control, CHX t = 24). רצועת mRFP-ATG9A בעלת המשקל המולקולרי הגבוה יותר קורסת לתוך הרצועה התחתונה לאחר טיפול ב-PNGase F (איור 2C, PNGase F, t = 24). הנתונים האלה מראים שהחלבון האנדוגני רוכש גליקנים בוגרים במהירות, כפי שמשתקף מהדומיננטיות של רצועת המשקל המולקולרית הגבוהה יותר, ומרדף CHX אינו משפיע על היחס בין הפסים הכפולים (איור 2B). במקרה של mRFP-ATG9A בעל ביטוי יתר חולף, טיפול CHX גורם להצטברות של הפס העליון, מה שמצביע על כך שגליקנים בוגרים יותר נרכשים כאשר בריכת המיון מתקפלת ויוצאת מהמיון אל הגולג'י (איור 2C).
הוספת מקשר בין רצף ATG9A לבין התגים הפלואורסצנטיים יכולה להיות מועילה בקידום לוקליזציה פיזיולוגית יותר וסחר של החלבון. מיזוג רצף 3x-FLAG (24 חומצות אמינו) בין פלואורופור N-terminal ו-ATG9A מסייע לחלבון בעל ביטוי יתר להתנהג באופן דומה לחלבון האנדוגני (איור 3). ואכן, mCherry-3xFLAG-ATG9A בעל ביטוי יתר מתחבר לסמן Golgi GM130 בתנאי הזנה (איור 3A). חשוב לציין שלוקליזציה זו ותא שלפוחית ATG9A נשמרים לאורך זמן, מה שמאפשר מחקר מרחבי-זמני של הסחר ב-ATG9A (איור 3B).
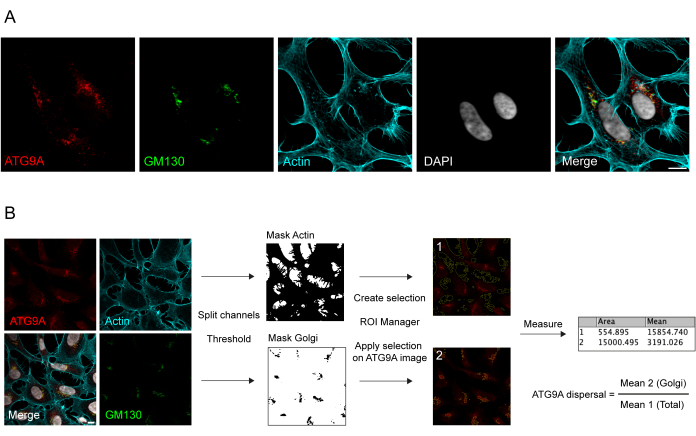
איור 1: ניתוח תמונות של לוקליזציה אנדוגנית של ATG9A. (A) תמונה אימונופלואורסצנטית מייצגת של ATG9A אנדוגני (אדום), GM130 כסמן גולג'י (ירוק) ופאלואדין כדי להמחיש את שלד האקטין (ציאן). סרגל קנה מידה = 10 מיקרומטר. (B) תהליך עבודה של ניתוח התמונה כדי לקבוע את החלק של ATG9A אנדוגני הממוקם באזור Golgi. סרגל קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
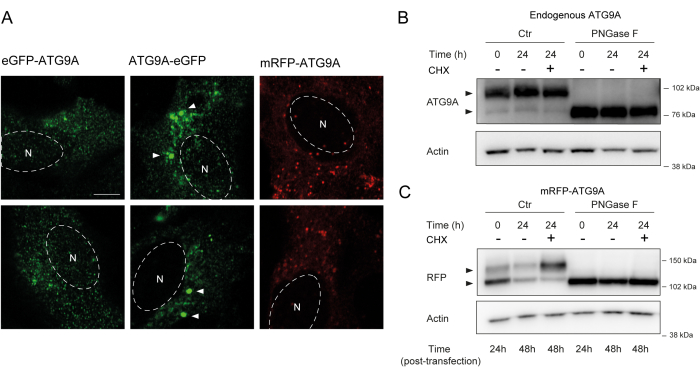
איור 2: ניתוח של מבנים המתויגים באופן פלואורסצנטי ATG9A על-ידי לוקליזציה וגליקוזילציה . (A) eGFP N-terminally tagged ATG9A פחות מקומי בגולג'י ושוכן בעיקר בשלפוחיות. ATG9A המתויג ב-eGFP C מציג אגרגטים בתוך התא (חלק מהדוגמאות מסומנות בראשי חץ לבנים; eGFP-ATG9A ו-ATG9A-eGFP מסומנים בירוק). mRFP N-terminally tagged ATG9A הוא פחות מקומי ב Golgi ומתגורר בעיקר שלפוחיות. N מציין את המיקום המשוער של גרעין התא, וה- mRFP-ATG9A מסומן באדום. סרגל קנה מידה = 5 מיקרומטר. (B) ATG9A אנדוגני מופיע כשני פסים כאשר הוא מנותח על ידי כתם מערבי (ראשי חץ): פס עליון (גליקנים מורכבים מקושרי N) ופס תחתון (ללא גליקנים בוגרים מקושרי N). הטיפול עם cyclohexamide (CHX) אינו משפיע על היחס בין הפסים העליונים והתחתונים. הטיפול ב- PNGase F גורם להיעלמות הרצועה העליונה. (C) לאחר טרנספקציה חולפת של ATG9A המתויג על ידי mRFP בתאי HEK293A, נראים שני פסים בולטים על כתם מערבי (ראשי חץ). הטיפול ב- PNGase F גורם להיעלמות הרצועה העליונה. טיפול ב- CHX לאחר טרנספקציה מוביל לגליקוזילציה מוגברת מכיוון שמאגר ATG9A הנגוע מועבר מהמיון לגולג'י. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
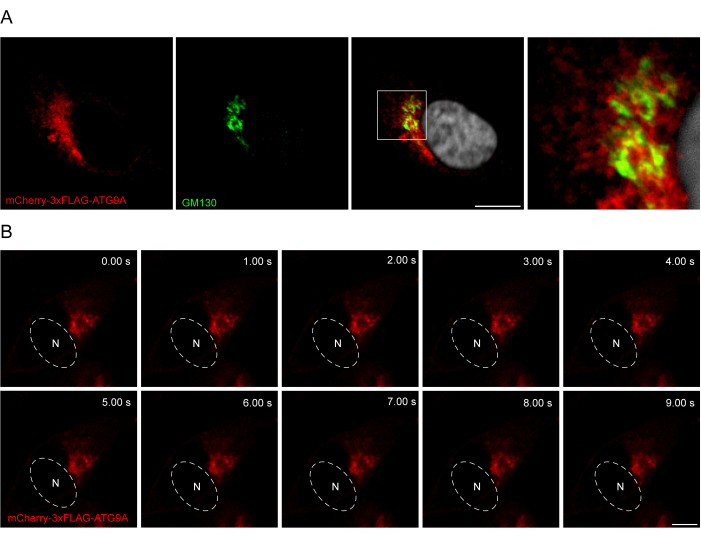
איור 3: ניתוח לוקליזציה של mCherry-3xFLAG-ATG9A על-ידי אימונופלואורסנציה והדמיה חיה. (A) ניסויים אימונופלואורסצנטיים של תאי HEK293A בעלי ביטוי יתר זמני של mCherry-3xFLAG-ATG9A ומוכתמים בסמן Golgi GM130. סרגל קנה מידה = 10 מיקרומטר. mCherry-3xFLAG-ATG9A צבוע באדום, וסמן GM130 Golgi צבוע בירוק. (B) מונטאז' מניסויי הדמיה חיה בתאי HEK293A המבטאים באופן ארעי את mCherry-3xFLAG-ATG9A. N מציין את המיקום המשוער של הגרעין. מסגרת זמן = 1 fps. סרגל קנה מידה = 10 מיקרומטר. mCherry-3xFLAG-ATG9A צבוע באדום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
מחקר זה ממחיש את הכלים השונים שניתן להשתמש בהם כדי לחקור לוקליזציה של ATG9A. ראשית, מחקר זה מתאר כיצד ATG9A ניתן לדמיין על ידי immunofluorescence וכיצד ניתן לכמת זאת. שנית, אסטרטגיות שניתן להשתמש בהן כדי לתייג ATG9A עם סמן פלואורסצנטי להדמיה בתאים קבועים או חיים מושווים. לבסוף, עבודה זו מתארת כיצד לחקור ולהשתמש במצב הגליקוזילציה של ATG9A כדי לקבוע אם ATG9A יצא מהמיון ונסחר דרך הגולג'י.
לגבי אפיון לוקליזציה אנדוגנית ATG9A על ידי אימונופלואורסצנציה, יש להקפיד על שיטות הקיבוע והחדירות הנהוגות לניסוי. על פי הנהלים הסטנדרטיים המתוארים כאן, קיבוע paraformaldehyde יחד עם permeabilization digitonin הם תנאים טובים כדי לדמיין הן ATG9A הקשורים Golgi ו ATG9A חיובי שלפוחית7. יחד עם הקיבוע והחלחול, גם עיתוי הדגירה עם פתרון הנוגדנים הראשוני הוא קריטי. ראינו, אך לא תועדנו, כי ריכוזים גבוהים יותר של תמיסת נוגדנים ראשונית וזמני דגירה ארוכים יותר יכולים להוביל לעלייה מטעה בצביעת גולג'י של ATG9A, אשר בסופו של דבר פוגעת בזיהוי של חלוקה מחדש של ATG9A לתאי ממברנה אחרים. בנוסף, מאחר ש-ATG9A קיים בתאים תוך-תאיים רבים 1,13,17,22,23,24,27,28,חשוב להשתמש בסמנים ספציפיים של הממברנה, יחד עם ATG9A, כדי לזהות היכן ATG9A ממוקם. מספר גישות שימשו בעבר לכימות לוקליזציה של ATG9A, כולל מקדם המתאם של פירסון עבור לוקליזציה29. עם זאת, החפיפה החלקית של ATG9A עם הגולג'י ותא השלפוחית המובהק מובילה למספר גבוה של חריגות פיקסלים, מה שעלול להטות את הפרשנות של מקדם המתאם. מסיבה זו עדיפה גישה פשטנית יותר המבוססת על היחס בין הפלואורסצנטיות הממוצעת בשני התאים המנותחים, וגישה זו פחות רגישה לשונות בין תאים. למידע נוסף על ניתוח תמונות באמצעות מיקרוסקופיה, הקוראים מופנים לספר זה פרק30.
כאשר חוקרים את מצב הגליקוזילציה של ATG9A, בחירת הג'לים להפעלת הכתמים המערביים חשובה. עבור פרוטוקול זה, 3%-8% ג'ל Tris-אצטט מועדפים מכיוון שהם מציעים את הרזולוציה הגבוהה ביותר עבור חלבונים גדולים יותר, אך ניתן להשתמש גם בהרכבי ג'ל חלופיים או חוצצים רצים המציעים הפרדה טובה של חלבונים בעלי משקל מולקולרי גבוה. הנסיין יכול להבטיח הפרדה מקסימלית של חלבונים על ידי הגדלת זמן האלקטרופורזה.
בעת הכנת הדגימות כדי לדמיין ATG9A על כתם מערבי, יש להקפיד לא להרתיח את הדגימות לאחר הוספת חיץ Laemmli; רתיחה ב 95 ° C גורם להיווצרות של אגרגטים ATG9A, ולאחר מכן, ATG9A אינו נודד ביעילות לתוך ג'ל1. חימום הדגימות ב 65 ° C במשך 5 דקות מומלץ27.
רמות גבוהות של טרנספקציה מובילות בדרך כלל להצטברות גבוהה יותר של ATG9A במיון, בעוד רמות ביטוי מתונות מסייעות ללוקליזציה הפיזיולוגית של החלבון. באופן אנקדוטלי, זמני דגירה של 72 שעות במקום 48 שעות מסייעים לעתים קרובות בהפחתת לוקליזציה של מיון. יש לציין כי mRFP-ATG9A יכול לדווח במדויק על סחר ATG9A ולתפקד אם הרמות נשלטות באמצעות רמות ביטוי או באמצעות קווי תאים יציבים 8,9,22,27.
כישלונה של אוכלוסייה של ATG9A להתבטא יתר על המידה לרכוש גליקנים בוגרים מקושרי N יכול לשמש כקריאה לסחר ATG9A מוטרד. בעת מוטציה או מחיקה של אזורים מסוימים של ATG9A, קיים סיכון של שימור מוגבר של ER, אשר יכול להוביל לכישלון לרכוש גליקנים בוגרים N-linkans, ולכן, רצועת ATG9A נודדת מהר יותר על כתם מערבי. חוקרים העובדים עם מבני ATG9A קטועים צריכים לבדוק שימור ER, מצבי גליקוזילציה ולוקליזציה של גולג'י.
עבור דימות תאים חיים של ATG9A, מיקרוסקופ Airyscan, המסתמך על הפונקציה Airyscan המהירה, מספק רזולוציה אופטימלית של בדרך כלל כ -120 ננומטר. לדיוק לוקליזציה, קצב פריימים של כ- 1-2 פריימים לשנייה (fps) במצב רזולוציית על הוא אופטימלי, בהתאם למספר הערוצים המצולמים. מיקרוסקופים קונפוקליים דומים שיכולים לצלם במהירות גבוהה יכולים לשמש גם להדמיה של שלפוחיות ATG9A; עם זאת, יש לציין כי מהירות ההדמיה יכולה להשפיע ישירות על זיהוי אירועים, ולכן, להשפיע על פרשנות הנתונים.
לסיכום, הפרוטוקולים המוצגים מתארים דרכים לכמת ולאפיין לוקליזציה של ATG9A על ידי אימונופלואורסנציה, מיקרוסקופ תאים חיים ומצב הגליקוזילציה שלו. פרוטוקולים אלה יכולים לסייע לחוקרים העובדים עם ATG9A ולעזור למנוע כמה מלכודות.
Disclosures
S.A.T. מכהנת בוועדה המדעית המייעצת של Casma Therapeutics.
Acknowledgements
המחברים מודים לרוקו ד'אנטונו על ההגהה של היבטי כתב היד, כמו גם לכל חברי המעבדה לביולוגיה מולקולרית של אוטופגיה (MCBA) בהווה ובעבר על הדיונים שהובילו לחידוד פרוטוקולים אלה. A. V.V., S.D.T., E.A., S.A.T, נתמכו על ידי מכון פרנסיס קריק המקבל את מימון הליבה שלו ממחקר הסרטן בבריטניה (CC2134), המועצה הבריטית למחקר רפואי (CC2134). מחקר זה מומן במלואו או בחלקו על ידי Wellcome Trust (CC2134). לצורך גישה פתוחה, המחבר החיל רישיון זכויות יוצרים ציבורי CC BY לכל גרסה של כתב היד המקובל על המחבר הנובעת מהגשה זו.
Materials
| Name | Company | Catalog Number | Comments |
| 24 multiwell plates | Falcon | 353047 | For tissue culture |
| 35 mm Dish | No. 1.5 Coverslip | 14 mm Glass Diameter | Uncoated | MATTEK | P35G-1.5-14-C | Cell culture dish for live-cell microscopy |
| 4x Laemmli Sample Buffer | Bio-Rad | 1610747 | |
| 60 mm tissue culture dish | Thermofisher Scientific | 10099170 | For tissue culture |
| Alexa Fluor 647 Phalloidin | Thermofisher Scientific | A22287 | Actin stain |
| anti-ATG9A antibody | home made | STO-215 | Rabbit anti N-terminal peptide ATG9A |
| anti-Rabbit IgG, peroxidase-linked | Invitrogen | 10794347/NA934-1ml | Secondary antibody for rabbit polyclonal STO-215 |
| anti-RFP antibody | Evrogen | AB233 | for Western Blot |
| ATG9A Monoclonal Antibody (14F2 8B1), Invitrogen | Invitrogen | 15232826 | Antibody for immunofluorescence |
| ATG9A-eGFP | home made | Construct which expresses tagged ATG9A | |
| Bemis Parafilm | Thermofisher Scientific | 11747487 | self-sealing thermoplastic film |
| Bio-Rad Protein Assay Dye Reagent Concentrate | Bio-Rad | 5000006 | For determining protein concentration |
| Bovine serum albumin (BSA) | Merck | 10735086001 | For blocking non-specific labelling |
| CaCl2.2H2O | / | For PBS and EBSS | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | Supplement in lysis buffer to prevent protein degradation |
| Cy3 AffiniPure Goat Anti-Armenian Hamster IgG | Jackson ImmunoResearch | 127-165-099 | Secondary antibody for i14F2 8B1 antibody for mmunofluorescence |
| Cyclohexamide | Sigma Aldrich | 66-81-9 | To stop protein translation |
| D-Glucose | / | For EBSS | |
| Digitonin | Merck | 300410 | For permeabilizing cells |
| DMEM | Merck | D6546-6x500ml | For tissue culture |
| eGFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Fetal Bovine Serum | Gibco | 10270-106 | Supplement for DMEM for cell culture |
| FIJI (ImageJ) | / | https:/fiji.sc/ | Open source image analysis software |
| Hoechst | Thermofisher Scientific | H3570 | Stains the nucleus |
| KCl | / | For EBSS | |
| L-glutamine | Sigma | 67513 | For tissue culture |
| Lipofectamine 2000 | Invitrogen | 11668-019 | For Cell Transfection |
| LSM880 Airyscan microscope | Zeiss | / | Confocal microscopy |
| MgCl2 | / | For PBS | |
| MgSO4.7H2O | / | For EBSS | |
| Mowiol mounting solution | Millipore | 475904 | for permanent mounting glass coverslips |
| NaCl | / | For EBSS | |
| NaH2PO4.2H2O | / | For EBSS | |
| NaHCO3 | / | For EBSS | |
| NuPAGE 3 to 8%, Tris-Acetate, 1.5 mm, Mini Protein Gels | Thermofisher Scientific | EA0378BOX | for Western Blotting |
| NuPAGE MES SDS Running Buffer (20x) | Life Tech | NP0002 | for Western Blotting |
| Opti-MEM I Reduced Serum Medium | Thermofisher Scientific | 31985062 | For Cell Transfection |
| Paraformaldehyde | Agar Scientific | R1026 | For fixing cells |
| pcDNA3.1-mCherry-3xFlag-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Phosphate Buffered Saline (PBS) | / | For tissue culture | |
| PNGaseF | NEB | P0710S | To remove N-linked glycans |
| Poly-D-lysine hydrobromide mol wt 70,000-150,000 | Merck | P0899 | For coating coverslips |
| Rapid PNGase F enzyme | NEB | P07105 | To remove N-linked glycans |
| RFP-ATG9A | home made | Construct which expresses tagged ATG9A | |
| Triton X-100 | Thermofisher Scientific | 13454259 | Detergent for Cell lysis |
| Trypsin-EDTA solution | Sigma | T4049 | For tissue culture |
| Whatman Filter Paper | Merck | WHA1001325 | For Western Blot and IF |
| XCell SureLock Mini-Cell Electrophoresis System | Invitrogen | EI0001 | For Western Blotting |
| Zen Black edition | Zeiss | / | Used to operate the LSM 880 |
References
- Young, A. R., et al. Starvation and ULK1-dependent cycling of mammalian Atg9 between the TGN and endosomes. Journal of Cell Science. 119, 3888-3900 (2006).
- Maeda, S., et al. lipid scrambling activity and role in autophagosome formation of ATG9A. Nature Structural & Molecular Biology. 27 (12), 1194-1201 (2020).
- Matoba, K., et al. Atg9 is a lipid scramblase that mediates autophagosomal membrane expansion. Nature Structural & Molecular Biology. 27 (12), 1185-1193 (2020).
- Mercer, T. J., Gubas, A., Tooze, S. A. A molecular perspective of mammalian autophagosome biogenesis. Journal of Biological Chemistry. 293 (15), 5386-5395 (2018).
- Yamamoto, H., Zhang, S., Mizushima, N. Autophagy genes in biology and disease. Nature Reviews: Genetics. , (2023).
- Sawa-Makarska, J., et al. Reconstitution of autophagosome nucleation defines Atg9 vesicles as seeds for membrane formation. Science. 369 (6508), (2020).
- Melia, T. J., Lystad, A. H., Simonsen, A. Autophagosome biogenesis: From membrane growth to closure. Journal of Cell Biology. 219 (6), 202002085 (2020).
- Orsi, A., et al. Dynamic and transient interactions of Atg9 with autophagosomes, but not membrane integration, are required for autophagy. Molecular Biology of the Cell. 23 (10), 1860-1873 (2012).
- Judith, D., et al. ATG9A shapes the forming autophagosome through Arfaptin 2 and phosphatidylinositol 4-kinase IIIbeta. Journal of Cell Biology. 218 (5), 1634-1652 (2019).
- Karanasios, E., et al. Autophagy initiation by ULK complex assembly on ER tubulovesicular regions marked by ATG9 vesicles. Nature Communications. 7, 12420 (2016).
- Koyama-Honda, I., Itakura, E., Fujiwara, T. K., Mizushima, N. Temporal analysis of recruitment of mammalian ATG proteins to the autophagosome formation site. Autophagy. 9 (10), 1491-1499 (2013).
- Guardia, C. M., et al. Structure of human ATG9A, the only transmembrane protein of the core autophagy machinery. Cell Reports. 31 (13), 107837 (2020).
- Soreng, K., et al. SNX18 regulates ATG9A trafficking from recycling endosomes by recruiting Dynamin-2. EMBO Reports. 19 (4), e44837 (2018).
- Staudt, C., Gilis, F., Boonen, M., Jadot, M. Molecular determinants that mediate the sorting of human ATG9A from the endoplasmic reticulum. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1863 (9), 2299-2310 (2016).
- Knaevelsrud, H., Carlsson, S. R., Simonsen, A. SNX18 tubulates recycling endosomes for autophagosome biogenesis. Autophagy. 9 (10), 1639-1641 (2013).
- Takahashi, Y., et al. The Bif-1-Dynamin 2 membrane fission machinery regulates Atg9-containing vesicle generation at the Rab11-positive reservoirs. Oncotarget. 7 (15), 20855-20868 (2016).
- Imai, K., et al. Atg9A trafficking through the recycling endosomes is required for autophagosome formation. Journal of Cell Science. 129 (20), 3781-3791 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- van Vliet, A. R., et al. ATG9A and ATG2A form a heteromeric complex essential for autophagosome formation. Molecular Cell. 82 (22), 4324-4339 (2022).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Bradford assay for determining protein concentration. Cold Spring Harbor Protocols. 2020 (4), 102269 (2020).
- Kurien, B. T., Scofield, R. H. Validating antibody specificities for immunohistochemistry by protein blotting. Methods in Molecular Biology. 2593, 21-33 (2023).
- Lamb, C. A., et al. TBC1D14 regulates autophagy via the TRAPP complex and ATG9 traffic. EMBO Journal. 35 (3), 281-301 (2016).
- Longatti, A., et al. TBC1D14 regulates autophagosome formation via Rab11- and ULK1-positive recycling endosomes. Journal of Cell Biology. 197 (5), 659-675 (2012).
- Ravussin, A., Brech, A., Tooze, S. A., Stenmark, H. The phosphatidylinositol 3-phosphate-binding protein SNX4 controls ATG9A recycling and autophagy. Journal of Cell Science. 134 (3), (2021).
- DesMarais, V., Eddy, R. J., Sharma, V. P., Stone, O., Condeelis, J. S. Optimizing leading edge F-actin labeling using multiple actin probes, fixation methods and imaging modalities. BioTechniques. 66 (3), 113-119 (2019).
- Ennis, H. L., Lubin, M. Cycloheximide: Aspects of inhibition of protein synthesis in mammalian cells. Science. 146 (3650), 1474-1476 (1964).
- Webber, J. L., Tooze, S. A. Coordinated regulation of autophagy by p38alpha MAPK through mAtg9 and p38IP. EMBO Journal. 29 (1), 27-40 (2010).
- Claude-Taupin, A., et al. ATG9A protects the plasma membrane from programmed and incidental permeabilization. Nature Cell Biology. 23 (8), 846-858 (2021).
- Aaron, J. S., Taylor, A. B., Chew, T. L. Image co-localization - Co-occurrence versus correlation. Journal of Cell Science. 131 (3), 211847 (2018).
- D'Antuono, R., Nechyporuk-Zloy, V. Basic digital image acquisition, design, processing, analysis, management, and presentation. Principles of Light Microscopy: From Basic to Advanced. , 77-104 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved