Method Article
Dioscin 通过抑制体内 B 细胞活化和减少体外半乳糖缺乏型 IgA1 的产生来缓解 IgA 肾病
摘要
本研究为用薯蓣菌根瘤 (DNR) 的活性成分薯蓣星 (DIO) 治疗免疫球蛋白 A 肾病 (IgAN) 提供了实验数据,并为研究体内和体外草药的作用和潜在机制提供了范例。
摘要
循环半乳糖缺陷型 IgA1 (Gd-IgA1) 的增加是由于粘膜免疫反应过程中 IgA 阳性分泌细胞过度激活引起的,是 IgA 肾病 (IgAN) 发病机制的关键环节。派尔斑是 B 淋巴细胞转化为分泌 IgA 的浆细胞的重要部位,是 IgA 的主要来源。此外,核心 1β-1,3-半乳糖基转移酶 (C1GalT1) 及其分子伴侣 C1GalT1 特异性分子伴侣 (Cosmc) 的较低表达与 IgAN 患者 IgA1 的糖基化异常有关。我们的临床经验表明,日本薯蓣 (DNR) 草药可以缓解 IgAN 患者的蛋白尿和血尿,并改善肾功能。薯蓣星 (DIO) 是 DNR 的主要活性成分之一,具有多种药理活性。本研究探讨了 DIO 治疗 IgAN 的可能机制,通过粘膜免疫诱导建立 IgAN 模型小鼠。将小鼠分为对照组、模型组和 DIO 管饲法组。免疫荧光和免疫组化检测小鼠肾小球 IgA 沉积、肾脏病理变化以及 Peyer 斑块中 B 细胞标志物 CD20 和 CXCR5 的表达。脂多糖 (LPS) 刺激后,通过细胞计数试剂盒 8 (CCK-8) 、酶联免疫吸附测定 (ELISA) 检测、实时定量聚合酶链反应 (QRT-PCR) 和蛋白质印迹 (WB) 研究 DIO 对 DAKIKI 细胞增殖、IgA 和 Gd-IgA1 分泌、C1GalT1 和 Cosmc 表达的影响。在 体内研究中 ,DIO 减轻了 IgAN 模型小鼠 IgA 沉积伴肾小球系膜增生和 Peyer 斑中 CD20 和 CXCR5 表达增加。 体外 研究表明,0.25 μg/mL 至 1.0 μg/mL DIO 抑制 LPS 诱导的 DAKIKI 细胞增殖、IgA 和 Gd-IgA1 分泌,并上调 C1GalT1 和 Cosmc 的 mRNA 和蛋白表达。本研究表明,DIO 可能通过抑制分泌 IgA 的细胞的过度激活和上调 C1GALT1/Cosmc 表达来减少 Gd-IgA1 的产生。
引言
IgA 肾病 (IgAN) 是最常见的原发性肾小球肾炎类型,目前尚无特异性治疗方法,它仍然是终末期肾病的重要原因1。尽管 IgAN 的发病机制仍不完全清楚,但“多重命中假说”已被普遍接受,并得到大量临床和实验研究证据的支持2。IgAN 的发病机制包括激活 B 细胞和产生半乳糖缺陷型 IgA1 (Gd-IgA1)3。在粘膜免疫反应期间,由于 IgA 分泌细胞的过度增殖和激活,循环 Gd-IgA1 的增加是 IgAN 发病机制的关键环节 4,5,6。作为 B 淋巴细胞表型向分泌 IgA 的细胞增殖和激活的中心场所,Peyer 贴片是 IgA 分泌的主要来源,与 IgAN 的发生和发展密切相关 7,8。此外,分泌 IgA1 的细胞的增殖,以及核心 1β-1,3-半乳糖基转移酶 (C1GalT1) 和 C1GalT1 特异性分子伴侣 (Cosmc) 的表达,与 IgA1 的异常糖基化有关,这会导致 IgAN 患者产生 GD-IgA1 6,9。
近年来,草药治疗 IgAN 的临床研究取得了进展。益气清洁方是广安门医院肾内科治疗IgAN的必备方剂。本组既往研究发现,益气清洁方治疗后 IgAN 患者血清中 Gd-IgA1 降低。作为益气清解方中最常用的草药之一,薯蓣科 (DNR) 是薯蓣的干燥根茎,具有调节免疫、抑制炎症、缓解咳嗽和哮喘等多种功能10,11。几位学者用 DNR 治疗 IgAN 并取得了良好的结果 12,13,14。作为 DNR15 中的主要活性成分,薯片素 (DIO) 可降低尿酸、抑制纤维化、抑制炎症反应和抗氧化应激16,17。因此,DIO 可能具有抑制细胞分泌过量的 Gd-IgA1 并发挥特异性肾脏保护作用的新型作用机制。尽管如此,尚未报道 DIO 治疗 IgAN 的作用机制。
为探索 DIO 对 IgAN 的潜在治疗机制,为治疗 IgAN 提供新方法,我们开展了 DIO 对 IgAN 体内外治疗效果的实验。
研究方案
广安门市医院伦理委员会批准了该实验(动物实验伦理批准文号:IACUC-GAMH-2023-003)。
1. 为实验程序准备小鼠
- 在医院/研究中心的动物设施中饲养 22 只 SPF 级雄性 Balb/c 小鼠 (6-7 周龄,体重 20-25 克)。使用随机数表方法将动物分为对照 (n = 8) 和模型 (n = 14) 组。
- 在实验室笼中适应性饲养 1 周后,根据 Zou 等人的建模方案,用 0.1% 牛丙种球蛋白 (BGG) 溶液在含有 6 mmol/L HCl 的酸化水中喂养模型组(IgAN 组)9 周18。
- 将 0.1 mL 0.1% BGG 盐水溶液连续 3 天注入尾静脉,同时继续饮用 BGG 溶液以制备 IgAN 实验小鼠模型18。
- 让对照组自由饮用 6 mmol/L HCl 酸化水,不含 BGG 9 周。将相应体积的生理盐水连续 3 天注射到尾静脉中。
注:对照组和模型组的进料质量与正常进料相同。 - 尾静脉注射后,随机选择对照组 2 只小鼠和模型组 2 只小鼠,通过蛋白尿、光学显微镜和免疫荧光检查,以确定建模是否成功。
注意:不给动物提供食物,但并不禁止它们喝水;记录尿量。 - 通过代谢笼收集尿液 24 小时,并以 400 x g 离心 5 分钟;丢弃尿沉渣。上清液稀释 10 倍后,使用尿蛋白测定试剂盒测量蛋白尿浓度,然后乘以稀释因子和尿量以获得 24 小时的总尿蛋白。
注:显微镜和免疫荧光方法分别显示在第 3 节和第 4 节中。 - 模型制备成功后,将模型组中的 12 只小鼠分成 6 只小鼠,分别在模型组(IgAN 组)和 DIO 管饲法(DIO 组),按随机数表法。
- 让对照组继续饮用不含 BGG 的 6 mmol/L HCl 酸化水,模型组由含 6 mmol/L HCl 的酸化水组成的 0.1% BGG 溶液。根据药理实验方法的剂量转换公式计算 DIO 组管饲法给药的剂量(根据 70 kg 的人体质量换算)19。管饲法 DIO 片剂 0.06 g/kg,每天一次,持续 8 周。
- 管饲法 8 周后,用 0.4% 戊巴比妥钠 (60 mg/kg) 腹膜内麻醉小鼠,并通过脚趾捏确认适当麻醉后,分离肾脏和 Peyer 贴片,用于随后的光学显微镜检查和免疫组织化学分析。
注意: 体内 模型的方案在 补充 图 1 中。
2. 组织学分析
- 肾脏石蜡切片和 Peyer 贴剂
- 用 4% 多聚甲醛固定 3 mm 厚的肾组织或 1 个 Peyer 贴剂 24 小时,用梯度乙醇和二甲苯脱水。在蜡中浸泡 2 小时,密封并冷冻。
- 切下 2 μm 厚的肾切片和 4 μm 厚的 Peyer 贴片切片,然后将它们铺在温水中。用干净的载玻片舀起展开的切片,并在 40 °C 的恒温烤箱中烘烤 1 小时。在标本预处理后开始染色。
注意:取肾脏肺门部分的冠状面,组织块的厚度为 3 毫米。
- 在室温 (RT) 下用高碘酸溶液对石蜡切片脱蜡和染色 10 分钟,避光。用蒸馏水冲洗,然后用 Schiff 染色液干擦 20-30 分钟,避光。用蒸馏水冲洗,直到切片在显微镜下呈红色。
- 将切片置于苏木精染色液中,染色细胞核 3 分钟(染色太深的细胞核可被乙醇盐酸盐分裂),然后用流水冲洗至载玻片无色。
- 用梯度浓度的乙醇和二甲苯进行常规脱水,用中性胶密封切片,并在显微镜下观察。PAS 阳性为红色,细胞核为蓝色。
3. Peyer 斑的免疫组织化学分析
- 如步骤 2.1 中所述,准备 Peyer 补丁的石蜡切片。
注意:免疫组织化学和随后的免疫荧光切片的厚度为 4 μm。 - 对石蜡切片进行脱蜡:
- 将切片放入二甲苯 I 中 5 分钟,将二甲苯 II 中 5 分钟,将二甲苯 III 中放入 5 分钟。
- 此外,在无水乙醇 I 中冲洗玻片 5 分钟,在无水乙醇 II 中冲洗 5 分钟,在 85% 酒精中冲洗 5 分钟,在 75% 酒精中冲洗 5 分钟。然后用蒸馏水冲洗载玻片。
- 抗原修复
- 制备 50 倍柠檬酸钠储备溶液,并用蒸馏水稀释至 1 倍以供使用。在高压灭菌器中加热 2 分钟,然后将切片放入高压灭菌器中,确保液位超过切片的液位。
- 高温加热 5 分钟,然后让载玻片自然冷却。用 PBS 溶液洗涤切片 3 次,每次 5 分钟。
- 封闭内源性过氧化物酶:用免疫组织化学笔在圆圈中标记组织的边界。将切片在 RT 下在 3% 过氧化氢溶液中孵育 15 分钟,避光,然后用 PBS 溶液洗涤切片 3 次,每次 5 分钟。
- 血清封闭:通过在室温下将 10% 山羊血清滴在标记 30 分钟的组织切片上来封闭切片。确保切片均匀地被染色剂覆盖。
- 一抗孵育:轻轻抖掉封闭液,加入一定比例的制备好的一抗(CD20 [1:800];CXCR5 [1:800]) 添加到该部分。将切片平放在湿箱中,并在 4 °C 下孵育过夜。
注:向湿盒中加入少量水,以防止抗体蒸发。 - 二抗孵育:用 PBS 溶液洗涤切片 3 次,每次 5 分钟。通过摇晃切片干燥去除 PBS,用一滴一抗相关物种的二抗(HRP 标记)覆盖组织,并在 RT 下孵育 50 分钟。
- 3,3'-二氨基联苯胺 (DAB) 均质化:用 PBS 溶液洗涤切片 3 次,每次 5 分钟。将切片摇干后,将新鲜制备的 DAB 显色溶液滴在切片上。在显微镜下观察显色时间;阳性为棕黄色。用自来水冲洗以终止颜色发展。
- 染色核:用苏木精复染约 1 分钟,用自来水洗涤,然后用自来水冲洗 10 分钟,恢复为蓝色。
- 脱水和密封:
- 将切片放入 75% 酒精中 5 分钟,将 85% 酒精中放置 5 分钟。将切片置于无水乙醇 I 中 5 分钟,将无水乙醇 II 置于 5 分钟,将无水乙醇 III 置于 5 分钟。
- 在二甲苯 I 中清洗切片 5 分钟,取出略微晾干,并用中性胶密封切片。
- 图像采集:通过显微镜检查收集图像,并通过 halo 软件进行分析,对组织进行全景图像分析。
注:苏木精染色的细胞核为蓝色,DAB 阳性表达为棕黄色。
4. 肾脏 IgA 免疫荧光
- 如步骤 2.1 中所述,为肾脏准备石蜡切片。
- 脱蜡石蜡切片:
- 将切片放入二甲苯 I 中 5 分钟,将二甲苯 II 中 5 分钟,将二甲苯 III 中放入 5 分钟。在无水乙醇 I、无水乙醇 II、95% 乙醇、90% 乙醇、80% 乙醇、70% 乙醇和 50% 乙醇中处理切片,各 5 分钟,并用蒸馏水洗涤。
- 蛋白酶 K 修复:将切片摇干,并用组织化学笔在组织切片周围画一个圆圈。滴加蛋白酶 K 工作溶液(储备液和 PBS 的比例为 1:9)以覆盖组织,并在 37 °C 下孵育 30 分钟。用 PBS 洗涤切片 3 次,每次 5 分钟。
- 穿透细胞膜:将切片稍微摇干,然后用 0.1% Triton 覆盖。在 RT 中孵育 20 分钟,然后用 PBS 洗涤切片 3 次,每次 5 分钟。
- 封闭:滴加 10% 山羊血清以均匀覆盖组织,以便在 RT 下封闭 30 分钟。
- 一抗孵育:滴加适量山羊抗小鼠 AF488 偶联物 IgA 抗体 (1:500) 均匀覆盖组织,并在 4 °C 下孵育过夜。
- 染色细胞核:用 PBS 洗涤切片 3 次,每次 5 分钟。去除 PBS 后,在切片上滴加 4',6-二脒基-2-苯基吲哚 (DAPI) 染色剂,并在室温下避光孵育 15 分钟。
- 清洗并密封切片:用 PBS 清洗切片 3 次,每次 5 分钟,然后用抗淬灭封固剂密封。
- 显微镜和摄影:在荧光显微镜下观察切片并拍摄图像。
注:对于 DAPI,紫外线激发波长为 330-380 nm,发射波长为 420 nm,蓝光。异硫氰酸荧光素 (FITC) 激发波长为 465-495 nm,发射波长为 515-555 nm,绿光。
5. 细胞培养
- 从美国 ATCC 获得人 B 淋巴细胞系 DAKIKI。在补充有 10% FBS 和 1% 青霉素 - 链霉素的 RPMI-1640 培养基中培养 DAKIKI 细胞。
- 在 37 °C、5% CO2 培养箱中培养细胞,每 2-3 天传代培养一次。在所有实验中使用对数生长期的细胞。
- 在 70%-80% 汇合度时,用无菌移液器收集细胞,并以 140 x g 离心细胞 5 分钟。弃去上清液,用无血清培养基重悬,24 小时后,将所有细胞置于静止期以进行后续处理。
6. 用于在正常 DAKIKI 细胞上筛选安全浓度 DIO 的 LDH 细胞毒性测定
- 将 DAKIKI 细胞以 4x105 个细胞/孔的密度接种在 96 孔板中,并设置低对照组、高对照组和不同浓度的 DIO(0.25、0.5、1.0、2.0、4.0、8.0 μg/mL)。根据分组方法,在相应处理后,在 5% CO2、37 °C 培养箱中孵育 24 小时。
- 根据细胞毒性检测试剂盒的说明,在高对照组每孔加入 5 μL 裂解物,然后将板置于 5% CO2、37 °C 培养箱中 15 分钟。
- 取出板,向每个孔中加入 100 μL 反应混合物,在 RT 下避光孵育 10 分钟,然后加入 50 μL 终止反应溶液。尽快在酶标仪上测量 490 nm 处的 OD 值。
- 计算不同浓度 DIO 的 LDH 释放率,≤10% 作为给药的最大剂量,根据以下公式:LDH 释放率 =(实验井 LDH - 低对照 LDH)/(高控制 LDH - 低控制 LDH)x 100%。
7. CCK-8 检测 DIO 对 DAKIKI 细胞增殖影响的检测
- 根据我们之前的实验结果20,使用 LPS 40 μg/mL 建立 IgAN 模型来诱导 DAKIKI 细胞。
- 然后,在 96 孔板中接种 4x10个 5 个细胞/孔,并分为对照组、模型组和 DIO 低、中和高浓度组(0.25 μg/mL、0.5 μg/mL 和 1.0 μg/mL)。将板在 5% CO2、37 °C 培养箱中孵育 24 小时。
- 然后,向每个孔中加入 20 μL CCK-8 试剂,并将板放回培养箱(5% CO 2,37 °C)中 2 小时。孵育后,尽快在酶标仪上检测 450 nm 波长的 OD。
8. ELISA 检测 DIO 对 DAKIKI 细胞分泌 IgA 和 Gd-IgA1 的影响
- 将 DAKIKI 细胞以 6x106 个细胞/孔的密度接种在 6 孔板中,并根据步骤 7.2 对细胞进行分组和处理。将细胞培养 24 小时,然后在 4 °C 下以 850 x g 离心 10 分钟以获得上清液。
- 根据试剂盒说明检测 IgA 和 Gd-IgA1 浓度。
9.qRT-PCR 检测 DIO 对 DAKIKI 细胞 C1GALT1 和 Cosmc mRNA 水平的影响
- 将 DAKIKI 细胞以 6x106 个细胞/孔的密度接种在 6 孔板中,将细胞分组并按照步骤 7.2 中提到的 CCK8 处理,并孵育 24 小时。根据总 RNA 提取试剂盒的说明从 DAKIKI 细胞中提取总 RNA。
- 从每组样品中取出 1 μL 提取的 RNA 并测量其浓度后,根据试剂盒说明将每个样品中的 1 μg 总 RNA 反向转录到 cDNA 中。
- 然后,进行 RT-PCR 扩增以检测每个基因的表达(95 °C 15 分钟,95 °C 10 秒,60 °C 30 秒)。使用 2-ΔΔCT 方法计算每个基因的表达水平,β-肌动蛋白作为内部参考。
注:引物序列如下:
C1GALT1: 5'-AAGGTTGACACCCAGCCTAA-3', 5'-CTTTGACGTGTTTGGCCTTT-3';
Cosmc: 5'-GCTCCTTTTTGAAGGGTGTG-3', 5'-TACTGCAGCCCAAAGACTCA-3';
β-肌动蛋白:5'-TCACCCACACTGTGCCCATCTACGA-3',5'-CAGCGGAACCGCTCATTGCCAATGG-3'。
10. Western blotting 用于检查 DIO 对 DAKIKI 细胞中 C1GALT1 和 Cosmc 蛋白表达的影响
- 将 DAKIKI 细胞以 6x106 个细胞/孔的密度接种在 6 孔板中。按照步骤 7.2 中的说明对它们进行分组和处理。孵育 24 小时后,收集每组细胞。
- 加入适量的细胞裂解液(PMSF:磷酸酶抑制剂:RIPA 裂解液 = 1:1:100)并在冰上孵育 30 分钟。然后在 4 °C 下以 13,500 x g 离心 10 分钟并收集上清液。
- 使用 BCA 蛋白浓度测定试剂盒测定蛋白质浓度。
- 通过涡旋将蛋白质样品与 5x SDS-PAGE 上样缓冲液以 4:1 混合,并在 100 °C 下加热混合样品 5 分钟以使蛋白质变性。
- 要检测不同分子量的蛋白质,将蛋白质标记物(5 μL/孔)和样品(20 μg/孔)添加到 12% SDS-PAGE 凝胶的不同泳道中,运行 SDS-PAGE 电泳,并将凝胶转移到 PVDF 膜上。
- 在 RT 下用 5% 脱脂牛奶封闭膜 2 小时,并与相应的一抗(C1GALT1 [1:1000]、Cosmc [1:2000])孵育 24 小时。使用 β-肌动蛋白抗体 (1:100000) 作为内参。
- 用 1x Tris 缓冲盐水、0.1% 吐温 20 去污剂 (TBST) 洗涤聚偏二氟乙烯 (PVDF) 膜 3 次(10 分钟/次),然后与相应的二级山羊抗兔 IgG 抗体 (1:10000) 在 RT 下孵育 2 小时。
- 再次用 TBST 洗涤膜(3 次,每次 10 分钟),并用适量的增强化学发光 (ECL) 工作溶液(根据制造商的说明)处理用于蛋白质条带检测。
- 使用化学发光成像系统捕获图像,并使用 Image J 图像分析系统对蛋白质的灰度值进行半定量分析。
11. 统计分析
- 使用适当的软件应用程序来分析数据。将所有数据表示为 SD (标准差) ±平均值,并通过单因素方差分析检验评估多个样本以进行组间比较。
注:SPSS 统计软件 26.0 用于统计分析。当方差相等时,LSD 法用于组间双向比较,当方差不相等时,Dunnett T3 法用于组间双向比较。P<0.05 被认为表明存在统计学意义差异。
结果
DIO 对 IgAN 小鼠模型肾组织的影响
与对照组相比,粘膜免疫诱导的 IgAN 小鼠模型(模型组)蛋白尿显著增加(补充 图 2),IgA 沉积在系膜区可见,荧光均匀分布在整个系膜区 (图 1A),肾组织的 PAS 染色显示系膜细胞增殖和基质增生 (图 1B),在 DIO 管饲法组 (DIO 组) 中降低。
DIO 对 Peyer 斑块 B 淋巴细胞的影响
Peyer 贴片是 B 淋巴细胞转化为 IgA 分泌细胞的主要位点。我们以 Peyer 贴片为研究对象,通过检测 B 细胞标志物 CD20 和 CXCR5 的表达来观察 DIO 对 B 淋巴细胞的影响。免疫组化结果显示,模型组CD20和CXCR5表达显著高于对照组。DIO 可以抑制上述分子标志物的表达 (图 2A、B)。
DIO 在 DAKIKI 细胞上的安全浓度范围
LDH 是质膜完整性的标志物和细胞死亡的指标,较高的 LDH 释放率表明细胞损伤更严重。采用 LDH 释放试验确定 DIO 的安全浓度范围。DIO 的最大安全浓度由低于 10% 的 LDH 释放率确定。结果(图 3)显示,DIO 在 0.25 至 1.0 μg/mL 的浓度下没有诱导明显的细胞毒性。因此,以下研究使用 0.25 、 0.5 和 1.0 μg/mL DIO 作为给药水平。
DIO 对 DAKIKI 细胞增殖的影响
实验结果(图 4)显示,与模型组 (LPS 刺激组) 相比,DIO 以浓度依赖性方式抑制 LPS 诱导的 DAKIKI 细胞增殖。浓度为 0.5 和 1.0 μg/mL 的 DIO 显著抑制 LPS 诱导的 DAKIKI 细胞增殖 (P < 0.01)。
DIO 对 DAKIKI 细胞分泌功能的影响
Gd-IgA1 水平与 IgAN 的病理过程密切相关,总 IgA 作为细胞分泌功能的指标一起检测。ELISA 检测 DAKIKI 细胞培养物上清液中 IgA 和 Gd-IgA1 含量。结果显示 (图 5A、B) 与对照组相比,受 LPS 刺激的 DAKIKI 细胞分泌更多的 IgA (P < 0.01)。相比之下,DIO 以浓度依赖性方式显着抑制 DAKIKI 细胞分泌 IgA (P < 0.01)。与对照组相比,LPS 刺激的 DAKIKI 细胞分泌更多的 Gd-IgA1 呈统计学趋势 (P < 0.10),DIO 抑制 LPS 刺激的 DAKIKI 细胞分泌 Gd-IgA1 呈浓度依赖性 (P < 0.05 和 P < 0.01),其中 1.0 μg/mL 的 DIO 显著抑制 Gd-IgA1 的分泌,抑制率为 25%。
DIO 的机制抑制 DAKIKI 细胞分泌 Gd-IgA1
为进一步探讨 DIO 抑制 DAKIKI 细胞过度分泌 Gd-IgA1 的可能机制,qRT-PCR 检测 DAKIKI 细胞中糖基化转移酶 C1GALT1 和伴侣蛋白 Cosmc mRNA 的水平,结果显示(图 6A,B)与对照组相比,模型组 DAKIKI 细胞中 C1GALT1 和 Cosmc mRNA 的相对表达下调(P < 0.01)。与模型组相比,DIO 在不同程度上上调了 C1GALT1 和 Cosmc 的相对 mRNA 表达,DIO 1.0 μg/mL 显著上调了 C1GALT1 和 Cosmc 的相对 mRNA 表达 (P < 0.05)。
同时,采用 WB 法检测 DIO 对 DAKIKI 细胞中 C1GALT1 和 Cosmc 蛋白表达的影响。与对照组相比,模型组 DAKIKI 细胞中 C1GALT1 和 Cosmc 蛋白表达明显下降 (P < 0.05)。与模型组相比,DIO 干预后 C1GALT1 和 Cosmc 蛋白表达上调。C1GALT1 和 Cosmc 的蛋白表达在 1.0 μg/mL 的浓度下被 DIO 显着上调 (P < 0.05) (图 7A-C)。
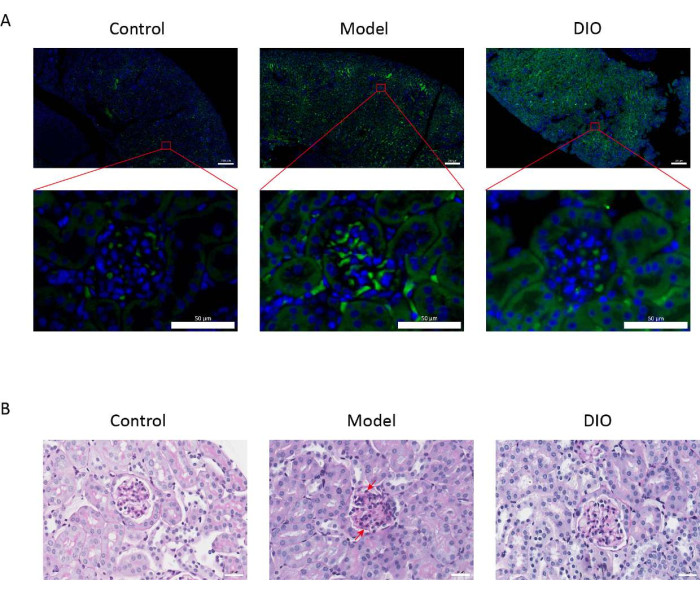
图 1:肾脏的组织病理学。 (A) 免疫荧光显微镜。各组小鼠肾脏切片用抗 IgA (绿色) 和 DAPI (蓝色) 染色。上面的图片比例尺 = 200 μm。下图比例尺 = 50 μm。n = 每组 6 个。(B) 对照组、模型组和 DIO 组小鼠肾组织 PAS 染色的代表性图片。比例尺 = 30 μm。向下的箭头显示系膜细胞,向上的箭头显示基质。比例尺 = 30 μm。n = 每组 6 个。 请单击此处查看此图的较大版本。
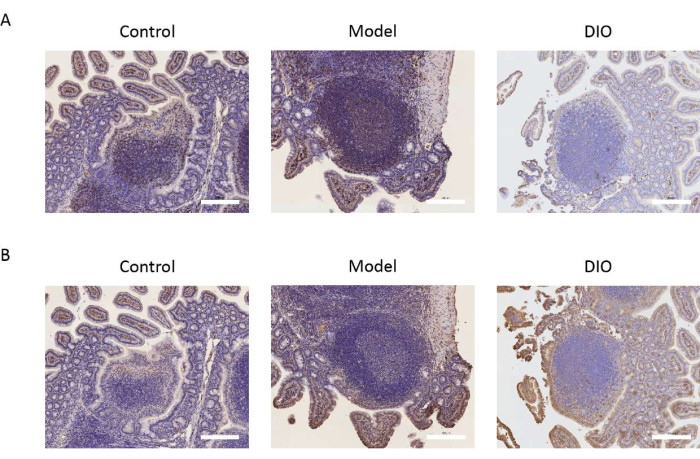
图 2:DIO 对 B 淋巴细胞标志物的影响。 (A) Peyer 贴片中 CD20 的表达。比例尺 = 200 μm。n = 每组 6 个。(B) CXCR5 在 Peyer 贴中的表达。比例尺位于图像的右下角。比例尺 = 200 μm。n = 每组 6 个。 请单击此处查看此图的较大版本。
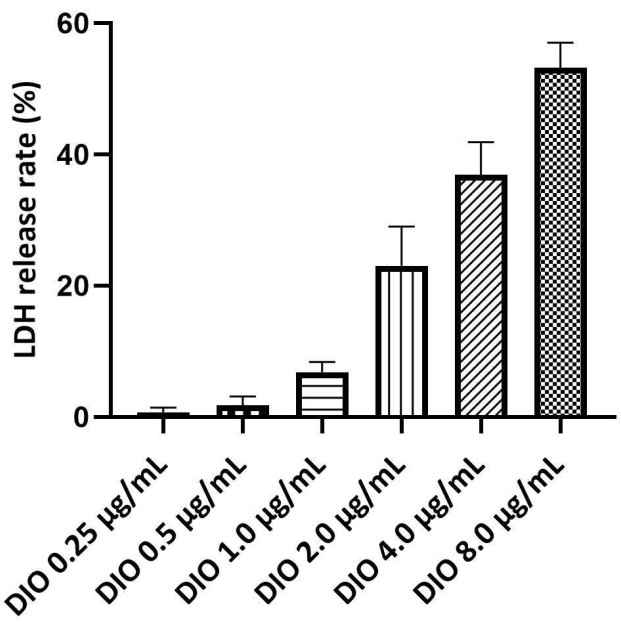
图 3.筛选 DAKIKI 细胞上 DIO 的安全浓度。 统计值表示为来自三个独立实验的 SD ±平均值。 请单击此处查看此图的较大版本。
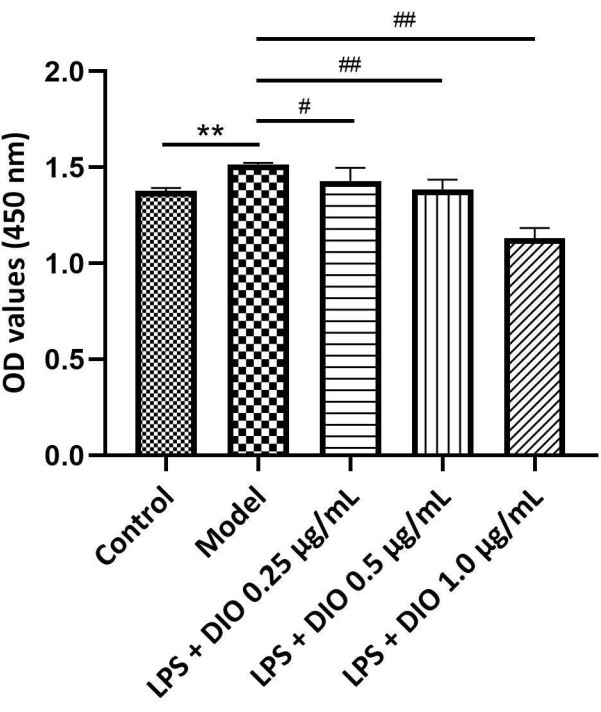
图 4.不同浓度的 DIO 会影响 DAKIKI 细胞的增殖。 数据以平均值 ±SD. 与对照组相比,**P < 0.01;与模型组相比, #P < 0.05' ##P < 0.01;所有实验的结果重复 3 次。 请单击此处查看此图的较大版本。
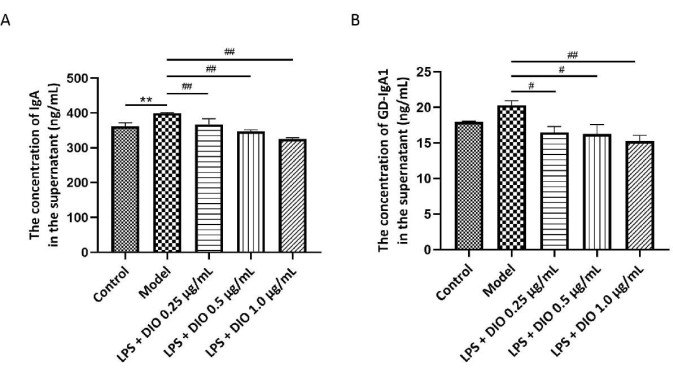
图 5.DIO 抑制 DAKIKI 细胞分泌 IgA 和 Gd-IgA1。 (A) ELISA 法检测各组 IgA 表达。(B) ELISA 法检测各组 Gd-IgA1 的表达。数据表示为 SD ±平均值。与对照组相比,**P < 0.01;与模型组相比, #P < 0.05, ##P < 0.01;所有实验结果均重复 3 次。 请单击此处查看此图的较大版本。
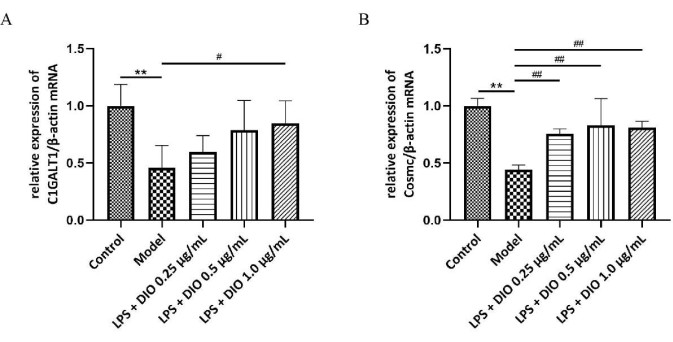
图 6.DIO 的机制抑制 DAKIKI 细胞过度分泌 Gd-IgA1。 (A) QRT-PCR 检测 C1GALT1 的 mRNA 表达。(B) QRT-PCR 检测 Cosmc 的 mRNA 表达。数据表示为 SD ±平均值。与对照组相比,**P<0.01;与模型组相比, #P < 0.05, ##P < 0.01;所有实验结果均重复 3 次。 请单击此处查看此图的较大版本。
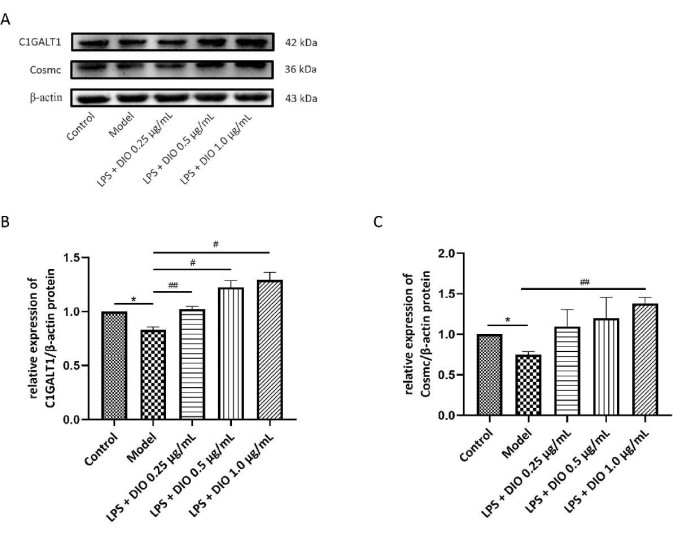
图 7.DIO 影响 DAKIKI 细胞中 C1GALT1 和 Cosmc 的蛋白表达。 (A) WB 验证了 DIO 上调 C1GALT1 和 Cosmc 蛋白表达。(B) 使用图像 J 对 C1GALT1 表达进行半定量分析。(C) 使用图像 J 对 Cosmc 表达进行半定量分析。数据以平均值 ±SD. 与对照组相比,*P < 0.05;与模型组相比, #P < 0.05,##P < 0.01,所有实验结果重复 3 次。 请单击此处查看此图的较大版本。
补充图 1.体内模型的架构。请单击此处下载此图。
补充 图 2.蛋白尿的变化。 数据表示为 SD ±平均值;n = 每组 6 个。 请点击此处下载此图表。
讨论
IgAN 的特征性病理特征是含有 IgA1 和 GD-IgA1 的免疫复合物在肾小球系膜区沉积21,22。减少免疫复合物的形成可以减少肾损伤并缓解 IgAN 的临床症状。在体内实验中,我们研究了 DIO 对 IgAN 的治疗效果,我们发现 DIO 可以减少 IgAN 模型小鼠肾脏中的 IgA 沉积。结果表明,肾脏中分泌 IgA 的细胞积累与 IgAN23 的发病机制有关。Peyer 斑作为 B 淋巴细胞增殖和活化的重要部位,是 IgA 分泌细胞的重要来源,因此我们检测了 Peyer 斑中 B 淋巴细胞标志物 (CD20、CXCR5) 的表达,发现 DIO 可以抑制 IgAN 小鼠模型中 B 淋巴细胞的表达。这些实验结果可为应用 DIO 治疗 IgAN 提供依据。
我们在 体外 进行了以下实验,以进一步研究 DIO 对 IgAN 的作用机制。首先,前面已经证明 DAKIKI 是一种分泌 IgA1 的 EBV 永生化 B 细胞系,其中一部分是 GD-IgA124,是药物对 IgAN 作用机制的 体外 研究的理想选择。我们选择 DAKIKI 细胞来研究 DIO 治疗 IgAN 的分子机制。此外,粘膜炎症免疫反应在 IgAN 的发病机制中起着不可或缺的作用。如上所述,我们使用 LPS 刺激 DAKIKI 细胞,DAKIKI 细胞可以释放促炎因子并介导炎症反应,这可以更好地模拟 IgAN 中粘膜免疫反应的机制。 体外 细胞模型可能有助于研究其他药物治疗 IgAN 的可能性和机制。结果表明,DIO 以浓度依赖性方式抑制 LPS 刺激的 DAKIKI 细胞的增殖。DIO 可抑制 LPS 刺激引起的 DAKIKI 细胞中 IgA 和 Gd-IgA1 的分泌,并上调 DAKIKI 细胞中 C1GalT1 及其伴侣 Cosmc 的 mRNA 和蛋白表达,表明 DIO 可以通过上调 C1GALT1/Cosmc 表达来减少 Gd-IgA1 的分泌,从而抑制 DAKIKI 细胞的过度活化。
在实验过程中应注意关键步骤。DAKIKI 细胞上清液中 Gd-IgA1 的浓度不在 ELISA 试剂盒的检测范围内(1.56~100 ng/mL),收集的上清液必须用超滤管离心,得到浓的 Gd-IgA1。此外,确保从每组开始的上清液体积相同,并且超滤后获得的浓缩物的最终体积相同。
在这项研究中,我们同时使用 了体外 和 体内 方法,它们在药理作用上可以相互支持,并为研究草药的作用及其机制提供了一个例子。此协议中有些内容可以改进。首先,我们没有检测到小鼠 DIO 管饲法组的血液浓度;因此,在 体外 实验中不使用相当于血液浓度的 DIO 浓度。其次,仅研究了 DNR 的活性成分 DIO 单体;DNR 的其他成分对 IgAN 的影响仍需进一步研究。
总之,本研究为用 DNR 的活性成分 DIO 治疗 IgAN 提供了实验依据。本研究通过模拟 体外 和 体内 IgAN 的粘膜免疫反应建立了 IgAN 的细胞病理模型。它为研究中医预防和治疗 IgAN 提供了新思路。
披露声明
作者声明他们没有相互竞争的经济利益。
致谢
这项工作得到了中国国家自然科学基金 (81973675) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Anti-CD20/MS4A1 Antibody | Boster Biotechnology Company | A03780-3 | |
| Antifade mounting medium | Beyotime, Shanghai, China | P0128S | |
| Balb/c mice | Beijing Weitong Lihua Laboratory Animal Technology Co., Ltd. | 110322220101424000 | |
| blocking serum | Solarbio, Beijing, China | SL038 | |
| Bovine gamma globulin | ShangHai YuanYe Biotechnology Company | S12031 | |
| C1GALT1 polyclonal antibody | Proteintech Group, Inc,USA | 27569-1-AP | |
| Citrate antigen retrieval solution(50×) | Phygene Biotechnology Company | PH0422 | |
| COSMC polyclonal antibody | Proteintech Group, Inc,USA | 19254-1-AP | |
| Cytotoxiciy detection kit | Roche Company | 4744926001 | |
| Dako REAL EnVision detection system, Peroxidase/DAB+ | Dako | K5007 | |
| DAPI | Invitrogen | D1306 | |
| Dioscin | National Institute For Food and Drug Control | 111707-201703 | |
| DIO tablets | Chengdu No 1 Pharmaceutical Co. Ltd. | H51023866 | |
| ECL working solution | Merck Biotechnology, Inc | WBKLS0100 | |
| Enhanced cell counting kit-8 | Beyotime, Shanghai, China | C0043 | |
| Fasking one-step removal of gene cDNA first-strand synthesis premix | TIANGEN,Beijing, China | KR118-02 | |
| Glycogen Periodic acid Schiff (PAS) stain kit | BaSO Biotechnology Company | BA4080A | |
| Goat anti-mouse IgA-AF488 | SouthernBiotech | 1040-30 | |
| Goat anti-rabbit IgG antibody (H+L), HRP conjugated | BeiJing Bioss Biotechnology Company | BS-0295G-HRP | |
| Human Gd-IgA1 ELISA kit | IBL | 27600 | |
| Human IgA ELISA kit | MultiSciences (LiankeBio) | 70-EK174-96 | |
| Pierce BCA protein assay kit | Thermo Scientific | 23227 | |
| PMSF solution | Beyotime, Shanghai, China | ST507 | |
| Proteinase K | Phygene Biotechnology Company | PH1521 | |
| Rabbit anti-CXCR5 polyclonal antibody | BeiJing Bioss Biotechnology Company | bs-23570R | |
| RIPA lysis buffer | Beyotime, Shanghai, China | P0013B | |
| RNAsimple total RNA extraction kit | TIANGEN,Beijing, China | DP419 | |
| RPMI Medium 1640 | Solarbio, Beijing, China | 31800 | |
| Super-Bradford protein assay kit | CWBIO, Beijing, China | CW0013 | |
| Triton X-100 | Beyotime, Shanghai, China | ST795 | |
| β-Actin Rabbit mAb | Abclonal, Wuhan, China | AC026 |
参考文献
- Knoppova, B., et al. The origin and activities of IgA1-containing immune complexes in IgA nephropathy. Frontiers in Immunology. 7, 117(2016).
- Suzuki, H., et al. The pathophysiology of IgA nephropathy. Journal of The American Society of Nephrology. 22 (10), 1795-1803 (2011).
- He, L., et al. Synthetic double-stranded RNA poly(I:C) aggravates IgA nephropathy by triggering IgA class switching recombination through the TLR3-BAFF axis. American Journal of Nephrology. 42 (3), 185-197 (2015).
- Zhao, N., et al. The level of galactose-deficient IgA1 in the sera of patients with IgA nephropathy is associated with disease progression. Kidney International. 82 (7), 790-796 (2012).
- Xing, Y., et al. C1GALT1 expression is associated with galactosylation of IgA1 in peripheral B lymphocyte in immunoglobulin a nephropathy. BMC Nephrology. 21 (1), 18(2020).
- Qin, W., et al. External suppression causes the low expression of the Cosmc gene in IgA nephropathy. Nephrology Dialysis Transplantation. 23 (5), 1608-1614 (2008).
- Sakai, F., et al. Lactobacillus gasseri SBT2055 induces TGF-β expression in dendritic cells and activates TLR2 signal to produce IgA in the small intestine. PLoS One. 9 (8), 105370(2014).
- Gutzeit, C., Magri, G., Cerutti, A. Intestinal IgA production and its role in host-microbe interaction. Immunological Reviews. 260 (1), 76-85 (2014).
- Serino, G., et al. In a retrospective international study, circulating miR-148b and let-7b were found to be serum markers for detecting primary IgA nephropathy. Kidney International. 89 (3), 683-692 (2016).
- Lu, F., et al. Therapeutic effect of Rhizoma Dioscoreae Nipponicae on gouty arthritis based on the SDF-1/CXCR 4 and p38 MAPK pathway: an in vivo and in vitro study. Phytotherapy research: PTR. 28 (2), 280-288 (2014).
- Wang, W., Xu, L., Zhou, L., Wan, S., Jiang, L. A Network pharmacology approach to reveal the underlying mechanisms of Rhizoma Dioscoreae Nipponicae in the treatment of asthma. Evidence-Based Complementary and Alternative Medicine: eCAM. 2022, 4749613(2022).
- Tian, W. W., Wei, Y. Professor TONG Xiaolin used the experience of Dioscoreae Nipponicae. Jilin Journal of Chinese Medicine. 40 (05), 589-592 (2020).
- Rao, X. R., Bai, Y. W. Das Xiwen's experience in treating IgA nephropathy. Beijing Journal of Traditional Chinese Medicine. 9, 691-693 (2008).
- Si, Y., Zhang, Y. A data mining study on the pattern of medication use in the treatment of IgA nephropathy by Professor Zhang Yu. Journal of Chinese Physician. 20 (01), 109-111 (2018).
- Jiang, H., et al. Optimization of the enzymatic extraction technology of Diosgenin from Dioscorea nipponica. Chinese Traditional Patent Medicine. 39 (03), 621-624 (2017).
- Qi, M., et al. Dioscin alleviates lipopolysaccharide-induced inflammatory kidney injury via the microRNA let-7i/TLR4/MyD88 signaling pathway. Pharmacological Research. 111, 509-522 (2016).
- Yang, L., et al. Recent advances in the pharmacological activities of Dioscin. BioMed Research International. 2019, 5763602(2019).
- Nal Zou, J., et al. Toll-like receptor 4 signaling pathway in the protective effect of Pioglitazone on experimental immunoglobulin A nephropathy. Chinese Medical Journal. 130 (8), 906-913 (2017).
- Xu, S. Y., Bian, R. L., Chen, X. Pharmacological experiments methodology. Chinese Pharmacological Bulletin. 1, 19(1992).
- Shen, J. C., Ren, Y., Rao, X. R., You, Y., Li, S. Network pharmacology, molecular docking, and in vitro experiments to explore the molecular mechanism of Dioscorea Nipponica Makion in the treatment of IgA nephropathy. World Journal of Integrated Traditional and Western Medicine. 16 (12), 2246-2254 (2021).
- Mestecky, J., et al. IgA nephropathy: molecular mechanisms of the disease. Annual Review of Pathology. 8, 217-240 (2013).
- Novak, J., et al. IgA1-containing immune complexes in IgA nephropathy differentially affect proliferation of mesangial cells. Kidney International. 67 (2), 504-513 (2005).
- Nihei, Y., et al. Identification of IgA autoantibodies targeting mesangial cells redefines the pathogenesis of IgA nephropathy. Science Advances. 9 (12), (2023).
- Raska, M., et al. Identification and characterization of CMP-NeuAc: GalNAc-IgA1 alpha2,6-sialyltransferase in IgA1-producing cells. Journal of Molecular Biology. 369 (1), 69-78 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。