Method Article
Dioscin In Vivo에서 B 세포 활성화를 억제하고 In vitro에서 갈락토오스 결핍 IgA1 생산을 감소시켜 IgA 신병증 완화를 중재했습니다.
요약
본 연구는 면역글로불린 A신증(IgAN)을 Dioscoreae Nipponicae Rhizoma(DNR)의 활성성분인 디오신(DIO)으로 치료하기 위한 실험 데이터와 in vivo 및 in vitro에서 한약의 효과 및 기저 기전을 연구하기 위한 패러다임을 제공합니다.
초록
순환 갈락토오스 결핍 IgA1(Gd-IgA1)의 증가는 점막 면역 반응 과정에서 IgA 양성 분비 세포의 과도한 활성화로 인해 발생하며, 이는 IgA 신병증(IgAN)의 발병기전에서 중요한 연결 고리입니다. B 림프구가 IgA를 분비하는 형질세포로 전환되는 중요한 장소인 Peyer's patch는 IgA의 주요 공급원입니다. 또한, 코어 1β-1,3-갈락토실트랜스퍼라제(C1GalT1)와 그 분자 샤페론인 C1GalT1-특이적 분자 샤페론(Cosmc)의 낮은 발현은 IgAN 환자에서 IgA1의 비정상적인 당화(glycosylation)와 관련이 있습니다. 당사의 임상 경험에 따르면 Dioscoreae Nipponicae Rhizoma(DNR) 한약은 IgAN 환자의 단백뇨 및 혈뇨를 완화하고 신장 기능을 개선할 수 있습니다. 디오신(DIO)은 다양한 약리활성을 가진 DNR의 주요 활성 성분 중 하나입니다. 이 연구는 점막 면역 유도에 의해 확립된 IgAN.The IgAN 모델 마우스의 IgAN을 치료하는 DIO의 가능한 메커니즘을 탐구합니다. 마우스는 대조군, 모델 및 DIO gavage 그룹으로 나뉘었습니다. 마우스의 사구체 IgA 침착, 신장 병리학적 변화, Peyer's patch의 B 세포 마커 CD20 및 CXCR5 발현은 면역형광 및 면역조직화학에 의해 검출되었습니다. LPS(lipopolysaccharide) 자극 후 DIO가 DAKIKI 세포 증식, IgA 및 Gd-IgA1 분비, C1GalT1 및 Cosmc 발현에 미치는 영향을 세포 계수 키트-8(CCK-8) 분석, 효소 결합 면역 흡착 분석(ELISA) 검사, 정량적 실시간 중합효소 연쇄 반응(QRT-PCR) 및 웨스턴 블로팅(WB). in vivo 연구에서, IgAN 모델 마우스의 Peyer's patch에서 사구체 간막 증식을 동반한 IgA 침착 및 CD20 및 CXCR5의 발현 증가는 DIO에 의해 완화되었습니다. 시험관 내 연구에 따르면 0.25μg/mL에서 1.0μg/mL DIO는 LPS 유도 DAKIKI 세포 증식, IgA 및 Gd-IgA1 분비를 억제하고 C1GalT1 및 Cosmc의 mRNA 및 단백질 발현을 상향 조절했습니다. 이 연구는 DIO가 IgA 분비 세포의 과도한 활성화를 억제하고 C1GALT1/Cosmc 발현을 상향 조절함으로써 Gd-IgA1 생성을 감소시킬 수 있음을 보여줍니다.
서문
IgA 신병증(IgAN)은 원발성 사구체신염의 가장 흔한 유형으로, 특별한 치료법이 없으며 말기 신장 질환의 중요한 원인으로 남아 있습니다1. IgAN의 발병 기전은 아직 완전히 이해되지 않았지만, "다중 히트 가설"은 일반적으로 많은 임상 및 실험 연구 증거에 의해 받아들여지고 뒷받침되고 있습니다2. IgAN의 발병기전은 B 세포를 활성화하고 갈락토오스 결핍 IgA1(Gd-IgA1)3을 생성하는 것을 포함합니다. 점막 면역 반응 중 IgA 분비 세포의 과도한 증식 및 활성화로 인한 순환 Gd-IgA1의 증가는 IgAN 4,5,6의 발병기전에서 중요한 연결 고리입니다. IgA 분비 세포로의 B 림프구 표현형 전환의 증식 및 활성화를 위한 중심 장소인 Peyer's patch는 IgA 분비의 주요 원천이며 IgAN 7,8의 발생 및 발달과 밀접한 관련이 있습니다. 또한, IgA1 분비 세포의 증식과 Core 1β-1,3-galactosyltransferase(C1GalT1) 및 C1GalT1-specific molecular chaperone(Cosmc)의 발현은 IgAN 환자에서 GD-IgA1 생성을 유발하는 IgA1의 비정상적인 당화(glycosylation)와 관련이 있었다 6,9.
최근 몇 년 동안 한약을 이용한 IgAN 치료에 대한 임상 연구가 진행되고 있습니다. Yiqi Qingjie 포뮬러는 Guang'anmen 병원 신장내과에서 IgAN을 치료하기 위한 필수 포뮬러입니다. 우리 그룹의 이전 연구에서는 Yiqi Qingjie Formula로 치료한 후 IgAN 환자의 혈청에서 Gd-IgA1이 감소한 것으로 나타났습니다. Yiqi Qingjie Formula에서 가장 많이 사용되는 허브 중 하나인 Dioscoreae Nipponicae Rhizoma(DNR)는 면역 조절, 염증 억제, 기침 및 천식 완화와 같은 다양한 기능을 가진 Dioscorea Nipponica Makino의 건조 뿌리줄기입니다10,11. 몇몇 학자들이 DNR로 IgAN을 치료하고 좋은 결과를 얻었습니다 12,13,14. DNR15의 주요 활성 성분인 디오신(DIO)은 요산을 낮추고, 섬유증을 억제하고, 염증 반응을 억제하고, 항산화 스트레스를 유발합니다16,17. 따라서 DIO는 과도한 Gd-IgA1의 세포 분비를 억제하고 특정 신장 보호 효과를 발휘하는 새로운 작용 기전을 가질 수 있습니다. 그러나 IgAN을 치료하기 위한 DIO의 작용 기전에 대한 연구는 보고되지 않았습니다.
IgAN에 대한 DIO의 잠재적 치료 기전을 탐색하고 IgAN의 치료를 위한 새로운 방법을 제공하기 위해 in vivo 및 in vitro에서 DIO가 IgAN에 미치는 치료 효과에 대한 실험을 수행했습니다.
프로토콜
광안먼병원 윤리위원회는 이 실험을 승인했다(동물실험 윤리승인번호: IACUC-GAMH-2023-003).
1. 실험 절차를 위한 마우스 준비
- 병원/연구 센터의 동물 시설에서 SPF 등급 수컷 Balb/c 마우스 22마리(생후 6-7주, 체중 20-25g)를 키웁니다. 난수 테이블 방법을 사용하여 동물을 대조군(n = 8)과 모형(n = 14) 그룹으로 나눕니다.
- 실험실 케이지에서 적응 사육 1주일 후, Zou et al.18의 모델링 프로토콜에 따라 9주 동안 6mmol/L HCl을 함유한 산성화된 물에 0.1% 소 감마 글로불린(BGG) 용액을 모델 그룹(IgAN 그룹)에 공급합니다.
- 식염수에 포함된 0.1% BGG 용액 0.1mL를 연속 3일 동안 꼬리 정맥에 주입하면서 BGG 용액을 계속 마시면서 IgAN 실험용 마우스 모델18을 제조합니다.
- 대조군이 9주 동안 BGG 없이 6mmol/L HCl 산성수를 자유롭게 마시게 합니다. 해당 부피의 식염수를 연속 3일 동안 꼬리 정맥에 주입합니다.
알림: 대조군과 모델 그룹은 일반 사료와 동일한 품질로 공급되었습니다. - 꼬리정맥 주입 후 대조군의 마우스 2마리와 모델군의 마우스 2마리를 무작위로 선정하여 단백뇨, 광현미경, 면역형광 등으로 검사하여 모델링이 성공적이었는지 판단합니다.
참고: 동물에게 음식은 제공되지 않지만 물이 금지되어 있지는 않습니다. 소변 배출량을 기록합니다. - 대사 케이지로 24시간 동안 소변을 채취하고 400 x g 에서 5분 동안 원심분리합니다. 소변 침전물을 버리십시오. 상층액을 10배 희석한 후 소변 단백질 분석 키트를 사용하여 단백뇨 농도를 측정한 다음 희석 계수와 소변량을 곱하여 총 소변 단백질의 24시간을 얻습니다.
참고: 현미경 검사와 면역형광 방법은 각각 섹션 3과 4에 나와 있습니다. - 모델을 성공적으로 준비한 후 모델 그룹의 12개의 마우스를 난수 테이블 방법에 따라 모델 그룹(IgAN기)과 DIO gavage 그룹(DIO 그룹)에 각각 6개의 마우스로 나눕니다.
- 대조군은 BGG 없이 6mmol/L HCl 산성화된 물을 계속 마시게 하고, 모델군은 6mmol/L HCl을 함유한 산성수로 구성된 0.1% BGG 용액을 마시게 합니다. 약리실험방법론의 용량 환산 공식에 따라 DIO기 gavage 투여의 용량을 계산합니다(인체 질량 70kg에 따라 환산)19. Gavage DIO 정제 0.06g/kg 8주 동안 하루에 한 번.
- 8주간의 개비질 후 0.4% 펜토바르비탈 나트륨(60mg/kg)으로 마우스를 복강내 마취하고 발가락 꼬집으로 적절한 마취를 확인한 후 후속 광학 현미경 및 면역조직화학 분석을 위해 신장과 Peyer's patch를 분리합니다.
참고: in vivo 모델에 대한 계획은 보충 그림 1에 있습니다.
2. 조직학적 분석
- 신장과 Peyer's patch를 위한 파라핀 절편
- 3mm 두께의 신장 조직 또는 1 Peyer's patch에 4% 파라포름알데히드를 24시간 동안 고정하고 그라디언트 에탄올과 크실렌으로 탈수합니다. 왁스에 2시간 동안 담그고 밀봉하고 얼립니다.
- 2μm 두께의 신장 절편과 4μm 두께의 페이어 패치 절편을 자르고 따뜻한 물에 펴 바릅니다. 깨끗한 유리 슬라이드로 펼쳐진 조각을 퍼내고 40°C의 항온 오븐에서 1시간 동안 굽습니다. 표본의 전처리 후 염색을 시작합니다.
참고: 신장의 구강 부분의 관상 표면을 3mm 조직 블록 두께로 촬영합니다.
- 빛을 피하고 주기적인 산성 용액으로 실온(RT)에서 10분 동안 파라핀 섹션을 왁스를 제거하고 염색합니다. 증류수로 헹구고 빛을 피해 20-30분 동안 Schiff의 염색 용액으로 건조 염색된 상태로 닦습니다. 현미경으로 단면이 빨갛게 될 때까지 증류수로 헹굽니다.
- 절편을 헤마톡실린 염색 용액에 넣고 핵을 3분 동안 염색하고(너무 깊게 염색된 핵은 에탄올 염산염으로 나눌 수 있음) 슬라이드가 무색이 될 때까지 흐르는 물로 헹굽니다.
- 에탄올과 크실렌의 그래디언트 농도로 일상적인 탈수를 수행하고, 중성 검으로 절편을 밀봉하고, 현미경으로 관찰합니다. PAS 양성은 빨간색이고 핵은 파란색입니다.
3. Peyer's patch의 면역조직화학적 분석
- 2.1단계에서 설명한 대로 Peyer's patch의 파라핀 섹션을 준비합니다.
참고: 면역조직화학적 및 후속 면역형광을 위한 절편의 두께는 4μm입니다. - 파라핀 부분을 왁스 제거:
- 절편을 크실렌 I에 5분 동안, 크실렌 II에 5분 동안, 크실렌 III에 5분 동안 넣습니다.
- 또한 슬라이드를 무수 에탄올 I에 5분, 무수 에탄올 II에 5분, 85% 알코올에 5분, 75% 알코올에 5분 동안 헹굽니다. 그런 다음 슬라이드를 증류수로 헹굽니다.
- 항원 검색
- 구연산나트륨 50x 원액을 준비하고 증류수로 1x로 희석하여 사용합니다. 오토클레이브에서 2분 동안 가열한 다음 슬라이스를 오토클레이브에 넣고 액체 레벨이 슬라이스 레벨을 초과하도록 합니다.
- 고온에서 5분 동안 가열한 다음 슬라이드를 자연적으로 식힙니다. PBS 용액으로 각각 5분 동안 슬라이스를 세 번 세척합니다.
- 내인성 과산화효소 차단: 면역조직화학적 펜으로 조직의 테두리를 원형으로 표시합니다. 빛으로부터 보호된 3% 과산화수소 용액에서 15분 동안 절편을 배양하고 매번 5분 동안 PBS 용액으로 절편을 3회 세척합니다.
- 혈청 차단: RT에서 30분 동안 표시된 조직 절편에 10% 염소 혈청을 떨어뜨려 절편을 차단합니다. 단면이 얼룩으로 고르게 덮여 있는지 확인합니다.
- 1차 항체 배양: 차단 용액을 부드럽게 털어내고 준비된 1차 항체(CD20 [1:800]; CXCR5 [1:800])을 추가합니다. 단면을 젖은 상자에 평평하게 놓고 4 °C에서 밤새 배양합니다.
참고: 항체의 증발을 방지하기 위해 젖은 상자에 소량의 물을 넣으십시오. - 2차 항체 배양: 매번 5분 동안 PBS 용액으로 절편을 세 번 세척합니다. 절편을 흔들어 건조시켜 PBS를 제거하고, 1차 항체의 관련 종의 2차 항체(HRP-label) 방울로 조직을 덮고, RT에서 50분 동안 배양합니다.
- 3,3'-디아미노벤지딘(DAB) 균질화: PBS 용액으로 절편을 각각 5분 동안 세 번 세척합니다. 단면을 흔들어 건조시킨 후 갓 준비한 DAB 발색 용액을 단면에 떨어뜨립니다. 현미경으로 색상 개발 시간을 관찰하십시오. 양수는 갈색을 띤 노란색입니다. 수돗물로 헹구어 발색을 종료합니다.
- 염색핵: 헤마톡실린으로 약 1분 동안 다시 염색하고 수돗물로 세척한 다음 수돗물로 10분 동안 헹구어 파란색으로 돌아갑니다.
- 탈수함과 바다표범 어업:
- 75분 동안 5% 알코올, 85% 알코올에 섹션을 5분 동안 넣습니다. 무수 에탄올 I에 5분 동안, 무수 에탄올 II를 5분 동안, 무수 에탄올 III에 5분 동안 섹션을 배치합니다.
- 크실렌 I로 단면을 5분 동안 세척하고 꺼내서 약간 건조시킨 다음 중성 검으로 단면을 밀봉합니다.
- 이미지 획득: 현미경 검사로 이미지를 수집하고 조직의 파노라마 이미지 분석을 위해 halo 소프트웨어로 분석합니다.
참고: Hematoxylin 염색 핵은 파란색이고 DAB 양성 발현은 갈색-노란색으로 관찰됩니다.
4. 신장 IgA 면역형광
- 2.1단계에서 설명한 대로 신장용 파라핀 절편을 준비합니다.
- 디왁스 파라핀 섹션:
- 절편을 크실렌 I에 5분 동안, 크실렌 II에 5분 동안, 크실렌 III에 5분 동안 넣습니다. 무수 에탄올 I, 무수 에탄올 II, 95% 에탄올, 90% 에탄올, 80% 에탄올, 70% 에탄올 및 50% 에탄올로 절편을 각각 5분 동안 처리하고 증류수로 세척합니다.
- Proteinase K 회수: 절편을 흔들어 말리고 조직화학 펜으로 조직 절편 주위에 원을 그립니다. proteinase K 작업 용액(원액과 PBS의 1:9 비율)을 적가하여 조직을 덮고 37°C에서 30분 동안 배양합니다. PBS로 섹션을 각각 5분 동안 세 번 세척합니다.
- 세포막 침투: 부분을 약간 건조하게 흔든 다음 0.1% 트리톤으로 덮습니다. RT에서 20분 동안 배양하고 PBS로 절편을 각각 5분 동안 세 번 세척합니다.
- 차단: 10% 염소 혈청을 한 방울 떨어뜨려 조직을 고르게 덮어 30분 동안 실온에서 차단합니다.
- 1차 항체 배양: 적당량의 goat anti-mouse AF488-conjugate IgA 항체(1:500)를 적가하여 조직을 균일하게 덮고 4°C에서 밤새 배양합니다.
- 염색 핵: PBS로 슬라이스를 각각 5분 동안 세 번 세척합니다. PBS를 제거한 후 절편에 4′,6-diamidino-2-phenylindole(DAPI) 염색을 적가하고 빛으로부터 보호된 RT에서 15분 동안 배양합니다.
- 섹션 세척 및 밀봉: PBS로 섹션을 5분 동안 세 번 세척한 다음 페이드 방지 장착 매체로 밀봉합니다.
- 현미경 및 사진: 형광 현미경으로 단면을 관찰하고 이미지를 촬영합니다.
참고: DAPI의 경우 자외선 여기는 파장 330-380nm이고 방출 파장은 420nm, 청색광입니다. 플루오레세인 이소티오시아네이트(FITC) 여기 파장은 465-495nm이고 방출 파장은 515-555nm이며 청신호입니다.
5. 세포 배양
- 미국 ATCC로부터 인간 B 림프구주 DAKIKI를 획득했습니다. 10% FBS 및 1% 페니실린-스트렙토마이신이 보충된 RPMI-1640 배지에서 DAKIKI 세포를 배양합니다.
- 37 °C, 5 % CO2 인큐베이터에서 세포를 배양하고 2-3 일마다 하위 배양합니다. 모든 실험에 대해 로그 성장 단계의 세포를 사용합니다.
- 70%-80% 밀도에서 멸균 피펫으로 세포를 수집하고 140 x g 에서 5분 동안 세포를 원심분리합니다. 상층액을 버리고 무혈청 배지로 재현탁한 다음 24시간 후에 후속 처리를 위해 모든 세포를 정지 상태로 둡니다.
6. 정상 DAKIKI 세포에서 안전한 농도의 DIO를 스크리닝하기 위한 LDH 세포독성 분석
- 4x105 cells/well 밀도의 96웰 플레이트에 DAKIKI 세포를 파종하고 Low control group, High control group 및 다양한 농도의 DIO(0.25, 0.5, 1.0, 2.0, 4.0, 8.0 μg/mL)를 설정합니다. 그룹화 방법에 따라 해당 처리 후 5 % CO2, 37 ° C 인큐베이터에서 24 시간 동안 배양합니다.
- 세포 독성 검출 키트의 지침에 따라 높은 대조군에서 웰당 5μL의 용해물을 추가한 다음 플레이트를 5% CO2, 37°C 인큐베이터에 15분 동안 넣습니다.
- 플레이트를 꺼내고 반응 혼합물 100μL를 각 웰에 첨가하고 실온에서 10분 동안 어두운 곳에서 배양한 다음 50μL의 정지 반응 용액을 추가합니다. 가능한 한 빨리 마이크로플레이트 리더에서 490nm에서 OD 값을 측정하십시오.
- 다양한 농도의 DIO 및 ≤10%의 LDH 방출률을 LDH 방출률 = (실험용 우물 LDH - 낮은 대조군 LDH) / (높은 대조군 LDH - 낮은 대조군 LDH) x 100% 공식에 따라 투여된 최대 용량으로 계산합니다.
7. DAKIKI 세포 증식에 대한 DIO의 효과를 검출하기 위한 CCK-8 분석
- 이전 실험20의 결과를 바탕으로 LPS 40 μg/mL를 사용하여 DAKIKI 세포를 유도하는 IgAN 모델을 구축합니다.
- 그런 다음 96웰 플레이트에 4x105 셀/웰을 파종하고 대조군, 모델 및 DIO 저농도, 중농도 및 고농도 그룹(0.25μg/mL, 0.5μg/mL 및 1.0μg/mL)으로 나눕니다. 플레이트를 5 % CO2, 37 ° C 인큐베이터에서 24 시간 동안 배양합니다.
- 그런 다음 각 웰에 20μL의 CCK-8 시약을 추가하고 플레이트를 인큐베이터(5% CO2, 37°C)에 2시간 동안 다시 넣습니다. 배양 후 가능한 한 빨리 마이크로플레이트 리더에서 450nm 파장에서 OD를 감지합니다.
8. DAKIKI 세포에 의한 IgA 및 Gd-IgA1 분비에 대한 DIO의 효과를 감지하기 위한 ELISA
- 6x106 cells/well 밀도의 6-well 플레이트에 DAKIKI 세포를 시드하고 7.2단계에 따라 세포를 그룹화하고 처리합니다. 세포를 24시간 동안 배양한 다음 4°C에서 10분 동안 850 x g 으로 원심분리하여 상층액을 얻습니다.
- 키트 지침에 따라 IgA 및 Gd-IgA1 농도를 검출합니다.
9.DAKIKI 세포의 C1GALT1 및 Cosmc mRNA 수준에 대한 DIO의 효과를 검출하기 위한 qRT-PCR
- 6-웰 플레이트에서 6x106 cells/well의 밀도로 DAKIKI 세포를 파종하고 세포를 그룹화하여 단계 7.2에서 언급한 CCK8로 처리한 다음 24시간 동안 배양합니다. total RNA 추출 키트의 지침에 따라 DAKIKI 세포에서 total RNA를 추출합니다.
- 각 샘플 그룹에서 추출된 RNA 1μL를 채취하고 농도를 측정한 후 키트 지침에 따라 각 샘플에서 총 RNA 1μg을 역으로 cDNA로 전사합니다.
- 그런 다음 RT-PCR 증폭을 수행하여 각 유전자의 발현을 검출합니다(95°C에서 15분, 95°C에서 10초, 60°C에서 30초). β-actin을 내부 기준으로 하는 2-ΔΔCT 방법을 사용하여 각 유전자의 발현 수준을 계산합니다.
참고: 프라이머 시퀀스는 다음과 같습니다.
C1GALT1: 5'-AAGGTTGACACCCAGCCTAA-3', 5'-CTTTGACGTGTTTGGCCTTT-3';
우주: 5'-GCTCCTTTTTGAAGGGTGTG-3', 5'-TACTGCAGCCCAAAGACTCA-3';
β-액틴: 5'-TCACCCACACTGTGCCCATCTACGA-3', 5'-CAGCGGAACCGCTCATTGCCAATGG-3'.
10. DAKIKI 세포에서 C1GALT1 및 Cosmc 단백질의 발현에 대한 DIO의 효과를 조사하기 위한 웨스턴 블로팅
- 6-웰 플레이트에서 6x106 cells/well의 밀도로 DAKIKI 셀을 파종합니다. 7.2단계에서 언급한 대로 그룹화하고 처리합니다. 24시간 배양 후 각 세포 그룹을 수집합니다.
- 적당량의 세포 용해 용액(PMSF: 인산가수분해효소 억제제: RIPA 용해 용액 = 1:1:100)을 넣고 얼음에서 30분 동안 배양합니다. 그런 다음 13,500 x g 에서 4 °C에서 10 분 동안 원심 분리하고 상층액을 수집합니다.
- BCA 단백질 농도 분석 키트를 사용하여 단백질 농도를 측정합니다.
- 단백질 샘플을 5x SDS-PAGE 로딩 버퍼와 4:1로 와류하여 혼합하고 혼합된 샘플을 100°C에서 5분 동안 가열하여 단백질을 변성시킵니다.
- 분자량이 다른 단백질을 검출하려면 단백질 마커(5μL/웰) 및 샘플(20μg/웰)을 12% SDS-PAGE 겔의 다른 레인에 추가하고, SDS-PAGE 전기영동을 실행하고, 겔을 PVDF 멤브레인으로 옮깁니다.
- RT에서 2시간 동안 5% 무지방 우유로 멤브레인을 차단하고 해당 1차 항체(C1GALT1 [1:1000], Cosmc [1:2000])로 24시간 동안 배양합니다. β-actin 항체 (1:100000)를 내부 대조군으로 사용하십시오.
- 폴리비닐리덴 플루오라이드(PVDF) 멤브레인을 1x 트리스 완충 식염수, 0.1% 트윈 20 세제(TBST)로 3회(10분/시간) 세척한 다음 해당 2차 염소 항토끼 IgG 항체(1: 10000)와 함께 실온에서 2시간 동안 배양합니다.
- 멤브레인을 TBST로 다시 세척하고(각 10분씩 3회) 단백질 밴드 검출을 위해 적절한 양의 ECL(Enhanced chemiluminescence) 작업 용액(제조업체의 지침에 따라)으로 처리합니다.
- 화학발광 이미징 시스템을 사용하여 이미지를 캡처하고 Image J 이미지 분석 시스템을 사용하여 단백질의 회색 값에 대한 반정량 분석을 수행합니다.
11. 통계 분석
- 데이터 분석을 위해 적절한 소프트웨어 응용 프로그램을 사용하십시오. 모든 데이터를 SD(표준 편차)± 평균으로 표현하고 그룹 간 비교를 위한 일원 분산 분석(one-way ANOVA) 검정으로 여러 표본을 평가합니다.
참고: SPSS 통계 소프트웨어 26.0이 통계 분석에 사용되었습니다. LSD 방법은 분산이 같을 때 그룹 간의 이원 비교에 사용되었고, Dunnett T3 방법은 분산이 같지 않을 때 그룹 간의 이원 비교에 사용되었습니다. P<0.05는 통계적으로 유의한 차이를 나타내는 것으로 간주되었습니다.
결과
IgAN 마우스 모델에서 DIO가 신장 조직에 미치는 영향
대조군과 비교했을 때, 점막 면역 유도 IgAN 마우스 모델(모델 그룹)은 단백뇨가 유의하게 증가하였고(보충 그림 2), IgA 침착은 간막 영역에서 볼 수 있었으며, 형광은 전체 간막 영역에 걸쳐 군집으로 균일하게 분포되어 있었으며 (그림 1A), 신장 조직의 PAS 염색은 간막 세포 증식 및 기질 증식을 보여주었습니다 (그림 1B), 이는 DIO gavage 그룹(DIO group)에서 감소되었다.
Peyer's patch의 B 림프구에 대한 DIO의 효과
Peyer's patch는 B 림프구가 IgA 분비 세포로 전환되는 주요 부위입니다. B 세포 마커 CD20 및 CXCR5의 발현을 감지하여 DIO가 B 림프구에 미치는 영향을 관찰하기 위해 Peyer의 패치를 연구 대상으로 삼았습니다. 면역조직화학적 결과는 CD20 및 CXCR5의 발현이 대조군에 비해 모델군에서 유의하게 높았다는 것을 보여주었다. DIO는 위의 분자 마커의 발현을 억제할 수 있습니다(그림 2A,B).
DAKIKI 셀에 대한 DIO의 안전한 농도 범위
LDH는 원형질막 무결성의 지표이자 세포 사멸의 지표이며, LDH 방출률이 높을수록 세포 손상이 더 심각함을 나타냅니다. LDH 방출 분석은 DIO의 안전한 농도 범위를 결정하는 데 사용되었습니다. DIO의 최대 안전 농도는 LDH 방출률이 10% 미만일 때 측정하였다. 결과(그림 3)는 0.25 - 1.0 μg/mL 농도에서 DIO에 의해 유도된 유의미한 세포독성을 보여주지 않았습니다. 따라서 다음 연구에서는 0.25, 0.5 및 1.0 μg/mL DIO를 투여 수준으로 사용했습니다.
DIO가 DAKIKI 세포 증식에 미치는 영향
실험 결과(그림 4)는 모델 그룹(LPS 자극 그룹)과 비교하여 DIO가 농도 의존적 방식으로 LPS 유도 DAKIKI 세포 증식을 억제한다는 것을 보여주었습니다. 0.5 및 1.0 μg/mL 농도의 DIO는 LPS 유도 DAKIKI 세포 증식을 유의하게 억제했습니다(P < 0.01).
DIO가 DAKIKI 세포의 분비 기능에 미치는 영향
Gd-IgA1 수치는 IgAN의 병리학적 과정과 밀접한 관련이 있으며, 총 IgA는 세포 분비 기능의 지표로 함께 검사됩니다. ELISA 분석을 사용하여 DAKIKI 세포 배양의 상층액에서 IgA 및 Gd-IgA1 함량을 검출했습니다. 그 결과(그림 5A, B) LPS에 의해 자극된 DAKIKI 세포는 대조군에 비해 더 많은 IgA를 분비하는 것으로 나타났습니다(P < 0.01). 이에 비해 DIO는 DAKIKI 세포가 농도 의존적 방식으로 IgA(P < 0.01)를 분비하는 것을 유의하게 억제했습니다. 대조군에 비해 LPS에 의해 자극된 DAKIKI 세포는 통계적 경향(P < 0.10)으로 Gd-IgA1을 더 많이 분비하였고, DIO는 LPS 자극 DAKIKI 세포에서 Gd-IgA1 분비를 농도 의존적으로 억제하였으며(P < 0.05, P < 0.01), 그 중 1.0 μg/mL의 DIO는 25%의 억제율로 Gd-IgA1의 분비를 유의하게 억제하였다.
DIO의 기전은 DAKIKI 세포에 의한 Gd-IgA1 분비를 억제합니다
DAKIKI 세포에 의한 과도한 Gd-IgA1 분비를 억제하는 DIO의 가능한 메커니즘을 추가로 조사하기 위해 DAKIKI 세포의 glycosylated transferase C1GALT1 및 chaperone protein Cosmc mRNA의 수준을 qRT-PCR로 검출했으며, 그 결과(그림 6A, B)에서 C1GALT1 및 Cosmc의 상대적 mRNA 발현이 대조군에 비해 모델 그룹의 DAKIKI 세포에서 하향 조절되었음을 보여주었습니다(P < 0.01)입니다. DIO는 C1GALT1와 Cosmc의 상대적 mRNA 발현을 모델 그룹에 비해 다른 정도로 상향 조절했으며, DIO 1.0μg/mL는 C1GALT1 및 Cosmc의 상대적 mRNA 발현을 유의하게 상향 조절했습니다(P < 0.05).
동시에 WB 방법을 사용하여 DAKIKI 세포에서 C1GALT1 및 Cosmc의 단백질 발현에 대한 DIO의 효과를 검출했습니다. 대조군과 비교했을 때, 모델군의 DAKIKI 세포에서 C1GALT1와 Cosmc의 단백질 발현은 뚜렷하게 감소하였다(P < 0.05). 모델 그룹과 비교하여, DIO 중재 후 C1GALT1 및 Cosmc의 단백질 발현은 상향 조절되었습니다. C1GALT1 및 Cosmc의 단백질 발현은 1.0μg/mL(P < 0.05)의 농도에서 DIO에 의해 유의하게 상향 조절되었습니다(그림 7A-C).
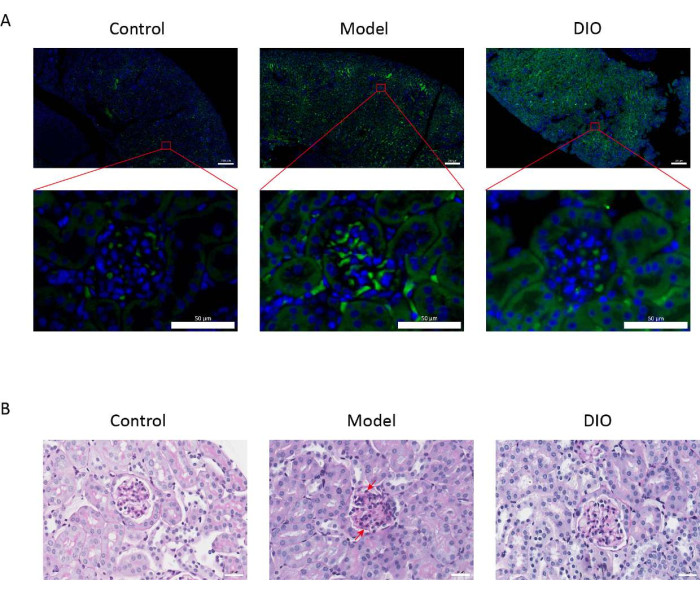
그림 1: 신장의 조직병리학. (A) 면역형광 현미경. 각 그룹의 마우스의 신장 절편을 항-IgA(녹색) 및 DAPI(파란색)로 염색했습니다. 위의 그림 눈금 막대 = 200μm. 아래 그림 눈금 막대 = 50μm. n = 그룹당 6. (B) 대조군, 모델 및 DIO 그룹의 마우스에서 신장 조직의 PAS 염색을 대표하는 사진. 눈금 막대 = 30 μm. 아래쪽 화살표는 간막 세포를 나타내고 위쪽 화살표는 기질을 나타냅니다. 눈금 막대 = 30 μm. n = 그룹당 6. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
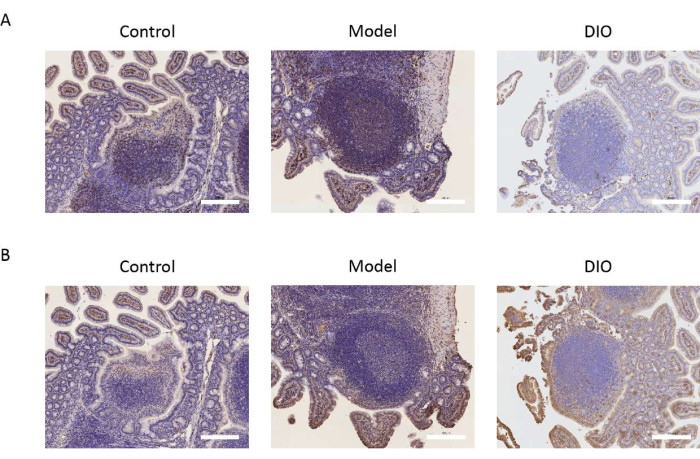
그림 2: B 림프구 마커에 대한 DIO의 효과. (A) Peyer's patch에서 CD20의 발현. 스케일 바 = 200 μm. n = 그룹당 6. (B) Peyer's patch에서 CXCR5의 발현. 축척 막대는 이미지의 오른쪽 아래 모서리에 있습니다. 스케일 바 = 200 μm. n = 그룹당 6. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
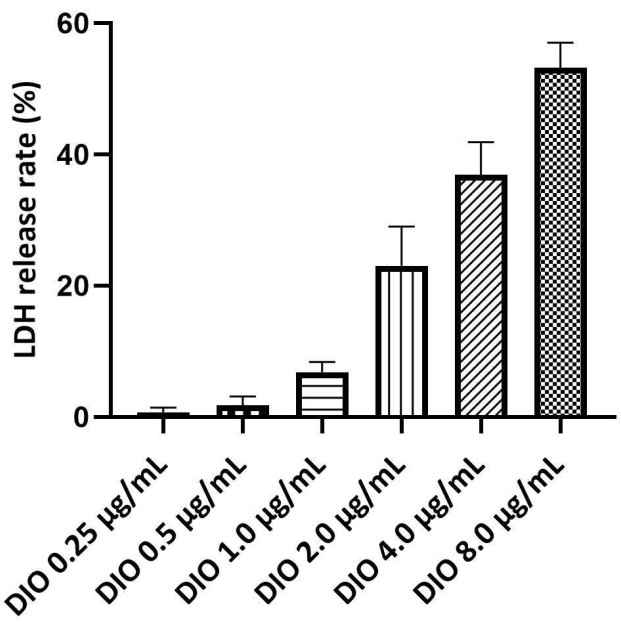
그림 3. DAKIKI 세포에 대한 DIO의 안전한 농도 스크리닝. 통계적 값은 3개의 독립적인 실험에서 얻은 평균 ± SD로 표현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
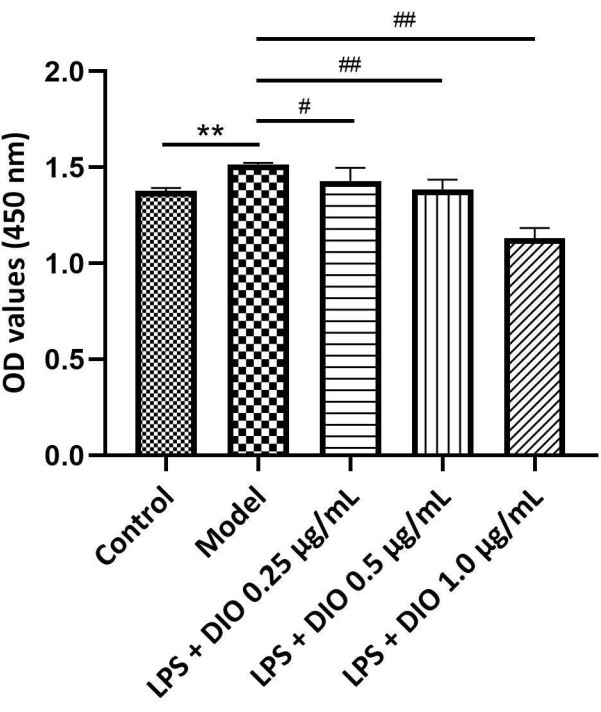
그림 4. 다양한 농도의 DIO는 DAKIKI 세포의 증식에 영향을 미칩니다. 데이터는 평균 ±SD로 표현되었다. 대조군과 비교했을 때, **P < 0.01; 모델 그룹과 비교했을 때, #P < 0.05' ##P < 0.01; 모든 실험의 결과를 3회 반복하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
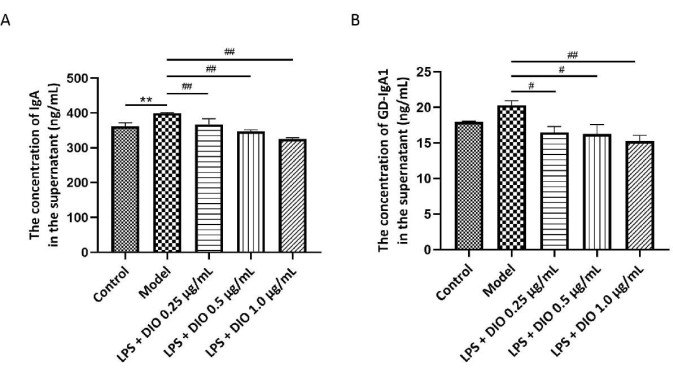
그림 5. DIO는 DAKIKI 세포에 의한 IgA 및 Gd-IgA1 분비를 억제합니다. (A) ELISA 방법은 각 그룹에서 IgA의 발현을 검출하였다. (B) ELISA 방법은 각 그룹에서 Gd-IgA1의 발현을 검출하였다. 데이터는 평균 ± SD로 표현되었다. 대조군과 비교했을 때, **P < 0.01; 모델 그룹과 비교하여 #P < 0.05, ##P < 0.01; 모든 실험 결과를 3회 반복하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
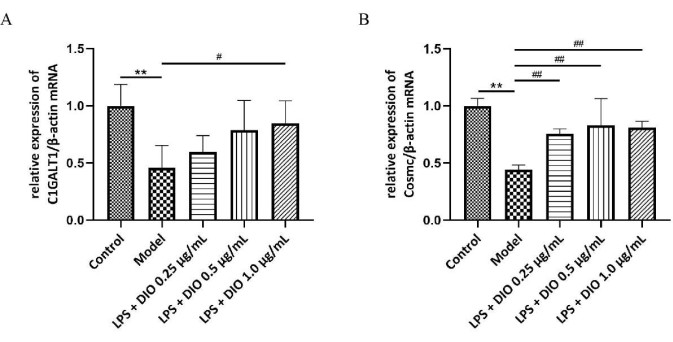
그림 6. DIO의 기전은 DAKIKI 세포에 의한 과도한 Gd-IgA1 분비를 억제합니다. (A) QRT-PCR은 C1GALT1의 mRNA 발현을 검출하였다. (B) QRT-PCR은 Cosmc의 mRNA 발현을 검출하였다. 데이터는 평균 ± SD로 표현되었다. 대조군과 비교했을 때, **P<0.01; 모델 그룹과 비교하여 #P < 0.05, ##P < 0.01; 모든 실험 결과를 3회 반복하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
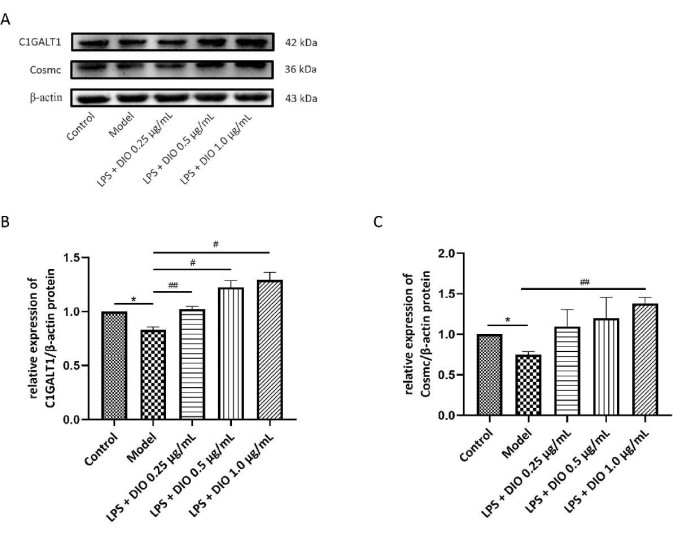
그림 7. DIO는 DAKIKI 세포에서 C1GALT1와 Cosmc의 단백질 발현에 영향을 미칩니다. (A) WB는 DIO에 의한 C1GALT1 및 Cosmc의 단백질 발현의 상향 조절을 검증했습니다. (B) C1GALT1 발현의 반정량 분석은 이미지 J를 사용하여 수행하였다. (C) 이미지 J를 이용하여 Cosmc 발현의 반정량 분석을 수행하였다. 데이터는 대조군과 비교하여 평균±SD.*P < 0.05; 모델군과 비교하여, #P < 0.05, ##P < 0.01, 모든 실험 결과를 3회 반복하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1. in vivo 모델에 대한 스키마입니다. 이 그림을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2. 단백뇨의 변화. 데이터는 평균 ± SD로 표현되었습니다. n = 그룹당 6. 이 그림을 다운로드하려면 여기를 클릭하십시오.
토론
IgAN의 특징적인 병리학적 특징은 사구체21,22의 간막 영역에 IgA1 및 GD-IgA1 함유 면역 복합체가 침착되는 것입니다. 면역 복합체의 형성을 줄이면 신장 손상을 줄이고 IgAN의 임상 증상을 완화할 수 있습니다. in vivo 실험에서 IgAN에 대한 DIO의 치료 효과를 연구한 결과, DIO가 IgAN 모델 마우스의 신장에서 IgA 침착을 감소시킬 수 있음을 발견했습니다. 신장에서 IgA 분비 세포의 축적이 IgAN23의 발병과 관련이 있음이 입증되었습니다. B 림프구의 증식 및 활성화의 중요한 부위인 Peyer's patch는 IgA 분비 세포의 중요한 공급원이므로 Peyer's patch에서 B lymphocyte markers(CD20, CXCR5)의 발현을 조사한 결과 DIO가 IgAN 마우스 모델의 Peyer's patch에서 B 림프구의 발현을 억제할 수 있음을 발견했습니다. 이러한 실험 결과는 IgAN을 치료하는 데 DIO를 적용하기 위한 기초를 제공할 수 있습니다.
IgAN에 대한 DIO의 작용 기전을 추가로 조사하기 위해 In vitro 에서 다음과 같은 실험을 수행했습니다. 첫째, GD-IgA124의 일부인 IgA1을 분비하는 EBV 불멸화 B 세포주인 DAIKI가 IgAN에 대한 약물의 작용 기전을 시험관 내 연구에 이상적이라는 것이 이전에 입증되었습니다. 우리는 IgAN 치료에서 DIO의 분자 메커니즘을 조사하기 위해 DAKIKI 세포를 선택했습니다. 또한 점막 염증 면역 반응은 IgAN의 발병에 필수적인 역할을 합니다. 위에서 언급했듯이 LPS를 사용하여 DAKIKI 세포를 자극하여 염증 유발 인자를 방출하고 염증 반응을 중재할 수 있으며, 이는 IgAN의 점막 면역 반응 메커니즘을 더 잘 모방할 수 있습니다. in vitro 세포 모델은 IgAN을 치료하기 위한 다른 약물의 가능성과 메커니즘을 조사하는 데 도움이 될 수 있습니다. 그 결과, DIO는 LPS에 의해 자극된 DAKIKI 세포의 증식을 농도 의존적 방식으로 억제하는 것으로 나타났습니다. DIO는 LPS 자극에 의한 DAKIKI 세포에서 IgA 및 Gd-IgA1의 분비를 억제하고 DAKIKI 세포에서 C1GalT1 및 그 샤페론 Cosmc의 mRNA 및 단백질의 발현을 상향 조절할 수 있으며, 이는 DIO가 C1GALT1/Cosmc 발현을 상향 조절하여 Gd-IgA1의 분비를 감소시켜 DAKIKI 세포의 과도한 활성화를 억제할 수 있음을 시사합니다.
실험 절차 중에 주요 단계를 기록해야 합니다. DAKIKI 세포 상층액의 Gd-IgA1 농도는 ELISA 키트의 검출 범위(1.56~100ng/mL) 내에 있지 않으며 수집된 상층액은 농축된 Gd-IgA1을 얻기 위해 한외여과관으로 원심분리해야 합니다. 또한 각 그룹에서 시작하는 상층액의 부피가 동일하고 한외여과 후 얻어진 농축액의 최종 부피가 동일한지 확인하십시오.
본 연구에서는 in vitro 와 in vivo 방법을 동시에 사용하였는데, 이는 약리학적 효과에서 상호 보완할 수 있으며, 한약의 효과와 그 기전을 연구하기 위한 예시를 제공한다. 이 프로토콜에서 몇 가지 사항을 개선할 수 있습니다. 첫째, 우리는 마우스의 DIO gavage 그룹에서 혈액 농도를 감지하지 못했습니다. 따라서 혈중 농도에 해당하는 DIO 농도는 in vitro 실험에 사용되지 않습니다. 둘째, DNR의 활성 구성 요소인 DIO 단량체만 조사되었습니다. DNR의 다른 구성 요소가 IgAN에 미치는 영향은 여전히 추가 연구가 필요합니다.
결론적으로 본 연구는 DNR의 활성성분인 DIO로 IgAN을 치료하기 위한 실험적 근거를 제공한다. 이 연구는 in vitro 및 in vivo 모두에서 IgAN의 점막 면역 반응을 모방하여 IgAN의 세포 병리학적 모델을 확립했습니다. IgAN을 예방하고 치료하기 위해 중국 전통 의학을 연구하기 위한 새로운 아이디어를 제공합니다.
공개
저자는 경쟁하는 재정적 이익이 없다고 선언합니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단 (81973675)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Anti-CD20/MS4A1 Antibody | Boster Biotechnology Company | A03780-3 | |
| Antifade mounting medium | Beyotime, Shanghai, China | P0128S | |
| Balb/c mice | Beijing Weitong Lihua Laboratory Animal Technology Co., Ltd. | 110322220101424000 | |
| blocking serum | Solarbio, Beijing, China | SL038 | |
| Bovine gamma globulin | ShangHai YuanYe Biotechnology Company | S12031 | |
| C1GALT1 polyclonal antibody | Proteintech Group, Inc,USA | 27569-1-AP | |
| Citrate antigen retrieval solution(50×) | Phygene Biotechnology Company | PH0422 | |
| COSMC polyclonal antibody | Proteintech Group, Inc,USA | 19254-1-AP | |
| Cytotoxiciy detection kit | Roche Company | 4744926001 | |
| Dako REAL EnVision detection system, Peroxidase/DAB+ | Dako | K5007 | |
| DAPI | Invitrogen | D1306 | |
| Dioscin | National Institute For Food and Drug Control | 111707-201703 | |
| DIO tablets | Chengdu No 1 Pharmaceutical Co. Ltd. | H51023866 | |
| ECL working solution | Merck Biotechnology, Inc | WBKLS0100 | |
| Enhanced cell counting kit-8 | Beyotime, Shanghai, China | C0043 | |
| Fasking one-step removal of gene cDNA first-strand synthesis premix | TIANGEN,Beijing, China | KR118-02 | |
| Glycogen Periodic acid Schiff (PAS) stain kit | BaSO Biotechnology Company | BA4080A | |
| Goat anti-mouse IgA-AF488 | SouthernBiotech | 1040-30 | |
| Goat anti-rabbit IgG antibody (H+L), HRP conjugated | BeiJing Bioss Biotechnology Company | BS-0295G-HRP | |
| Human Gd-IgA1 ELISA kit | IBL | 27600 | |
| Human IgA ELISA kit | MultiSciences (LiankeBio) | 70-EK174-96 | |
| Pierce BCA protein assay kit | Thermo Scientific | 23227 | |
| PMSF solution | Beyotime, Shanghai, China | ST507 | |
| Proteinase K | Phygene Biotechnology Company | PH1521 | |
| Rabbit anti-CXCR5 polyclonal antibody | BeiJing Bioss Biotechnology Company | bs-23570R | |
| RIPA lysis buffer | Beyotime, Shanghai, China | P0013B | |
| RNAsimple total RNA extraction kit | TIANGEN,Beijing, China | DP419 | |
| RPMI Medium 1640 | Solarbio, Beijing, China | 31800 | |
| Super-Bradford protein assay kit | CWBIO, Beijing, China | CW0013 | |
| Triton X-100 | Beyotime, Shanghai, China | ST795 | |
| β-Actin Rabbit mAb | Abclonal, Wuhan, China | AC026 |
참고문헌
- Knoppova, B., et al. The origin and activities of IgA1-containing immune complexes in IgA nephropathy. Frontiers in Immunology. 7, 117(2016).
- Suzuki, H., et al. The pathophysiology of IgA nephropathy. Journal of The American Society of Nephrology. 22 (10), 1795-1803 (2011).
- He, L., et al. Synthetic double-stranded RNA poly(I:C) aggravates IgA nephropathy by triggering IgA class switching recombination through the TLR3-BAFF axis. American Journal of Nephrology. 42 (3), 185-197 (2015).
- Zhao, N., et al. The level of galactose-deficient IgA1 in the sera of patients with IgA nephropathy is associated with disease progression. Kidney International. 82 (7), 790-796 (2012).
- Xing, Y., et al. C1GALT1 expression is associated with galactosylation of IgA1 in peripheral B lymphocyte in immunoglobulin a nephropathy. BMC Nephrology. 21 (1), 18(2020).
- Qin, W., et al. External suppression causes the low expression of the Cosmc gene in IgA nephropathy. Nephrology Dialysis Transplantation. 23 (5), 1608-1614 (2008).
- Sakai, F., et al. Lactobacillus gasseri SBT2055 induces TGF-β expression in dendritic cells and activates TLR2 signal to produce IgA in the small intestine. PLoS One. 9 (8), 105370(2014).
- Gutzeit, C., Magri, G., Cerutti, A. Intestinal IgA production and its role in host-microbe interaction. Immunological Reviews. 260 (1), 76-85 (2014).
- Serino, G., et al. In a retrospective international study, circulating miR-148b and let-7b were found to be serum markers for detecting primary IgA nephropathy. Kidney International. 89 (3), 683-692 (2016).
- Lu, F., et al. Therapeutic effect of Rhizoma Dioscoreae Nipponicae on gouty arthritis based on the SDF-1/CXCR 4 and p38 MAPK pathway: an in vivo and in vitro study. Phytotherapy research: PTR. 28 (2), 280-288 (2014).
- Wang, W., Xu, L., Zhou, L., Wan, S., Jiang, L. A Network pharmacology approach to reveal the underlying mechanisms of Rhizoma Dioscoreae Nipponicae in the treatment of asthma. Evidence-Based Complementary and Alternative Medicine: eCAM. 2022, 4749613(2022).
- Tian, W. W., Wei, Y. Professor TONG Xiaolin used the experience of Dioscoreae Nipponicae. Jilin Journal of Chinese Medicine. 40 (05), 589-592 (2020).
- Rao, X. R., Bai, Y. W. Das Xiwen's experience in treating IgA nephropathy. Beijing Journal of Traditional Chinese Medicine. 9, 691-693 (2008).
- Si, Y., Zhang, Y. A data mining study on the pattern of medication use in the treatment of IgA nephropathy by Professor Zhang Yu. Journal of Chinese Physician. 20 (01), 109-111 (2018).
- Jiang, H., et al. Optimization of the enzymatic extraction technology of Diosgenin from Dioscorea nipponica. Chinese Traditional Patent Medicine. 39 (03), 621-624 (2017).
- Qi, M., et al. Dioscin alleviates lipopolysaccharide-induced inflammatory kidney injury via the microRNA let-7i/TLR4/MyD88 signaling pathway. Pharmacological Research. 111, 509-522 (2016).
- Yang, L., et al. Recent advances in the pharmacological activities of Dioscin. BioMed Research International. 2019, 5763602(2019).
- Nal Zou, J., et al. Toll-like receptor 4 signaling pathway in the protective effect of Pioglitazone on experimental immunoglobulin A nephropathy. Chinese Medical Journal. 130 (8), 906-913 (2017).
- Xu, S. Y., Bian, R. L., Chen, X. Pharmacological experiments methodology. Chinese Pharmacological Bulletin. 1, 19(1992).
- Shen, J. C., Ren, Y., Rao, X. R., You, Y., Li, S. Network pharmacology, molecular docking, and in vitro experiments to explore the molecular mechanism of Dioscorea Nipponica Makion in the treatment of IgA nephropathy. World Journal of Integrated Traditional and Western Medicine. 16 (12), 2246-2254 (2021).
- Mestecky, J., et al. IgA nephropathy: molecular mechanisms of the disease. Annual Review of Pathology. 8, 217-240 (2013).
- Novak, J., et al. IgA1-containing immune complexes in IgA nephropathy differentially affect proliferation of mesangial cells. Kidney International. 67 (2), 504-513 (2005).
- Nihei, Y., et al. Identification of IgA autoantibodies targeting mesangial cells redefines the pathogenesis of IgA nephropathy. Science Advances. 9 (12), (2023).
- Raska, M., et al. Identification and characterization of CMP-NeuAc: GalNAc-IgA1 alpha2,6-sialyltransferase in IgA1-producing cells. Journal of Molecular Biology. 369 (1), 69-78 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유