Method Article
Alivio de la nefropatía por IgA mediada por dioscina mediante la inhibición de la activación de las células B in vivo y la disminución de la producción de IgA1 deficiente en galactosa in vitro
En este artículo
Resumen
Este estudio proporciona datos experimentales para el tratamiento de la nefropatía por inmunoglobulina A (IgAN) con Dioscina (DIO), el ingrediente activo del rizoma Dioscoreae Nipponicae (DNR), y un paradigma para estudiar los efectos de la medicina herbal y los mecanismos subyacentes in vivo e in vitro.
Resumen
El aumento de la IgA1 circulante deficiente en galactosa (Gd-IgA1) está causado por la activación excesiva de las células secretoras IgA positivas en el proceso de respuestas inmunitarias de la mucosa, que es un eslabón crítico en la patogénesis de la nefropatía por IgA (IgAN). El parche de Peyer, el lugar prominente donde los linfocitos B se transforman en células plasmáticas secretoras de IgA, es la fuente principal de IgA. Además, la menor expresión de la núcleo 1β-1,3-galactosiltransferasa (C1GalT1) y su chaperona molecular, la chaperona molecular específica de C1GalT1 (Cosmc), se relaciona con la glicosilación anormal de IgA1 en pacientes con IgAN. Nuestra experiencia clínica muestra que la medicina herbal de Dioscoreae Nipponicae Rhizoma (DNR) puede aliviar la proteinuria y la hematuria y mejorar la función renal en pacientes con IgAN. La dioscina (DIO) es uno de los principales ingredientes activos de la DNR, que tiene diversas actividades farmacológicas. Este estudio explora el posible mecanismo de DIO en el tratamiento de la IgAN.El modelo de ratón con IgAN se estableció mediante inducción inmunitaria de la mucosa. Los ratones se dividieron en los grupos de control, modelo y sonda nasogástrica. El depósito glomerular de IgA en ratones, los cambios patológicos renales y la expresión de los marcadores de células B CD20 y CXCR5 en el parche de Peyer se detectaron mediante inmunofluorescencia e inmunohistoquímica. Después de la estimulación con lipopolisacáridos (LPS), se estudiaron los efectos de DIO sobre la proliferación de células DAKIKI, la secreción de IgA y Gd-IgA1, C1GalT1 y la expresión de Cosmc mediante el ensayo del kit de recuento celular-8 (CCK-8), la prueba de inmunoabsorción enzimática (ELISA), la reacción en cadena de la polimerasa cuantitativa en tiempo real (QRT-PCR) y la transferencia occidental (WB). En estudios in vivo , la deposición de IgA acompañada de hiperplasia mesangial glomerular y el aumento de la expresión de CD20 y CXCR5 en el parche de Peyer en el ratón modelo de IgAN se alivió con DIO. Los estudios in vitro mostraron que 0,25 μg/mL a 1,0 μg/mL de DIO inhibió la proliferación de células DAKIKI inducida por LPS, la secreción de IgA y Gd-IgA1, y reguló al alza la expresión de ARNm y proteínas de C1GalT1 y Cosmc. Este estudio demuestra que DIO puede reducir la producción de Gd-IgA1 al inhibir la activación excesiva de las células secretoras de IgA y regular al alza la expresión de C1GALT1/Cosmc.
Introducción
La nefropatía por IgA (IgAN) es el tipo más frecuente de glomerulonefritis primaria, para la que no existe un tratamiento específico, y sigue siendo una causa importante de enfermedad renal terminal1. A pesar de que la patogenia de la IgAN aún no se comprende completamente, la "hipótesis de múltiples golpes" es generalmente aceptada y respaldada por un gran cuerpo de evidencia de investigación clínica y experimental2. La patogenia de la IgAN implica la activación de los linfocitos B y la producción de IgA1 deficiente en galactosa (Gd-IgA1)3. El aumento de la Gd-IgA1 circulante debido a la proliferación excesiva y a la activación de las células secretoras de IgA durante la respuesta inmunitaria de la mucosa es un eslabón crítico en la patogénesis de la IgAN 4,5,6. Como lugar central para la proliferación y activación de la conversión del fenotipo de los linfocitos B en células secretoras de IgA, el parche de Peyer es la principal fuente de secreción de IgA, estrechamente relacionada con la aparición y el desarrollo de IgAN 7,8. Además, la proliferación de células secretoras de IgA1, así como la expresión de la Core 1β-1,3-galactosiltransferasa (C1GalT1) y la chaperona molecular específica de C1GalT1 (Cosmc), se asociaron con una glicosilación anormal de IgA1, que causa la producción de GD-IgA1 en pacientes con IgAN 6,9.
El estudio clínico sobre el tratamiento con IgAN con fitoterapia ha progresado en los últimos años. La fórmula de Yiqi Qingjie es una fórmula esencial para el tratamiento de la IgAN por el Departamento de Nefrología del Hospital de Guang'anmen. El estudio previo de nuestro grupo encontró que la Gd-IgA1 disminuyó en el suero de los pacientes con IgAN después del tratamiento con Yiqi Qingjie Formula. Como una de las hierbas más utilizadas en la fórmula de Yiqi Qingjie, el rizoma Dioscoreae Nipponicae (DNR) es el rizoma seco de Dioscorea Nipponica Makino, que tiene varias funciones como regular la inmunidad, suprimir la inflamación, aliviar la tos y el asma10,11. Varios estudiosos trataron la IgAN con DNR y lograron buenos resultados 12,13,14. Como principal ingrediente activo de DNR15, la Dioscina (DIO) reduce el ácido úrico, inhibe la fibrosis, inhibe la respuesta inflamatoria y el estrés antioxidante16,17. Por lo tanto, DIO puede tener un mecanismo de acción novedoso para inhibir la secreción celular de Gd-IgA1 excesiva y ejercer efectos específicos de protección renal. Aún así, no se ha informado sobre el mecanismo de acción de DIO para tratar la IgAN.
Para explorar el posible mecanismo terapéutico de la DIO sobre la IgAN y proporcionar un nuevo método para el tratamiento de la IgAN, llevamos a cabo experimentos sobre los efectos terapéuticos de la DIO sobre la IgAN in vivo e in vitro.
Protocolo
El comité de ética del Hospital de Guanganmen aprobó este experimento (número de aprobación ética del experimento con animales: IACUC-GAMH-2023-003).
1. Preparación de los ratones para el procedimiento experimental
- Cría 22 ratones machos Balb/c de grado SPF (6-7 semanas de edad, peso corporal de 20-25 g) en el animalario del hospital/centro de investigación. Divida los animales en grupos de control (n = 8) y modelo (n = 14) utilizando el método de tabla de números aleatorios.
- Después de 1 semana de cría adaptativa en la jaula de laboratorio, alimentar al grupo modelo (grupo IgAN) con solución de gammaglobulina bovina (BGG) al 0,1% en agua acidificada que contenga 6 mmol/L de HCl durante 9 semanas según el protocolo de modelado de Zou et al.18.
- Inyecte 0,1 mL de solución de BGG al 0,1% en solución salina en la vena de cola durante 3 días consecutivos mientras continúa bebiendo solución de BGG para preparar un modelo experimental de ratón con IgAN18.
- Deje que el grupo de control beba libremente 6 mmol/L de agua acidificada HCl sin BGG durante 9 semanas. Inyecte el volumen correspondiente de solución salina en la vena de la cola durante 3 días consecutivos.
NOTA: Los grupos de control y modelo fueron alimentados con la misma calidad que el alimento normal. - Después de la inyección en la vena de cola, seleccione 2 ratones en el grupo de control y 2 ratones en el grupo modelo al azar y examínelos mediante proteinuria, microscopía óptica e inmunofluorescencia para determinar si el modelado fue exitoso.
NOTA: No se proporciona comida a los animales, pero no se les prohíbe el agua; Registre la producción de orina. - Recoger la orina durante 24 h en jaulas metabólicas y centrifugarla a 400 x g durante 5 min; Deseche los sedimentos de orina. Después de una dilución de 10 veces el sobrenadante, mida la concentración de proteinuria con un kit de ensayo de proteínas en orina y luego multiplique por el factor de dilución y el volumen de orina para obtener 24 h de proteína total en orina.
NOTA: Los métodos de microscopía e inmunofluorescencia se muestran en las secciones 3 y 4, respectivamente. - Después de preparar con éxito el modelo, divida 12 ratones en el grupo modelo en 6 ratones, cada uno en el grupo modelo (grupo IgAN) y en el grupo de sonda DIO (grupo DIO), de acuerdo con el método de la tabla de números aleatorios.
- Deje que el grupo de control continúe bebiendo 6 mmol/L de agua acidificada HCl sin BGG, y el grupo modelo de solución de BGG al 0,1% compuesta por agua acidificada que contenga 6 mmol/L de HCl. Calcule la dosis de administración de sonda nasogástrica del grupo DIO de acuerdo con la fórmula de conversión de dosis de la metodología experimental farmacológica (convertida de acuerdo con la masa corporal humana de 70 kg)19. Sonda nasogástrica DIO comprimidos de 0,06 g/kg una vez al día durante 8 semanas.
- Después de 8 semanas de sonda nasogástrica, anestesiar a los ratones por vía intraperitoneal con pentobarbital sódico al 0,4% (60 mg/kg), y después de confirmar la anestesia adecuada mediante pinzamiento del dedo del pie, aislar los riñones y el parche de Peyer para los análisis posteriores de microscopía óptica e inmunohistoquímica.
NOTA: El esquema para el modelo in vivo se encuentra en la Figura Suplementaria 1.
2. Análisis histológico
- Secciones de parafina para riñones y parche de Peyer
- Fijar tejidos renales de 3 mm de espesor o 1 parche de Peyer con paraformaldehído al 4% durante 24 h, deshidratar con etanol de gradiente y xileno. Sumergir en cera durante 2 h, sellar y congelar.
- Corte secciones de riñón de 2 μm de grosor y secciones de parche de Peyer de 4 μm de grosor y extiéndalas en agua tibia. Recoja las lonchas desplegadas con un portaobjetos de vidrio limpio y hornee en un horno de temperatura constante a 40 °C durante 1 h. Comience a teñir después del preprocesamiento de la muestra.
NOTA: Tome la superficie coronal de la parte hiliar del riñón, con un bloque de tejido de 3 mm de grosor.
- Desparafinar y teñir las secciones de parafina a temperatura ambiente (RT) durante 10 min con solución de ácido peryódico, evitando la luz. Enjuague con agua destilada y seque la mancha con la solución de tinción de Schiff durante 20-30 minutos, evitando la luz. Enjuague con agua destilada hasta que las secciones estén rojas bajo el microscopio.
- Coloque las secciones en una solución de tinción de hematoxilina, tiña los núcleos durante 3 minutos (los núcleos teñidos demasiado profundamente se pueden dividir con clorhidrato de etanol) y enjuague con agua corriente hasta que los portaobjetos estén incoloros.
- Realice una deshidratación de rutina con concentraciones de gradiente de etanol y xileno, selle las secciones con goma neutra y observe bajo un microscopio. El PAS-positivo es rojo y el núcleo es azul.
3. Análisis inmunohistoquímico del parche de Peyer
- Prepare secciones de parafina del parche de Peyer como se describe en el paso 2.1.
NOTA: El espesor de las secciones para inmunohistoquímica e inmunofluorescencia posterior es de 4 μm. - Desparafinar las secciones de parafina:
- Coloque las secciones en xileno I durante 5 minutos, xileno II durante 5 minutos y xileno III durante 5 minutos.
- Además, enjuague los portaobjetos con etanol anhidro I durante 5 minutos, etanol anhidro II durante 5 minutos, alcohol al 85% durante 5 minutos, alcohol al 75% durante 5 minutos. A continuación, enjuague los portaobjetos con agua destilada.
- Recuperación de antígenos
- Prepare 50 veces la solución madre de citrato de sodio y diluya con agua destilada hasta 1 vez para su uso. Caliéntelo en un autoclave durante 2 min, luego coloque las rodajas en el autoclave, asegurándose de que el nivel del líquido supere el nivel de las rodajas.
- Caliente a alta temperatura durante 5 minutos, luego deje que los portaobjetos se enfríen naturalmente. Lave las rodajas tres veces con solución de PBS durante 5 minutos cada una.
- Bloqueo de la peroxidasa endógena: Marque los bordes del tejido en un círculo con una pluma inmunohistoquímica. Incubar las secciones en una solución de peróxido de hidrógeno al 3% durante 15 min en RT, protegidas de la luz, y lavar las secciones tres veces con solución de PBS durante 5 min cada vez.
- Bloqueo del suero: Bloquee las secciones dejando caer un 10% de suero de cabra en las secciones de tejido marcadas durante 30 min en RT. Asegúrese de que las secciones estén cubiertas uniformemente con la mancha.
- Incubación de anticuerpos primarios: Agite suavemente la solución de bloqueo y agregue una proporción del anticuerpo primario preparado (CD20 [1:800]; CXCR5 [1:800]) a la sección. Coloque la sección plana en una caja húmeda e incube durante la noche a 4 °C.
NOTA: Agregue una pequeña cantidad de agua a la caja húmeda para evitar la evaporación del anticuerpo. - Incubación secundaria de anticuerpos: Lave las secciones tres veces con solución de PBS durante 5 minutos cada vez. Retire el PBS agitando las secciones para secarlas, cubra el tejido con una gota de anticuerpo secundario (marcado HRP) de las especies relacionadas con el anticuerpo primario e incube en RT durante 50 min.
- Homogeneización de 3,3'-diaminobenzidina (DAB): Lavar las secciones con solución de PBS tres veces durante 5 min cada una. Después de agitar las secciones para secarlas, deje caer la solución cromogénica DAB recién preparada sobre las secciones. Observe el tiempo de desarrollo del color bajo el microscopio; El positivo es de color amarillo parduzco. Enjuague con agua del grifo para terminar el desarrollo del color.
- Núcleos de tinción: Vuelva a tintar con hematoxilina durante aproximadamente 1 minuto, lave con agua del grifo y luego enjuague durante 10 minutos con agua del grifo para que vuelva a azul.
- Deshidratación y sellado:
- Coloque las secciones en alcohol al 75% durante 5 min y al 85% de alcohol durante 5 min. Coloque las secciones en etanol anhidro I durante 5 min, etanol anhidro II durante 5 min y etanol anhidro III durante 5 min.
- Lavar las secciones en xileno I durante 5 min, sacarlas para que se sequen ligeramente y sellar las secciones con goma neutra.
- Adquisición de imágenes: Recopile imágenes mediante examen microscópico y analícelas mediante software de halo para el análisis de imágenes panorámicas del tejido.
NOTA: Los núcleos teñidos con hematoxilina son azules y la expresión positiva de DAB se observa como amarillo parduzco.
4. Inmunofluorescencia renal de IgA
- Prepare secciones de parafina para los riñones como se describe en el paso 2.1.
- Secciones de parafina desparafina:
- Coloque las secciones en xileno I durante 5 minutos, xileno II durante 5 minutos y xileno III durante 5 minutos. Trate las secciones en etanol anhidro I, etanol anhidro II, 95% de etanol, 90% de etanol, 80% de etanol, 70% de etanol y 50% de etanol, cada una durante 5 min, y lávelas con agua destilada.
- Recuperación de proteinasa K: Agite las secciones para secarlas y dibuje un círculo alrededor de la sección de tejido con una pluma histoquímica. Añadir la solución de trabajo de proteinasa K (proporción 1:9 de solución madre y PBS) gota a gota para cubrir el tejido e incubar a 37 °C durante 30 min. Lave las secciones tres veces con PBS durante 5 minutos cada una.
- Penetración en la membrana celular: Agitar ligeramente las secciones para secarlas y luego cubrirlas con Triton al 0,1%. Incubar durante 20 min en RT y lavar las secciones tres veces con PBS durante 5 min cada una.
- Bloqueo: Añadir un 10% de suero de cabra gota a gota para cubrir el tejido de manera uniforme para el bloqueo en RT durante 30 min.
- Incubación primaria de anticuerpos: Añadir una cantidad adecuada de anticuerpo IgA conjugado AF488-conjugado de ratón de cabra (1:500) gota a gota para cubrir el tejido de manera uniforme e incubar durante la noche a 4 °C.
- Núcleos de tinción: Lave las rodajas tres veces con PBS durante 5 minutos cada una. Después de retirar el PBS, añadir la tinción de 4′,6-diamidino-2-fenilindol (DAPI) gota a gota en las secciones e incubar durante 15 min a RT, protegido de la luz.
- Lave y selle las secciones: Lave las secciones tres veces con PBS durante 5 minutos, luego séllelas con un medio de montaje antidecoloración.
- Microscopía y fotografía: Observe las secciones bajo un microscopio fluorescente y tome imágenes.
NOTA: Para DAPI, la excitación ultravioleta es de longitud de onda de 330-380 nm, y la longitud de onda de emisión es de 420 nm, luz azul. La longitud de onda de excitación del isotiocianato de fluoresceína (FITC) es de 465-495 nm y la longitud de onda de emisión es de 515-555 nm, luz verde.
5. Cultivo celular
- Obtención de la línea de linfocitos B humanos DAKIKI de ATCC, EE. UU. Cultivo de células DAKIKI en medio RPMI-1640 suplementado con 10% de FBS y 1% de penicilina-estreptomicina.
- Cultivar las células en una incubadora de 37 °C con 5% de CO2 y subcultivarlas cada 2-3 días. Utilice células en la fase de crecimiento logarítmico para todos los experimentos.
- Al 70%-80% de confluencia, recoja las células con una pipeta estéril y centrifugue las células a 140 x g durante 5 min. Deseche el sobrenadante, vuelva a suspender con el medio sin suero y, después de 24 h, deje todas las células en un período de reposo para el tratamiento posterior.
6. Ensayos de citotoxicidad de LDH para el cribado de concentraciones seguras de DIO en células DAKIKI normales
- Siembre las células DAKIKI en placas de 96 pocillos a una densidad de 4x105 células/pocillo y establezca un grupo de control bajo, un grupo de control alto y diferentes concentraciones de DIO (0,25, 0,5, 1,0, 2,0, 4,0, 8,0 μg/mL). Incubar en incubadora al 5% de CO2, a 37 °C durante 24 h después del tratamiento correspondiente según el método de agrupamiento.
- De acuerdo con las instrucciones del kit de detección de citotoxicidad, agregue 5 μL de lisado por pocillo en el grupo de control alto y luego coloque la placa en una incubadora de CO2 al 5%, a 37 °C durante 15 min.
- Saque la placa, agregue 100 μL de la mezcla de reacción a cada pocillo, incube en la oscuridad durante 10 minutos en RT y luego agregue 50 μL de la solución de reacción de parada. Mida el valor de diámetro exterior a 490 nm en el lector de microplacas lo antes posible.
- Calcule la tasa de liberación de LDH de diferentes concentraciones de DIO y ≤10% como la dosis máxima administrada según la fórmula: tasa de liberación de LDH = (LDH de pozo experimental - LDH de control bajo) / (LDH de control alto - LDH de control bajo) x 100%.
7. Ensayo CCK-8 para detectar el efecto de DIO en la proliferación de células DAKIKI
- Con base en los resultados de nuestros experimentos previos20, establecer un modelo de IgAN utilizando LPS 40 μg/mL para inducir células DAKIKI.
- A continuación, siembre 4x105 células/pocillo en placas de 96 pocillos y divídalo en los grupos de control, modelo y DIO de baja, media y alta concentración (0,25 μg/mL, 0,5 μg/mL y 1,0 μg/mL). Incubar las placas en una incubadora de 5% CO2, 37 °C durante 24 h.
- A continuación, añada 20 μL de reactivo CCK-8 a cada pocillo y vuelva a colocar las placas en la incubadora (5% CO2, 37 °C) durante 2 h. Después de la incubación, detecte el diámetro exterior a una longitud de onda de 450 nm en el lector de microplacas lo antes posible.
8. ELISA para detectar el efecto de DIO en la secreción de IgA y Gd-IgA1 por las células DAKIKI
- Siembre las células DAKIKI en placas de 6 pocillos a una densidad de 6x106 células/pocillo, y agrupe y trate las células de acuerdo con el paso 7.2. Cultivar las células durante 24 h, luego centrifugar a 850 x g durante 10 min a 4 °C para obtener el sobrenadante.
- Detecte las concentraciones de IgA y Gd-IgA1 de acuerdo con las instrucciones del kit.
9.qRT-PCR para detectar el efecto de DIO en los niveles de ARNm de C1GALT1 y Cosmc en células DAKIKI
- Siembre las células DAKIKI a una densidad de 6x106 células/pocillo en una placa de 6 pocillos, agrupe y trate las células como CCK8 mencionadas en el paso 7.2, e incube durante 24 h. Extraiga el ARN total de las células DAKIKI de acuerdo con las instrucciones del kit de extracción de ARN total.
- Después de tomar 1 μL de ARN extraído de cada grupo de muestras y medir su concentración, transcriba inversamente 1 μg de ARN total de cada muestra en ADNc de acuerdo con las instrucciones del kit.
- A continuación, realice la amplificación por RT-PCR para detectar la expresión de cada gen (95 °C durante 15 min, 95 °C durante 10 s y 60 °C durante 30 s). Calcular el nivel de expresión de cada gen utilizando el método 2-ΔΔCT con β-actina como referencia interna.
NOTA: Las secuencias de cebadores fueron las siguientes:
C1GALT1: 5'-AAGGTTGACACCCAGCCTAA-3', 5'-CTTTGACGTGTTTGGCCTTT-3';
Cosmc: 5'-GCTCCTTTTTGAAGGGTGTG-3', 5'-TACTGCAGCCCAAAGACTCA-3';
β-actina: 5'-TCACCCACACTGTGCCCATCTACGA-3', 5'-CAGCGGAACCGCTCATTGCCAATGG-3'.
10. Western blot para examinar el efecto de DIO en la expresión de las proteínas C1GALT1 y Cosmc en células DAKIKI
- Siembre las células DAKIKI a una densidad de 6x106 células/pocillo en una placa de 6 pocillos. Agrúpalos y trátalos como se menciona en el paso 7.2. Después de 24 h de incubación, recoja cada grupo de células.
- Añadir una cantidad adecuada de solución de lisis celular (PMSF: inhibidor de la fosfatasa: solución de lisis RIPA = 1:1:100) e incubar en hielo durante 30 min. A continuación, centrifugar a 13.500 x g durante 10 min a 4 °C y recoger el sobrenadante.
- Determine la concentración de proteínas utilizando el kit de ensayo de concentración de proteínas BCA.
- Mezcle las muestras de proteínas con tampón de carga SDS-PAGE 5x a 4:1 mediante vórtice y caliente las muestras mezcladas a 100 °C durante 5 minutos para desnaturalizar la proteína.
- Para detectar proteínas con diferentes pesos moleculares, agregue el marcador de proteínas (5 μL/pocillo) y las muestras (20 μg/pocillo) en diferentes carriles de un gel SDS-PAGE al 12%, ejecute la electroforesis SDS-PAGE y transfiera el gel a las membranas de PVDF.
- Bloquear las membranas con leche descremada al 5% durante 2 h en RT e incubar con los anticuerpos primarios correspondientes (C1GALT1 [1:1000], Cosmc [1:2000]) durante 24 h. Utilice el anticuerpo β-actina (1:100000) como control interno.
- Lave la membrana de fluoruro de polivinilideno (PVDF) con 1x solución salina tamponada Tris, detergente Tween 20 al 0,1% (TBST) tres veces (10 min/tiempo), luego incube con el correspondiente anticuerpo IgG secundario anti-conejo de cabra (1: 10000) a RT durante 2 h.
- Lave la membrana con TBST nuevamente (tres veces durante 10 minutos cada una) y trátela con una cantidad adecuada de solución de trabajo de quimioluminiscencia mejorada (ECL) (según las instrucciones del fabricante) para la detección de bandas de proteínas.
- Capture las imágenes utilizando el sistema de imágenes de quimioluminiscencia y realice un análisis semicuantitativo de los valores de gris de las proteínas utilizando el sistema de análisis de imágenes Image J.
11 de la Constitución. Análisis estadístico
- Utilice una aplicación de software adecuada para analizar los datos. Extraiga todos los datos como media ± SD (desviación estándar) y evalúe múltiples muestras mediante una prueba de ANOVA de un factor para la comparación entre grupos.
NOTA: Para el análisis estadístico se utilizó el software estadístico SPSS 26.0. Se utilizó el método LSD para las comparaciones bidireccionales entre los grupos cuando las varianzas eran iguales, y el método T3 de Dunnett para las comparaciones bidireccionales entre los grupos cuando las varianzas no eran iguales. Se consideró que P<0,05 indicaba una diferencia estadísticamente significativa.
Resultados
Efecto de DIO sobre el tejido renal en un modelo de ratones IgAN
En comparación con el grupo control, el modelo de ratones IgAN inducido por el sistema inmunitario de la mucosa (grupo modelo) tuvo un aumento significativo de la proteinuria (Figura complementaria 2), la deposición de IgA fue visible en la región mesangial, la fluorescencia se distribuyó uniformemente en grupos a lo largo de toda la región mesangial (Figura 1A), la tinción con PAS del tejido renal mostró proliferación de células mesangiales e hiperplasia estromal (Figura 1B), que se redujo en el grupo de sonda nasogástrica DIO (grupo DIO).
Efecto de la DIO sobre los linfocitos B en el parche de Peyer
El parche de Peyer es el sitio principal de la conversión de linfocitos B en células secretoras de IgA. Tomamos el parche de Peyer como objeto de investigación para observar el efecto de DIO en los linfocitos B mediante la detección de la expresión de los marcadores de células B CD20 y CXCR5. Los resultados inmunohistoquímicos mostraron que la expresión de CD20 y CXCR5 fue significativamente mayor en el grupo modelo en comparación con el grupo control. DIO podría inhibir la expresión de los marcadores moleculares anteriores (Figura 2A,B).
El rango de concentración seguro de DIO en las células DAKIKI
La LDH es un marcador de la integridad de la membrana plasmática y un indicador de muerte celular, con tasas de liberación de LDH más altas que indican un daño celular más grave. Se utilizó el ensayo de liberación de LDH para determinar el rango de concentración segura de DIO. La concentración máxima segura de DIO se determinó mediante una tasa de liberación de LDH inferior al 10%. Los resultados (Figura 3) no mostraron citotoxicidad significativa inducida por DIO a concentraciones de 0,25 a 1,0 μg/mL. Por lo tanto, en el siguiente estudio se utilizó 0,25, 0,5 y 1,0 μg/mL de DIO como nivel de dosificación.
Efectos de la DIO en la proliferación de células DAKIKI
Los resultados experimentales (Figura 4) mostraron que, en comparación con el grupo modelo (grupo estimulado por LPS), DIO inhibió la proliferación de células DAKIKI inducida por LPS de manera dependiente de la concentración. Las concentraciones de DIO de 0,5 y 1,0 μg/mL inhibieron significativamente la proliferación de células DAKIKI inducida por LPS (P < 0,01).
Efectos de la DIO sobre la función secretora de las células DAKIKI
Los niveles de Gd-IgA1 están estrechamente relacionados con el proceso patológico de la IgAN, y la IgA total se analiza conjuntamente como indicador de la función secretora celular. Se utilizó un ensayo ELISA para detectar el contenido de IgA y Gd-IgA1 en el sobrenadante del cultivo celular DAKIKI. Los resultados mostraron (Figura 5A,B) que las células DAKIKI estimuladas por LPS secretaron más IgA en comparación con el grupo control (P < 0,01). En comparación, DIO inhibió significativamente la secreción de IgA por parte de las células DAKIKI (P < 0,01) de una manera dependiente de la concentración. En comparación con el grupo control, las células DAKIKI estimuladas por LPS secretaron más Gd-IgA1 con una tendencia estadística (P < 0,10), y DIO inhibió la secreción de Gd-IgA1 de las células DAKIKI estimuladas por LPS de manera dependiente de la concentración (P < 0,05 y P < 0,01), entre las cuales DIO a 1,0 μg/mL inhibió significativamente la secreción de Gd-IgA1 con una tasa de inhibición del 25%.
El mecanismo de DIO inhibe la secreción de Gd-IgA1 por parte de las células DAKIKI
Para investigar más a fondo el posible mecanismo de DIO que inhibe la secreción excesiva de Gd-IgA1 por parte de las células DAKIKI, se detectaron los niveles de C1GALT1 transferasa glicosilada y ARNm de la proteína chaperona Cosmc en las células DAKIKI mediante qRT-PCR, y los resultados mostraron (Figura 6A, B) que la expresión relativa del ARNm de C1GALT1 y Cosmc estaba regulada a la baja en las células DAKIKI en el grupo modelo en comparación con el grupo de control (P < 0,01). DIO reguló al alza la expresión relativa de ARNm de C1GALT1 y Cosmc en diferentes grados en comparación con el grupo modelo, con DIO 1,0 μg /mL significativamente reguló al alza la expresión relativa de ARNm de C1GALT1 y Cosmc (P < 0,05).
Al mismo tiempo, se utilizó el método WB para detectar el efecto de DIO sobre la expresión proteica de C1GALT1 y Cosmc en células DAKIKI. En comparación con el grupo control, la expresión proteica de C1GALT1 y Cosmc en las células DAKIKI del grupo modelo disminuyó obviamente (P < 0,05). En comparación con el grupo modelo, la expresión proteica de C1GALT1 y Cosmc después de la intervención con DIO se reguló al alza. La expresión proteica de C1GALT1 y Cosmc fue significativamente regulada por DIO a una concentración de 1,0 μg/mL (P < 0,05) (Figura 7A-C).
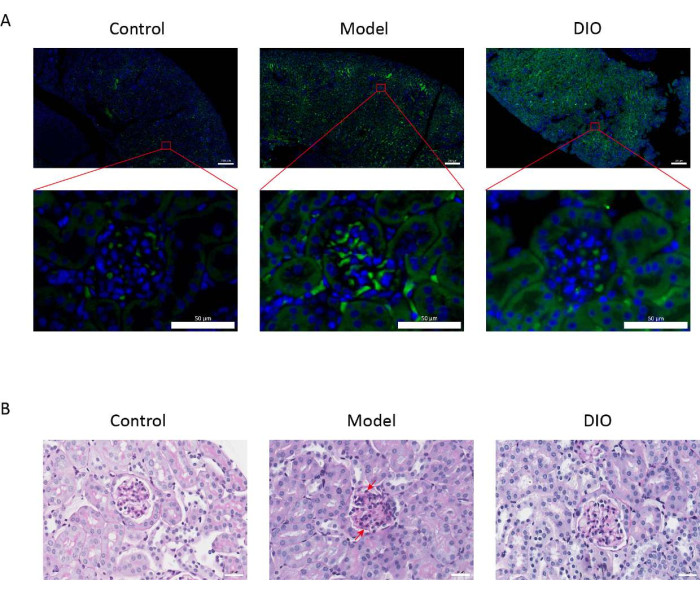
Figura 1: Histopatología de los riñones. (A) Microscopio de inmunofluorescencia. Las secciones renales de los ratones de cada grupo se tiñeron con anti-IgA (verde) y DAPI (azul). La barra de escala de la imagen anterior = 200 μm. La siguiente barra de escala de imagen = 50 μm. n = 6 por grupo. (B) Imágenes representativas de la tinción de tejido renal con PAS de ratones en los grupos Control, Modelo y DIO. Barra de escala = 30 μm. La flecha hacia abajo muestra las células mesangiales y la flecha hacia arriba muestra el estroma. Barra de escala = 30 μm. n = 6 por grupo. Haga clic aquí para ver una versión más grande de esta figura.
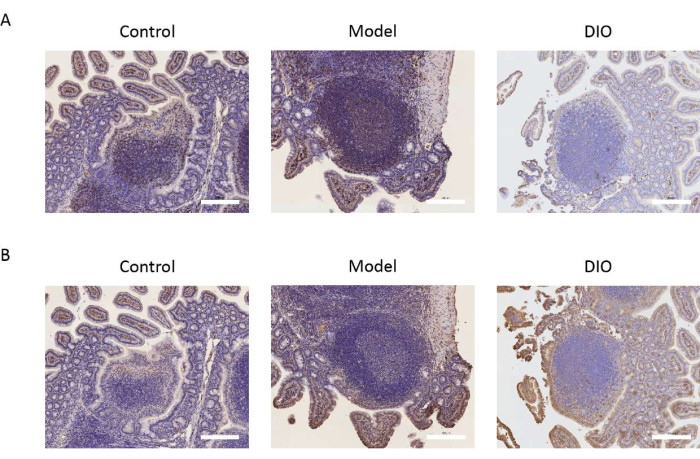
Figura 2: Efecto de DIO sobre los marcadores de linfocitos B. (A) La expresión de CD20 en el parche de Peyer. Barra de escala = 200 μm. n = 6 por grupo. (B) La expresión de CXCR5 en el parche de Peyer. Las barras de escala se encuentran en la esquina inferior derecha de la imagen. Barra de escala = 200 μm. n = 6 por grupo. Haga clic aquí para ver una versión más grande de esta figura.
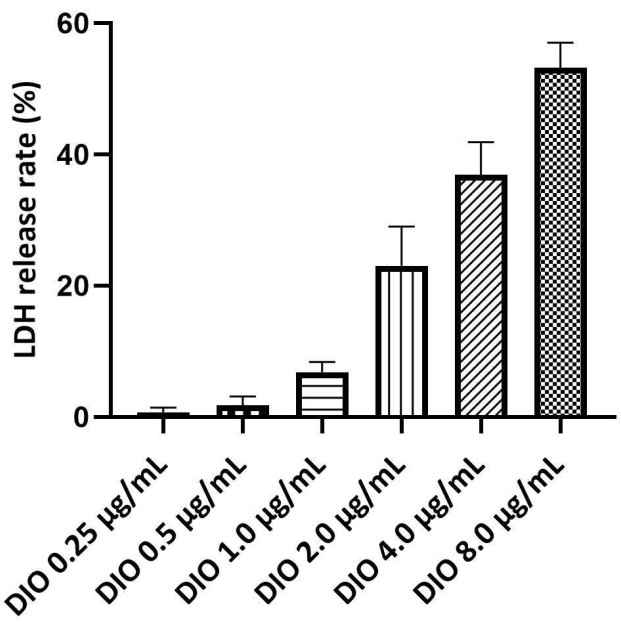
Figura 3. Cribado de la concentración segura de DIO en células DAKIKI. Los valores estadísticos se expresan como la media ± desviación estándar de tres experimentos independientes. Haga clic aquí para ver una versión más grande de esta figura.
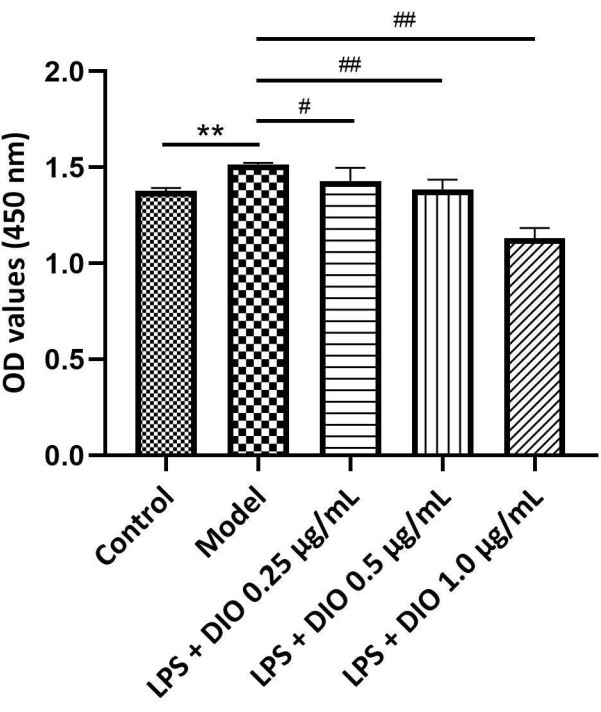
Figura 4. Diferentes concentraciones de DIO afectan la proliferación de las células DAKIKI. Los datos se expresaron como media ±DE. En comparación con el grupo control, **P < 0,01; en comparación con el grupo de modelos, #P < 0,05' ##P < 0,01; Los resultados de todos los experimentos se repitieron tres veces. Haga clic aquí para ver una versión más grande de esta figura.
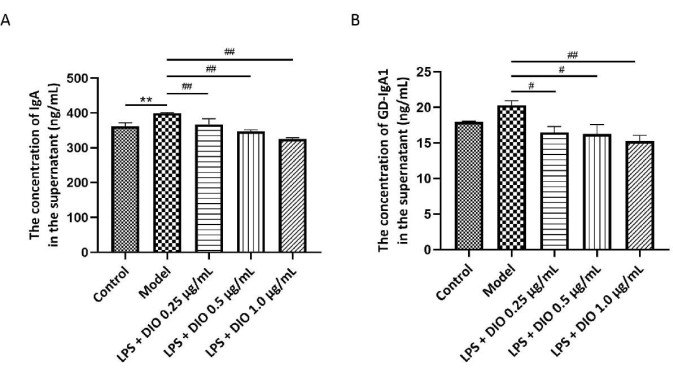
Figura 5. DIO inhibe la secreción de IgA y Gd-IgA1 por las células DAKIKI. (A) El método ELISA detectó la expresión de IgA en cada grupo. (B) El método ELISA detectó la expresión de Gd-IgA1 en cada grupo. Los datos se expresaron como media ± DE. En comparación con el grupo control, **P < 0,01; en comparación con el grupo de modelos, #P < 0,05, ##P < 0,01; Todos los resultados experimentales se repitieron tres veces. Haga clic aquí para ver una versión más grande de esta figura.
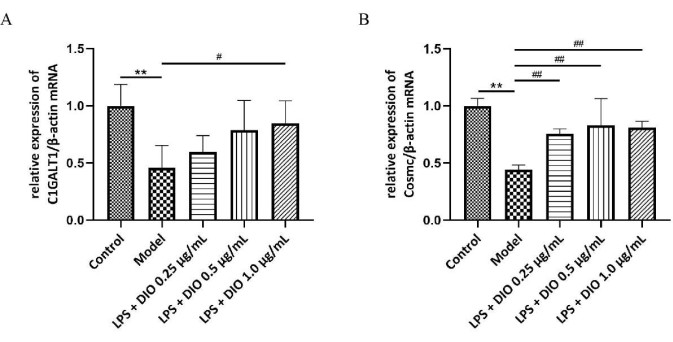
Figura 6. El mecanismo de DIO inhibe la secreción excesiva de Gd-IgA1 por parte de las células DAKIKI. (A) La QRT-PCR detectó la expresión de ARNm de C1GALT1. (B) QRT-PCR detectó la expresión de ARNm de Cosmc. Los datos se expresaron como media ± DE. En comparación con el grupo control, **P<0,01; en comparación con el grupo de modelos, #P < 0,05, ##P < 0,01; Todos los resultados experimentales se repitieron tres veces. Haga clic aquí para ver una versión más grande de esta figura.
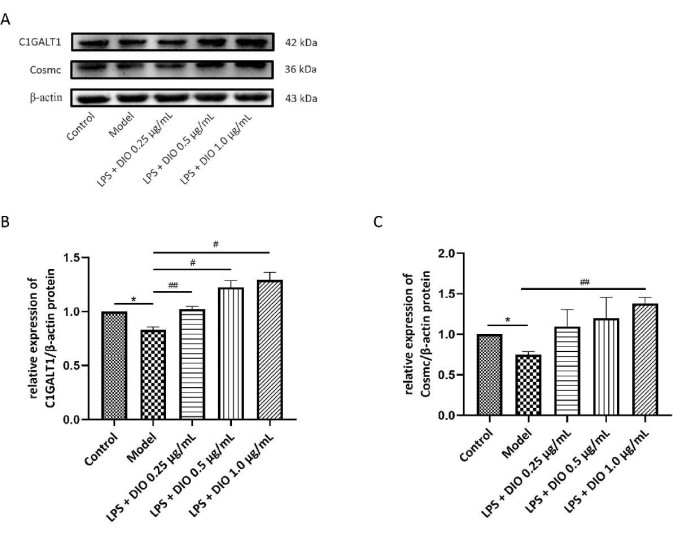
Figura 7. El DIO afecta a la expresión proteica de C1GALT1 y Cosmc en las células DAKIKI. (A) WB verificó la regulación al alza de la expresión proteica de C1GALT1 y Cosmc por DIO. (B) El análisis semicuantitativo de la expresión de C1GALT1 se realizó utilizando la imagen J. (C) El análisis semicuantitativo de la expresión de Cosmc utilizando la imagen J. Los datos se expresaron como media ±DE. En comparación con el grupo control,*P < 0,05; en comparación con el grupo modelo, #P < 0.05, ##P < 0.01, todos los resultados experimentales se repitieron tres veces. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1. El esquema para el modelo in vivo. Haga clic aquí para descargar esta figura.
Figura complementaria 2. Cambios en la proteinuria. Los datos se expresaron como media ± DE; n = 6 por grupo. Haga clic aquí para descargar esta figura.
Discusión
El rasgo patológico característico de la IgAN es el depósito de inmunocomplejos que contienen IgA1 y GD-IgA1 en la región mesangial del glomérulo21,22. La reducción de la formación de complejos inmunitarios puede reducir la lesión renal y aliviar los síntomas clínicos de la IgAN. En un experimento in vivo, estudiamos los efectos terapéuticos de DIO sobre IgAN, y descubrimos que DIO puede reducir la deposición de IgA en el riñón de ratones modelo de IgAN. Está demostrado que la acumulación de células secretoras de IgA en el riñón está relacionada con la patogénesis de la IgAN23. Como un sitio importante de proliferación y activación de linfocitos B, el parche de Peyer es una fuente importante de células secretoras de IgA, por lo que examinamos la expresión de marcadores de linfocitos B (CD20, CXCR5) en el parche de Peyer y descubrimos que DIO podría inhibir la expresión de linfocitos B en el modelo de ratones IgAN del parche de Peyer. Estos resultados experimentales podrían proporcionar una base para la aplicación de DIO en el tratamiento de la IgAN.
Realizamos los siguientes experimentos in vitro para investigar más a fondo el mecanismo de acción de DIO sobre IgAN. En primer lugar, se ha demostrado anteriormente que DAKIKI, una línea de células B inmortalizadas por el VEB que segrega IgA1, parte de la cual es GD-IgA124, es ideal para la investigación in vitro del mecanismo de acción del fármaco sobre la IgAN. Elegimos las células DAKIKI para investigar el mecanismo molecular de DIO en el tratamiento de IgAN. Además, la respuesta inmunitaria inflamatoria de la mucosa desempeña un papel integral en la patogénesis de la IgAN. Como se mencionó anteriormente, usamos LPS para estimular las células DAKIKI, que pueden liberar factores proinflamatorios y mediar respuestas inflamatorias, lo que puede imitar mejor el mecanismo de las respuestas inmunitarias de la mucosa en IgAN. El modelo celular in vitro puede ayudar a investigar la posibilidad y el mecanismo de otros fármacos para tratar la IgAN. Los resultados mostraron que DIO inhibió la proliferación de células DAKIKI estimuladas por LPS de una manera dependiente de la concentración. DIO podría inhibir la secreción de IgA y Gd-IgA1 en las células DAKIKI causada por la estimulación de LPS y regular al alza la expresión del ARNm y la proteína de C1GalT1 y su acompañante Cosmc en las células DAKIKI, lo que sugiere que DIO podría reducir la secreción de Gd-IgA1 mediante la regulación al alza de la expresión de C1GALT1/Cosmc y, por lo tanto, inhibir la activación excesiva de las células DAKIKI.
Se deben tener en cuenta los pasos clave durante los procedimientos experimentales. La concentración de Gd-IgA1 en el sobrenadante celular DAKIKI no está dentro del rango de detección del kit ELISA (1.56 ~ 100 ng / mL), y el sobrenadante recolectado debe centrifugarse mediante un tubo de ultrafiltración para obtener el Gd-IgA1 concentrado. Además, asegúrese de que el volumen de sobrenadante a partir de cada grupo sea el mismo y que el volumen final de concentrado obtenido después de la ultrafiltración sea el mismo.
En este estudio, utilizamos métodos in vitro e in vivo simultáneamente, que pueden apoyarse mutuamente en los efectos farmacológicos y proporcionar un ejemplo para estudiar los efectos y sus mecanismos de la medicina herbal. Algunas cosas podrían mejorarse en este protocolo. En primer lugar, no detectamos concentraciones sanguíneas en el grupo de sonda DIO de los ratones; por lo tanto, la concentración de DIO equivalente a las concentraciones en sangre no se utiliza en experimentos in vitro . En segundo lugar, solo se investigó el monómero DIO, el componente activo de DNR; los efectos de otros componentes de la DNR sobre la IgAN aún necesitan más estudio.
En conclusión, este estudio proporciona una base experimental para el tratamiento de la IgAN con DIO, el ingrediente activo de la DNR. Este estudio estableció un modelo patológico celular de IgAN mediante la imitación de la respuesta inmune de la mucosa de IgAN tanto in vitro como in vivo. Da una nueva idea para estudiar la medicina tradicional china para prevenir y tratar la IgAN.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (81973675).
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-CD20/MS4A1 Antibody | Boster Biotechnology Company | A03780-3 | |
| Antifade mounting medium | Beyotime, Shanghai, China | P0128S | |
| Balb/c mice | Beijing Weitong Lihua Laboratory Animal Technology Co., Ltd. | 110322220101424000 | |
| blocking serum | Solarbio, Beijing, China | SL038 | |
| Bovine gamma globulin | ShangHai YuanYe Biotechnology Company | S12031 | |
| C1GALT1 polyclonal antibody | Proteintech Group, Inc,USA | 27569-1-AP | |
| Citrate antigen retrieval solution(50×) | Phygene Biotechnology Company | PH0422 | |
| COSMC polyclonal antibody | Proteintech Group, Inc,USA | 19254-1-AP | |
| Cytotoxiciy detection kit | Roche Company | 4744926001 | |
| Dako REAL EnVision detection system, Peroxidase/DAB+ | Dako | K5007 | |
| DAPI | Invitrogen | D1306 | |
| Dioscin | National Institute For Food and Drug Control | 111707-201703 | |
| DIO tablets | Chengdu No 1 Pharmaceutical Co. Ltd. | H51023866 | |
| ECL working solution | Merck Biotechnology, Inc | WBKLS0100 | |
| Enhanced cell counting kit-8 | Beyotime, Shanghai, China | C0043 | |
| Fasking one-step removal of gene cDNA first-strand synthesis premix | TIANGEN,Beijing, China | KR118-02 | |
| Glycogen Periodic acid Schiff (PAS) stain kit | BaSO Biotechnology Company | BA4080A | |
| Goat anti-mouse IgA-AF488 | SouthernBiotech | 1040-30 | |
| Goat anti-rabbit IgG antibody (H+L), HRP conjugated | BeiJing Bioss Biotechnology Company | BS-0295G-HRP | |
| Human Gd-IgA1 ELISA kit | IBL | 27600 | |
| Human IgA ELISA kit | MultiSciences (LiankeBio) | 70-EK174-96 | |
| Pierce BCA protein assay kit | Thermo Scientific | 23227 | |
| PMSF solution | Beyotime, Shanghai, China | ST507 | |
| Proteinase K | Phygene Biotechnology Company | PH1521 | |
| Rabbit anti-CXCR5 polyclonal antibody | BeiJing Bioss Biotechnology Company | bs-23570R | |
| RIPA lysis buffer | Beyotime, Shanghai, China | P0013B | |
| RNAsimple total RNA extraction kit | TIANGEN,Beijing, China | DP419 | |
| RPMI Medium 1640 | Solarbio, Beijing, China | 31800 | |
| Super-Bradford protein assay kit | CWBIO, Beijing, China | CW0013 | |
| Triton X-100 | Beyotime, Shanghai, China | ST795 | |
| β-Actin Rabbit mAb | Abclonal, Wuhan, China | AC026 |
Referencias
- Knoppova, B., et al. The origin and activities of IgA1-containing immune complexes in IgA nephropathy. Frontiers in Immunology. 7, 117 (2016).
- Suzuki, H., et al. The pathophysiology of IgA nephropathy. Journal of The American Society of Nephrology. 22 (10), 1795-1803 (2011).
- He, L., et al. Synthetic double-stranded RNA poly(I:C) aggravates IgA nephropathy by triggering IgA class switching recombination through the TLR3-BAFF axis. American Journal of Nephrology. 42 (3), 185-197 (2015).
- Zhao, N., et al. The level of galactose-deficient IgA1 in the sera of patients with IgA nephropathy is associated with disease progression. Kidney International. 82 (7), 790-796 (2012).
- Xing, Y., et al. C1GALT1 expression is associated with galactosylation of IgA1 in peripheral B lymphocyte in immunoglobulin a nephropathy. BMC Nephrology. 21 (1), 18 (2020).
- Qin, W., et al. External suppression causes the low expression of the Cosmc gene in IgA nephropathy. Nephrology Dialysis Transplantation. 23 (5), 1608-1614 (2008).
- Sakai, F., et al. Lactobacillus gasseri SBT2055 induces TGF-β expression in dendritic cells and activates TLR2 signal to produce IgA in the small intestine. PLoS One. 9 (8), 105370 (2014).
- Gutzeit, C., Magri, G., Cerutti, A. Intestinal IgA production and its role in host-microbe interaction. Immunological Reviews. 260 (1), 76-85 (2014).
- Serino, G., et al. In a retrospective international study, circulating miR-148b and let-7b were found to be serum markers for detecting primary IgA nephropathy. Kidney International. 89 (3), 683-692 (2016).
- Lu, F., et al. Therapeutic effect of Rhizoma Dioscoreae Nipponicae on gouty arthritis based on the SDF-1/CXCR 4 and p38 MAPK pathway: an in vivo and in vitro study. Phytotherapy research: PTR. 28 (2), 280-288 (2014).
- Wang, W., Xu, L., Zhou, L., Wan, S., Jiang, L. A Network pharmacology approach to reveal the underlying mechanisms of Rhizoma Dioscoreae Nipponicae in the treatment of asthma. Evidence-Based Complementary and Alternative Medicine: eCAM. 2022, 4749613 (2022).
- Tian, W. W., Wei, Y. Professor TONG Xiaolin used the experience of Dioscoreae Nipponicae. Jilin Journal of Chinese Medicine. 40 (05), 589-592 (2020).
- Rao, X. R., Bai, Y. W. Das Xiwen's experience in treating IgA nephropathy. Beijing Journal of Traditional Chinese Medicine. 9, 691-693 (2008).
- Si, Y., Zhang, Y. A data mining study on the pattern of medication use in the treatment of IgA nephropathy by Professor Zhang Yu. Journal of Chinese Physician. 20 (01), 109-111 (2018).
- Jiang, H., et al. Optimization of the enzymatic extraction technology of Diosgenin from Dioscorea nipponica. Chinese Traditional Patent Medicine. 39 (03), 621-624 (2017).
- Qi, M., et al. Dioscin alleviates lipopolysaccharide-induced inflammatory kidney injury via the microRNA let-7i/TLR4/MyD88 signaling pathway. Pharmacological Research. 111, 509-522 (2016).
- Yang, L., et al. Recent advances in the pharmacological activities of Dioscin. BioMed Research International. 2019, 5763602 (2019).
- Nal Zou, J., et al. Toll-like receptor 4 signaling pathway in the protective effect of Pioglitazone on experimental immunoglobulin A nephropathy. Chinese Medical Journal. 130 (8), 906-913 (2017).
- Xu, S. Y., Bian, R. L., Chen, X. Pharmacological experiments methodology. Chinese Pharmacological Bulletin. 1, 19 (1992).
- Shen, J. C., Ren, Y., Rao, X. R., You, Y., Li, S. Network pharmacology, molecular docking, and in vitro experiments to explore the molecular mechanism of Dioscorea Nipponica Makion in the treatment of IgA nephropathy. World Journal of Integrated Traditional and Western Medicine. 16 (12), 2246-2254 (2021).
- Mestecky, J., et al. IgA nephropathy: molecular mechanisms of the disease. Annual Review of Pathology. 8, 217-240 (2013).
- Novak, J., et al. IgA1-containing immune complexes in IgA nephropathy differentially affect proliferation of mesangial cells. Kidney International. 67 (2), 504-513 (2005).
- Nihei, Y., et al. Identification of IgA autoantibodies targeting mesangial cells redefines the pathogenesis of IgA nephropathy. Science Advances. 9 (12), (2023).
- Raska, M., et al. Identification and characterization of CMP-NeuAc: GalNAc-IgA1 alpha2,6-sialyltransferase in IgA1-producing cells. Journal of Molecular Biology. 369 (1), 69-78 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados