Method Article
Диосцин опосредует облегчение IgA-нефропатии путем ингибирования активации В-клеток in vivo и снижения продукции IgA1 с дефицитом галактозы in vitro
В этой статье
Резюме
В этом исследовании представлены экспериментальные данные по лечению иммуноглобулиновой нефропатии А (IgAN) диосцином (ДИО), активным ингредиентом Dioscoreae Nipponicae Rhizoma (DNR), а также парадигма для изучения эффектов фитотерапии и основных механизмов in vivo и in vitro.
Аннотация
Повышение циркулирующего галактозодефицитного IgA1 (Gd-IgA1) обусловлено избыточной активацией IgA-положительных секреторных клеток в процессе иммунных реакций слизистой оболочки, что является критическим звеном в патогенезе IgA-нефропатии (IgAN). Пейерово пятно, заметное место, где В-лимфоциты превращаются в IgA-секретирующие плазматические клетки, является основным источником IgA. Кроме того, более низкая экспрессия ядра 1β-1,3-галактозилтрансферазы (C1GalT1) и ее молекулярного шаперона, C1GalT1-специфического молекулярного шаперона (Cosmc), связана с аномальным гликозилированием IgA1 у пациентов с IgAN. Наш клинический опыт показывает, что фитотерапия Dioscoreae Nipponicae Rhizoma (DNR) может облегчить протеинурию и гематурию и улучшить функцию почек у пациентов с IgAN. Диосцин (ДИО) является одним из основных активных ингредиентов ДНР, который обладает различной фармакологической активностью. В этом исследовании изучается возможный механизм DIO в лечении IgAN.Модель IgAN мыши была создана путем иммунной индукции слизистой оболочки. Мыши были разделены на контрольную, модельную и зондовую группы DIO. С помощью иммунофлуоресценции и иммуногистохимии выявлены клубочковое отложение IgA у мышей, патологические изменения почек и экспрессия маркеров В-клеток CD20 и CXCR5 в пластыре Пейера. После стимуляции липополисахаридами (ЛПС) влияние DIO на пролиферацию клеток DAKIKI, секрецию IgA и Gd-IgA1, экспрессию C1GalT1 и Cosmc изучали с помощью анализа набора для подсчета клеток-8 (CCK-8), иммуноферментного анализа (ИФА), количественной полимеразной цепной реакции в реальном времени (QRT-ПЦР) и вестерн-блоттинга (WB). В исследованиях in vivo отложение IgA, сопровождающееся гломерулярной мезангиальной гиперплазией и повышенной экспрессией CD20 и CXCR5 в пятне Пейера у мышей модели IgAN, было облегчено DIO. Исследования in vitro показали, что DIO от 0,25 мкг/мл до 1,0 мкг/мл ингибирует индуцированную ЛПС пролиферацию клеток DAKIKI, секрецию IgA и Gd-IgA1, а также повышает экспрессию мРНК и белков C1GalT1 и Cosmc. Это исследование демонстрирует, что DIO может снижать продукцию Gd-IgA1 путем ингибирования чрезмерной активации IgA-секретирующих клеток и повышения экспрессии C1GALT1/Cosmc.
Введение
IgA-нефропатия (IgAN) является наиболее распространенным типом первичного гломерулонефрита, для которого не существует специфического лечения, и он остается значимой причиной терминальной стадии почечной недостаточности1. Несмотря на то, что патогенез IgAN до сих пор до конца не изучен, «гипотеза множественного попадания» общепризнательна и подкреплена большим объемом клинических и экспериментальных данных2. Патогенез IgAN включает активацию В-клеток и выработку галактозодефицитного IgA1 (Gd-IgA1)3. Увеличение циркулирующего Gd-IgA1 из-за чрезмерной пролиферации и активации IgA-секретирующих клеток во время иммунного ответа слизистой оболочки является критическим звеном в патогенезе IgAN 4,5,6. Являясь центральным местом для пролиферации и активации фенотипа В-лимфоцитов в клетки, секретирующие IgA, пейеровов пластырь является основным источником секреции IgA, тесно связанным с возникновением и развитием IgAN 7,8. Кроме того, пролиферация IgA1-секретирующих клеток, а также экспрессия ядра 1β-1,3-галактозилтрансферазы (C1GalT1) и C1GalT1-специфического молекулярного шаперона (Cosmc) были связаны с аномальным гликозилированием IgA1, что вызывает продукцию GD-IgA1 у пациентов с IgAN 6,9.
В последние годы продвинулись клинические исследования лечения IgAN с помощью фитотерапии. Формула Yiqi Qingjie является незаменимой формулой для лечения IgAN в отделении нефрологии больницы Гуанъаньмэнь. Предыдущее исследование нашей группы показало, что Gd-IgA1 снижается в сыворотке крови пациентов с IgAN после лечения формулой Yiqi Qingjie. Являясь одной из наиболее часто используемых трав в формуле Yiqi Qingjie, Dioscoreae Nipponicae Rhizoma (DNR) представляет собой высушенное корневище Dioscorea Nipponica Makino, которое выполняет различные функции, такие как регулирование иммунитета, подавление воспаления, облегчение кашля и астмы10,11. Несколько ученых лечили IgAN с помощью DNR и добились хороших результатов 12,13,14. Являясь основным активным ингредиентом DNR15, диосцин (DIO) снижает уровень мочевой кислоты, подавляет фиброз, подавляет воспалительную реакцию и антиокислительный стресс16,17. Таким образом, DIO может обладать новым механизмом действия, ингибируя клеточную секрецию чрезмерного количества Gd-IgA1 и оказывая специфические защитные эффекты на почки. Тем не менее, не сообщалось о каких-либо исследованиях механизма действия DIO для лечения IgAN.
Чтобы изучить потенциальный терапевтический механизм воздействия ДИО на IgAN и предложить новый метод лечения IgAN, мы провели эксперименты по терапевтическому воздействию ДИО на IgAN in vivo и in vitro.
протокол
Комитет по этике больницы Гуанганьмэнь одобрил этот эксперимент (номер этического одобрения эксперимента на животных: IACUC-GAMH-2023-003).
1. Подготовка мышей к экспериментальной процедуре
- Вырастите 22 самцов мышей Balb/c класса SPF (в возрасте 6-7 недель, масса тела 20-25 г) в животноводческом помещении больницы/исследовательского центра. Разделите животных на контрольную (n = 8) и модельную (n = 14) группы с помощью метода таблицы случайных чисел.
- После 1 недели адаптивного выращивания в лабораторной клетке в течение 9 недель кормили модельную группу (группу IgAN) 0,1% раствором гамма-глобулина крупного рогатого скота (BGG) в подкисленной воде, содержащей 6 ммоль/л HCl.
- Вводите 0,1 мл 0,1% раствора BGG в физиологическом растворе в хвостовую вену в течение 3 дней подряд, продолжая пить раствор BGG для приготовления экспериментальной модели мышиIgAN 18.
- Дайте контрольной группе свободно выпить 6 ммоль/л подкисленной воды HCl без BGG в течение 9 недель. Введите соответствующий объем физиологического раствора в хвостовую вену в течение 3 дней подряд.
Примечание: Контрольная и модельная группы получали корм того же качества, что и обычный корм. - После инъекции хвостовой вены случайным образом выберите 2 мыши в контрольной группе и 2 мыши в модельной группе и изучите их с помощью протеинурии, световой микроскопии и иммунофлуоресценции, чтобы определить, было ли моделирование успешным.
ПРИМЕЧАНИЕ: Животным не предоставляется пища, но и не запрещено пить воду; Запись диуреза. - Собирайте мочу в течение 24 ч с помощью метаболических клеток и центрифугируйте ее при 400 х г в течение 5 мин; Сбросить осадок мочи. После 10-кратного разведения надосадочной жидкости измерьте концентрацию протеинурии с помощью набора для анализа белка мочи, а затем умножьте на фактор разведения и объем мочи, чтобы получить 24 часа общего белка мочи.
ПРИМЕЧАНИЕ: Методы микроскопии и иммунофлюоресценции показаны в разделах 3 и 4 соответственно. - После успешной подготовки модели разделите 12 мышей в модельной группе на 6 мышей, каждая из которых находится в модельной группе (группа IgAN) и группе DIO gavage (группа DIO), в соответствии с методом таблицы случайных чисел.
- Пусть контрольная группа продолжает пить 6 ммоль/л HCl подкисленной воды без BGG, а модельная группа 0,1% раствор BGG, состоящий из подкисленной воды, содержащей 6 ммоль/л HCl. Рассчитайте дозу введения DIO group gavage в соответствии с формулой пересчета дозы фармакологической экспериментальной методики (в пересчете на массу тела человека 70 кг)19. Gavage DIO таблетки по 0,06 г/кг один раз в сутки в течение 8 недель.
- После 8 недель зондирования мышам проводят внутрибрюшинную анестезию 0,4% пентобарбитала натрия (60 мг/кг), а после подтверждения надлежащей анестезии путем ущемления пальцев ног изолируют почки и пластырь Пейера для последующей световой микроскопии и иммуногистохимического анализа.
ПРИМЕЧАНИЕ: Схема для модели in vivo приведена на дополнительном рисунке 1.
2. Гистологический анализ
- Парафиновые срезы для почек и пластырь Пейера
- Зафиксируйте ткани почек толщиной 3 мм или 1 пластырь Пейера 4% параформальдегидом на 24 ч, обезвожьте градиентным этанолом и ксилолом. Опустить в воск на 2 часа, запечатать и заморозить.
- Вырежьте срезы почек толщиной 2 мкм и срезы пейерова пейера толщиной 4 мкм и разложите их в теплой воде. Зачерпните развернутые ломтики чистым предметным стеклом и запекайте их в духовке постоянной температуры при температуре 40 °C в течение 1 часа. Приступайте к окрашиванию после предварительной обработки образца.
ПРИМЕЧАНИЕ: Возьмите коронковую поверхность прикорневой части почки, толщиной 3 мм тканевого блока.
- Удалите парафин и окрашивайте срезы парафина при комнатной температуре (RT) в течение 10 минут периодическим раствором кислоты, избегая попадания света. Промойте дистиллированной водой и вытрите насухо испачканные раствором для окрашивания Шиффа в течение 20-30 минут, избегая попадания света. Промойте дистиллированной водой до тех пор, пока срезы не станут красными под микроскопом.
- Поместите срезы в раствор для окрашивания гематоксилина, закрасьте ядра на 3 мин (ядра, окрашенные слишком глубоко, могут быть разделены гидрохлоридом этанола) и промойте проточной водой до тех пор, пока стекла не станут бесцветными.
- Проведите рутинное обезвоживание с помощью градиентных концентраций этанола и ксилола, запечатайте срезы нейтральной камедью и наблюдайте под микроскопом. PAS-положительный имеет красный цвет, а ядро – синий.
3. Иммуногистохимический анализ пейерова пластыря
- Подготовьте парафиновые срезы пластыря Пейера, как описано в шаге 2.1.
ПРИМЕЧАНИЕ: Толщина срезов для иммуногистохимической и последующей иммунофлюоресценции составляет 4 мкм. - Депарафинизация срезов:
- Поместите срезы в ксилол I на 5 мин, ксилол II на 5 мин и ксилол III на 5 мин.
- Далее промыть предметные стекла в безводном этаноле I в течение 5 мин, безводном этаноле II в течение 5 мин, 85% спирте в течение 5 мин, 75% спирте в течение 5 мин. Затем промойте горки в дистиллированной воде.
- Забор антигена
- Приготовьте 50-кратный исходный раствор цитрата натрия и разбавьте дистиллированной водой до 1-кратного для использования. Нагрейте его в автоклаве в течение 2 минут, после чего поместите ломтики в автоклав, следя за тем, чтобы уровень жидкости превышал уровень ломтиков.
- Нагрейте при высокой температуре в течение 5 минут, затем дайте предметным стеклам остыть естественным образом. Промойте ломтики трижды раствором PBS по 5 мин каждый.
- Блокирование эндогенной пероксидазы: Отметьте границы ткани по кругу иммуногистохимической ручкой. Срезы инкубировать в 3% растворе перекиси водорода в течение 15 мин при РТ, защищенном от света, и каждый раз трижды промыть срезы раствором PBS в течение 5 мин.
- Блокирование сыворотки: Заблокируйте участки, капнув 10% козью сыворотку на участки ткани, помеченные в течение 30 минут при RT. Убедитесь, что участки равномерно покрыты пятном.
- Инкубация первичных антител: Осторожно стряхните блокирующий раствор и добавьте часть подготовленного первичного антитела (CD20 [1:800]; CXCR5 [1:800]) в раздел. Поместите секцию в плоскую форму во влажную коробку и выдерживайте в течение ночи при температуре 4 °C.
ПРИМЕЧАНИЕ: Добавьте небольшое количество воды во влажную коробку, чтобы предотвратить испарение антител. - Инкубация вторичных антител: каждый раз трижды промывайте срезы раствором PBS в течение 5 минут. Удалите PBS, встряхнув срезы насухо, покройте ткань каплей вторичного антитела (HRP-метка) родственных видов первичного антитела и инкубируйте при ЛТ в течение 50 минут.
- Гомогенизация 3,3'-диаминобензидина (DAB): Промойте срезы раствором PBS трижды в течение 5 мин каждая. Вытряхнув срезы насухо, капните на срезы свежеприготовленный хромогенный раствор DAB. Наблюдать за временем проявления цвета под микроскопом; Позитив – коричневато-желтый. Промойте водопроводной водой, чтобы остановить развитие цвета.
- Окрашивание ядер: Повторно окрашивайте гематоксилином в течение примерно 1 минуты, промойте водой из-под крана, а затем прополощите в течение 10 минут водопроводной водой, чтобы вернуть синий цвет.
- Обезвоживание и герметизация:
- Поместите срезы в 75% спирт на 5 мин и 85% спирт на 5 мин. Поместите секции в безводный этанол I на 5 минут, безводный этанол II на 5 минут и безводный этанол III на 5 минут.
- Промойте секции в ксилоле I в течение 5 минут, выньте их для небольшого подсыхания и заклейте секции нейтральной резинкой.
- Получение изображений: Собирайте изображения с помощью микроскопического исследования и анализируйте с помощью программного обеспечения гало для анализа панорамных изображений ткани.
Примечание: Окрашенные гематоксилином ядра имеют синий цвет, а положительная экспрессия DAB наблюдается как коричневато-желтая.
4. Почечная иммунофлюоресценция IgA
- Подготовьте парафиновые срезы для почек, как описано в шаге 2.1.
- Парафиновые срезы для депарафина:
- Поместите срезы в ксилол I на 5 мин, ксилол II на 5 мин и ксилол III на 5 мин. Обработайте срезы безводным этанолом I, безводным этанолом II, 95% этанолом, 90% этанолом, 80% этанолом, 70% этанолом и 50% этанолом в течение 5 минут и промойте дистиллированной водой.
- Извлечение протеиназы К: Вытряхните срезы насухо и нарисуйте круг вокруг участка ткани с помощью гистохимического ручки. Добавьте рабочий раствор протеиназы К (соотношение 1:9 стокового раствора и PBS) по каплям, чтобы покрыть ткань, и инкубируйте при 37 °C в течение 30 минут. Промойте секции три раза PBS по 5 минут каждая.
- Проникновение в клеточную мембрану: Слегка встряхните срезы насухо, а затем покройте их 0,1% Тритоном. Инкубировать в течение 20 минут при RT и трижды промыть секции PBS по 5 минут каждая.
- Блокирование: Добавьте 10% козью сыворотку по каплям, чтобы равномерно покрыть ткань для блокировки при RT в течение 30 минут.
- Первичная инкубация антител: Добавьте соответствующее количество козьего антитела IgA против мыши AF488 (1:500) по каплям, чтобы равномерно покрыть ткань, и инкубируйте в течение ночи при 4 °C.
- Окрашивание ядер: Промойте ломтики трижды PBS в течение 5 минут каждый. После удаления PBS добавьте по каплям краситель 4',6-диамидино-2-фенилиндол (DAPI) на срезы и выдерживайте в течение 15 минут при RT в защищенном от света месте.
- Промойте и загерметизируйте секции: Промойте секции трижды PBS в течение 5 минут, затем загерметизируйте их монтажной средой, препятствующей выцветанию.
- Микроскопия и фотография: Наблюдайте за срезами под флуоресцентным микроскопом и делайте снимки.
ПРИМЕЧАНИЕ: Для DAPI ультрафиолетовое возбуждение имеет длину волны 330-380 нм, а длина волны излучения составляет 420 нм, синий свет. Длина волны возбуждения флуоресцеина изотиоцианата (FITC) составляет 465-495 нм, а длина волны излучения - 515-555 нм, зеленый свет.
5. Культура клеток
- Получите линию В-лимфоцитов человека DAKIKI от ATCC, США. Культуру клеток DAKIKI в среде RPMI-1640 с добавлением 10% FBS и 1% пенициллин-стрептомицина.
- Культивируйте клетки в инкубаторе с температурой 37 °C и 5%CO2 и подкультивируйте их каждые 2-3 дня. Для всех экспериментов используйте клетки в логарифмической фазе роста.
- При конфлюенции 70%-80% соберите клетки с помощью стерильной пипетки и центрифугируйте клетки при давлении 140 x g в течение 5 минут. Выбросьте надосадочную жидкость, восстановите суспендию с помощью среды, не содержащей сыворотки, и через 24 ч оставьте все клетки в состоянии покоя для последующего лечения.
6. Анализ цитотоксичности ЛДГ для скрининга безопасных концентраций ДИО на нормальных клетках DAKIKI
- Засейте клетки DAKIKI в 96-луночные планшеты с плотностью 4x105 клеток/лунку и выделите группу Low control, группу High control и различные концентрации DIO (0,25, 0,5, 1,0, 2,0, 4,0, 8,0 мкг/мл). Инкубировать в инкубаторе с концентрацией 5%СО2, 37 °С в течение 24 ч после соответствующей обработки по методу группировки.
- В соответствии с инструкцией набора для определения цитотоксичности добавьте 5 мкл лизата на лунку в группе с высоким уровнем контроля, а затем поместите планшет в инкубатор с 5% содержаниемCO2, 37 °C на 15 минут.
- Достаньте тарелку, добавьте в каждую лунку по 100 мкл реакционной смеси, выдержите в темноте 10 мин при RT, а затем добавьте 50 мкл раствора для остановки реакции. Как можно скорее измерьте значение наружного диаметра на длине волны 490 нм на считывателе микропланшетов.
- Рассчитайте скорость высвобождения ЛДГ различных концентраций ДИО и ≤10% в качестве максимальной введенной дозы по формуле: скорость высвобождения ЛДГ = (экспериментальная скважина ЛДГ - низкий контроль ЛДГ) / (высокий контроль ЛДГ - низкий контроль ЛДГ) х 100%.
7. Анализ CCK-8 для определения влияния DIO на пролиферацию клеток DAKIKI
- Основываясь на результатах наших предыдущих экспериментов20, создать модель IgAN с использованием ЛПС 40 мкг/мл для индуцирования клеток DAKIKI.
- Затем засейте 4x105 клеток/лунку в 96-луночные планшеты и разделите на контрольную, модельную и DIO группы низкой, средней и высокой концентрации (0,25 мкг/мл, 0,5 мкг/мл и 1,0 мкг/мл). Инкубировать планшеты в инкубаторе с 5% CO2, 37 °C в течение 24 часов.
- Затем добавьте по 20 мкл реагента CCK-8 в каждую лунку и поместите планшеты обратно в инкубатор (5% CO2, 37 °C) на 2 ч. После инкубации как можно скорее определите наружный диаметр на длине волны 450 нм на микропланшетном риддере.
8. ИФА для определения влияния ДИО на секрецию IgA и Gd-IgA1 клетками DAKIKI
- Засейте клетки DAKIKI в 6-луночные планшеты с плотностью 6x106 клеток/лунку, сгруппируйте и обработайте клетки в соответствии с шагом 7.2. Культивируйте клетки в течение 24 ч, затем центрифугируйте при 850 x g в течение 10 мин при 4 °C для получения надосадочной жидкости.
- Определите концентрации IgA и Gd-IgA1 в соответствии с инструкцией к набору.
9. qRT-ПЦР для определения влияния DIO на уровни мРНК C1GALT1 и Cosmc в клетках DAKIKI
- Засейте клетки DAKIKI в плотности 6x106 клеток/лунку в 6-луночный планшет, сгруппируйте и обработайте клетки в соответствии с CCK8, упомянутым на шаге 7.2, и инкубируйте в течение 24 часов. Извлеките общую РНК из клеток DAKIKI в соответствии с инструкциями набора для экстракции общей РНК.
- После взятия 1 мкл экстрагированной РНК из каждой группы образцов и измерения ее концентрации обратное расшифровка 1 г общей РНК из каждого образца в кДНК в соответствии с инструкциями к набору.
- Затем проводят амплификацию ОТ-ПЦР для определения экспрессии каждого гена (95 °C в течение 15 мин, 95 °C в течение 10 с и 60 °C в течение 30 с). Рассчитайте уровень экспрессии каждого гена с помощью метода 2-ΔΔCT с β-актином в качестве внутреннего эталона.
ПРИМЕЧАНИЕ: Последовательности праймеров были следующими:
C1GALT1: 5'-AAGGTTGACACCCAGCCTAA-3', 5'-CTTTGACGTGTTTGGCCTTT-3';
Cosmc: 5'-GCTCCTTTTTGAAGGGTG-3', 5'-TACTGCAGCCCAAAGACTCA-3';
β-актин: 5'-TCACCCACACTGTGCCCATCTACGA-3', 5'-CAGCGGAACCGCTCATTGCCAATGG-3'.
10. Вестерн-блоттинг для изучения влияния DIO на экспрессию белков C1GALT1 и Cosmc в клетках DAKIKI
- Засейте клетки DAKIKI с плотностью 6x106 клеток/лунку в 6-луночный планшет. Сгруппируйте и обрабатывайте их, как указано в шаге 7.2. Через 24 ч инкубации соберите каждую группу клеток.
- Добавьте соответствующее количество раствора для лизиса клеток (PMSF: ингибитор фосфатазы: раствор для лизиса RIPA = 1:1:100) и инкубируйте на льду в течение 30 минут. Затем центрифугируйте при 13 500 x g в течение 10 минут при 4 °C и соберите надосадочную жидкость.
- Определите концентрацию белка с помощью набора для анализа концентрации белка BCA.
- Смешайте образцы белка с 5-кратным загрузочным буфером SDS-PAGE в соотношении 4:1 путем вортексирования и нагрейте смешанные образцы до 100 °C в течение 5 минут для денатурации белка.
- Чтобы обнаружить белки с различной молекулярной массой, добавьте маркер белка (5 мкл/лунку) и образцы (20 мкг/лунку) в разные полосы 12% геля SDS-PAGE, запустите электрофорез SDS-PAGE и перенесите гель на мембраны PVDF.
- Блокируйте мембраны 5% обезжиренным молоком в течение 2 ч при ЛТ и инкубируйте с соответствующими первичными антителами (C1GALT1 [1:1000], Cosmc [1:2000]) в течение 24 ч. Используйте антитела к β-актину (1:100000) в качестве внутреннего контроля.
- Промойте мембрану из поливинилиденфторида (PVDF) 1x трис-буферизованным физиологическим раствором, 0,1% детергентом Tween 20 (TBST) три раза (10 мин/раз), затем инкубируйте с соответствующими вторичными антителами IgG козы против кролика (1: 10000) в RT в течение 2 ч.
- Еще раз промойте мембрану TBST (три раза по 10 мин) и обработайте ее соответствующим количеством рабочего раствора с усиленной хемилюминесценцией (ECL) (в соответствии с инструкциями производителя) для обнаружения белковой полосы.
- Получение изображений с помощью системы хемилюминесцентной визуализации и выполнение полуколичественного анализа значений серого цвета белков с помощью системы анализа изображений Image J.
11. Статистический анализ
- Используйте соответствующее программное приложение для анализа данных. Выразите все данные в виде среднего ± SD (стандартное отклонение) и оцените несколько образцов с помощью одностороннего теста ANOVA для сравнения между группами.
ПРИМЕЧАНИЕ: Для статистического анализа использовалось статистическое программное обеспечение SPSS 26.0. Метод ЛСД использовался для двустороннего сравнения между группами, когда дисперсии были равны, а метод Даннетта Т3 использовался для двустороннего сравнения между группами, когда дисперсии не были равны. Считалось, что P<0,05 указывает на статистически значимую разницу.
Результаты
Влияние DIO на почечную ткань на модели мышей IgAN
По сравнению с контрольной группой, у мышей с иммуноиндуцированной слизистой оболочкой IgAN (модельная группа) наблюдалось значительное увеличение протеинурии (дополнительный рисунок 2), отложение IgA было видно в мезангиальной области, флуоресценция равномерно распределялась кластерами по всей мезангиальной области (рисунок 1A), окрашивание PAS почечной ткани показало пролиферацию мезангиальных клеток и стромальную гиперплазию (рисунок 1B), который был уменьшен в группе зондов DIO (группа DIO).
Влияние ДИО на В-лимфоциты в пластыре Пейера
Пейерово пластырь является ведущим местом превращения В-лимфоцитов в IgA-секретирующие клетки. Мы взяли пластырь Пейера в качестве объекта исследования для наблюдения за влиянием DIO на В-лимфоциты путем детектирования экспрессии маркеров В-клеток CD20 и CXCR5. Иммуногистохимические результаты показали, что экспрессия CD20 и CXCR5 была значительно выше в модельной группе по сравнению с контрольной группой. DIO может ингибировать экспрессию вышеуказанных молекулярных маркеров (рис. 2A, B).
Безопасный диапазон концентраций DIO на элементах DAKIKI
ЛДГ является маркером целостности плазматической мембраны и индикатором гибели клеток, при этом более высокая скорость высвобождения ЛДГ указывает на более серьезное повреждение клеток. Для определения безопасного диапазона концентраций ДИО использовали анализ высвобождения ЛДГ. Максимальная безопасная концентрация ДИО определялась по скорости выброса ЛДГ ниже 10%. Результаты (рис. 3) не показали значимой цитотоксичности, индуцированной DIO в концентрациях от 0,25 до 1,0 мкг/мл. Поэтому в следующем исследовании в качестве уровня дозирования использовались 0,25, 0,5 и 1,0 мкг/мл DIO.
Влияние DIO на пролиферацию клеток DAKIKI
Экспериментальные результаты (рис. 4) показали, что по сравнению с модельной группой (ЛПС-стимулированная группа), DIO ингибировал ЛПС-индуцированную пролиферацию клеток DAKIKI в зависимости от концентрации. DIO в концентрациях 0,5 и 1,0 мкг/мл значительно ингибировал ЛПС-индуцированную пролиферацию клеток DAKIKI (P < 0,01).
Влияние ДИО на секреторную функцию клеток DAKIKI
Уровни Gd-IgA1 тесно связаны с патологическим процессом IgAN, и общий IgA исследуется вместе как индикатор клеточной секреторной функции. Для определения содержания IgA и Gd-IgA1 в надосадочной жидкости культуры клеток DAKIKI был проведен иммуноферментный анализ. Результаты показали (рис. 5A, B), что клетки DAKIKI, стимулируемые ЛПС, секретируют больше IgA по сравнению с контрольной группой (P < 0,01). Для сравнения, DIO значительно ингибировал секрецию IgA (P < 0,01) клетками DAKIKI в зависимости от концентрации. По сравнению с контрольной группой, клетки DAKIKI, стимулированные ЛПС, секретировали больше Gd-IgA1 со статистической тенденцией (P < 0,10), а DIO ингибировали секрецию Gd-IgA1 из ЛПС-стимулированных клеток DAKIKI в зависимости от концентрации (P < 0,05 и P < 0,01), среди которых DIO в концентрации 1,0 мкг/мл значительно ингибировал секрецию Gd-IgA1 со скоростью ингибирования 25%.
Механизм DIO подавляет секрецию Gd-IgA1 клетками DAKIKI
Для дальнейшего изучения возможного механизма ингибирования DIO чрезмерной секреции Gd-IgA1 клетками DAKIKI с помощью кОТ-ПЦР были обнаружены уровни гликозилированной трансферазы C1GALT1 и шаперонового белка Cosmc мРНК в клетках DAKIKI, и результаты показали (рис. 6A, B), что относительная экспрессия мРНК C1GALT1 и Cosmc была снижена в клетках DAKIKI в модельной группе по сравнению с контрольной группой (P < 0,01). DIO в разной степени повышал относительную экспрессию мРНК C1GALT1 и Cosmc по сравнению с модельной группой, при этом DIO 1,0 мкг/мл значительно повышал относительную экспрессию мРНК C1GALT1 и Cosmc (P < 0,05).
В то же время метод WB был использован для выявления влияния DIO на экспрессию белков C1GALT1 и Cosmc в клетках DAKIKI. По сравнению с контрольной группой, экспрессия белков C1GALT1 и Cosmc в клетках DAKIKI в модельной группе заметно снизилась (P < 0,05). По сравнению с модельной группой, экспрессия белков C1GALT1 и Cosmc после вмешательства DIO была повышена. Экспрессия белков C1GALT1 и Cosmc значительно повышалась с помощью DIO в концентрации 1,0 мкг/мл (P < 0,05) (рис. 7A-C).
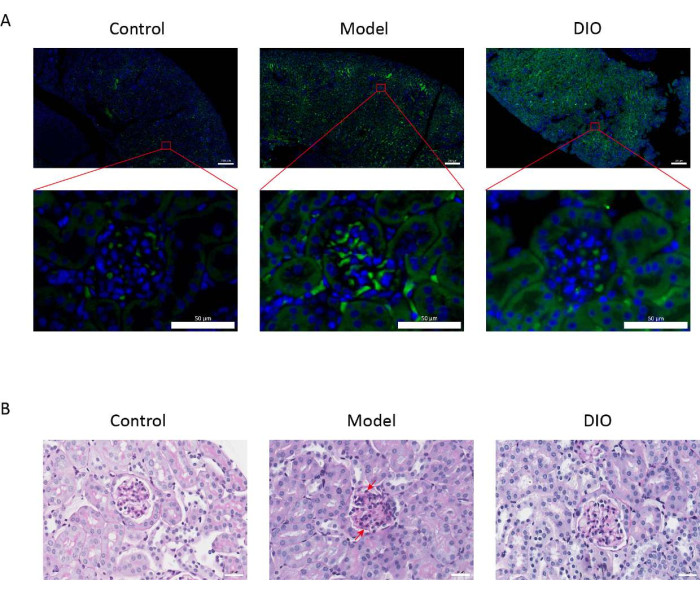
Рисунок 1: Гистопатология почек. (А) Иммунофлуоресцентный микроскоп. Срезы почек мышей в каждой группе окрашивали анти-IgA (зеленым) и DAPI (синим). Приведенная выше масштабная линейка = 200 мкм. Приведенная ниже масштабная линейка = 50 мкм. n = 6 на группу. (B) Репрезентативные фотографии окрашивания PAS почечной ткани у мышей в контрольной, модельной и DIO группах. Масштабная линейка = 30 мкм. Стрелка вниз показывает мезангиальные клетки, а стрелка вверх — строму. Масштабная линейка = 30 мкм. n = 6 на группу. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
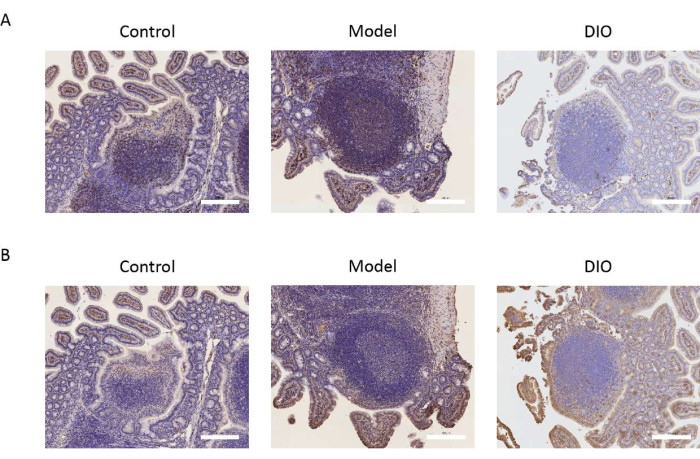
Рисунок 2: Влияние DIO на маркеры В-лимфоцитов. (A) Экспрессия CD20 в пейеровом пятне. Масштабная линейка = 200 мкм. n = 6 на группу. (B) Экспрессия CXCR5 в пятне Пейера. Масштабные линейки находятся в правом нижнем углу изображения. Масштабная линейка = 200 мкм. n = 6 на группу. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
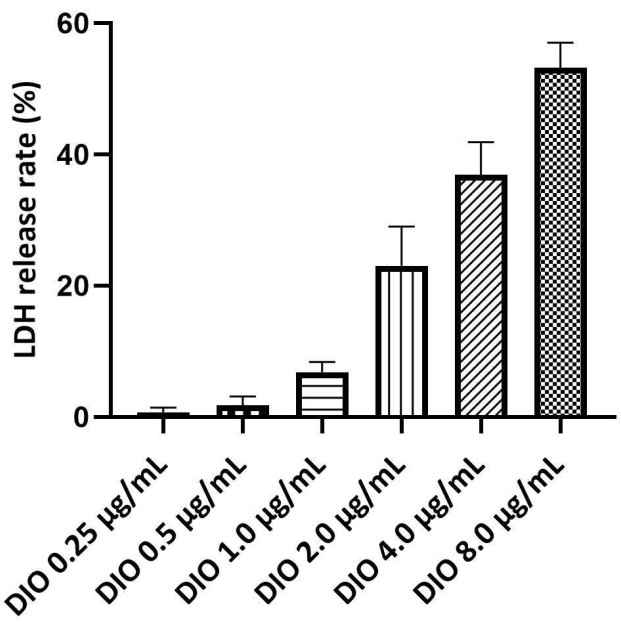
Рисунок 3. Скрининг безопасной концентрации DIO на клетках DAKIKI. Статистические значения выражаются в виде среднего значения ± SD из трех независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
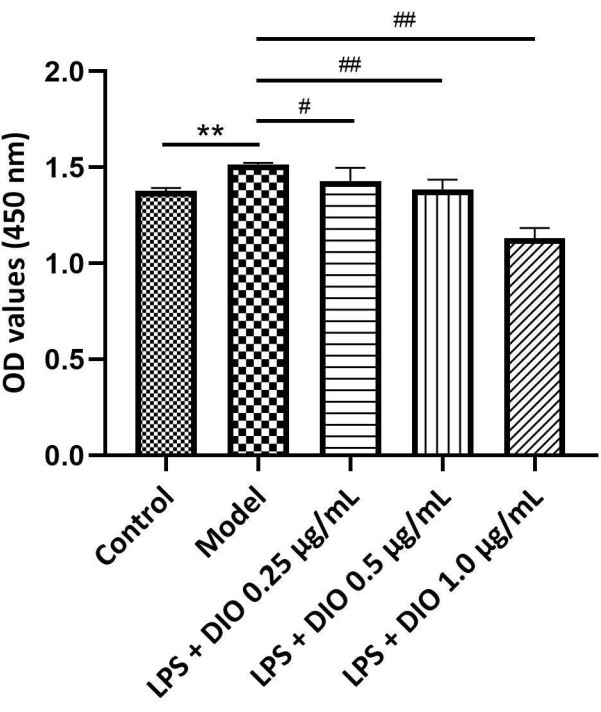
Рисунок 4. Различные концентрации DIO влияют на пролиферацию клеток DAKIKI. Данные были выражены в виде среднего значения ±SD. По сравнению с контрольной группой, **P < 0,01; по сравнению с модельной группой, #P < 0,05' ##P < 0,01; Результаты всех экспериментов повторялись трижды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
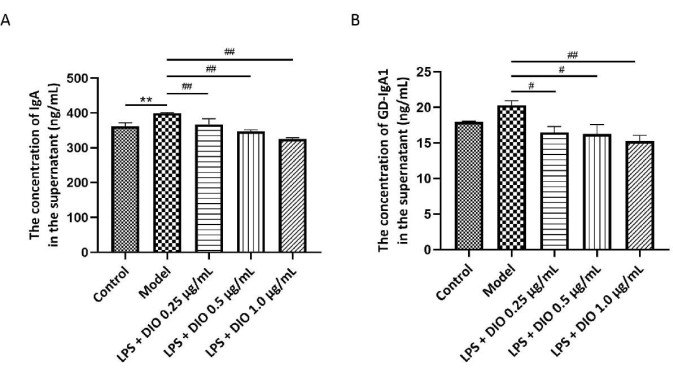
Рисунок 5. DIO ингибирует секрецию IgA и Gd-IgA1 клетками DAKIKI. (А) Методом ИФА была обнаружена экспрессия IgA в каждой группе. (B) Методом ИФА была обнаружена экспрессия Gd-IgA1 в каждой группе. Данные были выражены в виде среднего значения ± SD. По сравнению с контрольной группой, **P < 0,01; по сравнению с модельной группой, #P < 0,05, ##P < 0,01; Все экспериментальные результаты были повторены трижды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
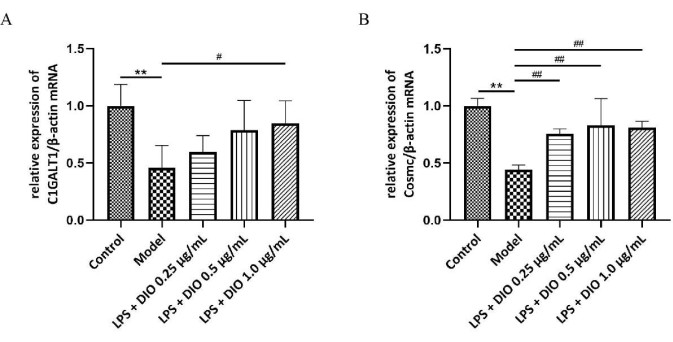
Рисунок 6. Механизм DIO подавляет чрезмерную секрецию Gd-IgA1 клетками DAKIKI. (A) QRT-ПЦР обнаружила экспрессию мРНК C1GALT1. (B) QRT-ПЦР обнаружила экспрессию мРНК Cosmc. Данные были выражены как среднее значение ± SD. По сравнению с контрольной группой, **P<0,01; по сравнению с модельной группой, #P < 0,05, ##P < 0,01; Все экспериментальные результаты были повторены трижды. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
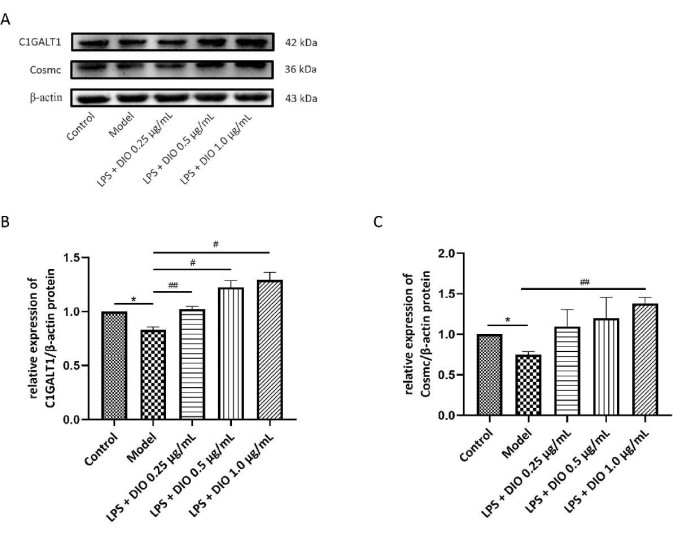
Рисунок 7. DIO влияет на экспрессию белков C1GALT1 и Cosmc в клетках DAKIKI. (A) WB подтвердил повышение экспрессии белков C1GALT1 и Cosmc с помощью DIO. (B) Полуколичественный анализ экспрессии C1GALT1 выполнен с использованием изображения J. (C) Полуколичественный анализ экспрессии Cosmc с использованием изображения J. Данные были выражены в виде среднего значения ±SD. По сравнению с контрольной группой*P < 0,05; по сравнению с модельной группой, #P < 0,05, ##P < 0,01, все экспериментальные результаты повторялись три раза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1. Схема для модели in vivo. Пожалуйста, нажмите здесь, чтобы скачать этот рисунок.
Дополнительный рисунок 2. Изменения протеинурии. Данные были выражены как среднее значение ± SD; n = 6 на группу. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Обсуждение
Характерным патологическим признаком IgAN является отложение IgA1 и GD-IgA1-содержащих иммунных комплексов в мезангиальной области клубочка21,22. Снижение образования иммунных комплексов может уменьшить повреждение почек и облегчить клинические симптомы IgAN. В эксперименте in vivo мы изучили терапевтическое воздействие DIO на IgAN, и обнаружили, что DIO может уменьшить отложение IgA в почках мышей модели IgAN. Показано, что накопление IgA-секретирующих клеток в почках связано с патогенезом IgAN23. Будучи важным местом пролиферации и активации В-лимфоцитов, пейеровы патч является важным источником IgA-секретирующих клеток, поэтому мы изучили экспрессию маркеров В-лимфоцитов (CD20, CXCR5) в пейеровом патче и обнаружили, что DIO может ингибировать экспрессию В-лимфоцитов в модели мышей IgAN. Эти экспериментальные результаты могут послужить основой для применения DIO в лечении IgAN.
Мы провели следующие эксперименты in vitro для дальнейшего изучения механизма действия DIO на IgAN. Во-первых, ранее было продемонстрировано, что DAKIKI, иммортализированная ВЭБ В-клеточная линия, которая секретирует IgA1, частью которого является GD-IgA124, идеально подходит для исследования in vitro механизма действия препарата на IgAN. Мы выбрали клетки DAKIKI для исследования молекулярного механизма DIO в лечении IgAN. Кроме того, воспалительный иммунный ответ слизистой оболочки играет неотъемлемую роль в патогенезе IgAN. Как упоминалось выше, мы используем ЛПС для стимуляции клеток DAKIKI, которые могут высвобождать провоспалительные факторы и опосредуть воспалительные реакции, что может лучше имитировать механизм иммунных реакций слизистых оболочек при IgAN. Клеточная модель in vitro может помочь в исследовании возможности и механизма применения других препаратов для лечения IgAN. Результаты показали, что DIO ингибирует пролиферацию клеток DAKIKI, стимулируемых ЛПС, в зависимости от концентрации. DIO может ингибировать секрецию IgA и Gd-IgA1 в клетках DAKIKI, вызванную стимуляцией ЛПС, и повышать экспрессию мРНК и белка C1GalT1 и его шаперона Cosmc в клетках DAKIKI, предполагая, что DIO может снижать секрецию Gd-IgA1 за счет повышения экспрессии C1GALT1/Cosmc и, таким образом, ингибировать чрезмерную активацию клеток DAKIKI.
В ходе экспериментальных процедур следует отметить ключевые этапы. Концентрация Gd-IgA1 в надосадочной жидкости клеток DAKIKI не находится в пределах диапазона обнаружения набора ELISA (1,56~100 нг/мл), и собранная надосадочная жидкость должна быть центрифугирована ультрафильтрационной трубкой для получения концентрированного Gd-IgA1. Кроме того, убедитесь, что объем надосадочной жидкости, начиная с каждой группы, одинаков, а конечный объем концентрата, полученного после ультрафильтрации, одинаков.
В данном исследовании мы использовали одновременно методы in vitro и in vivo , которые могут взаимно поддерживать друг друга в фармакологических эффектах и служить примером для изучения эффектов и их механизмов фитотерапии. Некоторые вещи можно было бы улучшить в этом протоколе. Во-первых, мы не обнаружили концентрации в крови мышей в группе DIO gavage; поэтому концентрация ДИО, эквивалентная концентрации в крови, не используется в экспериментах in vitro . Во-вторых, был исследован только мономер DIO, активный компонент DNR; влияние других компонентов DNR на IgAN все еще нуждается в дальнейшем изучении.
В заключение, это исследование обеспечивает экспериментальную основу для лечения IgAN с помощью DIO, активного ингредиента DNR. В этом исследовании была создана клеточная патологическая модель IgAN, имитирующая иммунный ответ IgAN на слизистую оболочку как in vitro , так и in vivo. Это дает новую идею для изучения традиционной китайской медицины для профилактики и лечения IgAN.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (81973675).
Материалы
| Name | Company | Catalog Number | Comments |
| Anti-CD20/MS4A1 Antibody | Boster Biotechnology Company | A03780-3 | |
| Antifade mounting medium | Beyotime, Shanghai, China | P0128S | |
| Balb/c mice | Beijing Weitong Lihua Laboratory Animal Technology Co., Ltd. | 110322220101424000 | |
| blocking serum | Solarbio, Beijing, China | SL038 | |
| Bovine gamma globulin | ShangHai YuanYe Biotechnology Company | S12031 | |
| C1GALT1 polyclonal antibody | Proteintech Group, Inc,USA | 27569-1-AP | |
| Citrate antigen retrieval solution(50×) | Phygene Biotechnology Company | PH0422 | |
| COSMC polyclonal antibody | Proteintech Group, Inc,USA | 19254-1-AP | |
| Cytotoxiciy detection kit | Roche Company | 4744926001 | |
| Dako REAL EnVision detection system, Peroxidase/DAB+ | Dako | K5007 | |
| DAPI | Invitrogen | D1306 | |
| Dioscin | National Institute For Food and Drug Control | 111707-201703 | |
| DIO tablets | Chengdu No 1 Pharmaceutical Co. Ltd. | H51023866 | |
| ECL working solution | Merck Biotechnology, Inc | WBKLS0100 | |
| Enhanced cell counting kit-8 | Beyotime, Shanghai, China | C0043 | |
| Fasking one-step removal of gene cDNA first-strand synthesis premix | TIANGEN,Beijing, China | KR118-02 | |
| Glycogen Periodic acid Schiff (PAS) stain kit | BaSO Biotechnology Company | BA4080A | |
| Goat anti-mouse IgA-AF488 | SouthernBiotech | 1040-30 | |
| Goat anti-rabbit IgG antibody (H+L), HRP conjugated | BeiJing Bioss Biotechnology Company | BS-0295G-HRP | |
| Human Gd-IgA1 ELISA kit | IBL | 27600 | |
| Human IgA ELISA kit | MultiSciences (LiankeBio) | 70-EK174-96 | |
| Pierce BCA protein assay kit | Thermo Scientific | 23227 | |
| PMSF solution | Beyotime, Shanghai, China | ST507 | |
| Proteinase K | Phygene Biotechnology Company | PH1521 | |
| Rabbit anti-CXCR5 polyclonal antibody | BeiJing Bioss Biotechnology Company | bs-23570R | |
| RIPA lysis buffer | Beyotime, Shanghai, China | P0013B | |
| RNAsimple total RNA extraction kit | TIANGEN,Beijing, China | DP419 | |
| RPMI Medium 1640 | Solarbio, Beijing, China | 31800 | |
| Super-Bradford protein assay kit | CWBIO, Beijing, China | CW0013 | |
| Triton X-100 | Beyotime, Shanghai, China | ST795 | |
| β-Actin Rabbit mAb | Abclonal, Wuhan, China | AC026 |
Ссылки
- Knoppova, B., et al. The origin and activities of IgA1-containing immune complexes in IgA nephropathy. Frontiers in Immunology. 7, 117 (2016).
- Suzuki, H., et al. The pathophysiology of IgA nephropathy. Journal of The American Society of Nephrology. 22 (10), 1795-1803 (2011).
- He, L., et al. Synthetic double-stranded RNA poly(I:C) aggravates IgA nephropathy by triggering IgA class switching recombination through the TLR3-BAFF axis. American Journal of Nephrology. 42 (3), 185-197 (2015).
- Zhao, N., et al. The level of galactose-deficient IgA1 in the sera of patients with IgA nephropathy is associated with disease progression. Kidney International. 82 (7), 790-796 (2012).
- Xing, Y., et al. C1GALT1 expression is associated with galactosylation of IgA1 in peripheral B lymphocyte in immunoglobulin a nephropathy. BMC Nephrology. 21 (1), 18 (2020).
- Qin, W., et al. External suppression causes the low expression of the Cosmc gene in IgA nephropathy. Nephrology Dialysis Transplantation. 23 (5), 1608-1614 (2008).
- Sakai, F., et al. Lactobacillus gasseri SBT2055 induces TGF-β expression in dendritic cells and activates TLR2 signal to produce IgA in the small intestine. PLoS One. 9 (8), 105370 (2014).
- Gutzeit, C., Magri, G., Cerutti, A. Intestinal IgA production and its role in host-microbe interaction. Immunological Reviews. 260 (1), 76-85 (2014).
- Serino, G., et al. In a retrospective international study, circulating miR-148b and let-7b were found to be serum markers for detecting primary IgA nephropathy. Kidney International. 89 (3), 683-692 (2016).
- Lu, F., et al. Therapeutic effect of Rhizoma Dioscoreae Nipponicae on gouty arthritis based on the SDF-1/CXCR 4 and p38 MAPK pathway: an in vivo and in vitro study. Phytotherapy research: PTR. 28 (2), 280-288 (2014).
- Wang, W., Xu, L., Zhou, L., Wan, S., Jiang, L. A Network pharmacology approach to reveal the underlying mechanisms of Rhizoma Dioscoreae Nipponicae in the treatment of asthma. Evidence-Based Complementary and Alternative Medicine: eCAM. 2022, 4749613 (2022).
- Tian, W. W., Wei, Y. Professor TONG Xiaolin used the experience of Dioscoreae Nipponicae. Jilin Journal of Chinese Medicine. 40 (05), 589-592 (2020).
- Rao, X. R., Bai, Y. W. Das Xiwen's experience in treating IgA nephropathy. Beijing Journal of Traditional Chinese Medicine. 9, 691-693 (2008).
- Si, Y., Zhang, Y. A data mining study on the pattern of medication use in the treatment of IgA nephropathy by Professor Zhang Yu. Journal of Chinese Physician. 20 (01), 109-111 (2018).
- Jiang, H., et al. Optimization of the enzymatic extraction technology of Diosgenin from Dioscorea nipponica. Chinese Traditional Patent Medicine. 39 (03), 621-624 (2017).
- Qi, M., et al. Dioscin alleviates lipopolysaccharide-induced inflammatory kidney injury via the microRNA let-7i/TLR4/MyD88 signaling pathway. Pharmacological Research. 111, 509-522 (2016).
- Yang, L., et al. Recent advances in the pharmacological activities of Dioscin. BioMed Research International. 2019, 5763602 (2019).
- Nal Zou, J., et al. Toll-like receptor 4 signaling pathway in the protective effect of Pioglitazone on experimental immunoglobulin A nephropathy. Chinese Medical Journal. 130 (8), 906-913 (2017).
- Xu, S. Y., Bian, R. L., Chen, X. Pharmacological experiments methodology. Chinese Pharmacological Bulletin. 1, 19 (1992).
- Shen, J. C., Ren, Y., Rao, X. R., You, Y., Li, S. Network pharmacology, molecular docking, and in vitro experiments to explore the molecular mechanism of Dioscorea Nipponica Makion in the treatment of IgA nephropathy. World Journal of Integrated Traditional and Western Medicine. 16 (12), 2246-2254 (2021).
- Mestecky, J., et al. IgA nephropathy: molecular mechanisms of the disease. Annual Review of Pathology. 8, 217-240 (2013).
- Novak, J., et al. IgA1-containing immune complexes in IgA nephropathy differentially affect proliferation of mesangial cells. Kidney International. 67 (2), 504-513 (2005).
- Nihei, Y., et al. Identification of IgA autoantibodies targeting mesangial cells redefines the pathogenesis of IgA nephropathy. Science Advances. 9 (12), (2023).
- Raska, M., et al. Identification and characterization of CMP-NeuAc: GalNAc-IgA1 alpha2,6-sialyltransferase in IgA1-producing cells. Journal of Molecular Biology. 369 (1), 69-78 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены