Method Article
通过离体活细胞成像询问唾液腺中的细胞间相互作用
摘要
免疫荧光成像受到仅在单个快照中观察复杂、时间依赖性生物过程的能力的限制。本研究概述了对精密切割小鼠下颌下腺切片进行的实时成像方法。这种方法可以实时观察体内平衡过程中的细胞间相互作用以及再生和修复过程。
摘要
唾液腺再生是一个复杂的过程,涉及各种细胞类型之间错综复杂的相互作用。最近的研究揭示了巨噬细胞在驱动再生反应中发挥的关键作用。然而,我们对这一关键作用的理解主要依赖于从固定组织活检中获得的静态视图。为了克服这一局限性并实时了解这些相互作用,本研究概述了一种用于 离体 培养唾液腺组织和捕获细胞迁移实时图像的综合方案。
该方案涉及几个关键步骤:首先,使用振动切片机仔细切片小鼠下颌下唾液腺组织,然后在气液界面培养。例如,通过暴露于辐射,这些切片可能会被故意伤害,以诱导细胞损伤并触发再生反应。为了追踪感兴趣的特定细胞,可以对它们进行内源性标记,例如利用从转基因小鼠收集的唾液腺组织,其中特定蛋白质用绿色荧光蛋白(GFP)标记。或者,可以使用荧光偶联抗体对表达特定目标细胞表面标志物的细胞进行染色。制备完成后,使用高内涵共聚焦成像系统在12小时内对唾液腺切片进行实时成像,每隔15分钟捕获一次图像。然后将生成的图像编译为视频,随后可以对其进行分析以提取有价值的细胞行为参数。这种创新方法为研究人员提供了一个强大的工具,可以研究和更好地了解损伤后唾液腺内的巨噬细胞相互作用,从而增进我们对这种动态生物学背景下再生过程的了解。
引言
巨噬细胞已被证明在再生和修复过程中发挥着越来越重要的作用,超越了其经典的免疫功能1,2。事实上,巨噬细胞参与了大量与再生相关的过程,在修复的所有阶段都表现出关键的调节活性,以及疤痕形成和纤维化 3,4。组织驻留巨噬细胞是高度异质的细胞类型,具有驱动多种细胞表型的复杂机制,它们在器官发育、功能和稳态中起着重要作用(如5 所述)。组织驻留巨噬细胞最初起源于卵黄囊和胎儿肝脏中的前体,随后它们以不同的速率被增殖或骨髓来源的血单核细胞取代,具体取决于现有巨噬细胞的寿命以及它们所在的组织或生态位6,7。
重要的是,组织驻留的巨噬细胞分散在所有组织中,并有助于不同的器官功能。它们由其微环境进行独特编程,以执行特定于生态位的功能。因此,巨噬细胞在组织内的定位提供了对其功能的洞察,在肺、乳腺、肠、皮肤和肌肉中观察到独特的群体 8,9,10。在乳腺发育过程中,导管巨噬细胞与导管树密切相关,它们的耗竭导致分支显着减少11。此外,巨噬细胞是青春期形态发生和妊娠期肺泡形成所必需的,它们积极监测上皮细胞。在肌肉损伤中,特定的巨噬细胞群"驻留在"损伤部位,提供了一个短暂的生态位,它们在其中提供干细胞增殖所需的增殖诱导线索。因此,它们表现出不同巨噬细胞群体在控制修复过程方面的特殊作用2.在肺部,也会发生类似的现象,即间质巨噬细胞引发表达白细胞介素 (IL)-R1 的肺泡 II 型 (AT2) 细胞,通过释放IL-1B 12 转化为损伤相关的瞬时祖细胞。此外,最近的研究表明,巨噬细胞对于照射损伤后小鼠下颌下唾液腺 (SMG) 的再生至关重要,如果没有巨噬细胞,上皮再生就会被破坏13。综上所述,这些数据强调了巨噬细胞活化和功能在组织损伤后以及体内平衡期间的短暂炎症生态位中的重要性。
巨噬细胞是活跃的细胞,其功能涉及与各种不同细胞类型的相互作用,包括直接细胞间接触14,15,以及更间接的方法,例如可溶性因子2,16的分泌,这对于生态位调节至关重要。虽然经典的免疫荧光成像有助于开始揭示这些相互作用,但它的局限性在于只能描述单个快照,从而省略了对高度动态再生过程至关重要的许多时间点17,18。随着时机的重要性和不同再生浪潮的出现越来越受到关注,必须更详细地剖析这些过程。
对于许多被诊断患有癌症的人来说,放射治疗是一种挽救生命的治疗方法。虽然放射治疗通常可有效缩小或消除肿瘤,但也会损害位于辐射场中的健康组织并引发免疫反应。辐射损伤可诱导快速巨噬细胞募集,以及直接和间接的免疫调节反应19,20。在头颈癌治疗期间,唾液腺经常被无意中照射21,22,导致上皮损伤、细胞萎缩和纤维化23,24,导致口干症或慢性口干25。
唾液腺由多种细胞类型和结构组成,包括但不限于上皮细胞(产唾液腺泡细胞和唾液转运导管细胞)、肌上皮细胞、上皮祖细胞、神经、血管、免疫细胞、成纤维细胞和细胞外基质 (ECM)。许多这些细胞类型在再生反应中的作用和反应先前已经描述过26,27,28,29,30。然而,这些不同的细胞在体内平衡和再生过程中如何相互作用,特别是巨噬细胞等免疫细胞的行为,研究得较少。这篇手稿描述了一种新建立的方法,用于研究 SMG 巨噬细胞与离体组织中其他感兴趣的细胞之间的活体相互作用。将SMG在振动切片机上切片,染色表面标记,并成像长达12小时。使用这种方法,可以观察到巨噬细胞对周围细胞的吞噬作用,可以研究巨噬细胞迁移动力学,并且可以证明巨噬细胞和上皮细胞之间的直接细胞间相互作用。
研究方案
所有程序均已获得英国内政部的批准,并在 PPL PB5FC9BD2 和 PP0330540 下执行。所有实验均符合ARRIVE指南和爱丁堡大学的指南。
野生型小鼠是商业获得的(见材料表)。Krt14CreER; 通过将 Krt14CreER/+ 小鼠31 与 R26mTmG/mTmG 小鼠32 杂交,在内部培育 R26mTmG 小鼠。在所有实验中,使用8-10周龄的雌性小鼠。
1. 收集和嵌入冲锋枪
- 通过将小鼠暴露于浓度升高的二氧化碳(CO2)中来对小鼠实施安乐死。之后,用70%乙醇(EtOH)喷洒切口区域,并使用剪刀和镊子仔细解剖周围组织的SMG(图1A)。使用镊子去除任何脂肪和结缔组织,并将腺体放入装有冰冷的汉克斯平衡盐溶液(HBSS,见 材料表)的收集管中。
- 使用镊子将腺体分成约1厘米2 的块。
- 将4%琼脂糖加热至50°C,然后将其直接倒入35mm培养皿中。
- 将少量熔化的50°C琼脂糖倒入单独的培养皿中,并通过在过量的琼脂糖中移动压盖来彻底冲洗压盖。
注意: 此步骤对于从腺体中去除多余的液体是必要的。过量的液体会阻止腺体正确粘附在琼脂糖上。 - 将4-6块腺体放入琼脂糖中,确保它们平放并在同一平面上(图1A)。
注意:确保压盖不接触琼脂表面或平板底部。 - 将盖子放在 35 毫米的盘子上,然后将其转移到冰箱中,用冰盖住盘子。
- 等待5-10分钟,使琼脂糖凝固。
2. 切片
- 使用手术刀小心地切开腺体嵌入的琼脂糖块,从培养皿中取出含有组织的块。留出大约 5 毫米的边框。
- 通过应用一滴强力胶将琼脂糖块连接到振动切片机的载物台(参见 材料表),确保块的整个底面与强力胶接触。
- 让强力胶硬化约 5 分钟。然后,用含有 1% 青霉素 - 链霉素 (P/S) 的冰冷 1x 磷酸盐缓冲盐水 (PBS) 填充振动切开室。
- 在振动切开室的侧面和底部都加冰。
注意: 保持非常寒冷的环境并根据需要更换冰块。 - 用手术刀切开切口,修剪掉多余的琼脂糖,并在每块腺体之间留出 5 毫米的间隙。这将生成单个切片。
- 将振动切片机刀片与琼脂糖块的表面对齐,并设置切片的起点和终点,以达到所需的切片厚度。
- 在开始切割过程之前,请确保刀片不与块接触。这种预防措施将防止意外切割大块琼脂糖并丢失部分样品。
- 在低速和高振动下切割厚度为 150 μm 的截面(例如,速度为 3,振动设置为 8-10,每个参数的刻度为 1-10)(图 1A)。
- 一旦切片被切割并释放到周围的 PBS 中,使用画笔收集切片并将它们放入装有预热的罗斯威尔公园纪念研究所 (RPMI) 培养基的培养皿中。
3. SMG切片的培养和染色
- 培养
- 向包含 0.4 μm 过滤器的 6 孔板的每个孔中加入 1.5 mL RPMI 培养基。确保过滤器下方没有气泡。
- 使用画笔将 1-6 片转移到每个过滤器上,注意不要破坏切片。
注意:确保切片没有淹没在介质中,而是漂浮在过滤器上。如果它们完全浸没,它们可能会在培养过程中窒息。 - 在37°C与5%CO2一起孵育,每3天更换一次培养基(图1A)。
- 使用市售辐照器用单剂量的 10 Gy 伽马射线照射实验板(参见 材料表)。之后,将它们放回培养箱。
- 用于实时成像的染色
- 使用画笔轻轻从过滤器中取出切片,并将它们放入每孔含有 500 μL 培养基的 24 孔板中,将切片浸没在那里。
- 将相关的偶联抗体和核染料(见 材料表)以适当的浓度27加入培养基中。
- 将切片与抗体在37°C温和搅拌下孵育2小时。
- 将切片浸没在培养基中,并在37°C下轻轻搅拌洗涤3轮10分钟。
4. 安装和实时成像
- 使用镊子,从双面成像垫片的一侧取下胶带,并将其粘合剂面朝下粘附在玻璃底 6 孔板的底部。
- 将 50 μL 培养基移液到垫片中心的间隙中。
- 使用画笔将切片放入介质中,确保其平放,没有任何气泡滞留。
- 使用移液管小心地从间隙中取出 20 μL 培养基。
- 使用镊子从垫片的顶部取下胶带,并在顶部放置一个 25 毫米的圆形盖玻片。按压垫片的边缘以确保盖玻片牢固附着,注意不要因施加太大的力而破坏盖玻片(图1A)。
- 在共聚焦显微镜上对切片进行所需的时间段或间隔成像(例如,使用20倍水物镜每15分钟持续12小时)。
结果
巨噬细胞对下颌下唾液腺损伤的反应仍然未知。这包括它们是否定位并迁移到腺体内的特定结构,以及它们迁移的距离和速度。这很难通过静态成像方法确定。
为了解决这个问题,已经开发了一种实时研究巨噬细胞-上皮细胞相互作用的实时成像方法。切片的免疫荧光染色与内源性标记的谱系追踪小鼠模型相结合(图1A 和 图2A)。在该模型中,将切片暴露于 10 Gy 的伽马辐照以诱导辐照损伤,并在辐照 (IR) 后 2 小时、3 天和 4 天成像,未辐照切片作为对照。数据从四个通道获取:Hoechst(使用激光 425 以最大限度地减少光毒性)、GFP (488)、dTomato (561) 和 Alexa 647 (640)。进行 z 堆栈,每 2-3 μm 捕获一次图像,总共收集 30 至 40 个平面,总高度为 80-90 μm。
使用这种技术并分析膜结合番茄 (mT) 信号和 Caspase3/7 活性,很明显,器官型切片保留了其上皮结构,在培养物中存活,并且表现出最小的细胞死亡。数据显示,来自R26mTmG小鼠32的下颌下腺的未辐照切片,培养7天,保留了其mT信号和上皮结构(图1B)。然而,在离体照射后 3 天,腺泡和导管细胞萎缩明显(图 1B;腺泡和导管结构分别由白色和绿色虚线突出显示),与体内辐射损伤一致13。在未辐照切片中细胞凋亡可以忽略不计,但有证据表明在辐照后4天辐照切片中存在半胱天冬酶3/7 +细胞(图1C;绿色箭头),类似于体内损伤33,34。此外,与未辐照对照组相比,辐照切片在体内重述了DNA 损伤 34、35、36、37,如 γH2AX38 升高所示(图 1D,E)。因此,器官型唾液腺切片在培养中表现出良好的活力,并且对照射的反应与体内组织相似。
在此之后,研究了实时细胞间相互作用。在 IR 后 3 天的 12 小时内观察到与 GFP 标记的上皮祖细胞 (Krt14CreER-GFP) 直接相互作用的巨噬细胞(图 2A 和 视频 1)。值得注意的是,很明显,巨噬细胞在上皮祖细胞附近保持数小时,通常在整个12小时的成像期间保持接触。此外,观察到巨噬细胞对上皮细胞的实时吞噬作用,证实了巨噬细胞在切片培养模型中发挥其传统功能(图2B, 视频2 和 视频3)。该技术还发现巨噬细胞在体内平衡和辐照损伤后都是相对静止的,这可能是因为它们在组织内的高密度。这首次证明,唾液腺巨噬细胞在体内平衡期间或辐照损伤后不会广泛迁移。然而,虽然巨噬细胞没有显示出明显的迁移,但周围组织在照射后表现出增加的动态,多个巨噬细胞在标记的上皮细胞簇周围积极相互作用。此外,仅基于核染色,该技术使我们能够可视化切片内的细胞随时间移动,通常整个导管似乎在组织内"迁移"(视频4)。随着时间的流逝,在培养过程中,切片从扁平形态转变为球状形态变得明显,这表明切片内的细胞运动可能是由于它们重新排列成球状结构,类似于潜在的重组事件。
最后,该测定产生的实时成像数据可用于定量测量细胞行为,例如迁移。可以检测和分割单个细胞(图3A),并且可以使用市售的成像和分析软件测量迁移(参见 材料表 和 视频5)。此外,可以进行最近的物体分析,以确定细胞(在这种情况下是巨噬细胞)是否迁移到更靠近其他感兴趣的细胞,在这种情况下, Krt14CreER-GFP +细胞,以及这种动态如何随时间变化(图3B)。

图 1:精密切割唾液腺组织切片中体内反应的概括。(A)实验方案示意图。(B) 从新鲜下颌下腺 (SMG) 组织、培养 7 天的未经处理的 SMG 切片或 3 天或 7 天前用单剂量 10 Gy 伽马辐照照射的 SMG 切片获得的膜结合番茄的代表性图像。白色虚线表示腺泡结构示例,绿色虚线表示导管结构示例。比例尺 = 50 μm。 (C) 从未经处理的 SMG 切片或 2 小时或 4 天前用单剂量 10 Gy γ 辐照照射的 SMG 切片获得的 Caspase-3/7 表达的代表性图像。绿色箭头表示正核。比例尺 = 50 μm。 (D) 从未经处理的 SMG 切片或 3 天前用单剂量 10 Gy γ 伽马辐照照射的 SMG 切片获得的 γH2AX 表达的代表性图像。比例尺 = 20 μm。 (E) γH2AX 在 EpCAM+ 上皮细胞中的代表性表达,来自未经操作的 SMG 切片或 2 小时和 3 天前用单剂量 10 Gy γ 照射照射的 SMG 切片。SSA = 侧散射面积。请点击这里查看此图的较大版本.
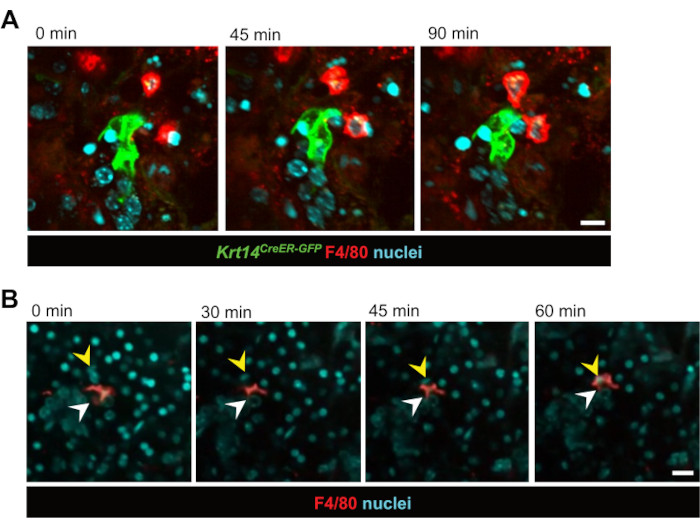
图2:巨噬细胞-上皮细胞相互作用和吞噬作用的实时成像。 (A) 照射后 KRT14+ 祖细胞与其后代(Krt14CreER-GFP+ 细胞)和巨噬细胞之间相互作用的连续静止图像。活细胞成像可在 90 分钟内捕获细胞动力学。比例尺 = 20 μm。关联的视频是 视频 1。(B)巨噬细胞吞噬上皮细胞的连续静止图像。活细胞成像显示 60 分钟内的过程。白色箭头指向巨噬细胞,黄色箭头表示正在经历吞噬作用的细胞核。比例尺 = 50 μm。关联的视频是 视频 2。 请点击这里查看此图的较大版本.
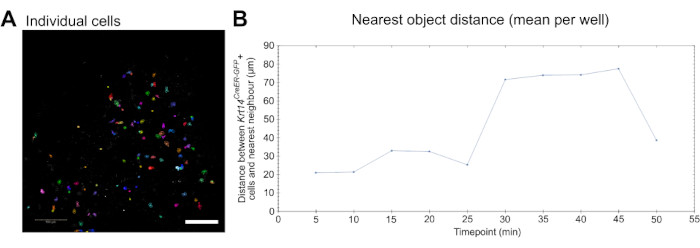
图 3:用于细胞动力学分析的实时成像。 (A) 用于分析细胞行为参数(如迁移)的单个细胞识别和分割的图像(见 视频 5)。细胞是随机伪着色的,用于区分单个细胞和轨迹。比例尺 = 100 μm。 (B) 在 10 个时间点上绘制的最近物体到单个 Krt14CreER-GFP+ 细胞的距离(以 μm 为单位)的量化(每 5 分钟捕获一次图像)。数据以每口井的平均值表示。 请点击这里查看此图的较大版本.
视频 1:实时成像揭示了照射后 KRT14+ 祖细胞/后代与巨噬细胞之间的动态相互作用。在活体成像之前,将切片暴露于单次 10 Gy γ 辐照剂量。 Krt14CreER-GFP+ 细胞以绿色表示,巨噬细胞 (F4/80+) 以红色表示,细胞核以青色表示。该视频由一个 z 堆栈组成,跨越 12 小时的培养期,每 15 分钟捕获一次图像。 请点击此处下载视频。
视频 2:实时成像捕获吞噬上皮细胞的巨噬细胞。巨噬细胞(F4/80+)用红色表示,细胞核用青色表示。该视频由一个 z 堆栈组成,跨越 12 小时的培养期,每 15 分钟拍摄一次图像。
视频 3:最大投影实时成像显示巨噬细胞吞噬上皮细胞。巨噬细胞(F4/80+)以红色显示,细胞核以青色显示。该视频的最大投影 z 堆栈图像总计 80 μm( 视频 2 中呈现单个平面),跨越 12 小时的培养期,每 15 分钟拍摄一次图像。
视频 4:实时成像说明了照射后唾液腺上皮在培养物中的动态行为。在实时成像之前,切片接受单次 10 Gy 伽马辐照剂量。巨噬细胞(F4/80+)以红色表示,细胞核以青色表示。该视频包括一个 z 堆栈,跨越 12 小时的培养期,每 15 分钟捕获一次图像。
视频 5:随时间推移的定量细胞迁移跟踪。该视频演示了从实时成像视频中对细胞轨迹进行单独示踪。箭头表示像元轨迹,像元单独为伪着色。该视频由一个 z 堆栈组成,跨越 1 小时的培养期,每 15 分钟拍摄一次图像。
讨论
离体培养唾液腺组织的能力为在稳态和损伤反应的背景下研究细胞间相互作用提供了极好的机会。尽管小鼠下颌下腺的活体成像是可行的39,40,但该技术依赖于使用荧光报告小鼠模型来内源性标记感兴趣的细胞,并且必须在终末麻醉下进行。在这里,描述了一种离体培养下颌下腺切片的方法,以维持细胞结构和细胞间相互作用。这种方法改进了当前的实时成像技术,并提供了活体成像的替代方案。
使用这种技术对组织进行长期维护依赖于在气液界面培养切片。以前的外植体模型26,41可能只成功培养了几天,因为它们被浸没在培养基中,基本上"窒息"了。相比之下,使用气液界面培养系统可以长时间保持组织健康和结构,确保高质量的成像。在成像前使用少量介质在空间受限的腔室内安装 SMG 切片以保持切片平整的方法,是该技术成功不可或缺的一部分。该测定中细胞的可视化取决于内源性标记的报告小鼠或荧光偶联抗体。大量针对特定细胞类型和亚群的转基因荧光报告小鼠模型和偶联抗体使该方法适用于探索各种细胞特异性相互作用。
虽然这种方法提供了组织原位和体外照射损伤导致腺泡和导管结构萎缩的良好模型,类似于体内发生的情况 13,但某些元素不能在体外概括。这些包括缺乏功能性脉管系统和神经元输入,以及缺乏浸润性炎症细胞。鉴于血管和神经在唾液腺稳态和再生中的作用26,42 以及迁移性免疫细胞43(如 T 细胞和 B 细胞)在唾液腺功能、损伤反应、感染和干燥综合征 (SS) 发病机制中的重要性(如44 所述),该测定可能会遗漏一些重要的细胞相互作用。此外,每 15 分钟成像一次可能会错过非常快速的迁移事件,例如自然杀伤 (NK) 细胞45 和树突状细胞 (DC)46 运动。然而,成像间隔可以优化以研究感兴趣的特定细胞间相互作用,并且通过 z 堆栈进行 3 维成像的能力允许评估 3D 细胞运动。在成像过程中牢固地安装组织对于定量至关重要,例如细胞跟踪测量。此外,尽管这项研究利用了小鼠组织,但该协议为研究人类唾液腺中的细胞间相互作用提供了一种可行的方法,产生了其他方法无法获得的有价值的翻译信息。
虽然组织驻留巨噬细胞在体内平衡和再生中的作用已在几种组织中得到证实 2,10,11,12,但它们在唾液腺中的作用在很大程度上仍未得到解答。尽管已知巨噬细胞对辐照损伤后的上皮再生至关重要13,但这种作用的确切机制仍然未知。唾液腺切片的实时成像能够实时可视化和分析复杂的组织动力学,而传统共聚焦成像通常会忽略这一点。此外,很明显,巨噬细胞在体内执行各种功能时会经历形状的动态变化 47,48,49,并且该方案可能比固定组织中的典型静态视图更好地表示这些变化。未来的研究可以利用这种技术来研究细胞间通讯在体内平衡、损伤和再生/消退过程中的变化。这种方法将有助于阐明最终可能提供治疗益处的关键信号通路和事件。
披露声明
作者没有需要披露的利益冲突。
致谢
SE 由 Wellcome Trust 赠款 108906/Z/15/Z 资助;EE 由 UKRI/MRC 赠款 MR/S005544/1 和爱丁堡大学的校长奖学金资助。图 1A 是用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 0.4 µm filter cell culture inserts (Nunc) | Avantor/VWR | 734-2240 | Inserts pre-packed in 6-well multidishes, 20 mm × 25 mm |
| 24 well plate | Corning | 3524 | |
| 35 mm dish | Falcon | 353001 | |
| 6 well plate | Corning | 3516 | |
| Coverslips | Paul Marienfeld GmbH & Co. KG | 111650 | Deckglaser Cover Glasses 25 mm diameter |
| Double-sided sticker | Grace Bio-Labs | 654004 | SecureSeal Imaging Spacers SS1 x 13, 13 mm diameter x 0.12 mm depth, 25 mm x 25mm OD |
| EtOH | Scientific Laboratories Supplies | CHE1924 | Absolute ethanol (EtOH) AR, 99.7% |
| F4/80 antibody | Invitrogen | 17-4801-82 | F4/80 Monoclonal Antibody (BM8), APC, eBioscience |
| Forceps | Fine Science Tools | 91113-10 | Student Fine Forceps Straight Broad Shanks |
| Glass bottom 6 well plate | Cellvis | P06-1.5H-N | 6 well glass bottom plate with high performance #1.5 cover glass |
| Hanks Balanced Salt Solution (HBSS) | Life Technologies | 14025050 | +calcium +magnesium, no phenol red |
| Hoechst | Sigma Aldrich | 14533 | Alternative name: bisBenzimide H 33342 trihydrochloride |
| Ice box | Fisher Scientific | 11339623 | Azlon Polyurethane Ice Buckets with Lid |
| Imaging and analysis software | Harmony | ||
| Low Melting Agarose | Merck | A9414-25G | |
| Paintbrush | Watercolour brush, 10 mm x 2mm tip | ||
| Penicillin-Streptomycin | Sigma Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered |
| Phosphate Buffered Saline (PBS) | Life Technologies | 20012027 | |
| RPMI | ThermoFisher | 12634010 | Gibco Advanced DMEM/F-12 |
| Scalpel | Swann-Morton | Disposable scalpels, No. 11 blade | |
| Scissors | Fine Science Tools | 14088-10 | Extra Narrow Scissors 10.5 cm |
| Shepherd Mark-I-68A 137Cs irradiator | JL Shepherd & Associates | ||
| Superglue | Bostik | Multi-purpose superglue, fast setting, ultra strong | |
| Vibratome | Leica | Leica VT 1000 S | |
| Vibratome blades | Astra | Superior Platinum Double Edge blade | |
| Wild-type (C57BL/BJ) mice | Charles River |
参考文献
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Lucas, T., et al. Differential roles of macrophages in diverse phases of skin repair. J Immunol. 184 (7), 3964-3977 (2010).
- Duffield, J. S., et al. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair. J Clin Invest. 115 (1), 56-65 (2005).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat Immunol. 17 (1), 34-40 (2016).
- Mass, E., Nimmerjahn, F., Kierdorf, K., Schlitzer, A. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nat Rev Immunol. 23 (9), 563-579 (2023).
- Dick, S. A., et al. Three tissue resident macrophage subsets coexist across organs with conserved origins and life cycles. Sci Immunol. 7 (67), (2022).
- Hassel, C., Gausserès, B., Guzylack-Piriou, L., Foucras, G. Ductal macrophages predominate in the immune landscape of the lactating mammary gland. Front Immunol. 12, 754661(2021).
- Kolter, J., et al. A subset of skin macrophages contributes to the surveillance and regeneration of local nerves. Immunity. 50 (6), 1482-1497 (2019).
- Dawson, C. A., et al. Tissue-resident ductal macrophages survey the mammary epithelium and facilitate tissue remodelling. Nat Cell Biol. 22 (5), 546-558 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- McKendrick, J. G., et al. CSF1R-dependent macrophages in the salivary gland are essential for epithelial regeneration after radiation-induced injury. Sci Immunol. 8 (89), doi:10.1126/sciimmunol.add4374 eadd4374(2023).
- Muntjewerff, E. M., Meesters, L. D., vanden Bogaart, G. Antigen cross-presentation by macrophages. Front Immunol. 11, 1276(2020).
- Bissonnette, E. Y., Lauzon-Joset, J. F., Debley, J. S., Ziegler, S. F. Cross-talk between alveolar macrophages and lung epithelial cells is essential to maintain lung homeostasis. Front Immunol. 11, 583042(2020).
- Xue, Q., et al. Analysis of single-cell cytokine secretion reveals a role for paracrine signaling in coordinating macrophage responses to TLR4 stimulation. Sci Signal. 8 (381), (2015).
- McArdle, S., Mikulski, Z., Ley, K. Live cell imaging to understand monocyte, macrophage, and dendritic cell function in atherosclerosis. J Exp Med. 213 (7), 1117-1131 (2016).
- Gurevich, D. B., et al. Live imaging of wound angiogenesis reveals macrophage orchestrated vessel sprouting and regression. Embo j. 37 (13), (2018).
- Meziani, L., et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages. Eur Respir J. 51 (3), (2018).
- Bickelhaupt, S., et al. Effects of CTGF blockade on attenuation and reversal of radiation-induced pulmonary fibrosis. J Natl Cancer Inst. 109 (8), (2017).
- Formenti, S. C., Demaria, S. Systemic effects of local radiotherapy. Lancet Oncol. 10 (7), 718-726 (2009).
- Chambers, M. S., Garden, A. S., Kies, M. S., Martin, J. W. Radiation-induced xerostomia in patients with head and neck cancer: pathogenesis, impact on quality of life, and management. Head Neck. 26 (9), 796-807 (2004).
- Radfar, L., Sirois, D. A. Structural and functional injury in minipig salivary glands following fractionated exposure to 70 Gy of ionizing radiation: an animal model for human radiation-induced salivary gland injury. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 96 (3), 267-274 (2003).
- Grehn, A. L., Gustafsson, H., Franzén, L., Thornell, L. E., Henriksson, R. Ultrastructural morphometry of parotid acinar cells following fractionated irradiation. Oral Oncol. 33 (1), 23-28 (1997).
- Rocchi, C., Emmerson, E. Mouth-watering results: clinical need, current approaches, and future directions for salivary gland regeneration. Trends Mol Med. 26 (7), 649-669 (2020).
- Emmerson, E., et al. Salivary glands regenerate after radiation injury through SOX2-mediated secretory cell replacement. EMBO Mol Med. 10 (3), 8051(2018).
- May, A. J., et al. Diverse progenitor cells preserve salivary gland ductal architecture after radiation-induced damage. Development. 145 (21), (2018).
- Knox, S. M., et al. Parasympathetic stimulation improves epithelial organ regeneration. Nat Commun. 4, 1494(2013).
- Mizrachi, A., et al. Radiation-induced microvascular injury as a mechanism of salivary gland hypofunction and potential target for radioprotectors. Radiat Res. 186 (2), 189-195 (2016).
- Friedrich, R. E., Bartel-Friedrich, S., Holzhausen, H. J., Lautenschläger, C. The effect of external fractionated irradiation on the distribution pattern of extracellular matrix proteins in submandibular salivary glands of the rat. J Craniomaxillofac Surg. 30 (4), 246-254 (2002).
- Vasioukhin, V., Degenstein, L., Wise, B., Fuchs, E. The magical touch: genome targeting in epidermal stem cells induced by tamoxifen application to mouse skin. Proc Natl Acad Sci U S A. 96 (15), 8551-8556 (1999).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Gilman, K. E., et al. P2X7 receptor deletion suppresses γ-radiation-induced hyposalivation. Am J Physiol Regul Integr Comp Physiol. 316 (5), R687-R696 (2019).
- Ren, J., et al. Radioprotective effects and mechanism of HL-003 on radiation-induced salivary gland damage in mice. Sci Rep. 12 (1), 8419(2022).
- Marmary, Y., et al. Radiation-induced loss of salivary gland function is driven by cellular senescence and prevented by IL6 modulation. Cancer Res. 76 (5), 1170-1180 (2016).
- Chang, S., et al. Inorganic nitrate alleviates total body irradiation-induced systemic damage by decreasing reactive oxygen species levels. Int J Radiat Oncol Biol Phys. 103 (4), 945-957 (2019).
- Varghese, J. J., et al. Localized delivery of amifostine enhances salivary gland radioprotection. J Dent Res. 97 (11), 1252-1259 (2018).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. gammaH2AX: a sensitive molecular marker of DNA damage and repair. Leukemia. 24 (4), 679-686 (2010).
- Takano, T., et al. Highly localized intracellular Ca(2+) signals promote optimal salivary gland fluid secretion. Elife. 10, (2021).
- Ficht, X., Thelen, F., Stolp, B., Stein, J. V. Preparation of murine submandibular salivary gland for upright intravital microscopy. J Vis Exp. 135, (2018).
- O'Dell, N. L., Sharawy, M. H., Schuster, G. S. Effects of in vivo single and multiple isoproterenol injections on subsequently explanted submandibular glands. Acta Anat (Basel. 105 (4), 431-438 (1979).
- Lombaert, I. M., et al. Cytokine treatment improves parenchymal and vascular damage of salivary glands after irradiation). Clin Cancer Res. 14 (23), 7741-7750 (2008).
- Stolp, B., et al. Salivary gland macrophages and tissue-resident CD8(+) T cells cooperate for homeostatic organ surveillance. Sci Immunol. 5 (46), 4371(2020).
- Verstappen, G. M., Pringle, S., Bootsma, H., Kroese, F. G. M. Epithelial-immune cell interplay in primary Sjögren syndrome salivary gland pathogenesis. Nat Rev Rheumatol. 17 (6), 333-348 (2021).
- Vanherberghen, B., et al. Microwell-based live cell imaging of NK cell dynamics to assess heterogeneity in motility and cytotoxic response. Methods Mol Biol. 1441, 87-106 (2016).
- de Winde, C. M., Munday, C., Acton, S. E. Molecular mechanisms of dendritic cell migration in immunity and cancer. Med Microbiol Immunol. 209 (4), 515-529 (2020).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Paterson, N., Lämmermann, T. Macrophage network dynamics depend on haptokinesis for optimal local surveillance. Elife. 11, (2022).
- Lim, K., et al. In situ neutrophil efferocytosis shapes T cell immunity to influenza infection. Nat Immunol. 21 (9), 1046-1057 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。