Method Article
חקירת אינטראקציות תאים-תאים בבלוטת הרוק באמצעות Ex Vivo Live Cell Imaging
In This Article
Summary
הדמיה אימונופלואורסצנטית מוגבלת על ידי היכולת לצפות בתהליכים ביולוגיים מורכבים ותלויי זמן בתמונת מצב אחת בלבד בזמן. מחקר זה מתאר גישת הדמיה חיה שנערכה על פרוסות בלוטות תת-לסתיות של עכברים שנחתכו בחיתוך מדויק. גישה זו מאפשרת תצפית בזמן אמת על אינטראקציות תא-תא במהלך הומאוסטזיס ותהליכי התחדשות ותיקון.
Abstract
התחדשות בלוטת הרוק היא תהליך מורכב הכולל אינטראקציות מורכבות בין סוגי תאים שונים. מחקרים אחרונים שפכו אור על התפקיד המרכזי שממלאים המקרופאגים בהנעת התגובה הרגנרטיבית. עם זאת, הבנתנו את התפקיד הקריטי הזה הסתמכה בעיקר על תצוגות סטטיות שהתקבלו מביופסיות רקמה קבועות. כדי להתגבר על מגבלה זו ולקבל תובנות לגבי אינטראקציות אלה בזמן אמת, מחקר זה מתאר פרוטוקול מקיף לטיפוח רקמת בלוטת הרוק ex vivo ולכידת תמונות חיות של נדידת תאים.
הפרוטוקול כולל מספר שלבים מרכזיים: ראשית, רקמת בלוטת הרוק התת-לסתית של העכבר נחתכת בזהירות באמצעות ויברטומה ולאחר מכן מתורבתת בממשק אוויר-נוזל. פרוסות אלה יכולות להיפגע בכוונה, למשל, באמצעות חשיפה לקרינה, כדי לגרום נזק לתאים ולעורר את התגובה הרגנרטיבית. כדי לעקוב אחר תאים ספציפיים בעלי עניין, הם יכולים להיות מסומנים אנדוגניים, למשל על ידי שימוש ברקמת בלוטת הרוק שנאספה מעכברים מהונדסים גנטית שבהם חלבון מסוים מסומן בחלבון פלואורסצנטי ירוק (GFP). לחלופין, ניתן להשתמש בנוגדנים מצומדים פלואורסצנטיים כדי להכתים תאים המבטאים סמנים ספציפיים של פני התא. לאחר ההכנה, פרוסות בלוטת הרוק עוברות הדמיה חיה באמצעות מערכת הדמיה קונפוקלית בעלת תוכן גבוה במשך 12 שעות, עם תמונות שצולמו במרווחים של 15 דקות. התמונות המתקבלות עוברות הידור ליצירת סרט, שלאחר מכן ניתן לנתח כדי לחלץ פרמטרים חשובים של התנהגות התא. שיטה חדשנית זו מספקת לחוקרים כלי רב עוצמה לחקור ולהבין טוב יותר אינטראקציות מקרופאגים בתוך בלוטת הרוק לאחר פציעה, ובכך מקדמת את הידע שלנו על תהליכי ההתחדשות הפועלים בהקשר ביולוגי דינמי זה.
Introduction
הוכח כי מקרופאגים ממלאים תפקידים חשובים יותר ויותר בתהליכי התחדשות ותיקון, מעבר לתפקוד החיסוני הקלאסי שלהם 1,2. ואכן, מקרופאגים מעורבים בשפע של תהליכים הקשורים להתחדשות, ומציגים פעילות רגולטורית קריטית בכל שלבי התיקון, כמו גם היווצרות צלקות ופיברוזיס 3,4. מקרופאגים שוכני רקמות הם סוגי תאים הטרוגניים מאוד עם מנגנונים מורכבים המניעים פנוטיפים תאיים מגוונים, והם ממלאים תפקידים חיוניים בהתפתחות איברים, תפקודם והומאוסטזיס (כפי שנסקרב-5). מקרופאגים שוכני רקמות נובעים בתחילה ממבשרי שק החלמון והכבד העוברי, ולאחר מכן הם מוחלפים על ידי התרבות או על ידי מונוציטים שמקורם במח עצם בשיעורים משתנים, בהתאם לתוחלת החיים של המקרופאגים הקיימים והרקמה או הגומחה שבתוכם הם שוכנים 6,7.
חשוב לציין, מקרופאגים שוכני רקמות מפוזרים בכל הרקמות ותורמים לתפקודי איברים מגוונים. הם מתוכנתים באופן ייחודי על ידי המיקרו-סביבה שלהם לבצע פונקציות ספציפיות לנישה ספציפית. מסיבה זו, לוקליזציה של מקרופאגים בתוך הרקמה מציעה תובנה לגבי תפקודם, עם אוכלוסיות ייחודיות שנצפו בריאה, בלוטת החלב, המעי, העור והשריר 8,9,10. במהלך התפתחות בלוטת החלב, מקרופאגים דוקטליים קשורים קשר הדוק לעץ הצינור, ודלדולם גורם לירידה משמעותית בהסתעפות11. יתר על כן, מקרופאגים נדרשים עבור מורפוגנזה במהלך ההתבגרות המינית alveologenesis בהריון, שם הם עוקבים באופן פעיל אחר האפיתל. בפציעת שרירים, אוכלוסייה מסוימת של מקרופאגים "שוכנת" בתוך אתר הפציעה, ומספקת נישה חולפת שבה הם מספקים רמזים הנגרמים על ידי התפשטות הדרושים לשגשוג תאי גזע. לפיכך, הם מציגים את התפקיד המיוחד של אוכלוסיות מקרופאגים מובחנות בניהול תהליך התיקון2. בריאה, תופעה דומה מתרחשת כאשר מקרופאגים אינטרסטיציאליים ראשוניים אינטרלוקין (IL)-R1-ביטוי נאדיות מסוג II (AT2) להמרה לאבות חולפים הקשורים לנזק באמצעות שחרור IL-1B12. יתר על כן, מחקרים אחרונים הראו כי מקרופאגים חיוניים להתחדשות בלוטת הרוק התת-לסתית של העכבר (SMG) לאחר פגיעה בקרינה, ובהיעדרם משתבשת התחדשות האפיתל13. יחד, נתונים אלה מדגישים את החשיבות של הפעלת מקרופאגים ותפקודם בגומחות דלקתיות חולפות לאחר פגיעה ברקמות, כמו גם במהלך הומאוסטזיס.
מקרופאגים הם תאים פעילים, ותפקידיהם כוללים אינטראקציות עם מגוון סוגי תאים שונים, כולל מגע ישיר בין תאלתא 14,15, כמו גם שיטות עקיפות יותר כגון הפרשת גורמים מסיסים 2,16, החיוניים לוויסות נישה. בעוד הדמיה אימונופלואורסצנטית קלאסית שימושית כדי להתחיל לפענח אינטראקציות אלה, היא מוגבלת על ידי תיאור תמונה אחת בלבד בזמן, ובכך משמיטה נקודות זמן רבות קריטיות לתהליך התחדשות דינמי ביותר17,18. ככל שחשיבות העיתוי והופעתם של גלים שונים של התחדשות מתחדדים, חיוני לנתח תהליכים אלה בפירוט רב יותר.
רדיותרפיה היא טיפול מציל חיים עבור אנשים רבים המאובחנים עם סרטן. בעוד שלעתים קרובות יעיל בכיווץ או חיסול הגידול(ים), הקרנות יכולות גם לפגוע ברקמות בריאות השוכבות בשדה הקרינה ולעורר תגובה חיסונית. פגיעה בקרינה יכולה לגרום לגיוס מקרופאגים מהיר, ולתגובות אימונומודולטוריות ישירות ועקיפות19,20. בלוטות הרוק לעיתים קרובות מוקרנות בשוגג במהלך הטיפול בסרטן הראש והצוואר21,22, מה שמוביל לנזק אפיתל, ניוון תאים ופיברוזיס23,24, וכתוצאה מכך קסרוסטומיה או יובש כרוני בפה25.
בלוטת הרוק מורכבת משפע של סוגי תאים ומבנים, כולל, אך לא רק, תאי אפיתל (הן תאים אצינאריים מייצרי רוק והן תאים צינוריים מובילי רוק), תאי מיואפיתל, תאי אב אפיתל, עצבים, כלי דם, תאי חיסון, פיברובלסטים ומטריצות חוץ-תאיות (ECM). התפקיד והתגובה של רבים מסוגי תאים אלה בתגובה הרגנרטיבית תוארו בעבר 26,27,28,29,30. עם זאת, האופן שבו התאים השונים האלה מתקשרים במהלך הומאוסטזיס והתחדשות, ובמיוחד כיצד תאים חיסוניים כמו מקרופאגים מתנהגים, נחקר פחות טוב. כתב יד זה מתאר שיטה חדשה לחקר האינטראקציות החיות בין מקרופאגים SMG ותאים אחרים בעלי עניין ברקמת ex vivo. ה-SMG נחתך על ויברטום, מוכתם לסמני פני השטח ומצולם במשך עד 12 שעות. באמצעות שיטה זו ניתן לצפות בפאגוציטוזה של התאים הסובבים על ידי מקרופאגים, לחקור קינטיקה של נדידת מקרופאגים, ולהדגים אינטראקציות ישירות בין תאים לתאים בין מקרופאגים לתאי אפיתל.
Protocol
כל ההליכים אושרו על ידי משרד הפנים הבריטי ובוצעו תחת PPLs PB5FC9BD2 ו-PP0330540. כל הניסויים מתאימים להנחיות ARRIVE ולאלה של אוניברסיטת אדינבורו.
עכברי בר הושגו באופן מסחרי (ראו טבלת חומרים). Krt14CreER; עכברי R26mTmG גודלו בבית, על ידי חציית עכבריKrt14 CreER/+ 31 עם עכברי R26mTmG/ mTmG 32. בכל הניסויים נעשה שימוש בנקבות עכברים בנות 8-10 שבועות.
1. איסוף והטמעת SMG
- הרדימו את העכבר/עכברים על ידי חשיפתם לריכוז עולה של פחמן דו חמצני (CO2). לאחר מכן, רססו את אזור החתך באתנול 70% (EtOH) והשתמשו במספריים ומלקחיים כדי לנתח בזהירות את ה-SMG(ים) מהרקמה שמסביב (איור 1A). הסר את כל השומן ורקמת החיבור באמצעות מלקחיים, והנח את הבלוטה בצינור איסוף המכיל תמיסת מלח מאוזנת של הנקס קרה כקרח (HBSS, ראה טבלת חומרים).
- מפרידים את הבלוטה לחתיכות בגודל של כ-1 ס"מ2 כל אחת באמצעות מלקחיים.
- מחממים 4% אגרוז ל 50 מעלות צלזיוס, ולאחר מכן יוצקים אותו ישירות לתוך צלחת 35 מ"מ.
- יוצקים כמות קטנה של אגרוז 50 מעלות צלזיוס מומס לתוך צלחת נפרדת ושוטפים היטב את הבלוטה על ידי הזזתה סביב האגרוז העודף.
הערה: שלב זה נחוץ כדי להסיר נוזלים עודפים מהבלוטות. עודף נוזלים יכול למנוע מהבלוטות להיצמד כראוי לאגרוז. - מקמו 4-6 חלקים של הבלוטה לתוך האגרוז, וודאו שהם שוכבים שטוחים ונמצאים באותו מישור (איור 1A).
הערה: ודא שהבלוטות אינן נוגעות בפני השטח של האגר או בתחתית הצלחת. - מניחים את המכסה על צלחת 35 מ"מ ומעבירים אותו לקופסת קרח, מכסים את הצלחת בקרח.
- חכו 5-10 דקות עד שהאגרוז יתמצק.
2. חלוקת חתכים
- השתמש באזמל כדי לחתוך בזהירות סביב גוש האגרוז המשובץ בבלוטה, והסר את הבלוק המכיל את הרקמה מהצלחת. השאר גבול של 5 מ"מ בקירוב.
- חברו את בלוק האגרוז לשלב הוויברטומה (ראו טבלת חומרים) על ידי מריחת טיפת דבק-על, וודאו שכל המשטח התחתון של הבלוק נמצא במגע עם דבק-העל.
- תנו לדבק-העל להתקשות במשך כ-5 דקות. לאחר מכן, מלאו את תא הוויברטום במי מלח חוצצים 1x פוספט קר כקרח (PBS) המכיל 1% פניצילין-סטרפטומיצין (P/S).
- הוסיפו קרח גם לצד וגם לחלק התחתון של תא הוויברטום.
הערה: שמרו על סביבה קרה מאוד והחליפו את הקרח לפי הצורך. - חתכו את עודפי האגרוז וצרו רווחים של 5 מ"מ בין כל פיסת בלוטה על ידי ביצוע חתכים עם אזמל. זה יניב פרוסות בודדות.
- יישרו את להב הוויברטומה עם פני גוש האגרוז וקבעו את נקודות ההתחלה והסיום של המקטעים כדי להשיג את עובי הפרוסה הרצוי.
- לפני תחילת תהליך החיתוך, ודא שהלהב אינו בא במגע עם הבלוק. אמצעי זהירות זה ימנע בטעות חיתוך חתיכות גדולות של אגרוז ואובדן חלקים מהדגימה.
- חתכו מקטעים בעובי של 150 מיקרומטר במהירות נמוכה ורטט גבוה (למשל, מהירות של 3 והגדרת רטט של 8-10 בסולם של 1-10 עבור כל פרמטר) (איור 1A).
- לאחר חיתוך קטע ושחרורו ל-PBS שמסביב, אספו את החלקים באמצעות מברשת צבע והניחו אותם בצלחת המכילה מדיה מחוממת מראש של מכון הזיכרון רוזוול פארק (RPMI) עם P/S.
3. גידול והכתמה של פרוסות SMG
- טיפוח
- הוסף 1.5 מ"ל של מדיה RPMI לכל באר של צלחת 6 בארות המכילה מסנן 0.4 מיקרומטר. ודאו שאין בועות אוויר כלואות מתחת לפילטר.
- מעבירים 1-6 פרוסות על כל פילטר בעזרת מברשת צבע, תוך הקפדה שלא לשבור את הפרוסות.
הערה: ודאו שהפרוסות אינן שקועות בחומרי הדפסה אלא צפות על המסנן. אם הם שקועים לחלוטין, הם עלולים להיחנק במהלך התרבות. - דגרו בטמפרטורה של 37°C עם 5% CO2, ושנו את המדיה כל 3 ימים (איור 1A).
- הקרינו צלחות ניסוי במנה אחת של קרינת גמא 10 Gy באמצעות מקרין זמין מסחרית (ראו טבלת חומרים). לאחר מכן, החזירו אותם לחממה.
- צביעה להדמיה חיה
- בעזרת מברשת צבע, הרימו בעדינות את הפרוסות מהפילטר והניחו אותן בצלחת בת 24 בארות המכילה 500 מיקרוליטר של מצע תרבית לכל באר, שם הפרוסות יהיו שקועות.
- הוסף את הנוגדנים המצומדים והכתם הגרעיני הרלוונטיים (ראה טבלת חומרים) למדיה בריכוזים המתאימים27.
- לדגור את הפרוסות עם נוגדנים במשך 2 שעות ב 37 ° C עם תסיסה עדינה.
- שטפו את הפרוסות על ידי טבילתן במצע תרבית ושטיפה במשך 3 סיבובים של 10 דקות כביסה בטמפרטורה של 37°C עם תסיסה עדינה.
4. הרכבה והדמיה חיה
- בעזרת מלקחיים, הסר את הסרט מצד אחד של ספייסר הדמיה דו-צדדי והצמיד אותו, בצד הדבק כלפי מטה, לתחתית צלחת בעלת תחתית זכוכית בעלת 6 בארות.
- פיפטה 50 μL של מדיה לתוך הרווח במרכז הספייסר.
- הניחו את הפרוסה במדיה באמצעות מברשת צבע, וודאו שהיא מונחת שטוחה ללא בועות אוויר כלואות.
- באמצעות פיפטה, בזהירות להסיר 20 μL של מדיה מן הפער.
- הסר את הסרט מהצד העליון של הספייסר באמצעות מלקחיים והנח עליו כיסוי עגול בקוטר 25 מ"מ. לחצו מסביב לקצה הספייסר כדי לוודא שהכיסוי מתחבר בחוזקה, והיזהרו שלא לשבור את הכיסוי על-ידי הפעלת כוח רב מדי (איור 1A).
- דמיינו את הפרוסה במיקרוסקופ קונפוקלי למשך פרק הזמן או מרווחי הזמן הרצויים (למשל, כל 15 דקות למשך 12 שעות באמצעות מטרת מים פי 20).
תוצאות
תגובת המקרופאגים לפגיעה בבלוטת הרוק התת-לסתית נותרה בלתי ידועה. זה כולל אם הם לוקליזציה ונודדים למבנים ספציפיים בתוך הבלוטה, כמו גם את המרחק והמהירות שבה הם נודדים. קשה לקבוע זאת באמצעות גישות הדמיה סטטית.
כדי להתמודד עם זה, פותחה גישת הדמיה חיה לחקר אינטראקציה בין תאי מקרופאג'-אפיתל בזמן אמת. צביעה אימונופלואורסצנטית של פרוסות שולבה עם מודל עכבר אנדוגני למעקב אחר שושלת (איור 1A ואיור 2A). במודל זה, פרוסות נחשפו לקרינת גמא של 10 Gy כדי לגרום לפגיעה בקרינה וצולמו תוך שעתיים, 3 ימים ו-4 ימים לאחר ההקרנה (IR), כאשר פרוסות שאינן מוקרנה משמשות כבקרות. הנתונים נרכשו מארבעה ערוצים: Hoechst (באמצעות לייזר 425 כדי למזער רעילות אור), GFP (488), dTomato (561) ו-Alexa 647 (640). בוצעה מחסנית z, ותמונה צולמה כל 2-3 מיקרומטר, עם סך של 30 עד 40 מטוסים שנאספו, וכתוצאה מכך הגובה הכולל של 80-90 מיקרומטר.
באמצעות טכניקה זו וניתוח אות עגבנייה (mT) הקשור לקרום ופעילות קספאז3/7, התברר כי פרוסות אורגנוטיפיות שמרו על מבנה האפיתל שלהן, שרדו בתרבית והציגו מוות תאי מינימלי. הנתונים הראו שפרוסות לא מוקרנות של הבלוטה התת-לסתית מעכברי R26mTmG 32, שגודלו בתרבית במשך 7 ימים, שמרו על אות mT וארכיטקטורת אפיתל (איור 1B). עם זאת, לאחר 3 ימים לאחר הקרנת ex vivo, ניכר ניוון תאים אצינאריים ודוקטליים (איור 1B; מבנים אציניים ודוקטליים מודגשים על-ידי קווים לבנים וירוקים מקווקוים, בהתאמה), בהתאם לפגיעה בקרינת in vivo 13. אפופטוזיס היה זניח בפרוסות שלא הוקרנו, אולם הייתה עדות לתאי קספז 3/7+ בפרוסות המוקרנות 4 ימים לאחר ההקרנה (איור 1C; חיצים ירוקים), בדומה לפגיעה in vivo 33,34. יתר על כן, פרוסות מוקרנות החזירו נזק לדנ"א vivo 34,35,36,37, כפי שמצוין על-ידי γH2AX38 גבוה בהשוואה לבקרות שלא הוקרנה (איור 1D,E). לפיכך, פרוסות בלוטות רוק אורגנוטיפיות הפגינו כדאיות טובה בתרבית והגיבו באופן דומה לרקמת in vivo לקרינה.
בעקבות זאת נחקרו אינטראקציות בין תאים בזמן אמת. מקרופאגים שמתקשרים ישירות עם תאי אב אפיתליאליים המסומנים בתווית GFP (Krt14,CreER-GFP) נצפו במשך פרק זמן של 12 שעות לאחר 3 ימים לאחר IR (איור 2A ווידאו 1). למרבה הפלא, ניכר היה כי מקרופאגים נשארו בסמיכות לתאי אב אפיתל במשך שעות, ולעתים קרובות נשארו בקשר במשך כל 12 שעות ההדמיה. יתר על כן, נצפתה פאגוציטוזה בזמן אמת של תאי אפיתל על-ידי מקרופאגים, שאישרה שהמקרופאגים מבצעים את תפקידם המסורתי במודל תרבית הפרוסה (איור 2B, סרטונים 2 ווידאו 3). טכניקה זו זיהתה גם כי המקרופאגים נייחים יחסית הן במהלך הומאוסטזיס והן לאחר פגיעה בקרינה, ככל הנראה בשל צפיפותם הגבוהה בתוך הרקמה. זה מראה, בפעם הראשונה, כי מקרופאגים של בלוטת הרוק אינם נודדים באופן נרחב במהלך הומאוסטזיס או לאחר פגיעה בקרינה. עם זאת, בעוד המקרופאגים לא הראו הגירה משמעותית, הרקמה שמסביב הראתה דינמיקה מוגברת לאחר הקרנה, עם מקרופאגים מרובים אינטראקציה פעילה סביב אשכולות של תאי אפיתל מסומנים. בנוסף, בהתבסס על צביעה גרעינית בלבד, טכניקה זו אפשרה לנו לדמיין את תנועת התא בתוך הפרוסה לאורך זמן, לעתים קרובות עם צינורות שלמים שנראה כי הם "נודדים" בתוך הרקמה (וידאו 4). עם הזמן במהלך תהליך הגידול, התברר כי פרוסות עברו ממורפולוגיה שטוחה למורפולוגיה דמוית ספרואיד, דבר המצביע על כך שתנועת התא בתוך הפרוסה נובעת ככל הנראה מסידור מחדש שלהם למבנה דמוי כדור, הדומה לאירוע ארגון מחדש פוטנציאלי.
לבסוף, ניתן להשתמש בנתוני ההדמיה החיה שנוצרו על-ידי בדיקה זו כדי למדוד באופן כמותי התנהגות תאים, כגון הגירה. תאים בודדים יכולים להיות מזוהים ומפולחים (איור 3A), ונדידה יכולה להימדד באמצעות תוכנת הדמיה וניתוח מסחרית זמינה (ראו טבלת חומרים ווידאו 5). יתר על כן, ניתוח העצמים הקרוב ביותר יכול להתבצע כדי לקבוע אם תאים, במקרה זה, מקרופאגים, נודדים קרוב יותר לתאים אחרים בעלי עניין, במקרה זה, תאי Krt14 CreER-GFP+, וכיצד דינמיקה זו משתנה עם הזמן (איור 3B).

איור 1: סיכום של תגובת in vivo בפרוסות רקמת בלוטת רוק חתוכות במדויק. (א) סכמה של פרוטוקול הניסוי. (B) תמונות מייצגות של עגבנייה קשורה לקרום שהתקבלו מרקמת בלוטה תת-לסתית טרייה (SMG), פרוסות SMG ללא מניפולציה שגודלו בתרבית במשך 7 ימים, או פרוסות SMG שהוקרנו במנה אחת של הקרנת גמא 10 Gy 3 או 7 ימים קודם לכן. קווים לבנים מקווקווים מציינים מבנים אצינאריים לדוגמה, וקווים ירוקים מקווקווים מציינים מבנים צינוריים לדוגמה. סרגל קנה מידה = 50 מיקרומטר. (C) תמונות מייצגות של ביטוי Caspase-3/7 המתקבלות מפרוסות SMG ללא מניפולציה או פרוסות SMG שהוקרנו במנה אחת של הקרנת גמא 10 Gy שעתיים או 4 ימים קודם לכן. ראשי חץ ירוקים מצביעים על גרעינים חיוביים. סרגל קנה מידה = 50 מיקרומטר. (D) תמונות מייצגות של ביטוי γH2AX שהתקבלו מפרוסות SMG לא מניפולטיביות או פרוסות SMG שהוקרנו במנה אחת של הקרנת גמא 10 Gy 3 ימים קודם לכן. סרגל קנה מידה = 20 מיקרומטר. (E) ביטוי מייצג של γH2AX בתאי אפיתל EpCAM+ מפרוסות SMG לא מניפולטיביות או פרוסות SMG שהוקרנו במנה אחת של הקרנת גמא 10 Gy שעתיים ושלושה ימים קודם לכן. SSA = אזור פיזור צד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
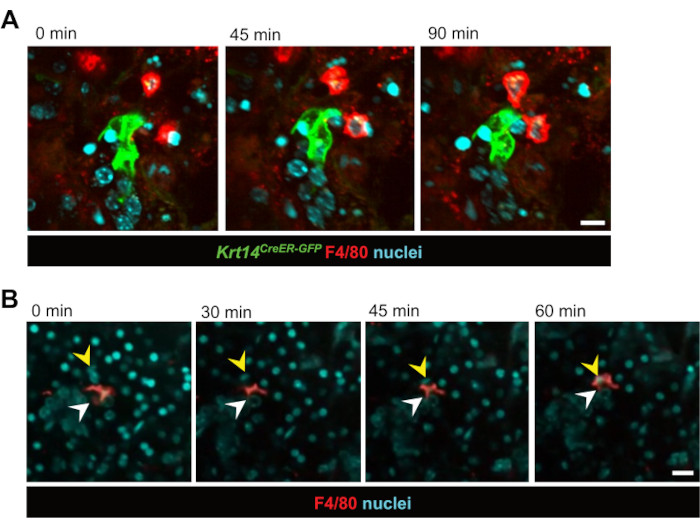
איור 2: הדמיה חיה של אינטראקציות בין תאי מקרופאג'-אפיתל ופאגוציטוזה. (A) תמונות סטילס רציפות של אינטראקציות בין תאי אב KRT14+ וצאצאיהם (תאיKrt14 CreER-GFP+) ומקרופאגים לאחר הקרנה. הדמיה חיה של תאים לוכדת דינמיקה תאית במשך 90 דקות. סרגל קנה מידה = 20 מיקרומטר. הווידאו המשויך הוא וידאו 1. (B) תמונות סטילס רציפות של מקרופאג שמבצע פאגוציטוזה של תא אפיתל. הדמיית תאים חיים מראה את התהליך על פני תקופה של 60 דקות. חיצים לבנים מצביעים על המקרופאגים, וחצים צהובים מצביעים על גרעין התא העובר פאגוציטוזה. סרגל קנה מידה = 50 מיקרומטר. הווידאו המשויך הוא וידאו 2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
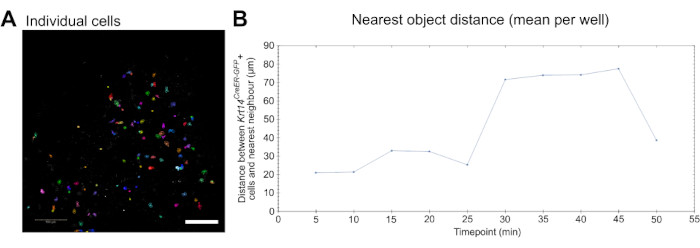
איור 3: הדמיה חיה לניתוח דינמיקה תאית. (A) תמונה הממחישה זיהוי וסגמנטציה של תאים בודדים לצורך ניתוח פרמטרים של התנהגות תאית, כגון הגירה (ראו סרטון 5). תאים הם פסאודו-צבעוניים באופן אקראי עבור תא בודד ומסלול הבחנה. סרגל קנה מידה = 100 מיקרומטר. (B) כימות המרחק (במיקרומטר) של האובייקט הקרוב ביותר לתאי Krt14 CreER-GFP+ בודדים ששורטטו על פני 10 נקודות זמן (תמונות שצולמו כל 5 דקות). הנתונים מוצגים כערך הממוצע לכל באר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
וידאו 1: הדמיה חיה החושפת אינטראקציות דינמיות בין תאי אב/צאצאים KRT14+ ומקרופאגים לאחר הקרנה. הפרוסות נחשפו למנת הקרנה אחת של 10 Gy gamma לפני הדמיה חיה. תאי Krt14CreER-GFP+ מיוצגים בירוק, מקרופאגים (F4/80+) באדום וגרעינים בציאן. הסרטון מורכב מערימת z אחת, המשתרעת על פני תקופת תרבות של 12 שעות עם תמונות שצולמו כל 15 דקות. אנא לחץ כאן להורדת הסרטון.
וידאו 2: הדמיה חיה לכידת מקרופאג הבולע תא אפיתל. מקרופאגים (F4/80+) מתוארים באדום, וגרעינים מוצגים בציאן. הסרטון מורכב מערימת z אחת ומתפרש על פני תקופת תרבות של 12 שעות עם תמונות שצולמו כל 15 דקות.אנא לחץ כאן להורדת הסרטון.
וידאו 3: הדמיה חיה של הקרנה מקסימלית המראה מקרופאג הבולע תא אפיתל. מקרופאגים (F4/80+) מוצגים באדום, וגרעינים מוצגים בציאן. הסרטון כולל הקרנה מקסימלית של תמונות z-stack בהיקף של 80 מיקרומטר (מישור יחיד מוצג בסרטון 2) ומתפרש על פני תקופת תרבות של 12 שעות עם תמונות שצולמו כל 15 דקות.אנא לחץ כאן להורדת הסרטון.
סרטון 4: הדמיה חיה הממחישה את ההתנהגות הדינמית של אפיתל בלוטת הרוק בתרבית לאחר הקרנה. פרוסות היו חשופות למנת הקרנה אחת של 10 Gy gamma לפני הדמיה חיה. מקרופאגים (F4/80+) מיוצגים באדום, גרעינים בציאן. הסרטון מורכב מערימת z אחת, המשתרעת על פני תקופת תרבות של 12 שעות עם תמונות שצולמו כל 15 דקות.אנא לחץ כאן להורדת הסרטון.
סרטון 5: מעקב כמותי אחר נדידת תאים לאורך זמן. סרטון זה מדגים את המעקב האינדיבידואלי אחר עקבות תאים מסרטוני הדמיה חיים. חצים מציינים עקבות תאים, ותאים צבועים בנפרד בפסאודו. הסרטון מורכב מערימת z אחת ומתפרש על פני תקופת תרבות של שעה עם תמונות שצולמו כל 15 דקות.אנא לחץ כאן להורדת הסרטון.
Discussion
היכולת לתרבית רקמת בלוטת הרוק ex vivo מהווה הזדמנות מצוינת לחקור אינטראקציות בין תאים בהקשר של הומאוסטזיס ותגובת פציעה. למרות הדמיה intravital של בלוטת submandibular העכבר הוא אפשרי39,40, טכניקה זו תלויה בשימוש מודלים עכבר כתב פלואורסצנטי כדי לתייג אנדוגנית תאים מעניינים חייב להתבצע תחת הרדמה סופנית. כאן מתוארת שיטה לתרבית פרוסות בלוטה תת-לסתית ex vivo, תוך שמירה על ארכיטקטורה תאית ואינטראקציות בין תאים. גישה זו מעדנת את טכניקות ההדמיה החיה הנוכחיות ומספקת חלופה לדימות תוך חיוני.
תחזוקה ארוכת טווח של רקמות באמצעות טכניקה זו מסתמכת על גידול פרוסות בממשק אוויר-נוזל. דגמי אקספלנט26,41 קודמים השיגו ככל הנראה תרבות מצליחה רק לימים ספורים מכיוון שהם היו שקועים במדיה ולמעשה "נחנקו". לעומת זאת, השימוש במערכת תרבית ממשק אוויר-נוזל שומר על בריאות ומבנה הרקמה לאורך זמן, ומבטיח הדמיה באיכות גבוהה. השיטה של הרכבת פרוסות SMG לפני ההדמיה, עם כמות קטנה של מדיה ובתוך תא מוגבל מקום כדי לשמור על הפרוסה שטוחה, היא חלק בלתי נפרד מהצלחת הטכניקה. הדמיה של תאים בבדיקה זו תלויה בעכברי כתב המסומנים אנדוגנית או נוגדנים מצומדים פלואורסצנטית. שפע המודלים של עכברי כתב פלואורסצנטי מהונדס ונוגדנים מצומדים המכוונים לסוגי תאים ותת-קבוצות ספציפיות הופכים שיטה זו למתאימה לחקר אינטראקציות ספציפיות שונות לתאים.
בעוד ששיטה זו מספקת מודל טוב של רקמה באתרה ופגיעה בקרינה ex vivo גורמת לאטרופיה של מבנה אצינר ודוקטלי, בדומה למה שקורה ב- vivo13, אלמנטים מסוימים אינם ניתנים לשחזור ex vivo. אלה כוללים את חוסר תפקוד כלי הדם ואת הקלט העצבי, כמו גם היעדר תאים דלקתיים מסתננים. בהתחשב בתפקיד המתועד היטב של כלי הדם והעצבים בהומאוסטזיס של בלוטת הרוק ובהתחדשות26,42 והחשיבות של תאי חיסון נודדים43, כגון תאי T ו- B, בתפקוד בלוטת הרוק, תגובת פציעה, זיהום ופתוגנזה של תסמונת סיוגרן (SS) (כפי שנסקר ב44), בדיקה זו עלולה להחמיץ כמה אינטראקציות תאיות חשובות. בנוסף, אירועי נדידה מהירים מאוד, כגון תא הרג טבעי (NK)45 ותנועת תאים דנדריטיים (DC)46, עלולים להחמיץ על ידי הדמיה כל 15 דקות. עם זאת, ניתן למטב מרווחי הדמיה כדי לחקור את האינטראקציות הספציפיות בין תאים לתאים, והיכולת לצלם בשלושה ממדים באמצעות ערימות z מאפשרת הערכה של תנועת תאים תלת-ממדית. הרכבה מאובטחת של הרקמה במהלך ההדמיה חיונית לכימות, כגון מדידות מעקב אחר תאים. יתר על כן, למרות שמחקר זה השתמש ברקמת עכבר, הפרוטוקול מספק שיטה בת קיימא לחקר אינטראקציות תאים-תאים בבלוטות רוק אנושיות, ומייצר מידע תרגומי רב ערך שלא ניתן להשיג בשיטות אחרות.
בעוד שתפקידם של מקרופאגים שוכנים ברקמה בהומאוסטזיס ובהתחדשות הודגם במספר רקמות 2,10,11,12, תפקידם בבלוטות הרוק נותר במידה רבה ללא מענה. למרות שידוע כי מקרופאגים חיוניים להתחדשות אפיתל לאחר פגיעה בקרינה13, המנגנונים המדויקים העומדים בבסיס השפעה זו עדיין אינם ידועים. הדמיה חיה של פרוסות בלוטת הרוק מאפשרת הדמיה וניתוח בזמן אמת של דינמיקת רקמות מורכבת, אשר לעיתים קרובות מתפספסות על ידי הדמיה קונפוקלית מסורתית. בנוסף, ניכר כי מקרופאגים עוברים שינויים דינמיים בצורתם בעת ביצוע תפקודים שונים in vivo 47,48,49, ופרוטוקול זה מספק ככל הנראה ייצוג טוב יותר של שינויים אלה מאשר תצוגה סטטית טיפוסית ברקמה קבועה. מחקרים עתידיים יכולים להשתמש בטכניקה זו כדי לחקור כיצד תקשורת תא-תא משתנה במהלך הומאוסטזיס, פציעה והתחדשות/פתרון. גישה זו תהיה שימושית להבהרת מסלולי איתות מרכזיים ואירועים שעשויים בסופו של דבר להציע יתרונות טיפוליים.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
SE ממומנת על ידי מענק Wellcome Trust 108906/Z/15/Z; EE ממומן על ידי UKRI/MRC grant MR/S005544/1 ועל ידי מלגת קנצלר מאוניברסיטת אדינבורו. איור 1A נוצר באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 0.4 µm filter cell culture inserts (Nunc) | Avantor/VWR | 734-2240 | Inserts pre-packed in 6-well multidishes, 20 mm × 25 mm |
| 24 well plate | Corning | 3524 | |
| 35 mm dish | Falcon | 353001 | |
| 6 well plate | Corning | 3516 | |
| Coverslips | Paul Marienfeld GmbH & Co. KG | 111650 | Deckglaser Cover Glasses 25 mm diameter |
| Double-sided sticker | Grace Bio-Labs | 654004 | SecureSeal Imaging Spacers SS1 x 13, 13 mm diameter x 0.12 mm depth, 25 mm x 25mm OD |
| EtOH | Scientific Laboratories Supplies | CHE1924 | Absolute ethanol (EtOH) AR, 99.7% |
| F4/80 antibody | Invitrogen | 17-4801-82 | F4/80 Monoclonal Antibody (BM8), APC, eBioscience |
| Forceps | Fine Science Tools | 91113-10 | Student Fine Forceps Straight Broad Shanks |
| Glass bottom 6 well plate | Cellvis | P06-1.5H-N | 6 well glass bottom plate with high performance #1.5 cover glass |
| Hanks Balanced Salt Solution (HBSS) | Life Technologies | 14025050 | +calcium +magnesium, no phenol red |
| Hoechst | Sigma Aldrich | 14533 | Alternative name: bisBenzimide H 33342 trihydrochloride |
| Ice box | Fisher Scientific | 11339623 | Azlon Polyurethane Ice Buckets with Lid |
| Imaging and analysis software | Harmony | ||
| Low Melting Agarose | Merck | A9414-25G | |
| Paintbrush | Watercolour brush, 10 mm x 2mm tip | ||
| Penicillin-Streptomycin | Sigma Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered |
| Phosphate Buffered Saline (PBS) | Life Technologies | 20012027 | |
| RPMI | ThermoFisher | 12634010 | Gibco Advanced DMEM/F-12 |
| Scalpel | Swann-Morton | Disposable scalpels, No. 11 blade | |
| Scissors | Fine Science Tools | 14088-10 | Extra Narrow Scissors 10.5 cm |
| Shepherd Mark-I-68A 137Cs irradiator | JL Shepherd & Associates | ||
| Superglue | Bostik | Multi-purpose superglue, fast setting, ultra strong | |
| Vibratome | Leica | Leica VT 1000 S | |
| Vibratome blades | Astra | Superior Platinum Double Edge blade | |
| Wild-type (C57BL/BJ) mice | Charles River |
References
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Lucas, T., et al. Differential roles of macrophages in diverse phases of skin repair. J Immunol. 184 (7), 3964-3977 (2010).
- Duffield, J. S., et al. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair. J Clin Invest. 115 (1), 56-65 (2005).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat Immunol. 17 (1), 34-40 (2016).
- Mass, E., Nimmerjahn, F., Kierdorf, K., Schlitzer, A. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nat Rev Immunol. 23 (9), 563-579 (2023).
- Dick, S. A., et al. Three tissue resident macrophage subsets coexist across organs with conserved origins and life cycles. Sci Immunol. 7 (67), (2022).
- Hassel, C., Gausserès, B., Guzylack-Piriou, L., Foucras, G. Ductal macrophages predominate in the immune landscape of the lactating mammary gland. Front Immunol. 12, 754661(2021).
- Kolter, J., et al. A subset of skin macrophages contributes to the surveillance and regeneration of local nerves. Immunity. 50 (6), 1482-1497 (2019).
- Dawson, C. A., et al. Tissue-resident ductal macrophages survey the mammary epithelium and facilitate tissue remodelling. Nat Cell Biol. 22 (5), 546-558 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- McKendrick, J. G., et al. CSF1R-dependent macrophages in the salivary gland are essential for epithelial regeneration after radiation-induced injury. Sci Immunol. 8 (89), doi:10.1126/sciimmunol.add4374 eadd4374(2023).
- Muntjewerff, E. M., Meesters, L. D., vanden Bogaart, G. Antigen cross-presentation by macrophages. Front Immunol. 11, 1276(2020).
- Bissonnette, E. Y., Lauzon-Joset, J. F., Debley, J. S., Ziegler, S. F. Cross-talk between alveolar macrophages and lung epithelial cells is essential to maintain lung homeostasis. Front Immunol. 11, 583042(2020).
- Xue, Q., et al. Analysis of single-cell cytokine secretion reveals a role for paracrine signaling in coordinating macrophage responses to TLR4 stimulation. Sci Signal. 8 (381), (2015).
- McArdle, S., Mikulski, Z., Ley, K. Live cell imaging to understand monocyte, macrophage, and dendritic cell function in atherosclerosis. J Exp Med. 213 (7), 1117-1131 (2016).
- Gurevich, D. B., et al. Live imaging of wound angiogenesis reveals macrophage orchestrated vessel sprouting and regression. Embo j. 37 (13), (2018).
- Meziani, L., et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages. Eur Respir J. 51 (3), (2018).
- Bickelhaupt, S., et al. Effects of CTGF blockade on attenuation and reversal of radiation-induced pulmonary fibrosis. J Natl Cancer Inst. 109 (8), (2017).
- Formenti, S. C., Demaria, S. Systemic effects of local radiotherapy. Lancet Oncol. 10 (7), 718-726 (2009).
- Chambers, M. S., Garden, A. S., Kies, M. S., Martin, J. W. Radiation-induced xerostomia in patients with head and neck cancer: pathogenesis, impact on quality of life, and management. Head Neck. 26 (9), 796-807 (2004).
- Radfar, L., Sirois, D. A. Structural and functional injury in minipig salivary glands following fractionated exposure to 70 Gy of ionizing radiation: an animal model for human radiation-induced salivary gland injury. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 96 (3), 267-274 (2003).
- Grehn, A. L., Gustafsson, H., Franzén, L., Thornell, L. E., Henriksson, R. Ultrastructural morphometry of parotid acinar cells following fractionated irradiation. Oral Oncol. 33 (1), 23-28 (1997).
- Rocchi, C., Emmerson, E. Mouth-watering results: clinical need, current approaches, and future directions for salivary gland regeneration. Trends Mol Med. 26 (7), 649-669 (2020).
- Emmerson, E., et al. Salivary glands regenerate after radiation injury through SOX2-mediated secretory cell replacement. EMBO Mol Med. 10 (3), 8051(2018).
- May, A. J., et al. Diverse progenitor cells preserve salivary gland ductal architecture after radiation-induced damage. Development. 145 (21), (2018).
- Knox, S. M., et al. Parasympathetic stimulation improves epithelial organ regeneration. Nat Commun. 4, 1494(2013).
- Mizrachi, A., et al. Radiation-induced microvascular injury as a mechanism of salivary gland hypofunction and potential target for radioprotectors. Radiat Res. 186 (2), 189-195 (2016).
- Friedrich, R. E., Bartel-Friedrich, S., Holzhausen, H. J., Lautenschläger, C. The effect of external fractionated irradiation on the distribution pattern of extracellular matrix proteins in submandibular salivary glands of the rat. J Craniomaxillofac Surg. 30 (4), 246-254 (2002).
- Vasioukhin, V., Degenstein, L., Wise, B., Fuchs, E. The magical touch: genome targeting in epidermal stem cells induced by tamoxifen application to mouse skin. Proc Natl Acad Sci U S A. 96 (15), 8551-8556 (1999).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Gilman, K. E., et al. P2X7 receptor deletion suppresses γ-radiation-induced hyposalivation. Am J Physiol Regul Integr Comp Physiol. 316 (5), R687-R696 (2019).
- Ren, J., et al. Radioprotective effects and mechanism of HL-003 on radiation-induced salivary gland damage in mice. Sci Rep. 12 (1), 8419(2022).
- Marmary, Y., et al. Radiation-induced loss of salivary gland function is driven by cellular senescence and prevented by IL6 modulation. Cancer Res. 76 (5), 1170-1180 (2016).
- Chang, S., et al. Inorganic nitrate alleviates total body irradiation-induced systemic damage by decreasing reactive oxygen species levels. Int J Radiat Oncol Biol Phys. 103 (4), 945-957 (2019).
- Varghese, J. J., et al. Localized delivery of amifostine enhances salivary gland radioprotection. J Dent Res. 97 (11), 1252-1259 (2018).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. gammaH2AX: a sensitive molecular marker of DNA damage and repair. Leukemia. 24 (4), 679-686 (2010).
- Takano, T., et al. Highly localized intracellular Ca(2+) signals promote optimal salivary gland fluid secretion. Elife. 10, (2021).
- Ficht, X., Thelen, F., Stolp, B., Stein, J. V. Preparation of murine submandibular salivary gland for upright intravital microscopy. J Vis Exp. 135, (2018).
- O'Dell, N. L., Sharawy, M. H., Schuster, G. S. Effects of in vivo single and multiple isoproterenol injections on subsequently explanted submandibular glands. Acta Anat (Basel. 105 (4), 431-438 (1979).
- Lombaert, I. M., et al. Cytokine treatment improves parenchymal and vascular damage of salivary glands after irradiation). Clin Cancer Res. 14 (23), 7741-7750 (2008).
- Stolp, B., et al. Salivary gland macrophages and tissue-resident CD8(+) T cells cooperate for homeostatic organ surveillance. Sci Immunol. 5 (46), 4371(2020).
- Verstappen, G. M., Pringle, S., Bootsma, H., Kroese, F. G. M. Epithelial-immune cell interplay in primary Sjögren syndrome salivary gland pathogenesis. Nat Rev Rheumatol. 17 (6), 333-348 (2021).
- Vanherberghen, B., et al. Microwell-based live cell imaging of NK cell dynamics to assess heterogeneity in motility and cytotoxic response. Methods Mol Biol. 1441, 87-106 (2016).
- de Winde, C. M., Munday, C., Acton, S. E. Molecular mechanisms of dendritic cell migration in immunity and cancer. Med Microbiol Immunol. 209 (4), 515-529 (2020).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Paterson, N., Lämmermann, T. Macrophage network dynamics depend on haptokinesis for optimal local surveillance. Elife. 11, (2022).
- Lim, K., et al. In situ neutrophil efferocytosis shapes T cell immunity to influenza infection. Nat Immunol. 21 (9), 1046-1057 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved