Method Article
Interrogación de las interacciones célula-célula en la glándula salival a través de imágenes de células vivas ex vivo
En este artículo
Resumen
Las imágenes inmunofluorescentes están limitadas por la capacidad de observar procesos biológicos complejos y dependientes del tiempo en una sola instantánea en el tiempo. Este estudio describe un enfoque de imágenes en vivo realizado en cortes de glándula submandibular de ratón cortados con precisión. Este enfoque permite la observación en tiempo real de las interacciones célula-célula durante la homeostasis y los procesos de regeneración y reparación.
Resumen
La regeneración de las glándulas salivales es un proceso complejo que implica intrincadas interacciones entre varios tipos de células. Estudios recientes han arrojado luz sobre el papel fundamental que desempeñan los macrófagos en la conducción de la respuesta regenerativa. Sin embargo, nuestra comprensión de este papel crítico se ha basado principalmente en vistas estáticas obtenidas de biopsias de tejido fijo. Para superar esta limitación y obtener información sobre estas interacciones en tiempo real, este estudio describe un protocolo integral para cultivar tejido de glándulas salivales ex vivo y capturar imágenes en vivo de la migración celular.
El protocolo consta de varios pasos clave: en primer lugar, el tejido de la glándula salival submandibular de ratón se corta cuidadosamente con un vibrátomo y luego se cultiva en una interfaz aire-líquido. Estos cortes pueden lesionarse intencionalmente, por ejemplo, a través de la exposición a la radiación, para inducir daño celular y desencadenar la respuesta regenerativa. Para rastrear células específicas de interés, se pueden marcar endógenamente, por ejemplo, utilizando tejido de glándulas salivales recolectado de ratones modificados genéticamente, donde una proteína en particular está marcada con proteína fluorescente verde (GFP). Alternativamente, los anticuerpos conjugados con fluorescencia se pueden emplear para teñir células que expresan marcadores específicos de la superficie celular de interés. Una vez preparadas, los cortes de glándulas salivales se someten a imágenes en vivo utilizando un sistema de imágenes confocales de alto contenido durante una duración de 12 h, con imágenes capturadas a intervalos de 15 minutos. Las imágenes resultantes se compilan para crear una película, que posteriormente se puede analizar para extraer valiosos parámetros de comportamiento de la celda. Este método innovador proporciona a los investigadores una poderosa herramienta para investigar y comprender mejor las interacciones de los macrófagos dentro de la glándula salival después de una lesión, avanzando así en nuestro conocimiento de los procesos regenerativos en juego en este contexto biológico dinámico.
Introducción
Se ha demostrado que los macrófagos desempeñan un papel cada vez más importante en los procesos de regeneración y reparación, que van más allá de su función inmunitaria clásica 1,2. De hecho, los macrófagos están involucrados en una gran cantidad de procesos relacionados con la regeneración, exhibiendo una actividad reguladora crítica en todas las etapas de reparación, así como en la formación de cicatrices y fibrosis 3,4. Los macrófagos residentes en los tejidos son tipos de células muy heterogéneos con mecanismos complejos que impulsan diversos fenotipos celulares, y desempeñan un papel esencial en el desarrollo, la función y la homeostasis de los órganos (como se revisa en5). Los macrófagos residentes en los tejidos surgen inicialmente de precursores en el saco vitelino y en el hígado fetal, y posteriormente son reemplazados por la proliferación o por monocitos sanguíneos derivados de la médula ósea a ritmos variables, dependiendo de la longevidad de los macrófagos existentes y del tejido o nicho en el que residen 6,7.
Es importante destacar que los macrófagos residentes en los tejidos están dispersos por todos los tejidos y contribuyen a diversas funciones de los órganos. Están programados de forma única por su microentorno para realizar funciones específicas de nicho. Por esta razón, la localización de los macrófagos dentro del tejido ofrece información sobre su función, con poblaciones únicas observadas en el pulmón, la glándula mamaria, el intestino, la piel y el músculo 8,9,10. Durante el desarrollo de la glándula mamaria, los macrófagos ductales están íntimamente asociados con el árbol ductal, y su depleción da como resultado una reducción significativa de la ramificación11. Además, los macrófagos son necesarios para la morfogénesis durante la pubertad y la alveologénesis en el embarazo, donde controlan activamente el epitelio. En la lesión muscular, una población específica de macrófagos "habita" dentro del sitio de la lesión, proporcionando un nicho transitorio en el que suministran las señales inducidas por la proliferación necesarias para la proliferación de células madre. Por lo tanto, exhiben el papel especializado de distintas poblaciones de macrófagos en el gobierno del proceso de reparación2. En el pulmón, ocurre un fenómeno similar cuando los macrófagos intersticiales preparan a las células alveolares de tipo II (AT2) que expresan interleucina (IL)-R1 para convertirlas en progenitores transitorios asociados al daño a través de la liberación de IL-1B12. Además, investigaciones recientes han demostrado que los macrófagos son esenciales para la regeneración de la glándula salival submandibular (SMG) del ratón después de una lesión por irradiación y, en su ausencia, la regeneración epitelial se interrumpe13. En conjunto, estos datos destacan la importancia de la activación y función de los macrófagos en los nichos inflamatorios transitorios después de una lesión tisular, así como durante la homeostasis.
Los macrófagos son células activas, y sus funciones implican interacciones con una variedad de diferentes tipos celulares, incluyendo el contacto directo célula-célula14,15, así como métodos más indirectos como la secreción de factores solubles 2,16, que son esenciales para la regulación del nicho. Si bien las imágenes inmunofluorescentes clásicas son útiles para comenzar a desentrañar estas interacciones, están limitadas por representar solo una instantánea en el tiempo, omitiendo así numerosos puntos de tiempo críticos para un proceso regenerativo altamente dinámico17,18. A medida que la importancia del tiempo y la aparición de diferentes olas de regeneración se vuelven más nítidas, es esencial diseccionar estos procesos con mayor detalle.
La radioterapia es un tratamiento que salva la vida de muchas personas diagnosticadas con cáncer. Aunque a menudo es eficaz para reducir o eliminar los tumores, la radioterapia también puede dañar los tejidos sanos que se encuentran en el campo de radiación y provocar una respuesta inmunitaria. La lesión por radiación puede inducir un rápido reclutamiento de macrófagos y respuestas inmunomoduladoras directas e indirectas19,20. Las glándulas salivales a menudo se irradian inadvertidamente durante el tratamiento del cáncer de cabeza y cuello21,22, lo que conduce a daño epitelial, atrofia celular y fibrosis23,24, lo que resulta en xerostomía o sequedad bucal crónica25.
La glándula salival está compuesta por una gran cantidad de tipos de células y estructuras, que incluyen, entre otras, células epiteliales (tanto células acinares productoras de saliva como células ductales transportadoras de saliva), células mioepiteliales, células progenitoras epiteliales, nervios, vasos sanguíneos, células inmunitarias, fibroblastos y matriz extracelular (MEC). El papel y la respuesta de muchos de estos tipos celulares en la respuesta regenerativa han sido descritos previamente 26,27,28,29,30. Sin embargo, la forma en que estas diferentes células interactúan durante la homeostasis y la regeneración, y en particular cómo se comportan las células inmunitarias como los macrófagos, está menos estudiada. Este manuscrito describe un método recientemente establecido para estudiar las interacciones vivas entre los macrófagos SMG y otras células de interés en tejidos ex vivo. El subfusil se corta en un vibrátomo, se tiñe para obtener marcadores de superficie y se obtienen imágenes durante un máximo de 12 horas. Con este método, se puede observar la fagocitosis de las células circundantes por parte de los macrófagos, se puede estudiar la cinética de migración de los macrófagos y se pueden demostrar las interacciones directas célula-célula entre los macrófagos y las células epiteliales.
Protocolo
Todos los procedimientos fueron aprobados por el Ministerio del Interior del Reino Unido y se realizaron bajo los PPL PB5FC9BD2 y PP0330540. Todos los experimentos se alinean con las directrices de ARRIVE y las de la Universidad de Edimburgo.
Los ratones de tipo salvaje se obtuvieron comercialmente (ver Tabla de Materiales). Krt14CreER; Los ratones R26mTmG se criaron en casa, cruzando ratones Krt14CreER/+ 31 con ratones R26mTmG/mTmG 32. En todos los experimentos, se utilizaron ratones hembra de 8 a 10 semanas de edad.
1. Recolección e integración del subfusil
- Aplicar la eutanasia a los ratones exponiéndolos a una concentración creciente de dióxido de carbono (CO2). Después, rocíe el área de la incisión con etanol al 70 % (EtOH) y use tijeras y fórceps para diseccionar cuidadosamente los SMG del tejido circundante (Figura 1A). Retire la grasa y el tejido conectivo con pinzas y coloque la glándula en un tubo de recolección que contenga una solución salina equilibrada de Hanks (HBSS, por sus siglas en inglés) helada, consulte la Tabla de materiales.
- Separe la glándula en trozos de aproximadamente 1 cm2 cada uno con pinzas.
- Calentar agarosa al 4% a 50 °C y verterla directamente en un plato de 35 mm.
- Vierta una pequeña cantidad de agarosa derretida a 50 °C en un plato aparte y enjuague bien la glándula moviéndola en el exceso de agarosa.
NOTA: Este paso es necesario para eliminar el exceso de líquido de las glándulas. Un exceso de líquidos puede impedir que las glándulas se adhieran correctamente a la agarosa. - Coloque de 4 a 6 piezas de la glándula en la agarosa, asegurándose de que queden planas y estén en el mismo plano (Figura 1A).
NOTA: Asegúrese de que las glándulas no toquen la superficie del agar ni el fondo de la placa. - Coloque la tapa en el plato de 35 mm y transfiéralo a una nevera, cubriendo el plato con hielo.
- Espere de 5 a 10 minutos para que la agarosa se solidifique.
2. Seccionamiento
- Use un bisturí para cortar con cuidado alrededor del bloque de agarosa incrustado en la glándula, retirando el bloque que contiene el pañuelo del plato. Deje un borde de aproximadamente 5 mm.
- Fije el bloque de agarosa a la etapa del vibratomo (ver Tabla de materiales) aplicando una gota de superpegamento, asegurándose de que toda la superficie inferior del bloque esté en contacto con el superpegamento.
- Deja que el superpegamento se endurezca durante aproximadamente 5 minutos. A continuación, llene la cámara del vibrátomo con solución salina tamponada con fosfato (PBS) helada que contenga un 1% de penicilina-estreptomicina (P/S).
- Agregue hielo tanto en el costado como en la parte inferior de la cámara del vibráto.
NOTA: Mantenga un ambiente muy frío y reemplace el hielo según sea necesario. - Recorta el exceso de agarosa y crea espacios de 5 mm entre cada trozo de glándula haciendo incisiones con un bisturí. Esto producirá rebanadas individuales.
- Alinee la cuchilla del vibrátomo con la cara del bloque de agarosa y establezca los puntos inicial y final de las secciones para lograr el grosor de rebanada deseado.
- Antes de comenzar el proceso de corte, asegúrese de que la cuchilla no esté en contacto con el bloque. Esta precaución evitará cortar accidentalmente trozos grandes de agarosa y perder partes de la muestra.
- Corte secciones con un espesor de 150 μm a baja velocidad y alta vibración (por ejemplo, una velocidad de 3 y un ajuste de vibración de 8-10 en una escala de 1-10 para cada parámetro) (Figura 1A).
- Una vez que se corta una sección y se libera en el PBS circundante, recoja las secciones con un pincel y colóquelas en un plato que contenga medios precalentados del Roswell Park Memorial Institute (RPMI) con P/S.
3. Cultivo y tinción de rodajas de SMG
- Cultivo
- Agregue 1,5 ml de medio RPMI a cada pocillo de una placa de 6 pocillos que contenga un filtro de 0,4 μm. Asegúrese de que no haya burbujas de aire atrapadas debajo del filtro.
- Transfiera de 1 a 6 rodajas a cada filtro con un pincel, teniendo cuidado de no romper las rodajas.
NOTA: Asegúrese de que los sectores no estén sumergidos en el medio, sino que floten en el filtro. Si están completamente sumergidos, pueden asfixiarse durante el cultivo. - Incubar a 37 °C con 5% de CO2 y cambiar el medio cada 3 días (Figura 1A).
- Irradiar placas experimentales con una dosis única de radiación gamma de 10 Gy utilizando un irradiador disponible en el mercado (véase la Tabla de materiales). Después, devuélvalos a la incubadora.
- Tinción para imágenes en vivo
- Con un pincel, levante suavemente las rodajas del filtro y colóquelas en una placa de 24 pocillos que contenga 500 μL de medio de cultivo por pocillo, donde se sumergirán las rodajas.
- Añadir los anticuerpos conjugados y la tinción nuclear pertinentes (véase la Tabla de materiales) a los medios en las concentraciones adecuadas27.
- Incubar las rodajas con anticuerpos durante 2 h a 37 °C con una agitación suave.
- Lavar las rodajas sumergiéndolas en medios de cultivo y lavándolas durante 3 rondas de 10 minutos lavadas a 37 °C con una suave agitación.
4. Montaje e imágenes en vivo
- Con unas pinzas, retire la cinta de un lado de un espaciador de imágenes de doble cara y adhiérala, con el adhesivo hacia abajo, al fondo de una placa de 6 pocillos con fondo de vidrio.
- Pipetee 50 μL de medio en el espacio en el centro del espaciador.
- Coloque la rebanada en el medio con un pincel, asegurándose de que quede plana sin burbujas de aire atrapadas.
- Con una pipeta, retire con cuidado 20 μL de medio del espacio.
- Retire la cinta de la parte superior del espaciador con unas pinzas y coloque un cubreobjetos circular de 25 mm en la parte superior. Presione alrededor del borde del espaciador para asegurarse de que el cubreobjetos se adhiera firmemente, teniendo cuidado de no romper el cubrecubreobjetos aplicando demasiada fuerza (Figura 1A).
- Tome imágenes de la rebanada en un microscopio confocal durante el período de tiempo o los intervalos deseados (p. ej., cada 15 minutos durante 12 h con un objetivo de agua de 20x).
Resultados
La respuesta de los macrófagos a la lesión en la glándula salival submandibular sigue siendo desconocida. Esto incluye si se localizan y migran a estructuras específicas dentro de la glándula, así como la distancia y la velocidad a la que migran. Esto ha sido difícil de determinar a través de enfoques de imágenes estáticas.
Para abordar esto, se ha desarrollado un enfoque de imagen en vivo para estudiar la interacción entre macrófagos y células epiteliales en tiempo real. La tinción inmunofluorescente de cortes se combinó con un modelo de ratón de rastreo de linaje marcado endógenamente (Figura 1A y Figura 2A). En este modelo, los cortes se expusieron a 10 Gy de irradiación gamma para inducir lesiones por irradiación y se obtuvieron imágenes a las 2 h, 3 días y 4 días después de la irradiación (IR), con cortes no irradiados que sirvieron como controles. Los datos se adquirieron de cuatro canales: Hoechst (utilizando láser 425 para minimizar la fototoxicidad), GFP (488), dTomato (561) y Alexa 647 (640). Se realizó una pila z y se capturó una imagen cada 2-3 μm, con un total de 30 a 40 planos recolectados, lo que resultó en una altura total de 80-90 μm.
Utilizando esta técnica y analizando la señal de tomate unido a la membrana (mT) y la actividad de la caspasa3/7, se hizo evidente que las rodajas organotípicas conservaron su estructura epitelial, sobrevivieron en cultivo y exhibieron una muerte celular mínima. Los datos mostraron que los cortes no irradiados de la glándula submandibular de ratones R26mTmG 32, cultivados durante 7 días, conservaron su señal mT y su arquitectura epitelial (Figura 1B). Sin embargo, a los 3 días después de la irradiación ex vivo, la atrofia de las células acinares y ductales fue evidente (Figura 1B; las estructuras acini y ductal resaltadas por líneas blancas y verdes discontinuas, respectivamente), lo que concuerda con la lesión por radiación in vivo 13. La apoptosis fue insignificante en los cortes no irradiados, pero hubo evidencia de células de caspasa 3/7+ en los cortes irradiados a los 4 días después de la irradiación (Figura 1C; flechas verdes), similar a la lesión in vivo 33,34. Además, los cortes irradiados recapitulados dañaron in vivo el ADN 34,35,36,37, como lo indica un γH2AX38 elevado en comparación con los controles no irradiados (Figura 1D,E). Por lo tanto, los cortes organotípicos de glándulas salivales mostraron una buena viabilidad en cultivo y respondieron de manera similar al tejido in vivo a la irradiación.
A continuación, se investigaron las interacciones célula-célula en tiempo real. Se observaron macrófagos que interactuaban directamente con células progenitoras epiteliales marcadas con GFP (Krt14CreER-GFP) durante un período de tiempo de 12 h a los 3 días posteriores a la RI (Figura 2A y Video 1). Sorprendentemente, fue evidente que los macrófagos permanecieron muy cerca de las células progenitoras epiteliales durante horas, a menudo permaneciendo en contacto durante todo el período de imágenes de 12 horas. Además, se observó la fagocitosis en tiempo real de las células epiteliales por parte de los macrófagos, lo que confirma que los macrófagos llevan a cabo su función tradicional en el modelo de cultivo en corte (Figura 2B, Videos 2 y Video 3). Esta técnica también identificó que los macrófagos son relativamente estacionarios tanto durante la homeostasis como después de la lesión por irradiación, probablemente debido a su alta densidad dentro del tejido. Esto demuestra, por primera vez, que los macrófagos de las glándulas salivales no migran extensamente durante la homeostasis o después de una lesión por irradiación. Sin embargo, mientras que los macrófagos no mostraron una migración significativa, el tejido circundante mostró una mayor dinámica después de la irradiación, con múltiples macrófagos interactuando activamente alrededor de grupos de células epiteliales marcadas. Además, basada únicamente en la tinción nuclear, esta técnica nos permitió visualizar el movimiento celular dentro del corte a lo largo del tiempo, a menudo con conductos enteros que parecen "migrar" dentro del tejido (Video 4). Con el tiempo, durante el proceso de cultivo, se hizo evidente que las rodajas cambiaron de una morfología plana a una similar a la de un esferoide, lo que sugiere que el movimiento celular dentro de la rebanada probablemente se deba a su reorganización en una estructura similar a una esfera, que se asemeja a un evento de reorganización potencial.
Por último, los datos de imágenes en vivo generados por este ensayo pueden utilizarse para medir cuantitativamente el comportamiento celular, como la migración. Las células individuales se pueden detectar y segmentar (Figura 3A), y la migración se puede medir utilizando un software de imágenes y análisis disponible en el mercado (consulte la Tabla de materiales y el video 5). Además, se puede realizar un análisis del objeto más cercano para determinar si las células, en este caso, los macrófagos, migran más cerca de otras células de interés, en este caso, las células Krt14 CreER-GFP+, y cómo cambia esta dinámica con el tiempo (Figura 3B).

Figura 1: Recapitulación de la respuesta in vivo en cortes de tejido de glándulas salivales cortados con precisión. (A) Esquema del protocolo experimental. (B) Imágenes representativas de tomate unido a la membrana obtenidas de tejido fresco de la glándula submandibular (SMG), rodajas de SMG no manipuladas cultivadas durante 7 días, o rodajas de SMG irradiadas con una dosis única de irradiación gamma de 10 Gy 3 o 7 días antes. Las líneas blancas discontinuas indican estructuras acinares de ejemplo y las líneas verdes discontinuas indican estructuras ductales de ejemplo. Barra de escala = 50 μm. (C) Imágenes representativas de la expresión de caspasa-3/7 obtenidas a partir de cortes de SMG no manipulados o cortes de SMG irradiados con una dosis única de irradiación gamma de 10 Gy 2 h o 4 días antes. Las puntas de flecha verdes indican núcleos positivos. Barra de escala = 50 μm. (D) Imágenes representativas de la expresión de γH2AX obtenidas a partir de cortes de SMG no manipulados o cortes de SMG irradiados con una dosis única de irradiación gamma de 10 Gy 3 días antes. Barra de escala = 20 μm. (E) Expresión representativa de γH2AX en células epiteliales de EpCAM+ a partir de cortes de SMG no manipulados o cortes de SMG irradiados con una dosis única de irradiación gamma de 10 Gy 2 h y 3 días antes. SSA = área de dispersión lateral. Haga clic aquí para ver una versión más grande de esta figura.
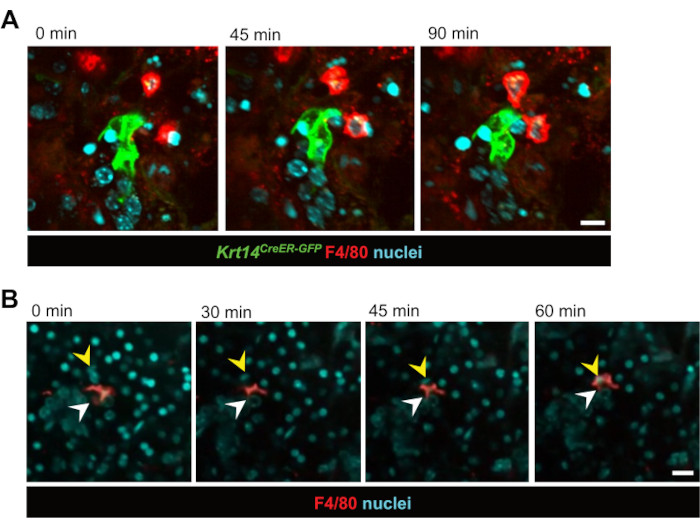
Figura 2: Imágenes en vivo de las interacciones entre macrófagos y células epiteliales y fagocitosis. (A) Imágenes fijas secuenciales de las interacciones entre las células progenitoras KRT14+ y su progenie (células Krt14 CreER-GFP+) y los macrófagos después de la irradiación. Las imágenes de células vivas capturan la dinámica celular durante un período de 90 minutos. Barra de escala = 20 μm. El vídeo asociado es el vídeo 1. (B) Imágenes fijas secuenciales de un macrófago fagocitando una célula epitelial. Las imágenes de células vivas muestran el proceso durante un período de 60 minutos. Las flechas blancas apuntan al macrófago y las flechas amarillas indican el núcleo de la célula que sufre fagocitosis. Barra de escala = 50 μm. El vídeo asociado es el vídeo 2. Haga clic aquí para ver una versión más grande de esta figura.
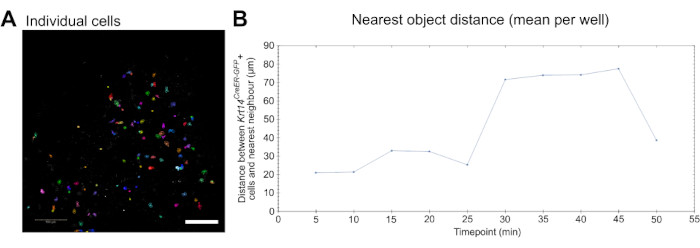
Figura 3: Imágenes en vivo para el análisis de la dinámica celular. (A) Imagen que ilustra la identificación y segmentación de células individuales para analizar parámetros de comportamiento celular, como la migración (ver Video 5). Las celdas se pseudocolorean aleatoriamente para la distinción de celdas individuales y pistas. Barra de escala = 100 μm. (B) Cuantificación de la distancia (en μm) del objeto más cercano a las células individualesKrt14 CreER-GFP+ trazadas en 10 puntos de tiempo (imágenes capturadas cada 5 min). Los datos se presentan como el valor medio por pocillo. Haga clic aquí para ver una versión más grande de esta figura.
Vídeo 1: Imágenes en directo que revelan las interacciones dinámicas entre las células/progenie progenitora KRT14+ y los macrófagos después de la irradiación. Los cortes se expusieron a una sola dosis de irradiación gamma de 10 Gy antes de la obtención de imágenes en vivo. Las célulasKrt14 CreER-GFP+ están representadas en verde, los macrófagos (F4/80+) en rojo y los núcleos en cian. El video comprende una sola pila z, que abarca un período de cultivo de 12 h con imágenes capturadas cada 15 minutos. Haga clic aquí para descargar el video.
Video 2: Imágenes en vivo que capturan un macrófago engullendo una célula epitelial. Los macrófagos (F4/80+) se representan en rojo y los núcleos se muestran en cian. El video consiste en una sola pila z y abarca un período de cultivo de 12 h con imágenes tomadas cada 15 minutos. Haga clic aquí para descargar el video.
Vídeo 3: Imagen en vivo de máxima proyección que muestra un macrófago engullendo una célula epitelial. Los macrófagos (F4/80+) se muestran en rojo y los núcleos se muestran en cian. El video presenta una proyección máxima de imágenes de pila z que suman un total de 80 μm (un solo plano se presenta en el Video 2) y abarca un período de cultivo de 12 h con imágenes tomadas cada 15 minutos.
Video 4: Imágenes en vivo que ilustran el comportamiento dinámico del epitelio de las glándulas salivales en cultivo después de la irradiación. Los cortes se sometieron a una dosis única de irradiación gamma de 10 Gy antes de la obtención de imágenes en vivo. Los macrófagos (F4/80+) están representados en rojo, los núcleos en cian. El video consta de una sola pila z, que abarca un período de cultivo de 12 h con imágenes capturadas cada 15 minutos. Haga clic aquí para descargar el video.
Vídeo 5: Seguimiento cuantitativo de la migración celular a lo largo del tiempo. Este video muestra el rastreo individual de huellas celulares a partir de videos de imágenes en vivo. Las flechas indican rastros de celdas, y las celdas son pseudocoloreadas individualmente. El video consta de una sola pila z y abarca un período de cultivo de 1 h con imágenes tomadas cada 15 minutos. Haga clic aquí para descargar el video.
Discusión
La capacidad de cultivar tejido de glándulas salivales ex vivo presenta una excelente oportunidad para estudiar las interacciones célula-célula en el contexto tanto de la homeostasis como de la respuesta a la lesión. A pesar de que la imagen intravital de la glándula submandibular de ratón es factible39,40, esta técnica depende del uso de modelos de ratón fluorescente reportero para marcar endógenamente las células de interés y debe realizarse bajo anestesia terminal. Aquí, se describe un método para cultivar cortes de glándulas submandibulares ex vivo, manteniendo la arquitectura celular y las interacciones célula-célula. Este enfoque perfecciona las técnicas actuales de obtención de imágenes en vivo y proporciona una alternativa a las imágenes intravitales.
El mantenimiento a largo plazo del tejido mediante esta técnica se basa en el cultivo de rodajas en una interfaz aire-líquido. Es probable que los modelos de explanteanteriores 26,41 hayan logrado un cultivo exitoso durante solo unos pocos días porque estaban sumergidos en los medios y esencialmente "asfixiados". Por el contrario, el uso de un sistema de cultivo de interfaz aire-líquido mantiene la salud y la estructura de los tejidos durante un período prolongado, lo que garantiza imágenes de alta calidad. El método de montar las rebanadas de SMG antes de la obtención de imágenes, con una pequeña cantidad de medios y dentro de una cámara de espacio restringido para mantener la rebanada plana, es fundamental para el éxito de la técnica. La visualización de las células en este ensayo depende de ratones reporteros marcados endógenamente o de anticuerpos conjugados con fluorescencia. La abundancia de modelos de ratones reporteros fluorescentes transgénicos y anticuerpos conjugados dirigidos a tipos y subconjuntos celulares específicos hace que este método sea adecuado para explorar diversas interacciones específicas de las células.
Si bien este método proporciona un buen modelo de la lesión por irradiación in situ y ex vivo da lugar a una atrofia de la estructura acinar y ductal, similar a lo que ocurre in vivo13, algunos elementos no pueden recapitularse ex vivo. Estos incluyen la falta de vasculatura funcional y de entrada neuronal, así como la ausencia de células inflamatorias infiltrantes. Dado el papel bien documentado de los vasos sanguíneos y los nervios en la homeostasis y regeneración de las glándulas salivales26,42 y la importancia de las células inmunitarias migratorias43, como las células T y B, en la función de las glándulas salivales, la respuesta a lesiones, la infección y la patogénesis del síndrome de Sjögren (SS) (como se revisó en44), este ensayo puede pasar por alto algunas interacciones celulares importantes. Además, los eventos migratorios muy rápidos, como el movimiento de la célula asesina natural (NK)45 y la célula dendrítica (DC)46, pueden pasar desapercibidos mediante la obtención de imágenes cada 15 minutos. Sin embargo, los intervalos de obtención de imágenes se pueden optimizar para estudiar las interacciones específicas célula-célula de interés, y la capacidad de obtener imágenes en 3 dimensiones a través de pilas z permite la evaluación del movimiento celular en 3D. El montaje seguro del tejido durante la obtención de imágenes es crucial para la cuantificación, como las mediciones de seguimiento celular. Además, aunque este estudio utilizó tejido de ratón, el protocolo proporciona un método viable para estudiar las interacciones célula-célula en las glándulas salivales humanas, generando información traslacional valiosa inalcanzable a través de otros métodos.
Si bien el papel de los macrófagos residentes en los tejidos en la homeostasis y la regeneración se ha demostrado en varios tejidos 2,10,11,12, su papel en las glándulas salivales sigue siendo en gran medida incontestado. Aunque se sabe que los macrófagos son esenciales para la regeneración epitelial después de una lesión por irradiación13, los mecanismos precisos que subyacen a este efecto siguen siendo desconocidos. Las imágenes en vivo de cortes de glándulas salivales permiten la visualización y el análisis en tiempo real de la dinámica de tejidos complejos, que a menudo se pasan por alto en las imágenes confocales tradicionales. Además, es evidente que los macrófagos experimentan cambios dinámicos en su forma mientras realizan diversas funciones in vivo 47,48,49, y este protocolo probablemente proporciona una mejor representación de estos cambios que una vista estática típica en tejido fijo. Los estudios futuros pueden utilizar esta técnica para investigar cómo cambia la comunicación célula-célula a lo largo del curso de la homeostasis, la lesión y la regeneración/resolución. Este enfoque será útil para dilucidar vías y eventos de señalización clave que, en última instancia, pueden ofrecer beneficios terapéuticos.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
SE está financiado por la subvención 108906/Z/15/Z de Wellcome Trust; EE está financiado por la subvención MR/S005544/1 del UKRI/MRC y por una beca del canciller de la Universidad de Edimburgo. La figura 1A se crea con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.4 µm filter cell culture inserts (Nunc) | Avantor/VWR | 734-2240 | Inserts pre-packed in 6-well multidishes, 20 mm × 25 mm |
| 24 well plate | Corning | 3524 | |
| 35 mm dish | Falcon | 353001 | |
| 6 well plate | Corning | 3516 | |
| Coverslips | Paul Marienfeld GmbH & Co. KG | 111650 | Deckglaser Cover Glasses 25 mm diameter |
| Double-sided sticker | Grace Bio-Labs | 654004 | SecureSeal Imaging Spacers SS1 x 13, 13 mm diameter x 0.12 mm depth, 25 mm x 25mm OD |
| EtOH | Scientific Laboratories Supplies | CHE1924 | Absolute ethanol (EtOH) AR, 99.7% |
| F4/80 antibody | Invitrogen | 17-4801-82 | F4/80 Monoclonal Antibody (BM8), APC, eBioscience |
| Forceps | Fine Science Tools | 91113-10 | Student Fine Forceps Straight Broad Shanks |
| Glass bottom 6 well plate | Cellvis | P06-1.5H-N | 6 well glass bottom plate with high performance #1.5 cover glass |
| Hanks Balanced Salt Solution (HBSS) | Life Technologies | 14025050 | +calcium +magnesium, no phenol red |
| Hoechst | Sigma Aldrich | 14533 | Alternative name: bisBenzimide H 33342 trihydrochloride |
| Ice box | Fisher Scientific | 11339623 | Azlon Polyurethane Ice Buckets with Lid |
| Imaging and analysis software | Harmony | ||
| Low Melting Agarose | Merck | A9414-25G | |
| Paintbrush | Watercolour brush, 10 mm x 2mm tip | ||
| Penicillin-Streptomycin | Sigma Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered |
| Phosphate Buffered Saline (PBS) | Life Technologies | 20012027 | |
| RPMI | ThermoFisher | 12634010 | Gibco Advanced DMEM/F-12 |
| Scalpel | Swann-Morton | Disposable scalpels, No. 11 blade | |
| Scissors | Fine Science Tools | 14088-10 | Extra Narrow Scissors 10.5 cm |
| Shepherd Mark-I-68A 137Cs irradiator | JL Shepherd & Associates | ||
| Superglue | Bostik | Multi-purpose superglue, fast setting, ultra strong | |
| Vibratome | Leica | Leica VT 1000 S | |
| Vibratome blades | Astra | Superior Platinum Double Edge blade | |
| Wild-type (C57BL/BJ) mice | Charles River |
Referencias
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Lucas, T., et al. Differential roles of macrophages in diverse phases of skin repair. J Immunol. 184 (7), 3964-3977 (2010).
- Duffield, J. S., et al. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair. J Clin Invest. 115 (1), 56-65 (2005).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat Immunol. 17 (1), 34-40 (2016).
- Mass, E., Nimmerjahn, F., Kierdorf, K., Schlitzer, A. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nat Rev Immunol. 23 (9), 563-579 (2023).
- Dick, S. A., et al. Three tissue resident macrophage subsets coexist across organs with conserved origins and life cycles. Sci Immunol. 7 (67), (2022).
- Hassel, C., Gausserès, B., Guzylack-Piriou, L., Foucras, G. Ductal macrophages predominate in the immune landscape of the lactating mammary gland. Front Immunol. 12, 754661(2021).
- Kolter, J., et al. A subset of skin macrophages contributes to the surveillance and regeneration of local nerves. Immunity. 50 (6), 1482-1497 (2019).
- Dawson, C. A., et al. Tissue-resident ductal macrophages survey the mammary epithelium and facilitate tissue remodelling. Nat Cell Biol. 22 (5), 546-558 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- McKendrick, J. G., et al. CSF1R-dependent macrophages in the salivary gland are essential for epithelial regeneration after radiation-induced injury. Sci Immunol. 8 (89), doi:10.1126/sciimmunol.add4374 eadd4374(2023).
- Muntjewerff, E. M., Meesters, L. D., vanden Bogaart, G. Antigen cross-presentation by macrophages. Front Immunol. 11, 1276(2020).
- Bissonnette, E. Y., Lauzon-Joset, J. F., Debley, J. S., Ziegler, S. F. Cross-talk between alveolar macrophages and lung epithelial cells is essential to maintain lung homeostasis. Front Immunol. 11, 583042(2020).
- Xue, Q., et al. Analysis of single-cell cytokine secretion reveals a role for paracrine signaling in coordinating macrophage responses to TLR4 stimulation. Sci Signal. 8 (381), (2015).
- McArdle, S., Mikulski, Z., Ley, K. Live cell imaging to understand monocyte, macrophage, and dendritic cell function in atherosclerosis. J Exp Med. 213 (7), 1117-1131 (2016).
- Gurevich, D. B., et al. Live imaging of wound angiogenesis reveals macrophage orchestrated vessel sprouting and regression. Embo j. 37 (13), (2018).
- Meziani, L., et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages. Eur Respir J. 51 (3), (2018).
- Bickelhaupt, S., et al. Effects of CTGF blockade on attenuation and reversal of radiation-induced pulmonary fibrosis. J Natl Cancer Inst. 109 (8), (2017).
- Formenti, S. C., Demaria, S. Systemic effects of local radiotherapy. Lancet Oncol. 10 (7), 718-726 (2009).
- Chambers, M. S., Garden, A. S., Kies, M. S., Martin, J. W. Radiation-induced xerostomia in patients with head and neck cancer: pathogenesis, impact on quality of life, and management. Head Neck. 26 (9), 796-807 (2004).
- Radfar, L., Sirois, D. A. Structural and functional injury in minipig salivary glands following fractionated exposure to 70 Gy of ionizing radiation: an animal model for human radiation-induced salivary gland injury. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 96 (3), 267-274 (2003).
- Grehn, A. L., Gustafsson, H., Franzén, L., Thornell, L. E., Henriksson, R. Ultrastructural morphometry of parotid acinar cells following fractionated irradiation. Oral Oncol. 33 (1), 23-28 (1997).
- Rocchi, C., Emmerson, E. Mouth-watering results: clinical need, current approaches, and future directions for salivary gland regeneration. Trends Mol Med. 26 (7), 649-669 (2020).
- Emmerson, E., et al. Salivary glands regenerate after radiation injury through SOX2-mediated secretory cell replacement. EMBO Mol Med. 10 (3), 8051(2018).
- May, A. J., et al. Diverse progenitor cells preserve salivary gland ductal architecture after radiation-induced damage. Development. 145 (21), (2018).
- Knox, S. M., et al. Parasympathetic stimulation improves epithelial organ regeneration. Nat Commun. 4, 1494(2013).
- Mizrachi, A., et al. Radiation-induced microvascular injury as a mechanism of salivary gland hypofunction and potential target for radioprotectors. Radiat Res. 186 (2), 189-195 (2016).
- Friedrich, R. E., Bartel-Friedrich, S., Holzhausen, H. J., Lautenschläger, C. The effect of external fractionated irradiation on the distribution pattern of extracellular matrix proteins in submandibular salivary glands of the rat. J Craniomaxillofac Surg. 30 (4), 246-254 (2002).
- Vasioukhin, V., Degenstein, L., Wise, B., Fuchs, E. The magical touch: genome targeting in epidermal stem cells induced by tamoxifen application to mouse skin. Proc Natl Acad Sci U S A. 96 (15), 8551-8556 (1999).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Gilman, K. E., et al. P2X7 receptor deletion suppresses γ-radiation-induced hyposalivation. Am J Physiol Regul Integr Comp Physiol. 316 (5), R687-R696 (2019).
- Ren, J., et al. Radioprotective effects and mechanism of HL-003 on radiation-induced salivary gland damage in mice. Sci Rep. 12 (1), 8419(2022).
- Marmary, Y., et al. Radiation-induced loss of salivary gland function is driven by cellular senescence and prevented by IL6 modulation. Cancer Res. 76 (5), 1170-1180 (2016).
- Chang, S., et al. Inorganic nitrate alleviates total body irradiation-induced systemic damage by decreasing reactive oxygen species levels. Int J Radiat Oncol Biol Phys. 103 (4), 945-957 (2019).
- Varghese, J. J., et al. Localized delivery of amifostine enhances salivary gland radioprotection. J Dent Res. 97 (11), 1252-1259 (2018).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. gammaH2AX: a sensitive molecular marker of DNA damage and repair. Leukemia. 24 (4), 679-686 (2010).
- Takano, T., et al. Highly localized intracellular Ca(2+) signals promote optimal salivary gland fluid secretion. Elife. 10, (2021).
- Ficht, X., Thelen, F., Stolp, B., Stein, J. V. Preparation of murine submandibular salivary gland for upright intravital microscopy. J Vis Exp. 135, (2018).
- O'Dell, N. L., Sharawy, M. H., Schuster, G. S. Effects of in vivo single and multiple isoproterenol injections on subsequently explanted submandibular glands. Acta Anat (Basel. 105 (4), 431-438 (1979).
- Lombaert, I. M., et al. Cytokine treatment improves parenchymal and vascular damage of salivary glands after irradiation). Clin Cancer Res. 14 (23), 7741-7750 (2008).
- Stolp, B., et al. Salivary gland macrophages and tissue-resident CD8(+) T cells cooperate for homeostatic organ surveillance. Sci Immunol. 5 (46), 4371(2020).
- Verstappen, G. M., Pringle, S., Bootsma, H., Kroese, F. G. M. Epithelial-immune cell interplay in primary Sjögren syndrome salivary gland pathogenesis. Nat Rev Rheumatol. 17 (6), 333-348 (2021).
- Vanherberghen, B., et al. Microwell-based live cell imaging of NK cell dynamics to assess heterogeneity in motility and cytotoxic response. Methods Mol Biol. 1441, 87-106 (2016).
- de Winde, C. M., Munday, C., Acton, S. E. Molecular mechanisms of dendritic cell migration in immunity and cancer. Med Microbiol Immunol. 209 (4), 515-529 (2020).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Paterson, N., Lämmermann, T. Macrophage network dynamics depend on haptokinesis for optimal local surveillance. Elife. 11, (2022).
- Lim, K., et al. In situ neutrophil efferocytosis shapes T cell immunity to influenza infection. Nat Immunol. 21 (9), 1046-1057 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados