Method Article
Tükürük bezindeki hücre-hücre etkileşimlerinin ex vivo canlı hücre görüntüleme ile sorgulanması
Bu Makalede
Özet
İmmünofloresan görüntüleme, karmaşık, zamana bağlı biyolojik süreçleri zaman içinde tek bir anlık görüntüde gözlemleme yeteneği ile sınırlıdır. Bu çalışma, hassas kesilmiş fare submandibular bez dilimleri üzerinde yürütülen canlı görüntüleme yaklaşımını özetlemektedir. Bu yaklaşım, homeostaz ve rejenerasyon ve onarım süreçleri sırasında hücre-hücre etkileşimlerinin gerçek zamanlı olarak gözlemlenmesine izin verir.
Özet
Tükürük bezi rejenerasyonu, çeşitli hücre tipleri arasındaki karmaşık etkileşimleri içeren karmaşık bir süreçtir. Son çalışmalar, makrofajların rejeneratif yanıtı yönlendirmede oynadığı önemli role ışık tutmuştur. Bununla birlikte, bu kritik role ilişkin anlayışımız öncelikle sabit doku biyopsilerinden elde edilen statik görüntülere dayanmaktadır. Bu sınırlamanın üstesinden gelmek ve bu etkileşimler hakkında gerçek zamanlı olarak bilgi edinmek için bu çalışma, tükürük bezi dokusunun ex vivo kültürlenmesi ve hücre göçünün canlı görüntülerinin yakalanması için kapsamlı bir protokolün ana hatlarını çizmektedir.
Protokol birkaç önemli adımdan oluşur: İlk olarak, fare submandibular tükürük bezi dokusu bir vibratom kullanılarak dikkatlice dilimlenir ve daha sonra bir hava-sıvı arayüzünde kültürlenir. Bu dilimler, örneğin radyasyona maruz kalarak, hücresel hasarı indüklemek ve rejeneratif yanıtı tetiklemek için kasıtlı olarak yaralanabilir. İlgilenilen spesifik hücreleri izlemek için, belirli bir proteinin yeşil floresan proteini (GFP) ile işaretlendiği genetiği değiştirilmiş farelerden toplanan tükürük bezi dokusu kullanılarak endojen olarak etiketlenebilirler. Alternatif olarak, floresan konjuge antikorlar, ilgilenilen spesifik hücre yüzeyi belirteçlerini eksprese eden hücreleri boyamak için kullanılabilir. Tükürük bezi dilimleri hazırlandıktan sonra, 15 dakikalık aralıklarla yakalanan görüntülerle 12 saatlik bir süre boyunca yüksek içerikli bir konfokal görüntüleme sistemi kullanılarak canlı görüntülemeye tabi tutulur. Elde edilen görüntüler daha sonra bir film oluşturmak için derlenir ve daha sonra değerli hücre davranış parametrelerini çıkarmak için analiz edilebilir. Bu yenilikçi yöntem, araştırmacılara yaralanmayı takiben tükürük bezi içindeki makrofaj etkileşimlerini araştırmak ve daha iyi anlamak için güçlü bir araç sağlar, böylece bu dinamik biyolojik bağlamda rol oynayan rejeneratif süreçler hakkındaki bilgimizi geliştirir.
Giriş
Makrofajların, klasik bağışıklık fonksiyonlarının ötesine geçerek, rejenerasyon ve onarım süreçlerinde giderek daha önemli roller oynadıkları gösterilmiştir 1,2. Gerçekten de, makrofajlar, onarımın tüm aşamalarında kritik düzenleyici aktivitenin yanı sıra skar oluşumu ve fibrozsergileyen rejenerasyonla ilgili çok sayıda süreçte yer alır 3,4. Dokuda yerleşik makrofajlar, çeşitli hücresel fenotipleri yönlendiren karmaşık mekanizmalara sahip oldukça heterojen hücre tipleridir ve organ gelişimi, işlevi ve homeostazında önemli roller oynarlar (5'te gözden geçirildiği gibi). Dokuda yerleşik makrofajlar başlangıçta yolk kesesi ve fetal karaciğerdeki öncüllerden kaynaklanır ve daha sonra mevcut makrofajların uzun ömürlülüğüne ve içinde bulundukları doku veya nişe bağlı olarak değişen oranlarda proliferasyon veya kemik iliği kaynaklı kan monositleri ile değiştirilirler 6,7.
Daha da önemlisi, dokuda yerleşik makrofajlar tüm dokulara dağılır ve çeşitli organ fonksiyonlarına katkıda bulunur. Nişe özgü işlevleri yerine getirmek için mikro çevreleri tarafından benzersiz bir şekilde programlanırlar. Bu nedenle, makrofajların doku içindeki lokalizasyonu, akciğer, meme bezi, bağırsak, deri ve kasta gözlenen benzersiz popülasyonlarla işlevleri hakkında fikir verir 8,9,10. Meme bezi gelişimi sırasında, duktal makrofajlar duktal ağaçla yakından ilişkilidir ve bunların tükenmesi, dallanmanın önemli ölçüde azalmasına neden olur11. Ayrıca, makrofajlar ergenlik döneminde morfogenez ve gebelikte alveologenez için gereklidir ve burada epiteli aktif olarak izlerler. Kas yaralanmasında, belirli bir makrofaj popülasyonu, yaralanma bölgesinde "yaşar" ve kök hücre çoğalması için gerekli olan proliferasyona bağlı ipuçlarını sağladıkları geçici bir niş sağlar. Bu nedenle, onarım sürecini yönetmede farklı makrofaj popülasyonlarının özel rolünü sergilerler2. Akciğerde, interstisyel makrofajların, IL-1B 12'nin salınması yoluyla hasarla ilişkili geçici progenitörlere dönüşüm için interlökin (IL)-R1 eksprese eden alveolar tip II (AT2) hücreleri hazırladığı benzer bir fenomen meydana gelir. Ayrıca, son araştırmalar, makrofajların ışınlama yaralanmasından sonra fare submandibuler tükürük bezinin (SMG) rejenerasyonu için gerekli olduğunu ve bunların yokluğunda epitelyal rejenerasyonun bozulduğunu göstermiştir13. Birlikte ele alındığında, bu veriler, doku hasarından sonra ve homeostaz sırasında geçici enflamatuar nişlerde makrofaj aktivasyonunun ve fonksiyonunun önemini vurgulamaktadır.
Makrofajlar aktif hücrelerdir ve işlevleri, doğrudan hücre-hücre teması14,15 dahil olmak üzere çeşitli farklı hücre tipleriyle etkileşimleri ve ayrıca niş düzenleme için gerekli olan çözünür faktörlerin(2,16) salgılanması gibi daha dolaylı yöntemleri içerir. Klasik immünofloresan görüntüleme bu etkileşimleri çözmeye başlamak için yararlı olsa da, zaman içinde yalnızca tek bir anlık görüntüyü göstermekle sınırlıdır, böylece oldukça dinamik bir rejeneratif süreç için kritik olan çok sayıda zaman noktasını atlar17,18. Zamanlamanın önemi ve farklı yenilenme dalgalarının ortaya çıkması daha keskin bir odak noktası haline geldikçe, bu süreçleri daha ayrıntılı olarak incelemek esastır.
Radyoterapi, kanser teşhisi konan birçok kişi için hayat kurtarıcı bir tedavidir. Radyoterapi genellikle tümör(ler)i küçültmede veya ortadan kaldırmada etkili olsa da, radyasyon alanında yatan sağlıklı dokulara da zarar verebilir ve bir bağışıklık tepkisi ortaya çıkarabilir. Radyasyon hasarı, hızlı makrofaj alımına ve doğrudan ve dolaylı immünomodülatör yanıtlaraneden olabilir 19,20. Tükürük bezleri genellikle baş ve boyun kanseri tedavisi sırasında yanlışlıkla ışınlanır21,22, bu da epitel hasarına, hücre atrofisine ve fibrozise23,24 yol açarak kserostomi veya kronik ağız kuruluğunaneden olur 25.
Tükürük bezi, epitel hücreleri (hem tükürük üreten asiner hücreler hem de tükürük taşıyan duktal hücreler), miyoepitelyal hücreler, epitelyal progenitör hücreler, sinirler, kan damarları, bağışıklık hücreleri, fibroblastlar ve hücre dışı matriks (ECM) dahil ancak bunlarla sınırlı olmamak üzere çok sayıda hücre tipi ve yapısından oluşur. Bu hücre tiplerinin çoğunun rejeneratif yanıttaki rolü ve yanıtı daha öncetanımlanmıştır 26,27,28,29,30. Bununla birlikte, bu farklı hücrelerin homeostaz ve rejenerasyon sırasında nasıl etkileşime girdiği ve özellikle makrofajlar gibi bağışıklık hücrelerinin nasıl davrandığı daha az çalışılmıştır. Bu makale, SMG makrofajları ile ex vivo dokudaki diğer ilgili hücreler arasındaki canlı etkileşimleri incelemek için yeni kurulan bir yöntemi açıklamaktadır. SMG bir vibratom üzerinde dilimlenir, yüzey işaretleyicileri için boyanır ve 12 saate kadar görüntülenir. Bu yöntem kullanılarak çevre hücrelerin makrofajlar tarafından fagositozu gözlenebilir, makrofaj migrasyon kinetiği çalışılabilir ve makrofajlar ile epitel hücreleri arasındaki doğrudan hücre-hücre etkileşimleri gösterilebilir.
Protokol
Tüm prosedürler Birleşik Krallık İçişleri Bakanlığı tarafından onaylandı ve PPL'ler PB5FC9BD2 ve PP0330540 kapsamında gerçekleştirildi. Tüm deneyler ARRIVE yönergelerine ve Edinburgh Üniversitesi'nin yönergelerine uygundur.
Yabani tip fareler ticari olarak elde edildi (Malzeme Tablosuna bakınız). Krt14Krema; R26mTmG fareleri, Krt14CreER/+ fareleri31 ile R26mTmG/ mTmG fareleri32 çaprazlayarak evde yetiştirildi. Tüm deneylerde 8-10 haftalık dişi fareler kullanıldı.
1. SMG'nin toplanması ve yerleştirilmesi
- Fareleri/fareleri artan karbondioksit konsantrasyonuna (CO2) maruz bırakarak ötenazi yapın. Daha sonra, insizyon bölgesine %70 etanol (EtOH) püskürtün ve SMG'leri çevreleyen dokudan dikkatlice incelemek için makas ve forseps kullanın (Şekil 1A). Forseps kullanarak herhangi bir yağ ve bağ dokusunu çıkarın ve bezi buz gibi soğuk Hanks Dengeli Tuz Çözeltisi (HBSS, Malzeme Tablosuna bakınız) içeren bir toplama tüpüne yerleştirin.
- Bezi, forseps kullanarak her biri yaklaşık 1cm2 büyüklüğünde parçalara ayırın.
- % 4 agarozu 50 ° C'ye ısıtın ve ardından doğrudan 35 mm'lik bir tabağa dökün.
- Az miktarda eritilmiş 50 °C agarozu ayrı bir kaba dökün ve bezi fazla agarozun içinde hareket ettirerek iyice durulayın.
NOT: Bu adım, bezlerdeki fazla sıvıyı çıkarmak için gereklidir. Fazla sıvı, bezlerin agaroza düzgün bir şekilde yapışmasını engelleyebilir. - Bezin 4-6 parçasını agarozun içine yerleştirin, düz durduklarından ve aynı düzlemde olduklarından emin olun (Şekil 1A).
NOT: Bezlerin agar yüzeyine veya plakanın altına temas etmediğinden emin olun. - Kapağı 35 mm'lik tabağa yerleştirin ve plakayı buzla kaplayarak bir buzluğa aktarın.
- Agarozun katılaşması için 5-10 dakika bekleyin.
2. Bölümlendirme
- Beze gömülü agaroz bloğunun etrafını dikkatlice kesmek için bir neşter kullanın ve dokuyu içeren bloğu çanaktan çıkarın. Yaklaşık 5 mm'lik bir kenarlık bırakın.
- Bir damla süper yapıştırıcı uygulayarak, bloğun tüm alt yüzeyinin süper yapıştırıcı ile temas halinde olduğundan emin olarak, agaroz bloğunu vibratom aşamasına (Malzeme Tablosuna bakın) yapıştırın.
- Süper yapıştırıcının yaklaşık 5 dakika sertleşmesine izin verin. Ardından, vibratom odasını %1 Penisilin-Streptomisin (P/S) içeren buz gibi soğuk 1x fosfat tamponlu salin (PBS) ile doldurun.
- Vibratom odasının hem yanına hem de altına buz ekleyin.
NOT: Çok soğuk bir ortam sağlayın ve gerekirse buzu değiştirin. - Fazla agarozu kesin ve bir neşter ile kesiler yaparak her bez parçası arasında 5 mm boşluklar oluşturun. Bu, tek tek dilimler verecektir.
- Vibratom bıçağını agaroz bloğun yüzüyle hizalayın ve istenen dilim kalınlığını elde etmek için bölümlerin başlangıç ve bitiş noktalarını ayarlayın.
- Kesme işlemine başlamadan önce bıçağın blokla temas etmediğinden emin olun. Bu önlem, büyük agaroz parçalarının yanlışlıkla kesilmesini ve numunenin parçalarının kaybolmasını önleyecektir.
- Düşük hızda ve yüksek titreşimde 150 μm kalınlığında kesitler kesin (örneğin, her parametre için 1-10 ölçeğinde 3 hız ve 8-10 titreşim ayarı) (Şekil 1A).
- Bir bölüm kesilip çevredeki PBS'ye bırakıldıktan sonra, bölümleri bir boya fırçası kullanarak toplayın ve P/S ile önceden ısıtılmış Roswell Park Memorial Institute (RPMI) ortamı içeren bir tabağa yerleştirin.
3. SMG dilimlerinin kültürlenmesi ve boyanması
- Kültür
- 0,4 μm filtre içeren 6 oyuklu bir plakanın her bir oyuğuna 1,5 mL RPMI ortamı ekleyin. Filtrenin altında hava kabarcığı olmadığından emin olun.
- Dilimleri kırmamaya dikkat ederek bir boya fırçası kullanarak her filtreye 1-6 dilim aktarın.
NOT: Dilimlerin ortama batırılmadığından, bunun yerine filtrenin üzerinde yüzdüğünden emin olun. Tamamen suya batırılırlarsa, kültür sırasında boğulabilirler. - 37 °C'de %5CO2 ile inkübe edin ve ortamı her 3 günde bir değiştirin (Şekil 1A).
- Deney plakalarını, piyasada bulunan bir ışınlayıcı kullanarak tek bir doz 10 Gy gama radyasyonu ile ışınlayın (bkz. Daha sonra onları kuluçka makinesine geri koyun.
- Canlı görüntüleme için boyama
- Bir boya fırçası kullanarak, dilimleri filtreden yavaşça kaldırın ve dilimlerin daldırılacağı oyuk başına 500 μL kültür ortamı içeren 24 oyuklu bir plakaya yerleştirin.
- İlgili konjuge antikorları ve nükleer lekeyi (Malzeme Tablosuna bakınız) uygun konsantrasyonlardaortama ekleyin 27.
- Dilimleri antikorlarla 37 ° C'de 2 saat boyunca hafif çalkalama ile inkübe edin.
- Dilimleri kültür ortamına batırarak yıkayın ve 37 °C'de hafif çalkalayarak 3 tur 10 dakikalık yıkama yapın.
4. Montaj ve canlı görüntüleme
- Forseps kullanarak, bandı çift taraflı bir görüntüleme ara parçasının bir tarafından çıkarın ve yapışkan tarafı aşağı bakacak şekilde cam tabanlı 6 oyuklu bir plakanın altına yapıştırın.
- Ara parçanın ortasındaki boşluğa 50 μL ortam pipetleyin.
- Dilimi bir boya fırçası kullanarak ortama yerleştirin ve sıkışmış hava kabarcığı olmadan düz durmasını sağlayın.
- Bir pipet kullanarak, boşluktan 20 μL ortamı dikkatlice çıkarın.
- Forseps kullanarak bandı ara parçanın üst tarafından çıkarın ve üstüne 25 mm'lik dairesel bir lamel yerleştirin. Çok fazla kuvvet uygulayarak lamel kırılmamasına dikkat ederek lamellerin sıkıca yapıştığından emin olmak için ara parçanın kenarına bastırın (Şekil 1A).
- Dilimi istenen süre veya aralıklar için konfokal mikroskopta görüntüleyin (örneğin, 20x su objektifi kullanarak 12 saat boyunca her 15 dakikada bir).
Sonuçlar
Makrofajların submandibuler tükürük bezindeki hasara tepkisi bilinmemektedir. Bu, bez içindeki belirli yapılara lokalize olup olmadıklarını ve göç edip etmediklerini, ayrıca göç ettikleri mesafe ve hızı içerir. Bunu statik görüntüleme yaklaşımlarıyla belirlemek zor olmuştur.
Bunu ele almak için, makrofaj-epitel hücre etkileşimini gerçek zamanlı olarak incelemek için canlı bir görüntüleme yaklaşımı geliştirilmiştir. Dilimlerin immünofloresan boyanması, endojen olarak etiketlenmiş bir soy izleme fare modeli ile birleştirildi (Şekil 1A ve Şekil 2A). Bu modelde, dilimler ışınlama hasarını indüklemek için 10 Gy gama ışınlamasına maruz bırakıldı ve ışınlamadan 2 saat, 3 gün ve 4 gün sonra (IR) görüntülendi, ışınlanmamış dilimler kontrol görevi gördü. Veriler dört kanaldan elde edildi: Hoechst (fototoksisiteyi en aza indirmek için lazer 425 kullanılarak), GFP (488), dTomato (561) ve Alexa 647 (640). Bir z-yığını gerçekleştirildi ve her 2-3 μm'de bir görüntü yakalandı, toplam 30 ila 40 düzlem toplandı ve toplam yükseklik 80-90 μm oldu.
Bu tekniği kullanarak ve membrana bağlı Domates (mT) sinyalini ve Kaspaz3/7 aktivitesini analiz ederek, organotipik dilimlerin epitel yapılarını koruduğu, kültürde hayatta kaldığı ve minimal hücre ölümü sergilediği ortaya çıktı. Veriler, 7 gün boyunca kültürlenen R26mTmG fareleri32'den alınan submandibular bezin ışınlanmamış dilimlerinin mT sinyallerini ve epitel mimarilerini koruduğunu gösterdi (Şekil 1B). Bununla birlikte, ex vivo ışınlamayı takip eden 3 gün sonra, in vivo radyasyon hasarı13 ile tutarlı olarak asiner ve duktal hücre atrofisi belirgindi. Işınlanmamış dilimlerde apoptoz ihmal edilebilir düzeydeydi, ancak ışınlamadan 4 gün sonra ışınlanmış dilimlerde Kaspaz 3/7+ hücrelerine dair kanıtlar vardı (Şekil 1C; yeşil oklar), in vivo yaralanmayabenzer 33,34. Ayrıca, ışınlanmış dilimler, ışınlanmamış kontrollere kıyasla yüksek γH2AX 38 ile gösterildiği gibi, in vivo DNA hasarı34,35,36,37 olarak özetlenmiştir (Şekil 1D,E). Bu nedenle, organotipik tükürük bezi dilimleri kültürde iyi canlılık sergiledi ve ışınlamaya in vivo dokuya benzer şekilde yanıt verdi.
Bunu takiben, gerçek zamanlı hücre-hücre etkileşimleri araştırıldı. GFP etiketli epitelyal progenitör hücrelerle (Krt14CreER-GFP) DOĞRUDAN ETKILEŞIME GIREN MAKROFAJLAR, IR'den 3 gün sonra 12 saatlik bir süre boyunca gözlenmiştir (Şekil 2A ve Video 1). Dikkat çekici bir şekilde, makrofajların saatlerce epitelyal progenitör hücrelere yakın kaldıkları ve genellikle 12 saatlik görüntüleme süresi boyunca temas halinde kaldıkları açıktı. Ayrıca, epitel hücrelerinin makrofajlar tarafından gerçek zamanlı fagositozu gözlendi ve makrofajların dilim kültürü modelinde geleneksel işlevlerini yerine getirdiğini doğruladı (Şekil 2B, Video 2 ve Video 3). Bu teknik aynı zamanda makrofajların hem homeostaz sırasında hem de ışınlama hasarını takiben, muhtemelen doku içindeki yüksek yoğunlukları nedeniyle nispeten durağan olduğunu tespit etti. Bu, ilk kez, tükürük bezi makrofajlarının homeostaz sırasında veya ışınlama hasarından sonra yoğun bir şekilde göç etmediğini göstermektedir. Bununla birlikte, makrofajlar önemli bir göç göstermezken, çevredeki doku, ışınlamayı takiben artan dinamikler sergiledi ve çoklu makrofajlar, etiketli epitel hücrelerinin kümeleri etrafında aktif olarak etkileşime girdi. Ek olarak, yalnızca nükleer boyamaya dayanan bu teknik, zaman içinde dilim içindeki hücre hareketini görselleştirmemize izin verdi, genellikle tüm kanallar doku içinde 'göç ediyor' gibi görünüyordu (Video 4). Kültürleme işlemi sırasında zamanla, dilimlerin düzden küre benzeri bir morfolojiye kaydığı ortaya çıktı, bu da dilim içindeki hücre hareketinin, potansiyel bir yeniden yapılanma olayına benzeyen küre benzeri bir yapıya yeniden düzenlenmesinden kaynaklandığını düşündürdü.
Son olarak, bu tahlil tarafından üretilen canlı görüntüleme verileri, göç gibi hücre davranışını nicel olarak ölçmek için kullanılabilir. Tek tek hücreler tespit edilebilir ve bölümlere ayrılabilir (Şekil 3A) ve migrasyon, ticari olarak temin edilebilen bir görüntüleme ve analiz yazılımı kullanılarak ölçülebilir (bkz. Malzeme Tablosu ve Video 5). Ayrıca, hücrelerin, bu durumda makrofajların, ilgilenilen diğer hücrelere, bu durumda Krt14CreER-GFP+ hücrelerine daha yakın göç edip etmediğini ve bu dinamiğin zaman içinde nasıl değiştiğini belirlemek için en yakın nesne analizi yapılabilir (Şekil 3B).

Şekil 1: Hassas kesilmiş tükürük bezi doku dilimlerinde in vivo yanıtın özetlenmesi. (A) Deney protokolünün şeması. (B) Taze submandibular bez (SMG) dokusundan elde edilen zara bağlı Domatesin, 7 gün boyunca kültürlenmiş manipüle edilmemiş SMG dilimlerinin veya 3 veya 7 gün önce tek bir doz 10 Gy gama ışınlaması ile ışınlanmış SMG dilimlerinin temsili görüntüleri. Kesikli beyaz çizgiler örnek asiner yapıları, kesikli yeşil çizgiler ise örnek duktal yapıları gösterir. Ölçek çubuğu = 50 μm. (C) 2 saat veya 4 gün önce tek bir doz 10 Gy gama ışınlaması ile ışınlanmış, manipüle edilmemiş SMG dilimlerinden veya SMG dilimlerinden elde edilen Kaspaz-3/7 ekspresyonunun temsili görüntüleri. Yeşil ok uçları pozitif çekirdekleri gösterir. Ölçek çubuğu = 50 μm. (D) 3 gün önce tek bir doz 10 Gy gama ışınlaması ile ışınlanmış, manipüle edilmemiş SMG dilimlerinden veya SMG dilimlerinden elde edilen γH2AX ekspresyonunun temsili görüntüleri. Ölçek çubuğu = 20 μm. (E) 2 saat ve 3 gün önce tek bir doz 10 Gy gama ışınlaması ile ışınlanmış, manipüle edilmemiş SMG dilimlerinden veya SMG dilimlerinden EpCAM + epitel hücrelerinde γH2AX'in temsili ekspresyonu. SSA = yan saçılma alanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
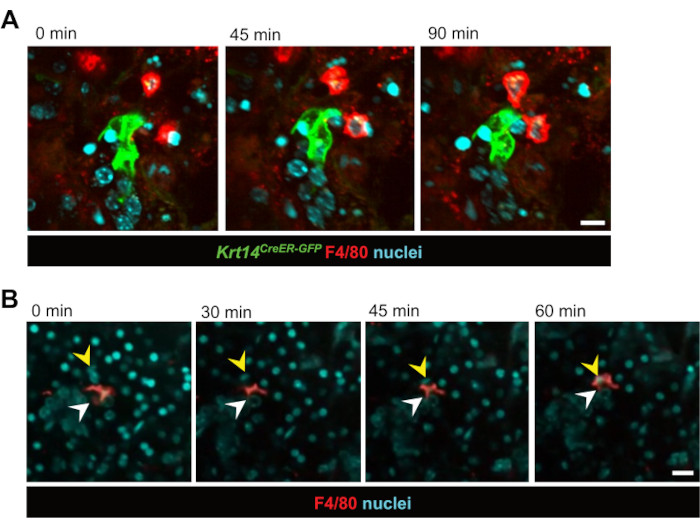
Şekil 2: Makrofaj-epitel hücre etkileşimlerinin ve fagositozun canlı görüntülenmesi. (A) Işınlamayı takiben KRT14+ progenitör hücreler ve onların soyları (Krt14CreER-GFP+ hücreleri) ve makrofajlar arasındaki etkileşimlerin ardışık hareketsiz görüntüleri. Canlı hücre görüntüleme, 90 dakikalık bir süre boyunca hücresel dinamikleri yakalar. Ölçek çubuğu = 20 μm. İlişkili video Video 1'dir. (B) Bir epitel hücresini fagosite eden bir makrofajın ardışık hareketsiz görüntüleri. Canlı hücre görüntüleme, süreci 60 dakikalık bir süre boyunca gösterir. Beyaz oklar makrofajı, sarı oklar ise fagositoz geçiren hücrenin çekirdeğini gösterir. Ölçek çubuğu = 50 μm. İlişkili video Video 2'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
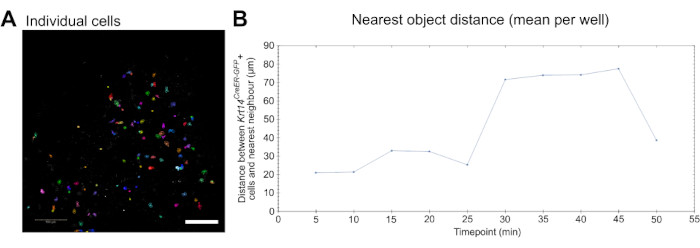
Şekil 3: Hücresel dinamik analiz için canlı görüntüleme. (A) Göç gibi hücresel davranış parametrelerini analiz etmek için bireysel hücre tanımlamasını ve segmentasyonunu gösteren resim (bkz. Video 5). Hücreler, tek tek hücre ve iz ayrımı için rastgele sözde renklendirilir. Ölçek çubuğu = 100 μm. (B) En yakın nesnenin 10 zaman noktası üzerinden çizilen tek tek Krt14CreER-GFP+ hücrelerine olan mesafesinin (μm cinsinden) ölçülmesi (görüntüler her 5 dakikada bir yakalanır). Veriler, kuyu başına ortalama değer olarak sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Video 1: Işınlamadan sonra KRT14+ progenitör hücreleri/dölleri ve makrofajlar arasındaki dinamik etkileşimleri ortaya çıkaran canlı görüntüleme. Dilimler canlı görüntülemeden önce tek bir 10 Gy gama ışınlama dozuna maruz bırakıldı. Krt14CreER-GFP + hücreleri yeşil, makrofajlar (F4 / 80+) kırmızı ve çekirdekler camgöbeği ile temsil edilir. Video, her 15 dakikada bir çekilen görüntülerle 12 saatlik bir kültür periyoduna yayılan tek bir z-yığınından oluşuyor. Videoyu indirmek için lütfen buraya tıklayın.
Video 2: Bir epitel hücresini yutan bir makrofajı yakalayan canlı görüntüleme. Makrofajlar (F4/80+) kırmızı renkle, çekirdekler ise camgöbeği ile gösterilmiştir. Video, tek bir z-yığınından oluşur ve her 15 dakikada bir çekilen görüntülerle 12 saatlik bir kültür periyoduna yayılır.
Video 3: Bir epitel hücresini yutan bir makrofajı gösteren maksimum projeksiyon canlı görüntüleme. Makrofajlar (F4/80+) kırmızı renkle gösterilir ve çekirdekler camgöbeği ile gösterilir. Video, toplam 80 μm'lik maksimum z-yığını görüntü projeksiyonuna sahiptir (Video 2'de tek bir düzlem sunulmuştur) ve her 15 dakikada bir çekilen görüntülerle 12 saatlik bir kültür periyodunu kapsar.
Video 4: Işınlama sonrası kültürde tükürük bezi epitelinin dinamik davranışını gösteren canlı görüntüleme. Dilimler, canlı görüntülemeden önce tek bir 10 Gy gama ışınlama dozuna tabi tutuldu. Makrofajlar (F4/80+) kırmızı, çekirdekler camgöbeği ile temsil edilir. Video, her 15 dakikada bir çekilen görüntülerle 12 saatlik bir kültür periyoduna yayılan tek bir z-yığınından oluşur.Videoyu indirmek için lütfen buraya tıklayın.
Video 5: Zaman içinde kantitatif hücre göçü izleme. Bu video, canlı görüntüleme videolarından hücre izlerinin bireysel olarak izlenmesini gösterir. Oklar hücre izlerini gösterir ve hücreler ayrı ayrı sözde renklidir. Video, tek bir z-yığınından oluşur ve her 15 dakikada bir çekilen görüntülerle 1 saatlik bir kültür periyoduna yayılır.
Tartışmalar
Tükürük bezi dokusunu ex vivo kültürleme yeteneği, hem homeostaz hem de yaralanma yanıtı bağlamında hücre-hücre etkileşimlerini incelemek için mükemmel bir fırsat sunar. Fare submandibular bezinin intravital görüntülemesi mümkün olmasına rağmen39,40, bu teknik, ilgilenilen hücreleri endojen olarak etiketlemek için floresan raportör fare modellerinin kullanılmasına bağlıdır ve terminal anestezi altında yapılmalıdır. Burada, submandibular bez dilimlerini ex vivo kültürlemek için hücresel mimariyi ve hücre-hücre etkileşimlerini koruyan bir yöntem açıklanmaktadır. Bu yaklaşım, mevcut canlı görüntüleme tekniklerini geliştirir ve intravital görüntülemeye bir alternatif sunar.
Bu tekniği kullanarak dokunun uzun süreli bakımı, dilimlerin bir hava-sıvı arayüzünde kültürlenmesine dayanır. Önceki eksplant modelleri26,41 muhtemelen sadece birkaç gün boyunca başarılı bir kültüre ulaşmıştır, çünkü medyaya batırılmışlardı ve esasen "boğulmuşlardı". Buna karşılık, bir hava-sıvı arayüz kültür sisteminin kullanılması, doku sağlığını ve yapısını uzun süre koruyarak yüksek kaliteli görüntüleme sağlar. SMG dilimlerini görüntülemeden önce, az miktarda ortamla ve dilimi düz tutmak için alan kısıtlı bir bölme içine monte etme yöntemi, tekniğin başarısının ayrılmaz bir parçasıdır. Bu tahlilde hücrelerin görselleştirilmesi, endojen olarak etiketlenmiş raportör farelere veya floresan konjuge antikorlara bağlıdır. Transgenik floresan raportör fare modellerinin ve belirli hücre tiplerini ve alt kümelerini hedefleyen konjuge antikorların bolluğu, bu yöntemi hücreye özgü çeşitli etkileşimleri keşfetmek için uygun hale getirir.
Bu yöntem, in situ ve ex vivo ışınlama yaralanmasının iyi bir doku modeli sağlamasına rağmen, in vivo13'te meydana gelenlere benzer şekilde asiner ve duktal yapı atrofisine neden olur, bazı elementler ex vivo olarak özetlenemez. Bunlar, işleyen vaskülatür ve nöronal girdi eksikliğinin yanı sıra sızan enflamatuar hücrelerin yokluğunu içerir. Tükürük bezi homeostazı ve rejenerasyonunda kan damarlarının ve sinirlerin iyi belgelenmiş rolü26,42 ve tükürük bezi fonksiyonunda, yaralanma yanıtında, enfeksiyonda ve Sjögren Sendromu (SS) patogenezinde T ve B hücreleri gibi göçmen bağışıklık hücrelerinin43 önemi göz önüne alındığında (44'te gözden geçirildiği gibi), bu test bazı önemli hücresel etkileşimleri gözden kaçırabilir. Ek olarak, Doğal Öldürücü (NK) hücre45 ve Dendritik Hücre (DC) 46 hareketi gibi çok hızlı göç olayları, her 15 dakikada bir görüntüleme ile gözden kaçabilir. Bununla birlikte, görüntüleme aralıkları, ilgilenilen spesifik hücre-hücre etkileşimlerini incelemek için optimize edilebilir ve z-yığınları aracılığıyla 3 boyutlu görüntüleme yeteneği, 3D hücre hareketinin değerlendirilmesine olanak tanır. Görüntüleme sırasında dokunun güvenli bir şekilde monte edilmesi, hücre izleme ölçümleri gibi miktar tayini için çok önemlidir. Ayrıca, bu çalışmada fare dokusu kullanılmasına rağmen, protokol, insan tükürük bezlerindeki hücre-hücre etkileşimlerini incelemek için uygun bir yöntem sağlar ve diğer yöntemlerle elde edilemeyen değerli translasyonel bilgiler üretir.
Dokuda yerleşik makrofajların homeostaz ve rejenerasyondaki rolü birçok dokudagösterilmiş olsa da 2,10,11,12, tükürük bezlerindeki rolleri büyük ölçüde cevapsız kalmaktadır. Makrofajların ışınlama hasarından sonra epitelyal rejenerasyon için gerekli olduğubilinmesine rağmen 13, bu etkinin altında yatan kesin mekanizmalar bilinmemektedir. Tükürük bezi dilimlerinin canlı görüntülenmesi, geleneksel konfokal görüntülemede sıklıkla gözden kaçan karmaşık doku dinamiklerinin gerçek zamanlı olarak görselleştirilmesini ve analiz edilmesini sağlar. Ek olarak, makrofajların çeşitli işlevleri yerine getirirken dinamik şekil değişikliklerine uğradığı açıktır in vivo 47,48,49 ve bu protokol muhtemelen bu değişikliklerin sabit dokudaki tipik bir statik görünümden daha iyi bir temsilini sağlar. Gelecekteki çalışmalar, hücre-hücre iletişiminin homeostaz, yaralanma ve rejenerasyon / çözünürlük boyunca nasıl değiştiğini araştırmak için bu tekniği kullanabilir. Bu yaklaşım, sonuçta terapötik faydalar sağlayabilecek temel sinyal yollarını ve olayları aydınlatmak için yararlı olacaktır.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
SE, Wellcome Trust hibesi 108906/Z/15/Z tarafından finanse edilmektedir; EE, UKRI/MRC hibesi MR/S005544/1 ve Edinburgh Üniversitesi'nden Şansölye Bursu tarafından finanse edilmektedir. Şekil 1A, BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.4 µm filter cell culture inserts (Nunc) | Avantor/VWR | 734-2240 | Inserts pre-packed in 6-well multidishes, 20 mm × 25 mm |
| 24 well plate | Corning | 3524 | |
| 35 mm dish | Falcon | 353001 | |
| 6 well plate | Corning | 3516 | |
| Coverslips | Paul Marienfeld GmbH & Co. KG | 111650 | Deckglaser Cover Glasses 25 mm diameter |
| Double-sided sticker | Grace Bio-Labs | 654004 | SecureSeal Imaging Spacers SS1 x 13, 13 mm diameter x 0.12 mm depth, 25 mm x 25mm OD |
| EtOH | Scientific Laboratories Supplies | CHE1924 | Absolute ethanol (EtOH) AR, 99.7% |
| F4/80 antibody | Invitrogen | 17-4801-82 | F4/80 Monoclonal Antibody (BM8), APC, eBioscience |
| Forceps | Fine Science Tools | 91113-10 | Student Fine Forceps Straight Broad Shanks |
| Glass bottom 6 well plate | Cellvis | P06-1.5H-N | 6 well glass bottom plate with high performance #1.5 cover glass |
| Hanks Balanced Salt Solution (HBSS) | Life Technologies | 14025050 | +calcium +magnesium, no phenol red |
| Hoechst | Sigma Aldrich | 14533 | Alternative name: bisBenzimide H 33342 trihydrochloride |
| Ice box | Fisher Scientific | 11339623 | Azlon Polyurethane Ice Buckets with Lid |
| Imaging and analysis software | Harmony | ||
| Low Melting Agarose | Merck | A9414-25G | |
| Paintbrush | Watercolour brush, 10 mm x 2mm tip | ||
| Penicillin-Streptomycin | Sigma Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered |
| Phosphate Buffered Saline (PBS) | Life Technologies | 20012027 | |
| RPMI | ThermoFisher | 12634010 | Gibco Advanced DMEM/F-12 |
| Scalpel | Swann-Morton | Disposable scalpels, No. 11 blade | |
| Scissors | Fine Science Tools | 14088-10 | Extra Narrow Scissors 10.5 cm |
| Shepherd Mark-I-68A 137Cs irradiator | JL Shepherd & Associates | ||
| Superglue | Bostik | Multi-purpose superglue, fast setting, ultra strong | |
| Vibratome | Leica | Leica VT 1000 S | |
| Vibratome blades | Astra | Superior Platinum Double Edge blade | |
| Wild-type (C57BL/BJ) mice | Charles River |
Referanslar
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Lucas, T., et al. Differential roles of macrophages in diverse phases of skin repair. J Immunol. 184 (7), 3964-3977 (2010).
- Duffield, J. S., et al. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair. J Clin Invest. 115 (1), 56-65 (2005).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat Immunol. 17 (1), 34-40 (2016).
- Mass, E., Nimmerjahn, F., Kierdorf, K., Schlitzer, A. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nat Rev Immunol. 23 (9), 563-579 (2023).
- Dick, S. A., et al. Three tissue resident macrophage subsets coexist across organs with conserved origins and life cycles. Sci Immunol. 7 (67), (2022).
- Hassel, C., Gausserès, B., Guzylack-Piriou, L., Foucras, G. Ductal macrophages predominate in the immune landscape of the lactating mammary gland. Front Immunol. 12, 754661(2021).
- Kolter, J., et al. A subset of skin macrophages contributes to the surveillance and regeneration of local nerves. Immunity. 50 (6), 1482-1497 (2019).
- Dawson, C. A., et al. Tissue-resident ductal macrophages survey the mammary epithelium and facilitate tissue remodelling. Nat Cell Biol. 22 (5), 546-558 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- McKendrick, J. G., et al. CSF1R-dependent macrophages in the salivary gland are essential for epithelial regeneration after radiation-induced injury. Sci Immunol. 8 (89), doi:10.1126/sciimmunol.add4374 eadd4374(2023).
- Muntjewerff, E. M., Meesters, L. D., vanden Bogaart, G. Antigen cross-presentation by macrophages. Front Immunol. 11, 1276(2020).
- Bissonnette, E. Y., Lauzon-Joset, J. F., Debley, J. S., Ziegler, S. F. Cross-talk between alveolar macrophages and lung epithelial cells is essential to maintain lung homeostasis. Front Immunol. 11, 583042(2020).
- Xue, Q., et al. Analysis of single-cell cytokine secretion reveals a role for paracrine signaling in coordinating macrophage responses to TLR4 stimulation. Sci Signal. 8 (381), (2015).
- McArdle, S., Mikulski, Z., Ley, K. Live cell imaging to understand monocyte, macrophage, and dendritic cell function in atherosclerosis. J Exp Med. 213 (7), 1117-1131 (2016).
- Gurevich, D. B., et al. Live imaging of wound angiogenesis reveals macrophage orchestrated vessel sprouting and regression. Embo j. 37 (13), (2018).
- Meziani, L., et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages. Eur Respir J. 51 (3), (2018).
- Bickelhaupt, S., et al. Effects of CTGF blockade on attenuation and reversal of radiation-induced pulmonary fibrosis. J Natl Cancer Inst. 109 (8), (2017).
- Formenti, S. C., Demaria, S. Systemic effects of local radiotherapy. Lancet Oncol. 10 (7), 718-726 (2009).
- Chambers, M. S., Garden, A. S., Kies, M. S., Martin, J. W. Radiation-induced xerostomia in patients with head and neck cancer: pathogenesis, impact on quality of life, and management. Head Neck. 26 (9), 796-807 (2004).
- Radfar, L., Sirois, D. A. Structural and functional injury in minipig salivary glands following fractionated exposure to 70 Gy of ionizing radiation: an animal model for human radiation-induced salivary gland injury. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 96 (3), 267-274 (2003).
- Grehn, A. L., Gustafsson, H., Franzén, L., Thornell, L. E., Henriksson, R. Ultrastructural morphometry of parotid acinar cells following fractionated irradiation. Oral Oncol. 33 (1), 23-28 (1997).
- Rocchi, C., Emmerson, E. Mouth-watering results: clinical need, current approaches, and future directions for salivary gland regeneration. Trends Mol Med. 26 (7), 649-669 (2020).
- Emmerson, E., et al. Salivary glands regenerate after radiation injury through SOX2-mediated secretory cell replacement. EMBO Mol Med. 10 (3), 8051(2018).
- May, A. J., et al. Diverse progenitor cells preserve salivary gland ductal architecture after radiation-induced damage. Development. 145 (21), (2018).
- Knox, S. M., et al. Parasympathetic stimulation improves epithelial organ regeneration. Nat Commun. 4, 1494(2013).
- Mizrachi, A., et al. Radiation-induced microvascular injury as a mechanism of salivary gland hypofunction and potential target for radioprotectors. Radiat Res. 186 (2), 189-195 (2016).
- Friedrich, R. E., Bartel-Friedrich, S., Holzhausen, H. J., Lautenschläger, C. The effect of external fractionated irradiation on the distribution pattern of extracellular matrix proteins in submandibular salivary glands of the rat. J Craniomaxillofac Surg. 30 (4), 246-254 (2002).
- Vasioukhin, V., Degenstein, L., Wise, B., Fuchs, E. The magical touch: genome targeting in epidermal stem cells induced by tamoxifen application to mouse skin. Proc Natl Acad Sci U S A. 96 (15), 8551-8556 (1999).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Gilman, K. E., et al. P2X7 receptor deletion suppresses γ-radiation-induced hyposalivation. Am J Physiol Regul Integr Comp Physiol. 316 (5), R687-R696 (2019).
- Ren, J., et al. Radioprotective effects and mechanism of HL-003 on radiation-induced salivary gland damage in mice. Sci Rep. 12 (1), 8419(2022).
- Marmary, Y., et al. Radiation-induced loss of salivary gland function is driven by cellular senescence and prevented by IL6 modulation. Cancer Res. 76 (5), 1170-1180 (2016).
- Chang, S., et al. Inorganic nitrate alleviates total body irradiation-induced systemic damage by decreasing reactive oxygen species levels. Int J Radiat Oncol Biol Phys. 103 (4), 945-957 (2019).
- Varghese, J. J., et al. Localized delivery of amifostine enhances salivary gland radioprotection. J Dent Res. 97 (11), 1252-1259 (2018).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. gammaH2AX: a sensitive molecular marker of DNA damage and repair. Leukemia. 24 (4), 679-686 (2010).
- Takano, T., et al. Highly localized intracellular Ca(2+) signals promote optimal salivary gland fluid secretion. Elife. 10, (2021).
- Ficht, X., Thelen, F., Stolp, B., Stein, J. V. Preparation of murine submandibular salivary gland for upright intravital microscopy. J Vis Exp. 135, (2018).
- O'Dell, N. L., Sharawy, M. H., Schuster, G. S. Effects of in vivo single and multiple isoproterenol injections on subsequently explanted submandibular glands. Acta Anat (Basel. 105 (4), 431-438 (1979).
- Lombaert, I. M., et al. Cytokine treatment improves parenchymal and vascular damage of salivary glands after irradiation). Clin Cancer Res. 14 (23), 7741-7750 (2008).
- Stolp, B., et al. Salivary gland macrophages and tissue-resident CD8(+) T cells cooperate for homeostatic organ surveillance. Sci Immunol. 5 (46), 4371(2020).
- Verstappen, G. M., Pringle, S., Bootsma, H., Kroese, F. G. M. Epithelial-immune cell interplay in primary Sjögren syndrome salivary gland pathogenesis. Nat Rev Rheumatol. 17 (6), 333-348 (2021).
- Vanherberghen, B., et al. Microwell-based live cell imaging of NK cell dynamics to assess heterogeneity in motility and cytotoxic response. Methods Mol Biol. 1441, 87-106 (2016).
- de Winde, C. M., Munday, C., Acton, S. E. Molecular mechanisms of dendritic cell migration in immunity and cancer. Med Microbiol Immunol. 209 (4), 515-529 (2020).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Paterson, N., Lämmermann, T. Macrophage network dynamics depend on haptokinesis for optimal local surveillance. Elife. 11, (2022).
- Lim, K., et al. In situ neutrophil efferocytosis shapes T cell immunity to influenza infection. Nat Immunol. 21 (9), 1046-1057 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır