Method Article
Untersuchung von Zell-Zell-Interaktionen in der Speicheldrüse mittels ex vivo Lebendzell-Bildgebung
In diesem Artikel
Zusammenfassung
Die immunfluoreszierende Bildgebung ist durch die Fähigkeit eingeschränkt, komplexe, zeitabhängige biologische Prozesse in nur einer einzigen Momentaufnahme zu beobachten. Diese Studie skizziert einen Live-Imaging-Ansatz, der an präzisionsgeschnittenen Unterkieferdrüsenschnitten von Mäusen durchgeführt wird. Dieser Ansatz ermöglicht die Echtzeitbeobachtung von Zell-Zell-Interaktionen während der Homöostase und der Regenerations- und Reparaturprozesse.
Zusammenfassung
Die Regeneration der Speicheldrüsen ist ein komplexer Prozess, bei dem es um komplizierte Interaktionen zwischen verschiedenen Zelltypen geht. Jüngste Studien haben Aufschluss über die zentrale Rolle von Makrophagen bei der Steuerung der regenerativen Reaktion gegeben. Unser Verständnis dieser kritischen Rolle beruht jedoch in erster Linie auf statischen Ansichten, die aus fixierten Gewebebiopsien gewonnen wurden. Um diese Einschränkung zu überwinden und Einblicke in diese Wechselwirkungen in Echtzeit zu gewinnen, skizziert diese Studie ein umfassendes Protokoll für die Kultivierung von Speicheldrüsengewebe ex vivo und die Aufnahme von Live-Bildern der Zellmigration.
Das Protokoll umfasst mehrere wichtige Schritte: Zunächst wird das submandibuläre Speicheldrüsengewebe der Maus vorsichtig mit einem Vibratom durchtrennt und dann an einer Luft-Flüssigkeits-Grenzfläche kultiviert. Diese Schnitte können z.B. durch Strahlenbelastung absichtlich verletzt werden, um Zellschäden hervorzurufen und die regenerative Reaktion auszulösen. Um bestimmte Zellen von Interesse zu verfolgen, können sie endogen markiert werden, z. B. durch die Verwendung von Speicheldrüsengewebe von genetisch veränderten Mäusen, bei denen ein bestimmtes Protein mit grün fluoreszierendem Protein (GFP) markiert ist. Alternativ können fluoreszenzkonjugierte Antikörper verwendet werden, um Zellen zu färben, die spezifische Zelloberflächenmarker von Interesse exprimieren. Nach der Präparation werden die Speicheldrüsenschnitte mit einem konfokalen High-Content-Bildgebungssystem über einen Zeitraum von 12 Stunden einer Live-Bildgebung unterzogen, wobei die Bilder in Abständen von 15 Minuten aufgenommen werden. Die resultierenden Bilder werden dann zu einem Film zusammengefügt, der anschließend analysiert werden kann, um wertvolle Parameter für das Zellverhalten zu extrahieren. Diese innovative Methode bietet Forschern ein leistungsfähiges Werkzeug, um Makrophageninteraktionen innerhalb der Speicheldrüse nach einer Verletzung zu untersuchen und besser zu verstehen, wodurch unser Wissen über die regenerativen Prozesse, die in diesem dynamischen biologischen Kontext ablaufen, erweitert wird.
Einleitung
Es hat sich gezeigt, dass Makrophagen eine immer wichtigere Rolle bei den Regenerations- und Reparaturprozessen spielen, die über ihre klassische Immunfunktion hinausgehen 1,2. In der Tat sind Makrophagen an einer Vielzahl von Prozessen im Zusammenhang mit der Regeneration beteiligt und zeigen eine kritische regulatorische Aktivität in allen Stadien der Reparatur sowie der Narbenbildung und Fibrose 3,4. Geweberesidente Makrophagen sind sehr heterogene Zelltypen mit komplexen Mechanismen, die verschiedene zelluläre Phänotypen antreiben, und sie spielen eine wesentliche Rolle bei der Entwicklung, Funktion und Homöostase von Organen (siehe5). Geweberesidente Makrophagen entstehen zunächst aus Vorläufern im Dottersack und in der fetalen Leber und werden anschließend durch Proliferation oder durch aus dem Knochenmark gewonnene Blutmonozyten mit unterschiedlicher Geschwindigkeit ersetzt, abhängig von der Langlebigkeit der vorhandenen Makrophagen und dem Gewebe oder der Nische, in der sie sich befinden 6,7.
Wichtig ist, dass geweberesidente Makrophagen in allen Geweben verteilt sind und zu verschiedenen Organfunktionen beitragen. Sie sind durch ihre Mikroumgebung einzigartig programmiert, um nischenspezifische Funktionen auszuführen. Aus diesem Grund bietet die Lokalisierung von Makrophagen innerhalb des Gewebes einen Einblick in ihre Funktion, wobei einzigartige Populationen in der Lunge, der Brustdrüse, dem Darm, der Haut und den Muskeln beobachtet werden 8,9,10. Während der Entwicklung der Brustdrüse sind duktale Makrophagen eng mit dem duktalen Baum verbunden, und ihre Erschöpfung führt zu einer signifikant reduzierten Verzweigung11. Darüber hinaus werden Makrophagen für die Morphogenese in der Pubertät und die Alveologenese in der Schwangerschaft benötigt, wo sie das Epithel aktiv überwachen. Bei Muskelverletzungen "verweilt" eine bestimmte Population von Makrophagen an der Verletzungsstelle und bietet eine vorübergehende Nische, in der sie proliferationsinduzierte Hinweise liefern, die für die Stammzellproliferation erforderlich sind. Damit zeigen sie die spezialisierte Rolle unterschiedlicher Makrophagenpopulationen bei der Steuerung des Reparaturprozesses2. In der Lunge tritt ein ähnliches Phänomen auf, bei dem interstitielle Makrophagen Interleukin (IL)-R1-exprimierende alveoläre Typ II (AT2)-Zellen für die Umwandlung in schädigungsassoziierte transiente Vorläuferzellen durch die Freisetzung von IL-1B12 vorbereiten. Darüber hinaus haben neuere Forschungen gezeigt, dass Makrophagen für die Regeneration der submandibulären Speicheldrüse (SMG) der Maus nach einer Bestrahlungsverletzung unerlässlich sind und in ihrer Abwesenheit die epitheliale Regeneration gestört ist13. Zusammengenommen unterstreichen diese Daten die Bedeutung der Makrophagenaktivierung und -funktion in transienten Entzündungsnischen nach Gewebeverletzungen sowie während der Homöostase.
Makrophagen sind aktive Zellen, und ihre Funktionen umfassen Interaktionen mit einer Vielzahl verschiedener Zelltypen, einschließlich des direkten Zell-Zell-Kontakts14,15 sowie indirekterer Methoden wie der Sekretion der löslichen Faktoren 2,16, die für die Nischenregulation unerlässlich sind. Während die klassische Immunfluoreszenz-Bildgebung nützlich ist, um mit der Entschlüsselung dieser Wechselwirkungen zu beginnen, ist sie begrenzt, da sie nur eine einzige Momentaufnahme in der Zeit darstellt und dadurch zahlreiche Zeitpunkte auslässt, die für einen hochdynamischen regenerativen Prozess entscheidend sind17,18. Da die Bedeutung des Timings und der Entstehung verschiedener Regenerationswellen immer stärker in den Fokus rückt, ist es wichtig, diese Prozesse genauer zu analysieren.
Die Strahlentherapie ist für viele Menschen, bei denen Krebs diagnostiziert wurde, eine lebensrettende Behandlung. Während die Strahlentherapie oft wirksam ist, um den/die Tumor(e) zu verkleinern oder zu eliminieren, kann sie auch gesundes Gewebe schädigen, das im Strahlenfeld liegt, und eine Immunantwort hervorrufen. Eine Strahlenschädigung kann eine schnelle Rekrutierung von Makrophagen sowie direkte und indirekte immunmodulatorische Reaktionen hervorrufen 19,20. Die Speicheldrüsen werden bei der Behandlung von Kopf-Hals-Krebs oft versehentlich bestrahlt21,22, was zu Epithelschäden, Zellatrophie und Fibrose23,24 führt, was zu Xerostomie oder chronischer Mundtrockenheit führt25.
Die Speicheldrüse besteht aus einer Vielzahl von Zelltypen und -strukturen, einschließlich, aber nicht beschränkt auf Epithelzellen (sowohl speichelproduzierende Azinuszellen als auch speicheltransportierende duktale Zellen), Myoepithelzellen, epitheliale Vorläuferzellen, Nerven, Blutgefäße, Immunzellen, Fibroblasten und extrazelluläre Matrix (EZM). Die Rolle und Reaktion vieler dieser Zelltypen bei der regenerativen Reaktion wurde bereits beschrieben 26,27,28,29,30. Wie diese verschiedenen Zellen während der Homöostase und Regeneration interagieren und insbesondere wie sich Immunzellen wie Makrophagen verhalten, ist jedoch weniger gut untersucht. Dieses Manuskript beschreibt eine neu etablierte Methode zur Untersuchung der Live-Interaktionen zwischen SMG-Makrophagen und anderen Zellen von Interesse in ex vivo Gewebe. Die MP wird auf einem Vibratom geschnitten, für Oberflächenmarker gefärbt und bis zu 12 Stunden lang belichtet. Mit dieser Methode kann die Phagozytose umgebender Zellen durch Makrophagen beobachtet, die Migrationskinetik von Makrophagen untersucht und direkte Zell-Zell-Interaktionen zwischen Makrophagen und Epithelzellen nachgewiesen werden.
Protokoll
Alle Verfahren wurden vom britischen Innenministerium genehmigt und im Rahmen der PPLs PB5FC9BD2 und PP0330540 durchgeführt. Alle Experimente orientieren sich an den ARRIVE-Richtlinien und denen der University of Edinburgh.
Wildtyp-Mäuse wurden kommerziell gewonnen (siehe Materialtabelle). Krt14CreER; R26mTmG-Mäuse wurden im Haus gezüchtet, indem Krt14CreER/+ -Mäuse31 mit R26mTmG/mTmG-Mäusen 32 gekreuzt wurden. In allen Experimenten wurden weibliche 8-10 Wochen alte Mäuse verwendet.
1. Sammeln und Einbetten der SMG
- Euthanasie die Maus/Mäuse, indem man sie einer steigenden Konzentration von Kohlendioxid (CO2) aussetzt. Besprühen Sie anschließend den Inzisionsbereich mit 70%igem Ethanol (EtOH) und trennen Sie die SMGs mit Schere und Pinzette vorsichtig vom umgebenden Gewebe (Abbildung 1A). Entfernen Sie jegliches Fett und Bindegewebe mit einer Pinzette und legen Sie die Drüse in ein Sammelröhrchen mit eiskalter Hanks Balanced Salt Solution (HBSS, siehe Materialtabelle).
- Trennen Sie die Drüse mit einer Pinzette in ca. 1 cm2 große Stücke.
- 4%ige Agarose auf 50 °C erhitzen und dann direkt in eine 35-mm-Schale gießen.
- Geben Sie eine kleine Menge geschmolzener 50 °C heißer Agarose in eine separate Schale und spülen Sie die Stopfbuchse gründlich aus, indem Sie sie in der überschüssigen Agarose bewegen.
HINWEIS: Dieser Schritt ist notwendig, um überschüssige Flüssigkeit aus den Drüsen zu entfernen. Ein Übermaß an Flüssigkeit kann verhindern, dass die Drüsen richtig an der Agarose haften. - Legen Sie 4-6 Stücke der Drüse in die Agarose und achten Sie darauf, dass sie flach liegen und sich in der gleichen Ebene befinden (Abbildung 1A).
HINWEIS: Stellen Sie sicher, dass die Drüsen nicht die Oberfläche des Agars oder den Boden der Platte berühren. - Legen Sie den Deckel auf die 35-mm-Schale und geben Sie sie in eine Eisbox, wobei Sie die Platte mit Eis bedecken.
- Warten Sie 5-10 Minuten, bis die Agarose fest geworden ist.
2. Sektion
- Schneiden Sie mit einem Skalpell vorsichtig um den in der Drüse eingebetteten Agaroseblock herum und entfernen Sie den Block, der das Gewebe enthält, aus der Schale. Lassen Sie einen Rand von ca. 5 mm frei.
- Befestigen Sie den Agaroseblock an der Bühne des Vibratoms (siehe Materialtabelle), indem Sie einen Tropfen Sekundenkleber auftragen und darauf achten, dass die gesamte Unterseite des Blocks mit dem Sekundenkleber in Kontakt kommt.
- Den Sekundenkleber ca. 5 Min. aushärten lassen. Füllen Sie dann die Vibratomkammer mit eiskalter 1x phosphatgepufferter Kochsalzlösung (PBS) mit 1% Penicillin-Streptomycin (P/S).
- Füge Eis sowohl an der Seite als auch am Boden der Vibratomkammer hinzu.
HINWEIS: Halten Sie eine sehr kalte Umgebung aufrecht und ersetzen Sie das Eis nach Bedarf. - Schneiden Sie überschüssige Agarose ab und schaffen Sie 5 mm Lücken zwischen den einzelnen Drüsenstücken, indem Sie mit einem Skalpell Einschnitte machen. Dadurch entstehen einzelne Scheiben.
- Richten Sie die Vibratomklinge an der Fläche des Agaroseblocks aus und legen Sie die Start- und Endpunkte der Abschnitte fest, um die gewünschte Scheibendicke zu erreichen.
- Bevor Sie mit dem Schneiden beginnen, stellen Sie sicher, dass die Klinge nicht mit dem Block in Berührung kommt. Diese Vorsichtsmaßnahme verhindert, dass versehentlich große Agarosestücke geschnitten werden und Teile der Probe verloren gehen.
- Schneiden Sie Abschnitte mit einer Dicke von 150 μm bei niedriger Geschwindigkeit und hoher Vibration (z. B. einer Geschwindigkeit von 3 und einer Vibrationseinstellung von 8-10 auf einer Skala von 1-10 für jeden Parameter) (Abbildung 1A).
- Sobald ein Abschnitt geschnitten und in die umgebende PBS freigegeben ist, sammeln Sie die Abschnitte mit einem Pinsel und legen Sie sie in eine Schale mit vorgewärmten Medien des Roswell Park Memorial Institute (RPMI) mit P/S.
3. Kultivierung und Färbung von SMG-Scheiben
- Verfeinernd
- Geben Sie 1,5 ml RPMI-Medien in jede Vertiefung einer 6-Well-Platte, die einen 0,4-μm-Filter enthält. Stellen Sie sicher, dass sich keine Luftblasen unter dem Filter befinden.
- Übertragen Sie 1-6 Scheiben mit einem Pinsel auf jeden Filter und achten Sie darauf, dass die Scheiben nicht brechen.
HINWEIS: Stellen Sie sicher, dass die Schichten nicht in Medien eingetaucht sind, sondern stattdessen auf dem Filter schwimmen. Wenn sie vollständig untergetaucht sind, können sie während der Kultur ersticken. - Bei 37 °C mit 5 % CO2 inkubieren und das Medium alle 3 Tage wechseln (Abbildung 1A).
- Bestrahlen Sie Versuchsplatten mit einer Einzeldosis von 10 Gy Gammastrahlung unter Verwendung eines handelsüblichen Bestrahlungsgeräts (siehe Materialtabelle). Danach legst du sie wieder in den Inkubator zurück.
- Färbung für die Live-Bildgebung
- Heben Sie die Schichten vorsichtig mit einem Pinsel aus dem Filter und legen Sie sie in eine 24-Well-Platte mit 500 μl Nährmedien pro Well, in die die Slices eingetaucht werden.
- Die entsprechenden konjugierten Antikörper und die Kernfärbung (siehe Materialtabelle) werden in den entsprechenden Konzentrationen27 zu den Medien gegeben.
- Die Scheiben mit Antikörpern für 2 h bei 37 °C unter leichtem Rühren inkubieren.
- Waschen Sie die Scheiben, indem Sie sie in Nährmedien eintauchen und 3 Runden à 10 Minuten waschen und bei 37 °C unter leichtem Rühren waschen.
4. Montage und Live-Bildgebung
- Entfernen Sie das Klebeband mit einer Pinzette von einer Seite eines doppelseitigen Abstandshalters und kleben Sie es mit der Klebeseite nach unten auf den Boden einer 6-Well-Platte mit Glasboden.
- Pipettieren Sie 50 μl des Mediums in den Spalt in der Mitte des Abstandshalters.
- Legen Sie die Scheibe mit einem Pinsel in das Medium und achten Sie darauf, dass sie flach und ohne eingeschlossene Luftblasen aufliegt.
- Entfernen Sie mit einer Pipette vorsichtig 20 μl des Mediums aus dem Spalt.
- Entfernen Sie das Klebeband mit einer Pinzette von der Oberseite des Abstandshalters und legen Sie ein 25 mm kreisförmiges Deckglas darauf. Drücken Sie um den Rand des Abstandshalters, um sicherzustellen, dass das Deckglas fest befestigt ist, und achten Sie darauf, das Deckglas nicht durch zu viel Kraft zu zerbrechen (Abbildung 1A).
- Fotografieren Sie die Schicht auf einem konfokalen Mikroskop für den gewünschten Zeitraum oder die gewünschten Intervalle (z. B. alle 15 Minuten für 12 Stunden mit einem 20-fachen Wasserobjektiv).
Ergebnisse
Die Reaktion von Makrophagen auf Verletzungen in der submandibulären Speicheldrüse ist noch unbekannt. Dazu gehört, ob sie bestimmte Strukturen innerhalb der Drüse lokalisieren und dorthin wandern, sowie die Entfernung und Geschwindigkeit, mit der sie wandern. Dies war bisher nur schwer mit statischen Bildgebungsansätzen zu bestimmen.
Um dieses Problem anzugehen, wurde ein Live-Imaging-Ansatz entwickelt, um die Interaktion zwischen Makrophagen und Epithelzellen in Echtzeit zu untersuchen. Die immunfluoreszierende Färbung der Schnitte wurde mit einem endogen markierten Mausmodell kombiniert, das die Abstammungslinie verfolgt (Abbildung 1A und Abbildung 2A). In diesem Modell wurden die Schichten einer Gamma-Bestrahlung von 10 Gy ausgesetzt, um eine Bestrahlungsverletzung zu induzieren, und wurden 2 h, 3 Tage und 4 Tage nach der Bestrahlung (IR) abgebildet, wobei nicht bestrahlte Schichten als Kontrollen dienten. Die Daten wurden von vier Kanälen erfasst: Hoechst (mit Laser 425 zur Minimierung der Phototoxizität), GFP (488), dTomato (561) und Alexa 647 (640). Es wurde ein Z-Stapel erstellt und alle 2-3 μm ein Bild aufgenommen, wobei insgesamt 30 bis 40 Ebenen gesammelt wurden, was zu einer Gesamthöhe von 80-90 μm führte.
Mit dieser Technik und der Analyse des membrangebundenen Tomatensignals (mT) und der Caspase3/7-Aktivität wurde deutlich, dass organotypische Schnitte ihre Epithelstruktur behielten, in Kultur überlebten und einen minimalen Zelltod aufwiesen. Die Daten zeigten, dass nicht bestrahlte Schnitte der Unterkieferdrüse von R26mTmG-Mäusen 32, die 7 Tage lang kultiviert wurden, ihr mT-Signal und ihre Epithelarchitektur behielten (Abbildung 1B). 3 Tage nach der Ex-vivo-Bestrahlung war jedoch eine azinäre und duktale Zellatrophie erkennbar (Abbildung 1B; Acini- und duktale Strukturen durch gestrichelte weiße bzw. grüne Linien hervorgehoben), was mit einer In-vivo-Strahlenschädigung übereinstimmt13. Die Apoptose war in den nicht bestrahlten Schnitten vernachlässigbar, aber es gab Hinweise auf Caspase 3/7+ Zellen in den bestrahlten Schnitten 4 Tage nach der Bestrahlung (Abbildung 1C; grüne Pfeile), ähnlich wie in vivo Schädigung33,34. Darüber hinaus rekapitulierten bestrahlte Schnitte in vivo DNA-Schäden 34,35,36,37, was durch erhöhte γH2AX38 im Vergleich zu nicht bestrahlten Kontrollen angezeigt wird (Abbildung 1D,E). So zeigten organotypische Speicheldrüsenschnitte eine gute Lebensfähigkeit in Kultur und reagierten ähnlich wie in vivo Gewebe auf Bestrahlung.
Im Anschluss daran wurden Zell-Zell-Interaktionen in Echtzeit untersucht. Makrophagen, die direkt mit GFP-markierten epithelialen Vorläuferzellen (Krt14CreER-GFP) interagieren, wurden über einen Zeitraum von 12 Stunden 3 Tage nach IR beobachtet (Abbildung 2A und Video 1). Bemerkenswert war, dass die Makrophagen stundenlang in unmittelbarer Nähe zu den epithelialen Vorläuferzellen blieben und oft während der gesamten 12-stündigen Bildgebungsperiode in Kontakt blieben. Darüber hinaus wurde die Phagozytose von Epithelzellen durch Makrophagen in Echtzeit beobachtet, was bestätigt, dass Makrophagen ihre traditionelle Funktion im Schnittkulturmodell erfüllen (Abbildung 2B, Videos 2 und Video 3). Diese Technik identifizierte auch, dass Makrophagen sowohl während der Homöostase als auch nach einer Bestrahlungsverletzung relativ stationär sind, was wahrscheinlich auf ihre hohe Dichte im Gewebe zurückzuführen ist. Dies zeigt erstmals, dass Speicheldrüsenmakrophagen während der Homöostase oder nach Bestrahlungsschäden nicht großflächig wandern. Während die Makrophagen jedoch keine signifikante Migration zeigten, zeigte das umgebende Gewebe nach der Bestrahlung eine erhöhte Dynamik, wobei mehrere Makrophagen aktiv um Cluster markierter Epithelzellen interagierten. Darüber hinaus ermöglichte uns diese Technik, die ausschließlich auf der Kernfärbung basierte, die Zellbewegung innerhalb der Schicht im Laufe der Zeit zu visualisieren, wobei oft ganze Kanäle innerhalb des Gewebes zu "wandern" schienen (Video 4). Im Laufe der Zeit während des Kultivierungsprozesses wurde deutlich, dass sich die Scheiben von einer flachen zu einer kugelförmigen Morphologie verschoben haben, was darauf hindeutet, dass die Zellbewegung innerhalb der Scheibe wahrscheinlich auf ihre Umlagerung in eine kugelartige Struktur zurückzuführen ist, die einem potenziellen Reorganisationsereignis ähnelt.
Schließlich können die von diesem Assay generierten Live-Bildgebungsdaten verwendet werden, um das Zellverhalten, wie z. B. die Migration, quantitativ zu messen. Einzelne Zellen können detektiert und segmentiert werden (Abbildung 3A), und die Migration kann mit einer handelsüblichen Bildgebungs- und Analysesoftware gemessen werden (siehe Materialtabelle und Video 5). Darüber hinaus kann eine Analyse des nächstgelegenen Objekts durchgeführt werden, um festzustellen, ob Zellen, in diesem Fall Makrophagen, näher an andere Zellen von Interesse, in diesem Fall Krt14CreER-GFP+-Zellen, wandern und wie sich diese Dynamik im Laufe der Zeit ändert (Abbildung 3B).

Abbildung 1: Rekapitulation der In-vivo-Reaktion in präzisionsgeschnittenen Speicheldrüsen-Gewebeschnitten. (A) Schematische Darstellung des Versuchsprotokolls. (B) Repräsentative Bilder von membrangebundenen Tomaten, die aus frischem submandibulärem Drüsengewebe (SMG), unmanipulierten SMG-Schnitten, die 7 Tage lang kultiviert wurden, oder SMG-Schnitten, die 3 oder 7 Tage zuvor mit einer Einzeldosis von 10 Gy Gammabestrahlung bestrahlt wurden. Gestrichelte weiße Linien zeigen Beispiele für azinäre Strukturen, und gestrichelte grüne Linien zeigen Beispiele für duktale Strukturen. Maßstabsbalken = 50 μm. (C) Repräsentative Bilder der Caspase-3/7-Expression, die aus unmanipulierten SMG-Schichten oder SMG-Schichten gewonnen wurden, die 2 h oder 4 Tage zuvor mit einer Einzeldosis von 10 Gy Gammabestrahlung bestrahlt wurden. Grüne Pfeilspitzen zeigen positive Kerne an. Maßstabsbalken = 50 μm. (D) Repräsentative Bilder der γH2AX-Expression, die aus unmanipulierten SMG-Schichten oder SMG-Schichten gewonnen wurden, die 3 Tage zuvor mit einer Einzeldosis von 10 Gy Gamma-Bestrahlung bestrahlt wurden. Maßstabsbalken = 20 μm. (E) Repräsentative Expression von γH2AX in EpCAM+-Epithelzellen aus unmanipulierten SMG-Schnitten oder SMG-Schichten, die 2 h und 3 Tage zuvor mit einer Einzeldosis von 10 Gy Gamma-Bestrahlung bestrahlt wurden. SSA = seitliche Streufläche. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
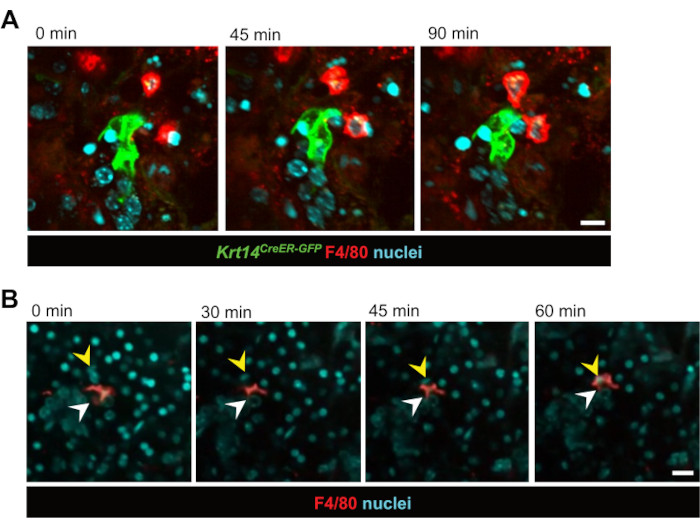
Abbildung 2: Live-Bildgebung von Makrophagen-Epithelzell-Interaktionen und Phagozytose. (A) Sequenzielle Standbilder von Interaktionen zwischen KRT14+-Vorläuferzellen und ihren Nachkommen (Krt14-CreER-GFP+-Zellen) und Makrophagen nach Bestrahlung. Die Bildgebung lebender Zellen erfasst die Zelldynamik über einen Zeitraum von 90 Minuten. Maßstabsbalken = 20 μm. Das zugehörige Video ist Video 1. (B) Sequenzielle Standbilder eines Makrophagen, der eine Epithelzelle phagozytiert. Die Bildgebung lebender Zellen zeigt den Prozess über einen Zeitraum von 60 Minuten. Weiße Pfeile zeigen auf den Makrophagen und gelbe Pfeile zeigen den Zellkern an, der sich in der Phagozytose befindet. Maßstabsbalken = 50 μm. Das zugehörige Video ist Video 2. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
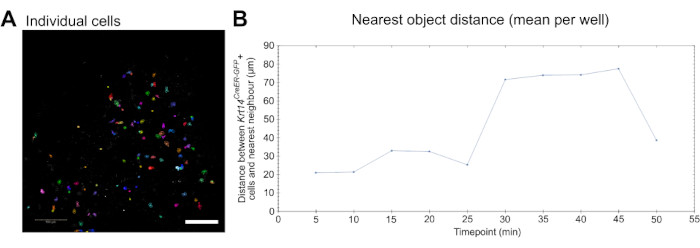
Abbildung 3: Live-Bildgebung für die Analyse der Zelldynamik. (A) Bild zur Veranschaulichung der Identifizierung und Segmentierung einzelner Zellen zur Analyse zellulärer Verhaltensparameter, wie z. B. Migration (siehe Video 5). Die Zellen werden nach dem Zufallsprinzip pseudogefärbt, um einzelne Zellen und Spuren zu unterscheiden. Maßstabsbalken = 100 μm. (B) Quantifizierung des Abstands (in μm) des nächstgelegenen Objekts zu einzelnen Krt14CreER-GFP+-Zellen, aufgetragen über 10 Zeitpunkte (Bilder alle 5 Minuten aufgenommen). Die Daten werden als Mittelwert pro Well dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Live-Bildgebung, die dynamische Interaktionen zwischen KRT14+ Vorläuferzellen/Nachkommen und Makrophagen nach Bestrahlung zeigt. Die Schichten wurden vor der Live-Bildgebung einer einzigen Gamma-Bestrahlungsdosis von 10 Gy ausgesetzt. Krt14CreER-GFP+-Zellen sind in Grün, Makrophagen (F4/80+) in Rot und Zellkerne in Cyan dargestellt. Das Video besteht aus einem einzelnen Z-Stapel, der sich über einen Kulturzeitraum von 12 Stunden erstreckt und alle 15 Minuten aufgenommen wird. Bitte klicken Sie hier, um das Video herunterzuladen.
Video 2: Live-Bildgebung eines Makrophagen, der eine Epithelzelle verschlingt. Makrophagen (F4/80+) sind rot dargestellt, Zellkerne sind cyan dargestellt. Das Video besteht aus einem einzigen Z-Stapel und erstreckt sich über einen Kulturzeitraum von 12 Stunden, wobei alle 15 Minuten Bilder aufgenommen werden.Bitte klicken Sie hier, um das Video herunterzuladen.
Video 3: Live-Bildgebung mit maximaler Projektion, die einen Makrophagen zeigt, der eine Epithelzelle verschlingt. Makrophagen (F4/80+) sind rot und Zellkerne in Cyan dargestellt. Das Video bietet eine maximale Projektion von Z-Stack-Bildern mit einer Gesamtgröße von 80 μm (eine einzelne Ebene ist in Video 2 dargestellt) und umfasst eine Kulturperiode von 12 Stunden, wobei alle 15 Minuten Bilder aufgenommen werden.
Video 4: Live-Bildgebung zur Veranschaulichung des dynamischen Verhaltens des Speicheldrüsenepithels in Kultur nach Bestrahlung. Die Schichten wurden vor der Live-Bildgebung einer einzigen Gamma-Bestrahlungsdosis von 10 Gy unterzogen. Makrophagen (F4/80+) sind in Rot dargestellt, Zellkerne in Cyan. Das Video besteht aus einem einzelnen Z-Stapel, der sich über einen Kulturzeitraum von 12 Stunden erstreckt und alle 15 Minuten aufgenommen wird. Bitte klicken Sie hier, um das Video herunterzuladen.
Video 5: Quantitative Verfolgung der Zellmigration im Zeitverlauf. Dieses Video zeigt die individuelle Verfolgung von Zellspuren aus Live-Imaging-Videos. Pfeile zeigen Zellenspuren an, und Zellen sind einzeln pseudofarben. Das Video besteht aus einem einzigen Z-Stapel und erstreckt sich über eine Kulturperiode von 1 Stunde mit Bildern, die alle 15 Minuten aufgenommen werden.Bitte klicken Sie hier, um das Video herunterzuladen.
Diskussion
Die Möglichkeit, Speicheldrüsengewebe ex vivo zu kultivieren, bietet eine hervorragende Möglichkeit, Zell-Zell-Interaktionen sowohl im Kontext der Homöostase als auch der Verletzungsreaktion zu untersuchen. Obwohl eine intravitale Bildgebung der submandibulären Drüse der Maus möglich ist39,40, hängt diese Technik von der Verwendung fluoreszierender Reportermausmodelle ab, um Zellen von Interesse endogen zu markieren, und muss unter terminaler Anästhesie durchgeführt werden. Hier wird eine Methode beschrieben, um submandibuläre Drüsenschnitte ex vivo zu kultivieren, wobei die zelluläre Architektur und die Zell-Zell-Interaktionen erhalten bleiben. Dieser Ansatz verfeinert aktuelle Live-Imaging-Techniken und bietet eine Alternative zur intravitalen Bildgebung.
Die langfristige Erhaltung des Gewebes mit dieser Technik beruht auf der Kultivierung von Schnitten an einer Luft-Flüssigkeits-Grenzfläche. Frühere Explantat-Modelle26,41 haben wahrscheinlich nur wenige Tage lang eine erfolgreiche Kultur erreicht, weil sie in Medien getaucht und im Wesentlichen "erstickt" wurden. Im Gegensatz dazu erhält die Verwendung eines Luft-Flüssigkeits-Grenzflächenkultursystems die Gesundheit und Struktur des Gewebes über einen längeren Zeitraum und gewährleistet eine qualitativ hochwertige Bildgebung. Die Methode, SMG-Schichten vor der Bildgebung mit einer kleinen Menge an Medien und in einer Kammer mit begrenztem Platz zu montieren, um die Schicht flach zu halten, ist ein wesentlicher Bestandteil des Erfolgs der Technik. Die Visualisierung der Zellen in diesem Assay hängt von endogen markierten Reportermäusen oder fluoreszenzkonjugierten Antikörpern ab. Die Fülle an transgenen fluoreszierenden Reportermausmodellen und konjugierten Antikörpern, die auf bestimmte Zelltypen und Untergruppen abzielen, macht diese Methode geeignet, um verschiedene zellspezifische Interaktionen zu untersuchen.
Während diese Methode ein gutes Modell von Gewebe in situ liefert und eine ex vivo Bestrahlungsverletzung zu einer azinären und duktalen Strukturatrophie führt, ähnlich wie in vivo13, können einige Elemente nicht ex vivo rekapituliert werden. Dazu gehören das Fehlen eines funktionierenden Gefäß- und neuronalen Inputs sowie das Fehlen von infiltrierenden Entzündungszellen. Angesichts der gut dokumentierten Rolle von Blutgefäßen und Nerven bei der Homöostase und Regeneration der Speicheldrüsen26,42 und der Bedeutung von wandernden Immunzellen43, wie T- und B-Zellen, für die Speicheldrüsenfunktion, die Verletzungsreaktion, die Infektion und die Pathogenese des Sjögren-Syndroms (SS) (wie in44 überprüft), kann dieser Assay einige wichtige zelluläre Interaktionen übersehen. Darüber hinaus können sehr schnelle Migrationsereignisse, wie z. B. die Bewegung der natürlichen Killerzelle (NK)45 und der dendritischen Zelle (DC)46, durch die Bildgebung alle 15 Minuten übersehen werden. Die Bildgebungsintervalle können jedoch optimiert werden, um die spezifischen Zell-Zell-Interaktionen von Interesse zu untersuchen, und die Fähigkeit, durch Z-Stapel in 3 Dimensionen abzubilden, ermöglicht die Beurteilung der 3D-Zellbewegung. Die sichere Befestigung des Gewebes während der Bildgebung ist entscheidend für die Quantifizierung, wie z. B. Zellverfolgungsmessungen. Obwohl in dieser Studie Mausgewebe verwendet wurde, bietet das Protokoll eine praktikable Methode zur Untersuchung von Zell-Zell-Interaktionen in menschlichen Speicheldrüsen, die wertvolle translationale Informationen generiert, die mit anderen Methoden nicht erreichbar sind.
Während die Rolle von geweberesidenten Makrophagen bei der Homöostase und Regeneration in mehreren Geweben nachgewiesen wurde 2,10,11,12, bleibt ihre Rolle in den Speicheldrüsen weitgehend unbeantwortet. Obwohl bekannt ist, dass Makrophagen für die Regeneration des Epithels nach einer Bestrahlungsverletzung unerlässlich sind13, sind die genauen Mechanismen, die diesem Effekt zugrunde liegen, noch unbekannt. Die Live-Bildgebung von Speicheldrüsenschnitten ermöglicht die Visualisierung und Analyse komplexer Gewebedynamiken in Echtzeit, die bei der herkömmlichen konfokalen Bildgebung oft übersehen werden. Darüber hinaus ist es offensichtlich, dass Makrophagen dynamische Formänderungen erfahren, während sie verschiedene Funktionen in vivo ausführen 47,48,49, und dieses Protokoll bietet wahrscheinlich eine bessere Darstellung dieser Veränderungen als eine typische statische Ansicht in fixiertem Gewebe. Zukünftige Studien können diese Technik nutzen, um zu untersuchen, wie sich die Zell-Zell-Kommunikation im Verlauf von Homöostase, Verletzung und Regeneration/Auflösung verändert. Dieser Ansatz wird nützlich sein, um wichtige Signalwege und Ereignisse aufzuklären, die letztendlich einen therapeutischen Nutzen bieten könnten.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
SE wird durch den Wellcome Trust Grant 108906/Z/15/Z finanziert; EE wird durch das UKRI/MRC-Stipendium MR/S005544/1 und durch ein Chancellor's Fellowship der University of Edinburgh finanziert. Abbildung 1A wird mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.4 µm filter cell culture inserts (Nunc) | Avantor/VWR | 734-2240 | Inserts pre-packed in 6-well multidishes, 20 mm × 25 mm |
| 24 well plate | Corning | 3524 | |
| 35 mm dish | Falcon | 353001 | |
| 6 well plate | Corning | 3516 | |
| Coverslips | Paul Marienfeld GmbH & Co. KG | 111650 | Deckglaser Cover Glasses 25 mm diameter |
| Double-sided sticker | Grace Bio-Labs | 654004 | SecureSeal Imaging Spacers SS1 x 13, 13 mm diameter x 0.12 mm depth, 25 mm x 25mm OD |
| EtOH | Scientific Laboratories Supplies | CHE1924 | Absolute ethanol (EtOH) AR, 99.7% |
| F4/80 antibody | Invitrogen | 17-4801-82 | F4/80 Monoclonal Antibody (BM8), APC, eBioscience |
| Forceps | Fine Science Tools | 91113-10 | Student Fine Forceps Straight Broad Shanks |
| Glass bottom 6 well plate | Cellvis | P06-1.5H-N | 6 well glass bottom plate with high performance #1.5 cover glass |
| Hanks Balanced Salt Solution (HBSS) | Life Technologies | 14025050 | +calcium +magnesium, no phenol red |
| Hoechst | Sigma Aldrich | 14533 | Alternative name: bisBenzimide H 33342 trihydrochloride |
| Ice box | Fisher Scientific | 11339623 | Azlon Polyurethane Ice Buckets with Lid |
| Imaging and analysis software | Harmony | ||
| Low Melting Agarose | Merck | A9414-25G | |
| Paintbrush | Watercolour brush, 10 mm x 2mm tip | ||
| Penicillin-Streptomycin | Sigma Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered |
| Phosphate Buffered Saline (PBS) | Life Technologies | 20012027 | |
| RPMI | ThermoFisher | 12634010 | Gibco Advanced DMEM/F-12 |
| Scalpel | Swann-Morton | Disposable scalpels, No. 11 blade | |
| Scissors | Fine Science Tools | 14088-10 | Extra Narrow Scissors 10.5 cm |
| Shepherd Mark-I-68A 137Cs irradiator | JL Shepherd & Associates | ||
| Superglue | Bostik | Multi-purpose superglue, fast setting, ultra strong | |
| Vibratome | Leica | Leica VT 1000 S | |
| Vibratome blades | Astra | Superior Platinum Double Edge blade | |
| Wild-type (C57BL/BJ) mice | Charles River |
Referenzen
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Lucas, T., et al. Differential roles of macrophages in diverse phases of skin repair. J Immunol. 184 (7), 3964-3977 (2010).
- Duffield, J. S., et al. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair. J Clin Invest. 115 (1), 56-65 (2005).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat Immunol. 17 (1), 34-40 (2016).
- Mass, E., Nimmerjahn, F., Kierdorf, K., Schlitzer, A. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nat Rev Immunol. 23 (9), 563-579 (2023).
- Dick, S. A., et al. Three tissue resident macrophage subsets coexist across organs with conserved origins and life cycles. Sci Immunol. 7 (67), (2022).
- Hassel, C., Gausserès, B., Guzylack-Piriou, L., Foucras, G. Ductal macrophages predominate in the immune landscape of the lactating mammary gland. Front Immunol. 12, 754661(2021).
- Kolter, J., et al. A subset of skin macrophages contributes to the surveillance and regeneration of local nerves. Immunity. 50 (6), 1482-1497 (2019).
- Dawson, C. A., et al. Tissue-resident ductal macrophages survey the mammary epithelium and facilitate tissue remodelling. Nat Cell Biol. 22 (5), 546-558 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- McKendrick, J. G., et al. CSF1R-dependent macrophages in the salivary gland are essential for epithelial regeneration after radiation-induced injury. Sci Immunol. 8 (89), doi:10.1126/sciimmunol.add4374 eadd4374(2023).
- Muntjewerff, E. M., Meesters, L. D., vanden Bogaart, G. Antigen cross-presentation by macrophages. Front Immunol. 11, 1276(2020).
- Bissonnette, E. Y., Lauzon-Joset, J. F., Debley, J. S., Ziegler, S. F. Cross-talk between alveolar macrophages and lung epithelial cells is essential to maintain lung homeostasis. Front Immunol. 11, 583042(2020).
- Xue, Q., et al. Analysis of single-cell cytokine secretion reveals a role for paracrine signaling in coordinating macrophage responses to TLR4 stimulation. Sci Signal. 8 (381), (2015).
- McArdle, S., Mikulski, Z., Ley, K. Live cell imaging to understand monocyte, macrophage, and dendritic cell function in atherosclerosis. J Exp Med. 213 (7), 1117-1131 (2016).
- Gurevich, D. B., et al. Live imaging of wound angiogenesis reveals macrophage orchestrated vessel sprouting and regression. Embo j. 37 (13), (2018).
- Meziani, L., et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages. Eur Respir J. 51 (3), (2018).
- Bickelhaupt, S., et al. Effects of CTGF blockade on attenuation and reversal of radiation-induced pulmonary fibrosis. J Natl Cancer Inst. 109 (8), (2017).
- Formenti, S. C., Demaria, S. Systemic effects of local radiotherapy. Lancet Oncol. 10 (7), 718-726 (2009).
- Chambers, M. S., Garden, A. S., Kies, M. S., Martin, J. W. Radiation-induced xerostomia in patients with head and neck cancer: pathogenesis, impact on quality of life, and management. Head Neck. 26 (9), 796-807 (2004).
- Radfar, L., Sirois, D. A. Structural and functional injury in minipig salivary glands following fractionated exposure to 70 Gy of ionizing radiation: an animal model for human radiation-induced salivary gland injury. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 96 (3), 267-274 (2003).
- Grehn, A. L., Gustafsson, H., Franzén, L., Thornell, L. E., Henriksson, R. Ultrastructural morphometry of parotid acinar cells following fractionated irradiation. Oral Oncol. 33 (1), 23-28 (1997).
- Rocchi, C., Emmerson, E. Mouth-watering results: clinical need, current approaches, and future directions for salivary gland regeneration. Trends Mol Med. 26 (7), 649-669 (2020).
- Emmerson, E., et al. Salivary glands regenerate after radiation injury through SOX2-mediated secretory cell replacement. EMBO Mol Med. 10 (3), 8051(2018).
- May, A. J., et al. Diverse progenitor cells preserve salivary gland ductal architecture after radiation-induced damage. Development. 145 (21), (2018).
- Knox, S. M., et al. Parasympathetic stimulation improves epithelial organ regeneration. Nat Commun. 4, 1494(2013).
- Mizrachi, A., et al. Radiation-induced microvascular injury as a mechanism of salivary gland hypofunction and potential target for radioprotectors. Radiat Res. 186 (2), 189-195 (2016).
- Friedrich, R. E., Bartel-Friedrich, S., Holzhausen, H. J., Lautenschläger, C. The effect of external fractionated irradiation on the distribution pattern of extracellular matrix proteins in submandibular salivary glands of the rat. J Craniomaxillofac Surg. 30 (4), 246-254 (2002).
- Vasioukhin, V., Degenstein, L., Wise, B., Fuchs, E. The magical touch: genome targeting in epidermal stem cells induced by tamoxifen application to mouse skin. Proc Natl Acad Sci U S A. 96 (15), 8551-8556 (1999).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Gilman, K. E., et al. P2X7 receptor deletion suppresses γ-radiation-induced hyposalivation. Am J Physiol Regul Integr Comp Physiol. 316 (5), R687-R696 (2019).
- Ren, J., et al. Radioprotective effects and mechanism of HL-003 on radiation-induced salivary gland damage in mice. Sci Rep. 12 (1), 8419(2022).
- Marmary, Y., et al. Radiation-induced loss of salivary gland function is driven by cellular senescence and prevented by IL6 modulation. Cancer Res. 76 (5), 1170-1180 (2016).
- Chang, S., et al. Inorganic nitrate alleviates total body irradiation-induced systemic damage by decreasing reactive oxygen species levels. Int J Radiat Oncol Biol Phys. 103 (4), 945-957 (2019).
- Varghese, J. J., et al. Localized delivery of amifostine enhances salivary gland radioprotection. J Dent Res. 97 (11), 1252-1259 (2018).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. gammaH2AX: a sensitive molecular marker of DNA damage and repair. Leukemia. 24 (4), 679-686 (2010).
- Takano, T., et al. Highly localized intracellular Ca(2+) signals promote optimal salivary gland fluid secretion. Elife. 10, (2021).
- Ficht, X., Thelen, F., Stolp, B., Stein, J. V. Preparation of murine submandibular salivary gland for upright intravital microscopy. J Vis Exp. 135, (2018).
- O'Dell, N. L., Sharawy, M. H., Schuster, G. S. Effects of in vivo single and multiple isoproterenol injections on subsequently explanted submandibular glands. Acta Anat (Basel. 105 (4), 431-438 (1979).
- Lombaert, I. M., et al. Cytokine treatment improves parenchymal and vascular damage of salivary glands after irradiation). Clin Cancer Res. 14 (23), 7741-7750 (2008).
- Stolp, B., et al. Salivary gland macrophages and tissue-resident CD8(+) T cells cooperate for homeostatic organ surveillance. Sci Immunol. 5 (46), 4371(2020).
- Verstappen, G. M., Pringle, S., Bootsma, H., Kroese, F. G. M. Epithelial-immune cell interplay in primary Sjögren syndrome salivary gland pathogenesis. Nat Rev Rheumatol. 17 (6), 333-348 (2021).
- Vanherberghen, B., et al. Microwell-based live cell imaging of NK cell dynamics to assess heterogeneity in motility and cytotoxic response. Methods Mol Biol. 1441, 87-106 (2016).
- de Winde, C. M., Munday, C., Acton, S. E. Molecular mechanisms of dendritic cell migration in immunity and cancer. Med Microbiol Immunol. 209 (4), 515-529 (2020).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Paterson, N., Lämmermann, T. Macrophage network dynamics depend on haptokinesis for optimal local surveillance. Elife. 11, (2022).
- Lim, K., et al. In situ neutrophil efferocytosis shapes T cell immunity to influenza infection. Nat Immunol. 21 (9), 1046-1057 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten