Method Article
唾液腺における細胞間相互作用の Ex Vivo Live Cell Imaging(英語)
要約
免疫蛍光イメージングは、複雑で時間依存の生物学的プロセスを1つのスナップショットで観察する能力に制約があります。この研究は、精密にカットされたマウスの顎下腺スライスで実施されたライブイメージングアプローチの概要を説明します。このアプローチにより、ホメオスタシス中の細胞間相互作用や再生・修復の過程をリアルタイムで観察することができます。
要約
唾液腺の再生は、さまざまな細胞タイプ間の複雑な相互作用を含む複雑なプロセスです。最近の研究では、マクロファージが再生応答の駆動に果たす極めて重要な役割に光が当てられています。しかし、この重要な役割についての私たちの理解は、主に固定組織生検から得られた静的な見解に依存していました。この制限を克服し、これらの相互作用に関する洞察をリアルタイムで得るために、この研究では、唾液腺組織 をex vivo で培養し、細胞遊走のライブ画像をキャプチャするための包括的なプロトコルの概要を説明します。
プロトコルは複数の主ステップを含む: 最初に、マウスの顎下唾液腺のティッシュはビブラトームを使用して注意深くスライスされ、次に気液体インターフェイスで培養される。これらのスライスは、例えば放射線への曝露によって意図的に損傷し、細胞の損傷を誘発し、再生反応を引き起こす可能性があります。目的の特定の細胞を追跡するために、特定のタンパク質が緑色蛍光タンパク質(GFP)でマークされている遺伝子改変マウスから採取した唾液腺組織を利用するなどして、内因的に標識することができます。あるいは、蛍光標識抗体を使用して、目的の特定の細胞表面マーカーを発現する細胞を染色することもできます。準備が完了すると、唾液腺スライスは、12時間にわたってハイコンテント共焦点イメージングシステムを使用してライブイメージングにかけられ、画像は15分間隔で撮影されます。次に、得られた画像をコンパイルしてムービーを作成し、その後、それを分析して貴重な細胞挙動パラメータを抽出できます。この革新的な方法は、損傷後の唾液腺内のマクロファージ相互作用を調査し、よりよく理解するための強力なツールを研究者に提供し、それによって、このダイナミックな生物学的状況において作用する再生プロセスに関する知識を深めます。
概要
マクロファージは、再生と修復の過程においてますます重要な役割を担うことが示されており、古典的な免疫機能を超えて広がっています1,2。実際、マクロファージは再生に関連する多くのプロセスに関与しており、修復のすべての段階で重要な調節活性を示し、瘢痕形成や線維化も示しています3,4。組織常在マクロファージは、多様な細胞表現型を駆動する複雑なメカニズムを持つ非常に不均一な細胞型であり、臓器の発生、機能、および恒常性に不可欠な役割を果たします(5でレビュー)。組織に常在するマクロファージは、最初は卵黄嚢と胎児の肝臓の前駆体から発生し、その後、既存のマクロファージの寿命とそれらが存在する組織またはニッチに応じて、さまざまな速度で増殖または骨髄由来の血液単球に置き換えられます6,7。
重要なことは、組織に常在するマクロファージがすべての組織に分散し、多様な臓器機能に寄与していることです。それらは、ニッチ固有の機能を実行するために、微小環境によって独自にプログラムされています。このため、組織内のマクロファージの局在は、肺、乳腺、腸、皮膚、および筋肉で観察されたユニークな集団で、それらの機能に関する洞察を提供します8,9,10。乳腺の発達中、乳管マクロファージは乳管樹と密接に関連しており、それらの枯渇は枝分かれの有意な減少をもたらす11。さらに、マクロファージは思春期の形態形成や妊娠中の肺胞形成に必要であり、上皮を活発に監視しています。筋肉損傷では、マクロファージの特定の集団が損傷部位内に「住み着き」、幹細胞の増殖に必要な増殖誘導の手がかりを供給する一時的なニッチを提供します。したがって、それらは修復プロセスを支配する上で異なるマクロファージ集団の特殊な役割を示しています2。肺では、間質性マクロファージがインターロイキン(IL)-R1を発現する肺胞II型(AT2)細胞をプライミングし、IL-1Bの放出を介して損傷関連一過性前駆細胞に変換するという同様の現象が起こります12。さらに、最近の研究では、被曝傷害後のマウス顎下唾液腺(SMG)の再生にマクロファージが必須であり、マクロファージが存在しないと上皮再生が阻害されることが明らかになっています13。まとめると、このデータは、組織損傷後および恒常性維持中の一過性炎症性ニッチにおけるマクロファージの活性化と機能の重要性を強調しています。
マクロファージは活性細胞であり、その機能には、細胞間の直接的な接触14,15や、ニッチな調節に不可欠な可溶性因子の分泌2,16などのより間接的な方法など、さまざまな細胞タイプとの相互作用が含まれます。古典的な免疫蛍光イメージングは、これらの相互作用の解明を開始するのに有用であるが、それは時間内の単一のスナップショットのみを描写することによって制限され、それによって高度に動的な再生プロセスに重要な多数の時点を省略する17,18。タイミングの重要性と再生のさまざまな波の出現がより鮮明になるにつれて、これらのプロセスをより詳細に分析することが不可欠です。
放射線治療は、がんと診断された多くの人にとって命を救う治療法です。放射線療法は、腫瘍の縮小や除去に効果的であることが多い一方で、放射線野に横たわる健康な組織を損傷し、免疫反応を誘発することもあります。放射線障害は、急速なマクロファージの動員、および直接的および間接的な免疫調節反応を誘発する可能性があります19,20。頭頸部がんの治療中に唾液腺に不注意で照射されることが多く21,22、上皮損傷、細胞萎縮、線維症23,24を引き起こし、口腔乾燥症や慢性口渇25を引き起こします。
唾液腺は、上皮細胞(唾液を産生する腺房細胞と唾液を輸送する乳管細胞の両方)、筋上皮細胞、上皮前駆細胞、神経、血管、免疫細胞、線維芽細胞、細胞外マトリックス(ECM)など、多数の細胞の種類と構造で構成されています。再生応答におけるこれらの細胞型の多くの役割と応答は、以前に説明されています26、27、28、29、30。しかし、これらの異なる細胞がホメオスタシスと再生の間にどのように相互作用するか、特にマクロファージなどの免疫細胞がどのように振る舞うかについては、あまりよく研究されていません。この原稿では、SMGマクロファージと ex vivo 組織内の他の目的細胞との間の生きた相互作用を研究するために新たに確立された方法について説明しています。SMGはビブラトームでスライスされ、表面マーカーのために染色され、最大12時間画像化されます。この方法を用いることで、マクロファージによる周辺細胞の貪食を観察し、マクロファージ遊走速度を研究し、マクロファージと上皮細胞との直接的な細胞間相互作用を示すことができます。
プロトコル
すべての手続きは英国内務省によって承認され、PPL PB5FC9BD2およびPP0330540の下で実施されました。すべての実験は、ARRIVEガイドラインとエジンバラ大学のガイドラインに沿っています。
野生型マウスを市販品として入手した( 資料表参照)。 Krt14CreERです。 R26mTmG マウスは、 Krt14CreER/+ マウス31 とR26mTmG/mTmG マウス32を交配して、ハウスで飼育した。すべての実験で、8〜10週齢の雌マウスを使用しました。
1. SMGの収集と埋め込み
- マウス/マウスを二酸化炭素(CO2)濃度の上昇にさらして安楽死させます。その後、切開部に70%エタノール(EtOH)をスプレーし、ハサミと鉗子を使用して周囲の組織からSMGを慎重に解剖します(図1A)。鉗子を使用して脂肪組織と結合組織を取り除き、氷冷したハンクス平衡塩溶液(HBSS、 材料表を参照)を含む収集チューブに腺を入れます。
- 鉗子を使用して、腺をそれぞれ約1 cm2 の小片に分離します。
- 4%アガロースを50°Cに加熱し、35mmのディッシュに直接注ぎます。
- 少量の溶融した50°Cアガロースを別の皿に注ぎ、余分なアガロースの中で腺を動かして腺を完全にすすいでください。
注意: この手順は、腺から余分な液体を取り除くために必要です。液体が多すぎると、腺がアガロースに適切に付着しなくなる可能性があります。 - 腺の4〜6個の断片をアガロースに配置し、それらが平らで同じ平面にあることを確認します(図1A)。
注意: 腺が寒天の表面またはプレートの底に触れていないことを確認してください。 - 35mmの皿に蓋をしてアイスボックスに移し、プレートを氷で覆います。
- アガロースが固まるまで5〜10分待ちます。
2. セクショニング
- メスを使用して腺に埋め込まれたアガロースブロックの周りを慎重に切断し、組織を含むブロックを皿から取り除きます。.約5mmの境界線を残します。
- アガロースブロックをビブラトームのステージ( 材料表を参照)に瞬間接着剤を一滴垂らし、ブロックの底面全体が瞬間接着剤に接触するように取り付けます。
- 瞬間接着剤を約5分間固めます。次に、1%ペニシリン-ストレプトマイシン(P / S)を含む氷冷した1xリン酸緩衝生理食塩水(PBS)でビブラトームチャンバーを満たします。
- ビブラトームチャンバーの側面と底の両方に氷を追加します。
注意: 非常に寒い環境を維持し、必要に応じて氷を交換してください。 - 余分なアガロースを切り取り、メスで切開して各腺の間に5mmの隙間を作ります。これにより、個々のスライスが生成されます。
- ビブラトームブレードをアガロースブロックの面に合わせ、切片の始点と終点を設定して、希望のスライスの厚さを実現します。
- 切断プロセスを開始する前に、ブレードがブロックに接触していないことを確認してください。この予防措置により、アガロースの大きな破片を誤って切断したり、サンプルの一部を紛失したりするのを防ぐことができます。
- 低速および高振動(たとえば、各パラメータのスケール1〜10で速度3、振動設定8〜10)で厚さ150μmの切断セクション(図1A)。
- 切片を切断して周囲のPBSに放出したら、絵筆を使用して切片を収集し、P/Sで予め温めたロズウェルパーク記念研究所(RPMI)培地を含む皿に入れます。
3. SMGスライスの培養と染色
- 培養
- 0.4 μm フィルターを含む 6 ウェルプレートの各ウェルに 1.5 mL の RPMI 培地を添加します。フィルターの下に気泡が閉じ込められていないことを確認してください。
- スライスを壊さないように注意しながら、絵筆を使用して各フィルターに1〜6スライスを移します。
メモ: スライスが用紙に浸かっているのではなく、フィルターに浮いていることを確認します。完全に水没すると、培養中に窒息する可能性があります。 - 37°Cで5%CO2でインキュベートし、3日ごとに培地を交換します(図1A)。
- 市販の照射器を用いて、10Gyのガンマ線を単回照射する実験プレートを照射する( 材料表参照)。その後、インキュベーターに戻します。
- ライブイメージングのための染色
- 絵筆を使用して、スライスをフィルターからそっと持ち上げ、ウェルあたり500 μLの培地を含む24ウェルプレートに入れ、スライスを水没させます。
- 関連する標識抗体および核染色剤( 材料表を参照)を適切な濃度で培地に添加します27。
- スライスを抗体とともに37°Cで2時間、穏やかに撹拌しながらインキュベートします。
- スライスを培地に浸し、穏やかに撹拌しながら37°Cで10分間の洗浄を3回行って洗浄します。
4. 取り付けとライブイメージング
- 鉗子を使用して、両面イメージングスペーサーの片側からテープをはがし、粘着面を下にしてガラス底の6ウェルプレートの底に接着します。
- 50 μLの培地をスペーサー中央の隙間にピペットで入れます。
- 絵筆を使ってスライスをメディアに入れ、気泡が閉じ込められていない平らな状態にします。
- ピペットを使用して、ギャップから20 μLの培地を慎重に取り除きます。
- 鉗子を使用してスペーサーの上面からテープをはがし、その上に25mmの円形カバーガラスを置きます。スペーサーの端を押してカバーガラスがしっかりと取り付けられるようにし、力を入れすぎてカバーガラスが壊れないように注意してください(図1A)。
- 共焦点顕微鏡で、必要な期間または間隔でスライスを画像化します(例:20倍の水対物レンズを使用して、15分ごとに12時間)。
結果
顎下唾液腺の損傷に対するマクロファージの応答は不明のままです。これには、腺内の特定の構造に局在して移動するかどうか、および移動する距離と速度が含まれます。これは、静的イメージングアプローチでは判断が困難でした。
これに対処するために、マクロファージと上皮細胞の相互作用をリアルタイムで研究するためのライブイメージングアプローチが開発されました。スライスの免疫蛍光染色は、内在的に標識された系統追跡マウスモデルと組み合わせました(図1A および 図2A)。このモデルでは、スライスを10Gyのガンマ線照射に曝露して照射傷害を誘発し、照射後2時間、3日後、4日後に画像化(IR)し、非照射スライスを対照とした。データは、Hoechst(光毒性を最小限に抑えるためにレーザー425を使用)、GFP(488)、dTomato(561)、およびAlexa 647(640)の4つのチャネルから取得しました。zスタックを行い、2〜3μmごとに画像を撮影し、合計30〜40面を収集することで、全高80〜90μmとした。
この手法を用いて、膜結合型トマト(mT)シグナルとカスパーゼ3/7活性を解析したところ、器官型スライスは上皮構造を保持し、培養中で生存し、細胞死が最小限に抑えられることが明らかになりました。このデータは、7日間培養したR26mTmGマウス32の顎下腺の非照射スライスが、mTシグナルと上皮構造を保持していることを示しました(図1B)。しかしながら、ex vivo照射の3日後には、腺房および乳管細胞の萎縮が明らかであり(図1B;腺房構造および乳管構造は、それぞれ白と緑の破線で強調表示されている)、in vivo放射線傷害と一致した13。アポトーシスは、非照射スライスではごくわずかであったが、照射後4日目には、照射スライスにカスパーゼ3/7+細胞の証拠が見られ(図1C;緑色の矢印)、in vivo傷害33,34と同様であった。さらに、照射されたスライスは、照射されていない対照と比較してγH2AX38の上昇によって示されるように、in vivo DNA損傷34、35、36、37を再現しました(図1D、E)。したがって、器官型唾液腺切片は培養中で良好な生存率を示し、放射線照射に対してin vivo組織と同様に応答した。
これに続いて、リアルタイムの細胞間相互作用が調査されました。GFP標識上皮前駆細胞(Krt14CreER-GFP)と直接相互作用するマクロファージを、IR後3日目の12時間にわたって観察しました(図2A および ビデオ1)。驚くべきことに、マクロファージは上皮前駆細胞に何時間も接近し、しばしば12時間のイメージング期間全体にわたって接触していることが明らかになりました。さらに、マクロファージによる上皮細胞のリアルタイム貪食が観察され、マクロファージがスライス培養モデルにおいて従来の機能を果たしていることが確認されました(図2B、 動画2 、 動画3)。また、この手法により、マクロファージはホメオスタシス中も放射線損傷後も比較的静止していることが同定されましたが、これはおそらく組織内での高密度によるものと考えられます。これは、唾液腺マクロファージが恒常性維持中や照射損傷後に広範囲に遊走しないことを初めて実証した。しかし、マクロファージは有意な移動を示さなかったが、周囲の組織は照射後に動態の増加を示し、複数のマクロファージが標識上皮細胞のクラスターの周りで活発に相互作用した。さらに、核染色のみに基づいて、この手法により、経時的にスライス内の細胞の動きを視覚化することができ、多くの場合、管全体が組織内で「移動」しているように見えます(ビデオ4)。培養の過程で時間の経過とともに、スライスが平らな形状から回転楕円体のような形態にシフトすることが明らかになり、スライス内の細胞の動きは、潜在的な再編成イベントに似た球状構造への再配列によるものである可能性が高いことが示唆されました。
最後に、このアッセイによって生成されたライブイメージングデータを使用して、遊走などの細胞挙動を定量的に測定できます。個々の細胞を検出してセグメント化し(図3A)、市販のイメージングおよび解析ソフトウェアを使用して移動を測定できます( 材料表 および ビデオ5を参照)。さらに、最近傍物解析を行うことで、細胞(この場合はマクロファージ)が他の目的細胞(この場合は Krt14CreER-GFP+細胞)に接近するかどうか、およびこの動態が経時的にどのように変化するかを判断することができます(図3B)。

図1:精密に切断された唾液腺組織切片におけるin vivo応答の再現。(A)実験プロトコルの概略図。(B)新鮮な顎下腺(SMG)組織、7日間培養した未操作のSMGスライス、または3日または7日前に10Gyガンマ線を単回照射したSMGスライスから得られた膜結合トマトの代表的な画像。白の破線はアシナ構造の例を示し、緑の破線はダクト構造の例を示す。スケールバー = 50 μm。 (C)2時間前または4日前に10Gyガンマ線を単回照射した未操作のSMGスライスまたはSMGスライスから得られたカスパーゼ-3/7発現の代表画像。緑色の矢印は正の原子核を示します。スケールバー = 50 μm。 (D)3日前に10Gyガンマ線を単回照射した未操作のSMGスライスまたはSMGスライスから得られたγH2AX発現の代表画像。スケールバー = 20 μm。 (E)2時間前と3日前に10Gyガンマ線を単回照射した未操作SMGスライスまたはSMGスライスからのEpCAM+上皮細胞におけるγH2AXの代表的な発現。SSA = 側方散乱領域。この図の拡大版をご覧になるには、ここをクリックしてください。
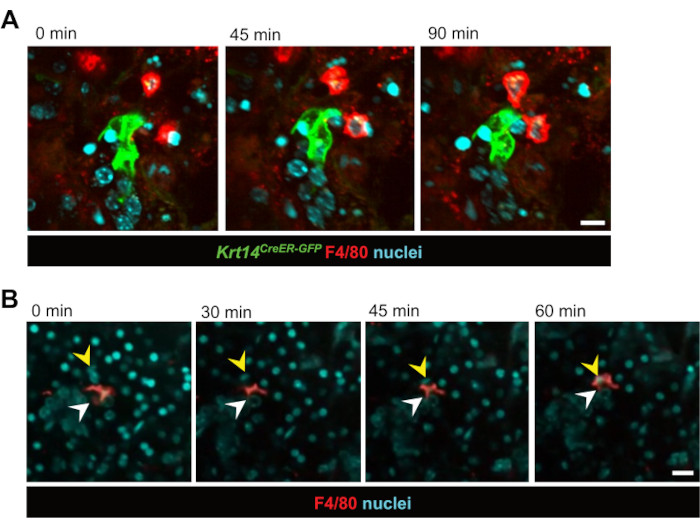
図2:マクロファージ-上皮細胞相互作用と食作用のライブイメージング。 (A)照射後のKRT14+前駆細胞とその子孫(Krt14CreER-GFP+細胞)とマクロファージとの相互作用の連続静止画。ライブセルイメージングは、90分間の細胞動態を捉えます。スケールバー = 20 μm。関連ビデオは ビデオ 1 です。(B)上皮細胞を貪食するマクロファージの連続静止画。ライブセルイメージングは、60分間のプロセスを示します。白い矢印はマクロファージを指し、黄色の矢印は貪食を受けている細胞の核を示しています。スケールバー = 50 μm。関連ビデオは ビデオ 2 です。 この図の拡大版をご覧になるには、ここをクリックしてください。
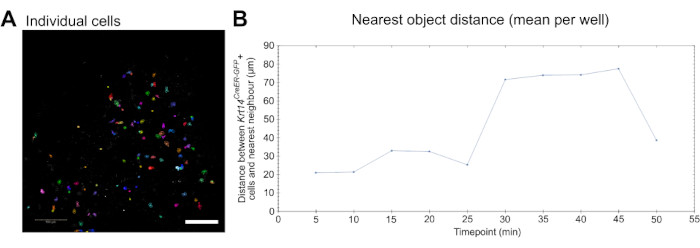
図3:細胞動態解析のためのライブイメージング。 (A)遊走などの細胞挙動パラメータを解析するための個々の細胞の同定とセグメンテーションを示す画像( ビデオ5を参照)。細胞は、個々の細胞とトラックを区別するためにランダムに疑似色付けされます。スケールバー = 100 μm。 (B)10の時点(5分ごとに撮影された画像)をプロットした、個々の Krt14CreER-GFP+細胞に最も近い物体までの距離(μm単位)の定量化。ウェルあたりの平均値として表示されるデータ。 この図の拡大版をご覧になるには、ここをクリックしてください。
ビデオ1:照射後のKRT14+前駆細胞/子孫とマクロファージの間の動的相互作用を明らかにするライブイメージング。スライスは、ライブイメージングの前に10Gyのガンマ線を1回照射した。 Krt14CreER-GFP+細胞は緑色、マクロファージ(F4/80+)は赤色、核はシアンで表されています。このビデオは、12時間の培養期間にわたる単一のzスタックで構成されており、15分ごとに画像が撮影されています。
動画2:上皮細胞を包み込むマクロファージを捉えたライブイメージング。マクロファージ(F4/80+)は赤色、核はシアンで示しています。ビデオは単一のzスタックで構成され、12時間の培養期間にまたがり、15分ごとに撮影された画像があります。
ビデオ3:上皮細胞を包み込むマクロファージを示す最大投影ライブイメージング。マクロファージ(F4/80+)は赤色、核はシアンで表示しています。このビデオは、最大80μmのzスタック画像を投影し( ビデオ2では1つの平面を提示)、12時間の培養期間にまたがり、15分ごとに画像を撮影しています。
動画4:放射線照射後の培養における唾液腺上皮の動的挙動を示すライブイメージング。スライスは、ライブイメージングの前に10Gyのガンマ線を1回照射した。マクロファージ(F4/80+)は赤色、核はシアンで表されます。このビデオは、12時間の培養期間にわたる単一のzスタックで構成されており、15分ごとに画像がキャプチャされています。
動画5:経時的な細胞遊走の定量的追跡。このビデオでは、ライブイメージングビデオから細胞の痕跡を個別にトレースする方法を紹介します。矢印はセルの軌跡を示し、セルは個別に擬似色付けされます。ビデオは単一のzスタックで構成され、15分ごとに撮影された画像で1時間の培養期間にまたがっています。
ディスカッション
唾液腺組織をex vivoで培養する能力は、ホメオスタシスと損傷応答の両方の文脈で細胞間相互作用を研究する絶好の機会を提供します。マウス顎下腺の生体内イメージングは実現可能であるが39,40、この技術は、蛍光レポーターマウスモデルを使用して目的の細胞を内因的に標識することに依存しており、終末麻酔下で実施する必要があります。ここでは、細胞構造と細胞間相互作用を維持しながら、ex vivoで顎下腺スライスを培養する方法について説明する。このアプローチは、現在のライブイメージング技術を改良し、生体内イメージングに代わるものを提供します。
この技術を用いた組織の長期維持は、空気と液体の界面でのスライスの培養に依存しています。以前の外植体モデル26,41は、培地に浸かり、本質的に「窒息」したため、わずか数日間で培養に成功した可能性があります。対照的に、空気-液体界面培養システムの使用は、組織の健康と構造を長期間維持し、高品質のイメージングを保証します。イメージング前にSMGスライスを少量の培地で、スペースが限られたチャンバー内にマウントしてスライスを平らに保つ方法は、この技術の成功に不可欠です。このアッセイにおける細胞の可視化は、内在的に標識されたレポーターマウスまたは蛍光標識抗体に依存します。この分析法は、特定の細胞タイプおよびサブセットを標的とするトランスジェニック蛍光レポーターマウスモデルおよび標識抗体が豊富にあるため、さまざまな細胞特異的相互作用の探索に適しています。
この方法は、in vivoで発生するものと同様に、in situおよびex vivo照射傷害が腺房および管構造の萎縮をもたらす組織の優れたモデルを提供します13、一部の要素はex vivoで再現できません。これらには、機能している血管系およびニューロン入力の欠如、ならびに浸潤性炎症細胞の欠如が含まれる。唾液腺の恒常性と再生における血管と神経の役割は十分に文書化されており26,42、唾液腺機能、損傷反応、感染、シェーグレン症候群(SS)の病因(44でレビュー)におけるT細胞やB細胞などの遊走性免疫細胞43の重要性を考えると、このアッセイはいくつかの重要な細胞相互作用を見逃す可能性があります。さらに、ナチュラルキラー(NK)細胞45や樹状細胞(DC)46の動きなど、非常に速い遊走イベントは、15分ごとのイメージングでは見逃される可能性があります。しかし、イメージング間隔は、関心のある特定の細胞間相互作用を研究するために最適化することができ、zスタックを介して3次元でイメージングする機能により、3D細胞の動きを評価することができます。イメージング中に組織をしっかりと固定することは、細胞追跡測定などの定量化に不可欠です。なお、この調査がマウスティッシュを利用したが、プロトコルは人間の唾液腺の細胞細胞相互作用を調査するための実行可能な方法を提供し、他の方法によって達成できない貴重な翻訳情報を生成する。
ホメオスタシスと再生における組織常在マクロファージの役割は、いくつかの組織で実証されていますが2,10,11,12、唾液腺におけるそれらの役割は、ほとんど解明されていません。マクロファージは被曝傷害後の上皮再生に必須であることが知られているが13、その正確なメカニズムは不明である。唾液腺スライスのライブイメージングにより、従来の共焦点イメージングでは見落とされがちな複雑な組織動態のリアルタイム可視化と解析が可能になります。さらに、マクロファージはin vivoでさまざまな機能を果たしながら形状が動的に変化することは明らかであり47,48,49、このプロトコルは、固定組織における典型的な静的なビューよりもこれらの変化をよりよく表現する可能性があります。今後の研究では、この手法を利用して、ホメオスタシス、損傷、再生/解決の過程で細胞間コミュニケーションがどのように変化するかを調べることができます。このアプローチは、最終的に治療上の利益をもたらす可能性のある主要なシグナル伝達経路とイベントを解明するのに役立ちます。
開示事項
著者には開示すべき利益相反はありません。
謝辞
SEは、ウェルカムトラストの助成金108906/Z/15/Zによって資金提供されています。EEは、UKRI / MRC助成金MR / S005544/1とエジンバラ大学の学長フェローシップによって資金提供されています。図 1A は BioRender.com で作成されています。
資料
| Name | Company | Catalog Number | Comments |
| 0.4 µm filter cell culture inserts (Nunc) | Avantor/VWR | 734-2240 | Inserts pre-packed in 6-well multidishes, 20 mm × 25 mm |
| 24 well plate | Corning | 3524 | |
| 35 mm dish | Falcon | 353001 | |
| 6 well plate | Corning | 3516 | |
| Coverslips | Paul Marienfeld GmbH & Co. KG | 111650 | Deckglaser Cover Glasses 25 mm diameter |
| Double-sided sticker | Grace Bio-Labs | 654004 | SecureSeal Imaging Spacers SS1 x 13, 13 mm diameter x 0.12 mm depth, 25 mm x 25mm OD |
| EtOH | Scientific Laboratories Supplies | CHE1924 | Absolute ethanol (EtOH) AR, 99.7% |
| F4/80 antibody | Invitrogen | 17-4801-82 | F4/80 Monoclonal Antibody (BM8), APC, eBioscience |
| Forceps | Fine Science Tools | 91113-10 | Student Fine Forceps Straight Broad Shanks |
| Glass bottom 6 well plate | Cellvis | P06-1.5H-N | 6 well glass bottom plate with high performance #1.5 cover glass |
| Hanks Balanced Salt Solution (HBSS) | Life Technologies | 14025050 | +calcium +magnesium, no phenol red |
| Hoechst | Sigma Aldrich | 14533 | Alternative name: bisBenzimide H 33342 trihydrochloride |
| Ice box | Fisher Scientific | 11339623 | Azlon Polyurethane Ice Buckets with Lid |
| Imaging and analysis software | Harmony | ||
| Low Melting Agarose | Merck | A9414-25G | |
| Paintbrush | Watercolour brush, 10 mm x 2mm tip | ||
| Penicillin-Streptomycin | Sigma Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered |
| Phosphate Buffered Saline (PBS) | Life Technologies | 20012027 | |
| RPMI | ThermoFisher | 12634010 | Gibco Advanced DMEM/F-12 |
| Scalpel | Swann-Morton | Disposable scalpels, No. 11 blade | |
| Scissors | Fine Science Tools | 14088-10 | Extra Narrow Scissors 10.5 cm |
| Shepherd Mark-I-68A 137Cs irradiator | JL Shepherd & Associates | ||
| Superglue | Bostik | Multi-purpose superglue, fast setting, ultra strong | |
| Vibratome | Leica | Leica VT 1000 S | |
| Vibratome blades | Astra | Superior Platinum Double Edge blade | |
| Wild-type (C57BL/BJ) mice | Charles River |
参考文献
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Lucas, T., et al. Differential roles of macrophages in diverse phases of skin repair. J Immunol. 184 (7), 3964-3977 (2010).
- Duffield, J. S., et al. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair. J Clin Invest. 115 (1), 56-65 (2005).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat Immunol. 17 (1), 34-40 (2016).
- Mass, E., Nimmerjahn, F., Kierdorf, K., Schlitzer, A. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nat Rev Immunol. 23 (9), 563-579 (2023).
- Dick, S. A., et al. Three tissue resident macrophage subsets coexist across organs with conserved origins and life cycles. Sci Immunol. 7 (67), (2022).
- Hassel, C., Gausserès, B., Guzylack-Piriou, L., Foucras, G. Ductal macrophages predominate in the immune landscape of the lactating mammary gland. Front Immunol. 12, 754661(2021).
- Kolter, J., et al. A subset of skin macrophages contributes to the surveillance and regeneration of local nerves. Immunity. 50 (6), 1482-1497 (2019).
- Dawson, C. A., et al. Tissue-resident ductal macrophages survey the mammary epithelium and facilitate tissue remodelling. Nat Cell Biol. 22 (5), 546-558 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- McKendrick, J. G., et al. CSF1R-dependent macrophages in the salivary gland are essential for epithelial regeneration after radiation-induced injury. Sci Immunol. 8 (89), doi:10.1126/sciimmunol.add4374 eadd4374(2023).
- Muntjewerff, E. M., Meesters, L. D., vanden Bogaart, G. Antigen cross-presentation by macrophages. Front Immunol. 11, 1276(2020).
- Bissonnette, E. Y., Lauzon-Joset, J. F., Debley, J. S., Ziegler, S. F. Cross-talk between alveolar macrophages and lung epithelial cells is essential to maintain lung homeostasis. Front Immunol. 11, 583042(2020).
- Xue, Q., et al. Analysis of single-cell cytokine secretion reveals a role for paracrine signaling in coordinating macrophage responses to TLR4 stimulation. Sci Signal. 8 (381), (2015).
- McArdle, S., Mikulski, Z., Ley, K. Live cell imaging to understand monocyte, macrophage, and dendritic cell function in atherosclerosis. J Exp Med. 213 (7), 1117-1131 (2016).
- Gurevich, D. B., et al. Live imaging of wound angiogenesis reveals macrophage orchestrated vessel sprouting and regression. Embo j. 37 (13), (2018).
- Meziani, L., et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages. Eur Respir J. 51 (3), (2018).
- Bickelhaupt, S., et al. Effects of CTGF blockade on attenuation and reversal of radiation-induced pulmonary fibrosis. J Natl Cancer Inst. 109 (8), (2017).
- Formenti, S. C., Demaria, S. Systemic effects of local radiotherapy. Lancet Oncol. 10 (7), 718-726 (2009).
- Chambers, M. S., Garden, A. S., Kies, M. S., Martin, J. W. Radiation-induced xerostomia in patients with head and neck cancer: pathogenesis, impact on quality of life, and management. Head Neck. 26 (9), 796-807 (2004).
- Radfar, L., Sirois, D. A. Structural and functional injury in minipig salivary glands following fractionated exposure to 70 Gy of ionizing radiation: an animal model for human radiation-induced salivary gland injury. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 96 (3), 267-274 (2003).
- Grehn, A. L., Gustafsson, H., Franzén, L., Thornell, L. E., Henriksson, R. Ultrastructural morphometry of parotid acinar cells following fractionated irradiation. Oral Oncol. 33 (1), 23-28 (1997).
- Rocchi, C., Emmerson, E. Mouth-watering results: clinical need, current approaches, and future directions for salivary gland regeneration. Trends Mol Med. 26 (7), 649-669 (2020).
- Emmerson, E., et al. Salivary glands regenerate after radiation injury through SOX2-mediated secretory cell replacement. EMBO Mol Med. 10 (3), 8051(2018).
- May, A. J., et al. Diverse progenitor cells preserve salivary gland ductal architecture after radiation-induced damage. Development. 145 (21), (2018).
- Knox, S. M., et al. Parasympathetic stimulation improves epithelial organ regeneration. Nat Commun. 4, 1494(2013).
- Mizrachi, A., et al. Radiation-induced microvascular injury as a mechanism of salivary gland hypofunction and potential target for radioprotectors. Radiat Res. 186 (2), 189-195 (2016).
- Friedrich, R. E., Bartel-Friedrich, S., Holzhausen, H. J., Lautenschläger, C. The effect of external fractionated irradiation on the distribution pattern of extracellular matrix proteins in submandibular salivary glands of the rat. J Craniomaxillofac Surg. 30 (4), 246-254 (2002).
- Vasioukhin, V., Degenstein, L., Wise, B., Fuchs, E. The magical touch: genome targeting in epidermal stem cells induced by tamoxifen application to mouse skin. Proc Natl Acad Sci U S A. 96 (15), 8551-8556 (1999).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Gilman, K. E., et al. P2X7 receptor deletion suppresses γ-radiation-induced hyposalivation. Am J Physiol Regul Integr Comp Physiol. 316 (5), R687-R696 (2019).
- Ren, J., et al. Radioprotective effects and mechanism of HL-003 on radiation-induced salivary gland damage in mice. Sci Rep. 12 (1), 8419(2022).
- Marmary, Y., et al. Radiation-induced loss of salivary gland function is driven by cellular senescence and prevented by IL6 modulation. Cancer Res. 76 (5), 1170-1180 (2016).
- Chang, S., et al. Inorganic nitrate alleviates total body irradiation-induced systemic damage by decreasing reactive oxygen species levels. Int J Radiat Oncol Biol Phys. 103 (4), 945-957 (2019).
- Varghese, J. J., et al. Localized delivery of amifostine enhances salivary gland radioprotection. J Dent Res. 97 (11), 1252-1259 (2018).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. gammaH2AX: a sensitive molecular marker of DNA damage and repair. Leukemia. 24 (4), 679-686 (2010).
- Takano, T., et al. Highly localized intracellular Ca(2+) signals promote optimal salivary gland fluid secretion. Elife. 10, (2021).
- Ficht, X., Thelen, F., Stolp, B., Stein, J. V. Preparation of murine submandibular salivary gland for upright intravital microscopy. J Vis Exp. 135, (2018).
- O'Dell, N. L., Sharawy, M. H., Schuster, G. S. Effects of in vivo single and multiple isoproterenol injections on subsequently explanted submandibular glands. Acta Anat (Basel. 105 (4), 431-438 (1979).
- Lombaert, I. M., et al. Cytokine treatment improves parenchymal and vascular damage of salivary glands after irradiation). Clin Cancer Res. 14 (23), 7741-7750 (2008).
- Stolp, B., et al. Salivary gland macrophages and tissue-resident CD8(+) T cells cooperate for homeostatic organ surveillance. Sci Immunol. 5 (46), 4371(2020).
- Verstappen, G. M., Pringle, S., Bootsma, H., Kroese, F. G. M. Epithelial-immune cell interplay in primary Sjögren syndrome salivary gland pathogenesis. Nat Rev Rheumatol. 17 (6), 333-348 (2021).
- Vanherberghen, B., et al. Microwell-based live cell imaging of NK cell dynamics to assess heterogeneity in motility and cytotoxic response. Methods Mol Biol. 1441, 87-106 (2016).
- de Winde, C. M., Munday, C., Acton, S. E. Molecular mechanisms of dendritic cell migration in immunity and cancer. Med Microbiol Immunol. 209 (4), 515-529 (2020).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Paterson, N., Lämmermann, T. Macrophage network dynamics depend on haptokinesis for optimal local surveillance. Elife. 11, (2022).
- Lim, K., et al. In situ neutrophil efferocytosis shapes T cell immunity to influenza infection. Nat Immunol. 21 (9), 1046-1057 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved