Method Article
Исследование межклеточных взаимодействий в слюнных железах с помощью визуализации живых клеток ex vivo
В этой статье
Резюме
Иммунофлуоресцентная визуализация ограничена возможностью наблюдать сложные, зависящие от времени биологические процессы всего за один снимок во времени. В этом исследовании описывается подход к визуализации в реальном времени, проводимый на прецизионно вырезанных срезах подчелюстной железы мыши. Такой подход позволяет в режиме реального времени наблюдать за межклеточными взаимодействиями во время гомеостаза и процессами регенерации и репарации.
Аннотация
Регенерация слюнных желез представляет собой сложный процесс, включающий сложные взаимодействия между различными типами клеток. Недавние исследования пролили свет на ключевую роль, которую играют макрофаги в управлении регенеративным ответом. Тем не менее, наше понимание этой важнейшей роли в первую очередь опиралось на статические изображения, полученные при фиксированной биопсии тканей. Чтобы преодолеть это ограничение и получить представление об этих взаимодействиях в режиме реального времени, в этом исследовании описывается комплексный протокол культивирования ткани слюнных желез ex vivo и получения изображений миграции клеток в реальном времени.
Протокол включает в себя несколько ключевых этапов: сначала ткань подчелюстной слюнной железы мыши тщательно срезается с помощью вибратома, а затем культивируется на границе раздела воздух-жидкость. Эти срезы могут быть намеренно повреждены, например, в результате воздействия радиации, чтобы вызвать повреждение клеток и запустить регенеративную реакцию. Для отслеживания конкретных клеток, представляющих интерес, они могут быть эндогенно помечены, например, с использованием ткани слюнных желез, собранной у генетически модифицированных мышей, где определенный белок помечен зеленым флуоресцентным белком (GFP). В качестве альтернативы флуоресцентно-конъюгированные антитела могут быть использованы для окрашивания клеток, экспрессирующих специфические маркеры клеточной поверхности, представляющие интерес. После подготовки срезы слюнных желез подвергаются визуализации в реальном времени с использованием системы конфокальной визуализации с высоким содержанием в течение 12 часов с интервалом в 15 минут. Полученные изображения затем компилируются для создания фильма, который впоследствии может быть проанализирован для извлечения ценных параметров поведения клеток. Этот инновационный метод предоставляет исследователям мощный инструмент для изучения и лучшего понимания взаимодействий макрофагов в слюнных железах после травмы, тем самым расширяя наши знания о регенеративных процессах, происходящих в этом динамичном биологическом контексте.
Введение
Было показано, что макрофаги играют все более важную роль в процессах регенерации и репарации, выходя за рамки их классической иммунной функции 1,2. Действительно, макрофаги участвуют во множестве процессов, связанных с регенерацией, проявляя важнейшую регуляторную активность на всех стадиях репарации, а также образования рубцов и фиброза 3,4. Тканевые резидентные макрофаги представляют собой крайне гетерогенные типы клеток со сложными механизмами, управляющими различными клеточными фенотипами, и они играют важную роль в развитии органов, функционировании и гомеостазе (как рассмотрено в5). Тканевые резидентные макрофаги первоначально возникают из предшественников в желточном мешке и печени плода, а затем они замещаются пролиферацией или моноцитами крови костного мозга с различной скоростью, в зависимости от продолжительности жизни существующих макрофагов и ткани или ниши, в которойони находятся.
Важно отметить, что тканевые резидентные макрофаги распределены по всем тканям и участвуют в различных функциях органов. Они уникально запрограммированы своим микроокружением на выполнение функций, специфичных для ниши. По этой причине локализация макрофагов в ткани дает представление об их функциях, при этом уникальные популяции наблюдаются в легких, молочной железе, кишечнике, коже и мышцах 8,9,10. Во время развития молочной железы протоковые макрофаги тесно связаны с протоковым деревом, и их истощение приводит к значительному уменьшению ветвления11. Кроме того, макрофаги необходимы для морфогенеза в период полового созревания и альвеологенеза во время беременности, где они активно контролируют эпителий. При мышечном повреждении специфическая популяция макрофагов «обитает» в месте повреждения, обеспечивая временную нишу, в которой они поставляют индуцированные пролиферацией сигналы, необходимые для пролиферации стволовых клеток. Таким образом, они демонстрируют специализированную роль отдельных популяций макрофагов в управлении процессом репарации2. В легких аналогичное явление происходит, когда интерстициальные макрофаги праймируют интерлейкин (IL)-R1-экспрессирующие альвеолярные клетки II типа (AT2) для превращения в ассоциированные с повреждением транзиторные предшественники путем высвобожденияIL-1B 12. Кроме того, недавние исследования показали, что макрофаги необходимы для регенерации подчелюстной слюнной железы (СМГ) мыши после лучевого поражения, и при их отсутствии регенерация эпителия нарушается13. Взятые вместе, эти данные подчеркивают важность активации и функции макрофагов в транзиторных воспалительных нишах после повреждения тканей, а также во время гомеостаза.
Макрофаги являются активными клетками, и их функции включают взаимодействие с различными типами клеток, включая прямой межклеточный контакт14,15, а также более косвенные методы, такие как секреция растворимых факторов 2,16, которые необходимы для регуляции ниши. В то время как классическая иммунофлуоресцентная визуализация полезна для того, чтобы начать разгадывать эти взаимодействия, она ограничена отображением только одного снимка во времени, тем самым пропуская многочисленные временные точки, критически важные для высокодинамичного регенеративногопроцесса. По мере того, как важность времени и возникновения различных волн регенерации становится все более очевидной, важно проанализировать эти процессы более подробно.
Лучевая терапия является жизненно важным методом лечения для многих людей, у которых диагностирован рак. Несмотря на то, что лучевая терапия часто эффективна для уменьшения или устранения опухоли (опухолей), она также может повредить здоровые ткани, лежащие в поле облучения, и вызвать иммунный ответ. Лучевое поражение может индуцировать быстрое рекрутирование макрофагов, а также прямые и косвенные иммуномодулирующие реакции19,20. Слюнные железы часто непреднамеренно облучаются во время лечения рака головы и шеи21,22, что приводит к повреждению эпителия, атрофии клеток и фиброзу23,24, что приводит к ксеростомии или хронической сухости во рту25.
Слюнная железа состоит из множества типов клеток и структур, включая, помимо прочего, эпителиальные клетки (как ацинарные клетки, продуцирующие слюну, так и протоковые клетки, транспортирующие слюну), миоэпителиальные клетки, эпителиальные клетки-предшественники, нервы, кровеносные сосуды, иммунные клетки, фибробласты и внеклеточный матрикс (ВКМ). Роль и реакция многих из этих типов клеток в регенеративном ответе были описаны ранее 26,27,28,29,30. Однако то, как эти различные клетки взаимодействуют во время гомеостаза и регенерации, и, в частности, как ведут себя иммунные клетки, такие как макрофаги, изучено менее хорошо. В данной статье описывается недавно разработанный метод изучения живых взаимодействий между макрофагами SMG и другими клетками, представляющими интерес в тканях ex vivo. Пистолет-пулемет нарезается на вибратоме, окрашивается для поверхностных маркеров и визуализируется в течение 12 часов. С помощью этого метода можно наблюдать фагоцитоз окружающих клеток макрофагами, изучать кинетику миграции макрофагов и демонстрировать прямые межклеточные взаимодействия между макрофагами и эпителиальными клетками.
протокол
Все процедуры были одобрены Министерством внутренних дел Великобритании и выполнены в соответствии с PPL PB5FC9BD2 и PP0330540. Все эксперименты проводятся в соответствии с рекомендациями ARRIVAL и Эдинбургского университета.
Мыши дикого типа были получены в промышленных масштабах (см. Таблицу материалов). Крт14КреЭР; Мыши R26mTmG были выведены в домашних условиях путем скрещивания мышей Krt14CreER/+ 31 с мышами R26mTmG/ mTmG 32. Во всех экспериментах использовались самки мышей в возрасте 8-10 недель.
1. Сбор и встраивание пистолета-пулемёта
- Усыпьте мышей/мышей, подвергнув их воздействию растущей концентрации углекислого газа (CO2). После этого опрыскайте область разреза 70% этанолом (EtOH) и с помощью ножниц и щипцов осторожно отделите SMG от окружающих тканей (рис. 1A). Удалите жир и соединительную ткань с помощью щипцов и поместите железу в сборную пробирку, содержащую ледяной сбалансированный солевой раствор Хэнкса (HBSS, см. Таблицу материалов).
- Разделите железу на кусочки размером примерно 1 см2 каждый с помощью щипцов.
- Нагрейте 4%-ную агарозу до 50 °С, а затем перелейте ее прямо в посуду диаметром 35 мм.
- Небольшое количество растопленной 50 °C агарозы вылить в отдельную посуду и тщательно промыть железу, перемещая ее в избытке агарозы.
ПРИМЕЧАНИЕ: Этот шаг необходим для удаления лишней жидкости из желез. Избыток жидкости может помешать железам правильно прилипнуть к агарозе. - Поместите 4-6 кусочков железы в агарозу, следя за тем, чтобы они лежали ровно и находились в одной плоскости (рисунок 1А).
ПРИМЕЧАНИЕ: Убедитесь, что железы не касаются поверхности агара или дна пластины. - Накройте тарелку крышкой 35 мм и переложите ее в холодильник, накрыв тарелку льдом.
- Подождите 5-10 минут, чтобы агароза застыла.
2. Секционирование
- С помощью скальпеля осторожно разрежьте вросший в железу агарозный блок, удалив блок, содержащий ткань, из чашки. Оставьте границу примерно 5 мм.
- Прикрепите агарозный блок к ступени вибратома (см. Таблицу материалов), нанеся каплю суперклея, следя за тем, чтобы вся нижняя поверхность блока соприкасалась с суперклеем.
- Дайте суперклею затвердеть примерно 5 минут. Затем заполните вибратомную камеру ледяным 1x фосфатно-буферным физиологическим раствором (PBS), содержащим 1% пенициллина-стрептомицина (P/S).
- Добавьте лед как сбоку, так и на дно вибратомной камеры.
ПРИМЕЧАНИЕ: Поддерживайте очень холодную среду и заменяйте лед по мере необходимости. - Обрежьте излишки агарозы и создайте 5-миллиметровые зазоры между каждым кусочком железы, сделав надрезы скальпелем. В результате получаются отдельные ломтики.
- Совместите лопасть вибратома с поверхностью агарозного блока и установите начальную и конечную точки секций для достижения желаемой толщины среза.
- Перед началом процесса резки убедитесь, что лезвие не соприкасается с блоком. Эта мера предосторожности предотвратит случайное отрезание крупных кусков агарозы и потерю частей образца.
- Вырезать участки толщиной 150 мкм с низкой скоростью и высокой вибрацией (например, скорость 3 и настройка вибрации 8-10 по шкале 1-10 для каждого параметра) (рис. 1А).
- После того, как секция вырезана и выпущена в окружающий PBS, соберите кусочки с помощью кисти и поместите их в чашку, содержащую предварительно подогретый носитель Мемориального института Розуэлл-Парка (RPMI) с P/S.
3. Культивирование и окрашивание срезов пистолета-пулемета
- Культивирование
- Добавьте 1,5 мл фильтрующего материала RPMI в каждую лунку 6-луночного планшета, содержащего фильтр 0,4 мкм. Убедитесь, что под фильтром нет пузырьков воздуха.
- Перенесите 1-6 ломтиков на каждый фильтр с помощью кисти, стараясь не сломать ломтики.
ПРИМЕЧАНИЕ: Убедитесь, что ломтики не погружены в фильтрующий материал, а плавают на фильтре. Если они полностью погружены в воду, они могут задохнуться во время культивирования. - Инкубируйте при 37 °C с 5%CO2 и меняйте среду каждые 3 дня (Рисунок 1A).
- Облучают экспериментальные планшеты однократной дозой гамма-излучения 10 Гр с помощью имеющегося в продаже облучателя (см. таблицу материалов). После этого верните их в инкубатор.
- Окрашивание для визуализации в реальном времени
- С помощью кисти осторожно извлеките срезы из фильтра и поместите их в 24-луночный планшет, содержащий 500 мкл питательной среды на лунку, куда ломтики будут погружены.
- Добавляют соответствующие конъюгированные антитела и ядерное окрашивание (см. таблицу материалов) в среду в соответствующих концентрациях27.
- Инкубируют срезы с антителами в течение 2 ч при 37 °C при легком перемешивании.
- Промойте ломтики, погрузив их в питательную среду и промыв в течение 3 циклов по 10 минут при 37 °C при легком перемешивании.
4. Монтаж и визуализация в реальном времени
- С помощью щипцов снимите ленту с одной стороны двусторонней прокладки и приклейте ее клейкой стороной вниз к нижней части 6-луночной пластины со стеклянным дном.
- Пипетка 50 мкл среды в зазор в центре прокладки.
- Поместите срез в носитель с помощью кисти, убедившись, что он лежит ровно, без застрявших пузырьков воздуха.
- С помощью пипетки осторожно удалите 20 мкл среды из зазора.
- Снимите ленту с верхней стороны распорки с помощью щипцов и положите сверху круглое покровное стекло диаметром 25 мм. Надавите на край распорки, чтобы убедиться, что защитное стекло надежно прикреплено, соблюдая осторожность, чтобы не сломать защитный лист, приложив слишком большое усилие (Рисунок 1A).
- Изображение среза на конфокальном микроскопе в течение желаемого периода времени или интервалов (например, каждые 15 минут в течение 12 часов с использованием 20-кратного водяного объектива).
Результаты
Реакция макрофагов на повреждение подчелюстной слюнной железы остается неизвестной. Это включает в себя то, локализуются ли они и мигрируют ли они в определенные структуры внутри железы, а также расстояние и скорость, с которой они мигрируют. Это было трудно определить с помощью статической визуализации.
Для решения этой проблемы был разработан подход к визуализации в реальном времени для изучения взаимодействия макрофагов и эпителиальных клеток в режиме реального времени. Иммунофлуоресцентное окрашивание срезов комбинировали с эндогенно меченной моделью мышей, отслеживающих родословную (рис. 1А и рис. 2А). В этой модели срезы подвергались воздействию гамма-облучения в дозе 10 Гр для индуцирования лучевого повреждения и визуализировались через 2 ч, 3 и 4 дня после облучения (ИК), при этом необлученные срезы служили контрольной группой. Данные были получены по четырем каналам: Hoechst (с использованием лазера 425 для минимизации фототоксичности), GFP (488), dTomato (561) и Alexa 647 (640). Был выполнен z-стек, и изображение было получено каждые 2-3 мкм, в общей сложности было собрано от 30 до 40 плоскостей, в результате чего общая высота составила 80-90 мкм.
Используя этот метод и анализируя связанный с мембраной сигнал томата (мТ) и активность Caspase3/7, стало очевидно, что органотипические срезы сохраняют свою эпителиальную структуру, выживают в культуре и демонстрируют минимальную гибель клеток. Данные показали, что необлученные срезы подчелюстной железы от мышей R26mTmG 32, культивируемые в течение 7 дней, сохраняли свой mT-сигнал и эпителиальную архитектуру (рис. 1B). Однако через 3 дня после облучения ex vivo была очевидна ацинарная и протоковая атрофия клеток (рис. 1B; ацинусы и протоковые структуры выделены пунктирными белыми и зелеными линиями соответственно), что согласуется с лучевым повреждением in vivo 13. Апоптоз был незначительным в необлученных срезах, но были обнаружены клетки каспазы 3/7+ в облученных срезах через 4 дня после облучения (рис. 1C; зеленые стрелки), что аналогично повреждению in vivo 33,34. Кроме того, облученные срезы рекапитулировали in vivo повреждения ДНК 34,35,36,37, на что указывает повышенный уровень γH2AX38 по сравнению с необлученными контрольными группами (рис. 1D, E). Таким образом, органотипические срезы слюнных желез демонстрировали хорошую жизнеспособность в культуре и реагировали на облучение аналогично тканям in vivo.
После этого были исследованы межклеточные взаимодействия в режиме реального времени. Макрофаги, непосредственно взаимодействующие с мечеными GFP эпителиальными клетками-предшественниками (Krt14,CreER-GFP), наблюдались в течение 12 ч через 3 дня после ИР (рис. 2A и видео 1). Примечательно, что было очевидно, что макрофаги оставались в непосредственной близости от эпителиальных клеток-предшественников в течение нескольких часов, часто оставаясь в контакте в течение всего 12-часового периода визуализации. Кроме того, наблюдался фагоцитоз эпителиальных клеток макрофагами в режиме реального времени, что подтвердило, что макрофаги выполняют свою традиционную функцию в модели культуры срезов (рис. 2B, видео 2 и видео 3). Этот метод также показал, что макрофаги относительно неподвижны как во время гомеостаза, так и после радиационного поражения, вероятно, из-за их высокой плотности в тканях. Это впервые демонстрирует, что макрофаги слюнных желез не мигрируют экстенсивно во время гомеостаза или после лучевого поражения. Однако, в то время как макрофаги не показали значительной миграции, окружающая ткань продемонстрировала повышенную динамику после облучения, при этом несколько макрофагов активно взаимодействовали вокруг кластеров меченых эпителиальных клеток. Кроме того, основанный исключительно на ядерном окрашивании, этот метод позволил нам визуализировать движение клеток внутри среза с течением времени, часто с целыми протоками, которые, казалось, «мигрировали» в ткани (видео 4). Со временем, в процессе культивирования, стало очевидно, что срезы сместились от плоской к сфероидной морфологии, предполагая, что движение клеток внутри среза, вероятно, связано с их перегруппировкой в сфероподобную структуру, напоминающую потенциальное событие реорганизации.
Наконец, данные визуализации в реальном времени, полученные с помощью этого анализа, могут быть использованы для количественного измерения поведения клеток, таких как миграция. Отдельные клетки могут быть обнаружены и сегментированы (рис. 3A), а миграция может быть измерена с помощью коммерчески доступного программного обеспечения для визуализации и анализа (см. таблицу материалов и видео 5). Кроме того, может быть проведен анализ ближайшего объекта, чтобы определить, мигрируют ли клетки, в данном случае макрофаги, ближе к другим клеткам, представляющим интерес, в данном случае к клеткам Krt14 CreER-GFP+, и как эта динамика меняется с течением времени (рис. 3B).

Рисунок 1: Рекапитуляция реакции in vivo в точно вырезанных срезах ткани слюнных желез. (А) Схема протокола эксперимента. (B) Репрезентативные изображения мембранного томата, полученные из свежей ткани подчелюстной железы (SMG), необработанных ломтиков SMG, культивируемых в течение 7 дней, или ломтиков SMG, облученных однократной дозой гамма-облучения 10 Гр за 3 или 7 дней до этого. Пунктирными белыми линиями обозначены примеры ацинарных структур, а пунктирными зелеными линиями — примеры протоковых структур. Масштабная линейка = 50 мкм. (C) Репрезентативные изображения экспрессии Caspase-3/7, полученные из необработанных срезов SMG или срезов SMG, облученных однократной дозой гамма-облучения 10 Гр за 2 ч или 4 дня до этого. Зелеными стрелками обозначены положительные ядра. Масштабная линейка = 50 мкм. (D) Репрезентативные изображения экспрессии γH2AX, полученные из необработанных срезов SMG или срезов SMG, облученных однократной дозой гамма-излучения 10 Гр за 3 дня до этого. Масштабная линейка = 20 мкм. (E) Репрезентативная экспрессия γH2AX в эпителиальных клетках EpCAM+ из необработанных срезов SMG или срезов SMG, облученных однократной дозой гамма-облучения 10 Гр за 2 ч и 3 дня до этого. SSA = область бокового рассеяния. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
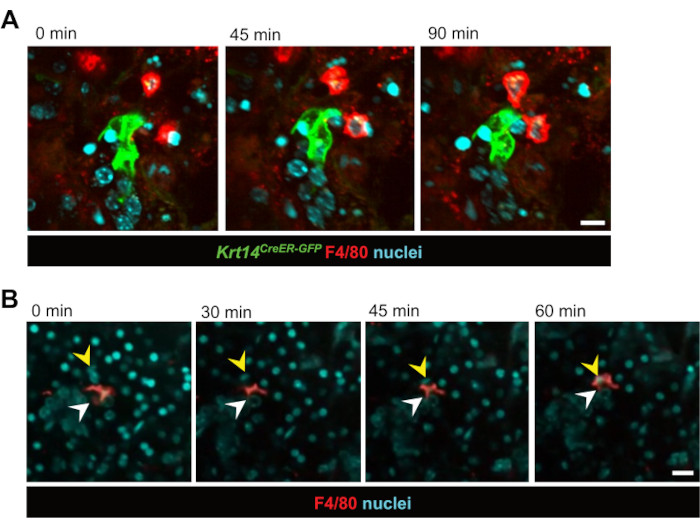
Рисунок 2: Визуализация макрофагально-эпителиальных клеточных взаимодействий и фагоцитоза в реальном времени. (A) Последовательные неподвижные изображения взаимодействий между клетками-предшественниками KRT14+ и их потомством (клетками Krt14CreER-GFP+) и макрофагами после облучения. Визуализация клеток в реальном времени фиксирует клеточную динамику в течение 90 минут. Масштабная линейка = 20 мкм. Связанное видео — Видео 1. (B) Последовательные неподвижные изображения макрофага, фагоцитозирующего эпителиальную клетку. Визуализация клеток в реальном времени показывает процесс в течение 60 минут. Белые стрелки указывают на макрофаг, а желтые – на ядро клетки, подвергающейся фагоцитозу. Масштабная линейка = 50 мкм. Связанное видео — Видео 2. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
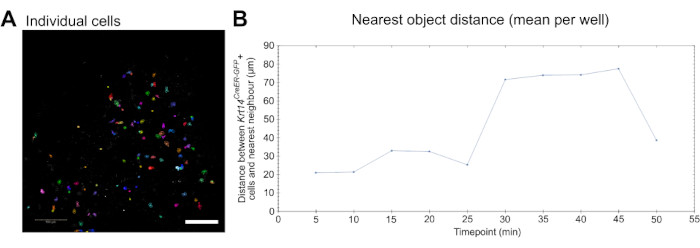
Рисунок 3: Визуализация в реальном времени для анализа клеточной динамики. (A) Изображение, иллюстрирующее индивидуальную идентификацию и сегментацию клеток для анализа параметров клеточного поведения, таких как миграция (см. Видео 5). Ячейки окрашены случайным образом для различения отдельных ячеек и дорожек. Масштабная линейка = 100 мкм. (B) Количественная оценка расстояния (в мкм) от ближайшего объекта до отдельных ячеек Krt14 CreER-GFP+ на графике в 10 временных точках (изображения снимаются каждые 5 минут). Данные представлены в виде среднего значения на скважину. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Видео 1: Визуализация в реальном времени, показывающая динамическое взаимодействие между клетками-предшественниками KRT14+ и макрофагами после облучения. Срезы подвергались однократному облучению дозой гамма-излучения 10 Гр перед визуализацией в реальном времени. Клетки Krt14 CreER-GFP+ представлены зеленым цветом, макрофаги (F4/80+) — красным, а ядра — голубым. Видео состоит из одного z-стека, охватывающего 12-часовой период культивирования с изображениями, снимаемыми каждые 15 минут. Пожалуйста, нажмите здесь, чтобы загрузить видео.
Видео 2: Изображение в реальном времени, на котором макрофаг поглощает эпителиальную клетку. Макрофаги (F4/80+) изображены красным цветом, а ядра — голубым. Видео состоит из одного z-стека и охватывает 12-часовой период культивирования с изображениями, сделанными каждые 15 минут.Пожалуйста, нажмите здесь, чтобы загрузить видео.
Видео 3: Максимально проекционное изображение в реальном времени, показывающее, как макрофаг поглощает эпителиальную клетку. Макрофаги (F4/80+) показаны красным цветом, а ядра — голубым. Видео демонстрирует максимальную проекцию изображений z-стека общим размером 80 мкм (одна плоскость представлена в Видео 2) и охватывает 12-часовой период культивирования с изображениями, сделанными каждые 15 минут.
Видео 4: Живое изображение, иллюстрирующее динамическое поведение эпителия слюнных желез в культуре после облучения. Срезы подвергали однократному гамма-облучению дозой 10 Гр перед визуализацией в реальном времени. Макрофаги (F4/80+) представлены красным цветом, ядра – голубым. Видео состоит из одного z-стека, охватывающего 12-часовой период культивирования с изображениями, снимаемыми каждые 15 минут.Пожалуйста, нажмите здесь, чтобы загрузить видео.
Видео 5: Количественное отслеживание миграции клеток с течением времени. В этом видео демонстрируется индивидуальная трассировка треков клеток из видео с изображениями в реальном времени. Стрелки обозначают треки ячеек, а ячейки по отдельности окрашены псевдоцветом. Видео состоит из одного z-стека и охватывает 1-часовой период культивирования с изображениями, сделанными каждые 15 минут.Пожалуйста, нажмите здесь, чтобы загрузить видео.
Обсуждение
Возможность культивирования тканей слюнных желез ex vivo предоставляет прекрасную возможность для изучения межклеточных взаимодействий в контексте как гомеостаза, так и реакции на повреждение. Несмотря на то, что прижизненная визуализация подчелюстной железы мыши осуществима39,40, этот метод основан на использовании флуоресцентных репортерных мышей для эндогенной маркировки интересующих клеток и должен выполняться под терминальной анестезией. Здесь описан метод культивирования срезов подчелюстной железы ex vivo с сохранением клеточной архитектуры и межклеточных взаимодействий. Этот подход совершенствует существующие методы визуализации в реальном времени и обеспечивает альтернативу прижизненной визуализации.
Долгосрочное сохранение тканей с помощью этого метода основано на культивировании срезов на границе раздела воздух-жидкость. Предыдущие модели эксплантов26,41, вероятно, достигли успешной культуры всего за несколько дней, потому что они были погружены в среду и, по сути, «задохнулись». В отличие от этого, использование системы культивирования на границе раздела воздух-жидкость поддерживает здоровье и структуру тканей в течение длительного периода времени, обеспечивая высокое качество визуализации. Метод монтажа срезов SMG перед визуализацией с небольшим количеством материала и в камере с ограниченным пространством, чтобы срез оставался плоским, является неотъемлемой частью успеха этого метода. Визуализация клеток в этом анализе зависит от эндогенно меченых репортерных мышей или флуоресцентно-конъюгированных антител. Обилие трансгенных флуоресцентных репортерных мышей и конъюгированных антител, нацеленных на определенные типы и субпопуляции клеток, делает этот метод подходящим для изучения различных клеточно-специфических взаимодействий.
Несмотря на то, что этот метод обеспечивает хорошую модель тканей in situ, а радиационное повреждение ex vivo приводит к ацинарной и протоковой атрофии, аналогичной тому, что происходит in vivo13, некоторые элементы не могут быть воспроизведены ex vivo. К ним относятся недостаток функционирующих сосудов и нейронов, а также отсутствие инфильтрирующих воспалительных клеток. Учитывая хорошо задокументированную роль кровеносных сосудов и нервов в гомеостазе и регенерации слюнных желез26,42 и важность мигрирующих иммунных клеток43, таких как Т- и В-клетки, в функции слюнных желез, реакции на повреждение, инфекцию и патогенез синдрома Шегрена (СС) (как рассмотрено в44), этот анализ может упустить некоторые важные клеточные взаимодействия. Кроме того, очень быстрые миграционные события, такие как движение естественных клеток-киллеров (NK)45 и дендритных клеток (DC)46, могут быть пропущены при визуализации каждые 15 минут. Тем не менее, интервалы визуализации могут быть оптимизированы для изучения конкретных взаимодействий между клетками, а возможность получения изображений в 3-х измерениях с помощью z-стеков позволяет оценивать 3D-движение клеток. Надежная фиксация ткани во время визуализации имеет решающее значение для количественной оценки, например, для отслеживания клеток. Кроме того, несмотря на то, что в этом исследовании использовалась мышиная ткань, протокол обеспечивает жизнеспособный метод изучения межклеточных взаимодействий в слюнных железах человека, генерируя ценную трансляционную информацию, недостижимую другими методами.
В то время как роль тканевых резидентных макрофагов в гомеостазе и регенерации была продемонстрирована в нескольких тканях 2,10,11,12, их роль в слюнных железах остается в значительной степени нерешенной. Хотя известно, что макрофаги необходимы для регенерации эпителия после лучевого поражения13, точные механизмы, лежащие в основе этого эффекта, остаются неизвестными. Визуализация срезов срезов слюнных желез в режиме реального времени позволяет визуализировать и анализировать сложную динамику тканей, которые часто упускаются из виду при традиционной конфокальной визуализации. Кроме того, очевидно, что макрофаги претерпевают динамические изменения формы, выполняя различные функции in vivo 47,48,49, и этот протокол, вероятно, обеспечивает лучшее представление этих изменений, чем типичный статический вид в фиксированной ткани. В будущих исследованиях этот метод может быть использован для изучения того, как межклеточная коммуникация изменяется в ходе гомеостаза, повреждения и регенерации/разрешения. Этот подход будет полезен для выяснения ключевых сигнальных путей и событий, которые в конечном итоге могут принести терапевтическую пользу.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
SE финансируется грантом Wellcome Trust 108906/Z/15/Z; EE финансируется за счет гранта UKRI/MRC MR/S005544/1 и стипендии канцлера Эдинбургского университета. Рисунок 1A создан с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.4 µm filter cell culture inserts (Nunc) | Avantor/VWR | 734-2240 | Inserts pre-packed in 6-well multidishes, 20 mm × 25 mm |
| 24 well plate | Corning | 3524 | |
| 35 mm dish | Falcon | 353001 | |
| 6 well plate | Corning | 3516 | |
| Coverslips | Paul Marienfeld GmbH & Co. KG | 111650 | Deckglaser Cover Glasses 25 mm diameter |
| Double-sided sticker | Grace Bio-Labs | 654004 | SecureSeal Imaging Spacers SS1 x 13, 13 mm diameter x 0.12 mm depth, 25 mm x 25mm OD |
| EtOH | Scientific Laboratories Supplies | CHE1924 | Absolute ethanol (EtOH) AR, 99.7% |
| F4/80 antibody | Invitrogen | 17-4801-82 | F4/80 Monoclonal Antibody (BM8), APC, eBioscience |
| Forceps | Fine Science Tools | 91113-10 | Student Fine Forceps Straight Broad Shanks |
| Glass bottom 6 well plate | Cellvis | P06-1.5H-N | 6 well glass bottom plate with high performance #1.5 cover glass |
| Hanks Balanced Salt Solution (HBSS) | Life Technologies | 14025050 | +calcium +magnesium, no phenol red |
| Hoechst | Sigma Aldrich | 14533 | Alternative name: bisBenzimide H 33342 trihydrochloride |
| Ice box | Fisher Scientific | 11339623 | Azlon Polyurethane Ice Buckets with Lid |
| Imaging and analysis software | Harmony | ||
| Low Melting Agarose | Merck | A9414-25G | |
| Paintbrush | Watercolour brush, 10 mm x 2mm tip | ||
| Penicillin-Streptomycin | Sigma Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered |
| Phosphate Buffered Saline (PBS) | Life Technologies | 20012027 | |
| RPMI | ThermoFisher | 12634010 | Gibco Advanced DMEM/F-12 |
| Scalpel | Swann-Morton | Disposable scalpels, No. 11 blade | |
| Scissors | Fine Science Tools | 14088-10 | Extra Narrow Scissors 10.5 cm |
| Shepherd Mark-I-68A 137Cs irradiator | JL Shepherd & Associates | ||
| Superglue | Bostik | Multi-purpose superglue, fast setting, ultra strong | |
| Vibratome | Leica | Leica VT 1000 S | |
| Vibratome blades | Astra | Superior Platinum Double Edge blade | |
| Wild-type (C57BL/BJ) mice | Charles River |
Ссылки
- Wynn, T. A., Vannella, K. M. Macrophages in tissue repair, regeneration, and fibrosis. Immunity. 44 (3), 450-462 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Lucas, T., et al. Differential roles of macrophages in diverse phases of skin repair. J Immunol. 184 (7), 3964-3977 (2010).
- Duffield, J. S., et al. Selective depletion of macrophages reveals distinct, opposing roles during liver injury and repair. J Clin Invest. 115 (1), 56-65 (2005).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Ginhoux, F., Schultze, J. L., Murray, P. J., Ochando, J., Biswas, S. K. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat Immunol. 17 (1), 34-40 (2016).
- Mass, E., Nimmerjahn, F., Kierdorf, K., Schlitzer, A. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nat Rev Immunol. 23 (9), 563-579 (2023).
- Dick, S. A., et al. Three tissue resident macrophage subsets coexist across organs with conserved origins and life cycles. Sci Immunol. 7 (67), (2022).
- Hassel, C., Gausserès, B., Guzylack-Piriou, L., Foucras, G. Ductal macrophages predominate in the immune landscape of the lactating mammary gland. Front Immunol. 12, 754661 (2021).
- Kolter, J., et al. A subset of skin macrophages contributes to the surveillance and regeneration of local nerves. Immunity. 50 (6), 1482-1497 (2019).
- Dawson, C. A., et al. Tissue-resident ductal macrophages survey the mammary epithelium and facilitate tissue remodelling. Nat Cell Biol. 22 (5), 546-558 (2020).
- Choi, J., et al. Inflammatory signals induce AT2 cell-derived damage-associated transient progenitors that mediate alveolar regeneration. Cell Stem Cell. 27 (3), 366-382 (2020).
- McKendrick, J. G., et al. CSF1R-dependent macrophages in the salivary gland are essential for epithelial regeneration after radiation-induced injury. Sci Immunol. 8 (89), eadd4374 (2023).
- Muntjewerff, E. M., Meesters, L. D., vanden Bogaart, G. Antigen cross-presentation by macrophages. Front Immunol. 11, 1276 (2020).
- Bissonnette, E. Y., Lauzon-Joset, J. F., Debley, J. S., Ziegler, S. F. Cross-talk between alveolar macrophages and lung epithelial cells is essential to maintain lung homeostasis. Front Immunol. 11, 583042 (2020).
- Xue, Q., et al. Analysis of single-cell cytokine secretion reveals a role for paracrine signaling in coordinating macrophage responses to TLR4 stimulation. Sci Signal. 8 (381), (2015).
- McArdle, S., Mikulski, Z., Ley, K. Live cell imaging to understand monocyte, macrophage, and dendritic cell function in atherosclerosis. J Exp Med. 213 (7), 1117-1131 (2016).
- Gurevich, D. B., et al. Live imaging of wound angiogenesis reveals macrophage orchestrated vessel sprouting and regression. Embo j. 37 (13), (2018).
- Meziani, L., et al. CSF1R inhibition prevents radiation pulmonary fibrosis by depletion of interstitial macrophages. Eur Respir J. 51 (3), (2018).
- Bickelhaupt, S., et al. Effects of CTGF blockade on attenuation and reversal of radiation-induced pulmonary fibrosis. J Natl Cancer Inst. 109 (8), (2017).
- Formenti, S. C., Demaria, S. Systemic effects of local radiotherapy. Lancet Oncol. 10 (7), 718-726 (2009).
- Chambers, M. S., Garden, A. S., Kies, M. S., Martin, J. W. Radiation-induced xerostomia in patients with head and neck cancer: pathogenesis, impact on quality of life, and management. Head Neck. 26 (9), 796-807 (2004).
- Radfar, L., Sirois, D. A. Structural and functional injury in minipig salivary glands following fractionated exposure to 70 Gy of ionizing radiation: an animal model for human radiation-induced salivary gland injury. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 96 (3), 267-274 (2003).
- Grehn, A. L., Gustafsson, H., Franzén, L., Thornell, L. E., Henriksson, R. Ultrastructural morphometry of parotid acinar cells following fractionated irradiation. Oral Oncol. 33 (1), 23-28 (1997).
- Rocchi, C., Emmerson, E. Mouth-watering results: clinical need, current approaches, and future directions for salivary gland regeneration. Trends Mol Med. 26 (7), 649-669 (2020).
- Emmerson, E., et al. Salivary glands regenerate after radiation injury through SOX2-mediated secretory cell replacement. EMBO Mol Med. 10 (3), 8051 (2018).
- May, A. J., et al. Diverse progenitor cells preserve salivary gland ductal architecture after radiation-induced damage. Development. 145 (21), (2018).
- Knox, S. M., et al. Parasympathetic stimulation improves epithelial organ regeneration. Nat Commun. 4, 1494 (2013).
- Mizrachi, A., et al. Radiation-induced microvascular injury as a mechanism of salivary gland hypofunction and potential target for radioprotectors. Radiat Res. 186 (2), 189-195 (2016).
- Friedrich, R. E., Bartel-Friedrich, S., Holzhausen, H. J., Lautenschläger, C. The effect of external fractionated irradiation on the distribution pattern of extracellular matrix proteins in submandibular salivary glands of the rat. J Craniomaxillofac Surg. 30 (4), 246-254 (2002).
- Vasioukhin, V., Degenstein, L., Wise, B., Fuchs, E. The magical touch: genome targeting in epidermal stem cells induced by tamoxifen application to mouse skin. Proc Natl Acad Sci U S A. 96 (15), 8551-8556 (1999).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Gilman, K. E., et al. P2X7 receptor deletion suppresses γ-radiation-induced hyposalivation. Am J Physiol Regul Integr Comp Physiol. 316 (5), R687-R696 (2019).
- Ren, J., et al. Radioprotective effects and mechanism of HL-003 on radiation-induced salivary gland damage in mice. Sci Rep. 12 (1), 8419 (2022).
- Marmary, Y., et al. Radiation-induced loss of salivary gland function is driven by cellular senescence and prevented by IL6 modulation. Cancer Res. 76 (5), 1170-1180 (2016).
- Chang, S., et al. Inorganic nitrate alleviates total body irradiation-induced systemic damage by decreasing reactive oxygen species levels. Int J Radiat Oncol Biol Phys. 103 (4), 945-957 (2019).
- Varghese, J. J., et al. Localized delivery of amifostine enhances salivary gland radioprotection. J Dent Res. 97 (11), 1252-1259 (2018).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. gammaH2AX: a sensitive molecular marker of DNA damage and repair. Leukemia. 24 (4), 679-686 (2010).
- Takano, T., et al. Highly localized intracellular Ca(2+) signals promote optimal salivary gland fluid secretion. Elife. 10, (2021).
- Ficht, X., Thelen, F., Stolp, B., Stein, J. V. Preparation of murine submandibular salivary gland for upright intravital microscopy. J Vis Exp. 135, (2018).
- O'Dell, N. L., Sharawy, M. H., Schuster, G. S. Effects of in vivo single and multiple isoproterenol injections on subsequently explanted submandibular glands. Acta Anat (Basel. 105 (4), 431-438 (1979).
- Lombaert, I. M., et al. Cytokine treatment improves parenchymal and vascular damage of salivary glands after irradiation). Clin Cancer Res. 14 (23), 7741-7750 (2008).
- Stolp, B., et al. Salivary gland macrophages and tissue-resident CD8(+) T cells cooperate for homeostatic organ surveillance. Sci Immunol. 5 (46), 4371 (2020).
- Verstappen, G. M., Pringle, S., Bootsma, H., Kroese, F. G. M. Epithelial-immune cell interplay in primary Sjögren syndrome salivary gland pathogenesis. Nat Rev Rheumatol. 17 (6), 333-348 (2021).
- Vanherberghen, B., et al. Microwell-based live cell imaging of NK cell dynamics to assess heterogeneity in motility and cytotoxic response. Methods Mol Biol. 1441, 87-106 (2016).
- de Winde, C. M., Munday, C., Acton, S. E. Molecular mechanisms of dendritic cell migration in immunity and cancer. Med Microbiol Immunol. 209 (4), 515-529 (2020).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Paterson, N., Lämmermann, T. Macrophage network dynamics depend on haptokinesis for optimal local surveillance. Elife. 11, (2022).
- Lim, K., et al. In situ neutrophil efferocytosis shapes T cell immunity to influenza infection. Nat Immunol. 21 (9), 1046-1057 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены