需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Methods Article
抗菌氧化石墨烯/铜纳米复合材料的制备
摘要
在此,我们介绍了氧化石墨烯/铜 (GO/Cu) 纳米复合材料作为抗菌纳米材料。评估了 GO/Cu 纳米复合材料对抗生素耐药革兰氏阳性菌和革兰氏阴性菌的抗菌效果。
摘要
抗生素是目前最常用的杀死细菌的抗菌疗法。然而,当细菌持续过度暴露于抗生素时,会产生耐药性。开发可以替代现有抗生素的抗菌剂至关重要,因为抗生素耐药细菌对所有当前抗生素都具有耐药机制,并且可以促进院内感染。为了应对这一挑战,在这项研究中,我们提出了氧化石墨烯/铜 (GO/Cu) 纳米复合材料作为可以替代现有抗生素的抗菌材料。通过透射电子显微镜和扫描电子显微镜对 GO/Cu 纳米复合材料进行了表征。他们表明铜 (Cu) 纳米颗粒在氧化石墨烯片上生长良好。此外,微量稀释肉汤法用于确认抗菌物质对耐甲氧西林金 黄色葡萄球菌 (MRSA) 和 铜绿假单胞 菌 (P. aeruginosa) 的疗效,这些物质通常与医院感染有关。具体来说,99.8% 的 MRSA 和 84.7% 的铜 绿假单 胞菌被 500 μg/mL 的 GO/Cu 纳米复合材料消除。金属纳米复合材料可以通过释放离子、形成活性氧和物理破坏细菌来根除抗生素耐药细菌。这项研究证明了抗菌 GO/Cu 纳米复合材料在根除抗生素耐药细菌方面的潜力。
引言
细菌感染对公共卫生有重大影响。尤其是病原菌,可以逃避身体的保护机制并引起疾病1。抗生素广泛用于治疗细菌感染。然而,抗生素的不当使用促进了抗生素耐药细菌的出现。目前,由抗生素耐药细菌引起的院内感染已在医疗机构中引起明显的并发症2。不幸的是,细菌对所有当前的抗生素都有耐药机制3。因此,开发新的抗生素是必不可少的,尽管也很有可能出现耐药机制。
金属纳米颗粒因其有效的抗菌特性而成为对抗抗生素耐药细菌的有前途的药物 4,5,6。细菌很难对金属纳米颗粒产生耐药机制,因为它们不与任何特定的细菌受体结合7。特别是,银、铜和锌氧化物纳米颗粒因其卓越的抗菌功效而成为广泛研究的重点 8,9,10,11,12,13。金属纳米颗粒对细菌的毒性归因于三个主要机制:1) 金属离子的释放,2) 活性氧 (ROS) 的产生,例如 •OH 和 •O2−,以及 3) 物理相互作用和附着 4,14。
在这项研究中,开发了氧化石墨烯/铜 (GO/Cu) 纳米复合材料作为抗菌剂。铜 (Cu) 可有效杀死接触其表面的病原体并干扰细菌基因复制。然而,它是人体中必不可少的微量元素,对哺乳动物细胞的毒性较小,因为它具有调节细胞内 Cu 浓度的稳态机制4。当 Cu 纳米颗粒被氧化时,它们会产生 Cu 离子,Cu 离子对带负电荷的细菌具有相对较高的亲和力 15,16。Cu 离子与细胞结构(例如蛋白质、膜和 DNA)结合,破坏细胞功能17。通过在氧化石墨烯 (GO) 表面合成 Cu 纳米颗粒,可以控制金属离子的释放速率 18,19,20。GO 还通过防止细菌通过氧化应激粘附在粗糙表面或通过形成 ROS21,22 而显示出抗菌作用。此外,GO/Cu 纳米复合材料通过 Cu 2+ 的化学作用释放出比 GO 更多的 ROS,Cu2+ 会破坏细菌蛋白质和 DNA,导致细菌死亡23,24。
本文概述了合成 GO/Cu 纳米复合材料的方案,并介绍了一种针对临床细菌 MRSA 和 铜绿假单胞菌的抗菌检测方法,这是导致院内感染的最常见的多重耐药细菌菌株25。该协议旨在引入一种简单的化学还原方法来合成可以阻止抗生素耐药细菌生长的 GO/Cu 纳米复合材料。我们分别使用氯化铜 (II) (CuCl2) 和硼氢化钠 (NaBH4) 作为前驱体和还原剂。该协议还描述了使用微量稀释肉汤方法将这些纳米复合材料应用于细菌的细节。为了排除由于金属纳米颗粒的吸收干扰引起的误差并做出准确的评估,使用菌落计数法评估抗菌能力。
研究方案
1. GO/Cu 纳米复合材料的制备
注:生长在 GO 纳米片上的 Cu 纳米颗粒的大小和形态由 GO 氧化程度、Cu 前驱体的浓度和还原剂的浓度决定26。
- 在玻璃瓶中制备 10 mL 1 mg/mL GO 悬浮液。对 GO 悬浮液进行超声处理 1 小时,直到 GO 充分分散在蒸馏 (DI) 水中。
- 在玻璃瓶中制备 20 mM CuCl2 溶液。对 CuCl2 溶液进行超声处理,直到 CuCl2 充分分散在去离子水中。
- 向 GO 溶液中加入 10 mL 的 20 mM CuCl2 溶液,并在 70 °C 下对混合物进行超声处理 1 小时。
- 制备 20 mM NaBH4 溶液。
注意: 此程序必须在化学通风橱中进行。一旦将还原剂 NaBH4 引入水中,就会发生氧化还原反应。在实验前立即准备 NaBH4 溶液。 - 制备 NaBH4、GO 和 CuCl2 的混合物
- 将 20 mL 的 20 mM NaBH4 溶液添加到 GO 和 CuCl2 混合物中,同时用磁棒以 200 rpm 的速度搅拌。加入 NaBH4 溶液后,连续搅拌 30 分钟。
注意: 此程序必须在化学通风橱中进行。
- 将 20 mL 的 20 mM NaBH4 溶液添加到 GO 和 CuCl2 混合物中,同时用磁棒以 200 rpm 的速度搅拌。加入 NaBH4 溶液后,连续搅拌 30 分钟。
- 混合物的离心
- 将步骤 1.5.1 中的混合物转移到离心管中。在室温下以 23,000 × g 离心溶液 10 分钟。丢弃上清液。
注意: 操作离心机时,请始终通过放置同等重量的试管来保持平衡。
- 将步骤 1.5.1 中的混合物转移到离心管中。在室温下以 23,000 × g 离心溶液 10 分钟。丢弃上清液。
- 用 10 mL 去离子水重悬 GO/Cu 纳米复合混合物并对其进行超声处理,以使沉淀物均匀分散在整个溶液中。
- 在室温下以 23,000 × g 离心溶液 10 分钟;然后去除上清液。
- 再次重复步骤 1.7-1.8 以去除未反应的化学物质。
- 向 GO/Cu 纳米复合材料中加入 1 mL 蒸馏水,并对混合物进行超声处理,使沉淀物均匀分布在整个液相中。
注意:将所有 GO/Cu 纳米复合材料溶液收集在一个锥形管中。 - 在 -60 °C 下真空下将溶液冷冻干燥过夜,直到 GO/Cu 纳米复合材料完全干燥并获得 GO/Cu 纳米复合材料粉末。
- 将 GO/Cu 纳米复合材料粉末储存在 -20 °C 直至使用。
2. 抗菌试验用细菌的准备
注意:此程序必须在带有酒精灯的生物安全柜中进行。细菌废物在处置前必须进行高压灭菌。处理抗生素耐药细菌时,必须佩戴手套、长袍和口罩,实验后必须使用肥皂或洗手液洗手。始终彻底消毒;如果实验区域发生污染,请立即用 70% 乙醇消毒。
- 细菌培养基制备
- 在烧瓶中混合 20 g 胰蛋白酶大豆琼脂和 500 mL 蒸馏水。在 121 °C 的高压灭菌器中对混合物消毒 15 分钟。
- 在琼脂变硬之前,将 15 mL 琼脂溶液倒入培养皿中,制备琼脂平板。将琼脂板储存在 4 °C 直至使用。
注意:这必须在琼脂溶液硬化之前快速完成。为防止污染,在硬化过程中用紫外线对琼脂板消毒 15 分钟。 - 在烧瓶中混合 15 g 胰蛋白酶大豆汤 (TSB) 和 500 mL 蒸馏水。在 121 °C 的高压灭菌器中对混合物消毒 15 分钟。
- 将 40-50 mL 肉汤溶液分装到 50 mL 锥形管中。将肉汤储存在 4 °C 直至使用。
注意:为防止污染,请用紫外线对等分的肉汤消毒 15 分钟。
- 细菌培养
- 使用环将 MSRA 或 铜绿假单 胞菌原液接种在琼脂平板上。使用振荡培养箱在 37 °C 下孵育琼脂平板 24 小时。
- 使用环将一个细菌菌落接种到 10 mL 的肉汤中。使用振荡培养箱以 200 rpm 的转速在 37 °C 下孵育肉汤 24 小时。
- 再次重复步骤 2.2.1-2.2.2 以获得具有相同特性的细菌。
- 24 小时后,使用无菌蒸馏水连续将细菌溶液稀释 10 倍。将 100 μL 稀释的细菌悬浮液接种到琼脂平板上,然后用撒布机涂抹。使用振荡培养箱在 37 °C 下孵育琼脂平板 24 小时。
注意:稀释水平取决于细菌。目标是在琼脂平板中制备少于 100 个菌落。 - 孵育 24 小时后计数细菌菌落,以使用公式 (1) 确定菌落形成单位 (CFU)。
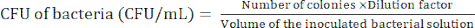 (1)
(1) - 重复步骤 2.2.4-2.2.5 至少 3 次,以确认细菌的 CFU 是否相对恒定。
3. 使用微量稀释肉汤法的抗菌试验
- 第 1 天) 使用环将琼脂平板中的一个细菌菌落接种到 10 mL 肉汤中。使用振荡培养箱以 200 rpm 的转速在 37 °C 下孵育肉汤 24 小时。
- 第 2 天)使用 Dulbecco 磷酸盐缓冲盐水 (DPBS) 制备至少三种浓度的 GO/Cu 纳米复合材料混合物。对 GO/Cu 纳米复合材料悬浮液进行超声处理,直到 GO/Cu 纳米复合材料在 DPBS 中充分分散。
注:在该方案中,测试了 500、250、125 和 62.5 μg/mL 的 GO/Cu 纳米复合材料混合物。 - 制备控制溶液。阴性对照是 DPBS,阳性对照是 DPBS 中 1% 的青霉素/链霉素溶液,可杀死细菌。
- 将 100 μL GO/Cu 纳米复合悬浮液和对照溶液添加到 96 孔板中。一式三份添加所有样品。
注意:在将样品应用于细菌之前,用紫外线对样品进行消毒 15 分钟。 - 根据孵育 24 小时后的 CFU,使用 TSB 将细菌悬浮液稀释至 1 × 106 CFU/mL。
注意:根据步骤 2.2.5,我们研究中的初始 MRSA 和 铜绿假单 胞菌培养悬浮液浓度分别为 4.5 × 109 CFU/mL 和 3 × 109 CFU/mL。通过分别将培养物稀释 4,500 倍和 3,000 倍,获得 1 ×10 6 CFU/mL 的细菌浓度。 - 将 100 μL 的 1 × 106 CFU/mL 稀释的细菌悬浮液接种到 96 孔板的样品孔中。使用振荡培养箱以 200 rpm 的转速在 37 °C 下孵育 96 孔板 24 小时。
注:与 100 μL 样品混合后,细菌的最终浓度为 5 × 105 CFU/mL。 - 第 3 天) 用 200 μL 微量移液器吸头充分混合样品和细菌悬浮液。用无菌蒸馏水连续将样品-细菌混合物稀释十倍。
注意:稀释水平取决于细菌。目标是在琼脂平板中制备少于 100 个菌落。 - 将 100 μL 稀释的细菌悬浮液接种到琼脂平板上,然后用撒布机涂抹。使用振荡培养箱在 37 °C 下孵育琼脂平板 24 小时。
- 第 4 天)使用方程 (2) 计数细菌菌落并确定 CFU 值以确认 GO/Cu 纳米复合材料的抗菌活性。
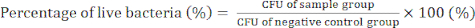 (2)
(2)
结果
进行了透射电子显微镜 (TEM) 、扫描电子显微镜 (SEM) 和能量色散 X 射线光谱 (EDS) 分析,以确认 GO/Cu 纳米复合材料的形成。 图 1A、B 显示异质 Cu 纳米颗粒在 GO 片材上生长。如图 1C 所示,EDS 映射确认 GO 片材上的颗粒是 Cu 纳米颗粒。
讨论
在此,我们报道了一种低成本且简单的制备沉积有 Cu 纳米颗粒的 GO 纳米片的方法,这将是根除抗生素耐药细菌的潜在有效方法。合成 GO/Cu 纳米复合材料的关键步骤是将 GO 和 CuCl2 彻底分散在溶液中,并在混合它们的同时保持高温。此外,氧化还原步骤必须快速进行,因为还原剂一旦与水接触就会引起还原反应。通常,Cu 纳米颗粒强烈倾向于自聚集,在生理介质?...
披露声明
Jonghoon Choi 博士是 Nanomedicine Corporation 费曼理工学院的首席执行官/创始人,Yonghyun Choi 博士是 The Nanomedicine Corporation 的 Feynman Institute of Technology 的首席技术官。
致谢
这项研究得到了 2022 年中央大学研究资助的支持(在 Jonghoon Choi 教授休假期间)。这项研究还得到了韩国国家研究基金会 (NRF) 的基础科学研究计划的支持,该计划由教育部资助 (No.RS-2023-00275006),以及由韩国环境部(MOE)资助的韩国环境工业与技术研究所(KEITI)(第2022002980003号)资助。临床 MRSA 和 铜绿假单 胞菌购自中央大学医院。
材料
| Name | Company | Catalog Number | Comments |
| Antibiotic-Antimycotic | Gibco | 15240062 | |
| Clinical MDR bacterial strains | Chung-Ang University Hospital (Seoul, South Korea) | ||
| Copper(II) chloride dihydrate | Duksan | 10125-13-0 | |
| Field Emission Scanning Electron Microscope (FE-SEM) | Carl Zeiss | SIGMA | |
| Graphene oxide | Sigma | 796034 | |
| Sodium Borohydride | Sigma | 71320 | |
| Transmission Electron Microscopy (TEM) | JEOL | JEM-2100 | |
| Tryptic Soy Agar | BD difco | 236950 | |
| Tryptic Soy Broth | BD difco | 211825 |
参考文献
- Doron, S., Gorbach, S. L. Bacterial infections: Overview. International Encyclopedia of Public Health. , 273-282 (2008).
- Van Duin, D., Paterson, D. L. Multidrug-resistant bacteria in the community: An update. Infect Dis Clin North Am. 34 (4), 709-722 (2020).
- Blair, J. M. A., Webber, M. A., Baylay, A. J., Ogbolu, D. O., Piddock, L. J. V. Molecular mechanisms of antibiotic resistance. Nat Rev Microbiol. 13 (1), 42-51 (2015).
- Sánchez-López, E., et al. Metal-based nanoparticles as antimicrobial agents: An overview. Nanomaterials (Basel). 10 (2), 292 (2020).
- Makabenta, J. M. V., et al. Nanomaterial-based therapeutics for antibiotic-resistant bacterial infections. Nat Rev Microbiol. 19 (1), 23-36 (2021).
- Liang, X., Govindaraju, S., Yun, K. Dual applicability of polyaniline coated gold nanorods: A study of antibacterial and redox activity. BioChip J. 12 (2), 137-145 (2018).
- Niño-Martínez, N., Salas Orozco, M. F., Martínez-Castañón, G. A., Torres Méndez, F., Ruiz, F. Molecular mechanisms of bacterial resistance to metal and metal oxide nanoparticles. Int J Mol Sci. 20 (11), 2808 (2019).
- Kim, J., Choi, Y., Park, J., Choi, J. Gelatin-gallic acid microcomplexes release go/cu nanomaterials to eradicate antibiotic-resistant microbes and their biofilm. ACS Infect Dis. 9 (2), 296-307 (2023).
- Jang, J., et al. Development of antibiofilm nanocomposites: Ag/cu bimetallic nanoparticles synthesized on the surface of graphene oxide nanosheets. ACS Appl Mater Interfaces. 12 (32), 35826-35834 (2020).
- Jang, J., Choi, Y., Tanaka, M., Choi, J. Development of silver/graphene oxide nanocomposites for antibacterial and antibiofilm applications. J Ind Eng Chem. 83, 46-52 (2020).
- Bankier, C., et al. Synergistic antibacterial effects of metallic nanoparticle combinations. Sci Rep. 9 (1), 16074 (2019).
- Mendes, C. R., et al. Antibacterial action and target mechanisms of zinc oxide nanoparticles against bacterial pathogens. Sci Rep. 12 (1), 2658 (2022).
- Yoon, S., et al. Biologically benign multi-functional mesoporous silica encapsulated gold/silver nanorods for anti-bacterial applications by on-demand release of silver ions. BioChip J. 13 (4), 362-369 (2019).
- Slavin, Y. N., Asnis, J., Häfeli, U. O., Bach, H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. J Nanobiotechnology. 15 (1), 65 (2017).
- Ismail, N. A., et al. Sonochemical synthesis of a copper reduced graphene oxide nanocomposite using honey and evaluation of its antibacterial and cytotoxic activities. Front Mol Biosci. 9, 995853 (2022).
- Tu, Y., et al. Remarkable antibacterial activity of reduced graphene oxide functionalized by copper ions. Adv Funct Mater. 31 (13), 2008018 (2021).
- Li, M., et al. Toward a molecular understanding of the antibacterial mechanism of copper-bearing titanium alloys against staphylococcus aureus. Adv Healthc Mater. 5 (5), 557-566 (2016).
- Yang, Z., et al. Long-term antibacterial stable reduced graphene oxide nanocomposites loaded with cuprous oxide nanoparticles. J Colloid Interface Sci. 533, 13-23 (2019).
- Yang, Y., et al. Graphene oxide/copper nanoderivatives-modified chitosan/hyaluronic acid dressings for facilitating wound healing in infected full-thickness skin defects. Int J Nanomedicine. 15, 8231-8247 (2020).
- Mao, M., et al. Graphene oxide-copper nanocomposites suppress cariogenic streptococcus mutans biofilm formation. Int J Nanomedicine. 16, 7727-7739 (2021).
- Ravikumar, V., Mijakovic, I., Pandit, S. Antimicrobial activity of graphene oxide contributes to alteration of key stress-related and membrane bound proteins. Int J Nanomedicine. 17, 6707-6721 (2022).
- Afreen, G., Shoeb, M., Upadhyayula, S. Effectiveness of reactive oxygen species generated from rgo/cds qd heterostructure for photodegradation and disinfection of pollutants in waste water. Mater Sci Eng C. 108, 110372 (2020).
- Yang, F., et al. Fabrication of graphene oxide/copper synergistic antibacterial coating for medical titanium substrate. J Colloid Interface Sci. 638, 1-13 (2023).
- Rajapaksha, P., et al. Antibacterial properties of graphene oxide-copper oxide nanoparticle nanocomposites. ACS Appl Bio Mater. 2 (12), 5687-5696 (2019).
- Sachdeva, C., Satyamoorthy, K., Murali, T. S. Microbial interplay in skin and chronic wounds. Curr Clin Microbiol Rep. 9 (3), 21-31 (2022).
- Ramos, M. K., Zarbin, A. J. G. Graphene/copper oxide nanoparticles thin films as precursor for graphene/copper hexacyanoferrate nanocomposites. Appl Surf Sci. 515, 146000 (2020).
- Fivenson, E. M., et al. A role for the gram-negative outer membrane in bacterial shape determination. PNAS. 120 (35), e2301987120 (2023).
- Wu, C., et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity. Biomater. 34 (2), 422-433 (2013).
- Zhang, W., et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of hif-1α. Adv Healthc Mater. 5 (11), 1299-1309 (2016).
- Labauve, A. E., Wargo, M. J. Growth and laboratory maintenance of pseudomonas aeruginosa. Curr Protoc Microbiol. 25 (1), 6E.1.1-6E.1.8 (2012).
- Lin, J., et al. The icmf3 locus is involved in multiple adaptation- and virulence-related characteristics in pseudomonas aeruginosa pao1. Front Cell Infect Microbiol. 5, 70 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。