Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изготовление антибактериальных нанокомпозитов на основе оксида графена/меди
В этой статье
Резюме
В данной работе мы представляем нанокомпозиты оксид графена/медь (GO/Cu) в качестве антибактериального наноматериала. Антибактериальная эффективность нанокомпозитов GO/Cu оценивалась в отношении как устойчивых к антибиотикам грамположительных, так и грамотрицательных бактерий.
Аннотация
Антибиотики в настоящее время являются наиболее часто используемым антибактериальным средством для уничтожения бактерий. Тем не менее, бактерии развивают устойчивость при постоянном чрезмерном воздействии антибиотиков. Разработка противомикробных препаратов, которые могут заменить существующие антибиотики, имеет важное значение, поскольку устойчивые к антибиотикам бактерии обладают механизмами устойчивости ко всем современным антибиотикам и могут способствовать развитию внутрибольничных инфекций. Чтобы решить эту проблему, в данном исследовании мы предлагаем нанокомпозиты оксид графена/медь (GO/Cu) в качестве антибактериальных материалов, которые могут заменить существующие антибиотики. Нанокомпозиты GO/Cu характеризуются просвечивающей электронной микроскопией и сканирующей электронной микроскопией. Они показывают, что наночастицы меди (Cu) хорошо растут на листах оксида графена. Кроме того, метод микроразведения используется для подтверждения эффективности антимикробного вещества в отношении метициллин-резистентного золотистого стафилококка (MRSA) и синегнойной палочки (P. aeruginosa), которые часто участвуют в внутрибольничных инфекциях. В частности, 99,8% MRSA и 84,7% P. aeruginosa элиминируются 500 мкг/мл нанокомпозитов GO/Cu. Нанокомпозиты металлов могут уничтожать устойчивые к антибиотикам бактерии, высвобождая ионы, образуя активные формы кислорода и физически повреждая бактерии. Это исследование демонстрирует потенциал антибактериальных нанокомпозитов GO/Cu в уничтожении устойчивых к антибиотикам бактерий.
Введение
Бактериальные инфекции оказывают значительное влияние на здоровье населения. Патогенные бактерии, в частности, могут уклоняться от защитных механизмов организма и вызывать заболевания1. Антибиотики широко используются для лечения бактериальных инфекций. Однако неправильное использование антибиотиков ускорило появление устойчивых к антибиотикам бактерий. В настоящее время внутрибольничные инфекции, связанные с устойчивыми к антибиотикам бактериями, вызывают заметные осложнения в медицинских учреждениях2. К сожалению, бактерии обладают механизмами устойчивости ко всем современным антибиотикам3. Поэтому разработка новых антибиотиков имеет важное значение, хотя существует также высокая вероятность появления механизмов резистентности.
Наночастицы металлов стали перспективными агентами для борьбы с антибиотикорезистентными бактериями благодаря своим эффективным антибактериальнымсвойствам 4,5,6. Бактериям трудно выработать механизмы устойчивости к наночастицам металлов, поскольку они не связываются с какими-либо специфическими бактериальными рецепторами7. В частности, наночастицы серебра, меди и оксида цинка находятся в центре обширных исследований из-за их замечательной антибактериальной эффективности 8,9,10,11,12,13. Токсичность наночастиц металлов по отношению к бактериям объясняется тремя основными механизмами: 1) высвобождением ионов металлов, 2) образованием активных форм кислорода (АФК), таких как •OH и •O2−, и 3) физическим взаимодействием и прикреплением 4,14.
В этом исследовании нанокомпозиты оксид графена/медь (GO/Cu) были разработаны в качестве антимикробного агента. Медь (Cu) эффективно убивает патогены, которые сталкиваются с ее поверхностью, и препятствует репликации бактериальных генов. Тем не менее, это незаменимый микроэлемент в организме человека, и он менее токсичен для клеток млекопитающих, поскольку обладает гомеостатическими механизмами, регулирующими концентрацию Cu внутри клеток4. Когда наночастицы Cu окисляются, они генерируют ионы Cu, которые имеют относительно высокое сродство к отрицательно заряженным бактериям 15,16. Ионы меди связываются с клеточными структурами (например, белками, мембранами и ДНК), нарушая функции клеток17. Синтезируя наночастицы Cu на поверхности оксида графена (GO), можно контролировать скорость высвобождения ионов металлов 18,19,20. GO также проявляет антибактериальный эффект, предотвращая адгезию бактерий с шероховатой поверхностью через окислительный стресс или образование АФК21,22. Кроме того, нанокомпозиты GO/Cu выделяют больше АФК, чем GO, благодаря химическому действию Cu2+, который повреждает бактериальные белки и ДНК, что приводит к гибели бактерий23,24.
В данной статье изложен протокол синтеза нанокомпозитов GO/Cu и представлен подход к антимикробному тестированию против клинических бактерий MRSA и P. aeruginosa, наиболее распространенных штаммов бактерий с множественной лекарственной устойчивостью, вызывающих внутрибольничные инфекции25. Этот протокол направлен на внедрение метода легкого химического восстановления для синтеза нанокомпозитов GO/Cu, которые могут препятствовать росту устойчивых к антибиотикам бактерий. Мы используем хлорид меди (II) (CuCl2) и боргидрид натрия (NaBH4) в качестве прекурсора и восстановителя соответственно. В протоколе также описаны особенности применения этих нанокомпозитов к бактериям методом микроразведения бульона. Чтобы исключить ошибки, связанные с абсорбционной интерференцией наночастиц металлов, и сделать точную оценку, антибактериальная способность оценивается с помощью метода подсчета колоний.
протокол
1. Получение нанокомпозитов GO/Cu
Размер и морфология наночастиц Cu, которые растут на нанолистах GO, определяются степенью окисления GO, концентрацией предшественника Cu и концентрацией восстановителя26.
- Приготовьте 10 мл суспензии ГО 1 мг/мл в стеклянном флаконе. Ультразвуковой обработкой суспензии ГО следует проводить в течение 1 ч до тех пор, пока ГО хорошо не диспергируется в дистиллированной (DI) воде.
- Приготовьте 20 мМ раствор CuCl2 в стеклянном флаконе. Обрабатывайте раствор CuCl2 ультразвуком до тех пор, пока CuCl2 хорошо диспергируется в деионизированной воде.
- Добавьте 10 мл раствора 20 мМ CuCl2 в раствор ГО и обрабатывайте смесь ультразвуком при 70 °C в течение 1 ч.
- Приготовьте 20 мМ раствор NaBH4 .
ВНИМАНИЕ: Эту процедуру необходимо проводить в вытяжном шкафу для химических веществ. Окислительно-восстановительная реакция происходит, как только восстановитель NaBH4 вводится в воду. Приготовьте раствор NaBH4 непосредственно перед экспериментом. - Приготовление смеси NaBH4, GO и CuCl2
- Добавьте 20 мл 20 мл раствора NaBH4 20 мМ в смесь GO и CuCl2 при перемешивании с помощью магнитного стержня со скоростью 200 об/мин. После добавления раствора NaBH4 непрерывно перемешивайте в течение 30 минут.
ВНИМАНИЕ: Эту процедуру необходимо проводить в вытяжном шкафу для химических веществ.
- Добавьте 20 мл 20 мл раствора NaBH4 20 мМ в смесь GO и CuCl2 при перемешивании с помощью магнитного стержня со скоростью 200 об/мин. После добавления раствора NaBH4 непрерывно перемешивайте в течение 30 минут.
- Центрифугирование смеси
- Переложите смесь с шага 1.5.1 в центрифужную пробирку. Центрифугируйте раствор при 23 000 × г в течение 10 минут при комнатной температуре. Выбросьте надосадочную жидкость.
ВНИМАНИЕ: При работе с центрифугой всегда поддерживайте равновесие, размещая пробирки одинакового веса.
- Переложите смесь с шага 1.5.1 в центрифужную пробирку. Центрифугируйте раствор при 23 000 × г в течение 10 минут при комнатной температуре. Выбросьте надосадочную жидкость.
- Ресуспендируйте нанокомпозитную смесь GO/Cu с 10 мл воды DI и произведите их ультразвуковую обработку, чтобы осадок равномерно распределился по всему раствору.
- Центрифугировать раствор при 23 000 × г в течение 10 мин при комнатной температуре; Затем удалите надосадочную жидкость.
- Повторите шаги 1.7-1.8 еще раз, чтобы удалить непрореагировавшие химические вещества.
- Добавьте 1 мл дистиллированной воды в нанокомпозиты GO/Cu и обработайте смесь ультразвуком для равномерного распределения осадка по всей жидкой фазе.
ПРИМЕЧАНИЕ: Соберите все нанокомпозитные растворы GO/Cu в одной конической пробирке. - Сублимационную сушку раствора при температуре −60 °C в вакууме в течение ночи до полного высыхания нанокомпозитов GO/Cu и получения порошка нанокомпозита GO/Cu.
- Храните нанокомпозитный порошок GO/Cu при температуре −20 °C до использования.
2. Подготовка бактерий к антибактериальному тесту
ВНИМАНИЕ: Эту процедуру необходимо проводить в шкафу биологической безопасности со спиртовой лампой. Перед утилизацией бактериальные отходы должны быть подвергнуты автоклавированию. При работе с устойчивыми к антибиотикам бактериями необходимо надевать перчатки, халаты и маски, а руки после эксперимента мыть с мылом или дезинфицирующим средством для рук. Всегда тщательно дезинфицируйте; Если на экспериментальном участке произошло заражение, немедленно продезинфицируйте его 70% этанолом.
- Приготовление бактериальных питательных сред
- Смешайте в колбе 20 г триптического соевого агара и 500 мл дистиллированной воды. Стерилизовать смесь в автоклаве при температуре 121 °C в течение 15 минут.
- Приготовьте агаровую пластину, налив 15 мл раствора агара в чашку Петри до того, как агар застынет. Храните агаровую пластину при температуре 4 °C до использования.
ПРИМЕЧАНИЕ: Это необходимо сделать быстро, пока агаровый раствор не застыл. Для предотвращения загрязнения стерилизуйте агаровую пластину ультрафиолетом в течение 15 минут во время затвердевания. - Смешайте в колбе 15 г триптического соевого бульона (TSB) и 500 мл дистиллированной воды. Стерилизовать смесь в автоклаве при температуре 121 °C в течение 15 минут.
- Аликвоту 40-50 мл раствора отвара в коническую пробирку объемом 50 мл. Хранить бульон при температуре 4 °C до использования.
ПРИМЕЧАНИЕ: Во избежание загрязнения стерилизуйте аликвотированный бульон ультрафиолетом в течение 15 минут.
- Бактериальный посев
- Инокулируйте исходный раствор MSRA или P. aeruginosa на агаровую пластину с помощью петли. Инкубируйте агаровую тарелку при температуре 37 °C с помощью встряхивающего инкубатора в течение 24 часов.
- Внесите одну колонию бактерий в 10 мл бульона с помощью петли. Инкубируйте бульон при температуре 37 °C с помощью встряхивающего инкубатора при 200 об/мин в течение 24 ч.
- Повторите шаги 2.2.1-2.2.2 еще раз, чтобы получить бактерии с теми же характеристиками.
- Через 24 ч последовательно разбавьте бактериальный раствор в десять раз, используя стерильную дистиллированную воду. Инокулируйте 100 мкл разведенной бактериальной суспензии на агаровую пластину и распределите ее с помощью разбрасывателя. Инкубируйте агаровую тарелку при температуре 37 °C с помощью встряхивающего инкубатора в течение 24 часов.
ПРИМЕЧАНИЕ: Уровень разбавления зависит от бактерий. Стремитесь приготовить менее 100 колоний в агаровой тарелке. - Подсчитайте колонии бактерий после 24-часовой инкубации, чтобы определить колониеобразующую единицу (КОЕ) с помощью уравнения (1).
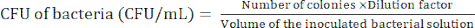 (1)
(1) - Повторите шаги 2.2.4-2.2.5 не менее 3 раз, чтобы подтвердить, является ли КОЕ бактерий относительно постоянным.
3. Антибактериальный тест методом микроразведения бульона
- День 1) Внесите одну колонию бактерий из агаровой пластины в 10 мл бульона с помощью петли. Инкубируйте бульон при температуре 37 °C с помощью встряхивающего инкубатора при 200 об/мин в течение 24 ч.
- День 2) Приготовьте смесь нанокомпозитов GO/Cu в не менее трех концентрациях с использованием фосфатно-солевого буфера Дульбекко (DPBS). Ультразвуком обрабатывают нанокомпозитную суспензию GO/Cu до тех пор, пока нанокомпозиты GO/Cu хорошо диспергируются в DPBS.
ПРИМЕЧАНИЕ: В данном протоколе были протестированы 500, 250, 125 и 62,5 мкг/мл нанокомпозитной смеси GO/Cu. - Приготовьте контрольные растворы. Отрицательным контролем является DPBS, а положительным контролем является 1% раствора пенициллина/стрептомицина в DPBS, который убивает бактерии.
- Добавьте 100 мкл нанокомпозитной суспензии GO/Cu и контрольные растворы в 96-луночные планшеты. Сложите все образцы в трех экземплярах.
ПРИМЕЧАНИЕ: Стерилизуйте образцы с помощью ультрафиолета в течение 15 минут перед нанесением их на бактерии. - В зависимости от КОЕ после 24 ч инкубации разбавить бактериальную суспензию с использованием TSB до 1 × 106 КОЕ/мл.
ПРИМЕЧАНИЕ: Исходные концентрации суспензии MRSA и P. aeruginosa в нашем исследовании, согласно этапу 2.2.5, составляют 4,5 × 109 КОЕ/мл и 3 × 109 КОЕ/мл соответственно. Бактериальные концентрации 1 × 106 КОЕ/мл получают путем разбавления культур в 4500х и 3000х соответственно. - Инокулируйте 100 мкл 1 × 106 КОЕ/мл разведенной бактериальной суспензии в лунки для образцов в 96-луночных планшетах. Инкубируйте 96-луночные планшеты при 37 °C с помощью встряхивающего инкубатора при 200 об/мин в течение 24 часов.
ПРИМЕЧАНИЕ: Конечная концентрация бактерий составляет 5 × 105 КОЕ/мл после смешивания со 100 μл образца. - День 3) Энергично перемешайте образец и бактериальные суспензии с помощью наконечника для микропипетки объемом 200 мкл. Серийно разбавляйте смесь проба с бактериями в десять раз стерильной дистиллированной водой.
ПРИМЕЧАНИЕ: Уровень разбавления зависит от бактерий. Стремитесь приготовить менее 100 колоний в агаровой тарелке. - Инокулируйте 100 мкл разведенной бактериальной суспензии на агаровую пластину и распределите ее с помощью разбрасывателя. Инкубируйте агаровую тарелку при температуре 37 °C с помощью встряхивающего инкубатора в течение 24 часов.
- День 4) Подсчет колоний бактерий и определение значений КОЕ для подтверждения антибактериальной активности нанокомпозитов GO/Cu с помощью уравнения (2).
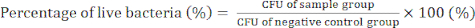 (2)
(2)
Результаты
Для подтверждения формирования нанокомпозитов GO/Cu были проведены анализы с помощью просвечивающей электронной микроскопии (ПЭМ), сканирующей электронной микроскопии (СЭМ) и энергодисперсионной рентгеновской спектроскопии (ЭДС). На рисунках 1A, B
Обсуждение
В данной работе мы сообщаем о недорогом и простом методе получения нанолистов GO, осажденных наночастицами Cu, который может быть потенциально эффективным методом для уничтожения устойчивых к антибиотикам бактерий. Важнейшим этапом синтеза нанокомпозитов GO/Cu являетс?...
Раскрытие информации
Д-р Чонхун Чой является генеральным директором/основателем, а д-р Йонгхён Чой является техническим директором Технологического института Фейнмана в Корпорации наномедицины.
Благодарности
Это исследование было поддержано исследовательским грантом Университета Чунг-Анг в 2022 году (во время творческого отпуска профессора Чонхун Чоя). Это исследование также было поддержано Программой фундаментальных научных исследований через Национальный исследовательский фонд Кореи (NRF), финансируемой Министерством образования (No. RS-2023-00275006) и грант Корейского института окружающей среды, промышленности и технологий (KEITI), финансируемый Министерством окружающей среды Кореи (MOE) (No 2022002980003). Клинические MRSA и P. aeruginosa были получены из университетской больницы Чунг-Анг.
Материалы
| Name | Company | Catalog Number | Comments |
| Antibiotic-Antimycotic | Gibco | 15240062 | |
| Clinical MDR bacterial strains | Chung-Ang University Hospital (Seoul, South Korea) | ||
| Copper(II) chloride dihydrate | Duksan | 10125-13-0 | |
| Field Emission Scanning Electron Microscope (FE-SEM) | Carl Zeiss | SIGMA | |
| Graphene oxide | Sigma | 796034 | |
| Sodium Borohydride | Sigma | 71320 | |
| Transmission Electron Microscopy (TEM) | JEOL | JEM-2100 | |
| Tryptic Soy Agar | BD difco | 236950 | |
| Tryptic Soy Broth | BD difco | 211825 |
Ссылки
- Doron, S., Gorbach, S. L. Bacterial infections: Overview. International Encyclopedia of Public Health. , 273-282 (2008).
- Van Duin, D., Paterson, D. L. Multidrug-resistant bacteria in the community: An update. Infect Dis Clin North Am. 34 (4), 709-722 (2020).
- Blair, J. M. A., Webber, M. A., Baylay, A. J., Ogbolu, D. O., Piddock, L. J. V. Molecular mechanisms of antibiotic resistance. Nat Rev Microbiol. 13 (1), 42-51 (2015).
- Sánchez-López, E., et al. Metal-based nanoparticles as antimicrobial agents: An overview. Nanomaterials (Basel). 10 (2), 292 (2020).
- Makabenta, J. M. V., et al. Nanomaterial-based therapeutics for antibiotic-resistant bacterial infections. Nat Rev Microbiol. 19 (1), 23-36 (2021).
- Liang, X., Govindaraju, S., Yun, K. Dual applicability of polyaniline coated gold nanorods: A study of antibacterial and redox activity. BioChip J. 12 (2), 137-145 (2018).
- Niño-Martínez, N., Salas Orozco, M. F., Martínez-Castañón, G. A., Torres Méndez, F., Ruiz, F. Molecular mechanisms of bacterial resistance to metal and metal oxide nanoparticles. Int J Mol Sci. 20 (11), 2808 (2019).
- Kim, J., Choi, Y., Park, J., Choi, J. Gelatin-gallic acid microcomplexes release go/cu nanomaterials to eradicate antibiotic-resistant microbes and their biofilm. ACS Infect Dis. 9 (2), 296-307 (2023).
- Jang, J., et al. Development of antibiofilm nanocomposites: Ag/cu bimetallic nanoparticles synthesized on the surface of graphene oxide nanosheets. ACS Appl Mater Interfaces. 12 (32), 35826-35834 (2020).
- Jang, J., Choi, Y., Tanaka, M., Choi, J. Development of silver/graphene oxide nanocomposites for antibacterial and antibiofilm applications. J Ind Eng Chem. 83, 46-52 (2020).
- Bankier, C., et al. Synergistic antibacterial effects of metallic nanoparticle combinations. Sci Rep. 9 (1), 16074 (2019).
- Mendes, C. R., et al. Antibacterial action and target mechanisms of zinc oxide nanoparticles against bacterial pathogens. Sci Rep. 12 (1), 2658 (2022).
- Yoon, S., et al. Biologically benign multi-functional mesoporous silica encapsulated gold/silver nanorods for anti-bacterial applications by on-demand release of silver ions. BioChip J. 13 (4), 362-369 (2019).
- Slavin, Y. N., Asnis, J., Häfeli, U. O., Bach, H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. J Nanobiotechnology. 15 (1), 65 (2017).
- Ismail, N. A., et al. Sonochemical synthesis of a copper reduced graphene oxide nanocomposite using honey and evaluation of its antibacterial and cytotoxic activities. Front Mol Biosci. 9, 995853 (2022).
- Tu, Y., et al. Remarkable antibacterial activity of reduced graphene oxide functionalized by copper ions. Adv Funct Mater. 31 (13), 2008018 (2021).
- Li, M., et al. Toward a molecular understanding of the antibacterial mechanism of copper-bearing titanium alloys against staphylococcus aureus. Adv Healthc Mater. 5 (5), 557-566 (2016).
- Yang, Z., et al. Long-term antibacterial stable reduced graphene oxide nanocomposites loaded with cuprous oxide nanoparticles. J Colloid Interface Sci. 533, 13-23 (2019).
- Yang, Y., et al. Graphene oxide/copper nanoderivatives-modified chitosan/hyaluronic acid dressings for facilitating wound healing in infected full-thickness skin defects. Int J Nanomedicine. 15, 8231-8247 (2020).
- Mao, M., et al. Graphene oxide-copper nanocomposites suppress cariogenic streptococcus mutans biofilm formation. Int J Nanomedicine. 16, 7727-7739 (2021).
- Ravikumar, V., Mijakovic, I., Pandit, S. Antimicrobial activity of graphene oxide contributes to alteration of key stress-related and membrane bound proteins. Int J Nanomedicine. 17, 6707-6721 (2022).
- Afreen, G., Shoeb, M., Upadhyayula, S. Effectiveness of reactive oxygen species generated from rgo/cds qd heterostructure for photodegradation and disinfection of pollutants in waste water. Mater Sci Eng C. 108, 110372 (2020).
- Yang, F., et al. Fabrication of graphene oxide/copper synergistic antibacterial coating for medical titanium substrate. J Colloid Interface Sci. 638, 1-13 (2023).
- Rajapaksha, P., et al. Antibacterial properties of graphene oxide-copper oxide nanoparticle nanocomposites. ACS Appl Bio Mater. 2 (12), 5687-5696 (2019).
- Sachdeva, C., Satyamoorthy, K., Murali, T. S. Microbial interplay in skin and chronic wounds. Curr Clin Microbiol Rep. 9 (3), 21-31 (2022).
- Ramos, M. K., Zarbin, A. J. G. Graphene/copper oxide nanoparticles thin films as precursor for graphene/copper hexacyanoferrate nanocomposites. Appl Surf Sci. 515, 146000 (2020).
- Fivenson, E. M., et al. A role for the gram-negative outer membrane in bacterial shape determination. PNAS. 120 (35), e2301987120 (2023).
- Wu, C., et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity. Biomater. 34 (2), 422-433 (2013).
- Zhang, W., et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of hif-1α. Adv Healthc Mater. 5 (11), 1299-1309 (2016).
- Labauve, A. E., Wargo, M. J. Growth and laboratory maintenance of pseudomonas aeruginosa. Curr Protoc Microbiol. 25 (1), 6E.1.1-6E.1.8 (2012).
- Lin, J., et al. The icmf3 locus is involved in multiple adaptation- and virulence-related characteristics in pseudomonas aeruginosa pao1. Front Cell Infect Microbiol. 5, 70 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены