È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fabbricazione di nanocompositi antibatterici di ossido di grafene/rame
In questo articolo
Riepilogo
In questo articolo, introduciamo i nanocompositi di ossido di grafene/rame (GO/Cu) come nanomateriale antibatterico. L'efficacia antibatterica dei nanocompositi GO/Cu è stata valutata sia contro i batteri gram-positivi che contro i batteri gram-negativi resistenti agli antibiotici.
Abstract
Gli antibiotici sono attualmente il trattamento antibatterico più utilizzato per uccidere i batteri. Tuttavia, i batteri sviluppano resistenza quando sono continuamente sovraesposti agli antibiotici. Lo sviluppo di agenti antimicrobici in grado di sostituire gli antibiotici esistenti è essenziale perché i batteri resistenti agli antibiotici hanno meccanismi di resistenza per tutti gli antibiotici attuali e possono promuovere infezioni nosocomiali. Per affrontare questa sfida, in questo studio, proponiamo nanocompositi di ossido di grafene/rame (GO/Cu) come materiali antibatterici che possono sostituire gli antibiotici esistenti. I nanocompositi GO/Cu sono caratterizzati dalla microscopia elettronica a trasmissione e dalla microscopia elettronica a scansione. Mostrano che le nanoparticelle di rame (Cu) sono ben cresciute sui fogli di ossido di grafene. Inoltre, viene utilizzato un metodo di brodo di microdiluizione per confermare l'efficacia della sostanza antimicrobica contro lo Staphylococcus aureus resistente alla meticillina (MRSA) e lo Pseudomonas aeruginosa (P. aeruginosa), che sono frequentemente implicati nelle infezioni nosocomiali. In particolare, il 99,8% degli MRSA e l'84,7% di P. aeruginosa vengono eliminati da 500 μg/mL di nanocompositi GO/Cu. I nanocompositi metallici possono sradicare i batteri resistenti agli antibiotici rilasciando ioni, formando specie reattive dell'ossigeno e danneggiando fisicamente i batteri. Questo studio dimostra il potenziale dei nanocompositi antibatterici GO/Cu nell'eradicazione dei batteri resistenti agli antibiotici.
Introduzione
Le infezioni batteriche hanno un impatto significativo sulla salute pubblica. I batteri patogeni, in particolare, possono eludere i meccanismi protettivi dell'organismo e causare malattie1. Gli antibiotici sono ampiamente usati per trattare le infezioni batteriche. Tuttavia, l'uso inappropriato di antibiotici ha accelerato l'emergere di batteri resistenti agli antibiotici. Attualmente, le infezioni nosocomiali attribuibili a batteri resistenti agli antibiotici hanno causato notevoli complicanze nelle strutture sanitarie2. Sfortunatamente, i batteri hanno meccanismi di resistenza per tutti gli antibiotici attuali3. Pertanto, lo sviluppo di nuovi antibiotici è essenziale, sebbene vi sia anche un'alta probabilità che emergano meccanismi di resistenza.
Le nanoparticelle metalliche sono emerse come agenti promettenti per combattere i batteri resistenti agli antibiotici grazie alle loro efficaci proprietà antibatteriche 4,5,6. È difficile per i batteri sviluppare meccanismi di resistenza contro le nanoparticelle metalliche perché non si legano a nessun recettore batterico specifico7. In particolare, le nanoparticelle di argento, rame e ossido di zinco sono al centro di un'ampia ricerca a causa della loro notevole efficacia antibatterica 8,9,10,11,12,13. La tossicità delle nanoparticelle metalliche nei confronti dei batteri è attribuita a tre meccanismi primari: 1) il rilascio di ioni metallici, 2) la generazione di specie reattive dell'ossigeno (ROS), come •OH e •O2−, e 3) l'interazione fisica e l'attaccamento 4,14.
In questo studio, i nanocompositi di ossido di grafene/rame (GO/Cu) sono stati sviluppati come agente antimicrobico. Il rame (Cu) uccide efficacemente gli agenti patogeni che incontrano la sua superficie e interferisce con la replicazione genica batterica. Tuttavia, è un microelemento essenziale nel corpo umano ed è meno tossico per le cellule dei mammiferi perché ha meccanismi omeostatici che regolano le concentrazioni di Cu all'interno delle cellule4. Quando le nanoparticelle di Cu vengono ossidate, generano ioni Cu, che hanno un'affinità relativamente alta per i batteri caricati negativamente15,16. Gli ioni Cu si legano alle strutture cellulari (ad esempio, proteine, membrane e DNA), interrompendo le funzioni cellulari17. Sintetizzando nanoparticelle di Cu sulla superficie dell'ossido di grafene (GO), è possibile controllare il tasso di rilascio di ioni metallici 18,19,20. Il GO mostra anche un effetto antibatterico prevenendo l'adesione batterica con una superficie ruvida attraverso lo stress ossidativo o formando ROS21,22. Inoltre, i nanocompositi GO/Cu rilasciano più ROS che GO attraverso l'azione chimica del Cu2+, che danneggia le proteine batteriche e il DNA, portando alla morte dei batteri23,24.
Questo documento delinea il protocollo per la sintesi di nanocompositi GO/Cu e introduce un approccio di test antimicrobico contro i batteri clinici MRSA e P. aeruginosa, i più comuni ceppi di batteri multiresistenti che causano infezioni nosocomiali25. Questo protocollo mira a introdurre un metodo di riduzione chimica semplice per la sintesi di nanocompositi GO/Cu che possono ostacolare la crescita di batteri resistenti agli antibiotici. Utilizziamo il cloruro di rame(II) (CuCl2) e il boroidruro di sodio (NaBH4) rispettivamente come precursore e agente riducente. Il protocollo descrive anche le specifiche dell'applicazione di questi nanocompositi ai batteri utilizzando il metodo del brodo di microdiluizione. Per escludere errori dovuti all'interferenza di assorbimento delle nanoparticelle metalliche e fare valutazioni accurate, la capacità antibatterica viene valutata utilizzando il metodo del conteggio delle colonie.
Protocollo
1. Preparazione dei nanocompositi GO/Cu
NOTA: La dimensione e la morfologia delle nanoparticelle di Cu che crescono sui nanofogli di GO sono determinate dal grado di ossidazione del GO, dalla concentrazione del precursore del Cu e dalla concentrazione dell'agente riducente26.
- Preparare 10 mL di sospensione di OB da 1 mg/mL in un flacone di vetro. Sonicare la sospensione GO per 1 ora fino a quando il GO non è ben disperso in acqua distillata (DI).
- Preparare una soluzione di 20 mM di CuCl2 in un flaconcino di vetro. Sonicare la soluzione di CuCl2 fino a quando CuCl2 non è ben disperso in acqua deionizzata.
- Aggiungere 10 mL della soluzione 20 mM di CuCl2 alla soluzione di GO e sonicare la miscela a 70 °C per 1 ora.
- Preparare una soluzione di NaBH4 da 20 mM.
ATTENZIONE: Questa procedura deve essere eseguita in una cappa chimica. Una reazione redox si verifica non appena l'agente riducente NaBH4 viene introdotto nell'acqua. Preparare la soluzione di NaBH4 immediatamente prima dell'esperimento. - Preparazione della miscela di NaBH4, GO e CuCl2
- Aggiungere 20 mL della soluzione 20 mM di NaBH4 alla miscela di OB e CuCl2 mescolando con una barra magnetica a 200 giri/min. Dopo aver aggiunto la soluzione di NaBH4 , mescolare continuamente per 30 minuti.
ATTENZIONE: Questa procedura deve essere eseguita in una cappa chimica.
- Aggiungere 20 mL della soluzione 20 mM di NaBH4 alla miscela di OB e CuCl2 mescolando con una barra magnetica a 200 giri/min. Dopo aver aggiunto la soluzione di NaBH4 , mescolare continuamente per 30 minuti.
- Centrifugazione della miscela
- Trasferire la miscela del passaggio 1.5.1 in una provetta da centrifuga. Centrifugare la soluzione a 23.000 × g per 10 minuti a temperatura ambiente. Scartare il surnatante.
ATTENZIONE: Quando si utilizza la centrifuga, mantenere sempre l'equilibrio posizionando tubi di uguale peso.
- Trasferire la miscela del passaggio 1.5.1 in una provetta da centrifuga. Centrifugare la soluzione a 23.000 × g per 10 minuti a temperatura ambiente. Scartare il surnatante.
- Risospendere la miscela nanocomposita GO/Cu con 10 mL di acqua deionizzata e sonicarla per consentire al precipitato di disperdersi uniformemente in tutta la soluzione.
- Centrifugare la soluzione a 23.000 × g per 10 minuti a temperatura ambiente; Quindi rimuovere il surnatante.
- Ripetere ancora una volta i passaggi 1.7-1.8 per rimuovere le sostanze chimiche non reagite.
- Aggiungere 1 mL di acqua distillata ai nanocompositi GO/Cu e sonicare la miscela per disperdere uniformemente il sedimento in tutta la fase liquida.
NOTA: Raccogliere tutte le soluzioni nanocomposite GO/Cu in un unico tubo conico. - Liofilizzare la soluzione a -60 °C sotto vuoto per una notte fino a quando i nanocompositi GO/Cu sono completamente essiccati e ottengono polvere di nanocomposito GO/Cu.
- Conservare la polvere di nanocomposito GO/Cu a -20 °C fino al momento dell'uso.
2. Preparazione dei batteri per il test antibatterico
ATTENZIONE: Questa procedura deve essere eseguita in una cabina di sicurezza biologica con una lampada ad alcool. I rifiuti batterici devono essere sterilizzati in autoclave prima dello smaltimento. Quando si maneggiano batteri resistenti agli antibiotici, è necessario indossare guanti, camici e maschere e lavarsi le mani con sapone o disinfettante per le mani dopo l'esperimento. Disinfettare sempre accuratamente; Se si verifica una contaminazione nell'area sperimentale, disinfettarla immediatamente con etanolo al 70%.
- Preparazione di terreni di coltura batterica
- Mescolare 20 g di agar di soia triptico e 500 ml di acqua distillata in un pallone. Sterilizzare la miscela in autoclave a 121 °C per 15 min.
- Preparare la piastra di agar versando 15 ml di soluzione di agar in una piastra di Petri prima che l'agar si indurisca. Conservare la piastra di agar a 4 °C fino al momento dell'uso.
NOTA: Questa operazione deve essere eseguita rapidamente prima che la soluzione di agar si indurisca. Per evitare contaminazioni, sterilizzare la piastra di agar con UV per 15 minuti durante l'indurimento. - Mescolare 15 g di brodo di soia triptico (TSB) e 500 ml di acqua distillata in un pallone. Sterilizzare la miscela in autoclave a 121 °C per 15 min.
- Aliquotare 40-50 mL della soluzione di brodo in una provetta conica da 50 mL. Conservare il brodo a 4 °C fino al momento dell'utilizzo.
NOTA: Per evitare contaminazioni, sterilizzare il brodo aliquotato con UV per 15 minuti.
- Coltura batterica
- Inoculare la soluzione madre di MSRA o P. aeruginosa sulla piastra di agar utilizzando un anello. Incubare la piastra di agar a 37 °C utilizzando un'incubatrice ad agitazione per 24 ore.
- Inoculare una colonia di batteri in 10 ml di brodo usando un anello. Incubare il brodo a 37 °C utilizzando un'incubatrice agitatrice a 200 giri/min per 24 ore.
- Ripetere ancora una volta i passaggi 2.2.1-2.2.2 per ottenere batteri con le stesse caratteristiche.
- Dopo 24 ore, diluire in serie la soluzione batterica di dieci volte utilizzando acqua distillata sterile. Inoculare 100 μl della sospensione batterica diluita sulla piastra di agar e stenderla con uno spandiconcime. Incubare la piastra di agar a 37 °C utilizzando un'incubatrice ad agitazione per 24 ore.
NOTA: Il livello di diluizione dipende dai batteri. Cerca di preparare meno di 100 colonie in una piastra di agar. - Contare le colonie batteriche dopo l'incubazione di 24 ore per determinare l'unità formante colonia (CFU) utilizzando l'equazione (1).
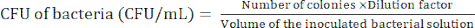 (1)
(1) - Ripetere i passaggi 2.2.4-2.2.5 almeno 3 volte per confermare se la CFU dei batteri è relativamente costante.
3. Test antibatterico con il metodo del brodo di microdiluizione
- Giorno 1) Inoculare una colonia di batteri dalla piastra di agar in 10 ml di brodo usando un anello. Incubare il brodo a 37 °C utilizzando un'incubatrice agitatrice a 200 giri/min per 24 ore.
- Giorno 2) Preparare la miscela di nanocompositi GO/Cu in almeno tre concentrazioni utilizzando la soluzione salina tamponata con fosfato (DPBS) di Dulbecco. Sonicare la sospensione nanocomposita GO/Cu fino a quando i nanocompositi GO/Cu non sono ben dispersi in DPBS.
NOTA: In questo protocollo sono stati testati 500, 250, 125 e 62,5 μg/mL della miscela nanocomposita GO/Cu. - Preparare le soluzioni di controllo. Il controllo negativo è il DPBS e il controllo positivo è l'1% di una soluzione di penicillina/streptomicina nel DPBS che ucciderà i batteri.
- Aggiungere 100 μl della sospensione nanocomposita GO/Cu e le soluzioni di controllo in piastre a 96 pozzetti. Aggiungere tutti i campioni in triplice copia.
NOTA: Sterilizzare i campioni con UV per 15 minuti prima di applicarli ai batteri. - Sulla base delle CFU dopo 24 ore di incubazione, diluire la sospensione batterica con TSB a 1 × 106 CFU/mL.
NOTA: Le concentrazioni iniziali di MRSA e sospensione di coltura di P. aeruginosa nel nostro studio, secondo la fase 2.2.5, sono rispettivamente di 4,5 × 109 CFU/mL e 3 × 109 CFU/mL. Concentrazioni batteriche di 1 × 106 CFU/mL si ottengono diluendo le colture rispettivamente 4.500x e 3.000x. - Inoculare 100 μl della sospensione batterica diluita da 1 ×10 6 CFU/mL nei pozzetti del campione nelle piastre a 96 pozzetti. Incubare le piastre a 96 pozzetti a 37 °C utilizzando un incubatore vibrante a 200 giri/min per 24 ore.
NOTA: La concentrazione finale di batteri è di 5 × 105 CFU/mL dopo la miscelazione con 100 μL di campione. - Giorno 3) Miscelare energicamente il campione e le sospensioni batteriche con un puntale per micropipetta da 200 μl. Diluire in serie la miscela campione-batteri di dieci volte con acqua distillata sterile.
NOTA: Il livello di diluizione dipende dai batteri. Cerca di preparare meno di 100 colonie in una piastra di agar. - Inoculare 100 μl della sospensione batterica diluita sulla piastra di agar e stenderla con uno spandiconcime. Incubare la piastra di agar a 37 °C utilizzando un'incubatrice ad agitazione per 24 ore.
- Giorno 4) Contare le colonie batteriche e determinare i valori di CFU per confermare l'attività antibatterica dei nanocompositi GO/Cu utilizzando l'equazione (2).
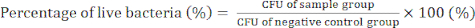 (2)
(2)
Risultati
Per confermare la formazione di nanocompositi GO/Cu sono state eseguite analisi di microscopia elettronica a trasmissione (TEM), microscopia elettronica a scansione (SEM) e spettroscopia a raggi X a dispersione di energia (EDS). Le figure 1A, B mostrano che nanoparticelle di rame eterogenee sono state coltivate sui fogli di GO. Come mostrato nella Figura 1C, la mappatura EDS ha confermato che le particelle sul f...
Discussione
In questo articolo, riportiamo un metodo semplice e a basso costo per la preparazione di nanofogli di GO depositati con nanoparticelle di Cu, che sarebbe un metodo potenzialmente efficiente per sradicare i batteri resistenti agli antibiotici. Il passaggio critico nella sintesi dei nanocompositi GO/Cu consiste nel disperdere completamente GO e CuCl2 nella soluzione e mantenere una temperatura elevata durante la miscelazione. Inoltre, la fase redox deve essere eseguita rapidamen...
Divulgazioni
Il Dr. Jonghoon Choi è l'Amministratore Delegato/Fondatore e il Dr. Yonghyun Choi è il CTO del Feynman Institute of Technology presso la Nanomedicine Corporation.
Riconoscimenti
Questa ricerca è stata sostenuta dalla borsa di ricerca dell'Università Chung-Ang nel 2022 (durante il congedo sabbatico del professor Jonghoon Choi). Questa ricerca è stata supportata anche dal Programma di Ricerca Scientifica di Base attraverso la National Research Foundation of Korea (NRF), finanziato dal Ministero dell'Istruzione (No. RS-2023-00275006) e la sovvenzione del Korea Environment Industry & Technology Institute (KEITI) finanziata dal Ministero dell'Ambiente coreano (MOE) (n. 2022002980003). L'MRSA clinico e il P. aeruginosa sono stati ottenuti dall'ospedale universitario di Chung-Ang.
Materiali
| Name | Company | Catalog Number | Comments |
| Antibiotic-Antimycotic | Gibco | 15240062 | |
| Clinical MDR bacterial strains | Chung-Ang University Hospital (Seoul, South Korea) | ||
| Copper(II) chloride dihydrate | Duksan | 10125-13-0 | |
| Field Emission Scanning Electron Microscope (FE-SEM) | Carl Zeiss | SIGMA | |
| Graphene oxide | Sigma | 796034 | |
| Sodium Borohydride | Sigma | 71320 | |
| Transmission Electron Microscopy (TEM) | JEOL | JEM-2100 | |
| Tryptic Soy Agar | BD difco | 236950 | |
| Tryptic Soy Broth | BD difco | 211825 |
Riferimenti
- Doron, S., Gorbach, S. L. Bacterial infections: Overview. International Encyclopedia of Public Health. , 273-282 (2008).
- Van Duin, D., Paterson, D. L. Multidrug-resistant bacteria in the community: An update. Infect Dis Clin North Am. 34 (4), 709-722 (2020).
- Blair, J. M. A., Webber, M. A., Baylay, A. J., Ogbolu, D. O., Piddock, L. J. V. Molecular mechanisms of antibiotic resistance. Nat Rev Microbiol. 13 (1), 42-51 (2015).
- Sánchez-López, E., et al. Metal-based nanoparticles as antimicrobial agents: An overview. Nanomaterials (Basel). 10 (2), 292 (2020).
- Makabenta, J. M. V., et al. Nanomaterial-based therapeutics for antibiotic-resistant bacterial infections. Nat Rev Microbiol. 19 (1), 23-36 (2021).
- Liang, X., Govindaraju, S., Yun, K. Dual applicability of polyaniline coated gold nanorods: A study of antibacterial and redox activity. BioChip J. 12 (2), 137-145 (2018).
- Niño-Martínez, N., Salas Orozco, M. F., Martínez-Castañón, G. A., Torres Méndez, F., Ruiz, F. Molecular mechanisms of bacterial resistance to metal and metal oxide nanoparticles. Int J Mol Sci. 20 (11), 2808 (2019).
- Kim, J., Choi, Y., Park, J., Choi, J. Gelatin-gallic acid microcomplexes release go/cu nanomaterials to eradicate antibiotic-resistant microbes and their biofilm. ACS Infect Dis. 9 (2), 296-307 (2023).
- Jang, J., et al. Development of antibiofilm nanocomposites: Ag/cu bimetallic nanoparticles synthesized on the surface of graphene oxide nanosheets. ACS Appl Mater Interfaces. 12 (32), 35826-35834 (2020).
- Jang, J., Choi, Y., Tanaka, M., Choi, J. Development of silver/graphene oxide nanocomposites for antibacterial and antibiofilm applications. J Ind Eng Chem. 83, 46-52 (2020).
- Bankier, C., et al. Synergistic antibacterial effects of metallic nanoparticle combinations. Sci Rep. 9 (1), 16074 (2019).
- Mendes, C. R., et al. Antibacterial action and target mechanisms of zinc oxide nanoparticles against bacterial pathogens. Sci Rep. 12 (1), 2658 (2022).
- Yoon, S., et al. Biologically benign multi-functional mesoporous silica encapsulated gold/silver nanorods for anti-bacterial applications by on-demand release of silver ions. BioChip J. 13 (4), 362-369 (2019).
- Slavin, Y. N., Asnis, J., Häfeli, U. O., Bach, H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. J Nanobiotechnology. 15 (1), 65 (2017).
- Ismail, N. A., et al. Sonochemical synthesis of a copper reduced graphene oxide nanocomposite using honey and evaluation of its antibacterial and cytotoxic activities. Front Mol Biosci. 9, 995853 (2022).
- Tu, Y., et al. Remarkable antibacterial activity of reduced graphene oxide functionalized by copper ions. Adv Funct Mater. 31 (13), 2008018 (2021).
- Li, M., et al. Toward a molecular understanding of the antibacterial mechanism of copper-bearing titanium alloys against staphylococcus aureus. Adv Healthc Mater. 5 (5), 557-566 (2016).
- Yang, Z., et al. Long-term antibacterial stable reduced graphene oxide nanocomposites loaded with cuprous oxide nanoparticles. J Colloid Interface Sci. 533, 13-23 (2019).
- Yang, Y., et al. Graphene oxide/copper nanoderivatives-modified chitosan/hyaluronic acid dressings for facilitating wound healing in infected full-thickness skin defects. Int J Nanomedicine. 15, 8231-8247 (2020).
- Mao, M., et al. Graphene oxide-copper nanocomposites suppress cariogenic streptococcus mutans biofilm formation. Int J Nanomedicine. 16, 7727-7739 (2021).
- Ravikumar, V., Mijakovic, I., Pandit, S. Antimicrobial activity of graphene oxide contributes to alteration of key stress-related and membrane bound proteins. Int J Nanomedicine. 17, 6707-6721 (2022).
- Afreen, G., Shoeb, M., Upadhyayula, S. Effectiveness of reactive oxygen species generated from rgo/cds qd heterostructure for photodegradation and disinfection of pollutants in waste water. Mater Sci Eng C. 108, 110372 (2020).
- Yang, F., et al. Fabrication of graphene oxide/copper synergistic antibacterial coating for medical titanium substrate. J Colloid Interface Sci. 638, 1-13 (2023).
- Rajapaksha, P., et al. Antibacterial properties of graphene oxide-copper oxide nanoparticle nanocomposites. ACS Appl Bio Mater. 2 (12), 5687-5696 (2019).
- Sachdeva, C., Satyamoorthy, K., Murali, T. S. Microbial interplay in skin and chronic wounds. Curr Clin Microbiol Rep. 9 (3), 21-31 (2022).
- Ramos, M. K., Zarbin, A. J. G. Graphene/copper oxide nanoparticles thin films as precursor for graphene/copper hexacyanoferrate nanocomposites. Appl Surf Sci. 515, 146000 (2020).
- Fivenson, E. M., et al. A role for the gram-negative outer membrane in bacterial shape determination. PNAS. 120 (35), e2301987120 (2023).
- Wu, C., et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity. Biomater. 34 (2), 422-433 (2013).
- Zhang, W., et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of hif-1α. Adv Healthc Mater. 5 (11), 1299-1309 (2016).
- Labauve, A. E., Wargo, M. J. Growth and laboratory maintenance of pseudomonas aeruginosa. Curr Protoc Microbiol. 25 (1), 6E.1.1-6E.1.8 (2012).
- Lin, J., et al. The icmf3 locus is involved in multiple adaptation- and virulence-related characteristics in pseudomonas aeruginosa pao1. Front Cell Infect Microbiol. 5, 70 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon