JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
항균 그래핀 산화물/구리 나노복합체 제조
요약
여기에서는 항균 나노 물질로 그래 핀 산화물 / 구리 (GO / Cu) 나노 복합체를 소개합니다. GO/Cu 나노복합체의 항균 효과는 항생제 내성 그람 양성 및 그람 음성 박테리아 모두에 대해 평가되었습니다.
초록
항생제는 현재 박테리아를 죽이기 위해 가장 많이 사용되는 항균 치료제입니다. 그러나 박테리아는 항생제에 지속적으로 과도하게 노출되면 내성이 생깁니다. 항생제 내성균은 현재의 모든 항생제에 대한 내성 기전을 가지고 있고 병원 내 감염을 촉진할 수 있기 때문에 기존 항생제를 대체할 수 있는 항균제의 개발이 필수적입니다. 이러한 과제를 해결하기 위해 본 연구에서는 기존 항생제를 대체할 수 있는 항균 소재로 산화그래핀/구리(GO/Cu) 나노복합체를 제안한다. GO/Cu 나노복합체는 투과 전자 현미경 및 주사 전자 현미경이 특징입니다. 그들은 구리(Cu) 나노 입자가 그래핀 산화물 시트에서 잘 성장한다는 것을 보여줍니다. 또한 원내 감염과 자주 관련이 있는 메티실린 내성 황색포도상구균(MRSA) 및 녹농균(P. aeruginosa)에 대한 항균 물질의 효능을 확인하기 위해 미세 희석 육수 방법을 사용합니다. 구체적으로, MRSA의 99.8%와 녹농균의 84.7%는 500μg/mL의 GO/Cu 나노복합체에 의해 제거됩니다. 금속 나노 복합체는 이온을 방출하고 활성 산소 종을 형성하며 박테리아를 물리적으로 손상시켜 항생제 내성 박테리아를 박멸할 수 있습니다. 이 연구는 항생제 내성 박테리아를 박멸하는 데 있어 항균 GO/Cu 나노복합체의 잠재력을 보여줍니다.
서문
세균 감염은 공중 보건에 중대한 영향을 미칩니다. 특히 병원성 세균은 인체의 보호 기전을 회피하여 질병을 유발할 수 있습니다1. 항생제는 세균 감염을 치료하는 데 널리 사용됩니다. 하지만 항생제의 부적절한 사용으로 인해 항생제 내성 박테리아의 출현이 가속화되었습니다. 현재 항생제 내성 세균에 의한 병원 내 감염은 의료 시설에서 눈에 띄는 합병증을 일으키고 있다2. 불행히도, 박테리아는 현재의 모든 항생제에 대한 내성 기전을 가지고 있다3. 따라서 새로운 항생제 개발이 필수적이지만, 내성 기전이 나타날 가능성도 높습니다.
금속 나노 입자는 효과적인 항균 특성으로 인해 항생제 내성 박테리아와 싸우기위한 유망한 물질로 부상했습니다 4,5,6. 박테리아가 금속 나노 입자에 대한 내성 메커니즘을 개발하는 것은 특정 박테리아 수용체에 결합하지 않기 때문에 어렵다7. 특히은, 구리 및 산화 아연 나노 입자는 놀라운 항균 효능(8,9,10,11,12,13)으로 인해 광범위한 연구의 초점입니다. 박테리아에 대한 금속 나노 입자의 독성은 1) 금속 이온의 방출, 2) •OH 및 •O2−와 같은 활성 산소 종 (ROS)의 생성, 3) 물리적 상호 작용 및 부착 4,14의 세 가지 주요 메커니즘에 기인합니다.
이 연구에서는 항균제로 그래핀 산화물/구리(GO/Cu) 나노복합체를 개발했습니다. 구리(Cu)는 표면을 만나고 박테리아 유전자 복제를 방해하는 병원균을 효율적으로 죽입니다. 그러나, 그것은 인체에 필수적인 미세 원소이며, 세포 내부의 Cu 농도를 조절하는 항상성 메커니즘을 가지고 있기 때문에 포유류 세포에 덜 독성이 있습니다4. Cu 나노 입자가 산화되면 Cu 이온이 생성되며, 이는 음전하를 띤 박테리아15,16에 대해 상대적으로 높은 친화력을 갖는다. Cu 이온은 세포 구조(예: 단백질, 막 및 DNA)에 결합하여 세포 기능을 방해합니다17. 산화 그래 핀 (GO)의 표면에 Cu 나노 입자를 합성함으로써 금속 이온의 방출 속도를 18,19,20으로 제어 할 수 있습니다. GO는 또한 산화 스트레스를 통해 거친 표면과의 세균 접착을 방지하거나 ROS21,22를 형성함으로써 항균 효과를 나타냅니다. 또한, GO / Cu 나노 복합체는 Cu2 +의 화학적 작용을 통해 GO보다 더 많은 ROS를 방출하여 박테리아 단백질과 DNA를 손상시켜 박테리아23,24의 죽음을 초래합니다.
이 논문은 GO/Cu 나노복합체를 합성하기 위한 프로토콜을 간략하게 설명하고 병원 감염을 일으키는 가장 흔한 다제내성 박테리아 균주인 임상 박테리아 MRSA 및 P. aeruginosa에 대한 항균 테스트 접근 방식을 소개합니다25. 이 프로토콜은 항생제 내성 박테리아의 성장을 방해할 수 있는 GO/Cu 나노 복합체를 합성하기 위한 용이한 화학적 환원 방법을 도입하는 것을 목표로 합니다. 당사는 염화구리(II)염화구리(CuCl2)와 수소화붕소나트륨(NaBH4)을 각각 전구체 및 환원제로 사용합니다. 이 프로토콜은 또한 미세 희석 육수 방법을 사용하여 이러한 나노 복합체를 박테리아에 적용하는 세부 사항을 설명합니다. 금속 나노입자의 흡수 간섭으로 인한 오류를 배제하고 정확한 평가를 위해 콜로니 카운팅 방법을 사용하여 항균 능력을 평가합니다.
프로토콜
1. GO/Cu 나노복합체의 제조
참고 : GO 나노 시트에서 성장하는 Cu 나노 입자의 크기와 형태는 GO 산화 정도, Cu 전구체의 농도 및 환원제(26)의 농도에 의해 결정됩니다.
- 유리병에 1mg/mL GO 현탁액 10mL를 준비합니다. GO가 증류수(DI)에 잘 분산될 때까지 GO 현탁액을 1시간 동안 초음파 처리합니다.
- 유리 바이알에 20mM CuCl2 용액을 준비합니다. CuCl2 가 DI 물에 잘 분산 될 때까지 CuCl2 용액을 초음파 처리합니다.
- 20mM CuCl2 용액 10mL를 GO 용액에 첨가하고 혼합물을 70 ° C에서 1 시간 동안 초음파 처리합니다.
- 20mM NaBH4 용액을 준비합니다.
주의: 이 절차는 화학 흄 후드에서 수행해야 합니다. 산화 환원 반응은 환원제 NaBH4 가 물에 도입되자마자 발생합니다. 실험 직전에 NaBH4 용액을 준비합니다. - NaBH4, GO 및CuCl2의 혼합물 제조
- 20mM NaBH4 용액 20mL를 GO 및 CuCl2 혼합물에 넣고 200rpm에서 마그네틱 바(magnetic bar)로 교반합니다. NaBH4 용액을 첨가한 후 30분 동안 계속 저어줍니다.
주의: 이 절차는 화학 흄 후드에서 수행해야 합니다.
- 20mM NaBH4 용액 20mL를 GO 및 CuCl2 혼합물에 넣고 200rpm에서 마그네틱 바(magnetic bar)로 교반합니다. NaBH4 용액을 첨가한 후 30분 동안 계속 저어줍니다.
- 혼합물의 원심분리
- 1.5.1 단계의 혼합물을 원심 분리기 튜브로 옮깁니다. 용액을 23,000× g 에서 실온에서 10분 동안 원심분리합니다. 상층액을 버리십시오.
주의 : 원심분리기를 작동할 때는 항상 동일한 무게의 튜브를 배치하여 균형을 유지하십시오.
- 1.5.1 단계의 혼합물을 원심 분리기 튜브로 옮깁니다. 용액을 23,000× g 에서 실온에서 10분 동안 원심분리합니다. 상층액을 버리십시오.
- GO / Cu 나노 복합 혼합물을 10mL의 DI 물로 재현탁하고 침전물이 용액 전체에 고르게 분산되도록 초음파 처리합니다.
- 용액을 23,000× g 에서 실온에서 10분 동안 원심분리합니다. 그런 다음 상층액을 제거하십시오.
- 1.7-1.8단계를 한 번 더 반복하여 미반응 화학 물질을 제거합니다.
- GO / Cu 나노 복합체에 증류수 1mL를 첨가하고 혼합물을 초음파 처리하여 침전물을 액상 전체에 고르게 분산시킵니다.
알림: 하나의 원추형 튜브에 모든 GO/Cu 나노 복합 용액을 수집합니다. - GO / Cu 나노 복합체가 완전히 건조되고 GO / Cu 나노 복합체 분말을 얻을 때까지 진공 상태에서 -60 ° C에서 하룻밤 동안 용액을 동결 건조시킵니다.
- GO/Cu 나노복합 분말을 사용할 때까지 -20°C에서 보관하십시오.
2. 항균 시험을 위한 세균의 준비
주의: 이 절차는 알코올이 있는 생물 안전 캐비닛에서 수행해야 합니다.amp. 박테리아 폐기물은 폐기하기 전에 고압멸균해야 합니다. 항생제 내성균을 다룰 때는 장갑, 가운, 마스크 등을 착용해야 하며, 실험 후에는 비누나 손 소독제를 사용하여 손을 씻어야 합니다. 항상 철저히 소독하십시오. 실험 구역에서 오염이 발생하면 즉시 70% 에탄올로 소독하십시오.
- 세균 배양 배지 준비
- 플라스크에 트립틱 대두 한천 20g과 증류수 500mL를 섞습니다. 혼합물을 121°C의 오토클레이브에서 15분 동안 멸균합니다.
- 한천이 굳기 전에 한천 용액 15mL를 페트리 접시에 붓고 한천 플레이트를 준비합니다. 사용할 때까지 한천 플레이트를 4°C에서 보관하십시오.
참고: 이 작업은 한천 용액이 경화되기 전에 신속하게 수행해야 합니다. 오염을 방지하려면 경화하는 동안 한천 플레이트를 UV로 15분 동안 살균하십시오. - 플라스크에 트립틱 콩 육수(TSB) 15g과 증류수 500mL를 섞습니다. 혼합물을 121°C의 오토클레이브에서 15분 동안 멸균합니다.
- 40-50mL의 육수 용액을 50mL 원뿔형 튜브에 분취합니다. 사용할 때까지 육수를 4 °C에서 보관하십시오.
알림: 오염을 방지하려면 분양된 육수를 UV로 15분 동안 살균하십시오.
- 세균 배양
- 루프를 사용하여 한천 플레이트에 MSRA 또는 P. aeruginosa 원액을 접종합니다. 진탕 인큐베이터를 사용하여 37°C에서 한천 플레이트를 24시간 동안 배양합니다.
- 루프를 사용하여 박테리아 군집 하나를 육수 10mL에 접종합니다. 200rpm에서 진탕 인큐베이터를 사용하여 37°C에서 24시간 동안 육수를 배양합니다.
- 2.2.1-2.2.2 단계를 한 번 더 반복하여 동일한 특성을 가진 박테리아를 얻습니다.
- 24시간 후 멸균 증류수를 사용하여 박테리아 용액을 10배로 연속적으로 희석합니다. 희석된 세균 현탁액 100μL를 한천 플레이트에 접종하고 스프레더로 펴 바릅니다. 진탕 인큐베이터를 사용하여 37°C에서 한천 플레이트를 24시간 동안 배양합니다.
알림: 희석 수준은 박테리아에 따라 다릅니다. 한천 플레이트에 100개 미만의 콜로니를 준비하는 것을 목표로 합니다. - 방정식 (1)을 사용하여 콜로니 형성 단위(CFU)를 결정하기 위해 24시간 배양 후 박테리아 콜로니를 계산합니다.
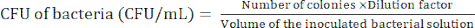 (1)
(1) - 2.2.4-2.2.5 단계를 3 회 이상 반복하여 박테리아의 CFU가 상대적으로 일정한지 확인합니다.
3. 미세희석액법을 이용한 항균시험
- 1일차) 루프를 사용하여 한천 플레이트의 박테리아 콜로니 1개를 육수 10mL에 접종합니다. 200rpm에서 진탕 인큐베이터를 사용하여 37°C에서 24시간 동안 육수를 배양합니다.
- 2일차) Dulbecco의 인산염 완충 식염수(DPBS)를 사용하여 GO/Cu 나노복합체 혼합물을 최소 3가지 농도로 준비합니다. GO / Cu 나노 복합체가 DPBS에 잘 분산 될 때까지 GO / Cu 나노 복합체 현탁액을 초음파 처리합니다.
참고: 이 프로토콜에서는 GO/Cu 나노복합체 혼합물의 500, 250, 125 및 62.5μg/mL를 테스트했습니다. - 제어 용액을 준비합니다. 음성 대조군은 DPBS이고 양성 대조군은 DPBS에 있는 페니실린/스트렙토마이신 용액의 1%로 박테리아를 죽입니다.
- 100μL의 GO/Cu 나노복합 현탁액과 대조 용액을 96웰 플레이트에 추가합니다. 모든 샘플을 삼중으로 추가합니다.
알림: 박테리아에 적용하기 전에 샘플을 UV로 15분 동안 살균하십시오. - 배양 24시간 후 CFU를 기준으로 TSB를 사용하여 박테리아 현탁액을 1 × 106 CFU/mL로 희석합니다.
참고: 2.2.5단계에 따른 본 연구의 초기 MRSA 및 녹농균 배양 현탁액 농도는 각각 4.5 × 109 CFU/mL 및 3 × 109 CFU/mL입니다. 1 × 106 CFU/mL의 박테리아 농도는 배양액을 각각 4,500배 및 3,000배 희석하여 얻습니다. - 1 × 106 CFU/mL 희석된 박테리아 현탁액 100μL를 96웰 플레이트의 시료 웰에 접종합니다. 200rpm에서 24시간 동안 진탕 인큐베이터를 사용하여 37°C에서 96웰 플레이트를 배양합니다.
참고: 박테리아의 최종 농도는 100μL의 샘플과 혼합한 후 5 × 105 CFU/mL입니다. - 3일차) 200μL 마이크로피펫 팁으로 샘플과 박테리아 현탁액을 세게 혼합합니다. 샘플-박테리아 혼합물을 멸균 증류수로 순차적으로 희석합니다.
알림: 희석 수준은 박테리아에 따라 다릅니다. 한천 플레이트에 100개 미만의 콜로니를 준비하는 것을 목표로 합니다. - 희석된 세균 현탁액 100μL를 한천 플레이트에 접종하고 스프레더로 펴 바릅니다. 진탕 인큐베이터를 사용하여 37°C에서 한천 플레이트를 24시간 동안 배양합니다.
- 4일차) 세균 군집을 세고 CFU 값을 결정하여 수학식 (2)를 사용하여 GO/Cu 나노복합체의 항균 활성을 확인합니다.
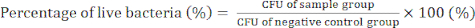 (2)
(2)
결과
투과 전자 현미경 (TEM), 주사 전자 현미경 (SEM) 및 에너지 분산 X 선 분광법 (EDS) 분석을 수행하여 GO / Cu 나노 복합체의 형성을 확인했습니다. 그림 1A, B 는 이질적인 Cu 나노 입자가 GO 시트에서 성장했음을 보여줍니다. 그림 1C에서 볼 수 있듯이 EDS 매핑은 GO 시트의 입자가 Cu 나노 입자임을 확인했습니다.
토론
여기에서, 우리는 항생제 내성 박테리아를 근절하기 위한 잠재적으로 효율적인 방법이 될 Cu 나노 입자로 증착된 GO 나노시트를 제조하는 저렴하고 간단한 방법을 보고합니다. GO/Cu 나노복합체를 합성하는 데 있어 중요한 단계는 GO와 CuCl2를 용액에 완전히 분산시키고 혼합하면서 고온을 유지하는 것입니다. 또한, 환원제는 물과 접촉하자마자 환원 반응을 일으키기...
공개
최종훈 박사는 CEO/설립자이며, 최용현 박사는 Nanomedicine Corporation의 파인만 공과대학(Feynman Institute of Technology)의 CTO입니다.
감사의 말
이번 연구는 2022년 중앙대학교 연구지원금(최종훈 교수의 안식년 휴가 기간)으로 지원됐다. 이 연구는 또한 한국연구재단(NRF)의 기초과학연구사업의 지원을 받아 이루어졌으며, 교육부의 지원을 받았다. RS-2023-00275006), 환경부(MOE) 주관 한국환경산업기술원(KEITI) 지원금(제2022002980003호)을 보유하고 있다. 임상적 MRSA와 녹농균은 중앙대학교병원에서 채취하였다.
자료
| Name | Company | Catalog Number | Comments |
| Antibiotic-Antimycotic | Gibco | 15240062 | |
| Clinical MDR bacterial strains | Chung-Ang University Hospital (Seoul, South Korea) | ||
| Copper(II) chloride dihydrate | Duksan | 10125-13-0 | |
| Field Emission Scanning Electron Microscope (FE-SEM) | Carl Zeiss | SIGMA | |
| Graphene oxide | Sigma | 796034 | |
| Sodium Borohydride | Sigma | 71320 | |
| Transmission Electron Microscopy (TEM) | JEOL | JEM-2100 | |
| Tryptic Soy Agar | BD difco | 236950 | |
| Tryptic Soy Broth | BD difco | 211825 |
참고문헌
- Doron, S., Gorbach, S. L. Bacterial infections: Overview. International Encyclopedia of Public Health. , 273-282 (2008).
- Van Duin, D., Paterson, D. L. Multidrug-resistant bacteria in the community: An update. Infect Dis Clin North Am. 34 (4), 709-722 (2020).
- Blair, J. M. A., Webber, M. A., Baylay, A. J., Ogbolu, D. O., Piddock, L. J. V. Molecular mechanisms of antibiotic resistance. Nat Rev Microbiol. 13 (1), 42-51 (2015).
- Sánchez-López, E., et al. Metal-based nanoparticles as antimicrobial agents: An overview. Nanomaterials (Basel). 10 (2), 292 (2020).
- Makabenta, J. M. V., et al. Nanomaterial-based therapeutics for antibiotic-resistant bacterial infections. Nat Rev Microbiol. 19 (1), 23-36 (2021).
- Liang, X., Govindaraju, S., Yun, K. Dual applicability of polyaniline coated gold nanorods: A study of antibacterial and redox activity. BioChip J. 12 (2), 137-145 (2018).
- Niño-Martínez, N., Salas Orozco, M. F., Martínez-Castañón, G. A., Torres Méndez, F., Ruiz, F. Molecular mechanisms of bacterial resistance to metal and metal oxide nanoparticles. Int J Mol Sci. 20 (11), 2808 (2019).
- Kim, J., Choi, Y., Park, J., Choi, J. Gelatin-gallic acid microcomplexes release go/cu nanomaterials to eradicate antibiotic-resistant microbes and their biofilm. ACS Infect Dis. 9 (2), 296-307 (2023).
- Jang, J., et al. Development of antibiofilm nanocomposites: Ag/cu bimetallic nanoparticles synthesized on the surface of graphene oxide nanosheets. ACS Appl Mater Interfaces. 12 (32), 35826-35834 (2020).
- Jang, J., Choi, Y., Tanaka, M., Choi, J. Development of silver/graphene oxide nanocomposites for antibacterial and antibiofilm applications. J Ind Eng Chem. 83, 46-52 (2020).
- Bankier, C., et al. Synergistic antibacterial effects of metallic nanoparticle combinations. Sci Rep. 9 (1), 16074 (2019).
- Mendes, C. R., et al. Antibacterial action and target mechanisms of zinc oxide nanoparticles against bacterial pathogens. Sci Rep. 12 (1), 2658 (2022).
- Yoon, S., et al. Biologically benign multi-functional mesoporous silica encapsulated gold/silver nanorods for anti-bacterial applications by on-demand release of silver ions. BioChip J. 13 (4), 362-369 (2019).
- Slavin, Y. N., Asnis, J., Häfeli, U. O., Bach, H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. J Nanobiotechnology. 15 (1), 65 (2017).
- Ismail, N. A., et al. Sonochemical synthesis of a copper reduced graphene oxide nanocomposite using honey and evaluation of its antibacterial and cytotoxic activities. Front Mol Biosci. 9, 995853 (2022).
- Tu, Y., et al. Remarkable antibacterial activity of reduced graphene oxide functionalized by copper ions. Adv Funct Mater. 31 (13), 2008018 (2021).
- Li, M., et al. Toward a molecular understanding of the antibacterial mechanism of copper-bearing titanium alloys against staphylococcus aureus. Adv Healthc Mater. 5 (5), 557-566 (2016).
- Yang, Z., et al. Long-term antibacterial stable reduced graphene oxide nanocomposites loaded with cuprous oxide nanoparticles. J Colloid Interface Sci. 533, 13-23 (2019).
- Yang, Y., et al. Graphene oxide/copper nanoderivatives-modified chitosan/hyaluronic acid dressings for facilitating wound healing in infected full-thickness skin defects. Int J Nanomedicine. 15, 8231-8247 (2020).
- Mao, M., et al. Graphene oxide-copper nanocomposites suppress cariogenic streptococcus mutans biofilm formation. Int J Nanomedicine. 16, 7727-7739 (2021).
- Ravikumar, V., Mijakovic, I., Pandit, S. Antimicrobial activity of graphene oxide contributes to alteration of key stress-related and membrane bound proteins. Int J Nanomedicine. 17, 6707-6721 (2022).
- Afreen, G., Shoeb, M., Upadhyayula, S. Effectiveness of reactive oxygen species generated from rgo/cds qd heterostructure for photodegradation and disinfection of pollutants in waste water. Mater Sci Eng C. 108, 110372 (2020).
- Yang, F., et al. Fabrication of graphene oxide/copper synergistic antibacterial coating for medical titanium substrate. J Colloid Interface Sci. 638, 1-13 (2023).
- Rajapaksha, P., et al. Antibacterial properties of graphene oxide-copper oxide nanoparticle nanocomposites. ACS Appl Bio Mater. 2 (12), 5687-5696 (2019).
- Sachdeva, C., Satyamoorthy, K., Murali, T. S. Microbial interplay in skin and chronic wounds. Curr Clin Microbiol Rep. 9 (3), 21-31 (2022).
- Ramos, M. K., Zarbin, A. J. G. Graphene/copper oxide nanoparticles thin films as precursor for graphene/copper hexacyanoferrate nanocomposites. Appl Surf Sci. 515, 146000 (2020).
- Fivenson, E. M., et al. A role for the gram-negative outer membrane in bacterial shape determination. PNAS. 120 (35), e2301987120 (2023).
- Wu, C., et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity. Biomater. 34 (2), 422-433 (2013).
- Zhang, W., et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of hif-1α. Adv Healthc Mater. 5 (11), 1299-1309 (2016).
- Labauve, A. E., Wargo, M. J. Growth and laboratory maintenance of pseudomonas aeruginosa. Curr Protoc Microbiol. 25 (1), 6E.1.1-6E.1.8 (2012).
- Lin, J., et al. The icmf3 locus is involved in multiple adaptation- and virulence-related characteristics in pseudomonas aeruginosa pao1. Front Cell Infect Microbiol. 5, 70 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유