É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fabricação de Nanocompósitos Antibacterianos de Óxido de Grafeno/Cobre
Neste Artigo
Resumo
Aqui, introduzimos nanocompósitos de óxido de grafeno / cobre (GO /) como um nanomaterial antibacteriano. A eficácia antibacteriana dos nanocompósitos GO/foi avaliada contra bactérias gram-positivas e gram-negativas resistentes a antibióticos.
Resumo
Os antibióticos são atualmente o tratamento antibacteriano mais utilizado para matar bactérias. No entanto, as bactérias desenvolvem resistência quando continuamente superexpostas a antibióticos. O desenvolvimento de agentes antimicrobianos que possam substituir os antibióticos existentes é essencial porque as bactérias resistentes a antibióticos têm mecanismos de resistência a todos os antibióticos atuais e podem promover infecções nosocomiais. Para enfrentar esse desafio, neste estudo, propomos nanocompósitos de óxido de grafeno/cobre (GO/) como materiais antibacterianos que podem substituir os antibióticos existentes. Os nanocompósitos GO/são caracterizados por microscopia eletrônica de transmissão e microscopia eletrônica de varredura. Eles mostram que as nanopartículas de cobre () são bem cultivadas nas folhas de óxido de grafeno. Além disso, um método de caldo de microdiluição é usado para confirmar a eficácia da substância antimicrobiana contra Staphylococcus aureus resistente à meticilina (MRSA) e Pseudomonas aeruginosa (P. aeruginosa), que são frequentemente implicados em infecções nosocomiais. Especificamente, 99,8% do MRSA e 84,7% do P. aeruginosa são eliminados por 500 μg/mL de nanocompósitos GO/. Os nanocompósitos metálicos podem erradicar bactérias resistentes a antibióticos liberando íons, formando espécies reativas de oxigênio e danificando fisicamente as bactérias. Este estudo demonstra o potencial dos nanocompósitos antibacterianos GO/na erradicação de bactérias resistentes a antibióticos.
Introdução
As infecções bacterianas têm um impacto significativo na saúde pública. As bactérias patogênicas, em particular, podem escapar dos mecanismos de proteção do corpo e causar doenças1. Os antibióticos são amplamente utilizados para tratar infecções bacterianas. No entanto, o uso inadequado de antibióticos precipitou o surgimento de bactérias resistentes a antibióticos. Atualmente, infecções hospitalares atribuíveis a bactérias resistentes a antibióticos têm causado complicações notáveis em estabelecimentos de saúde2. Infelizmente, as bactérias têm mecanismos de resistência para todos os antibióticos atuais3. Portanto, o desenvolvimento de novos antibióticos é essencial, embora também haja uma alta probabilidade de que surjam mecanismos de resistência.
As nanopartículas metálicas surgiram como agentes promissores para combater bactérias resistentes a antibióticos devido às suas propriedades antibacterianas eficazes 4,5,6. É difícil para as bactérias desenvolverem mecanismos de resistência contra nanopartículas metálicas porque elas não se ligam a nenhum receptor bacteriano específico7. Em particular, as nanopartículas de óxido de prata, cobre e zinco são o foco de extensas pesquisas devido à sua notável eficácia antibacteriana 8,9,10,11,12,13. A toxicidade das nanopartículas metálicas para as bactérias é atribuída a três mecanismos primários: 1) a liberação de íons metálicos, 2) a geração de espécies reativas de oxigênio (ROS), como •OH e •O2−, e 3) interação física e fixação 4,14.
Neste estudo, nanocompósitos de óxido de grafeno/cobre (GO/) foram desenvolvidos como um agente antimicrobiano. O cobre () mata eficientemente os patógenos que encontram sua superfície e interfere na replicação do gene bacteriano. No entanto, é um microelemento essencial no corpo humano e é menos tóxico para as células de mamíferos, pois possui mecanismos homeostáticos que regulam as concentrações de no interior das células4. Quando as nanopartículas de são oxidadas, elas geram íons, que têm uma afinidade relativamente alta por bactérias carregadas negativamente15,16. Os íons se ligam às estruturas celulares (por exemplo, proteínas, membranas e DNA), interrompendo as funções celulares17. Ao sintetizar nanopartículas de na superfície do óxido de grafeno (GO), a taxa de liberação de íons metálicos pode ser controlada 18,19,20. O GO também apresenta efeito antibacteriano ao impedir a adesão bacteriana com uma superfície áspera por meio do estresse oxidativo ou pela formação de ROS21,22. Além disso, os nanocompósitos GO/liberam mais ROS do que GO através da ação química do2+, que danifica as proteínas bacterianas e o DNA, levando à morte de bactérias23,24.
Este artigo descreve o protocolo para sintetizar nanocompósitos GO/e apresenta uma abordagem de teste antimicrobiano contra bactérias clínicas MRSA e P. aeruginosa, as cepas de bactérias multirresistentes mais comuns que causam infecções nosocomiais25. Este protocolo visa introduzir um método de redução química fácil para sintetizar nanocompósitos GO/que podem impedir o crescimento de bactérias resistentes a antibióticos. Usamos cloreto de cobre (II) (CuCl2) e borohidreto de sódio (NaBH4) como precursor e agente redutor, respectivamente. O protocolo também descreve as especificidades da aplicação desses nanocompósitos a bactérias usando o método de caldo de microdiluição. Para excluir erros devido à interferência de absorção de nanopartículas metálicas e fazer avaliações precisas, a capacidade antibacteriana é avaliada usando o método de contagem de colônias.
Protocolo
1. Preparação dos nanocompósitos GO/
NOTA: O tamanho e a morfologia das nanopartículas de que crescem nas nanofolhas de GO são determinados pelo grau de oxidação de GO, a concentração do precursor de e a concentração do agente redutor26.
- Prepare 10 mL de suspensão de GO de 1 mg / mL em um frasco de vidro. Sonicar a suspensão de GO durante 1 h até que o GO esteja bem disperso em água destilada (DI).
- Prepare uma solução de CuCl20 mM 2 num frasco para injetáveis de vidro. Sonicar a solução de CuCl2 até que o CuCl2 esteja bem disperso em água DI.
- Adicionar 10 ml da solução de CuCl2 20 mM à solução de GO e sonicar a mistura a 70 °C durante 1 h.
- Prepare uma solução de NaBH20 mM 4.
CUIDADO: Este procedimento deve ser realizado em uma capela de exaustão química. Uma reação redox ocorre assim que o agente redutor NaBH4 é introduzido na água. Preparar a solução de NaBH4 imediatamente antes da experiência. - Preparando a mistura de NaBH4, GO e CuCl2
- Adicione 20 mL da solução 20 mM de NaBH4 à mistura de GO e CuCl2 , mexendo com uma barra magnética a 200 rpm. Após adicionar a solução de NaBH4 , mexa continuamente por 30 min.
CUIDADO: Este procedimento deve ser realizado em uma capela de exaustão química.
- Adicione 20 mL da solução 20 mM de NaBH4 à mistura de GO e CuCl2 , mexendo com uma barra magnética a 200 rpm. Após adicionar a solução de NaBH4 , mexa continuamente por 30 min.
- Centrifugação da mistura
- Transferir a mistura do passo 1.5.1 para um tubo de centrifugação. Centrifugue a solução a 23.000 × g por 10 min à temperatura ambiente. Descarte o sobrenadante.
CUIDADO: Ao operar a centrífuga, sempre mantenha o equilíbrio colocando tubos de igual peso.
- Transferir a mistura do passo 1.5.1 para um tubo de centrifugação. Centrifugue a solução a 23.000 × g por 10 min à temperatura ambiente. Descarte o sobrenadante.
- Ressuspenda a mistura de nanocompósitos GO/com 10 mL de água DI e sonice-os para permitir que o precipitado se disperse uniformemente por toda a solução.
- Centrifugue a solução a 23.000 × g por 10 min em temperatura ambiente; Em seguida, remova o sobrenadante.
- Repita as etapas 1.7-1.8 mais uma vez para remover os produtos químicos que não reagiram.
- Adicione 1 mL de água destilada aos nanocompósitos GO/e sonice a mistura para dispersar o sedimento uniformemente por toda a fase líquida.
NOTA: Colete todas as soluções de nanocompósitos GO/em um tubo cônico. - Liofilizar a solução a -60 °C sob vácuo durante a noite até que os nanocompósitos GO/estejam completamente secos e obtenham o pó nanocompósito GO/.
- Armazene o pó nanocompósito GO/a -20 °C até o uso.
2. Preparação de bactérias para o teste antibacteriano
CUIDADO: Este procedimento deve ser realizado em uma cabine de segurança biológica com uma lâmpada de álcool. Os resíduos bacterianos devem ser autoclavados antes do descarte. Ao manusear bactérias resistentes a antibióticos, luvas, aventais e máscaras devem ser usados, e as mãos devem ser lavadas com sabão ou desinfetante para as mãos após o experimento. Sempre desinfete completamente; Se ocorrer contaminação na área experimental, desinfete-a imediatamente com etanol 70%.
- Preparação de meios de cultura bacterianos
- Misture 20 g de ágar tríptico de soja e 500 mL de água destilada em um frasco. Esterilize a mistura em autoclave a 121 °C por 15 min.
- Prepare a placa de ágar despejando 15 mL da solução de ágar em uma placa de Petri antes que o ágar endureça. Conservar a placa de ágar-ágar a 4 °C até à utilização.
NOTA: Isso deve ser feito rapidamente antes que a solução de ágar endureça. Para evitar contaminação, esterilize a placa de ágar com UV por 15 min durante o endurecimento. - Misture 15 g de caldo tríptico de soja (TSB) e 500 mL de água destilada em um frasco. Esterilize a mistura em autoclave a 121 °C por 15 min.
- Alíquota 40-50 mL da solução de caldo em um tubo cônico de 50 mL. Conservar o caldo a 4 °C até à utilização.
NOTA: Para evitar contaminação, esterilize o caldo aliquotado com UV por 15 min.
- Cultura bacteriana
- Inocular a solução-mãe MSRA ou P. aeruginosa na placa de ágar usando uma alça. Incubar a placa de ágar-ágar a 37 °C com uma incubadora agitada durante 24 h.
- Inocule uma colônia da bactéria em 10 mL do caldo usando um laço. Incubar o caldo a 37 °C com uma incubadora agitada a 200 rpm durante 24 h.
- Repita as etapas 2.2.1-2.2.2 mais uma vez para obter bactérias com as mesmas características.
- Após 24 h, diluir em série a solução bacteriana dez vezes com água destilada estéril. Inocular 100 μl da suspensão bacteriana diluída na placa de ágar e espalhar com um espalhador. Incubar a placa de ágar-ágar a 37 °C com uma incubadora agitada durante 24 h.
NOTA: O nível de diluição depende das bactérias. Procure preparar menos de 100 colônias em uma placa de ágar. - Contar as colónias bacterianas após 24 h de incubação para determinar a unidade formadora de colónias (UFC) utilizando a equação (1).
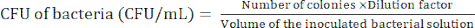 Características (1)
Características (1) - Repita as etapas 2.2.4-2.2.5 pelo menos 3x para confirmar se a UFC da bactéria é relativamente constante.
3. Teste antibacteriano usando o método de caldo de microdiluição
- Dia 1) Inocule uma colônia da bactéria da placa de ágar em 10 mL do caldo usando um laço. Incubar o caldo a 37 °C com uma incubadora agitada a 200 rpm durante 24 h.
- Dia 2) Prepare a mistura de nanocompósitos GO / em pelo menos três concentrações usando solução salina tamponada com fosfato (DPBS) de Dulbecco. Sonicar a suspensão de nanocompósitos GO/até que os nanocompósitos GO/estejam bem dispersos em DPBS.
NOTA: Neste protocolo, foram testados 500, 250, 125 e 62,5 μg/mL da mistura nanocompósita GO/. - Prepare as soluções de controle. O controle negativo é a SPBD, e o controle positivo é 1% de uma solução de penicilina/estreptomicina na SPBD que matará a bactéria.
- Adicione 100 μL da suspensão de nanocompósitos GO/e as soluções de controle em placas de 96 poços. Adicione todas as amostras em triplicado.
NOTA: Esterilize as amostras com UV por 15 minutos antes de aplicá-las às bactérias. - Com base na UFC após 24 h de incubação, diluir a suspensão bacteriana usando TSB a 1 × 106 UFC/mL.
NOTA: As concentrações iniciais de MRSA e suspensão de cultura de P. aeruginosa em nosso estudo, de acordo com a etapa 2.2.5, são de 4,5 × 109 UFC/mL e 3 × 109 UFC/mL, respectivamente. Concentrações bacterianas de 1 × 106 UFC/mL são obtidas diluindo as culturas em 4.500x e 3.000x, respectivamente. - Inocular 100 μL da suspensão bacteriana diluída de 1 ×10 6 UFC/ml nos alvéolos de amostra nas placas de 96 poços. Incubar as placas de 96 poços a 37 °C usando uma incubadora agitada a 200 rpm por 24 h.
NOTA: A concentração final de bactérias é de 5 × 105 UFC/mL após mistura com 100 μL de amostra. - Dia 3) Misture vigorosamente a amostra e as suspensões bacterianas com uma ponta de micropipeta de 200 μL. Diluir em série a mistura amostra-bactéria dez vezes com água destilada estéril.
NOTA: O nível de diluição depende das bactérias. Procure preparar menos de 100 colônias em uma placa de ágar. - Inocular 100 μl da suspensão bacteriana diluída na placa de ágar e espalhar com um espalhador. Incubar a placa de ágar-ágar a 37 °C com uma incubadora agitada durante 24 h.
- Dia 4) Conte as colônias bacterianas e determine os valores de UFC para confirmar a atividade antibacteriana dos nanocompósitos GO/usando a equação (2).
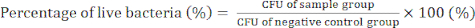 (2)
(2)
Resultados
Análises de microscopia eletrônica de transmissão (MET), microscopia eletrônica de varredura (MEV) e espectroscopia de raios X por dispersão de energia (EDS) foram realizadas para confirmar a formação de nanocompósitos GO/. A Figura 1A, B mostra que nanopartículas heterogêneas de foram cultivadas nas folhas de GO. Conforme mostrado na Figura 1C, o mapeamento EDS confirmou que as partículas na folha GO...
Discussão
Aqui, relatamos um método simples e de baixo custo para preparar nanofolhas de GO depositadas com nanopartículas de, que seria um método potencialmente eficiente para erradicar bactérias resistentes a antibióticos. A etapa crítica na síntese de nanocompósitos GO/é dispersar completamente GO e CuCl2 na solução e manter uma temperatura elevada enquanto os mistura. Além disso, a etapa redox deve ser conduzida rapidamente porque o agente redutor causa uma reação de r...
Divulgações
O Dr. Jonghoon Choi é o CEO/Fundador, e o Dr. Yonghyun Choi é o CTO do Instituto de Tecnologia Feynman da Nanomedicine Corporation.
Agradecimentos
Esta pesquisa foi apoiada pela bolsa de pesquisa da Universidade Chung-Ang em 2022 (durante a licença sabática do professor Jonghoon Choi). Esta pesquisa também foi apoiada pelo Programa de Pesquisa em Ciências Básicas por meio da Fundação Nacional de Pesquisa da Coreia (NRF), financiada pelo Ministério da Educação (No. RS-2023-00275006) e a subvenção do Instituto de Meio Ambiente, Indústria e Tecnologia da Coreia (KEITI) financiada pelo Ministério do Meio Ambiente da Coreia (MOE) (nº 2022002980003). MRSA clínico e P. aeruginosa foram obtidos no Hospital Universitário de Chung-Ang.
Materiais
| Name | Company | Catalog Number | Comments |
| Antibiotic-Antimycotic | Gibco | 15240062 | |
| Clinical MDR bacterial strains | Chung-Ang University Hospital (Seoul, South Korea) | ||
| Copper(II) chloride dihydrate | Duksan | 10125-13-0 | |
| Field Emission Scanning Electron Microscope (FE-SEM) | Carl Zeiss | SIGMA | |
| Graphene oxide | Sigma | 796034 | |
| Sodium Borohydride | Sigma | 71320 | |
| Transmission Electron Microscopy (TEM) | JEOL | JEM-2100 | |
| Tryptic Soy Agar | BD difco | 236950 | |
| Tryptic Soy Broth | BD difco | 211825 |
Referências
- Doron, S., Gorbach, S. L. Bacterial infections: Overview. International Encyclopedia of Public Health. , 273-282 (2008).
- Van Duin, D., Paterson, D. L. Multidrug-resistant bacteria in the community: An update. Infect Dis Clin North Am. 34 (4), 709-722 (2020).
- Blair, J. M. A., Webber, M. A., Baylay, A. J., Ogbolu, D. O., Piddock, L. J. V. Molecular mechanisms of antibiotic resistance. Nat Rev Microbiol. 13 (1), 42-51 (2015).
- Sánchez-López, E., et al. Metal-based nanoparticles as antimicrobial agents: An overview. Nanomaterials (Basel). 10 (2), 292 (2020).
- Makabenta, J. M. V., et al. Nanomaterial-based therapeutics for antibiotic-resistant bacterial infections. Nat Rev Microbiol. 19 (1), 23-36 (2021).
- Liang, X., Govindaraju, S., Yun, K. Dual applicability of polyaniline coated gold nanorods: A study of antibacterial and redox activity. BioChip J. 12 (2), 137-145 (2018).
- Niño-Martínez, N., Salas Orozco, M. F., Martínez-Castañón, G. A., Torres Méndez, F., Ruiz, F. Molecular mechanisms of bacterial resistance to metal and metal oxide nanoparticles. Int J Mol Sci. 20 (11), 2808 (2019).
- Kim, J., Choi, Y., Park, J., Choi, J. Gelatin-gallic acid microcomplexes release go/cu nanomaterials to eradicate antibiotic-resistant microbes and their biofilm. ACS Infect Dis. 9 (2), 296-307 (2023).
- Jang, J., et al. Development of antibiofilm nanocomposites: Ag/cu bimetallic nanoparticles synthesized on the surface of graphene oxide nanosheets. ACS Appl Mater Interfaces. 12 (32), 35826-35834 (2020).
- Jang, J., Choi, Y., Tanaka, M., Choi, J. Development of silver/graphene oxide nanocomposites for antibacterial and antibiofilm applications. J Ind Eng Chem. 83, 46-52 (2020).
- Bankier, C., et al. Synergistic antibacterial effects of metallic nanoparticle combinations. Sci Rep. 9 (1), 16074 (2019).
- Mendes, C. R., et al. Antibacterial action and target mechanisms of zinc oxide nanoparticles against bacterial pathogens. Sci Rep. 12 (1), 2658 (2022).
- Yoon, S., et al. Biologically benign multi-functional mesoporous silica encapsulated gold/silver nanorods for anti-bacterial applications by on-demand release of silver ions. BioChip J. 13 (4), 362-369 (2019).
- Slavin, Y. N., Asnis, J., Häfeli, U. O., Bach, H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. J Nanobiotechnology. 15 (1), 65 (2017).
- Ismail, N. A., et al. Sonochemical synthesis of a copper reduced graphene oxide nanocomposite using honey and evaluation of its antibacterial and cytotoxic activities. Front Mol Biosci. 9, 995853 (2022).
- Tu, Y., et al. Remarkable antibacterial activity of reduced graphene oxide functionalized by copper ions. Adv Funct Mater. 31 (13), 2008018 (2021).
- Li, M., et al. Toward a molecular understanding of the antibacterial mechanism of copper-bearing titanium alloys against staphylococcus aureus. Adv Healthc Mater. 5 (5), 557-566 (2016).
- Yang, Z., et al. Long-term antibacterial stable reduced graphene oxide nanocomposites loaded with cuprous oxide nanoparticles. J Colloid Interface Sci. 533, 13-23 (2019).
- Yang, Y., et al. Graphene oxide/copper nanoderivatives-modified chitosan/hyaluronic acid dressings for facilitating wound healing in infected full-thickness skin defects. Int J Nanomedicine. 15, 8231-8247 (2020).
- Mao, M., et al. Graphene oxide-copper nanocomposites suppress cariogenic streptococcus mutans biofilm formation. Int J Nanomedicine. 16, 7727-7739 (2021).
- Ravikumar, V., Mijakovic, I., Pandit, S. Antimicrobial activity of graphene oxide contributes to alteration of key stress-related and membrane bound proteins. Int J Nanomedicine. 17, 6707-6721 (2022).
- Afreen, G., Shoeb, M., Upadhyayula, S. Effectiveness of reactive oxygen species generated from rgo/cds qd heterostructure for photodegradation and disinfection of pollutants in waste water. Mater Sci Eng C. 108, 110372 (2020).
- Yang, F., et al. Fabrication of graphene oxide/copper synergistic antibacterial coating for medical titanium substrate. J Colloid Interface Sci. 638, 1-13 (2023).
- Rajapaksha, P., et al. Antibacterial properties of graphene oxide-copper oxide nanoparticle nanocomposites. ACS Appl Bio Mater. 2 (12), 5687-5696 (2019).
- Sachdeva, C., Satyamoorthy, K., Murali, T. S. Microbial interplay in skin and chronic wounds. Curr Clin Microbiol Rep. 9 (3), 21-31 (2022).
- Ramos, M. K., Zarbin, A. J. G. Graphene/copper oxide nanoparticles thin films as precursor for graphene/copper hexacyanoferrate nanocomposites. Appl Surf Sci. 515, 146000 (2020).
- Fivenson, E. M., et al. A role for the gram-negative outer membrane in bacterial shape determination. PNAS. 120 (35), e2301987120 (2023).
- Wu, C., et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity. Biomater. 34 (2), 422-433 (2013).
- Zhang, W., et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of hif-1α. Adv Healthc Mater. 5 (11), 1299-1309 (2016).
- Labauve, A. E., Wargo, M. J. Growth and laboratory maintenance of pseudomonas aeruginosa. Curr Protoc Microbiol. 25 (1), 6E.1.1-6E.1.8 (2012).
- Lin, J., et al. The icmf3 locus is involved in multiple adaptation- and virulence-related characteristics in pseudomonas aeruginosa pao1. Front Cell Infect Microbiol. 5, 70 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados