Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von antibakteriellen Graphenoxid/Kupfer-Nanokompositen
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir Graphenoxid/Kupfer (GO/Cu)-Nanokomposite als antibakterielles Nanomaterial vor. Die antibakterielle Wirksamkeit der GO/Cu-Nanokomposite wurde sowohl gegen antibiotikaresistente grampositive als auch gegen gramnegative Bakterien untersucht.
Zusammenfassung
Antibiotika sind derzeit die am häufigsten eingesetzte antibakterielle Behandlung zur Abtötung von Bakterien. Bakterien entwickeln jedoch Resistenzen, wenn sie ständig Antibiotika ausgesetzt sind. Die Entwicklung antimikrobieller Wirkstoffe, die bestehende Antibiotika ersetzen können, ist unerlässlich, da antibiotikaresistente Bakterien Resistenzmechanismen gegen alle gängigen Antibiotika aufweisen und nosokomiale Infektionen begünstigen können. Um diese Herausforderung anzugehen, schlagen wir in dieser Studie Graphenoxid/Kupfer (GO/Cu)-Nanokomposite als antibakterielle Materialien vor, die die bestehenden Antibiotika ersetzen können. GO/Cu-Nanokomposite zeichnen sich durch Transmissionselektronenmikroskopie und Rasterelektronenmikroskopie aus. Sie zeigen, dass Kupfer (Cu)-Nanopartikel auf den Graphenoxidschichten gut gewachsen sind. Zusätzlich wird eine Mikrodilutionsbouillon-Methode verwendet, um die Wirksamkeit der antimikrobiellen Substanz gegen Methicillin-resistente Staphylococcus aureus (MRSA) und Pseudomonas aeruginosa (P. aeruginosa) zu bestätigen, die häufig mit nosokomialen Infektionen in Verbindung gebracht werden. Konkret werden 99,8 % der MRSA und 84,7 % der P . aeruginosa durch 500 μg/ml GO/Cu-Nanokomposite eliminiert. Metall-Nanokomposite können antibiotikaresistente Bakterien ausrotten, indem sie Ionen freisetzen, reaktive Sauerstoffspezies bilden und die Bakterien physisch schädigen. Diese Studie zeigt das Potenzial von antibakteriellen GO/Cu-Nanokompositen bei der Ausrottung antibiotikaresistenter Bakterien.
Einleitung
Bakterielle Infektionen haben erhebliche Auswirkungen auf die öffentliche Gesundheit. Vor allem pathogene Bakterien können sich den Schutzmechanismen des Körpers entziehen und Krankheiten verursachen1. Antibiotika werden häufig zur Behandlung von bakteriellen Infektionen eingesetzt. Der unsachgemäße Einsatz von Antibiotika hat jedoch das Auftreten antibiotikaresistenter Bakterien beschleunigt. Derzeit haben nosokomiale Infektionen, die auf antibiotikaresistente Bakterien zurückzuführen sind, in Gesundheitseinrichtungen zu bemerkenswerten Komplikationen geführt2. Leider haben Bakterien Resistenzmechanismen gegen alle gängigen Antibiotika3. Daher ist die Entwicklung neuer Antibiotika unerlässlich, obwohl auch die Wahrscheinlichkeit hoch ist, dass Resistenzmechanismen entstehen.
Metall-Nanopartikel haben sich aufgrund ihrer wirksamen antibakteriellen Eigenschaften als vielversprechende Mittel zur Bekämpfung antibiotikaresistenter Bakterien erwiesen 4,5,6. Für Bakterien ist es schwierig, Resistenzmechanismen gegen Metall-Nanopartikel zu entwickeln, da sie nicht an spezifische bakterielle Rezeptoren binden7. Insbesondere Silber-, Kupfer- und Zinkoxid-Nanopartikel stehen aufgrund ihrer bemerkenswerten antibakteriellen Wirksamkeit im Mittelpunkt umfangreicher Forschungen 8,9,10,11,12,13. Die Toxizität von Metallnanopartikeln gegenüber Bakterien wird auf drei Hauptmechanismen zurückgeführt: 1) die Freisetzung von Metallionen, 2) die Erzeugung von reaktiven Sauerstoffspezies (ROS), wie •OH und •O 2−, und 3) die physikalische Wechselwirkung und Bindung 4,14.
In dieser Studie wurden Graphenoxid/Kupfer (GO/Cu)-Nanokomposite als antimikrobielles Mittel entwickelt. Kupfer (Cu) tötet Krankheitserreger, die auf seine Oberfläche treffen, effizient ab und stört die bakterielle Genreplikation. Es ist jedoch ein essentielles Mikroelement im menschlichen Körper und für Säugetierzellen weniger toxisch, da es über homöostatische Mechanismen verfügt, die die Cu-Konzentrationen in den Zellen regulieren4. Wenn Cu-Nanopartikel oxidiert werden, erzeugen sie Cu-Ionen, die eine relativ hohe Affinität zu negativ geladenen Bakterien aufweisen 15,16. Cu-Ionen binden an die zellulären Strukturen (z. B. Proteine, Membranen und DNA) und stören die Zellfunktionen17. Durch die Synthese von Cu-Nanopartikeln auf der Oberfläche von Graphenoxid (GO) kann die Freisetzungsrate von Metallionen gesteuert werden 18,19,20. GO zeigt auch eine antibakterielle Wirkung, indem es die bakterielle Adhäsion mit einer rauen Oberfläche durch oxidativen Stress verhindert oder ROS21,22 bildet. Darüber hinaus setzen GO/Cu-Nanokomposite durch die chemische Wirkung von Cu2+ mehr ROS als GO frei, wodurch bakterielle Proteine und DNA geschädigt werden, was zum Absterben von Bakterien führt23,24.
In diesem Artikel wird das Protokoll für die Synthese von GO/Cu-Nanokompositen vorgestellt und ein antimikrobieller Testansatz gegen klinische Bakterien MRSA und P. aeruginosa vorgestellt, die häufigsten multiresistenten Bakterienstämme, die nosokomiale Infektionen verursachen25. Dieses Protokoll zielt darauf ab, eine einfache chemische Reduktionsmethode für die Synthese von GO/Cu-Nanokompositen einzuführen, die das Wachstum antibiotikaresistenter Bakterien behindern kann. Wir verwenden Kupfer(II)-chlorid (CuCl2) und Natriumborhydrid (NaBH4) als Vorläufer bzw. Reduktionsmittel. Das Protokoll beschreibt auch die Besonderheiten der Anwendung dieser Nanokomposite auf Bakterien mit der Mikrodilutionsbrühe-Methode. Um Fehler aufgrund der Absorptionsinterferenz von Metallnanopartikeln auszuschließen und genaue Auswertungen vornehmen zu können, wird die antibakterielle Fähigkeit mit der Methode der Koloniezählung bewertet.
Protokoll
1. Herstellung der GO/Cu-Nanokomposite
HINWEIS: Die Größe und Morphologie der Cu-Nanopartikel, die auf den GO-Nanoblättern wachsen, werden durch den Grad der GO-Oxidation, die Konzentration des Cu-Vorläufers und die Konzentration des Reduktionsmittels26 bestimmt.
- Bereiten Sie 10 ml 1 mg/ml GO-Suspension in einer Glasflasche vor. Die GO-Suspension wird 1 h lang beschallt, bis GO gut in destilliertem (DI) Wasser dispergiert ist.
- Bereiten Sie eine 20 mM CuCl2-Lösung in einem Glasfläschchen vor. Die CuCl2-Lösung wird beschallt, bis CuCl2 gut in DI-Wasser dispergiert ist.
- Geben Sie 10 mL der 20 mM CuCl2-Lösung in die GO-Lösung und beschallen Sie das Gemisch 1 h lang bei 70 °C.
- Bereiten Sie eine 20 mM NaBH4-Lösung vor.
ACHTUNG: Dieses Verfahren muss in einem chemischen Abzug durchgeführt werden. Eine Redoxreaktion tritt auf, sobald das Reduktionsmittel NaBH4 in das Wasser eingebracht wird. Bereiten Sie die NaBH4-Lösung unmittelbar vor dem Experiment vor. - Zubereitung der Mischung aus NaBH4, GO und CuCl2
- Geben Sie 20 mL der 20 mM NaBH4-Lösung zu der GO- und CuCl2-Mischung , während Sie mit einem Magnetstab bei 200 U/min umrühren. Nach Zugabe der NaBH4-Lösung 30 Minuten lang kontinuierlich rühren.
ACHTUNG: Dieses Verfahren muss in einem chemischen Abzug durchgeführt werden.
- Geben Sie 20 mL der 20 mM NaBH4-Lösung zu der GO- und CuCl2-Mischung , während Sie mit einem Magnetstab bei 200 U/min umrühren. Nach Zugabe der NaBH4-Lösung 30 Minuten lang kontinuierlich rühren.
- Zentrifugation des Gemisches
- Das Gemisch aus Schritt 1.5.1 wird in ein Zentrifugenröhrchen überführt. Die Lösung wird bei 23.000 × g 10 min bei Raumtemperatur zentrifugiert. Entsorgen Sie den Überstand.
ACHTUNG: Halten Sie beim Betrieb der Zentrifuge immer das Gleichgewicht, indem Sie Röhrchen mit gleichem Gewicht platzieren.
- Das Gemisch aus Schritt 1.5.1 wird in ein Zentrifugenröhrchen überführt. Die Lösung wird bei 23.000 × g 10 min bei Raumtemperatur zentrifugiert. Entsorgen Sie den Überstand.
- Resuspendieren Sie das GO/Cu-Nanokomposit-Gemisch mit 10 ml DI-Wasser und beschallen Sie sie, damit sich der Niederschlag gleichmäßig in der Lösung verteilen kann.
- Die Lösung wird bei 23.000 × g 10 min bei Raumtemperatur zentrifugiert; Entfernen Sie dann den Überstand.
- Wiederholen Sie die Schritte 1.7-1.8 noch einmal, um die nicht umgesetzten Chemikalien zu entfernen.
- Geben Sie 1 ml destilliertes Wasser zu den GO/Cu-Nanokompositen und beschallen Sie die Mischung, um das Sediment gleichmäßig in der flüssigen Phase zu verteilen.
HINWEIS: Sammeln Sie alle GO/Cu-Nanokompositlösungen in einem konischen Röhrchen. - Die Lösung wird über Nacht bei -60 °C unter Vakuum gefriergetrocknet, bis die GO/Cu-Nanokomposite vollständig getrocknet sind, und erhält GO/Cu-Nanokomposit-Pulver.
- Lagern Sie das GO/Cu-Nanokomposit-Pulver bis zur Verwendung bei -20 °C.
2. Vorbereitung der Bakterien für den antibakteriellen Test
ACHTUNG: Dieses Verfahren muss in einer biologischen Sicherheitswerkbank mit einer Alkohollampe durchgeführt werden. Bakterielle Abfälle müssen vor der Entsorgung autoklaviert werden. Beim Umgang mit antibiotikaresistenten Bakterien müssen Handschuhe, Kittel und Masken getragen werden, und die Hände müssen nach dem Versuch mit Seife oder Händedesinfektionsmittel gewaschen werden. Immer gründlich desinfizieren; Kommt es zu einer Kontamination im Versuchsbereich, desinfizieren Sie diese sofort mit 70%igem Ethanol.
- Vorbereitung von Bakterienkulturmedien
- Mischen Sie 20 g tryptisches Soja-Agar und 500 ml destilliertes Wasser in einem Kolben. Die Mischung im Autoklaven bei 121 °C 15 min sterilisieren.
- Bereiten Sie die Agarplatte vor, indem Sie 15 ml der Agarlösung in eine Petrischale gießen, bevor der Agar aushärtet. Lagern Sie die Agarplatte bis zur Verwendung bei 4 °C.
HINWEIS: Dies muss schnell erfolgen, bevor die Agarlösung aushärtet. Um eine Kontamination zu vermeiden, sterilisieren Sie die Agarplatte während der Aushärtung 15 min lang mit UV. - Mischen Sie 15 g tryptische Sojabrühe (TSB) und 500 ml destilliertes Wasser in einem Kolben. Die Mischung im Autoklaven bei 121 °C 15 min sterilisieren.
- Aliquotieren Sie 40-50 mL der Bouillonlösung in ein konisches 50-ml-Röhrchen. Die Brühe bis zur Verwendung bei 4 °C lagern.
HINWEIS: Um eine Kontamination zu vermeiden, sterilisieren Sie die aliquotierte Brühe 15 Minuten lang mit UV.
- Bakterienkultur
- Die MSRA- oder P. aeruginosa-Stammlösung mit einer Schlaufe auf der Agarplatte inokulieren. Die Agarplatte wird bei 37 °C mit einem Schüttelinkubator 24 h lang inkubiert.
- Impfen Sie eine Kolonie der Bakterien mit einer Schlaufe in 10 ml der Brühe. Die Brühe wird bei 37 °C mit einem Schüttelbrutschrank bei 200 U/min 24 h lang inkubiert.
- Die Schritte 2.2.1 bis 2.2.2 werden noch einmal wiederholt, um Bakterien mit den gleichen Eigenschaften zu erhalten.
- Nach 24 h die Bakterienlösung mit sterilem destilliertem Wasser seriell zehnfach verdünnen. 100 μl der verdünnten Bakteriensuspension auf die Agarplatte impfen und mit einem Streuer verteilen. Die Agarplatte wird bei 37 °C mit einem Schüttelinkubator 24 h lang inkubiert.
HINWEIS: Der Verdünnungsgrad ist abhängig von den Bakterien. Ziel ist es, weniger als 100 Völker in einer Agarplatte vorzubereiten. - Zählen Sie die Bakterienkolonien nach der 24-stündigen Inkubation, um die koloniebildende Einheit (KBE) anhand von Gleichung (1) zu bestimmen.
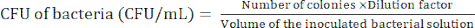 (1)
(1) - Wiederholen Sie die Schritte 2.2.4-2.2.5 mindestens 3x, um zu bestätigen, ob die KBE der Bakterien relativ konstant ist.
3. Antibakterieller Test mit der Methode der Mikroverdünnungsbrühe
- Tag 1) Eine Kolonie der Bakterien aus der Agarplatte mit einer Schlaufe in 10 ml Brühe impfen. Die Brühe wird bei 37 °C mit einem Schüttelbrutschrank bei 200 U/min 24 h lang inkubiert.
- Tag 2) Bereiten Sie das GO/Cu-Nanokomposit-Gemisch in mindestens drei Konzentrationen mit Dulbeccos phosphatgepufferter Kochsalzlösung (DPBS) vor. Die GO/Cu-Nanokomposit-Suspension wird beschallt, bis die GO/Cu-Nanokomposite in DPBS gut dispergiert sind.
HINWEIS: In diesem Protokoll wurden 500, 250, 125 und 62,5 μg/ml des GO/Cu-Nanokomposit-Gemisches getestet. - Bereiten Sie die Steuerungslösungen vor. Die Negativkontrolle ist DPBS, und die Positivkontrolle ist 1% einer Penicillin/Streptomycin-Lösung in DPBS, die die Bakterien abtötet.
- Geben Sie 100 μl der GO/Cu-Nanokomposit-Suspension und die Kontrolllösungen in 96-Well-Platten. Fügen Sie alle Proben in dreifacher Ausfertigung hinzu.
HINWEIS: Sterilisieren Sie die Proben 15 Minuten lang mit UV, bevor Sie sie auf Bakterien auftragen. - Basierend auf der KBE nach 24 Stunden Inkubation die Bakteriensuspension mit TSB auf 1 × 106 KBE/ml verdünnen.
HINWEIS: Die anfänglichen Suspensionskonzentrationen von MRSA und P. aeruginosa in unserer Studie betragen gemäß Schritt 2.2.5 jeweils 4,5 × 109 KBE/ml bzw. 3 × 109 KBE/ml. Bakterienkonzentrationen von 1 × 106 KBE/ml werden durch 4.500-fache bzw. 3.000-fache Verdünnung der Kulturen erhalten. - Impfen Sie 100 μl der verdünnten Bakteriensuspension von 1 × 106 KBE/ml in die Probenvertiefungen in den 96-Well-Platten. Inkubieren Sie die 96-Well-Platten bei 37 °C mit einem Schüttelinkubator bei 200 U/min für 24 Stunden.
HINWEIS: Die endgültige Bakterienkonzentration beträgt 5 × 105 KBE/ml nach dem Mischen mit 100 μl Probe. - Tag 3) Mischen Sie die Probe und die Bakteriensuspensionen kräftig mit einer 200 μl Mikropipettenspitze. Verdünnen Sie das Proben-Bakterien-Gemisch seriell zehnfach mit sterilem destilliertem Wasser.
HINWEIS: Der Verdünnungsgrad ist abhängig von den Bakterien. Ziel ist es, weniger als 100 Völker in einer Agarplatte vorzubereiten. - 100 μl der verdünnten Bakteriensuspension auf die Agarplatte impfen und mit einem Streuer verteilen. Die Agarplatte wird bei 37 °C mit einem Schüttelinkubator 24 h lang inkubiert.
- Tag 4) Zählen Sie die Bakterienkolonien und bestimmen Sie die KBE-Werte, um die antibakterielle Aktivität der GO/Cu-Nanokomposite anhand von Gleichung (2) zu bestätigen.
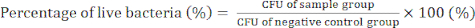 (2)
(2)
Ergebnisse
Transmissionselektronenmikroskopie (TEM), Rasterelektronenmikroskopie (REM) und energiedispersive Röntgenspektroskopie (EDS) wurden durchgeführt, um die Bildung von GO/Cu-Nanokompositen zu bestätigen. Abbildung 1A,B zeigt, dass heterogene Cu-Nanopartikel auf den GO-Blättern gezüchtet wurden. Wie in Abbildung 1C gezeigt, bestätigte die EDS-Kartierung, dass es sich bei den Partikeln auf dem GO-Blatt um Cu-Na...
Diskussion
Darin berichten wir über eine kostengünstige und einfache Methode zur Herstellung von GO-Nanoblättern, die mit Cu-Nanopartikeln abgeschieden wurden, die eine potenziell effiziente Methode zur Ausrottung antibiotikaresistenter Bakterien wäre. Der entscheidende Schritt bei der Synthese von GO/Cu-Nanokompositen besteht darin, GO und CuCl2 gründlich in der Lösung zu dispergieren und beim Mischen eine erhöhte Temperatur aufrechtzuerhalten. Des Weiteren muss der Redoxschritt ...
Offenlegungen
Dr. Jonghoon Choi ist der CEO/Gründer, und Dr. Yonghyun Choi ist der CTO des Feynman Institute of Technology bei der Nanomedicine Corporation.
Danksagungen
Diese Forschung wurde 2022 (während des Sabbaticals von Professor Jonghoon Choi) durch das Forschungsstipendium der Chung-Ang University unterstützt. Diese Forschung wurde auch durch das Basic Science Research Program der National Research Foundation of Korea (NRF) unterstützt, das vom Bildungsministerium (Nr. RS-2023-00275006) und das vom koreanischen Umweltministerium (MOE) finanzierte Stipendium des Korea Environment Industry & Technology Institute (KEITI) (Nr. 2022002980003). Klinisches MRSA und P. aeruginosa wurden vom Chung-Ang University Hospital gewonnen.
Materialien
| Name | Company | Catalog Number | Comments |
| Antibiotic-Antimycotic | Gibco | 15240062 | |
| Clinical MDR bacterial strains | Chung-Ang University Hospital (Seoul, South Korea) | ||
| Copper(II) chloride dihydrate | Duksan | 10125-13-0 | |
| Field Emission Scanning Electron Microscope (FE-SEM) | Carl Zeiss | SIGMA | |
| Graphene oxide | Sigma | 796034 | |
| Sodium Borohydride | Sigma | 71320 | |
| Transmission Electron Microscopy (TEM) | JEOL | JEM-2100 | |
| Tryptic Soy Agar | BD difco | 236950 | |
| Tryptic Soy Broth | BD difco | 211825 |
Referenzen
- Doron, S., Gorbach, S. L. Bacterial infections: Overview. International Encyclopedia of Public Health. , 273-282 (2008).
- Van Duin, D., Paterson, D. L. Multidrug-resistant bacteria in the community: An update. Infect Dis Clin North Am. 34 (4), 709-722 (2020).
- Blair, J. M. A., Webber, M. A., Baylay, A. J., Ogbolu, D. O., Piddock, L. J. V. Molecular mechanisms of antibiotic resistance. Nat Rev Microbiol. 13 (1), 42-51 (2015).
- Sánchez-López, E., et al. Metal-based nanoparticles as antimicrobial agents: An overview. Nanomaterials (Basel). 10 (2), 292 (2020).
- Makabenta, J. M. V., et al. Nanomaterial-based therapeutics for antibiotic-resistant bacterial infections. Nat Rev Microbiol. 19 (1), 23-36 (2021).
- Liang, X., Govindaraju, S., Yun, K. Dual applicability of polyaniline coated gold nanorods: A study of antibacterial and redox activity. BioChip J. 12 (2), 137-145 (2018).
- Niño-Martínez, N., Salas Orozco, M. F., Martínez-Castañón, G. A., Torres Méndez, F., Ruiz, F. Molecular mechanisms of bacterial resistance to metal and metal oxide nanoparticles. Int J Mol Sci. 20 (11), 2808 (2019).
- Kim, J., Choi, Y., Park, J., Choi, J. Gelatin-gallic acid microcomplexes release go/cu nanomaterials to eradicate antibiotic-resistant microbes and their biofilm. ACS Infect Dis. 9 (2), 296-307 (2023).
- Jang, J., et al. Development of antibiofilm nanocomposites: Ag/cu bimetallic nanoparticles synthesized on the surface of graphene oxide nanosheets. ACS Appl Mater Interfaces. 12 (32), 35826-35834 (2020).
- Jang, J., Choi, Y., Tanaka, M., Choi, J. Development of silver/graphene oxide nanocomposites for antibacterial and antibiofilm applications. J Ind Eng Chem. 83, 46-52 (2020).
- Bankier, C., et al. Synergistic antibacterial effects of metallic nanoparticle combinations. Sci Rep. 9 (1), 16074 (2019).
- Mendes, C. R., et al. Antibacterial action and target mechanisms of zinc oxide nanoparticles against bacterial pathogens. Sci Rep. 12 (1), 2658 (2022).
- Yoon, S., et al. Biologically benign multi-functional mesoporous silica encapsulated gold/silver nanorods for anti-bacterial applications by on-demand release of silver ions. BioChip J. 13 (4), 362-369 (2019).
- Slavin, Y. N., Asnis, J., Häfeli, U. O., Bach, H. Metal nanoparticles: Understanding the mechanisms behind antibacterial activity. J Nanobiotechnology. 15 (1), 65 (2017).
- Ismail, N. A., et al. Sonochemical synthesis of a copper reduced graphene oxide nanocomposite using honey and evaluation of its antibacterial and cytotoxic activities. Front Mol Biosci. 9, 995853 (2022).
- Tu, Y., et al. Remarkable antibacterial activity of reduced graphene oxide functionalized by copper ions. Adv Funct Mater. 31 (13), 2008018 (2021).
- Li, M., et al. Toward a molecular understanding of the antibacterial mechanism of copper-bearing titanium alloys against staphylococcus aureus. Adv Healthc Mater. 5 (5), 557-566 (2016).
- Yang, Z., et al. Long-term antibacterial stable reduced graphene oxide nanocomposites loaded with cuprous oxide nanoparticles. J Colloid Interface Sci. 533, 13-23 (2019).
- Yang, Y., et al. Graphene oxide/copper nanoderivatives-modified chitosan/hyaluronic acid dressings for facilitating wound healing in infected full-thickness skin defects. Int J Nanomedicine. 15, 8231-8247 (2020).
- Mao, M., et al. Graphene oxide-copper nanocomposites suppress cariogenic streptococcus mutans biofilm formation. Int J Nanomedicine. 16, 7727-7739 (2021).
- Ravikumar, V., Mijakovic, I., Pandit, S. Antimicrobial activity of graphene oxide contributes to alteration of key stress-related and membrane bound proteins. Int J Nanomedicine. 17, 6707-6721 (2022).
- Afreen, G., Shoeb, M., Upadhyayula, S. Effectiveness of reactive oxygen species generated from rgo/cds qd heterostructure for photodegradation and disinfection of pollutants in waste water. Mater Sci Eng C. 108, 110372 (2020).
- Yang, F., et al. Fabrication of graphene oxide/copper synergistic antibacterial coating for medical titanium substrate. J Colloid Interface Sci. 638, 1-13 (2023).
- Rajapaksha, P., et al. Antibacterial properties of graphene oxide-copper oxide nanoparticle nanocomposites. ACS Appl Bio Mater. 2 (12), 5687-5696 (2019).
- Sachdeva, C., Satyamoorthy, K., Murali, T. S. Microbial interplay in skin and chronic wounds. Curr Clin Microbiol Rep. 9 (3), 21-31 (2022).
- Ramos, M. K., Zarbin, A. J. G. Graphene/copper oxide nanoparticles thin films as precursor for graphene/copper hexacyanoferrate nanocomposites. Appl Surf Sci. 515, 146000 (2020).
- Fivenson, E. M., et al. A role for the gram-negative outer membrane in bacterial shape determination. PNAS. 120 (35), e2301987120 (2023).
- Wu, C., et al. Copper-containing mesoporous bioactive glass scaffolds with multifunctional properties of angiogenesis capacity, osteostimulation and antibacterial activity. Biomater. 34 (2), 422-433 (2013).
- Zhang, W., et al. Graphene oxide-copper nanocomposite-coated porous cap scaffold for vascularized bone regeneration via activation of hif-1α. Adv Healthc Mater. 5 (11), 1299-1309 (2016).
- Labauve, A. E., Wargo, M. J. Growth and laboratory maintenance of pseudomonas aeruginosa. Curr Protoc Microbiol. 25 (1), 6E.1.1-6E.1.8 (2012).
- Lin, J., et al. The icmf3 locus is involved in multiple adaptation- and virulence-related characteristics in pseudomonas aeruginosa pao1. Front Cell Infect Microbiol. 5, 70 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten