需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
具有天然微生物组的实验室小鼠设施的作和生物防护程序:免疫表型程序
* 这些作者具有相同的贡献
摘要
在这里,我们描述了结构和作程序,包括使用血液采样进行免疫表型分析的“野鼠”设施的微生物遏制措施。
摘要
使用具有天然微生物组的实验室小鼠,例如“野鼠”,由于它们与人类超有机体非常相似,因此为基础科学和应用科学提供了一种很有前途的研究工具。然而,这些小鼠携带着包括细菌、病毒和寄生虫在内的多种微生物组,其繁殖和维持对研究机构的畜牧设施构成了重大挑战。为了应对这些挑战,柏林夏里特医学院开发了一种专门的设施方案,用于饲养“野鼠”。这种方法涉及设计具有特定结构特征和作方案的设施,以有效控制天然微生物组,从而保护卫生标准更高的区域。
展示了一种从特定无病原体 (SPF) 和“野鼠”中采集血液进行免疫表型分析的方法,突出了该设施中实施的工作流程和生物防护措施。显着的结果显示,暴露于天然微生物组的“野鼠”会产生独特的免疫细胞群,在严格的卫生条件下繁殖和维持的小鼠中,免疫细胞群显着减少。
这项研究的意义在于它有可能为研究人员提供具有天然微生物组和类似于人类成年人的成熟免疫系统的小鼠的机会。这种方法可以提高临床前发现向临床实践的可转化性,从而推动生物医学研究领域的发展。
引言
在基础和应用科学中,如临床前和毒理学研究,小鼠实验仍然是必不可少的。然而,旨在减少生物噪声和最小化实验结果变异性的实验室环境中的卫生标准化在很大程度上导致了天然微生物群的排除。因此,卫生标准化、特定无病原体 (SPF) 实验室小鼠的出生和饲养条件与人类和动物通常暴露于的真实世界条件不同。实验室条件与人类疾病发生的自然环境之间的这种不匹配导致了“标准化谬误”:假设最小化实验条件的变化可以改善转化结果。然而,实际上,它限制了研究结果的生物学相关性 1,2。例如,研究表明,SPF 小鼠缺乏微生物和环境多样性会导致免疫系统发育不全,从而破坏免疫学和临床前研究的有效性3。
已经提出了几种方法来解决小鼠模型中的生物变异问题,每种方法都有自己的优点和局限性,包括与野生和宠物店小鼠共处 3,4,5,6,7,8,顺序暴露于共生体 9,将动物饲养在户外围栏 10 或大型动物的床上用品11,以及野生小鼠的粪便移植12.用于临床前和毒理学研究的一种很有前途的新型小鼠模型是“野人鼠”模型,它由含有天然微生物组13 的标准实验室小鼠品系组成。这些“野鼠”是通过将实验室小鼠品系的胚胎移植到野生捕获的小鼠体内而产生的。在出生过程中,实验室小鼠品系获得其代孕母亲的天然微生物组,模仿人类分娩过程中发生的自然接种13。“野鼠”可以像任何其他实验室小鼠品系一样繁殖,它们的天然微生物组可以代代相传。
“野鼠”拥有多种微生物群 - 包括细菌、病毒和寄生虫 - 这些微生物群通常被排除在 SPF 小鼠设施之外。因此,在研究机构中维持天然微生物组是一项挑战,因为必须在不影响整体 SPF 卫生标准的情况下控制这些微生物。
在柏林夏里特医学院,建立了一个专门用于“野鼠”的设施,通过严格的生物防护措施与 SPF 区域隔离。该设施包括繁殖室和实验室,确保在保护 SPF 区域的同时保持“野鼠”的天然微生物组(图 1)。
Charité 菌落的创始对是从德国弗里德里希-亚历山大-埃尔朗根大学 (FAU) 埃尔朗根大学医院微生物组研究系建立的“野鼠”菌落进口的。在导入菌落创始人之前,他们将获得健康证书,并通过扩展面板进行人畜共患病原体监测。哨兵将用于监测微生物组随时间的变化。SPF 和“野鼠”都在同一条件下饲养。将小鼠繁殖并优先饲养在 II 型单独通风笼 (IVC) 中,以 5 只小鼠为一组。设施内温度为 22 °C,光/暗循环为 12 小时。小鼠接受标准的谷物食物和自来水。对“野鼠”来说,床上用品和滋生物品的消毒是不必要的。然而,高压灭菌这些物品可以防止 SPF 小鼠所在区域的材料混淆。
在该协议中,展示了 SPF 和“Wildling mouses”的免疫表型程序,突出了“Wildling mouse”设施严格的微生物收容协议。这些措施确保了 SPF 环境的完整性,同时提供了与携带天然微生物组的小鼠一起工作的好处。
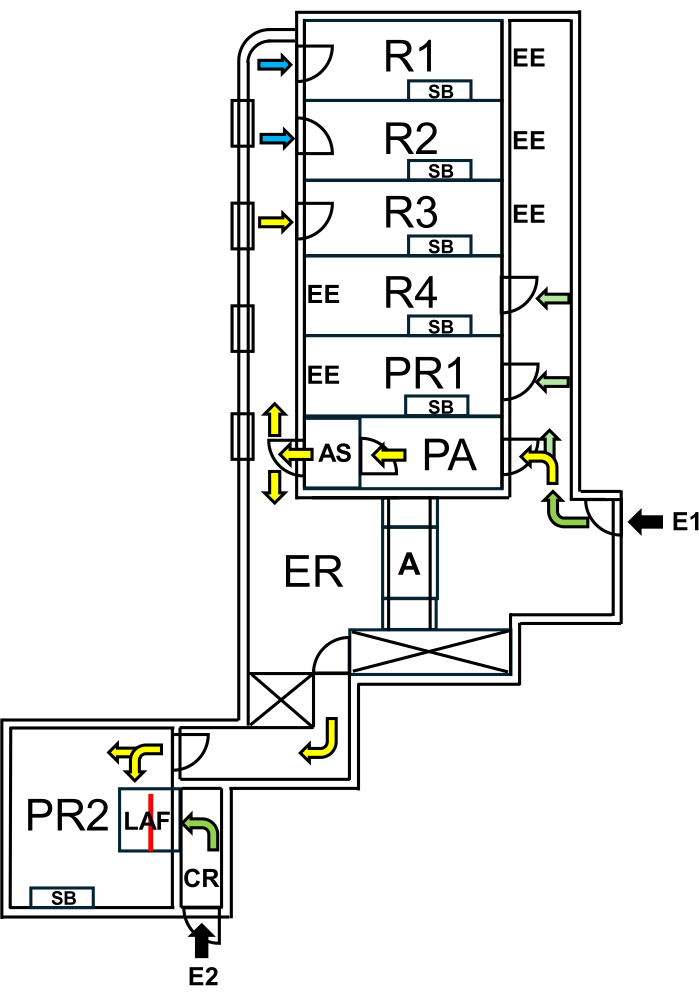
图 1:野鼠设施的布局。 E1 = 设施访问权限。箭头表示进入设施的路线。E2 = 从设施外部进入层流舱。PA = 带风淋室的人员气闸。AS = 风淋室。R1, R2 = 野鼠繁殖的房间。R3 = 饲养 Wilding 小鼠的空间。R4 = 饲养 SPF 小鼠的空间。PR1 = SPF 小鼠的手术室。PR2 = 野鼠手术室。SB = 无菌工作台。EE = 紧急出口。CR = LAF 机舱前的更衣室。LAF = 层流舱,用于在保护性气流下进行干预。A = 高压灭菌器。ER = 设备室。绿色箭头表示与 SPF 动物一起工作时可访问的路线,黄色箭头表示空气淋浴后可用于野人鼠工作的路径。蓝色箭头表示仅供饲养人员访问。红线标记了 LAF 机舱内的玻璃墙,它将空间分为两个部分,可以从 E1 通过 PR2 进入,也可以从 E2 通过 CR 进入。
Access restricted. Please log in or start a trial to view this content.
研究方案
“野鼠”设施和涉及活体动物的程序得到了负责动物实验的国家办公室“Landesamt für Gesundheit und Soziales Berlin”(LAGeSo)的批准。 图 2 总结了该协议最重要的步骤。
1. 进入 Wilding 设施
- 从负责的动物福利官员那里获得有关设施作和生物防护程序的个人介绍。
- 获取应答器钥匙进入“野鼠”设施,并通过在线预订系统预订手术室。
2. 进入“野鼠”设施
- 将衣服存放在更衣室。
- 换上区域服装:裤子、kasak 和一次性鞋套(图 3)。
3. 在 SPF 区域对 SPF 小鼠的血液进行采样
- 将 SPF 小鼠(雄性和雌性,8-20 周)从饲养它们的房间 (R4) 转移到封闭 IVC 笼中的 SPF 动物手术室 (PR1)。
- 打开层流工作台,用 70% Vol. 乙醇对工作区表面进行消毒。在工作台内工作。
- 检查毛细管是否有破损或碎裂的切片,以避免增加破损或伤害的风险。
- 在异氟醚短暂全身麻醉下(在富氧医用空气中以 5% 异氟醚诱导,然后以 1.5%-2.0% 维持),在踏板撤退反射丧失后(如脚趾捏伤所示),通过抓住颈部的鞘部压迫小鼠的颈静脉。
- 用一只手用拇指和食指固定动物的头部。将新鲜的毛细血管以 45° 角插入眼内眦下方的眼睛内眦。确保毛细血管位于眼球和眼眶之间。
注意:为避免创伤,请勿让毛细管尖端接触眼睛表面。 - 以轻柔的轴向旋转运动将毛细管插入鼻窦膜。继续旋转眼眶后部的管子,直到血液流动。在含有乙二胺四乙酸 (EDTA) 的采血管中收集至少 15 μL 血液(约 1 滴)。
- 在移除毛细血管之前,松开对颈部皱褶的抓握,以将流入组织的血液降至最低。为确保良好的止血,请使用干净的纱布垫或棉签止血。
- 轻轻旋转试管以混合血液和 EDTA。不要摇晃管子。将血样储存在冰上。
- 对工作表面进行消毒并关闭层流工作台。将封闭 IVC 中的 SPF 小鼠放回 SPF 饲养室 (R4)。
4. 进入“野鼠”区域
- 脱掉风淋室 (PA) 前厅的鞋子和袜子。穿上区域袜和全身个人防护装备 (PPE),包括 Tyvek 工作服、发网、棉手套、丁腈手套和口罩(图 3)。
- 通过粘合地板覆盖物进入袜子中的风淋室。风淋时,抬起手臂并进行 360° 旋转。
- 离开风淋室,穿上另一侧的区域鞋。
5. 从“野鼠”身上取样血液
- 将“野鼠”(雄性和雌性,8 - 20 周)从它们被关在封闭的 IVC 笼中的房间 (R3) 转移到手术室 (PR2)。
- 打开层流工作台并对工作区表面进行消毒。
- 按照第 3 节步骤 2-8 中描述的 SPF 小鼠采样程序进行作。
- 完成血液采样后,更换手套。对所有材料和表面进行消毒。关闭层流工作台。
6. 通过层流气流 (LAF) 柜从“野鼠”区域导出血液样本
注意:手术室 (PR2) 包含一个 LAF 柜,用作材料锁和无菌干预室。样品通过 LAF 舱转移出去。Wildling 区域的内部(通过 E1 和 PR2)和外部(通过 E2 和 CR)均可进入内部,中间由带滑动门的玻璃墙隔开(图 1)。需要两个人来导出材料:人员 1(在 Wildling 区域内 [通过 PR2])将执行步骤 6.1 和 6.2。人员 2(在 Wildling 区域之外 [通过 E2])将执行步骤 6.3-6.5。
- 对样品容器进行消毒。通过 LAF 舱玻璃壁上的滑动门取出样品容器。
- 将样本容器转移给 2 号人员完成后,在 LAF 机舱另一侧接收来自 2 号人员(在机舱罩衫锁中穿着防护服)的防护服并丢弃。对所有表面进行消毒。
- 在 LAF 机舱前面的通道 LAF 中穿上防护服(CR, 图 1)。
- 通过 LAF 小屋玻璃墙的滑动门从野人区域接收消毒样品容器,无需接触。
- 脱下防护服,通过滑动门进入 LAF 机舱内部进行丢弃。
7. 离开“野鼠”的设施
- 将一次性工作服和区域鞋留在该区域内。丢弃发网、橡胶手套和口罩。
注意:鞋子和工作服可以重复使用。 - 立即进入区域袜子的风淋室。在风淋时举起手臂并进行 360° 旋转。
- 离开风淋室,将区域袜子放入洗衣收集器中。穿上袜子、鞋子和一次性鞋套。衣物存放区 更衣室 洗衣房收集器。在更衣室换上衣服
8. 处理和分析血液样本
- 将血液样本带到实验室。
- 制备荧光团偶联的抗体染色混合物:对于每个样品,将 0.25 μL Alexa Fluor 700 抗小鼠 CD45、0.25 μL Brilliant Violet 605 抗小鼠 TCR-β 链、0.25 μL APC 抗小鼠 CD4、0.25 μL Brilliant Violet 785 抗小鼠 CD8、0.25 μL FITC 抗小鼠 CD44 和 0.25 μL PerCP/Cyanine5.5 抗小鼠 CD62L 抗体添加到 50 μL 流式细胞术缓冲液(磷酸盐缓冲盐水、 2 mM EDTA,0.1% 牛血清白蛋白,4 °C)。在冰上避光保存,直到步骤 8.8。
注:使用的荧光基团可以适应将用于样品采集的流式细胞仪的配置。
- 制备荧光团偶联的抗体染色混合物:对于每个样品,将 0.25 μL Alexa Fluor 700 抗小鼠 CD45、0.25 μL Brilliant Violet 605 抗小鼠 TCR-β 链、0.25 μL APC 抗小鼠 CD4、0.25 μL Brilliant Violet 785 抗小鼠 CD8、0.25 μL FITC 抗小鼠 CD44 和 0.25 μL PerCP/Cyanine5.5 抗小鼠 CD62L 抗体添加到 50 μL 流式细胞术缓冲液(磷酸盐缓冲盐水、 2 mM EDTA,0.1% 牛血清白蛋白,4 °C)。在冰上避光保存,直到步骤 8.8。
- 对采血管进行消毒。将 2 mL 冰冷的流式细胞术缓冲液添加到 5 mL 圆底聚苯乙烯管中。将试管放在冰上。
- 打开采血管。将 10 μL 血液添加到含有流式细胞术缓冲液和脉冲涡旋的试管中。
- 在 4 °C 下以 400 x g 旋转 5 分钟。
- 吸出上清液。加入 1 mL 红细胞 (RBC) 裂解缓冲液,脉冲涡旋,并在室温 (RT) 下孵育 3 分钟。
- 加入 100 μL 的 10x PBS。在 4 °C 下以 400 x g 旋转 5 分钟。
- 重复步骤 8.5-8.6。
- 吸出上清液。加入 50 μL 抗体染色混合物,涡旋,并在黑暗中在冰上孵育 20 分钟。
- 加入 1 mL 流式细胞术缓冲液。在 4 °C 下以 400 x g 旋转 5 分钟。
- 吸出上清液。加入 180 μL 流式细胞术缓冲液。
- 加入 20 μL SYTOX Blue 死细胞染色剂(终浓度 1:1000)用于活/死细胞鉴别。
- 在流式细胞仪上采集样品,并使用流式细胞仪采集软件或流式细胞术数据分析程序分析数据。
Access restricted. Please log in or start a trial to view this content.
结果
“野鼠”可能携带通常被排除在 SPF 设施之外的微生物,这对坚持严格卫生标准的研究机构的畜牧业实践构成了挑战。在过去的 4 年里,柏林夏里特医学院 (Charité - Universitätsmedizin Berlin) 和德国实验动物保护中心 (Bf3R) 的科学家和兽医开发了一个专门用于具有天然微生物组的小鼠的设施,通过合作努力采取了严格的生物防护措施(图 1)。为了?...
Access restricted. Please log in or start a trial to view this content.
讨论
具有天然微生物组的小鼠是基础和应用科学的一种很有前途的研究工具,因为它们与人类超有机体 3,9,10,11,12 更相似。将生物复杂性纳入小鼠模型的尝试导致了各种方法的发展,每种方法都有自己的优点和局限性 3,7,8,9,10,11,...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了 Charité 3R|替换 - 减少 - 优化。S.P.R. 得到了 Deutsche Forschungsgemeinschaft(DFG,德国研究基金会)、Emmy Noether-Programm RO 6247/1-1(项目 ID 446316360)、DFG SFB1160 IMPATH(项目 ID 256073931)和 TRR 359 PILOT(项目 ID 491676693)的支持。S.J. 得到了 Deutsche Forschungsgemeinschaft(DFG,德国研究基金会)JO 1216/2-1 和德国多发性硬化症协会 (DMSG e.V.) 的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
参考文献
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345(2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119(2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108(2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069(2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361(2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143(2018).
- Dirnagl, U., Kurreck, C., Bernard, R., Przesdzing, I. Premier. , https://premier-qms.org/ (2024).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。