É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Procedimentos Operacionais e de Biocontenção de uma Instalação para Camundongos de Laboratório com Microbioma Natural: Procedimento de Imunofenotipagem
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, descrevemos a estrutura e os procedimentos operacionais, incluindo medidas de contenção microbiana de uma instalação para "camundongos selvagens" usando amostragem de sangue para imunofenotipagem como exemplo.
Resumo
O uso de camundongos de laboratório com um microbioma natural, como "camundongos selvagens", oferece uma ferramenta de pesquisa promissora para a ciência básica e aplicada devido à sua grande semelhança com o superorganismo humano. No entanto, a criação e manutenção desses camundongos, que abrigam um microbioma diversificado, incluindo bactérias, vírus e parasitas, representam desafios significativos para as instalações de criação de animais em instituições de pesquisa. Para enfrentar esses desafios, um conceito de instalação especializada foi desenvolvido para abrigar "ratos selvagens" na Charité - Universitätsmedizin Berlin. Essa abordagem envolveu o projeto de uma instalação com características estruturais específicas e protocolos operacionais para conter efetivamente o microbioma natural, protegendo assim áreas com padrões de higiene mais elevados.
Uma metodologia para amostragem de sangue de camundongos livres de patógenos especificados (SPF) e "Wildling" para imunofenotipagem é demonstrada, destacando o fluxo de trabalho e as medidas de biocontenção implementadas na instalação. Resultados notáveis revelam que "camundongos selvagens" expostos a um microbioma natural desenvolvem populações distintas de células imunológicas, que são significativamente reduzidas em camundongos criados e mantidos sob condições rigorosas de higiene.
A importância deste estudo reside em seu potencial para fornecer aos pesquisadores acesso a camundongos que possuem um microbioma natural e um sistema imunológico maduro semelhante ao dos adultos humanos. Essa abordagem pode melhorar a traduzibilidade dos achados pré-clínicos para a prática clínica, avançando assim no campo da pesquisa biomédica.
Introdução
A experimentação em camundongos ainda é indispensável na ciência básica e aplicada, como a pesquisa pré-clínica e toxicológica. No entanto, a padronização da higiene em ambientes laboratoriais, visando reduzir o ruído biológico e minimizar a variabilidade nos resultados experimentais, levou à exclusão da microbiota natural em grande medida. Assim, as condições sob as quais camundongos de laboratório higienicamente padronizados e livres de patógenos especificados (SPF) nascem e são mantidos diferem das condições do mundo real às quais humanos e animais são normalmente expostos. Essa incompatibilidade entre as condições laboratoriais e os ambientes naturais em que ocorrem as doenças humanas dá origem à "falácia da padronização": supor que minimizar a variação nas condições experimentais melhora os resultados translacionais. No entanto, na realidade, limita a relevância biológica dos achados 1,2. Por exemplo, pesquisas mostraram que a ausência de diversidade microbiana e ambiental em camundongos com FPS pode resultar em um sistema imunológico subdesenvolvido, prejudicando a validade de estudos imunológicos e pré-clínicos3.
Várias abordagens foram propostas para lidar com a variação biológica em modelos de camundongos, cada uma com suas próprias vantagens e limitações, incluindo co-abitação com camundongos selvagens e pet shop 3,4,5,6,7,8, exposição sequencial a comensais 9, mantendo os animais em recintos ao ar livre10 ou em camas de animais grandes11 e transplantes fecais de camundongos selvagens12. Um novo modelo de camundongo promissor para pesquisa pré-clínica e toxicológica é o modelo "camundongos selvagens", que consiste em linhagens de camundongos de laboratório padrão que abrigam um microbioma natural13. Esses "camundongos selvagens" são gerados pelo transplante de embriões de linhagens de camundongos de laboratório para camundongos capturados na natureza. Durante o nascimento, as linhagens de camundongos de laboratório adquirem o microbioma natural de suas mães de aluguel, imitando a inoculação natural que ocorre durante o parto humano13. "Camundongos selvagens" podem ser criados como qualquer outra linhagem de camundongos de laboratório, com seu microbioma natural preservado ao longo de gerações.
"Camundongos selvagens" hospedam uma microbiota diversificada - incluindo bactérias, vírus e parasitas - que normalmente são excluídos das instalações de camundongos SPF. Consequentemente, manter um microbioma natural em instalações de pesquisa apresenta desafios, pois esses micróbios devem ser contidos sem comprometer os padrões gerais de higiene do FPS.
Na Charité - Universitätsmedizin Berlin, foi estabelecida uma instalação dedicada a "camundongos selvagens", separada das áreas SPF por medidas rígidas de biocontenção. A instalação inclui salas de reprodução e experimentação, garantindo que o microbioma natural dos "camundongos selvagens" seja mantido enquanto as áreas SPF são protegidas (Figura 1).
Os pares fundadores da colônia de Charité foram importados da colônia de "camundongos selvagens" estabelecida no Departamento de Pesquisa de Microbioma, Hospital Universitário de Erlangen, Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Alemanha. Eles são fornecidos com um certificado sanitário e monitorados com um painel estendido para patógenos zoonóticos antes da importação dos fundadores da colônia. Sentinelas serão usadas para monitorar o microbioma ao longo do tempo. Tanto o SPF quanto os "camundongos selvagens" são alojados nas mesmas condições. Os camundongos são criados e mantidos preferencialmente em gaiolas ventiladas individualmente (IVC) tipo II por muito tempo em grupos de cinco camundongos. A temperatura dentro da instalação é de 22 °C e o ciclo claro/escuro é de 12 h. Os ratos recebem ração padrão à base de grãos e água da torneira. A esterilização de itens de cama e enriquecimento é desnecessária para "camundongos selvagens". No entanto, a autoclavagem desses itens evita misturas de materiais em áreas onde os mouses SPF estão alojados.
Neste protocolo, os procedimentos de imunofenotipagem para SPF e "camundongos selvagens" são demonstrados, destacando os rigorosos protocolos de contenção microbiana na instalação "Camundongo selvagem". Essas medidas garantem a integridade dos ambientes SPF, ao mesmo tempo em que oferecem os benefícios de trabalhar com camundongos portadores de um microbioma natural.
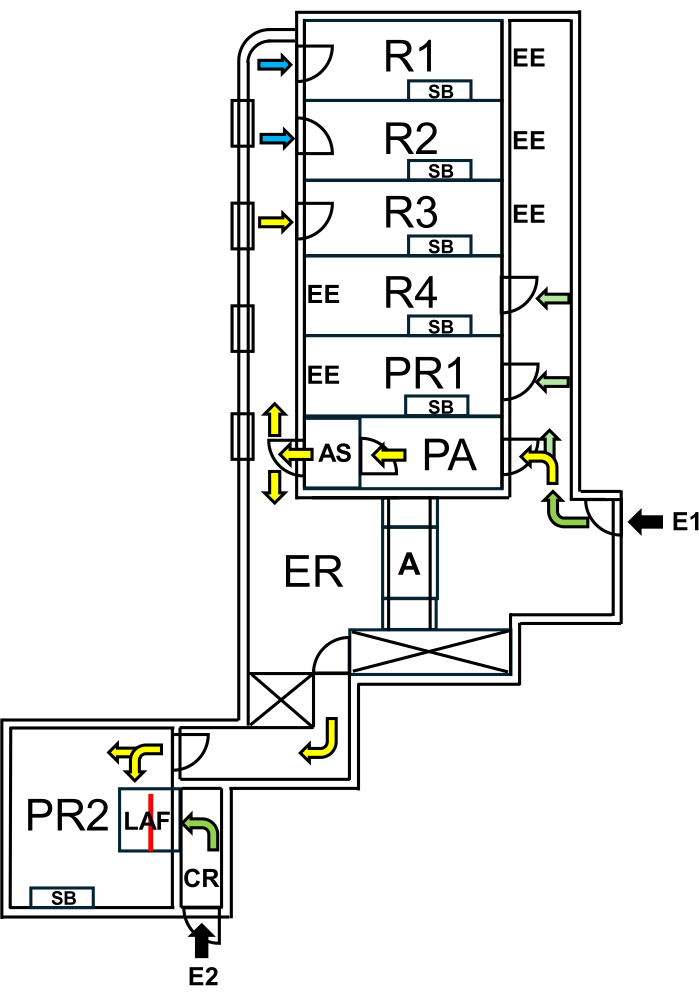
Figura 1: Layout da instalação para camundongos selvagens. E1 = acesso à instalação. As setas indicam a rota de entrada na instalação. E2 = acesso à cabina de fluxo de ar laminar a partir do exterior da instalação. PA = câmara de ar pessoal com chuveiro de ar. AS = chuveiro de ar. R1, R2 = salas para reprodução de ratos selvagens. R3 = espaço para manter ratos selvagens. R4 = espaço para manter camundongos SPF. PR1 = sala de procedimentos para camundongos SPF. PR2 = sala de procedimentos para camundongos selvagens. SB = bancada de trabalho estéril. EE = saídas de emergência. CR = vestiário em frente à cabine LAF. LAF = cabine de fluxo de ar laminar para intervenções sob fluxo de ar protetor. A = autoclave. ER = sala de equipamentos. As setas verdes representam rotas acessíveis ao trabalhar com animais SPF e as setas amarelas indicam caminhos disponíveis para trabalhar com camundongos selvagens após o banho de ar. As setas azuis indicam o acesso apenas para a equipe de criação. A linha vermelha marca a parede de vidro dentro da cabine LAF, que divide o espaço em duas seções que podem ser acessadas a partir de E1 via PR2 ou de E2 via CR. Clique aqui para ver uma versão maior desta figura.
Protocolo
A instalação para "camundongos selvagens" e os procedimentos envolvendo animais vivos foram aprovados pelo escritório estadual responsável pela experimentação animal, "Landesamt für Gesundheit und Soziales Berlin" (LAGeSo). As etapas mais importantes do protocolo estão resumidas na Figura 2.
1. Obtendo acesso às instalações da Wilding
- Obtenha uma introdução pessoal aos procedimentos operacionais e de biocontenção da instalação com o oficial responsável pelo bem-estar animal.
- Obtenha a chave do transponder para entrar nas instalações para "ratos selvagens" e reserve as salas de procedimentos através do sistema de reservas online.
2. Entrando nas instalações para "ratos selvagens"
- Deposite as roupas no vestiário.
- Coloque roupas da área: calças, kasak e capas de sapato descartáveis (Figura 3).
3. Amostragem de sangue de camundongos SPF na área SPF
- Transferir os ratinhos SPF (machos e fêmeas, 8-20 semanas) da sala onde são mantidos (R4) para a sala de procedimentos para animais SPF (PR1) numa gaiola fechada para VCI.
- Ligue a bancada de fluxo laminar e desinfete a superfície do espaço de trabalho com 70% de etanol Vol. Trabalhe dentro do banco.
- Inspecione os tubos capilares quanto a seções quebradas ou lascadas para evitar aumento do risco de quebra ou dano.
- Sob breve anestesia geral com isoflurano (indução a 5% de isoflurano em ar medicinal enriquecido com oxigênio, seguido de 1,5%-2,0% para manutenção), após perda do reflexo de retirada do pedal (conforme indicado por pinça do dedo do pé), comprima as veias do pescoço dos camundongos segurando a nuca.
- Usando uma mão, prenda a cabeça do animal usando o polegar e o indicador. Insira um capilar fresco no canto medial do olho sob a membrana nictitante em um ângulo de 45°. Certifique-se de que o capilar esteja posicionado entre o globo ocular e a órbita óssea do olho.
NOTA: Para evitar traumas, não deixe a ponta do tubo capilar tocar a superfície do olho. - Insira o capilar através da membrana sinusal com um movimento suave de rotação axial. Continue girando o tubo na parte de trás da órbita até que o sangue flua. Colete um mínimo de 15 μL de sangue em um tubo de coleta de sangue contendo ácido etilenodiaminotetracético (EDTA) (aproximadamente 1 gota).
- Antes de remover o capilar, afrouxe o aperto na nuca do pescoço para manter o sangramento no tecido ao mínimo. Para garantir uma boa hemostasia, use uma gaze limpa ou cotonete para estancar o sangramento.
- Gire levemente o tubo para misturar sangue e EDTA. Não agite o tubo. Armazene a amostra de sangue no gelo.
- Desinfete a superfície de trabalho e desligue a bancada de fluxo laminar. Retorne os camundongos SPF em uma VCI fechada para a sala de alojamento SPF (R4).
4. Entrando na área para "Ratos selvagens"
- Retire os sapatos e as meias na ante-sala do chuveiro de ar (PA). Coloque meias e equipamentos de proteção individual (EPI) de corpo inteiro consistindo de macacão Tyvek, rede de cabelo, se necessário, luvas de algodão, luvas de nitrilo e máscaras faciais (Figura 3).
- Entre no chuveiro de ar de meias através do revestimento adesivo do piso. Durante o banho de ar, levante os braços e faça um giro de 360°.
- Saia do chuveiro de ar e calce os sapatos da área do outro lado.
5. Amostragem de sangue de "camundongos selvagens"
- Transfira "camundongos selvagens" (machos e fêmeas, 8 a 20 semanas) da sala onde são mantidos (R3) em uma gaiola fechada de VCI para a sala de procedimentos (PR2).
- Ligue a bancada de fluxo laminar e desinfete a superfície do espaço de trabalho.
- Siga os procedimentos descritos para amostragem de camundongos SPF na seção 3, etapas 2-8.
- Depois de completar a coleta de sangue, troque as luvas. Desinfete todos os materiais e superfícies. Desligue a bancada de fluxo laminar.
6. Exportação de amostras de sangue da área de "camundongos selvagens" através do gabinete de fluxo de ar laminar (LAF)
NOTA: A sala de procedimentos (PR2) contém um gabinete LAF, que serve como fechadura de material e sala de intervenção estéril. As amostras são transferidas através da cabine LAF. O interior é acessível tanto por dentro (via E1 e PR2) quanto por fora (via E2 e CR) da área Wildling e é dividido ao meio por uma parede de vidro com uma porta deslizante (Figura 1). Duas pessoas são necessárias para exportar materiais: A Pessoa 1 (dentro da área Wildling [via PR2]) executará as etapas 6.1 e 6.2. A pessoa 2 (fora da área dos Selvagens [via E2]) executará as etapas 6.3 a 6.5.
- Desinfete os recipientes de amostra. Remova os recipientes de amostra através da porta deslizante na parede de vidro da cabine LAF.
- Após a conclusão da transferência dos recipientes de amostra para a pessoa 2, receba roupas de proteção da pessoa 2 (usa roupas de proteção na trava da bata da cabine) do outro lado da cabine LAF e descarte-as. Desinfete todas as superfícies.
- Coloque roupas de proteção no LAF de acesso em frente à cabine do LAF (CR, Figura 1).
- Receba recipientes de amostra desinfetados da área Wildling sem contato através da porta deslizante na parede de vidro da cabine LAF.
- Remova a roupa de proteção e passe-a pela porta deslizante para a área interna da cabine LAF para descarte.
7. Saindo da instalação para "ratos selvagens"
- Deixe macacões descartáveis e sapatos de área dentro da área. Descarte a rede de cabelo, luvas de borracha e máscara facial.
NOTA: Sapatos e macacões podem ser reutilizados. - Entre no chuveiro de ar imediatamente na área meias. Levante os braços e faça um giro de 360° durante o banho de ar.
- Deixe o chuveiro de ar e coloque as meias da área no coletor de roupas. Coloque as meias e sapatos e capas de sapato descartáveis. Depósito de roupas na área do vestiário no coletor de lavanderia. Troque de roupa no vestiário
8. Processamento e análise de amostras de sangue
- Traga amostras de sangue para o laboratório.
- Prepare o coquetel de coloração de anticorpos conjugados com fluoróforo: Para cada amostra, adicione 0,25 μL de Alexa Fluor 700 anti-mouse CD45, 0,25 μL de cadeia anti-camundongo TCR-β Brilliant Violet 605, 0,25 μL de APC anti-camundongo CD4, 0,25 μL de Brilliant Violet 785 anti-mouse CD8, 0,25 μL de FITC anti-camundongo CD44 e 0,25 μL de PerCP/Cyanine5.5 anti-camundongo CD62L a 50 μL de tampão de citometria de fluxo (solução salina tamponada com fosfato, 2 mM EDTA, 0,1% de albumina de soro bovino, 4 °C). Mantenha no escuro no gelo até a etapa 8.8.
NOTA: Os fluoróforos utilizados podem ser adaptados à configuração do citômetro de fluxo que será utilizado para a aquisição da amostra.
- Prepare o coquetel de coloração de anticorpos conjugados com fluoróforo: Para cada amostra, adicione 0,25 μL de Alexa Fluor 700 anti-mouse CD45, 0,25 μL de cadeia anti-camundongo TCR-β Brilliant Violet 605, 0,25 μL de APC anti-camundongo CD4, 0,25 μL de Brilliant Violet 785 anti-mouse CD8, 0,25 μL de FITC anti-camundongo CD44 e 0,25 μL de PerCP/Cyanine5.5 anti-camundongo CD62L a 50 μL de tampão de citometria de fluxo (solução salina tamponada com fosfato, 2 mM EDTA, 0,1% de albumina de soro bovino, 4 °C). Mantenha no escuro no gelo até a etapa 8.8.
- Desinfete os tubos de coleta de sangue. Adicione 2 mL de tampão de citometria de fluxo gelado a um tubo de poliestireno de fundo redondo de 5 mL. Coloque o tubo no gelo.
- Abra o tubo de coleta de sangue. Adicione 10 μL de sangue ao tubo que contém o tampão de citometria de fluxo e o vórtice de pulso.
- Gire para baixo a 400 x g por 5 min a 4 °C.
- Aspire o sobrenadante. Adicione 1 mL de tampão de lise de glóbulos vermelhos (RBC), vórtice de pulso e incube por 3 min em temperatura ambiente (RT).
- Adicione 100 μL de PBS 10x. Gire para baixo a 400 x g por 5 min a 4 °C.
- Repita as etapas 8.5-8.6.
- Aspire o sobrenadante. Adicione 50 μL de coquetel de coloração de anticorpos, vórtice e incube por 20 minutos em gelo no escuro.
- Adicione 1 mL de tampão de citometria de fluxo. Gire para baixo a 400 x g por 5 min a 4 °C.
- Aspire o sobrenadante. Adicione 180 μL de tampão de citometria de fluxo.
- Adicione 20 μL de SYTOX Blue Dead Cell Stain (concentração final 1:1000) para discriminação de vivos / mortos.
- Adquira amostras em um citômetro de fluxo e analise os dados usando o software de aquisição de citômetro de fluxo ou o programa de análise de dados de citometria de fluxo.
Resultados
Os "camundongos selvagens" potencialmente abrigam microrganismos normalmente excluídos das instalações do SPF, o que representa um desafio para as práticas de criação de animais dentro de instituições de pesquisa que mantêm padrões rigorosos de higiene. Nos últimos 4 anos, cientistas e veterinários da Charité - Universitätsmedizin Berlin e do Centro Alemão de Proteção de Animais de Laboratório (Bf3R) desenvolveram uma instalação dedicada a camundongos com um microbiom...
Discussão
Camundongos com um microbioma natural são uma ferramenta de pesquisa promissora para a ciência básica e aplicada devido à sua maior semelhança com o superorganismo humano 3,9,10,11,12. As tentativas de incorporar a complexidade biológica em modelos de camundongos levaram ao desenvolvimento de várias abordagens, cada uma...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pela Charité 3R| Substituir - Reduzir - Refinar. A S.P.R. foi apoiada pela Deutsche Forschungsgemeinschaft (DFG, Fundação Alemã de Pesquisa) Emmy Noether-Programm RO 6247/1-1 (ID do projeto 446316360), DFG SFB1160 IMPATH (ID do projeto 256073931) e TRR 359 PILOT (ID do projeto 491676693). S.J. foi apoiado pela Deutsche Forschungsgemeinschaft (DFG, Fundação Alemã de Pesquisa) JO 1216/2-1 e pela Sociedade Alemã de Esclerose Múltipla (DMSG e.V.).
Materiais
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
Referências
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345 (2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119 (2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108 (2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069 (2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361 (2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143 (2018).
- . Premier Available from: https://premier-qms.org/ (2024)
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados