A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
נהלי הפעלה והכלה ביולוגית של מתקן לעכברי מעבדה עם מיקרוביום טבעי: נוהל אימונופנוטיפ
* These authors contributed equally
In This Article
Summary
כאן, אנו מתארים את המבנה ונהלי ההפעלה, כולל אמצעי בלימה מיקרוביאליים של מתקן ל"עכברי פרא" באמצעות דגימת דם לאימונופנוטיפ כדוגמה.
Abstract
השימוש בעכברי מעבדה בעלי מיקרוביום טבעי, כגון "עכברי פרא", מציע כלי מחקר מבטיח הן למדע בסיסי והן למדע יישומי בשל הדמיון הרב שלהם לסופראורגניזם האנושי. עם זאת, הרבייה והתחזוקה של עכברים אלה, המכילים מיקרוביום מגוון הכולל חיידקים, וירוסים וטפילים, מציבים אתגרים משמעותיים למתקני גידול בעלי חיים במוסדות מחקר. כדי להתמודד עם אתגרים אלה, פותח קונספט של מתקן מיוחד לשיכון "עכברי פרא" ב-Charité - Universitätsmedizin Berlin. גישה זו כללה תכנון מתקן עם מאפיינים מבניים ספציפיים ופרוטוקולים תפעוליים כדי להכיל ביעילות את המיקרוביום הטבעי, ובכך להגן על אזורים עם תקני היגיינה גבוהים יותר.
מודגמת מתודולוגיה לדגימת דם הן מ-SPF והן מ"עכברי פרא" לאימונופנוטיפ, המדגישה את זרימת העבודה ואמצעי ההכלה הביולוגית המיושמים במתקן. תוצאות יוצאות דופן מגלות כי "עכברי פרא" שנחשפו למיקרוביום טבעי מפתחים אוכלוסיות תאי חיסון מובהקות, אשר מופחתות משמעותית בעכברים שגודלו ומתוחזקים בתנאי היגיינה מחמירים.
חשיבותו של מחקר זה טמונה בפוטנציאל שלו לספק לחוקרים גישה לעכברים בעלי מיקרוביום טבעי ומערכת חיסון בוגרת הדומה לזו של בני אדם בוגרים. גישה זו יכולה לשפר את יכולת התרגום של ממצאים פרה-קליניים לפרקטיקה קלינית, ובכך לקדם את תחום המחקר הביו-רפואי.
Introduction
ניסויים בעכברים עדיין הכרחיים במדע בסיסי ויישומי, כגון מחקר פרה-קליני וטוקסיקולוגי. עם זאת, הסטנדרטיזציה של ההיגיינה בסביבות מעבדה, שמטרתה להפחית את הרעש הביולוגי ולמזער את השונות בתוצאות הניסוי, הובילה להחרגה של מיקרוביוטה טבעית במידה רבה. לפיכך, התנאים שבהם נולדים ומוחזקים עכברי מעבדה סטנדרטיים היגייניים ונטולי פתוגנים (SPF) שונים מהתנאים בעולם האמיתי שאליהם נחשפים בני אדם ובעלי חיים בדרך כלל. חוסר ההתאמה הזה בין תנאי המעבדה לסביבות הטבעיות שבהן מתרחשות מחלות אנושיות מוליד את "כשל הסטנדרטיזציה": ההנחה שמזעור השונות בתנאי הניסוי משפר את תוצאות התרגום. עם זאת, במציאות, זה מגביל את הרלוונטיות הביולוגית של הממצאים 1,2. לדוגמה, מחקרים הראו כי היעדר מגוון מיקרוביאלי וסביבתי בעכברי SPF יכול לגרום למערכת חיסון לא מפותחת, ולערער את תוקפם של מחקרים אימונולוגיים ופרה-קליניים3.
הוצעו מספר גישות לטיפול בשונות ביולוגית במודלים של עכברים, שלכל אחת מהן יתרונות ומגבלות משלה, כולל מגורים משותפים עם עכברי פרא ועכברי חיות מחמד 3,4,5,6,7,8, חשיפה רציפה לקומנסל 9, החזקת בעלי החיים במכלאות חיצוניות10 או על מצעים מבעלי חיים גדולים11, והשתלות צואה מעכברי בר12. מודל עכברי חדש ומבטיח למחקר פרה-קליני וטוקסיקולוגי הוא מודל "עכברי פרא", המורכב מזני עכברי מעבדה סטנדרטיים המכילים מיקרוביום טבעי13. "עכברי פרא" אלה נוצרים על ידי השתלת עוברים מזני עכברי מעבדה לעכברים שנלכדו בטבע. במהלך הלידה, זני עכברי המעבדה רוכשים את המיקרוביום הטבעי של אמהותיהם הפונדקאיות, ומחקים את החיסון הטבעי המתרחשבמהלך הלידה האנושית. ניתן לגדל "עכברי פרא" כמו כל זן אחר של עכברי מעבדה, כאשר המיקרוביום הטבעי שלהם נשמר לאורך דורות.
"עכברי פרא" מארחים מיקרוביוטה מגוונת - כולל חיידקים, וירוסים וטפילים - שבדרך כלל אינם נכללים במתקני עכברי SPF. כתוצאה מכך, שמירה על מיקרוביום טבעי במתקני מחקר מציבה אתגרים, שכן יש להכיל את החיידקים הללו מבלי לפגוע בתקני ההיגיינה הכוללים של SPF.
ב-Charité - Universitätsmedizin Berlin, הוקם מתקן ייעודי ל"עכברי פרא", המופרד מאזורי ה-SPF על ידי אמצעי הכלה ביולוגית קפדניים. המתקן כולל חדרי רבייה וניסויים, שמבטיחים שהמיקרוביום הטבעי של "עכברי פרא" נשמר בזמן שאזורי SPF מוגנים (איור 1).
הזוגות המייסדים של המושבה של שאריטה יובאו ממושבת "עכברי הבר" שהוקמה במחלקה לחקר המיקרוביום, בית החולים האוניברסיטאי ארלנגן, פרידריך-אלכסנדר-אוניברסיטת ארלנגן-נירנברג (FAU), גרמניה. הם מקבלים תעודת בריאות ומנוטרים באמצעות פאנל מורחב לפתוגנים זואונוטיים לפני ייבוא מייסדי המושבה. זקיפים ישמשו לניטור המיקרוביום לאורך זמן. גם SPF וגם "עכברי פרא" שוכנים באותם תנאים. העכברים מגודלים ומוחזקים באופן מועדף בכלובים מאווררים בנפרד (IVC) סוג II ארוך בקבוצות של חמישה עכברים. הטמפרטורה בתוך המתקן היא 22 מעלות צלזיוס, ומחזור האור/חושך הוא 12 שעות. העכברים מקבלים צ'או סטנדרטי על בסיס דגנים ומי ברז. עיקור מצעים ופריטי העשרה מיותרים עבור "עכברי פרא". עם זאת, חיטוי פריטים אלה מונע ערבוב של חומרים באזורים שבהם מאוחסנים עכברי SPF.
בפרוטוקול זה, מודגמים הליכי האימונופנוטיפ הן עבור SPF והן עבור "עכברי פרא", המדגישים את פרוטוקולי ההכלה המיקרוביאלית המחמירים במתקן "עכבר פרא". אמצעים אלה מבטיחים את שלמות סביבות SPF תוך מתן היתרונות של עבודה עם עכברים הנושאים מיקרוביום טבעי.
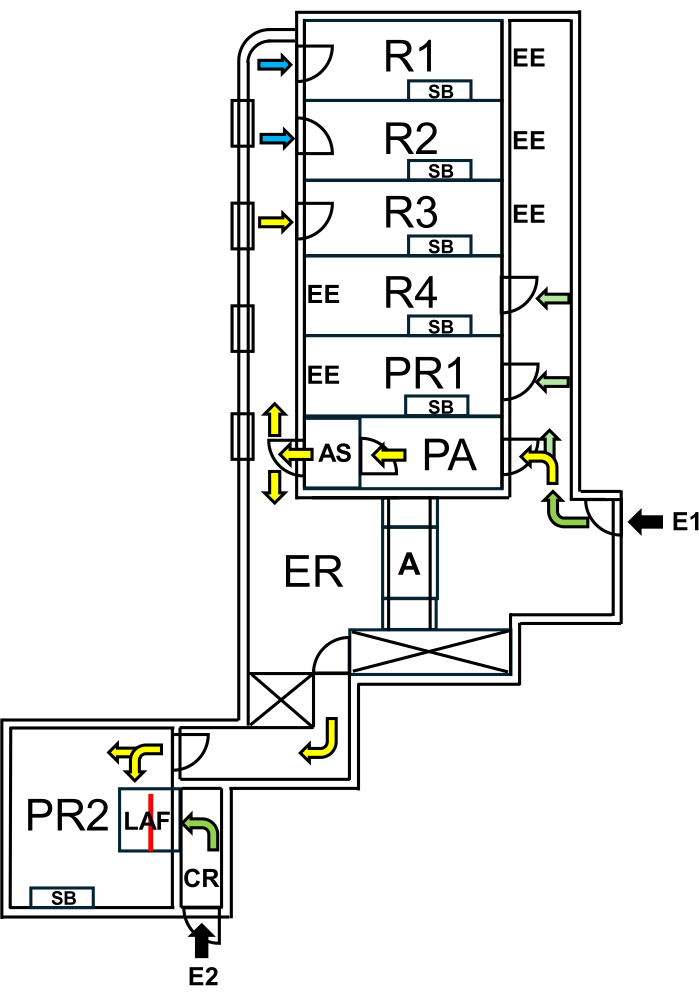
איור 1: פריסת המתקן עבור עכברי Wildling. E1 = גישה למתקן. החצים מציינים את נתיב הכניסה למתקן. E2 = גישה לתא זרימת האוויר הלמינרי מחוץ למתקן. PA = נעילת אוויר לכוח אדם עם מקלחת אוויר. AS = מקלחת אוויר. R1, R2 = חדרים לגידול עכברי פרא. R3 = מקום להחזקת עכברי פרא. R4 = מקום להחזקת עכברי SPF. PR1 = חדר פרוצדורות לעכברי SPF. PR2 = חדר פרוצדורות לעכברי פרא. SB = ספסל עבודה סטרילי. EE = יציאות חירום. CR = חדר הלבשה מול תא ה-LAF. LAF = תא זרימת אוויר למינרי להתערבויות תחת זרימת אוויר מגן. A = אוטוקלאב. ER = חדר ציוד. חיצים ירוקים מייצגים מסלולים נגישים בעת עבודה עם בעלי חיים SPF, וחצים צהובים מציינים נתיבים זמינים לעבודה עם עכברי Wildling לאחר מקלחת אווירית. חיצים כחולים מציינים גישה לצוות החקלאות בלבד. הקו האדום מסמן את קיר הזכוכית בתוך תא ה-LAF, המחלק את החלל לשני חלקים שניתן לגשת אליהם מ-E1 דרך PR2 או מ-E2 דרך CR. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
המתקן ל"עכברי בר" והנהלים הקשורים לבעלי חיים אושרו על ידי המשרד הממשלתי האחראי לניסויים בבעלי חיים, "Landesamt für Gesundheit und Soziales Berlin" (LAGeSo). השלבים החשובים ביותר של הפרוטוקול מסוכמים באיור 2.
1. קבלת גישה למתקן Wilding
- קבל היכרות אישית עם נהלי ההפעלה וההכלה הביולוגית של המתקן מהממונה האחראי על רווחת בעלי החיים.
- קבל את מפתח המשדר כדי להיכנס למתקן עבור "עכברים פראיים" ולהזמין את חדרי ההליכים באמצעות מערכת ההזמנות המקוונת.
2. כניסה למתקן ל"עכברי פרא"
- הפקידו את הבגדים בחדר ההלבשה.
- החליפו לבגדים באזור: מכנסיים, קסאק וכיסויי נעליים חד פעמיים (איור 3).
3. דגימת דם מעכברי SPF באזור ה-SPF
- העבירו את עכברי ה-SPF (זכר ונקבה, 8-20 שבועות) מהחדר בו הם מוחזקים (R4) לחדר ההליכים לבעלי חיים SPF (PR1) בכלוב IVC סגור.
- הפעל את ספסל הזרימה הלמינרית וחטא את משטח סביבת העבודה עם 70% אתנול נפח. עבדו בתוך הספסל.
- בדוק את הצינורות הנימים לאיתור חלקים שבורים או סדוקים כדי למנוע סיכון מוגבר לשבירה או נזק.
- בהרדמה כללית קצרה עם איזופלורן (אינדוקציה ב-5% איזופלורן באוויר רפואי מועשר בחמצן, ואחריו 1.5%-2.0% לתחזוקה), לאחר אובדן רפלקס נסיגת הדוושה (כפי שמצוין באמצעות צביטת הבוהן), דחסו את ורידי הצוואר של העכברים על ידי אחיזה בשרוול הצוואר.
- בעזרת יד אחת, אבטח את ראש החיה באמצעות האגודל והאצבע. הכנס נימים טריים לתוך הקנתוס המדיאלי של העין מתחת לקרום המניק בזווית של 45 מעלות. ודא שהנימים ממוקמים בין גלגל העין למסלול הגרמי של העין.
הערה: כדי למנוע טראומה, אל תתנו לקצה הצינור הנימי לגעת במשטח העין. - הכנס את הנימים דרך קרום הסינוס בתנועה סיבובית צירית עדינה. המשך לסובב את הצינור בחלק האחורי של המסלול עד לזרימת הדם. אסוף לפחות 15 מיקרוליטר דם בצינור איסוף דם המכיל חומצה אתילנדיאמינטטראצטית (EDTA) (כטיפה אחת).
- לפני הסרת הנימים, שחרר את האחיזה על קשקוש הצוואר כדי לשמור על דימום לתוך הרקמה למינימום. כדי להבטיח המוסטזיס טוב, השתמש בפד גזה נקי או ספוגית כדי לעצור את הדימום.
- סובב מעט את הצינור כדי לערבב דם ו-EDTA. אין לנער את הצינור. אחסן את דגימת הדם על קרח.
- יש לחטא את משטח העבודה ולכבות את ספסל הזרימה הלמינרית. החזר עכברי SPF ב- IVC סגור לחדר הדיור SPF (R4).
4. כניסה לאזור עבור "עכברי פרא"
- הסר נעליים וגרביים בחדר הכניסה של מקלחת האוויר (PA). לבשו גרבי שטח וציוד מגן אישי לכל הגוף (PPE) המורכב מסרבל Tyvek, רשת לשיער, במידת הצורך, כפפות כותנה, כפפות ניטריל ומסכות פנים (איור 3).
- היכנסו למקלחת האוויר בגרביים דרך כיסוי הרצפה הדביק. בזמן מקלחת אוויר, הרימו את הזרועות ובצעו סיבוב של 360 מעלות.
- צא ממקלחת האוויר ונעל נעלי אזור בצד השני.
5. דגימת דם מ"עכברי פרא"
- העבירו "עכברי פרא" (זכר ונקבה, 8 - 20 שבועות) מהחדר בו הם מוחזקים (R3) בכלוב IVC סגור לחדר ההליכים (PR2).
- הפעל את ספסל הזרימה הלמינרית וחטא את משטח סביבת העבודה.
- בצע את ההליכים המתוארים לדגימת עכברי SPF בסעיף 3, שלבים 2-8.
- לאחר השלמת דגימת הדם, החלף כפפות. חיטוי כל החומרים והמשטחים. כבה את ספסל הזרימה הלמינרית.
6. ייצוא דגימות דם מאזור "עכברי פרא" דרך ארון זרימת האוויר הלמינרית (LAF)
הערה: חדר ההליכים (PR2) מכיל ארון LAF, המשמש כמנעול חומרים וחדר התערבות סטרילי. הדגימות מועברות החוצה דרך תא ה-LAF. החלק הפנימי נגיש הן מבפנים (דרך E1 ו-PR2) והן מבחוץ (דרך E2 ו-CR) של אזור Wildling ומחולק באמצע על ידי קיר זכוכית עם דלת הזזה (איור 1). שני אנשים נדרשים לייצא חומרים: אדם 1 (בתוך אזור הפרא [דרך PR2]) יבצע את שלבים 6.1 ו-6.2. אדם 2 (מחוץ לאזור Wildling [דרך E2]) יבצע את שלבים 6.3-6.5.
- חיטוי מיכלי דגימה. הסירו דוגמאות מיכלים דרך דלת ההזזה בקיר הזכוכית של תא ה-LAF.
- לאחר השלמת העברת מיכלי הדגימה לאדם 2, קבל ביגוד מגן מאדם 2 (לובש ביגוד מגן במנעול הסמוק של התא) בצד השני של תא הנוסעים והשליך אותו. חיטוי כל המשטחים.
- לבש ביגוד מגן ב-LAF הגישה מול תא ה-LAF (CR, איור 1).
- קבל מיכלי דגימה מחוטאים מאזור Wildling ללא מגע דרך דלת ההזזה בקיר הזכוכית של תא ה-LAF.
- הסירו את בגדי המגן והעבירו אותם דרך דלת ההזזה לאזור הפנימי של תא ה-LAF לסילוק.
7. יציאה מהמתקן ל"עכברי פרא"
- השאירו אוברול חד פעמי ונעלי שטח בתוך האזור. יש להשליך רשת לשיער, כפפות גומי ומסכת פנים.
הערה: ניתן לעשות שימוש חוזר בנעליים ואוברולים. - היכנס מיד למקלחת האוויר בגרבי האזור. הרימו ידיים ובצעו סיבוב של 360 מעלות בזמן מקלחת אוויר.
- צאו ממקלחת האוויר והניחו גרבי אזור בקולט הכביסה. לבשו את הגרביים והנעליים וכיסויי נעליים חד פעמיים. הפקידו בגדים בחדר ההלבשה באספן הכביסה. החלפה לבגדים בחדר ההלבשה
8. עיבוד וניתוח דגימות דם
- הביאו דגימות דם למעבדה.
- הכן קוקטייל מכתים נוגדנים מצומד פלואורופור: לכל דגימה, הוסף 0.25 מיקרוליטר של Alexa Fluor 700 נגד עכבר CD45, 0.25 מיקרוליטר של שרשרת TCR-β נגד עכבר Brilliant Violet 605, 0.25 מיקרוליטר של APC נגד עכבר CD4, 0.25 מיקרוליטר של Brilliant Violet 785 נגד עכבר CD8, 0.25 מיקרוליטר של FITC נגד עכבר CD44 ו-0.25 מיקרוליטר של נוגדן CD62L נגד עכבר PerCP/Cyanine5.5 ל-50 מיקרוליטר של מאגר ציטומטריית זרימה (מי מלח עם חוצץ פוספט, 2 מ"מ EDTA, 0.1% אלבומין בסרום בקר, 4 מעלות צלזיוס). שמור בחושך על קרח עד שלב 8.8.
הערה: ניתן להתאים את הפלואורופורים המשמשים לתצורת ציטומטר הזרימה שישמש לרכישת דגימה.
- הכן קוקטייל מכתים נוגדנים מצומד פלואורופור: לכל דגימה, הוסף 0.25 מיקרוליטר של Alexa Fluor 700 נגד עכבר CD45, 0.25 מיקרוליטר של שרשרת TCR-β נגד עכבר Brilliant Violet 605, 0.25 מיקרוליטר של APC נגד עכבר CD4, 0.25 מיקרוליטר של Brilliant Violet 785 נגד עכבר CD8, 0.25 מיקרוליטר של FITC נגד עכבר CD44 ו-0.25 מיקרוליטר של נוגדן CD62L נגד עכבר PerCP/Cyanine5.5 ל-50 מיקרוליטר של מאגר ציטומטריית זרימה (מי מלח עם חוצץ פוספט, 2 מ"מ EDTA, 0.1% אלבומין בסרום בקר, 4 מעלות צלזיוס). שמור בחושך על קרח עד שלב 8.8.
- חיטוי צינורות איסוף דם. הוסף 2 מ"ל של מאגר ציטומטריה בזרימה קרה כקרח לצינור פוליסטירן תחתון עגול של 5 מ"ל. הניחו את הצינור על קרח.
- צינור איסוף דם פתוח. הוסף 10 מיקרוליטר דם לצינור המכיל את מאגר ציטומטריית הזרימה ומערבולת הדופק.
- יש להסתובב בטמפרטורה של 400 x גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- שאפו את הסופרנטנט. הוסף 1 מ"ל של מאגר ליזה של כדוריות דם אדומות (RBC), מערבולת דופק ודגירה למשך 3 דקות בטמפרטורת החדר (RT).
- הוסף 100 מיקרוליטר של 10x PBS. יש להסתובב בטמפרטורה של 400 x גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- חזור על שלבים 8.5-8.6.
- שאפו את הסופרנטנט. הוסף 50 מיקרוליטר של קוקטייל מכתים נוגדנים, מערבולת, ודגירה למשך 20 דקות על קרח בחושך.
- הוסף 1 מ"ל של מאגר ציטומטריית זרימה. יש להסתובב בטמפרטורה של 400 x גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- שאפו את הסופרנטנט. הוסף 180 מיקרוליטר של מאגר ציטומטריית זרימה.
- הוסף 20 מיקרוליטר של כתם תאים מתים כחולים של SYTOX (ריכוז סופי 1:1000) להבחנה בין חיים / מתים.
- רכוש דגימות על ציטומטר זרימה ונתח את הנתונים באמצעות תוכנת רכישת ציטומטר זרימה או תוכנית ניתוח נתוני ציטומטריית זרימה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
"עכברי בר" עלולים להכיל מיקרואורגניזמים שאינם נכללים בדרך כלל במתקני SPF, מה שמציב אתגר לשיטות גידול בעלי חיים במוסדות מחקר המקיימים תקני היגיינה מחמירים. במהלך 4 השנים האחרונות, מדענים ווטרינרים ב-Charité - Universitätsmedizin Berlin והמרכז הגרמני להגנה על חיות מעבדה (Bf3R) פיתחו מתקן המוק...
Access restricted. Please log in or start a trial to view this content.
Discussion
עכברים עם מיקרוביום טבעי הם כלי מחקר מבטיח למדע בסיסי ויישומי בגלל הדמיון הרב יותר שלהם לסופראורגניזם האנושי 3,9,10,11,12. ניסיונות לשלב מורכבות ביולוגית במודלים של עכברים הובילו לפיתו...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי Charité 3R| החלף - הפחית - חדד. S.P.R. נתמך על ידי Deutsche Forschungsgemeinschaft (DFG, קרן המחקר הגרמנית), Emmy Noether-Programm RO 6247/1-1 (מזהה פרויקט 446316360), DFG SFB1160 IMPATH (מזהה פרויקט 256073931) ו-TRR 359 PILOT (מזהה פרויקט 491676693). S.J. נתמך על ידי Deutsche Forschungsgemeinschaft (DFG, קרן המחקר הגרמנית) JO 1216/2-1 והאגודה הגרמנית לטרשת נפוצה (DMSG e.V).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
References
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345(2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119(2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108(2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069(2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361(2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143(2018).
- Dirnagl, U., Kurreck, C., Bernard, R., Przesdzing, I. Premier. , https://premier-qms.org/ (2024).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved