È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Procedure operative e di biocontenimento di una struttura per topi da laboratorio con un microbioma naturale: procedura di immunofenotipizzazione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, descriviamo la struttura e le procedure operative, comprese le misure di contenimento microbico di una struttura per "topi selvatici" utilizzando come esempio il campionamento del sangue per l'immunofenotipizzazione.
Abstract
L'uso di topi da laboratorio con un microbioma naturale, come i "topi bruti", offre uno strumento di ricerca promettente sia per la scienza di base che per quella applicata grazie alla loro stretta somiglianza con il superorganismo umano. Tuttavia, l'allevamento e il mantenimento di questi topi, che ospitano un microbioma diversificato che include batteri, virus e parassiti, pongono sfide significative per le strutture di allevamento degli animali presso gli istituti di ricerca. Per affrontare queste sfide, è stato sviluppato un concetto di struttura specializzata per l'alloggiamento dei "topi bruti" presso la Charité - Universitätsmedizin Berlin. Questo approccio ha comportato la progettazione di una struttura con specifiche caratteristiche strutturali e protocolli operativi per contenere efficacemente il microbioma naturale, proteggendo così aree con standard igienici più elevati.
Viene dimostrata una metodologia per il campionamento di sangue sia da patogeni specifici privi di patogeni (SPF) che da "topi bruti" per l'immunofenotipizzazione, evidenziando il flusso di lavoro e le misure di biocontenimento implementate nella struttura. Risultati notevoli rivelano che i "topi bruti" esposti a un microbioma naturale sviluppano popolazioni di cellule immunitarie distinte, che sono significativamente ridotte nei topi allevati e mantenuti in condizioni igieniche rigorose.
L'importanza di questo studio risiede nel suo potenziale di fornire ai ricercatori l'accesso a topi che possiedono un microbioma naturale e un sistema immunitario maturo simile a quello degli adulti umani. Questo approccio potrebbe migliorare la traducibilità dei risultati preclinici nella pratica clinica, facendo così progredire il campo della ricerca biomedica.
Introduzione
La sperimentazione sui topi è ancora indispensabile nelle scienze di base e applicate, come la ricerca preclinica e tossicologica. Tuttavia, la standardizzazione dell'igiene negli ambienti di laboratorio, volta a ridurre il rumore biologico e minimizzare la variabilità dei risultati sperimentali, ha portato all'esclusione del microbiota naturale in larga misura. Pertanto, le condizioni in cui nascono e vengono allevati topi da laboratorio igienicamente standardizzati e privi di patogeni specifici (SPF) differiscono dalle condizioni del mondo reale a cui gli esseri umani e gli animali sono normalmente esposti. Questa discrepanza tra le condizioni di laboratorio e gli ambienti naturali in cui si verificano le malattie umane dà origine alla "fallacia della standardizzazione": assumere che minimizzare la variazione nelle condizioni sperimentali migliori i risultati traslazionali. Tuttavia, in realtà, limita la rilevanza biologica dei risultati 1,2. Ad esempio, la ricerca ha dimostrato che l'assenza di diversità microbica e ambientale nei topi SPF può portare a un sistema immunitario sottosviluppato, minando la validità degli studi immunologici e preclinici3.
Sono stati proposti diversi approcci per affrontare la variazione biologica nei modelli murini, ognuno con i propri vantaggi e limiti, tra cui la co-housing con topi selvatici e pet shop 3,4,5,6,7,8, l'esposizione sequenziale ai commensali 9, il mantenimento degli animali in recinti all'aperto10 o su lettiere di animali di grossa taglia11 e i trapianti fecali da topi selvatici12. Un nuovo promettente modello murino per la ricerca preclinica e tossicologica è il modello "Wildling mice", che consiste in ceppi standard di topi da laboratorio che ospitano un microbioma naturale13. Questi "topi bruti" sono generati trapiantando embrioni da ceppi di topi da laboratorio in topi catturati in natura. Durante la nascita, i ceppi di topo da laboratorio acquisiscono il microbioma naturale delle loro madri surrogate, imitando l'inoculazione naturale che avviene durante il parto umano13. I "topi bruti" possono essere allevati come qualsiasi altro ceppo di topo da laboratorio, con il loro microbioma naturale preservato attraverso le generazioni.
I "topi bruti" ospitano un microbiota diversificato, tra cui batteri, virus e parassiti, che sono tipicamente esclusi dalle strutture per topi SPF. Di conseguenza, il mantenimento di un microbioma naturale nelle strutture di ricerca presenta delle sfide, poiché questi microbi devono essere contenuti senza compromettere gli standard igienici generali dell'SPF.
Alla Charité - Universitätsmedizin Berlin, è stata istituita una struttura dedicata ai "topi selvatici", separata dalle aree SPF da rigorose misure di biocontenimento. La struttura comprende sale di riproduzione e sperimentazione, garantendo il mantenimento del microbioma naturale dei "topi bruti" e la protezione delle aree SPF (Figura 1).
Le coppie fondatrici della colonia di Charité sono state importate dalla colonia di "topi selvatici" istituita presso il Dipartimento di Ricerca sul Microbioma, Ospedale Universitario di Erlangen, Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU), Germania. Vengono forniti con un certificato sanitario e monitorati con un pannello esteso per i patogeni zoonotici prima dell'importazione dei fondatori della colonia. Le sentinelle saranno utilizzate per monitorare il microbioma nel tempo. Sia SPF che "topi bruti" sono alloggiati nelle stesse condizioni. I topi sono allevati e tenuti preferenzialmente in gabbie ventilate individualmente (IVC) di tipo II lunghe in gruppi di cinque topi. La temperatura all'interno della struttura è di 22 °C e il ciclo luce/buio è di 12 ore. I topi ricevono cibo standard a base di cereali e acqua del rubinetto. La sterilizzazione della lettiera e degli articoli di arricchimento non è necessaria per i "topi bruti". Tuttavia, la sterilizzazione in autoclave di questi articoli impedisce la confusione dei materiali nelle aree in cui sono alloggiati i topi SPF.
In questo protocollo, vengono dimostrate le procedure di immunofenotipizzazione sia per SPF che per "Topi bruti", evidenziando i rigorosi protocolli di contenimento microbico presso la struttura "Topo bruto". Queste misure garantiscono l'integrità degli ambienti SPF, fornendo al contempo i vantaggi di lavorare con topi portatori di un microbioma naturale.
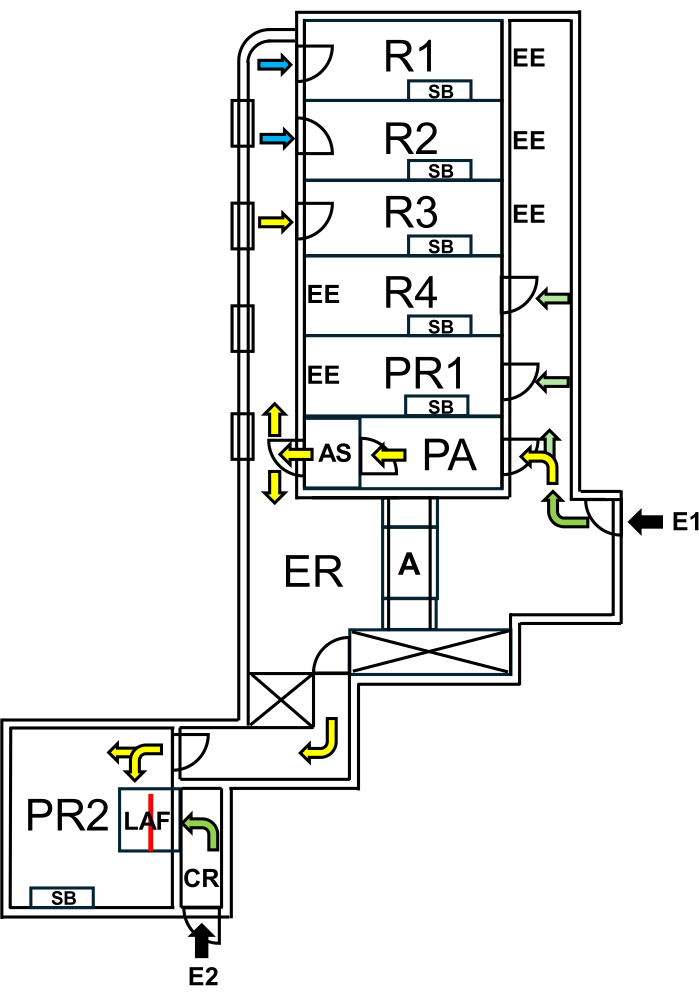
Figura 1: Layout della struttura per i topi bruti. E1 = accesso alla struttura. Le frecce indicano il percorso di ingresso nella struttura. E2 = accesso alla cabina del flusso d'aria laminare dall'esterno della struttura. PA = camera stagna per il personale con doccia d'aria. AS = doccia d'aria. R1, R2 = stanze per l'allevamento di topi bruti. R3 = spazio per tenere i topi selvatici. R4 = spazio per conservare i topi SPF. PR1 = sala operatoria per topi SPF. PR2 = sala operatoria per topi Bruti. SB = banco di lavoro sterile. EE = uscite di emergenza. CR = spogliatoio davanti alla cabina LAF. LAF = cabina a flusso d'aria laminare per interventi sotto flusso d'aria protettivo. A = autoclave. ER = locale tecnico. Le frecce verdi rappresentano i percorsi accessibili quando si lavora con animali SPF e le frecce gialle indicano i percorsi disponibili per lavorare con i topi bruti dopo la doccia d'aria. Le frecce blu indicano l'accesso solo per il personale dell'allevamento. La linea rossa segna la parete di vetro all'interno della cabina LAF, che divide lo spazio in due sezioni a cui si può accedere da E1 tramite PR2 o da E2 tramite CR. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
La struttura per i "Topi selvatici" e le procedure che coinvolgono animali vivi sono state approvate dall'ufficio statale responsabile per la sperimentazione animale, "Landesamt für Gesundheit und Soziales Berlin" (LAGeSo). I passaggi più importanti del protocollo sono riassunti nella Figura 2.
1. Ottenere l'accesso alla struttura Wilding
- Ottieni un'introduzione personale alle procedure operative e di biocontenimento della struttura dal responsabile del benessere degli animali.
- Prendi la chiave del transponder per entrare nella struttura per "Topi bruti" e prenota le sale operatorie tramite il sistema di prenotazione online.
2. Ingresso nella struttura per "Topi bruti"
- Depositare i vestiti nello spogliatoio.
- Cambiati con l'abbigliamento da zona: pantaloni, kasak e copriscarpe usa e getta (Figura 3).
3. Campionamento del sangue da topi SPF nell'area SPF
- Trasferire i topi SPF (maschio e femmina, 8-20 settimane) dalla stanza in cui sono tenuti (R4) alla sala procedure per animali SPF (PR1) in una gabbia IVC chiusa.
- Accendere il banco a flusso laminare e disinfettare la superficie dell'area di lavoro con etanolo al 70% Vol. Lavorare all'interno del banco.
- Ispezionare i tubi capillari per verificare la presenza di sezioni rotte o scheggiate per evitare un aumento del rischio di rotture o danni.
- In breve anestesia generale con isoflurano (induzione al 5% di isoflurano in aria medica arricchita di ossigeno, seguita da 1,5%-2,0% per il mantenimento), dopo la perdita del riflesso di ritiro del pedale (come indicato tramite pizzicamento delle dita), comprimere le vene del collo dei topi afferrando la collottola.
- Usando una mano, fissa la testa dell'animale usando il pollice e l'indice. Inserire un nuovo capillare nel canto mediale dell'occhio sotto la membrana nittitante con un angolo di 45°. Assicurarsi che il capillare sia posizionato tra il bulbo oculare e l'orbita ossea dell'occhio.
NOTA: Per evitare traumi, non lasciare che la punta del tubo capillare tocchi la superficie dell'occhio. - Inserire il capillare attraverso la membrana del seno con un leggero movimento rotatorio assiale. Continuare a ruotare il tubo nella parte posteriore dell'orbita fino a quando il sangue non scorre. Raccogliere almeno 15 μL di sangue in una provetta per la raccolta del sangue contenente acido etilendiamminotetraacetico (EDTA) (circa 1 goccia).
- Prima di rimuovere il capillare, allentare la presa sulla collottola per mantenere al minimo il sanguinamento nel tessuto. Per garantire una buona emostasi, utilizzare una garza o un tampone pulito per fermare l'emorragia.
- Ruotare leggermente il tubo per mescolare sangue e EDTA. Non scuotere il tubo. Conservare il campione di sangue in ghiaccio.
- Disinfettare la superficie di lavoro e spegnere il banco a flusso laminare. Riportare i topi SPF in un IVC chiuso nella stanza di alloggiamento SPF (R4).
4. Entrare nell'area per "Topi bruti"
- Togliere scarpe e calzini nell'anticamera della doccia d'aria (PA). Indossare calze e dispositivi di protezione individuale (DPI) per tutto il corpo costituiti da tuta in Tyvek, retina per capelli, se necessario, guanti di cotone, guanti in nitrile e maschere facciali (Figura 3).
- Entra nella doccia d'aria con i calzini attraverso il rivestimento adesivo del pavimento. Durante la doccia d'aria, sollevare le braccia ed eseguire una rotazione di 360°.
- Esci dalla doccia d'aria e indossa le scarpe da zona dall'altro lato.
5. Campionamento del sangue da "topi selvatici"
- Trasferire i "topi bruti" (maschio e femmina, 8 - 20 settimane) dalla stanza in cui sono tenuti (R3) in una gabbia IVC chiusa alla sala operatoria (PR2).
- Accendere il banco a flusso laminare e disinfettare la superficie dell'area di lavoro.
- Seguire le procedure descritte per il campionamento di topi SPF nella sezione 3, passaggi 2-8.
- Dopo aver completato il prelievo di sangue, cambiare i guanti. Disinfettare tutti i materiali e le superfici. Spegnere il banco a flusso laminare.
6. Esportazione di campioni di sangue dall'area "Topi bruti" tramite l'armadio a flusso d'aria laminare (LAF)
NOTA: La sala operatoria (PR2) contiene un armadio LAF, che funge da serratura del materiale e sala di intervento sterile. I campioni vengono trasferiti all'esterno attraverso la cabina LAF. L'interno è accessibile sia dall'interno (via E1 e PR2) che dall'esterno (via E2 e CR) dell'area dei Bruti ed è diviso al centro da una parete vetrata con porta scorrevole (Figura 1). Per esportare i materiali sono necessarie due persone: la persona 1 (all'interno dell'area dei Bruti [via PR2]) eseguirà i passaggi 6.1 e 6.2. La persona 2 (al di fuori dell'area dei Bruti [via E2]) eseguirà i passaggi 6.3-6.5.
- Disinfettare i contenitori dei campioni. Rimuovere i contenitori dei campioni attraverso la porta scorrevole nella parete di vetro della cabina LAF.
- Dopo che il trasferimento dei contenitori dei campioni alla persona 2 è stato completato, ricevere gli indumenti protettivi dalla persona 2 (indossa indumenti protettivi nel grembiule della cabina) sull'altro lato della cabina LAF e smaltirli. Disinfettare tutte le superfici.
- Indossare indumenti protettivi nella LAF di accesso davanti alla cabina LAF (CR, Figura 1).
- Ricevi contenitori per campioni disinfettati dall'area Wildling senza contatto attraverso la porta scorrevole nella parete di vetro della cabina LAF.
- Rimuovere gli indumenti protettivi e farli passare attraverso la porta scorrevole nell'area interna della cabina LAF per lo smaltimento.
7. Uscita dalla struttura per "Topi bruti"
- Lasciare tute usa e getta e scarpe da zona all'interno dell'area. Smaltire la retina per capelli, i guanti di gomma e la maschera facciale.
NOTA: Scarpe e tute possono essere riutilizzate. - Entra immediatamente nella doccia d'aria in zona calzini. Alza le braccia ed esegui una rotazione di 360° durante la doccia d'aria.
- Lasciare la doccia d'aria e posizionare i calzini nell'area di raccolta della biancheria. Indossa i calzini e le scarpe e i copriscarpe usa e getta. Deposito indumenti nello spogliatoio nel raccoglitore della biancheria. Cambiarsi nei vestiti nello spogliatoio
8. Elaborazione e analisi di campioni di sangue
- Portare campioni di sangue in laboratorio.
- Preparare un cocktail di colorazione con anticorpi coniugati con fluorofori: per ogni campione, aggiungere 0,25 μl di Alexa Fluor 700 anti-mouse CD45, 0,25 μl di Brilliant Violet 605 anti-mouse TCR-β chain, 0,25 μl di APC anti-mouse CD4, 0,25 μl di Brilliant Violet 785 anti-mouse CD8, 0,25 μl di FITC anti-mouse CD44 e 0,25 μl di anticorpo PerCP/Cyanine5.5 anti-mouse CD62L a 50 μl di tampone per citometria a flusso (soluzione salina tamponata con fosfato, 2 mM EDTA, 0,1% albumina sierica bovina, 4 °C). Mantenere al buio sul ghiaccio fino al passaggio 8.8.
NOTA: I fluorofori utilizzati possono essere adattati alla configurazione del citometro a flusso che verrà utilizzato per l'acquisizione del campione.
- Preparare un cocktail di colorazione con anticorpi coniugati con fluorofori: per ogni campione, aggiungere 0,25 μl di Alexa Fluor 700 anti-mouse CD45, 0,25 μl di Brilliant Violet 605 anti-mouse TCR-β chain, 0,25 μl di APC anti-mouse CD4, 0,25 μl di Brilliant Violet 785 anti-mouse CD8, 0,25 μl di FITC anti-mouse CD44 e 0,25 μl di anticorpo PerCP/Cyanine5.5 anti-mouse CD62L a 50 μl di tampone per citometria a flusso (soluzione salina tamponata con fosfato, 2 mM EDTA, 0,1% albumina sierica bovina, 4 °C). Mantenere al buio sul ghiaccio fino al passaggio 8.8.
- Disinfettare le provette per la raccolta del sangue. Aggiungere 2 mL di tampone per citometria a flusso ghiacciato in una provetta di polistirene a fondo tondo da 5 mL. Metti il tubo sul ghiaccio.
- Aprire la provetta per la raccolta del sangue. Aggiungere 10 μL di sangue alla provetta contenente il tampone per citometria a flusso e il vortice del polso.
- Centrifugare a 400 x g per 5 minuti a 4 °C.
- Aspirare il surnatante. Aggiungere 1 mL di tampone di lisi dei globuli rossi (RBC), vortice di impulsi e incubare per 3 minuti a temperatura ambiente (RT).
- Aggiungere 100 μl di PBS 10x. Centrifugare a 400 x g per 5 minuti a 4 °C.
- Ripetere i passaggi 8.5-8.6.
- Aspirare il surnatante. Aggiungere 50 μl di cocktail di colorazione anticorpale, vorticare e incubare per 20 minuti su ghiaccio al buio.
- Aggiungere 1 mL di tampone per citometria a flusso. Centrifugare a 400 x g per 5 minuti a 4 °C.
- Aspirare il surnatante. Aggiungere 180 μl di tampone per citometria a flusso.
- Aggiungere 20 μl di SYTOX Blue Dead Cell Stain (concentrazione finale 1:1000) per la distinzione tra vivo e morto.
- Acquisisci campioni su un citometro a flusso e analizza i dati utilizzando il software di acquisizione del citometro a flusso o il programma di analisi dei dati della citometria a flusso.
Risultati
I "topi selvatici" ospitano potenzialmente microrganismi tipicamente esclusi dalle strutture SPF, il che rappresenta una sfida per le pratiche di allevamento degli animali all'interno degli istituti di ricerca che rispettano rigorosi standard igienici. Negli ultimi 4 anni, gli scienziati e i veterinari della Charité - Universitätsmedizin Berlin e del Centro tedesco per la protezione degli animali da laboratorio (Bf3R) hanno sviluppato una struttura dedicata ai topi con un microbioma na...
Discussione
I topi con un microbioma naturale sono uno strumento di ricerca promettente per la scienza di base e applicata a causa della loro maggiore somiglianza con il superorganismo umano 3,9,10,11,12. I tentativi di incorporare la complessità biologica nei modelli murini hanno portato allo sviluppo di vari approcci, ciascuno con i pr...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da Charité 3R| Sostituisci - Riduci - Perfeziona. S.P.R. è stato sostenuto dalla Deutsche Forschungsgemeinschaft (DFG, Fondazione tedesca per la ricerca) Emmy Noether-Programm RO 6247/1-1 (ID progetto 446316360), DFG SFB1160 IMPATH (ID progetto 256073931) e TRR 359 PILOT (ID progetto 491676693). S.J. è stato sostenuto dalla Deutsche Forschungsgemeinschaft (DFG, Fondazione tedesca per la ricerca) JO 1216/2-1 e dalla Società tedesca per la sclerosi multipla (DMSG e.V.).
Materiali
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
Riferimenti
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345 (2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119 (2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108 (2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069 (2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361 (2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143 (2018).
- . Premier Available from: https://premier-qms.org/ (2024)
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon