JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
천연 마이크로바이옴을 가진 실험용 마우스를 위한 시설의 운영 및 생물 봉쇄 절차: 면역표현형 분석 절차
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 면역표현형을 위한 혈액 샘플링을 예로 들어 "야생 마우스" 시설의 미생물 억제 조치를 포함한 구조 및 운영 절차를 설명합니다.
초록
"와일들링 마우스"와 같은 천연 마이크로바이옴을 가진 실험용 마우스의 사용은 인간 초유기체와 매우 유사하기 때문에 기초 과학 및 응용 과학 모두에 유망한 연구 도구를 제공합니다. 그러나 박테리아, 바이러스, 기생충 등 다양한 마이크로바이옴을 보유한 이 쥐의 사육 및 유지는 연구 기관의 축산 시설에 상당한 문제를 제기하고 있습니다. 이러한 문제를 해결하기 위해 Charité - Universitätsmedizin Berlin에서 "Wildling 마우스"를 수용하기 위한 특수 시설 개념이 개발되었습니다. 이 접근 방식에는 자연 마이크로바이옴을 효과적으로 억제할 수 있는 특정 구조적 특징과 운영 프로토콜을 갖춘 시설을 설계하여 위생 기준이 더 높은 지역을 보호하는 것이 포함되었습니다.
면역표현형분석을 위해 지정된 병원체가 없는(SPF) 및 "와일들링 마우스"에서 혈액을 채취하는 방법론을 시연하여 시설에서 구현된 워크플로우 및 생물 봉쇄 조치를 강조합니다. 놀라운 결과에 따르면 천연 마이크로바이옴에 노출된 "와일들링 마우스"는 뚜렷한 면역 세포 집단을 발달시키며, 이는 엄격한 위생 조건에서 사육되고 유지된 마우스에서 크게 감소합니다.
이 연구의 의의는 연구자들이 자연 마이크로바이옴과 인간 성인과 유사한 성숙한 면역 체계를 가진 쥐에 접근할 수 있는 잠재력을 제공한다는 데 있습니다. 이 접근 방식은 전임상 결과를 임상 실습으로 번역할 수 있는 가능성을 향상시켜 생물 의학 연구 분야를 발전시킬 수 있습니다.
서문
생쥐를 대상으로 한 실험은 전임상 및 독성학 연구와 같은 기초 및 응용 과학에서 여전히 필수적입니다. 그러나 생물학적 소음을 줄이고 실험 결과의 변동성을 최소화하기 위한 실험실 환경의 위생 표준화로 인해 자연 미생물군은 상당 부분 배제되었습니다. 따라서 위생적으로 표준화되고 지정된 병원균이 없는(SPF) 실험용 마우스가 태어나고 사육되는 조건은 인간과 동물이 일반적으로 노출되는 실제 조건과 다릅니다. 실험실 조건과 인간 질병이 발생하는 자연 환경 간의 이러한 불일치는 "표준화 오류"를 야기합니다: 실험 조건의 변동을 최소화하면 번역 결과가 향상된다고 가정합니다. 그러나 실제로는 연구 결과의 생물학적 관련성을 제한합니다 1,2. 예를 들어, 연구에 따르면 SPF 마우스에 미생물 및 환경적 다양성이 없으면 면역 체계가 덜 발달하여 면역학 및 전임상 연구의 타당성이 훼손될 수 있습니다3.
생쥐 모델의 생물학적 변이를 해결하기 위해 몇 가지 접근법이 제안되었는데, 각각 고유한 장점과 한계가 있는데, 야생 및 애완동물 가게 생쥐와의 공동 주거3,4,5,6,7,8, 공생동물에 대한 순차적 노출9, 동물을 실외 우리10 또는 대형 동물11의 침구 위에 보관하기11, 야생 생쥐의 배설물 이식12 등이 있다. 전임상 및 독성학 연구를 위한 유망한 새로운 마우스 모델은 "Wildling 마우스" 모델이며, 이는 천연 마이크로바이옴13을 보유한 표준 실험실 마우스 균주로 구성됩니다. 이 "와일들링 마우스"는 실험실 마우스 균주의 배아를 야생에서 포획된 마우스에 이식하여 생성됩니다. 출생 시, 실험용 생쥐 균주는 대리모의 천연 마이크로바이옴을 획득하며, 이는 인간 분만 중에 발생하는 자연 접종을 모방합니다13. "와일들링 마우스"는 다른 실험실 마우스 균주와 마찬가지로 사육할 수 있으며, 천연 마이크로바이옴은 세대에 걸쳐 보존됩니다.
"와일들링 마우스"는 박테리아, 바이러스 및 기생충을 포함한 다양한 미생물군을 숙주로 삼고 있으며, 이러한 미생물군은 일반적으로 SPF 마우스 시설에서 제외됩니다. 결과적으로, 연구 시설에서 천연 마이크로바이옴을 유지하는 것은 전반적인 SPF 위생 기준을 손상시키지 않고 억제되어야 하기 때문에 어려운 과제입니다.
Charité - Universitätsmedizin Berlin에는 엄격한 생물 봉쇄 조치에 의해 SPF 영역과 분리된 "Wildling mice"를 위한 전용 시설이 설립되었습니다. 이 시설에는 사육실과 실험실이 포함되어 있어 SPF 영역이 보호되는 동안 "와일들링 마우스"의 자연 마이크로바이옴이 유지됩니다(그림 1).
Charité 군집의 창시자 쌍은 독일 Erlangen-Nürnberg (FAU)의 Friedrich-Alexander-Universität Erlangen에있는 University Hospital Erlangen의 미생물 군집 연구부에 설립 된 "Wilding mice"군집에서 수입되었습니다. 그들은 건강 증명서와 함께 제공되고 식민지 설립자가 수입되기 전에 동물원성 병원체에 대한 확장 패널로 모니터링됩니다. 센티넬은 시간이 지남에 따라 마이크로바이옴을 모니터링하는 데 사용됩니다. SPF와 "와일들링 마우스"는 모두 동일한 조건에서 사육됩니다. 마우스는 5 마리의 마우스 그룹으로 긴 IVC (Individual Ventilated Cage) 유형 II에서 우선적으로 사육되고 보관됩니다. 시설 내부 온도는 22°C이고 라이트/다크 사이클은 12시간입니다. 생쥐는 표준 곡물 기반 차우와 수돗물을 받습니다. 침구 및 농축 품목의 살균은 "Wildling mice"에 필요하지 않습니다. 그러나 이러한 품목을 고압증기멸균하면 SPF 마우스가 있는 영역에서 재료가 혼합되는 것을 방지할 수 있습니다.
이 프로토콜에서는 SPF 및 "Wildling 마우스" 모두에 대한 면역 표현형 분석 절차를 시연하여 "Wildling 마우스" 시설의 엄격한 미생물 억제 프로토콜을 강조합니다. 이러한 조치는 SPF 환경의 무결성을 보장하는 동시에 천연 마이크로바이옴을 가진 마우스와 함께 작업할 수 있는 이점을 제공합니다.
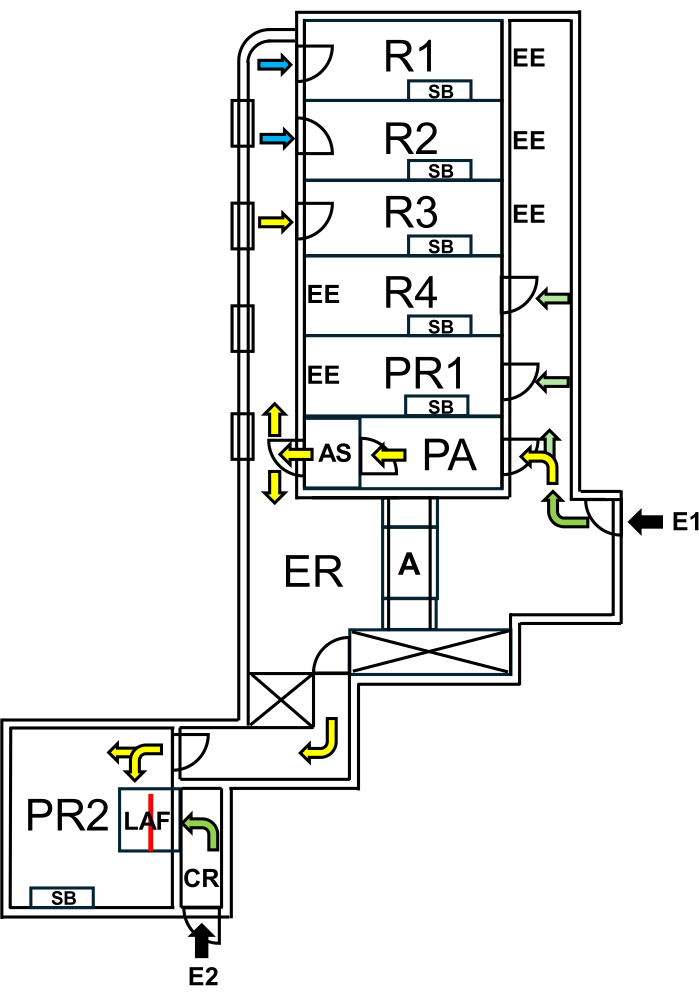
그림 1: Wildling 마우스를 위한 시설의 레이아웃. E1 = 시설 이용. 화살표는 시설로의 진입 경로를 나타냅니다. E2 = 시설 외부에서 층류 기류 캐빈에 대한 접근. PA = 에어 샤워기가 있는 인원 에어록. AS = 에어 샤워. R1, R2 = 와일들링 마우스 번식을 위한 방. R3 = 야생 마우스를 보관할 수 있는 공간. R4 = SPF 마우스를 보관할 수 있는 공간. PR1 = SPF 마우스의 시술실. PR2 = Wildling 마우스의 시술실. SB = 멸균 작업대. EE = 비상구. CR = LAF 객실 앞 탈의실. LAF = 보호 공기 흐름 하에서의 개입을 위한 층류 기류 캐빈. A = 오토클레이브. ER = 장비실. 녹색 화살표는 SPF 동물과 함께 작업할 때 접근할 수 있는 경로를 나타내고, 노란색 화살표는 에어 샤워 후 Wildling 마우스와 함께 작업할 수 있는 경로를 나타냅니다. 파란색 화살표는 축산 직원만 접근할 수 있음을 나타냅니다. 빨간색 선은 LAF 캐빈 내부의 유리벽을 표시하며, 공간을 PR2를 통해 E1에서 액세스하거나 CR을 통해 E2에서 액세스할 수 있는 두 섹션으로 나눕니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
"야생 생쥐"를 위한 시설과 살아있는 동물과 관련된 절차는 동물 실험을 담당하는 주 사무소인 "Landesamt für Gesundheit und Soziales Berlin"(LAGeSo)의 승인을 받았습니다. 프로토콜의 가장 중요한 단계는 그림 2에 요약되어 있습니다.
1. Wilding 시설 이용
- 담당 동물 복지 담당관으로부터 시설의 운영 및 생물 격리 절차에 대한 개인 소개를 받으십시오.
- 트랜스폰더 키를 받아 "Wildling mice" 시설에 입장하고 온라인 예약 시스템을 통해 시술실을 예약하십시오.
2. "와일들링 마우스"의 시설 입점
- 탈의실에 옷을 넣어주세요.
- 지역 의류로 갈아입기: 바지, 카삭, 일회용 신발 커버(그림 3).
3. SPF 영역의 SPF 마우스에서 혈액 샘플링
- SPF 마우스(수컷 및 암컷, 8-20주)를 보관하는 방(R4)에서 밀폐된 IVC 케이지의 SPF 동물(PR1) 시술실로 옮깁니다.
- 층류 벤치를 켜고 작업 공간 표면을 70% Vol. 에탄올. 벤치 내부에서 작업하십시오.
- 모세관에 파손되거나 부서진 부분이 있는지 검사하여 파손 또는 손상 위험이 증가하지 않도록 합니다.
- 이소플루란(산소가 풍부한 의료용 공기에서 5% 이소플루란으로 유도한 후 유지 관리를 위해 1.5%-2.0% 투여)으로 간단한 전신 마취 하에, 페달 철수 반사 상실 후(발가락 꼬집음을 통해 나타난 바와 같이) 목덜미를 잡고 마우스의 목 정맥을 압박합니다.
- 한 손으로 엄지와 검지를 사용하여 동물의 머리를 고정합니다. nictitating membrane 아래 눈의 내측각에 45° 각도로 새로운 모세혈관을 삽입합니다. 모세혈관이 안구와 눈의 뼈 안와 사이에 위치하는지 확인합니다.
알림: 외상을 방지하려면 모세혈관 끝이 눈 표면에 닿지 않도록 하십시오. - 부드러운 축 방향 회전 동작으로 부비동 막을 통해 모세관을 삽입합니다. 혈액이 흐를 때까지 안와 뒤쪽에서 튜브를 계속 회전시킵니다. 에틸렌디아민테트라아세트산(EDTA)이 함유된 채혈 튜브에 최소 15μL의 혈액을 수집합니다(약 1방울).
- 모세혈관을 제거하기 전에 목덜미의 손잡이를 풀어 조직의 출혈을 최소화합니다. 좋은 지혈을 위해 깨끗한 거즈 패드나 면봉을 사용하여 출혈을 멈추십시오.
- 튜브를 약간 돌려 혈액과 EDTA를 혼합합니다. 튜브를 흔들지 마십시오. 혈액 샘플을 얼음에 보관하십시오.
- 작업 표면을 소독하고 층류 벤치를 끕니다. 밀폐된 IVC의 SPF 마우스를 SPF 하우징 룸(R4)으로 반환합니다.
4. "와일들링 마우스" 구역 진입
- 에어 샤워기(PA)의 대기실에서 신발과 양말을 벗으십시오. 지역 양말과 Tyvek 작업복, 헤어 네트(필요한 경우), 면 장갑, 니트릴 장갑 및 안면 마스크로 구성된 전신 개인 보호 장비(PPE)를 착용합니다(그림 3).
- 접착 바닥재를 통해 양말을 신은 채로 에어 샤워에 들어갑니다. 에어샤워를 하는 동안 팔을 들어 올리고 360° 회전을 수행합니다.
- 에어 샤워기를 나와 반대편에 있는 에어리어 슈즈를 신습니다.
5. "야생 쥐"에서 혈액 샘플링
- "와일들링 마우스"(수컷 및 암컷, 8 - 20주)를 밀폐된 IVC 케이지에 보관하는 방(R3)에서 시술실(PR2)로 이송합니다.
- 층류 벤치를 켜고 작업 공간 표면을 소독합니다.
- 섹션 3, 2-8단계에서 SPF 마우스 샘플링에 대해 설명된 절차를 따릅니다.
- 혈액 채취를 완료한 후 장갑을 교체하십시오. 모든 재료와 표면을 소독하십시오. 층류 벤치를 끕니다.
6. 층류 기류(LAF) 캐비닛을 통해 "Wildling 마우스" 영역에서 혈액 샘플 내보내기
알림: 시술실(PR2)에는 재료 잠금 장치 및 멸균 중재실 역할을 하는 LAF 캐비닛이 있습니다. 샘플은 LAF 캐빈을 통해 운반됩니다. 내부는 Wildling 지역의 내부(E1 및 PR2를 통해)와 외부(E2 및 CR을 통해) 모두에서 접근할 수 있으며 중간은 슬라이딩 도어가 있는 유리 벽으로 나뉩니다(그림 1). 자재를 내보내려면 두 사람이 필요합니다: 사람 1([PR2를 통해] Wildling 영역 내부)은 6.1 및 6.2 단계를 수행합니다. 사람 2(Wildling 영역 외부[E2를 통해])는 6.3-6.5단계를 수행합니다.
- 샘플 용기를 소독합니다. LAF 객실의 유리 벽에 있는 슬라이딩 도어를 통해 샘플 용기를 제거합니다.
- 샘플 용기를 사람 2에게 옮긴 후 LAF 객실 반대편에 있는 사람 2(객실의 작업복 잠금 장치에 보호복을 착용)로부터 보호복을 받아 폐기합니다. 모든 표면을 소독하십시오.
- LAF 객실 앞의 액세스 LAF에서 보호복을 착용합니다(CR, 그림 1).
- LAF 객실의 유리벽에 있는 슬라이딩 도어를 통해 접촉 없이 Wildling 지역에서 소독된 샘플 용기를 받습니다.
- 보호복을 벗고 슬라이딩 도어를 통해 LAF 캐빈의 내부 영역으로 통과시켜 폐기합니다.
7. "와일들링 마우스"를 위한 시설 퇴장
- 일회용 작업복과 신발은 해당 지역 내에 두십시오. 머리망, 고무장갑, 안면 마스크는 폐기하십시오.
참고: 신발과 작업복은 재사용할 수 있습니다. - 에어 샤워는 즉시 양말 부위에 넣으십시오. 팔을 들어 올리고 에어 샤워를 하는 동안 360° 회전을 수행합니다.
- 에어 샤워기는 그대로 두고 세탁물 수집기에 양말을 넣으십시오. 양말과 신발, 일회용 신발 커버를 착용하십시오. 세탁물 수거기의 탈의실에 옷을 맡기십시오. 탈의실에서 옷으로 갈아입기
8. 혈액 샘플 처리 및 분석
- 혈액 샘플을 실험실로 가져옵니다.
- 형광단 접합 항체 염색 칵테일 준비: 각 샘플에 대해 Alexa Fluor 700 안티 마우스 CD45 0.25 μL, Brilliant Violet 605 안티 마우스 TCR-β 체인 0.25 μL, APC 안티 마우스 CD4 0.25 μL, Brilliant Violet 785 안티 마우스 CD8 0.25 μL, FITC 안티 마우스 CD44 0.25 μL 및 PerCP/Cyanine5.5 안티 마우스 CD62L 항체 0.25 μL를 50 μL의 유세포 분석 버퍼(인산염 완충 식염수, 2 mM EDTA, 0.1% 소 혈청 알부민, 4 °C). 8.8단계까지 얼음 위의 어둠 속에 보관하십시오.
참고: 사용된 형광단은 샘플 수집에 사용될 유세포 분석기의 구성에 맞게 조정할 수 있습니다.
- 형광단 접합 항체 염색 칵테일 준비: 각 샘플에 대해 Alexa Fluor 700 안티 마우스 CD45 0.25 μL, Brilliant Violet 605 안티 마우스 TCR-β 체인 0.25 μL, APC 안티 마우스 CD4 0.25 μL, Brilliant Violet 785 안티 마우스 CD8 0.25 μL, FITC 안티 마우스 CD44 0.25 μL 및 PerCP/Cyanine5.5 안티 마우스 CD62L 항체 0.25 μL를 50 μL의 유세포 분석 버퍼(인산염 완충 식염수, 2 mM EDTA, 0.1% 소 혈청 알부민, 4 °C). 8.8단계까지 얼음 위의 어둠 속에 보관하십시오.
- 채혈 튜브를 소독하십시오. 2 mL의 ice-cold 유세포 분석 버퍼를 5 mL 둥근 바닥 폴리스티렌 튜브에 추가합니다. 튜브를 얼음 위에 놓습니다.
- 채혈 튜브를 엽니다. 유세포 분석 완충액과 펄스 소용돌이가 포함된 튜브에 10μL의 혈액을 추가합니다.
- 400 x g 에서 4 °C에서 5분 동안 스핀 다운합니다.
- 상층액을 흡인합니다. 적혈구(RBC) 용해 완충액 1mL, 펄스 와류를 추가하고 실온(RT)에서 3분 동안 배양합니다.
- 100μL의 10x PBS를 추가합니다. 400 x g 에서 4 °C에서 5분 동안 스핀 다운합니다.
- 8.5-8.6단계를 반복합니다.
- 상층액을 흡인합니다. 50μL의 항체 염색 칵테일, 볼텍스를 추가하고 어두운 곳에서 얼음 위에서 20분 동안 배양합니다.
- 유세포 분석 완충액 1mL를 추가합니다. 400 x g 에서 4 °C에서 5분 동안 스핀 다운합니다.
- 상층액을 흡인합니다. 180 μL의 유세포 분석 완충액을 추가합니다.
- 20 μL의 SYTOX Blue Dead Cell Stain(최종 농도 1:1000)을 첨가하여 생사(live/dead)를 구별합니다.
- 유세포 분석기에서 샘플을 획득하고 유세포 분석기 수집 소프트웨어 또는 유세포 분석 데이터 분석 프로그램을 사용하여 데이터를 분석합니다.
Access restricted. Please log in or start a trial to view this content.
결과
"야생 생쥐"는 SPF 시설에서 일반적으로 배제되는 미생물을 보유하고 있을 수 있으며, 이는 엄격한 위생 기준을 유지하는 연구 기관 내의 축산 관행에 문제를 제기합니다. 지난 4년 동안 베를린 Charité - Universitätsmedizin과 독일 실험실 동물 보호 센터(Bf3R)의 과학자와 수의사는 공동 노력을 통해 엄격한 생물 봉쇄 조치를 통합한 천연 마이크로바이옴을 가진 쥐 전용 시설을 ?...
Access restricted. Please log in or start a trial to view this content.
토론
천연 마이크로바이옴을 가진 마우스는 인간 초유기체 3,9,10,11,12와 더 유사하기 때문에 기초 및 응용 과학을 위한 유망한 연구 도구입니다. 생물학적 복잡성을 마우스 모델에 통합하려는 시도는 각각 고유한 장점과 한계를 가진 다양한 접근 방식의 ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 작업은 Charité 3R| 바꾸기 - 줄이기 - 구체화. S.P.R.은 Deutsche Forschungsgemeinschaft(DFG, 독일 연구 재단) Emmy Noether-Programm RO 6247/1-1(프로젝트 ID 446316360), DFG SFB1160 IMPATH(프로젝트 ID 256073931) 및 TRR 359 PILOT(프로젝트 ID 491676693)의 지원을 받았습니다. S.J.는 Deutsche Forschungsgemeinschaft(DFG, German Research Foundation) JO 1216/2-1 및 German Multiple Sclerosis Society(DMSG e.V.)의 지원을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
참고문헌
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345(2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119(2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108(2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069(2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361(2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143(2018).
- Dirnagl, U., Kurreck, C., Bernard, R., Przesdzing, I. Premier. , https://premier-qms.org/ (2024).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유