Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Порядок эксплуатации и биоизоляции помещения для лабораторных мышей с природным микробиомом: процедура иммунофенотипирования
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье мы опишем структуру и рабочие процедуры, в том числе меры по сдерживанию микроорганизмов в учреждении для «диких мышей», используя в качестве примера забор крови для иммунофенотипирования.
Аннотация
Использование лабораторных мышей с природным микробиомом, таких как «мыши одичалых», является перспективным исследовательским инструментом как для фундаментальной, так и для прикладной науки благодаря их близкому сходству с человеческим суперорганизмом. Тем не менее, разведение и содержание этих мышей, которые являются носителями разнообразного микробиома, включая бактерии, вирусы и паразитов, создают значительные проблемы для животноводческих учреждений в исследовательских институтах. Для решения этих проблем была разработана концепция специализированного объекта для размещения «мышей одичалых» в Charité - Universitätsmedizin Berlin. Этот подход включал в себя проектирование объекта с особыми структурными особенностями и операционными протоколами для эффективного сдерживания естественного микробиома, тем самым защищая районы с более высокими стандартами гигиены.
Демонстрируется методология забора крови как у указанных мышей без патогенов (SPF), так и у мышей типа «одичалый» для иммунофенотипирования, что подчеркивает рабочий процесс и меры биосдерживания, реализованные в учреждении. Замечательные результаты показывают, что у «одичалых мышей», подвергшихся воздействию естественного микробиома, развиваются различные иммунные клеточные популяции, которые значительно сокращаются у мышей, разводимых и содержащихся в строгих гигиенических условиях.
Значение этого исследования заключается в его потенциале для предоставления исследователям доступа к мышам, которые обладают естественным микробиомом и зрелой иммунной системой, аналогичной иммунной системе взрослого человека. Такой подход может повысить переносимость доклинических результатов в клиническую практику, тем самым продвигая область биомедицинских исследований.
Введение
Эксперименты на мышах по-прежнему необходимы в фундаментальной и прикладной науке, такой как доклинические и токсикологические исследования. Тем не менее, стандартизация гигиены в лабораторных условиях, направленная на снижение биологического шума и минимизацию изменчивости экспериментальных результатов, привела к исключению естественной микробиоты в значительной степени. Таким образом, условия, в которых рождаются и содержатся гигиенически стандартизированные, свободные от патогенов (SPF) лабораторные мыши, отличаются от реальных условий, в которых обычно находятся люди и животные. Это несоответствие между лабораторными условиями и природной средой, в которой протекают болезни человека, приводит к «ошибке стандартизации»: предположению, что минимизация вариаций в экспериментальных условиях улучшает трансляционные результаты. Однако в действительности это ограничивает биологическую значимость выводов 1,2. Например, исследования показали, что отсутствие микробного разнообразия и разнообразия окружающей среды у мышей с SPF может привести к недоразвитию иммунной системы, что подрывает достоверность иммунологических и доклиническихисследований.
Было предложено несколько подходов для решения проблемы биологической изменчивости в мышиных моделях, каждый из которых имеет свои преимущества и ограничения, включая совместное проживание с дикими мышами и мышами из зоомагазинов 3,4,5,6,7,8, последовательное воздействие комменсалов9, содержание животных в уличных вольерах10 или на подстилке от крупных животных11 и трансплантацию фекалий от диких мышей12. Многообещающей новой моделью мышей для доклинических и токсикологических исследований является модель «Одичалых мышей», которая состоит из стандартных лабораторных линий мышей, несущих естественный микробиом13. Эти «мыши одичалые» создаются путем трансплантации эмбрионов лабораторных линий мышей мышам, пойманным в дикой природе. Во время рождения лабораторные линии мышей приобретают естественный микробиом своих суррогатных матерей, имитируя естественную инокуляцию, которая происходит во время родову человека. «Одичалых мышей» можно разводить так же, как и любую другую лабораторную линию мышей, при этом их естественный микробиом сохраняется из поколения в поколение.
«Мыши-одичалые» являются носителями разнообразной микробиоты, включая бактерии, вирусы и паразитов, которые обычно исключены из помещений для мышей с SPF. Следовательно, поддержание естественного микробиома в исследовательских центрах сопряжено с проблемами, поскольку эти микробы должны содержаться без ущерба для общих гигиенических стандартов SPF.
В Университетской клинике Шарите в Берлине был создан специальный центр для «Одичалых мышей», отделенный от зон SPF строгими мерами биоизоляции. Объект включает в себя помещения для разведения и экспериментов, гарантируя, что естественный микробиом «мышей одичалых» поддерживается, в то время как зоны SPF находятся под защитой (Рисунок 1).
Пары-основатели колонии Шарите были завезены из колонии мышей «Уайлдинг», созданной при Отделении исследований микробиома Университетской клиники Эрлангена, Университет Фридриха-Александра Эрлангена-Нюрнберга (FAU), Германия. Они снабжаются санитарным сертификатом и контролируются с помощью расширенной панели на предмет зоонозных патогенов перед импортом основателей колонии. Стражи будут использоваться для мониторинга микробиома с течением времени. И SPF, и «Одичалые мыши» содержатся в одинаковых условиях. Мышей разводят и содержат преимущественно в индивидуально вентилируемых клетках (НПВ) типа II типа длинными группами по пять мышей. Температура внутри помещения составляет 22 °C, а цикл света/темноты составляет 12 часов. Мыши получают стандартную зерновую воду и воду из-под крана. Стерилизация подстилки и предметов обогащения не нужна для «одичалых мышей». Тем не менее, автоклавирование этих предметов предотвращает путаницу материалов в зонах, где содержатся мыши с SPF.
В этом протоколе демонстрируются процедуры иммунофенотипирования как для SPF, так и для мышей «Одичалых», подчеркивая строгие протоколы сдерживания микроорганизмов на объекте «Мыши-одичалые». Эти меры обеспечивают целостность среды с SPF, обеспечивая при этом преимущества работы с мышами, несущими естественный микробиом.
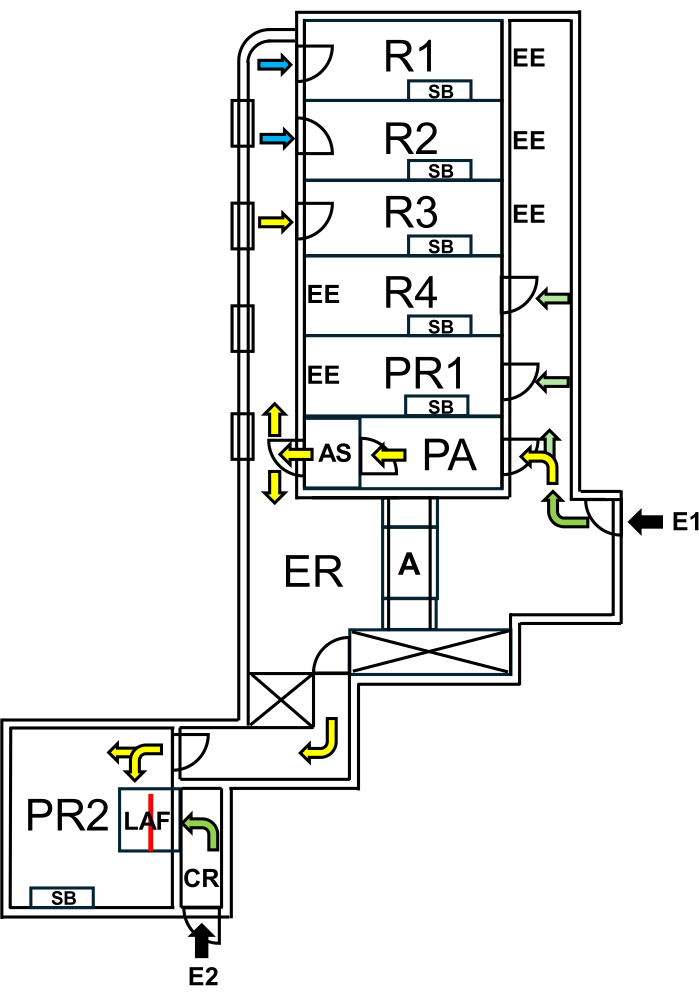
Рисунок 1: Схема помещения для мышей одичалых. E1 = доступ к объекту. Стрелками обозначен маршрут входа на объект. E2 = доступ к кабине с ламинарным потоком воздуха снаружи объекта. PA = шлюзовая камера для персонала с воздушным душем. AS = воздушный душ. R1, R2 = комнаты для разведения одичалых мышей. R3 = помещение для содержания мышей Уайлдинга. R4 = помещение для содержания мышей с SPF. PR1 = процедурный кабинет для мышей с SPF. PR2 = процедурный кабинет для мышей одичалых. SB = стерильный рабочий стол. EE = аварийные выходы. CR = раздевалка перед кабиной LAF. LAF = кабина с ламинарным воздушным потоком для вмешательств под защитным потоком воздуха. А = автоклав. ER = аппаратная. Зелеными стрелками обозначены маршруты, доступные при работе с SPF-животными, а желтыми стрелками обозначены пути, доступные для работы с мышами-одичалыми после принятия воздушного душа. Синие стрелки указывают на доступ только для персонала животноводческого хозяйства. Красной линией отмечена стеклянная стена внутри кабины LAF, которая делит пространство на две секции, доступ к которым можно получить либо из E1 через PR2, либо из E2 через CR. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Установка для «диких мышей» и процедуры с участием живых животных были одобрены ответственным государственным ведомством по экспериментам на животных «Landesamt für Gesundheit und Soziales Berlin» (LAGeSo). Наиболее важные этапы протокола обобщены на рисунке 2.
1. Получение доступа к объекту Wilding
- Получите личное представление о процедурах эксплуатации и биоизоляции объекта от ответственного сотрудника по защите животных.
- Получите ключ транспондера для входа в учреждение для «Одичалых мышей» и забронируйте процедурные кабинеты через систему онлайн-бронирования.
2. Вход в объект для "Одичалых мышей"
- Сдайте одежду на хранение в раздевалку.
- Переоденьтесь в местную одежду: брюки, касак и одноразовые бахилы (рисунок 3).
3. Забор крови у мышей с SPF в зоне SPF
- Переведите SPF-мышей (самцов и самок, 8-20 недель) из помещения, где они содержатся (R4), в процедурный кабинет для SPF-животных (PR1) в закрытой клетке IVC.
- Включите стенд с ламинарным потоком и продезинфицируйте рабочую поверхность с помощью этанола с содержанием 70%. Работа внутри верстака.
- Осмотрите капиллярные трубки на предмет сломанных или сколотых участков, чтобы избежать повышенного риска поломки или повреждения.
- Под кратковременной общей анестезией изофлураном (индукция на 5% изофлуране в обогащенном кислородом медицинском воздухе с последующим введением 1,5%-2,0% для поддержания), после потери рефлекса отмены педали (на что указывает защемление пальцев ног) сжимают вены шеи мышей, захватывая загривок шеи.
- Одной рукой закрепите голову животного большим и указательным пальцами. Вставьте свежий капилляр в медиальный кантус глаза под углом 45°. Убедитесь, что капилляр расположен между глазным яблоком и костной орбитой глаза.
ПРИМЕЧАНИЕ: Во избежание травм не позволяйте кончику капиллярной трубки касаться поверхности глаза. - Введите капилляр через мембрану пазухи мягким осевым вращательным движением. Продолжайте вращать трубку в задней части глазницы до тех пор, пока не начнет течь кровь. Соберите не менее 15 мкл крови в пробирку для сбора крови, содержащую этилендиаминтетрауксусную кислоту (ЭДТА) (примерно 1 капля).
- Перед удалением капилляра ослабьте хватку на загривке, чтобы свести к минимуму кровотечение в ткани. Чтобы обеспечить хороший гемостаз, используйте чистую марлевую салфетку или тампон, чтобы остановить кровотечение.
- Слегка поверните трубку, чтобы смешать кровь и ЭДТА. Не встряхивайте трубку. Храните образец крови на льду.
- Продезинфицируйте рабочую поверхность и выключите стенд ламинарного потока. Верните SPF-мышей в закрытом IVC в помещение SPF (R4).
4. Вход в зону для "Одичалых мышей"
- Снимите обувь и носки в прихожей воздушного душа (ПА). Наденьте носки и средства индивидуальной защиты (СИЗ) для всего тела, состоящие из комбинезона Tyvek, сетки для волос, при необходимости, хлопчатобумажных перчаток, нитриловых перчаток и масок для лица (Рисунок 3).
- Входите в воздушный душ в носках через клейкое напольное покрытие. Во время принятия воздушного душа поднимите руки и выполните поворот на 360°.
- Выйдите из воздушного душа и наденьте обувь с другой стороны.
5. Забор крови у «Диких мышей»
- Перенос «мышей одичалых» (самцов и самок, 8 - 20 недель) из помещения, где они содержатся (R3) в закрытой клетке IVC, в процедурный кабинет (PR2).
- Включите стенд с ламинарным потоком и продезинфицируйте поверхность рабочего места.
- Следуйте процедурам, описанным для отбора проб у мышей с SPF в разделе 3, шаги 2-8.
- После завершения забора крови смените перчатки. Продезинфицируйте все материалы и поверхности. Выключите стенд ламинарного потока.
6. Экспорт образцов крови из зоны "Одичалые мыши" через шкаф ламинарного потока воздуха (LAF)
ПРИМЕЧАНИЕ: Процедурный кабинет (PR2) содержит шкаф LAF, который служит материальным замком и стерильным операционным кабинетом. Образцы выводятся через кабину LAF. Внутрь зоны Одичалых можно попасть как изнутри (через E1 и PR2), так и снаружи (через E2 и CR) и разделено посередине стеклянной стеной с раздвижной дверью (рис. 1). Для экспорта материалов требуется два человека: Человек 1 (внутри зоны Одичалых [через PR2]) выполнит шаги 6.1 и 6.2. Человек 2 (за пределами зоны Одичалых [через E2]) выполнит шаги 6.3-6.5.
- Продезинфицируйте контейнеры с образцами. Извлеките контейнеры с образцами через раздвижную дверцу в стеклянной стене кабины LAF.
- После завершения передачи контейнеров с пробами лицу 2 получить защитную одежду от лица 2 (носит защитную одежду в халатном замке кабины) с другой стороны кабины ЛАФ и утилизировать ее. Продезинфицируйте все поверхности.
- Наденьте защитную одежду в LAF доступа перед кабиной LAF ( CR, рисунок 1).
- Бесконтактно принимайте продезинфицированные контейнеры с образцами из зоны Wildling через раздвижную дверь в стеклянной стене кабины LAF.
- Снимите защитную одежду и пропустите ее через раздвижную дверь во внутреннюю зону кабины LAF для утилизации.
7. Выход из объекта для "Одичалых мышей"
- Оставьте одноразовые комбинезоны и обувь внутри помещения. Выбросьте сетку для волос, резиновые перчатки и маску для лица.
ПРИМЕЧАНИЕ: Обувь и комбинезон можно использовать повторно. - Входите в воздушный душ сразу в зону носков. Поднимите руки и выполните поворот на 360° под воздушным душем.
- Выйдите из воздушного душа и положите носки в сборщик белья. Наденьте носки и обувь и одноразовые бахилы. Место хранения одежды в раздевалке в сборщике белья. Переодевание в раздевалке
8. Обработка и анализ образцов крови
- Принесите образцы крови в лабораторию.
- Приготовьте коктейль для окрашивания фторконъюгированных антител: Для каждого образца добавьте 0,25 мкл антимышиного CD45 Alexa Fluor 700, 0,25 мкл мышиной цепи TCR-β Brilliant Violet 605, 0,25 мкл антимышиного CD4 APC, 0,25 мкл антимышиного CD8 Brilliant Violet 785, 0,25 мкл антимышиного CD44 FITC и 0,25 мкл мышиного антитела CD62L PerCP/Cyanine5.5 к 50 мкл буфера для проточной цитометрии (фосфатно-солевой буфер, 2 мМ ЭДТА, 0,1% бычьего сывороточного альбумина, 4 °C). Держите в темноте на льду до шага 8.8.
ПРИМЕЧАНИЕ: Используемые флуорофоры могут быть адаптированы к конфигурации проточного цитометра, который будет использоваться для сбора образцов.
- Приготовьте коктейль для окрашивания фторконъюгированных антител: Для каждого образца добавьте 0,25 мкл антимышиного CD45 Alexa Fluor 700, 0,25 мкл мышиной цепи TCR-β Brilliant Violet 605, 0,25 мкл антимышиного CD4 APC, 0,25 мкл антимышиного CD8 Brilliant Violet 785, 0,25 мкл антимышиного CD44 FITC и 0,25 мкл мышиного антитела CD62L PerCP/Cyanine5.5 к 50 мкл буфера для проточной цитометрии (фосфатно-солевой буфер, 2 мМ ЭДТА, 0,1% бычьего сывороточного альбумина, 4 °C). Держите в темноте на льду до шага 8.8.
- Продезинфицируйте пробирки для сбора крови. Добавьте 2 мл буфера для проточной цитометрии ледяного потока в полистирольную пробирку объемом 5 мл с круглым дном. Поставьте трубку на лед.
- Откройте пробирку для забора крови. Добавьте 10 мкл крови в пробирку, содержащую буфер проточной цитометрии и пульсовый вихрь.
- Вращайте при 400 x g в течение 5 минут при 4 °C.
- Аспирируйте надосадочную жидкость. Добавьте 1 мл буфера для лизиса эритроцитов (RBC), импульсный вихрь и инкубируйте в течение 3 минут при комнатной температуре (RT).
- Добавьте 100 мкл 10x PBS. Вращайте при 400 x g в течение 5 минут при 4 °C.
- Повторите шаги 8.5-8.6.
- Аспирируйте надосадочную жидкость. Добавьте 50 мкл окрашивающего коктейля антител, вортекс и инкубируйте 20 мин на льду в темноте.
- Добавьте 1 мл буфера для проточной цитометрии. Вращайте при 400 x g в течение 5 минут при 4 °C.
- Аспирируйте надосадочную жидкость. Добавьте 180 мкл буфера для проточной цитометрии.
- Добавьте 20 μL SYTOX Blue Dead Cell Stain (конечная концентрация 1:1000) для различения живого и мертвого.
- Получите образцы на проточном цитометре и проанализируйте данные с помощью программного обеспечения для сбора данных проточного цитометра или программы анализа данных проточной цитометрии.
Access restricted. Please log in or start a trial to view this content.
Результаты
«Дикие мыши» потенциально являются переносчиками микроорганизмов, обычно исключенных из SPF-объектов, что создает проблему для практики животноводства в научно-исследовательских учреждениях, которые поддерживают строгие стандарты гигиены. За последние 4 года ученые...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Мыши с природным микробиомом являются перспективным исследовательским инструментом для фундаментальной и прикладной науки из-за их более близкого сходства с человеческим суперорганизмом 3,9,10,11,12.
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Работа выполнена при поддержке программы Charité 3R| Заменить - Уменьшить - Уточнить. S.P.R. была поддержана Deutsche Forschungsgemeinschaft (DFG, Немецкое научно-исследовательское общество), Emmy Noether-Programm RO 6247/1-1 (проект ID 446316360), DFG SFB1160 IMPATH (проект ID 256073931) и TRR 359 PILOT (проект ID 491676693). S.J. был поддержан Deutsche Forschungsgemeinschaft (DFG, Немецкое научно-исследовательское общество) JO 1216/2-1 и Немецким обществом рассеянного склероза (DMSG e.V.).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
Ссылки
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345(2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119(2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108(2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069(2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361(2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143(2018).
- Dirnagl, U., Kurreck, C., Bernard, R., Przesdzing, I. Premier. , https://premier-qms.org/ (2024).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены