このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
天然マイクロバイオームを持つ実験用マウスの施設の手術および生物学的封じ込め手順:イムノフェノタイピング手順
* これらの著者は同等に貢献しました
要約
ここでは、イムノフェノタイピングのための採血を例に、ワイルディングマウスの施設における微生物封じ込め対策を含む構造と運用手順について述べる。
要約
「野生マウス」のような天然のマイクロバイオームを持つ実験用マウスの使用は、ヒトの超生物によく似ているため、基礎科学と応用科学の両方にとって有望な研究ツールとなります。しかし、細菌、ウイルス、寄生虫など多様なマイクロバイオームを持つこれらのマウスの繁殖や維持は、研究機関の畜産施設にとって大きな課題となっています。これらの課題に対処するために、シャリテ-ベルリン大学に「野人のネズミ」を収容するための特別な施設コンセプトが開発されました。このアプローチには、特定の構造的特徴と運用プロトコルを備えた施設を設計し、自然のマイクロバイオームを効果的に封じ込めることで、より高い衛生基準を持つ地域を保護することが含まれていました。
免疫表現型検査のための指定病原体フリー(SPF)と「野生マウス」の両方からの採血の方法論が示され、施設で実施されているワークフローと生物学的封じ込め対策が強調されています。驚くべき結果から、天然のマイクロバイオームに曝露された「野生マウス」は、異なる免疫細胞集団を発達させ、厳しい衛生条件下で飼育および維持されたマウスでは、免疫細胞集団が大幅に減少することが明らかになりました。
この研究の重要性は、人間の成人と同様の自然なマイクロバイオームと成熟した免疫システムを持つマウスへのアクセスを研究者に提供する可能性にあります。このアプローチにより、前臨床所見の臨床実践への翻訳可能性が向上し、生物医学研究の分野が進歩する可能性があります。
概要
マウスでの実験は、前臨床研究や毒物学研究など、基礎科学や応用科学において依然として不可欠です。しかし、生物学的ノイズを低減し、実験結果のばらつきを最小限に抑えることを目的とした実験室環境の衛生の標準化により、天然微生物叢が大幅に排除されるようになりました。したがって、衛生的に標準化された特定病原体フリー(SPF)実験用マウスが生まれ、飼育される条件は、人間や動物が通常さらされる実際の条件とは異なります。実験室の条件と人間の病気が発生する自然環境との間のこの不一致は、実験条件の変動を最小限に抑えることでトランスレーショナルアウトカムが向上すると仮定する「標準化の誤謬」を引き起こします。しかし、実際には、それは発見の生物学的関連性を制限します1,2。例えば、SPFマウスに微生物や環境の多様性がないと、免疫系が未発達になり、免疫学的研究や前臨床研究の妥当性が損なわれる可能性があることが研究で示されています3。
マウスモデルにおける生物学的変異に対処するためにいくつかのアプローチが提案されており、それぞれに独自の利点と制限があり、これには、野生マウスおよびペットショップマウス3,4,5,6,7,8との共同飼育、共生動物9への逐次曝露9、動物を屋外の囲い10または大型動物の寝具11に保管すること11、および野生のマウス12からの糞便移植が含まれる.前臨床および毒物学研究のための有望な新しいマウスモデルは、天然のマイクロバイオーム13を持つ標準的な実験用マウス系統からなる「Wildlingマウス」モデルである。この「野性マウス」は、実験用マウス系統の胚を野生で捕獲したマウスに移植することで作製されます。出生中、実験用マウス系統は、ヒトの分娩中に起こる自然な接種を模倣して、代理母の自然なマイクロバイオームを獲得する13。「野生ネズミ」は、他の実験用マウスと同様に繁殖することができ、その自然なマイクロバイオームは世代を超えて保存されています。
「野生マウス」は、細菌、ウイルス、寄生虫など、通常はSPFマウス施設から除外される多様な微生物叢を宿主としています。その結果、研究施設で天然のマイクロバイオームを維持することは、これらの微生物を全体的なSPF衛生基準を損なうことなく封じ込める必要があるため、課題を提示します。
ベルリンのシャリテ大学では、「野人マウス」の専用施設が設立され、厳格な生物学的封じ込め措置によってSPFエリアから分離されました。この施設には繁殖室と実験室があり、「野生ネズミ」の自然なマイクロバイオームを維持しながら、SPFエリアが保護されています(図1)。
シャリテのコロニーの創設者ペアは、ドイツのエアランゲン大学病院、フリードリヒ・アレクサンダー・ユニバーシテート・エアランゲン大学(FAU)のマイクロバイオーム研究部門に設立された「ワイルディングマウス」コロニーから輸入されました。彼らには健康証明書が支給され、コロニーの創設者が輸入される前に、人獣共通感染症の病原体のための拡張パネルで監視されます。センチネルは、マイクロバイオームを経時的に監視するために使用されます。SPFと「野人マウス」はどちらも同じ条件下で飼育されています。マウスは、5匹のマウスのグループで、個別換気ケージ(IVC)II型で優先的に飼育されます。施設内の温度は22°Cで、明暗サイクルは12時間です。マウスは、標準的な穀物ベースのチャウと水道水を受け取ります。寝具やエンリッチメントアイテムの除菌は「野生ネズミ」には不要です。しかし、これらのアイテムをオートクレーブすることで、SPFマウスが飼育されている場所での材料の取り違えを防ぐことができます。
このプロトコルでは、SPFと「Wildlingマウス」の両方の免疫表現型検査手順が実証され、「Wildlingマウス」施設での厳格な微生物封じ込めプロトコルが強調されています。これらの対策は、SPF環境の完全性を確保しながら、天然のマイクロバイオームを持つマウスを扱う利点を提供します。
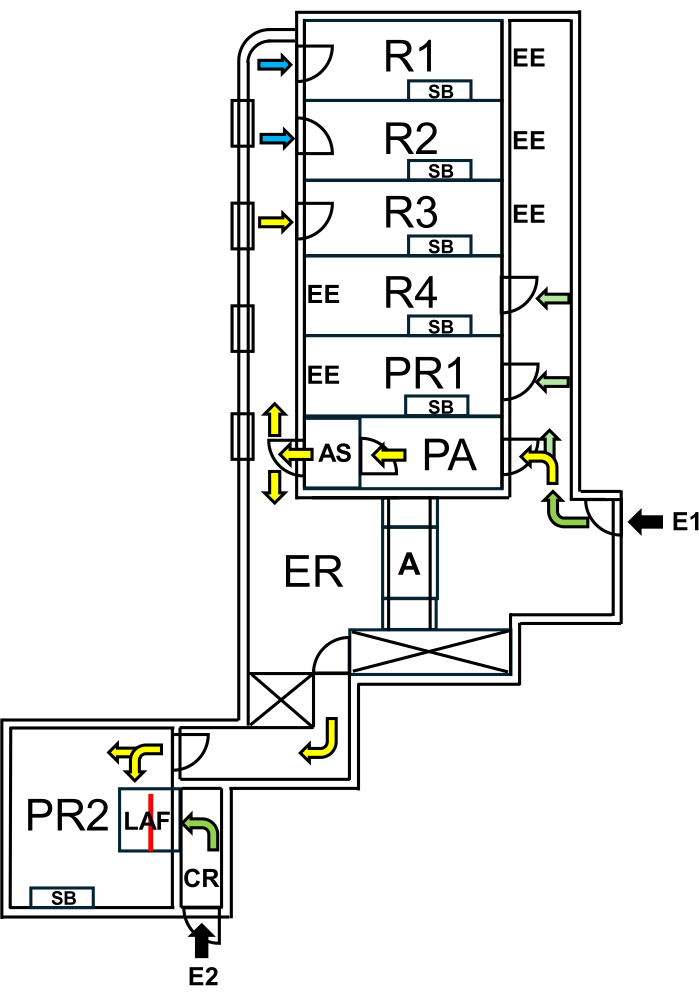
図1:野生ネズミの施設のレイアウト。 E1 = 施設へのアクセス。矢印は施設への入館ルートを示しています。E2 = 施設の外部から層流キャビンへのアクセス。PA = エアシャワー付き人員エアロック。AS = エアシャワー。R1、R2 = 野生ネズミの繁殖のための部屋。R3 = ワイルディングマウスを飼うためのスペース。R4 = SPFマウスを飼うためのスペース。PR1 = SPFマウスの処置室。PR2 = 野人マウスの処置室。SB = 滅菌作業台。EE = 非常口。CR = LAFキャビン前の更衣室。LAF = 保護気流下での介入のための層流キャビン。A = オートクレーブ。ER = 機器室。緑の矢印はSPFの動物を扱うときにアクセス可能なルートを表し、黄色の矢印はエアシャワーを浴びた後に野人のマウスと一緒に働くために利用できる経路を示しています。青い矢印は、飼育スタッフのみのアクセスを示しています。赤い線はLAFキャビン内のガラス壁を示しており、スペースを2つのセクションに分割し、E1からPR2またはE2からCR経由でアクセスできます 。
Access restricted. Please log in or start a trial to view this content.
プロトコル
「ワイルディングマウス」の施設と生きた動物を使った処置は、動物実験を担当する州立事務所「Landesamt für Gesundheit und Soziales Berlin」(LAGeSo)によって承認されました。プロトコルの最も重要なステップを 図 2 にまとめます。
1. ワイルディング施設へのアクセス
- 施設の運営手順と生物学的封じ込め手順について、担当の動物福祉担当官から個別に紹介を受けてください。
- 「Wildling mice」の施設に入るためのトランスポンダーキーを取得し、オンライン予約システムを介して手続き室を予約します。
2.「野人のネズミ」の施設内に入る
- 衣類は更衣室に預けてください。
- エリアウェア(ズボン、カサック、使い捨てシューズカバー)に着替えます(図3)。
3. SPF領域におけるSPFマウスの採血
- SPFマウス(雄と雌、8〜20週)を飼育室(R4)から密閉IVCケージ内のSPF動物(PR1)の処置室に移します。
- 層流ベンチのスイッチを入れ、作業スペースの表面を70%Vol.エタノールで消毒します。ベンチの中で作業します。
- キャピラリーチューブに壊れた部分や欠けた部分がないか検査して、破損や損傷のリスクが増さないようにします。
- イソフルランによる短時間の全身麻酔下(酸素が豊富な医療用空気中の5%イソフルランでの誘導、続いて維持のために1.5%〜2.0%)、ペダル離脱反射が失われた後(つま先のピンチで示されるように)、首筋をつかんでマウスの首の静脈を圧迫します。.
- 片手で、親指と人差し指で動物の頭を固定します。新しい毛細血管を瞬膜の下の眼の内側眼瞼に挿入します。毛細血管が眼球と眼の骨の軌道の間に配置されていることを確認してください。
注意: 外傷を避けるために、毛細血管の先端が目の表面に触れないようにしてください。 - キャピラリーを副鼻腔膜を通して、軸方向に緩やかに回転させます。血液が流れるまで、眼窩の後ろでチューブを回転させ続けます。エチレンジアミン四酢酸(EDTA)を含む採血管に最低15μLの血液を採取します(約1滴)。
- 毛細血管を取り外す前に、首筋のグリップを緩めて、組織への出血を最小限に抑えます。良好な止血を確保するために、清潔なガーゼパッドまたは綿棒を使用して出血を止めます。
- チューブを少し回転させて血液とEDTAを混合します。チューブを振らないでください。血液サンプルを氷上に保存します。
- 作業面を消毒し、層流ベンチのスイッチを切ります。閉じたIVCのSPFマウスをSPFハウジングルーム(R4)に戻します。
4.「野人のネズミ」のエリアに入る
- エアシャワー(PA)の控え室で靴と靴下を脱ぎます。エリアソックスと、タイベックのオーバーオール、ヘアネット(必要に応じて)、綿手袋、ニトリル手袋、フェイスマスクで構成される全身個人用保護具(PPE)を着用します(図3)。
- 粘着性の床材を介して靴下でエアシャワーに入ります。エアシャワーを浴びながら、腕を上げて360°回転させます。
- エアシャワーを出て、反対側でエリアシューズを履きます。
5.「ワイルディングマウス」からの採血
- 「野生マウス」(オスとメス、8〜20週間)を、密閉されたIVCケージに飼育されている部屋(R3)から処置室(PR2)に移します。
- 層流ベンチのスイッチを入れ、作業スペースの表面を消毒します。
- セクション3のステップ2〜8でSPFマウスのサンプリングについて説明した手順に従います。
- 採血が完了したら、手袋を交換します。すべての材料と表面を消毒します。層流ベンチのスイッチを切ります。
6. 「野生マウス」エリアからLAF(Laminar Airflow)キャビネット経由で血液サンプルをエクスポート
注:処置室(PR2)には、材料ロックと滅菌介入室として機能するLAFキャビネットが含まれています。サンプルはLAFキャビンを介して転送されます。内部は、ワイルドリングエリアの内側(E1とPR2経由)と外側(E2とCR経由)の両方からアクセスでき、スライドドア付きのガラス壁によって中央が分割されています(図1)。材料をエクスポートするには2人が必要です:パーソン1(ワイルドリングエリア内[PR2経由])は、手順6.1と6.2を実行します。パーソン2(ワイルドリングエリア外[E2経由])は、手順6.3〜6.5を実行します。
- サンプル容器を消毒します。LAFキャビンのガラス壁にあるスライドドアからサンプルコンテナを取り出します。
- 人2へのサンプル容器の移し替えが完了したら、LAFキャビンの反対側にいる人2(キャビンのスモックロックで防護服を着用している)から防護服を受け取り、廃棄します。すべての表面を消毒します。
- LAFキャビンの前のアクセスLAFで防護服を着用します(CR、 図1)。
- 消毒されたサンプルコンテナは、LAFキャビンのガラス壁にあるスライドドアを介して、ワイルドリングエリアから非接触で受け取ります。
- 防護服を脱ぎ、スライドドアを通してLAFキャビンの内部に通して廃棄します。
7.「野人のネズミ」の施設からの退出
- 使い捨てのオーバーオールとエリアシューズはエリア内に置いておきます。ヘアネット、ゴム手袋、フェイスマスクは廃棄してください。
注:靴とオーバーオールは再利用できます。 - エリアソックスですぐにエアシャワーに入ります。エアシャワーを浴びながら腕を上げて360°回転します。
- エアシャワーを放っておき、エリアソックスをランドリーコレクターに入れます。靴下と靴、使い捨ての靴カバーを履きます。ランドリーコレクターの更衣室にエリアの衣類を預けます。更衣室で着替える
8. 血液サンプルの処理と分析
- 血液サンプルを検査室に持参してください。
- 蛍光色素標識抗体染色カクテルの調製:各サンプルについて、0.25 μL の Alexa Fluor 700 抗マウス CD45、0.25 μL の Brilliant Violet 605 抗マウス TCR-β 鎖、0.25 μL の APC 抗マウス CD4、0.25 μL の Brilliant Violet 785 抗マウス CD8、0.25 μL の FITC 抗マウス CD44、0.25 μL の PerCP/Cyanine5.5 抗マウス CD62L 抗体を 50 μL のフローサイトメトリーバッファー (リン酸緩衝生理食塩水、 2 mM EDTA、0.1% ウシ血清アルブミン、4 °C)。ステップ8.8まで氷の上で暗闇に保管してください。
注:使用する蛍光色素は、サンプル取得に使用するフローサイトメーターの構成に適合させることができます。
- 蛍光色素標識抗体染色カクテルの調製:各サンプルについて、0.25 μL の Alexa Fluor 700 抗マウス CD45、0.25 μL の Brilliant Violet 605 抗マウス TCR-β 鎖、0.25 μL の APC 抗マウス CD4、0.25 μL の Brilliant Violet 785 抗マウス CD8、0.25 μL の FITC 抗マウス CD44、0.25 μL の PerCP/Cyanine5.5 抗マウス CD62L 抗体を 50 μL のフローサイトメトリーバッファー (リン酸緩衝生理食塩水、 2 mM EDTA、0.1% ウシ血清アルブミン、4 °C)。ステップ8.8まで氷の上で暗闇に保管してください。
- 採血管を消毒します。2 mLの氷冷フローサイトメトリーバッファーを5 mLの丸底ポリスチレンチューブに加えます。チューブを氷の上に置きます。
- 採血管を開きます。フローサイトメトリーバッファーとパルスボルテックスが入ったチューブに10 μLの血液を加えます。
- 400 x g で4°Cで5分間スピンダウンします。
- 上清を吸引します。1 mLの赤血球(RBC)溶解バッファー、パルスボルテックスを加え、室温(RT)で3分間インキュベートします。
- 100 μL の 10x PBS を添加します。400 x g で4°Cで5分間スピンダウンします。
- 手順8.5〜8.6を繰り返します。
- 上清を吸引します。抗体染色カクテル50 μLを加え、ボルテックスし、暗所で氷上で20分間インキュベートします。
- フローサイトメトリーバッファー1mLを添加します。400 x g で4°Cで5分間スピンダウンします。
- 上清を吸引します。180 μLのフローサイトメトリーバッファーを添加します。
- 生死弁別用に20 μLのSYTOX Blue Dead Cell Stain(最終濃度1:1000)を加えます。
- フローサイトメーターでサンプルを取得し、フローサイトメーター取得ソフトウェアまたはフローサイトメトリーデータ解析プログラムを使用してデータを解析します。
Access restricted. Please log in or start a trial to view this content.
結果
「ワイルディングマウス」は、通常はSPF施設から除外される微生物を宿している可能性があり、厳しい衛生基準を守る研究機関での畜産慣行に課題を投げかけています。過去4年間にわたり、ベルリンのシャリテ大学とドイツ実験動物保護センター(Bf3R)の科学者と獣医師は、天然のマイクロバイオームを持つマウス専用の施設を開発し、共同研究を通じて厳格な生物?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
天然のマイクロバイオームを持つマウスは、人間の超生物3,9,10,11,12により類似しているため、基礎科学および応用科学の有望な研究ツールです。生物学的な複雑さをマウスモデルに組み込む試みは、さまざまなアプローチの開発につながり、そ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この作業はCharité 3R|置換 - 削減 - リファイン。S.P.R.は、ドイツ研究振興協会(DFG)のエミー・ネーター・プログラムRO 6247/1-1(プロジェクトID 446316360)、DFG SFB1160 IMPATH(プロジェクトID 256073931)、TRR 359 PILOT(プロジェクトID 491676693)の支援を受けた。S.J.は、Deutsche Forschungsgemeinschaft(DFG、ドイツ研究財団)JO 1216/2-1およびドイツ多発性硬化症学会(DMSG e.V.)の支援を受けました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 anti-mouse CD45 antibody | BioLegend | 103127 | Clone 30F-11 |
| Animal Chow | Altromin | 1324 | |
| APC anti-mouse CD4 antibody | BioLegend | 100515 | Clone RM4-5 |
| Blood collection tube | Greiner | 450475 | MiniCollect K3E, K3EDTA |
| Bovine Serum Albumin | Sigma-Aldrich | A9647-100G | |
| Brilliant Violet 605 anti-mouse TCR-beta chain antibody | BioLegend | 109241 | Clone H57-597 |
| Brilliant Violet 785 anti-mouse CD8 antibody | BioLegend | 100749 | Clone 53-6.7 |
| Capillary | Hirschmann | 9000210 | Hirschmann minicaps, Na-hep |
| EDTA | Corning | 46-034-CI | |
| FITC anti-mouse CD44 antibody | BioLegend | 103021 | Clone IM7 |
| PerCP/Cyanine5.5 anti-mouse CD62L antibody | BioLegend | 104431 | Clone MEL-14 |
| Phosphate-buffered Saline (10x) | Gibco | 12579099 | |
| Phosphate-buffered Saline (1x) | Gibco | 14190094 | |
| RBC lysing buffer | BioLegend | 420302 | |
| Round Bottom Polystyrene Tube | Sarstedt | 55.476.005 | |
| SYTOX Blue Dead Cell Stain | Invitrogen | S34852 | |
| Tyvek overall (DuPont) | Fisher Scientific | 11371633 |
参考文献
- Voelkl, B., Wurbel, H., Krzywinski, M., Altman, N. The standardization fallacy. Nat Methods. 18 (1), 5-7 (2021).
- Voelkl, B., et al. Reproducibility of animal research in light of biological variation. Nat Rev Neurosci. 21 (7), 384-393 (2020).
- Beura, L. K., et al. Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature. 532 (7600), 512-516 (2016).
- Caruso, R., Ono, M., Bunker, M. E., Nunez, G., Inohara, N. Dynamic and asymmetric changes of the microbial communities after cohousing in laboratory mice. Cell Rep. 27 (11), 3401-3412.e3 (2019).
- Labuda, J. C., Fong, K. D., Mcsorley, S. J. Cohousing with dirty mice increases the frequency of memory T cells and has variable effects on intracellular bacterial infection. Immunohorizons. 6 (2), 184-190 (2022).
- Martin, M. D., et al. Cd115(+) monocytes protect microbially experienced mice against e. Coli-induced sepsis. Cell Rep. 42 (11), 113345(2023).
- Burger, S., et al. Natural microbial exposure from the earliest natural time point enhances immune development by expanding immune cell progenitors and mature immune cells. J Immunol. 210 (11), 1740-1751 (2023).
- Tabilas, C., et al. Early microbial exposure shapes adult immunity by altering cd8+ t cell development. Proc Natl Acad Sci U S A. 119 (49), e2212548119(2022).
- Reese, T. A., et al. Sequential infection with common pathogens promotes human-like immune gene expression and altered vaccine response. Cell Host Microbe. 19 (5), 713-719 (2016).
- Leung, J. M., et al. Rapid environmental effects on gut nematode susceptibility in rewilded mice. PLoS Biol. 16 (3), e2004108(2018).
- Sbierski-Kind, J., et al. Distinct housing conditions reveal a major impact of adaptive immunity on the course of obesity-induced type 2 diabetes. Front Immunol. 9, 1069(2018).
- Rosshart, S. P., et al. Wild mouse gut microbiota promotes host fitness and improves disease resistance. Cell. 171 (5), 1015-1028.e13 (2017).
- Rosshart, S. P., et al. Laboratory mice born to wild mice have natural microbiota and model human immune responses. Science. 365 (6452), eaaw4361(2019).
- Dirnagl, U., Kurreck, C., Castanos-Velez, E., Bernard, R. Quality management for academic laboratories: Burden or boon? Professional quality management could be very beneficial for academic research but needs to overcome specific caveats. EMBO Rep. 19 (11), e47143(2018).
- Dirnagl, U., Kurreck, C., Bernard, R., Przesdzing, I. Premier. , https://premier-qms.org/ (2024).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved